一、问题负担
约有5%的育龄女性经历过连续2次自然流产,少于1%的女性经历过3次或3次以上的连续自然流产[1]。关于复发性流产(recurrent pregnancy loss,RPL / recurrent spontanous abortion,RSA)的确切发生率,目前还缺乏数据,这是由于常有妊娠事件未被报道,有些流产未被注意,有些是生化妊娠,其余的由于回忆或报道偏差而丢失。由于人口统计数据存在多样化,同时缺乏对RSA进行分类的通用或标准化定义,患病率差异很大。
流行病学研究数据显示,偶发性流产的发生率为25%~30%,其中有1%~2%为RSA[2]。高龄和不孕夫妇的发生率相对较高。由于晚婚晚育和生活方式改变,这一数据还在上升。在瑞典,2003年至2012年的10年研究期间,RSA的发生率增加74%[3]。
二、经济负担
RSA的诊疗费用包括妊娠相关指标和流产病因检查。如果妊娠丢失不是以自然流产形式出现,则需要药物流产或手术清宫。RSA的常见病因筛查(必查项目)费用估计为3551美元,如果需要进行更全面的检查(备选项目),包括对血栓形成的筛查,则总计为5176美元。妊娠组织(products of conception,POC)的染色体核型分析成本约为1128美元,负压吸引术的成本估算是1338美元。为了降低成本,Nastaran等[4]比较了在第2次妊娠丢失中将POC 核型分析作为初步检查的成本效益。如果POC是整倍体或有不确定的核型结果,夫妻应该继续进一步的检查;如果核型结果提示为非整倍体胎儿,那么夫妻不建议做进一步评估。这种方案更经济,为特定的年龄组节省1135美元。因为这些夫妻更容易出现抑郁和其他行为变化[4],所以如果算上医院就诊和心理咨询,费用评估可能会更准确。
三、RSA 的定义
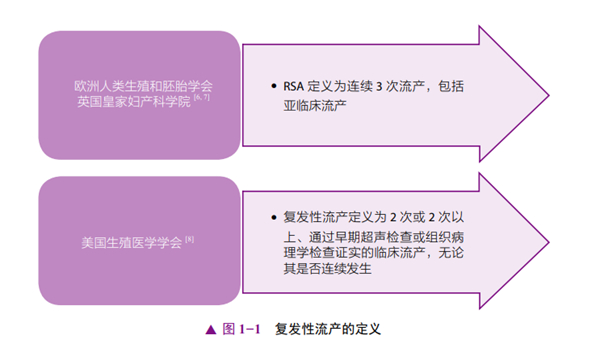
世界卫生组织将流产定义为获得生存能力之前的妊娠丢失[5]。用于RSA的各种术语包括复发性流产(recurrent miscarriage)或习惯性流产(habitual abortion)。不同的国家使用过不同的定义和分类[6-9](图1-1和图1-2)。

四、RSA的再发风险
连续2次流产之后再次流产的风险约为25%,3次流产之后再次流产的风险约为30%。谨慎的做法是2次妊娠丢失之后即开始针对RSA进行检查,如果夫妻有不孕史或女性年龄超过 35岁,则应更早开始检查[10]。
五、可改善和不可改善的危险因素
(一)不可改善的危险因素
1. 年龄
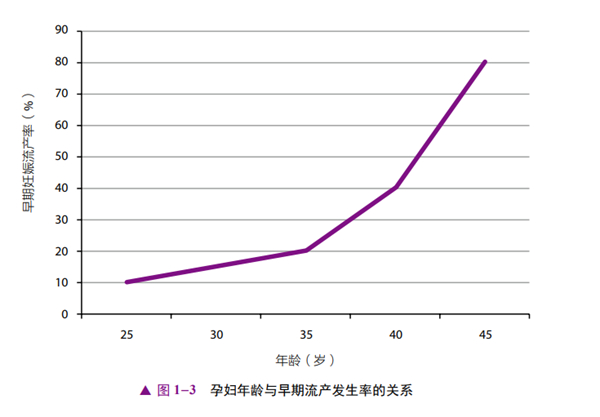
一对 RSA夫妻,再次妊娠结局的预测是基于女性的年龄和此前妊娠丢失的次数。与20~35 岁的女性相比,高龄夫妻(女性35岁以上,男性40岁以上)妊娠的结果往往不利。由图1-3所示的折线图可以看出,随着孕妇年龄的增加,早期流产的风险增加[11,12]。
2. 孕产史
孕产史可预测后续妊娠结局。每一次流产后,女性流产的风险就会增加,连续3次流产后,流产的风险约为40%。活产史并不一定会降低未来流产的风险。即使在连续4次妊娠失败后,下一次足月妊娠的概率仍然有60%~65%[13]。有研究报道,RSA女性在随后的妊娠中,无论是产前还是产时,都容易出现不良事件,如先兆流产、妊娠期高血压疾病、胎位不正、产前和产后出血、引产、器械助产、手剥胎盘等。因此,患有原发性RSA的女性在随后的妊娠中表现得像“虚拟初产妇”,会经历与初产妇相似的分娩特征、并发症和围产期结局[13,14]。在一项回顾性研究中,Hammoud等注意到,RSA患者的早产风险与流产次数成正比,其围产儿死亡率也因为早产原因而偏高。这两者之间的联系很难解释:早期流产继发于着床缺陷,而早产发生在妊娠晚期。可能的解释是早期流产中反复的扩张和刮宫所致的继发性损伤导致了早产发生率上升[15]。
3. 流产孕周
早期流产与中期流产的病因不同,结果也有所不同。与无胚胎活性的流产相比,在胎儿具有心管搏动后发生的流产,其预后更差[13]。
(二)可改善的危险因素
生活方式与环境因素
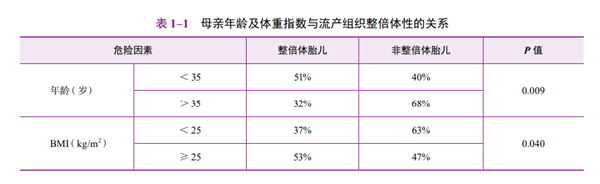
(1)体重指数(body mass index,BMI):BMI升高与高流产率独立相关。经过助孕治疗后成功受孕的肥胖女性比自然受孕的女性更容易发生流产。一项204例流产病例研究显示,流产组织的基因分析结果与孕妇年龄及BMI存在相关性(表1-1)[16]。
精液参数与不明原因RSA:一项横断面研究对305名在泌尿外科就诊的男性进行了精液分析和DNA碎片分析,按照男性体重分为超重(BMI 25~30 kg/m2)、肥胖(BMI ≥ 30 kg/m2)和正常(BMI<25 kg/m2),结果发现肥胖男性DNA损伤比例明显偏高[17]。另外,有RSA病史的夫妻,其精子含有两条性染色体的比例明显增加。Carrell的一项研究发现,与对照组相比,患有不明原因RSA的夫妻平均非整倍体率显著增加[18]。
(2)女性饮酒、吸烟或咀嚼烟草、咖啡因摄入:当进行一对一比较时,摄入常规剂量的烟酒或咖啡,与偶发性流产的关联性较弱;但是,对于吸烟和酗酒的男性,其与受精率呈负相关。
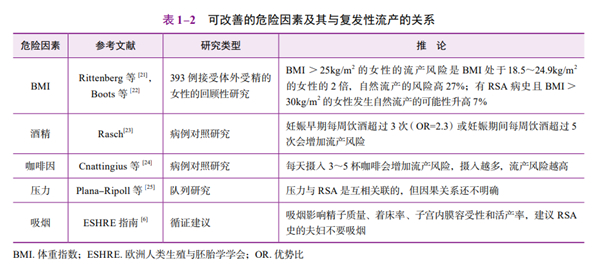
(3)辐射、重金属及污染物的职业暴露:单因素比较,没有显著的风险增加。当职业接触者还具有吸烟和饮酒等其他风险因素时,RSA的风险评分会增加。De Fleurian等[19]观察到暴露于重金属、溶剂气体和多环芳烃的男性精液参数异常;相对而言,与精液分析报道正常的人相比,那些精液分析报道异常的人,农药和其他化学物质的平均接触指数明显增高[20]。表1-2描述了可改善的危险因素与RSA的关系。
(三)早期复发性流产的诊疗方法
流产重复出现提示病因持续存在,必须加以识别和治疗。即使进行大量的检查,也只有60%的夫妻能明确病因。筛查、对因治疗、彻底咨询、解释未来可能的风险和复发率及定期随访,可以帮助这些RSA患者获得更好的妊娠结局[2]。检查可分为循证检查(EBW,必查项目)和更广泛的检查(备查项目)。图1-4展示了对患有早孕RSA女性的诊疗方法。
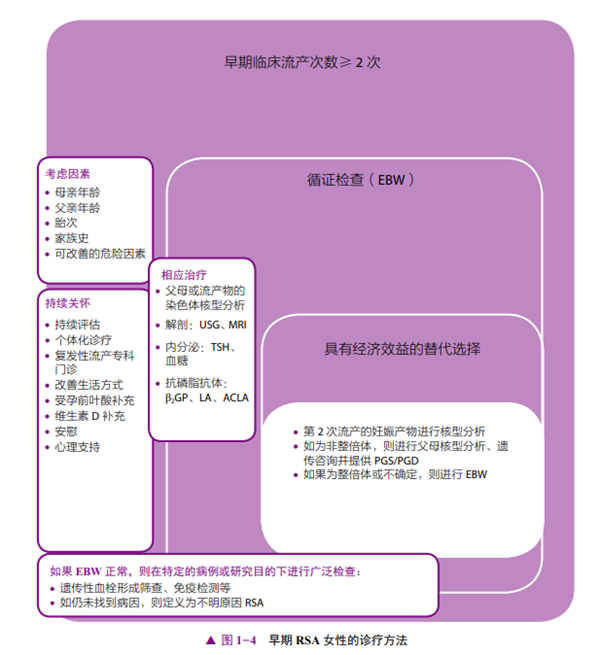
(四)循证检查
循证检查包括夫妻双方的遗传学检查、解剖和内分泌因素的评估及抗磷脂抗体的检测。文献表明,识别和治疗这些病因可能改善再次妊娠的结局。低生育能力的夫妻有相对较高的自然流产率,他们可能合并多种病因,这些夫妻需要进行早期评估,甚至在初次流产之后即开始评估。胚胎丢失或早期复发性流产常合并染色体畸变,也可能继发于抗磷脂抗体、内分泌因素、遗传性血栓形成(抗凝血酶Ⅲ、蛋白C或蛋白S缺乏,凝血因子Ⅴ或凝血酶原基因突变,高同型半胱氨酸血症),少数有解剖或感染因素。
(五)遗传学病因
早期流产最常见的病因是遗传因素,包括胚胎或父母起源的染色体畸变。在75%的早期自发流产后的流产组织标本中可发现遗传学异常,它可能是平衡(2%~5%)或非平衡易位、胚胎非整倍体、染色体数量异常(最常见的是三体)、基因重复或缺失或少见的单基因突变。平衡易位的夫妻生下患病婴儿的可能性不大[2]。
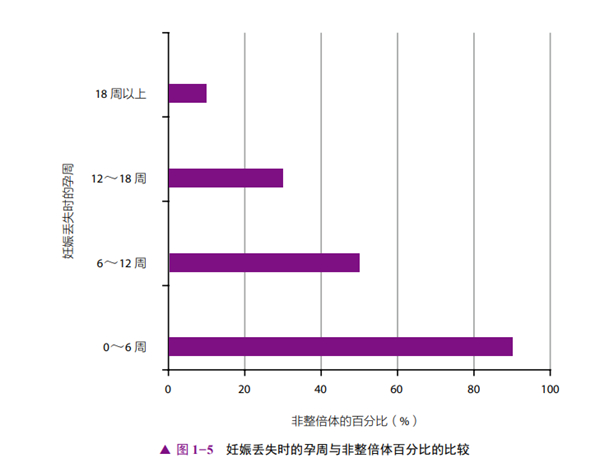
每次流产后,由遗传因素导致再次流产的风险就会降低。因此,有RSA史的女性中,胚胎非整倍体的发生率比偶发性流产的女性要低[7]。携带非平衡易位的胎儿可能会以流产、死产或伴有严重先天畸形的活产而告终。对比不同妊娠期的妊娠失败,由非整倍体导致的胎儿丢失随妊娠期的推进而降低(图1-5)[26]。美国妇产科学会(ACOG)建议对2次连续流产或3次非连续流产的女性进行流产物的基因分析[2]。
(六)基因分析
目前,基因检测已经用于诊断和预后判断。
1. 妊娠组织
妊娠组织可以进行基于微阵列的比较基因组杂交(array-CGH)以减少母亲的污染[27]。针对RSA流产组织的检查分为选择性评估和普遍评估两种方式。针对RSA的选择性评估是一种彻底且具有成本效益的方法,意味着只有当核型分析结果表明是一个整倍体胎儿时,才应该做进一步的评估。即使在高龄产妇身上,这种具有成本效益的方法也适用。与之相对的普遍评估则是对每一个有过2次流产病史的夫妇都要进行一组完整的基因检查[28]。
2. 父母的基因检测
外周血核型分析可以揭示遗传物质数量和结构上的异常,这是RSA病因研究中最彻底的遗传因素。特定的染色体异常或者重排都会影响活产的概率。基因咨询可以帮助患病夫妻了解已发现的基因异常的遗传概率、未来流产的风险,以及如果他们选择在不干预的情况下自行妊娠,是否有可能生下一个活的患病孩子。已知的染色体结构异常携带者和一些单基因缺陷携带者也可以选择进行辅助生殖,并结合胚胎植入前遗传诊断(PGD)对胚胎进行遗传分析,然后选择是否进行胚胎移植。
父母的核型异常遗传给胎儿的概率比孟德尔遗传预测的要少。在Carp等的队列研究中,已知的双亲核型畸变只出现在10%的流产中,而43.5%的流产是整倍体[29]。这种差异可能是由于某些受影响的胚胎临床前丢失所致。在父母核型异常的情况下,仍然可以鼓励其自然受孕,因为父母核型异常可能不能直接预测随后的胚胎核型异常。核型异常的父母产出健康婴儿的概率为75%,而胎儿核型异常的风险为5%~10%,这可能导致再次流产。如果继续妊娠,可能需要使用产前诊断技术,如早孕绒毛膜绒毛取样进行基因分析。对于不愿这样做的夫妻,可以建议其接受配子捐赠或收养[30]。
但是,即使是最近先进的PGT方法,也没有指南支持其使用或认为其使用可以产生良好的效果。2008年,美国生殖医学学会(ASRM)、欧洲人类生殖和胚胎学会(ESHRE)和英国生育学会认为,常规提供PGT对妊娠结局没有明显改善。有效的PGT对围产期结局没有促进作用,相反,它是昂贵且侵入性的方法。学会建议采用一种保守的、以团队为基础的方法,着重于支持性护理和定期监测[31]。
3. 单基因病
与流产相关的单基因缺陷主要有骨骼肌基因突变(包括三核苷酸重复序列)、参与免疫系统调节的基因突变、与妊娠植入或血栓形成相关的基因突变及某些特定酶的编码基因突变。这些突变导致早期复发性流产的情况较为罕见。
(七)内分泌 / 激素筛查
应检查和治疗未控制的糖尿病、甲状腺疾病和有症状的高泌乳素血症。无论是否有RSA病史,多囊卵巢综合征和黄体功能缺陷患者,其病情治疗方案或妊娠支持治疗都是相似的。
1. 糖尿病与RSA
在正常妊娠及糖尿病妊娠过程中,极端血糖水平下,孕妇的流产率都会增加;只是在糖尿病妊娠中,其流产率会更高。妊娠期糖尿病与流产风险明显相关,但亚临床葡萄糖耐受不良是否与RSA相关尚不清楚[32]。美国糖尿病协会建议,既往有糖尿病病史的女性有意愿妊娠时应达到以下血糖水平:空腹血糖 60~99 mg/dl,餐后血糖 100~129 mg/dl,糖化血红蛋白低于6%[33]。
在糖尿病女性中,有自然流产病史者空腹和餐后血糖水平高于有足月分娩活婴史的人。糖化血红蛋白水平越高,流产率越高。例如,早孕阶段糖化血红蛋白较正常水平升高一个标准差,则流产率增加3.1%,若糖化血红蛋白升高四个标准差,流产率会高达40%[34]。应建议女性在妊娠期间不要使用钠葡萄糖协同转运蛋白1(SGLT1)抑制药(如索格列净)治疗糖尿病。SGLT1在子宫内膜中表达,并控制糖原积累,而糖原积累对妊娠期组织营养至关重要。胚胎植入时人体子宫内膜的相对SGLT1缺陷可能导致早期妊娠失败和产科并发症,包括胎儿生长受限[35]。
2. 甲状腺疾病与 RSA
甲状腺疾病的筛查包括评估血清中促甲状腺激素(TSH)、甲状腺过氧化物酶抗体(anti-TPO)和甲状腺激素(T4)的水平[36]。
3. 妊娠期血清促甲状腺激素水平
2017年美国甲状腺协会妊娠指南建议,如果没有当地人群参考正常值,可采用4.0 mU/L为参考上限。然而,该参考上限偏高,许多亚临床甲状腺功能减退的病例可能被漏诊。因此,可以考虑将参考上限设为妊娠早期3.0 mU/L,妊娠中晚期3.5 mU/L,直到获得具有全国代表性的妊娠期TSH的数据[37,38]。
4. 甲状腺过氧化物酶抗体与RSA
TPO抗体的升高与RSA的关系存在争议。在对5914名患有RSA的女性进行的大型队列研究中,TPO抗体的存在并没有增加整倍体流产或不良妊娠结局的发生率。在药物试验中,TPO抗体水平升高的患者中使用左甲状腺素(LT4)并没有降低试验参与者的流产风险,也没有导致34周以上的活产率提高[39]。然而,如果RSA是由免疫反应引起的,甲状腺自身免疫似乎不是一个敏感的标志。
对包含460例甲状腺抗体阳性患者和1923例正常对照的8项研究进行Meta分析,发现抗甲状腺抗体阳性和复发性流产之间存在显著相关性(OR=2.3,95%CI 1.5~3.5)[40,41]。Kim团队的报道显示,抗甲状腺抗体阳性的复发性流产患者也表现出较高水平的抗心磷脂抗体水平和其他非器官特异性抗体[42]。
没有足够的证据可以确定LT4治疗是否能降低TPOAb阳性甲状腺功能正常的新晋孕妇的流产风险。但是,对于TPOAb阳性甲状腺功能正常的孕妇,如此前有流产病史,可以考虑给予LT4治疗,不仅风险极小,且具有潜在的好处。在这种情况下,25~50 μg的LT4是经典起始剂量[43]。在Lata等的病例对照研究中,具有RSA病史的孕妇的甲状腺自身免疫患病率(31%)明显高于健康孕妇对照组。在LT4治疗后,甲状腺功能正常和甲状腺功能低下的 TPOAb阳性女性的流产发生率没有差异[44]。
5. 多囊卵巢综合征和RSA
PCOS导致的RSA约占总妊娠的50%[45]。但是,对于患有多囊卵巢综合征的女性,无论是否有RSA,其治疗方法都是相同的。PCOS与RSA相关的可能机制如下[45]。
(1)PCOS患者的高雄激素血症、高胰岛素血症和胰岛素抵抗(IR)与流产风险增加均有关。Wang等注意到有RSA病史的女性妊娠早期存在更高的IR。
(2)PCOS涉及多个混杂因素,这些因素可能单独或联合造成血栓形成,并最终导致 RSA。
(3)在所有的可能机制中,IR、肥胖和高同型半胱氨酸血症(HHcy)最为重要。发生RSA 的PCOS组HHcy和IR的发生率分别为70%和56%,明显高于非PCOS组(HHcy:57%,IR:6%)。HHcy引发的流产率明显高于正常同型半胱氨酸组(PCOS:70% vs. 29%;非PCOS:57% vs. 42%)。同样,IR组流产率明显高于正常组(PCOS:70% vs. 56%;非PCOS:57% vs. 6%)[46]。
(4)在多囊卵巢综合征[46]患者中,PAI-I(一种内源性纤溶抑制药)水平升高,伴随的低纤溶状态导致的血栓形成是RSA的独立危险因素。
(5)Celik等比较了64例RSA孕妇组和64例对照组,发现[47]RPL组孕妇的空腹血糖、空腹血清胰岛素和HOMA-IR(胰岛素抵抗稳态模型评估)的平均值显著升高。Jakubowicz等发现高胰岛素血症导致妊娠早期胰岛素样生长因子结合蛋白-1(IGFBP-1)和免疫抑制性糖蛋白(glycodelin)浓度降低,从而增加流产的可能性。免疫抑制性糖蛋白可能在抑制子宫内膜对胚胎的免疫反应中发挥作用,而 IGFBP-1似乎促进了胎-母界面的黏附过程。然而,胰岛素能降低免疫抑制性糖蛋白和 IGFBP-1的浓度,增加流产[48]的风险。
6. 高泌乳素血症和 RSA
高血清催乳素水平导致卵泡发育受损、卵母细胞发育不良和黄体期缩短。当这些女性在随后的妊娠期接受溴隐停治疗时,治疗组的活产率为85%,对照组的活产率为52%[49]。
7. 生殖激素和 RSA
干扰素(IFN)-γ被认为是一个新发现的可能造成流产的病因,它与促黄体生成素和催乳激素相关。与对照组相比,RSA 组血清催乳素、FSH和LH水平显著升高。LH分泌过多往往与不孕及早期妊娠失败密切相关[49]。
8. 自身免疫和RSA
大约20%的RSA患者有自身免疫性疾病,而抗磷脂抗体(aPL)综合征是RPL最常见的自身免疫性疾病之一。有3次或3次以上RSA的女性中,大约15%伴有aPL持续呈阳性,如果不给予治疗,胎儿丢失率为50%~90%。抗磷脂综合征通常是可进行诊断和治疗的,也是唯一被证实其血栓倾向与不良妊娠结局有关的疾病。产科诊断标准包括:3次或3次以上胚胎丢失,1次或多次孕10周以上的胎儿丢失,有伴发胎儿生长受限和早产的子痫前期病史,狼疮抗凝物、β2-糖蛋白或抗心磷脂抗体滴度升高。自身免疫异常造成RSA的机制包括以下两方面。
(1)炎症:炎症是抗磷脂综合征的核心发病机制,组织损伤是除血栓形成以外,补体介导的炎症反应所致。
(2)子宫内膜和子宫内膜下血管:经多普勒超声检测,与正常妊娠女性相比,患有RSA和 aPL的女性在黄体中期这些血管明显受损,从而影响着床率。
这些孕妇应在孕前开始服用小剂量阿司匹林,并在尿妊娠试验呈阳性时进行抗凝治疗,并且至少持续至产后6周。阿司匹林和抗凝药物也能刺激产生IL-3,IL-3是胚胎着床和胎盘生长的重要因素,更有利于胚胎植入。Ziakas最近的Meta分析显示,肝素治疗对aPL患者早期妊娠丢失有效,但对晚期妊娠丢失无效。将低分子肝素(LMWH)联合阿司匹林治疗与普通肝素(UFH)联合阿司匹林治疗进行比较时,妊娠结局无差异[50,51]。
D Ippolito等证明低分子肝素可以通过阻断细胞表面的β2GPI与aPL的相互作用[52]来拮抗 aPL对人子宫内膜上皮细胞的损伤,并且具有剂量依赖性。统计数据表明,治疗后活产率有所改善,但对其他产科并发症如胎儿生长受限和子痫前期的疗效还不够令人满意。由抗磷脂抗体(aPL)造成的 RSA,且已经在使用阿司匹林和肝素的女性,糖皮质激素的应用没有额外的益处。其他自身免疫性疾病如系统性红斑狼疮、炎症性肠病、自身免疫性甲状腺炎、乳糜泻及不符合任何综合征的高滴度自身抗体都与 RSA[53]相关。
(八)解剖因素
宫颈功能不全和先天性子宫异常如纵隔子宫、双角子宫通常会导致妊娠中期妊娠丢失。以纵隔子宫为例,如果胚胎种植在纵隔上,此处纤维肌肉组织血管形成障碍,不利于胎儿有效的血管形成或胎盘发育,可能导致妊娠早期流产。一项研究[2]发现,宫腔镜下子宫纵隔切除术的实施能将流产率从80%降低到20%,成功妊娠从20%升高到90%。推荐使用经腹和经阴道三维或四维超声诊断子宫[2]异常。
(九)全面检查
1. 易栓症筛查
遗传性易栓症导致子宫胎盘血管血栓形成,这可能导致反复流产或更常见的死产或胎儿生长受限(表1-3)。

ACOG并不常规推荐进行遗传性易栓症筛查,皇家妇产科医师学院(RCOG)也不建议使用抗凝药物进行经验性治疗,除非有医学指征[2,54]。Viser等报道,患有RSA和遗传性易栓症的女性在服用阿司匹林或肝素或两者同时使用时,出生率相似。高同型半胱氨酸血症具有血栓形成倾向,可造成血管血栓形成,并可能导致流产。在不明原因的RSA病例中可以筛查血清同型半胱氨酸水平。治疗方法是补充叶酸,不可控或严重的高同型半胱氨酸血症可以进行预防性抗凝治疗[54,55]。
Kumar等在印度北部的一项研究中调查了复发性流产女性的遗传性易栓症情况,10%的病例发现 FVL杂合突变,2.7%的病例发现蛋白S缺乏[56]。
2. 免疫筛查
在排除了其他因素如解剖异常、内分泌紊乱和染色体异常的情况下,自然受孕或辅助生殖技术后与免疫异常相关复发性流产被称为免疫性复发性流产(IRA)。目前对以下免疫成分进行了研究。
(1)自然杀伤细胞(NK):NK细胞是在着床期和妊娠早期存在于子宫内膜的主要白细胞,调节滋养层的侵袭和血管生成。较高比例的NK细胞容易造成胚胎植入和妊娠失败[57,58]。
(2)辅助T细胞(helper T cell,Th):有利于维持妊娠,Th1/Th2细胞之间应处于平衡状态,且以Th2淋巴细胞为主,并与白细胞介素、NK细胞之间稳定相互作用。如果这种平衡被破坏,滋养细胞的细胞毒活性增强,将导致妊娠早期的妊娠丢失[57,58]。
(3)瘦素:瘦素是一种细胞因子样激素,在调节免疫反应中具有多重效应。它能激活单核细胞、树突状细胞和巨噬细胞,刺激产生 Th1型细胞,产生促炎细胞因子如 IFN-α和IL-2,调节适应性免疫。继发于免疫或不明原因的 RSA中的血清瘦素水平较高[58]。
(4)与正常孕妇相比,使用XMAP(multianalyte profiling)技术的Milliplex Luminex检测法测得的RSA女性血清细胞因子水平升高,提示其可能导致流产。与对照组相比,RSA组肿瘤坏死因子-α、IFN-γ、IL-8等细胞因子明显升高,IL-6明显降低(P<0.001)。在流产组中,细胞因子与FSH和LH之间没有显著相关性,而 IFN-γ与LH和催乳素之间有很强的相关性[59,60]。
人类白细胞抗原(HLA)、抗 HY抗体、NK细胞或细胞因子水平检测并不常规推荐。除了用于研究目的外,不推荐以往采用的免疫治疗,如淋巴细胞免疫治疗或父源性白细胞免疫、静脉注射免疫球蛋白、第三方供体细胞免疫或滋养细胞膜灌注等[59,60]。
(十)感染
妊娠期任何感染继发的高热通常导致高热相关的妊娠丢失,而不是复发性流产。但是,重复发生或有复发和缓解过程的感染,可能导致随后的妊娠过程出现流产。除非患者出现特异性的体征或症状,否则不建议对所有感染性疾病的抗体滴度进行常规筛查或随访。支原体、脲原体、刚地弓形虫、沙眼衣原体、巨细胞病毒、单核增生李斯特菌、风疹、单纯疱疹病毒(HSV)、麻疹和柯萨奇病毒,可以通过感染子宫内膜、宫颈内膜或胎儿-胎盘单位[2],引起妊娠早期流产。
在子宫内膜炎中,子宫内膜健康状态的分子标记物 nCyclin(一种腺上皮核细胞周期蛋白)升高。该标志物的异常升高表明妊娠可能失败,而正常水平则表明妊娠可能成功。血小板计数在感染或炎症时上升,是感染急性期的反应物。Mete Ural等发现,RSA患者的血小板计数和血小板分布宽度增加。因此,血小板计数具有较好的成本效益,易于测量和获得结果,是预测 RSA 的实用性标记物[61,62]。
(十一)心理因素
早孕RSA的夫妻会出现心理创伤,尤其是女性容易出现身心障碍,如抑郁、焦虑、不完整感和内疚感。各种研究表明,RSA可能与心理因素有关。在一项比较两组RSA夫妇的研究中,接受细心护理(除常规产科护理外)与接受常规产科护理相比,活产率更高(超过2倍)[63]。
(十二)原因不明的RSA
尽管进行了全面的检查,仍有50%的RSA找不到明确的病因,这些病例被归为原因不明的RSA或原因不明的复发性流产。免疫因素,如NK细胞失调、细胞毒性抗体的存在、母体阻断抗体的缺乏,以及固有的炎症反应增强倾向,被认为是可能的病因[13,14]。这些因素或单独或联合都可能导致 RSA。对于不明原因的RSA,不建议对免疫因素进行特殊检查,仅建议进行产前咨询和持续监测来处理不明原因的RSA。
六、黄体酮在RSA中的作用
孕激素对着床和维持妊娠至关重要。它具有免疫调节作用,并将平衡转移到Th2细胞因子反应,具有抗炎作用并维持妊娠[64]。孕激素能稳定子宫内膜,是胚胎着床所必需的,并在各种免疫反应中发挥关键作用,为维持妊娠提供稳态环境。因此,缺乏黄体酮可能导致流产。各种合成的和天然的黄体酮可以通过口服、阴道和胃肠外途径使用。具体剂量或具体途径的疗效未得到证实;然而,与自然受孕相比,辅助生殖技术受孕后使用的剂量更高,特别是在妊娠早期[65]。
有文献表明在RSA中使用孕激素有良好的结果。然而,在一项涉及1568名患者的随机对照试验(RCT)中,在不明原因复发性流产(PROMISE)女性妊娠早期使用孕激素治疗后妊娠结局并没有改善。如果已经开始孕激素治疗,还可以继续,孕激素治疗对这对夫妇的疗效报道十分有限或未经证实[66]。根据临床经验,如果没有使用禁忌,我们更倾向于在高危妊娠中补充孕激素。
PRISM试验即通过自然流产中的孕激素试验评估孕激素治疗早期妊娠出血的女性是否比安慰剂治疗会带来更高的活产率:这是一个双盲、安慰剂对照的RCT研究。符合条件的参与者是指年龄在16~39岁、孕周不超过12周、有阴道出血、超声可以看到宫内孕囊。结果显示,接受孕激素治疗的女性的活产率与接受安慰剂治疗的女性相似,两组的不良结局相似[67]。
七、其他可疑因素的可用治疗方法
1. 对于不明原因RSA的非血栓前状态的女性,抗凝治疗并不能改善妊娠结局[68]。
2. TNF-α抑制药和粒细胞集落刺激因子(G-CSF)用于治疗不明原因RSA正在进行试验研究。
3. 糖皮质激素或静脉注射免疫球蛋白治疗对RSA的疗效尚未证实。
八、管理
对于接受 RSA治疗的夫妇,没有固定或确定的方案。由于RSA可能是多因素的,应对患者提供个体化治疗。夫妇们应该放心,尽管经过大量调查仍未查明原因,但是60%~65%的夫妇将会有一个良好的妊娠结局。如果病因明确,应采取特异性的治疗,否则采取一般的必要支持措施,以达到最佳围产期结局(表1-4)。

九、结论
• RSA的原因可能是多因素的,当发现明确的病因时,纠正病因可以改善妊娠结局。RSA的检查应该在两次流产后开始,对于那些有生育问题的人应该尽早进行。
• 在不明原因的RSA中,即使流产次数多于3次或4次,下一次妊娠足月的概率为 60%~70%,远高于再次流产的概率。
• 尽管患有RSA的女性被视为高危妊娠,但详细的病史和临床检查、循证检查、遗传咨询、心理支持和安慰仍然是RSA良好结果的基础。
十、思考要点
• 尽管进行了大量的研究和探索,但RSA的女性的妊娠结局仍不清楚。对RSA者进行积极的咨询、细心的护理和定期的随访能得到最好的结果。
• 需要对不明原因的RSA进行进一步研究,以减轻对RSA女性进行检查和治疗所产生的经济负担。
• 应避免在没有明确证据的情况下过度治疗RSA。

本文来源《复发性流产与不良妊娠结局》,经出版社审核后发布,如需转载请注明出处。
 妇产科在线APP下载
妇产科在线APP下载










 京公网安备 11010202008857号
京公网安备 11010202008857号