Cambios histopatológicos en la miocardiopatía de la distrofia muscular del Golden Retriever
Historia natural de los cambios histopatológicos en la miocardiopatía de la distrofia muscular del Golden Retriever
 Sarah M. Scheider1*†
Sarah M. Scheider1*†  Garett T. Sansom2
Garett T. Sansom2  Lee-Jae Guo3
Lee-Jae Guo3  Shinji Furuya3†
Shinji Furuya3†  Brad R. Weeks1
Brad R. Weeks1  Joe N. Kornegay1,3
Joe N. Kornegay1,3- 1Departamento de Patología Veterinaria, Universidad de Texas A&M, College Station, TX, Estados Unidos
- 2Departamento de Salud Ambiental y Ocupacional, Universidad de Texas A&M, College Station, TX, Estados Unidos
- 3Departamento de Biociencias Veterinarias Integrativas, Universidad de Texas A&M, College Station, TX, Estados Unidos
Fondo: La distrofia muscular de Duchenne (DMD, por sus siglas en inglés) es una miopatía hereditaria ligada al cromosoma X que causa enfermedad progresiva del músculo esquelético y cardíaco. Las lesiones cardíacas se describieron en los primeros informes de DMD, y la miocardiopatía es ahora la principal causa de muerte. Sin embargo, el diagnóstico y el tratamiento de la miocardiopatía se han quedado rezagados con respecto a los de la enfermedad del músculo esquelético apendicular y respiratorio. La mayoría de los estudios en modelos animales se han realizado en el ratón mdx, que tiene una forma relativamente leve de miocardiopatía. Los perros con la enfermedad genéticamente homóloga Golden Retriever distrofia muscular (DMR) desarrollan una miocardiopatía progresiva análoga a la observada en la DMD. Los estudios descriptivos previos de la miocardiopatía GRMD se han limitado principalmente a la toma selectiva de muestras de corazones de perros jóvenes.
Métodos y resultados: Evaluamos sistemáticamente las lesiones cardíacas en 31 perros portadores y GRMD de 3 a 76 meses de edad y una cohorte separada de sabuesos normales de 2 a 10 años de edad. Tanto la puntuación semicuantitativa de la lesión como la cuantificación del área transversal de la fibrosis distinguieron a los perros con enfermedad GRMD de los perros normales. Los portadores generalmente tenían una afectación intermedia, pero tenían una fibrosis aún mayor que los perros GRMD. La infiltración grasa fue la característica más prominente en algunos perros GRMD de edad avanzada. La hipertrofia vascular aumentó en los perros con GRMD y se correlacionó positivamente con la gravedad de la lesión. La vacuolización de las fibras de Purkinje también aumentó, pero no se correlacionó con la gravedad de la lesión. Los cambios histopatológicos se correlacionaron con el realce tardío de gadolinio en la RM cardíaca.
Conclusión: Estas características son generalmente compatibles con las de la DMD y validan aún más la GRMD como un modelo útil para estudiar la patogénesis y el tratamiento de la miocardiopatía. Además, la naturaleza de algunas lesiones degenerativas sugiere que la hipoxia funcional o la isquemia no trombótica pueden contribuir a la progresión de la enfermedad.
Introducción
La distrofia muscular de Duchenne (DMD) y la distrofia muscular Golden Retriever (GRMD) son enfermedades musculares degenerativas genéticamente homólogas y fenotípicamente análogas causadas por mutaciones en el gen DMD, que codifica la proteína distrofina (1, 2). La pérdida de distrofina en el sarcolema conduce a la fragilidad de la membrana y a lesiones tanto esqueléticas (3) como musculares cardíacas (4, 5). Las complicaciones cardíacas son la principal causa de muerte en hombres jóvenes con DMD (6).
Aunque el corazón y el músculo esquelético carecen de distrofina, las diferencias en el Ca2+ La homeostasis (7-9), el metabolismo (10) y la localización del complejo distrofina-glicoproteína (11-13) contribuyen a cambios patológicos variables en los dos tejidos. Mientras que algunos estudios han demostrado que los déficits funcionales del músculo esquelético y cardíaco van de la mano, otros han demostrado una progresión variable (5, 6, 14-16). Este potencial de discordancia tiene importancia clínica. Las características típicas de la enfermedad cardíaca pueden no estar presentes en los niños con DMD en silla de ruedas (17, 18), lo que impide la evaluación de los efectos del tratamiento en el corazón. Más importante aún, la mejora en la función del músculo esquelético por sí sola podría aumentar la tensión en el corazón y acelerar la progresión de la enfermedad cardíaca (6, 17-21).
El perro GRMD es un importante modelo animal grande de DMD (1, 2). Las características de la enfermedad cardíaca en los perros afectados que son muy similares a las de los niños incluyen anomalías en el ECG (22-24), el inicio inicial de la lesión alrededor de la adolescencia (4, 5, 25), cambios predominantemente en el ventrículo izquierdo (VI) basolateral (4, 5, 25, 26) y la eventual progresión a miocardiopatía dilatada clínicamente evidente con fracción de eyección reducida e insuficiencia cardíaca (1, 2, 4 y 5). Estudios descriptivos patológicos previos, incluido el primer artículo de Valentine et al. (25), establecieron las características básicas de la miocardiopatía GRMD (1, 25-29). Sin embargo, estos estudios a menudo se centraron en perros jóvenes, y algunos evaluaron un número limitado de sitios anatómicos cardíacos. El estudio de Valentine fue exhaustivo en el sentido de que se evaluaron 13 perros y se tomaron muestras de 17 a 19 secciones cardíacas en cada uno de ellos, pero 24 de los 12 perros tenían <6 semanas de edad y no tenían anomalías detectables. En consecuencia, el estudio se centró en solo cinco perros con edades comprendidas entre los 5,6 meses (m) y los 6 años (y). Los cinco perros presentaban lesiones, estableciéndose 5,26 m como edad de inicio de los cambios patológicos. Basándose en un estudio de ocho beagles cruzados (CXMDJ) con la mutación GRMD, Yugeta et al. (12) sugirieron que el inicio patológico podría retrasarse hasta los 12 meses. Su evaluación patológica incluyó solo cuatro perros >21 m de edad, siendo el mayor de 12 m. No se observaron lesiones histopatológicas en perros <3 m, y solo 4 de los 29 perros mayores presentaron cambios. Si bien el estudio descriptivo más reciente realizado en Brasil (18) incluyó a <> perros con GRMD y también hizo el esfuerzo más concertado para diferenciar las lesiones entre los grupos de edad, solo se examinaron sitios individuales del VI y el ventrículo derecho (VD) para cada perro. Dado que todos los perros en el estudio de Brasil supuestamente murieron de insuficiencia cardíaca, los hallazgos patológicos en todos los grupos de edad podrían ser más típicos de la enfermedad en etapa terminal que de la enfermedad en etapa terminal. el espectro completo del desarrollo de la lesión.
Las mujeres portadoras heterocigóticas de mutaciones en el gen DMD también tienen un mayor riesgo de enfermedad cardíaca clínica (30-33) debido a la expresión de distrofina cardíaca en mosaico (30). Los portadores caninos de GRMD tienen un patrón de expresión de distrofina cardíaca en mosaico análogo (34) y lesiones similares a las de los perros afectados, incluyendo grados variables de fibrosis miocárdica, necrosis, mineralización e infiltración grasa concentrada en la pared libre del VI (35).
Dadas las similitudes entre las miocardiopatías DMD y GRMD, los estudios preclínicos en perros afectados deben informar el manejo de los pacientes con DMD. Los estudios patológicos suelen servir como el estándar de oro para establecer la progresión de la enfermedad y ayudan a seleccionar los marcadores diagnósticos y pronósticos adecuados. Reportamos una historia natural semi-cuantitativa de los cambios histopatológicos en la miocardiopatía en una gran cohorte de perros con GRMD en un amplio rango de edad.
Materiales y métodos
Animales
El cuidado de los perros en este estudio se rigió por los principios descritos en la Guía para el Cuidado y Uso de Animales de Laboratorio del Consejo Nacional de Investigación y los protocolos aprobados por el comité institucional de cuidado y uso de animales de la Universidad de Texas A&M. Típicamente, en nuestra colonia, las hembras portadoras se cruzan con semen de machos afectados, produciendo un 25% de machos normales, hembras portadoras, machos hemicigotos distróficos y hembras homocigóticas distróficas.
Se recolectaron corazones de treinta y ocho perros, incluidos 7 sabuesos normales (controles; 2-10 años; 5 hembras y 2 machos), 5 portadores de GRMD (3 m-4,5 años) y 26 perros afectados por GRMD [divididos en cuatro grupos de edad: <6 m (cinco perros), 6-12 m (siete perros), 12-24 m (cinco perros) y >24 m hasta 76 m (nueve perros)]. Los perros GRMD se dividieron en partes iguales entre machos hemicigotos y hembras homocigóticas.
Corazones
Se recolectaron corazones de perros afectados por GRMD que murieron o fueron sacrificados debido a la disminución de la calidad de vida (definida como una incapacidad para mantener la decúbito esternal o la progresión a insuficiencia cardíaca terminal) o en puntos finales para estudios no relacionados con la miocardiopatía. De los perros GRMD, solo uno fue sacrificado por razones relacionadas con la insuficiencia cardíaca intratable; Cuatro murieron o fueron sacrificados por otras razones. Se recolectaron corazones de perros portadores en los puntos finales terminales para estudios no relacionados con la miocardiopatía y de un perro (3 m) que murió bajo anestesia sin síntomas clínicos previos de enfermedad cardíaca. Se recolectaron corazones no afectados de una colonia no relacionada de perros sabuesos de trabajo sacrificados por eventos no cardíacos.
En todos los corazones, las muestras de las paredes libres del VI y del VD se congelaron en la necropsia y se almacenaron para posibles estudios de expresión génica e inmunohistoquímica. El resto del corazón entero se colocó en formol.
Patología macroscópica y seccionamiento
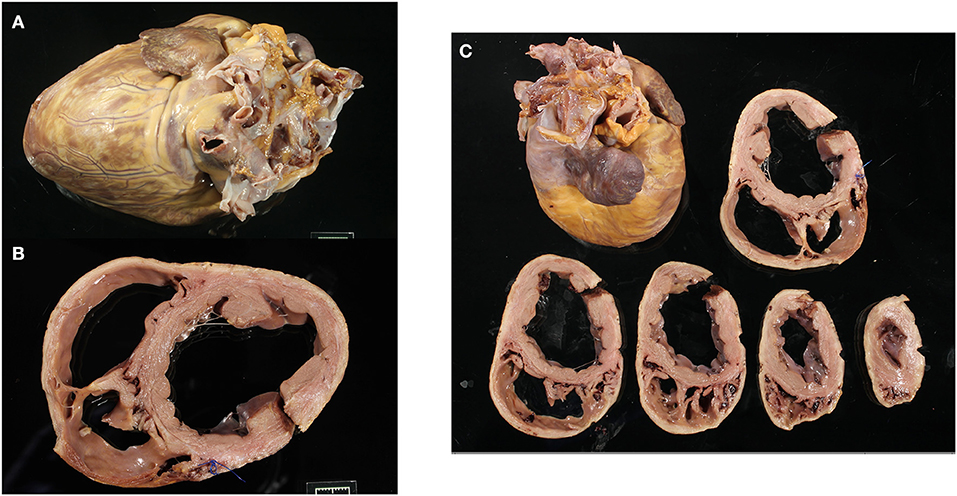
Los corazones fijos se pesaron y fotografiaron en seis vistas (craneal, caudal, lateral desde los lados izquierdo y derecho, base y ápice). Cada corazón se seccionó transversalmente a través del eje corto ventricular a intervalos de 1 cm hasta el nivel de las válvulas auriculoventriculares y se fotografió (Figura 1). Se pesaron los corazones y se midieron los espesores del VI fijo, del VD y del tabique interventricular (Tabla 1 y Tabla Suplementaria 1). Los corazones fueron evaluados macroscópicamente y en las imágenes para determinar la dilatación subjetiva, la palidez y la mineralización.
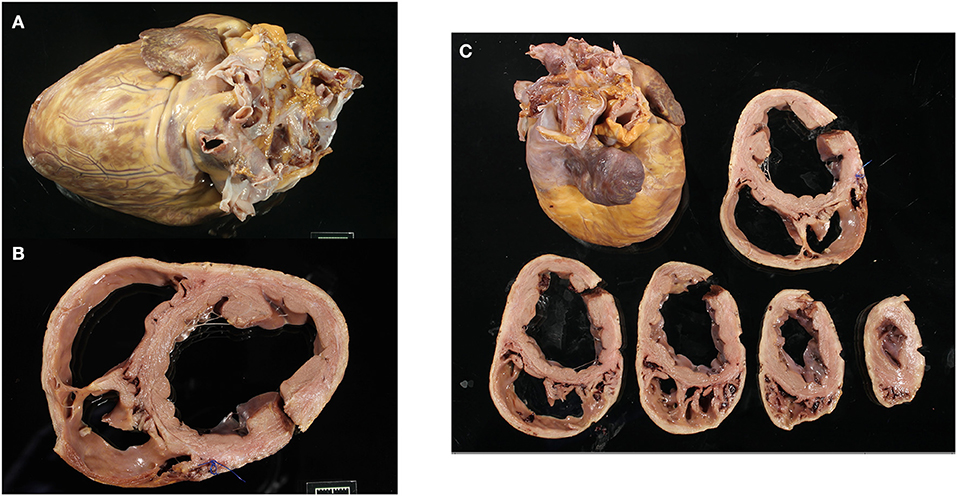 FIGURA 1. Imágenes macroscópicas representativas de un corazón con distrofia muscular Golden Retriever que muestran todo el corazón (A), la sección transversal basal con el ventrículo izquierdo y la dilatación del ventrículo derecho (B), y todas las secciones transversales ventriculares (C).
FIGURA 1. Imágenes macroscópicas representativas de un corazón con distrofia muscular Golden Retriever que muestran todo el corazón (A), la sección transversal basal con el ventrículo izquierdo y la dilatación del ventrículo derecho (B), y todas las secciones transversales ventriculares (C).
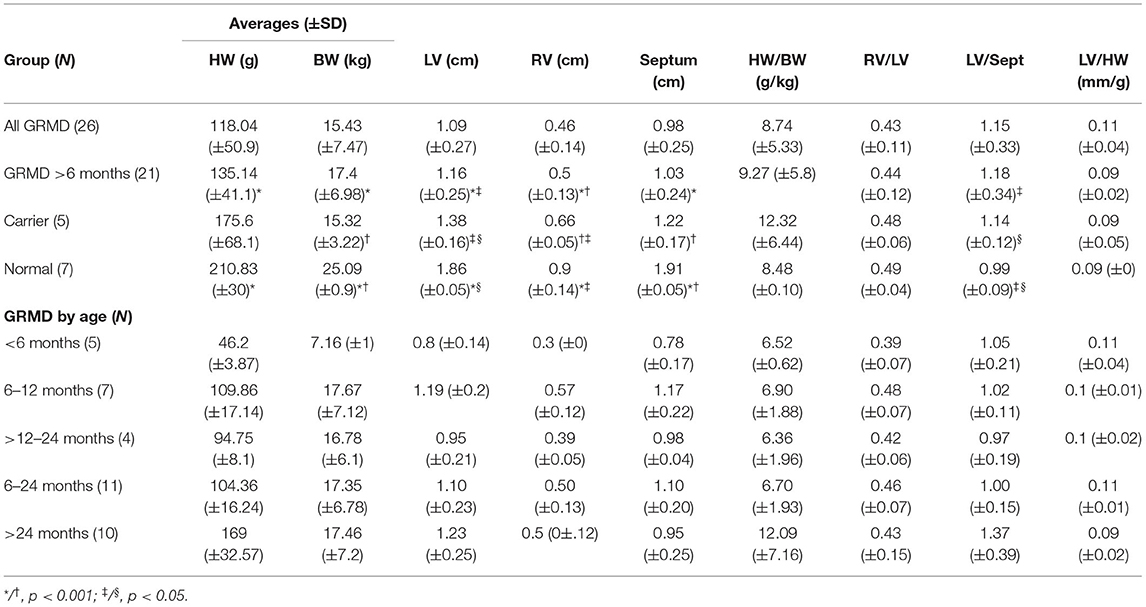 TABLA 1. Promedios de las mediciones cardíacas brutas para la distrofia muscular Golden Retriever (GRMD), perros portadores y normales.
TABLA 1. Promedios de las mediciones cardíacas brutas para la distrofia muscular Golden Retriever (GRMD), perros portadores y normales.
Cada corazón fue seccionado sistemáticamente para su histología. Se tomaron diecisiete secciones del VI (incluido el tabique) para corresponder con la segmentación estándar para imágenes avanzadas (36). Además, se recolectaron cuatro secciones del VD (anterior e inferior según se dispone a nivel basal y medio) y las aurículas izquierda y derecha. El nódulo auriculoventricular se aisló mediante la sección de la unión septal de la aurícula derecha por debajo del agujero oval y la cúspide no coronaria de la válvula aórtica. El nódulo sinoauricular se seccionó en la unión de la vena cava y la aurícula derecha (37). Los casetes de papel tisú que contenían las secciones se fotografiaron como referencia, se incluyeron en parafina y se procesaron de forma rutinaria. Los portaobjetos se cortaron con un espesor de 5-10 m y se tiñeron con hematoxilina y eosina (H&E) y tricrómico de Masson. Todas las diapositivas fueron escaneadas digitalmente a los 20 × en un generador de imágenes de diapositivas completas Hamamatsu NanoZoomer 2.0-HT (Hamamatsu Corporation; Bridgewater, Nueva Jersey, Estados Unidos).
Patología microscópica
Las imágenes digitales fueron evaluadas por un solo patólogo (SS) utilizando dos métodos para evaluar la gravedad de la enfermedad. A cada sección se le asignó un grado semicuantitativo para el porcentaje aproximado del área transversal afectada por lesiones histopatológicas, siguiendo generalmente el sistema descrito por Kane et al. (35) (0 = ninguno, 1 = 1-10%, 2 = 11-20%, 3 = 21-30% y 4 >30%) (Figura suplementaria 1). Estas puntuaciones se promediaron entre secciones y grupos para realizar comparaciones estadísticas (Tabla complementaria 2). En un segundo método, los cambios histopatológicos específicos se calificaron como ausentes/presentes, y se hicieron anotaciones para la naturaleza de algunos cambios. Las seis lesiones evaluadas fueron las siguientes: infiltración grasa (ausente/presente), necrosis aguda (ausente/presente), infiltrados inflamatorios (ninguno, principalmente histiocítico o principalmente linfoplasmocítico), mineralización (ausente/presente), vacuolización de la fibra de Purkinje (positiva si el 50% o más del citoplasma total de la fibra se vio afectado por la vacuolización) y la naturaleza de los cambios vasculares (ninguno, fibrosis, hipertrofia de la pared e hipertrofia intimal).
El porcentaje aproximado de secciones examinadas de todo el corazón con las seis lesiones individuales mencionadas anteriormente se puntuó semicuantitativamente utilizando un enfoque «+» modificado, en el que (−) = 0, (−/+) <0,5%, (+) = 0,5-20%, (++) = 20-30%, (+++) = 30-40% y (++++) >40% (Tablas 2, 3). Además, la localización de la lesión primaria dentro de cada segmento se clasificó como subepicárdica (1/3 externa), miocárdica media (1/3 media), subendocárdica (1/3 interna) o panmiocárdica (distribuida uniformemente a lo largo de la pared) (Figura 2).
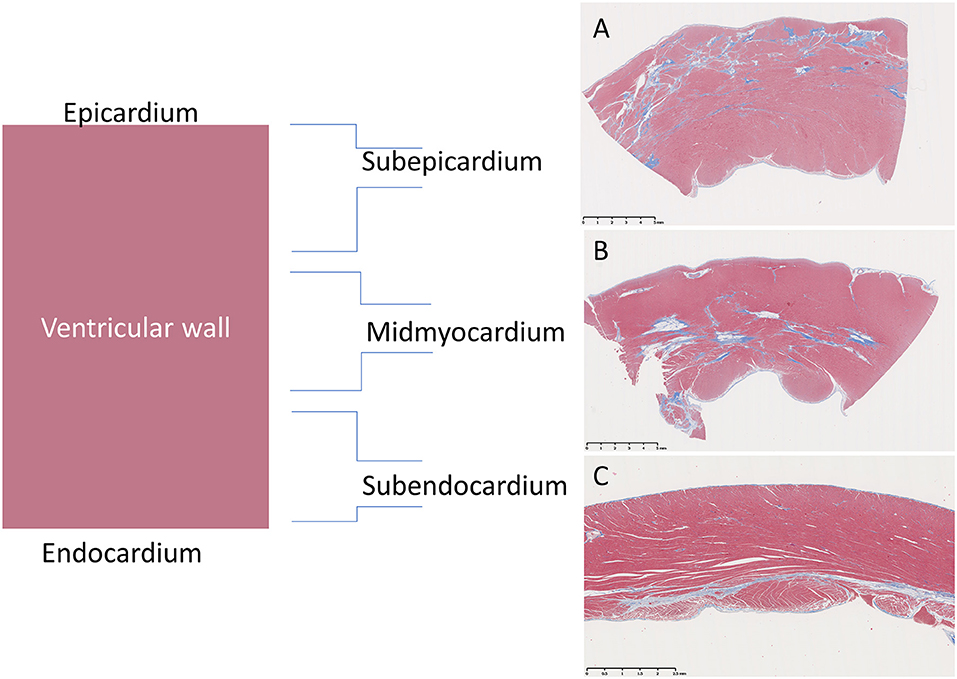 FIGURA 2. Representación de las distribuciones de las lesiones fibróticas dentro de la pared ventricular de perros Golden Retriever con distrofia muscular (DMGR) mediante una tinción tricrómica que tiñe el colágeno de azul y las fibras musculares de rojo. (A) El miocardio subepicárdico (machos, 3 años de edad) se ve afectado preferentemente en perros con GRMD (en la imagen) y en niños con distrofia muscular de Duchenne (no en la imagen). (B) Sin embargo, puede predominar el miocardio medio (varón, 4 años). (C) Los cambios subendocárdicos fueron raros y solo se observaron en el ventrículo derecho (mujer, 1 año de edad).
FIGURA 2. Representación de las distribuciones de las lesiones fibróticas dentro de la pared ventricular de perros Golden Retriever con distrofia muscular (DMGR) mediante una tinción tricrómica que tiñe el colágeno de azul y las fibras musculares de rojo. (A) El miocardio subepicárdico (machos, 3 años de edad) se ve afectado preferentemente en perros con GRMD (en la imagen) y en niños con distrofia muscular de Duchenne (no en la imagen). (B) Sin embargo, puede predominar el miocardio medio (varón, 4 años). (C) Los cambios subendocárdicos fueron raros y solo se observaron en el ventrículo derecho (mujer, 1 año de edad).
Los portaobjetos tricrómicos se analizaron cuantitativamente para determinar el porcentaje de fibrosis. Los archivos NDPI de cada diapositiva se exportaron como JPEG con un aumento de × 5 utilizando el NDPI to OME-TIFF Converter v1.5 (https://matthias-baldauf.at/software/ndpi-converter/). Estos archivos JPEG se recortaron en Graphic Converter (http://www.graphic-converter.net/) para eliminar secciones de tejido duplicadas y coágulos de sangre grandes. Los JPEG finales se analizaron en ImageJ utilizando macros por lotes (Datos Suplementarios S1) para distinguir el porcentaje de tinción azul del área total con tinción.
Resonancia magnética cardíaca
Algunos perros afectados por GRMD en este estudio formaron parte de un estudio de imágenes de historia natural separado (38) y se evaluó su función cardíaca antes de la recolección patológica. La resonancia magnética cardíaca (RMC) se realizó como se describió anteriormente (38), utilizando una máquina de resonancia magnética 3-T (Siemens 3T Magnetom Verio, Siemens Medical Solutions) mientras los perros estaban bajo anestesia general. Para identificar las lesiones fibróticas, se aplicó realce tardío de gadolinio (LGE) y un método de puntuación semicuantitativo (de 0 a 2; ninguno a realce marcado) para indicar la gravedad de la fibrosis en cada segmento miocárdico como se describió anteriormente (38). El método de segmentación del VI en la RMC fue similar a la segmentación histológica, ambos basados en el mismo estándar de 17 segmentos del VI (36) y modificados para el corazón canino. La distribución de la lesión del VI se comparó entre la RMC y las evaluaciones anatomopatológicas.
Estadística
Se calculó estadística descriptiva para cada variable, incluyendo sexo y edad. Se promediaron las mediciones brutas para los grupos y se compararon las medias con las pruebas t. Se realizó una prueba F de varianza con dos muestras para comparar la variabilidad en las relaciones entre el peso cardíaco (HW) y el peso corporal (PC) entre los grupos. Las secciones del corazón se clasificaron en 25 regiones para realizar comparaciones (como se describió anteriormente, 17 segmentos del ventrículo izquierdo, 4 segmentos del ventrículo izquierdo, aurículas izquierda y derecha, y los ganglios auriculoventricular y sinoauricular). Se realizó un análisis de varianza unidireccional (ANOVA) comparando la media y la desviación estándar del porcentaje de fibrosis y las puntuaciones semicuantitativas de las lesiones en todas las regiones del corazón y comparando el porcentaje de fibrosis entre las muestras de GRMD, portadoras y normales. Se utilizó la regresión logística ordinal para determinar si la variable independiente ordenada, la edad, se asociaba con un aumento en la puntuación semicuantitativa de la lesión de corte transversal. Se calculó el número promedio de secciones con cada una de las seis lesiones individuales detalladas anteriormente, y se utilizó un ANOVA para comparar la frecuencia de cambio entre GRMD, portador y normal, así como entre grupos de edad de GRMD para cada característica. Se calculó una prueba t de muestra independiente que comparó el porcentaje de fibrosis, estratificada por el sexo del perro del que se obtuvo la muestra. Se realizó una regresión logística ordenada, comparando un aumento en las puntuaciones semicuantitativas de la lesión y vasculares. Finalmente, se realizó el análisis de orden de rango de Spearman para evaluar la correlación entre el LGE y las puntuaciones patológicas, y se realizó un ANOVA para comparar el valor medio del porcentaje de fibrosis y las puntuaciones de LGE dentro de las secciones del VI en los corazones de siete perros. Las estadísticas se calcularon utilizando STATA 15 (College Station, TX, EE.UU.) y Microsoft Excel (Redmond, WA, EE.UU.).
Resultados
Hallazgos brutos
No se observaron lesiones macroscópicas en ninguno de los cinco perros afectados menores de 6 m de edad. Los perros mayores tenían múltiples lesiones que variaban en gravedad y distribución. De los perros de 10 a 12 meses de edad, 5/7 tenían cambios macroscópicos, incluyendo palidez y estrías en el VI (3/7) o en el VD (1/7), y 3/7 tenían focos fibróticos o mineralizados en el músculo papilar. Solo 1/7 tenía dilatación concomitante clara del VI y del VD en el examen macroscópico. En los cuatro perros de 12 a 24 m de edad, uno tenía dilatación del VD (1/4) o del VI (1/4). Los diez perros >24 m presentaron cambios macroscópicos, incluyendo dilatación del VI (7/10); dilatación del VD (4/10); dilatación auricular (2/10); paredes ventriculares delgadas (2/10); y palidez y estrías en el VI (6/10), VD (3/10) y tabique (3/10) o palidez con mineralización en el músculo papilar (3/10). En los perros portadores, 4/5 (todos >12 m) presentaron cambios macroscópicos, incluyendo engrosamiento del VI y del tabique (3/5), agrandamiento de la aurícula derecha (1/5) y palidez y estrías del VI y del tabique septal (1/5).
Además, se utilizaron pruebas t para comparar las mediciones brutas medias entre los grupos (Tabla 1). Para las comparaciones de las mediciones de la PC, la pros y la pared ventricular, se excluyeron los perros inmaduros (<6 m), a menos que se indique lo contrario, ya que las relaciones entre la fuerza natural y la propulsión y las relaciones ventriculares difieren incluso entre perros inmaduros normales y adultos (39). Con base en el peso corporal, los sabuesos normales eran significativamente más pesados (25,09 ± 0,09 kg) que los perros portadores (15,32 ± 3,22 kg) o adultos (17,4 ± 6,98 kg; p < 0,001 para ambos); el peso corporal de los perros portadores y adultos de GRMD no fue significativamente diferente. Del mismo modo, el promedio de HW difirió entre los grupos, con GRMD adulto (135,14 ± 41,05 g) < portador (175,6 ± 68,9 g) < normal (210,83 ± 0,05 g) (Tabla 1), pero la disparidad de HW solo fue significativa (p < 0,001) entre normal y GRMD. Para tener en cuenta mejor el efecto del tamaño corporal sobre el peso del corazón, se calcularon las relaciones HW/PC. La relación HW/PV no difirió entre los perros GRMD (8,74 ± 5,33), portadores (12,32 ± 6,44) y normales (8,48 ± 0,10) cuando se compararon todas las edades o cuando se compararon solo perros >6 m (9,27 ± 5,80) (Tabla 1), lo que sugiere que la menor HW en los perros GRMD se debió a su menor estatura. Los resultados para perros individuales se incluyen en la (Tabla suplementaria 1).
Se realizó una prueba F de varianza con dos muestras para comparar la variabilidad en las relaciones HW/BW en los perros. Curiosamente, los perros GRMD >24 m y los portadores >12 m tuvieron una varianza significativamente mayor en la relación HW/BW que los perros normales o los perros GRMD <24 m, lo que refleja la amplia variación fenotípica y la progresión de la enfermedad en perros mayores. En los perros GRMD >24 m, la relación HW/PN osciló entre 5,85 y 31,4 g/kg (Tabla Suplementaria 1), y cuatro perros cayeron muy por encima del rango previamente informado de 4,53 a 10,04 g/kg en perros adultos grandes (39, 40). De manera similar, los 3 perros portadores >24 m (28-76 m) tuvieron relaciones HW/BW más altas de 13,5 a 23,1 g/kg. El peso corporal no difirió entre los perros GRMD >24 m vs. los <24 m de edad, pero el HW fue significativamente mayor en el grupo de mayor edad (169 ± 32,6 vs. 104,4 ± 16,2 g; p < 0,001). Esto sugiere que el aumento de la relación HW/BW es impulsado por un aumento relativo de HW en los perros más viejos.
Al comparar las mediciones entre los grupos, el espesor promedio del VI varió significativamente: DMGR (1,09 ± 0,27 cm) < portador (1,38 ± 0,16 cm) < normal (1,86 ± 0,05 cm) (p < 0,05) (Tabla 1), pero la relación entre el espesor del VD y el espesor del VI no difirieron. De los cinco portadores, cuatro tenían engrosamiento subjetivo de la pared y del músculo papilar en relación con el tamaño del corazón en el examen macroscópico. Sin embargo, al corregir el grosor del VI para el HH general, los grupos no fueron significativamente diferentes (Tabla 1), lo que sugiere que los corazones con paredes más gruesas fueron proporcionalmente más pesados.
Puntuación semicuantitativa de lesiones en perros GRMD
Utilizando imágenes teñidas con H&E y tricrómico, las secciones se puntuaron semicuantitativamente en función del porcentaje total del área de la sección transversal, como lo describen generalmente Kane et al. (35) (0 = ninguno, 1 = 1-10%, 2 = 11-20%, 3 = 21-30% y 4 >30%). Las secciones del corazón se clasificaron en 25 regiones para realizar comparaciones, como se describió anteriormente. Entre los perros con GRMD, las puntuaciones de las secciones individuales variaron de 0,7 (varios sitios) a 1,4 (anterolateral basal). Las puntuaciones para los portadores fueron más bajas, variando de 0,3 a 1,2, y los sitios con mayor/menor afectación no correspondieron al grupo GRMD. Los perros normales tuvieron puntuaciones más bajas, que oscilaron entre 0,1 y 0,7. El área media general de la lesión transversal fue mayor en la GRMD vs. perros normales (1,02 vs. 0,3; p < 0,001). Si bien la puntuación media de los portadores (0,6) fue intermedia, no fue significativamente diferente de la de los perros GRMD o normales. En la evaluación del ANOVA de un factor que comparó la puntuación media del área transversal entre las secciones, ninguna sección tuvo una puntuación significativa mayor o menor en el área transversal. Los valores de los perros individuales y los promedios de las secciones se muestran en la (Tabla complementaria 2).
Se utilizó la regresión logística ordinal para determinar si la variable independiente ordenada, la edad, se asociaba con un aumento en la puntuación semicuantitativa de la lesión. Las puntuaciones de cada sección mostraron una correlación estadísticamente significativa (p < 0,001) con la edad, consistente con la progresión de la enfermedad a lo largo del tiempo.
Infiltración grasa
La infiltración grasa (Figuras 3A, B) se observó con frecuencia en los corazones de los perros portadores y GRMD de mayor edad (Tabla 2). Mientras que el porcentaje de secciones afectadas en cada corazón normal osciló entre 0 y 30%, los perros portadores y GRMD >24 m tenían >50% de secciones que mostraban infiltración grasa y degeneración. En los perros GRMD >24 m, 195/232 (84%) de las secciones examinadas presentaron cambios grasos. Un porcentaje similar de secciones (56/76, 74%) en portadoras también mostraron degeneración grasa, mientras que solo 18/149 (12%) de las secciones normales presentaron esta lesión. Sin embargo, solo las diferencias entre GRMD y perros normales fueron significativas (p < 0,01), probablemente debido al número relativamente bajo de portadores.
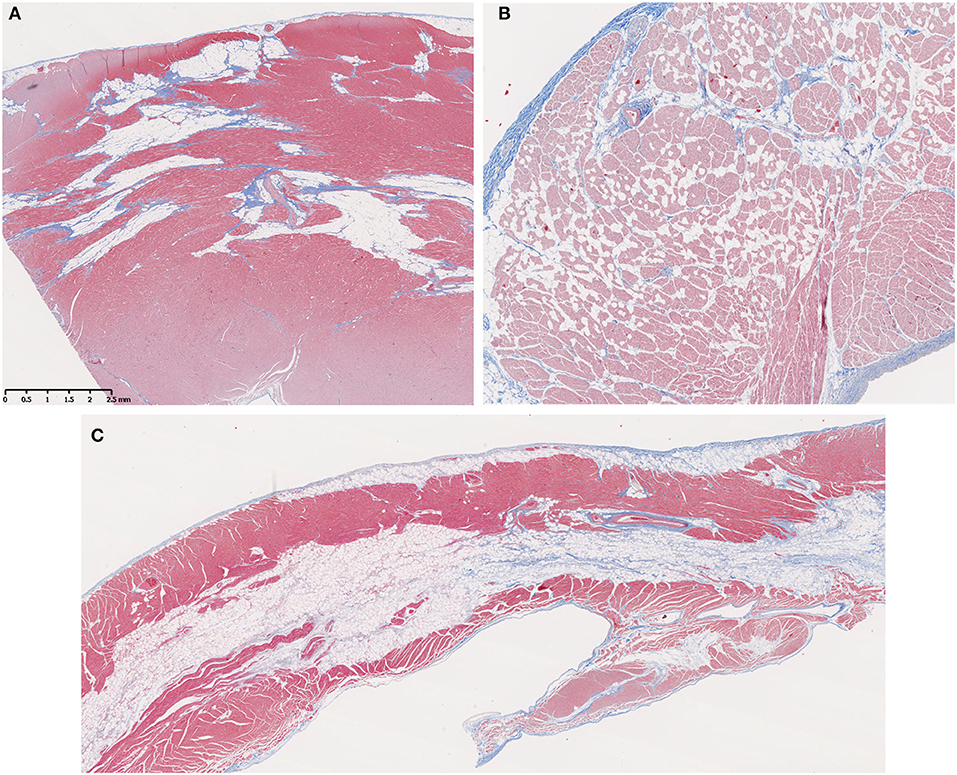 FIGURA 3. La infiltración grasa fue una característica prominente en los perros mayores con distrofia muscular Golden Retriever (GRMD). (A) Una sección de la pared libre del ventrículo izquierdo de una perra de 3 años de edad muestra grandes bandas de grasa (tejido vacuolado que no mancha) que reemplaza el músculo miocárdico normal (rojo) y predomina sobre la fibrosis (azul). (B) En algunos casos, la infiltración grasa fue más difusa con grupos individuales o pequeños de células grasas dispersas por todo el miocardio (varón, 1 año de edad). (C) En varios perros, el VD mostró un sorprendente reemplazo miocárdico medio por bandas de grasa con tejido fibrótico mínimo (macho, 3,5 años de edad). En estas secciones teñidas con tricrómicos, las fibras musculares = rojo, el colágeno = azul y las células grasas = tejido vacuolado sin tinción; × 10 aumentos originales.
FIGURA 3. La infiltración grasa fue una característica prominente en los perros mayores con distrofia muscular Golden Retriever (GRMD). (A) Una sección de la pared libre del ventrículo izquierdo de una perra de 3 años de edad muestra grandes bandas de grasa (tejido vacuolado que no mancha) que reemplaza el músculo miocárdico normal (rojo) y predomina sobre la fibrosis (azul). (B) En algunos casos, la infiltración grasa fue más difusa con grupos individuales o pequeños de células grasas dispersas por todo el miocardio (varón, 1 año de edad). (C) En varios perros, el VD mostró un sorprendente reemplazo miocárdico medio por bandas de grasa con tejido fibrótico mínimo (macho, 3,5 años de edad). En estas secciones teñidas con tricrómicos, las fibras musculares = rojo, el colágeno = azul y las células grasas = tejido vacuolado sin tinción; × 10 aumentos originales.
La infiltración y degeneración grasa aumentó con la edad. No se vio ninguno en ningún perro <6 m. Los perros GRMD >24 m tuvieron una proporción significativamente mayor de secciones con infiltración grasa (84,05%) que cualquiera de los grupos más jóvenes de GRMD (0%, 6 m; 14,75%, 6-12 m; 16,95%, >12-24 m; p < 0,001) (Tabla 2). Lo mismo fue probablemente cierto para los portadores, en los que solo dos secciones en un perro <12 m tenían infiltración grasa, aunque los números eran demasiado pequeños para determinar la importancia. Ningún perro normal medía <22 m; los tres perros de mayor edad presentaron el mayor número de secciones afectadas en este grupo (Tabla 3).
El reemplazo graso del miocardio medio fue una característica prominente en el VD de algunos perros con GRMD (Figura 3C), con solo pequeñas bandas de músculo que quedaban a cada lado de una banda central de tejido adiposo. Este patrón no se observó en el ventrículo izquierdo, donde las áreas irregulares de grasa tendían a rodear los vasos y mezclarse con fibrosis (Figura 3A).
Necrosis aguda
De los 26 perros GRMD, 0/5 <6 m (0%), 5/7 6-12 m (71%), 2/4 12-24 m (50%) y 4/10 >24 m (40%) tenían al menos una sección con necrosis coagulativa aguda (Figura 4). Casi la mitad del número de perros con GRMD con este cambio (5/11) tuvieron tres o más secciones con necrosis aguda. Más de la mitad del número de perros con necrosis aguda (7/11) midió entre 6 y 24 m, lo que apunta a la aparición relativamente temprana de esta lesión. Se encontró necrosis aguda al menos una vez en las 17 secciones del VI y 4 del VD que se examinaron en cada perro, y ninguna sección del corazón tuvo una mayor probabilidad de lesiones. No se encontró necrosis aguda en las aurículas. Por cierto, 3/7 perros normales y 2/5 perros portadores, cada uno >24 m, también tenían al menos una, pero no más de tres, secciones con necrosis miocárdica aguda (Tabla 3).
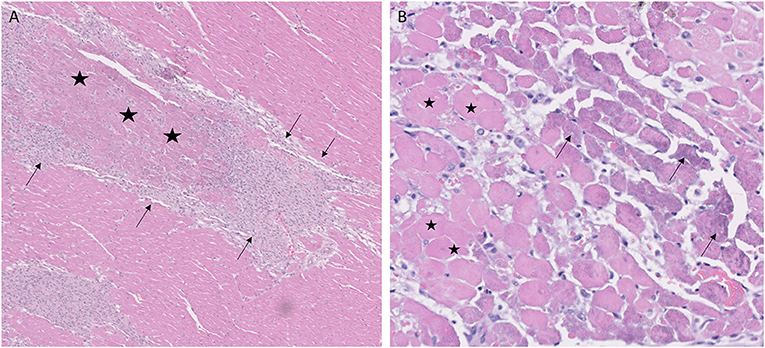 FIGURA 4. La necrosis miocárdica coagulativa fue una característica en algunos corazones con distrofia muscular Golden Retriever. (A) Las áreas de necrosis coagulativa tipo infarto caracterizadas por la pérdida de detalle citoplasmático y el mantenimiento de la arquitectura tisular (estrellas) están rodeadas por macrófagos y pericitos proliferantes (flechas); H&E, × 5 aumentos. (B) Necrosis coagulativa aguda con pérdida de núcleos y citoplasma hipereosinofílico (células representativas con estrellas); Las células en los márgenes de las lesiones tienen mineralización basófila granular (flechas). Hembra de 1 año, H&E, × 20 aumentos.
FIGURA 4. La necrosis miocárdica coagulativa fue una característica en algunos corazones con distrofia muscular Golden Retriever. (A) Las áreas de necrosis coagulativa tipo infarto caracterizadas por la pérdida de detalle citoplasmático y el mantenimiento de la arquitectura tisular (estrellas) están rodeadas por macrófagos y pericitos proliferantes (flechas); H&E, × 5 aumentos. (B) Necrosis coagulativa aguda con pérdida de núcleos y citoplasma hipereosinofílico (células representativas con estrellas); Las células en los márgenes de las lesiones tienen mineralización basófila granular (flechas). Hembra de 1 año, H&E, × 20 aumentos.
Una perra hembra de 12 m de edad tenía secciones marcadamente más afectadas (14/27 segmentos cardíacos) con necrosis miocárdica aguda. Este perro tuvo un incidente de respiración abdominal marcada y orina oscura de causa indeterminada después de la anestesia para el tratamiento de heridas a ~ 6 m de edad. No se documentó hipertermia y la oxigenación de la sangre se mantuvo en el rango normal. Como parte de un estudio no cardíaco, fue sacrificada bajo anestesia a los 12 m de edad.
Inflamación
Las células inflamatorias se observaron en todos los grupos de enfermedad y no difirieron entre las edades, incluso si se excluyeron los perros más jóvenes (Tabla 2). Si bien las puntuaciones generales de inflamación entre los perros normales, GRMD y portadores no difirieron, hubo diferencias en los tipos de células. Los perros normales tenían infiltrados linfoplasmocíticos, con un perro de 46 m de edad con infiltrados en casi todas las secciones examinadas. A pesar de que los perros normales fueron sacrificados por lesiones no cardíacas, dos perros examinados inicialmente para el estudio fueron excluidos debido a la enfermedad de Chagas crónica (Trypanosoma cruzi) detectada histológicamente y por PCR. No se detectó T. cruzi en el resto de los perros, pero la exposición con lesiones asociadas puede explicar la inflamación inesperada en algunos perros de este grupo. Por el contrario, los perros portadores y con GRMD tuvieron pocas secciones con infiltración linfoplasmocítica (cuatro en todos los perros examinados), con inflamación predominantemente histiocítica. La inflamación histiocítica es típica secundaria a la degeneración y a la necrosis aguda, que se produce inicialmente en 48 h y alcanza su punto máximo en torno a los 6 a 10 días, con una resolución lenta a medida que el tejido se remodela (41, 42).
Curiosamente, al comparar los grupos de edad, los perros <6 m tenían significativamente menos secciones con inflamación (sin inflamación) que los perros de 10-12 y >24 m de edad (p < 0,05 y p < 0,01), pero no fueron significativamente diferentes del pequeño grupo de perros de 12 a 24 m de edad. Los perros de 10 a 12 m tendieron a tener secciones más inflamadas que los perros de 12 a 24 m de edad (p = 0,054), mientras que los perros >24 m tuvieron secciones significativamente más afectadas que los perros de 12 a 24 m de edad (p < 0,05). Sin embargo, los perros de 10-12 m y >24 m de edad no difirieron.
Mineralización
No se observó ningún mineral en los corazones de los perros normales. Todos los perros GRMD >10 m tenían mineral en al menos 1 sección, con la excepción de un macho de 17 m de edad que presentaba pocas lesiones de cualquier tipo (Tabla 3). El número promedio de secciones que contienen mineral difirió significativamente (p < 0.05) entre los grupos de edad de GRMD (<6 m: 0 secciones, sin mineral detectable; 6-12 m: 8.4 secciones; 12-24 m: 2 secciones; >24 m: 8.8 secciones). Los números bajos en el grupo de 12 a 24 m probablemente reflejan las lesiones relativamente leves en este grupo de edad en nuestro estudio, ya que se ha demostrado previamente que el grado de mineralización disminuye con la edad (25). Dos de los cinco portadores también tenían mineral en al menos una sección.
Fibras Purkinje
Estudios previos describieron pero no puntuaron la vacuolización de la fibra de Purkinje a partir de menos de 6 m en el corazón GRMD (CXMDJ) (27). También se han descrito cambios degenerativos en las fibras de Purkinje de niños con DMD (43). Puntuamos la vacuolización de la fibra de Purkinje como presente si las vacuolas afectaban al 50% o más del citoplasma total de la fibra (Figura 5). De los 26 perros GRMD, 4/5 (80%) <6 m, 6/7 (86%) 6-12 m, 4/4 (100%) 12-24 m y 7/10 (70%) >24 m tenían al menos un segmento con vacuolización. Los perros GRMD tuvieron un aumento significativo de la vacuolización de la fibra (promedio, 6,9 secciones afectadas; rango, 0-19) en comparación con ambos portadores (1,4 secciones; p < 0,01) y perros normales (1,6 secciones; p < 0,01) (Tablas 2 y 3). La vacuolización de la fibra de Purkinje no difirió entre los perros portadores y normales ni entre los grupos de edad de la cohorte GRMD. A diferencia del estudio anterior de CXMDJ, a algunos perros GRMD no se les detectó vacuolización de la fibra de Purkinje. Además, la vacuolación no se correlacionó con la edad ni con las puntuaciones semicuantitativas o cuantitativas de las lesiones. De hecho, la vacuolización fue marcada en algunos de los perros más jóvenes que, por lo demás, no tenían lesiones. El examen de los portaobjetos H&E no mostró una diferencia visual apreciable en las vacuolas entre los grupos. Los ganglios sinoauricular y auriculoventricular no presentaron anomalías observables con la tinción de H&E o tricrómica.
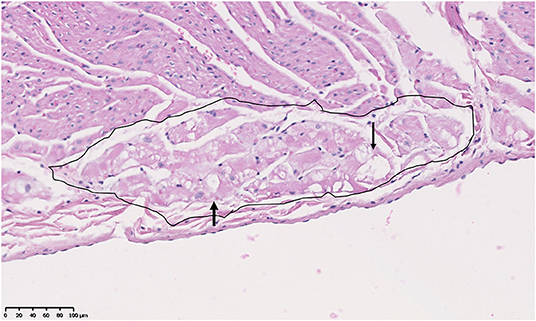 FIGURA 5. Vacuolización de la fibra de Purkinje (área encerrada en un círculo) (espacios despejados indicados por puntas de flecha) en el corazón de un perro macho Golden Retriever con distrofia muscular Golden Retriever de 18 meses de edad. H&E, × 20 aumentos.
FIGURA 5. Vacuolización de la fibra de Purkinje (área encerrada en un círculo) (espacios despejados indicados por puntas de flecha) en el corazón de un perro macho Golden Retriever con distrofia muscular Golden Retriever de 18 meses de edad. H&E, × 20 aumentos.
Cambios vasculares
Se evaluaron los cambios vasculares de fibrosis e hipertrofia medial (Figura 6). Los corazones de los perros GRMD <6 m solo tuvieron cambios raros. Los de perros adultos (>6 m) con GRMD tuvieron una frecuencia significativamente mayor de hipertrofia de la pared vascular que los perros normales (5,2 vs. 1,7 secciones; p < 0,01). Aunque los números bajos impidieron la detección de una diferencia entre los perros normales y los portadores, dos de los portadores tenían hipertrofia en el doble de secciones que los perros normales más altos.
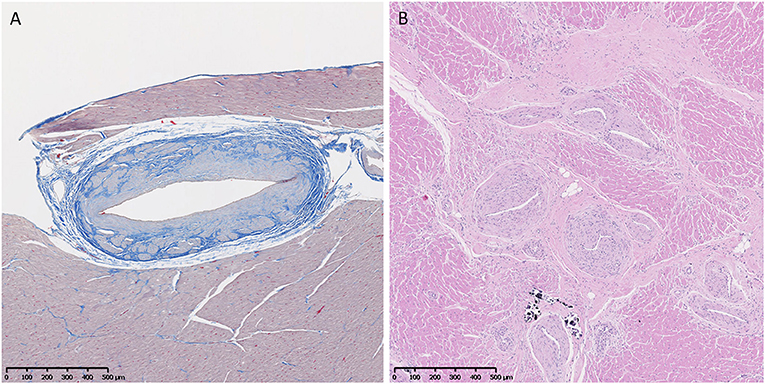 FIGURA 6. (A) Aumento del tejido fibroso (azul) en una arteriola de una niña normal de 3 años de edad. Tricrómico, × 5 aumentos. (B) Marcada hipertrofia medial e íntima y proliferación vascular en arteriolas en el corazón de un perro macho Golden Retriever con distrofia muscular Golden Retriever de 6 años de edad. H&E, × 5 aumentos.
FIGURA 6. (A) Aumento del tejido fibroso (azul) en una arteriola de una niña normal de 3 años de edad. Tricrómico, × 5 aumentos. (B) Marcada hipertrofia medial e íntima y proliferación vascular en arteriolas en el corazón de un perro macho Golden Retriever con distrofia muscular Golden Retriever de 6 años de edad. H&E, × 5 aumentos.
La regresión logística ordenada que comparó un aumento en la puntuación transversal semicuantitativa (que no incluyó cambios vasculares) y las puntuaciones vasculares en perros GRMD mostró una asociación altamente significativa entre la hipertrofia arteriolar y un aumento en la puntuación de gravedad semicuantitativa. Por cada aumento de 1 punto en la puntuación vascular, hubo un aumento de 0,32 en la puntuación de gravedad semicuantitativa (puntuación z = 3,91, p < 0,001). Aunque están correlacionados, no está claro si existe una asociación causal o si ambos representan un aumento acumulado de los cambios degenerativos con la edad.
Además, la mineralización aórtica fue una característica prominente en los perros GRMD, con 11/26 con mineralización prominente en la aorta: 0/5 <6 m, 4/7 6-12 m, 1/4 12-24 m y 6/10 >24 m de edad. No se observó mineralización aórtica en los portadores, mientras que 2/7 de los sabuesos normales más viejos tenían depósitos minerales mucho más pequeños en la pared aórtica.
Aunque la hipertrofia endotelial fue descrita por Valentine et al. en un perro, no se detectó en este estudio.
Fibrosis cuantitativa
Se realizó un análisis de varianza para evaluar la relación entre el estado de la enfermedad y el porcentaje de fibrosis del área transversal medido mediante tinción tricrómica. Se incluyeron datos de todos los grupos de edad, incluidos los perros más levemente afectados <6 m. Los tres grupos fueron muy diferentes (p < 0,001), siendo los portadores los que presentaron mayor fibrosis (media: 9,82 ± 1,01% de tinción azul) en comparación con la GRMD (7,84 ± 0,25%), mientras que los perros normales (4,35 ± 0,26%) tuvieron el porcentaje más bajo. Una prueba t independiente no indicó diferencias entre los sexos en la fibrosis.
Además, el grado de tinción de fibrosis difirió significativamente entre los grupos de edad de GRMD según lo determinado por ANOVA de un factor (puntuación f = 15,01, p < 0,001). La prueba post-hoc de Tukey reveló que el valor medio a los 6-12 m (5,38 ± 3,54%) fue significativamente menor que el de todos los demás grupos (p < 0,05) y que el grupo de 12-24 m tuvo el mayor grado de fibrosis (9,80 ± 8,31%), siendo superior incluso al grupo >24 m (8,28 ± 5,23%; p < 0,05). Los valores más bajos en los perros más viejos podrían reflejar mayores depósitos de grasa, que no se detectan por este método, con una fibrosis proporcionalmente menor.
El ANOVA de un factor mostró una diferencia estadísticamente significativa entre los grupos (puntuación f = 7,64, p < 0,001) para el grado de tinción de fibrosis en las secciones de 17 VI y 4 RV de perros con DMGR. La prueba post-hoc de Tukey reveló que las secciones del VD tenían los niveles más altos de fibrosis en comparación con las otras secciones, pero eran similares entre sí (p < 0,001). La sección anterolateral del VI medio tuvo una fibrosis significativamente menor que las otras secciones.
Localización de lesiones dentro de la pared
Estudios previos de GRMD (25) y DMD (4) describen una miocardiopatía difusa con localización subepicárdica a veces prominente de fibrosis y otras lesiones. La localización predominante en cada sección fue principalmente subepicárdica, miocárdica media, subendocárdica o transmural (distribución uniforme a lo largo de la pared miocárdica) (Figura 2). De acuerdo con las observaciones previas, las lesiones degenerativas se concentraron inicialmente en la mitad externa del miocardio (el subepicardio y el miocardio medio o la porción del VD de la pared del tabique). En los perros de mayor edad, más secciones tenían lesiones transmurales, como podría esperarse en una enfermedad progresiva. En general, los cortes basales del VI tenían un mayor grado de lesiones externas (o subepicárdicas), mientras que el VD y las porciones más apicales tenían una distribución más difusa/transmural en general o, como se describió anteriormente, una distribución miocárdica media prominente, particularmente en el VD más apical.
Correlación con la RTG en la resonancia magnética cardíaca
La correlación de los hallazgos histológicos específicos con las imágenes diagnósticas es el objetivo final para realizar un mejor seguimiento de la progresión de la miocardiopatía. La RMC con realce tardío de gadolinio es una modalidad común para la evaluación clínica de la miocardiopatía en la GRMD y la DMD (44). Ocho perros GRMD en este estudio formaron parte de nuestro estudio de historia natural de imágenes cardíacas (38), y siete de ellos tenían suficientes exploraciones de imágenes de LGE dentro de los 7 días anteriores a las colecciones de corazón, lo que permitió una comparación retrospectiva con los resultados patológicos (los datos preliminares de un perro se informaron previamente, incluida una comparación visual representativa de macroscopios, Resonancia magnética e imágenes histológicas) (38). Con el fin de evaluar la correlación entre el LGE y la evaluación patológica dentro de cada sección del corazón en los siete perros, se realizó el análisis de orden de rango de Spearman. Las observaciones sin un par entre los enfoques se eliminaron del análisis. Esta prueba no paramétrica reveló una relación monótona altamente significativa (p < 0,0001) entre estos dos métodos, con un coeficiente de relación moderadamente positivo de 0,44. Las puntuaciones de LGE y patología semicuantitativa para cada sección aumentaron juntas, mostrando una consistencia entre las evaluaciones de imagen y anatomopatológicas. El porcentaje de fibrosis también se comparó con las tres categorías de LGE en las mismas secciones (N = 107) mediante la realización de un ANOVA de un factor. El ANOVA de un factor no produjo resultados estadísticamente significativos (p = 0,493). Si bien hubo un ligero aumento en el porcentaje de fibrosis en la categoría más alta de LGE, es probable que esto se deba a un aumento en los hallazgos dentro de esta categoría en comparación con otros grupos. Con base en este análisis, no existe una correlación clara entre estas variables.
Discusión
La enfermedad miocárdica en la DMD se define clásicamente como una miocardiopatía dilatada con VI más pronunciada vs. Lesiones y cambios funcionales del VD (4-6). Los estudios previos de la miocardiopatía GRMD han estado limitados por el número de perros estudiados o por las secciones anatómicas evaluadas (25, 26). En este trabajo se describen las lesiones macroscópicas e histológicas a lo largo del corazón en una gran cohorte de perros con GRMD de edades comprendidas entre los 3 y los 76 m. Al igual que en los estudios anteriores más limitados, no se observó un aumento general de la relación HW/PC, típicamente asociada con la miocardiopatía hipertrófica. Sin embargo, las relaciones HW/BW de algunos GRMD y perros portadores fueron de 3 a 4 veces más altas que el rango normal (39, 40). Si bien la disminución del peso corporal debido a la atrofia muscular en los perros con DMGR podría contribuir al aumento de la relación HW/PC, hubo poca diferencia en el peso corporal entre los grupos. Por otro lado, el HW aumentó en los perros más viejos y en los perros portadores. Además, el HW no se correlacionó directamente con la edad en los perros adultos. Tomados en conjunto, estos hallazgos sugieren que las proporciones elevadas de HW/BW en corazones afectados y portadores ocurrieron debido a la hipertrofia cardíaca excéntrica como se informó previamente en nuestros perros (38) y se observó en miocardiopatía dilatada canina (45), ratones mdx (46) y en algunos estudios de portadores de DMD (47) y niños con DMD (48, 49).
La fibrosis es el principal cambio patológico en la miocardiopatía por DMD, que ocurre inicialmente en la porción posterobasal de la pared libre del ventrículo izquierdo y se extiende al tercio externo y, finalmente, a todo el ventrículo izquierdo y al tabique (4, 22). El ventrículo derecho puede estar dilatado pero, en general, está libre de fibrosis. Los perros GRMD de este estudio también tenían lesiones pronunciadas en el VI, pero a diferencia de la DMD, el VD también estaba muy afectado, aunque a menudo con más cambios grasos que fibróticos. Las lesiones cardíacas en la DMD son consistentemente más pronunciadas en el subepicardio, con preservación de las fibras musculares más cercanas a la cámara ventricular izquierda. Este también fue el caso en los perros GRMD estudiados aquí, pero no detectamos la concentración posterobasal distintiva observada con las lesiones tempranas de DMD, sino que encontramos cambios más difusos. En particular, la afectación de los músculos papilares y el área posterobasal explica la insuficiencia de la válvula mitral en la DMD (50). Los músculos papilares en los perros con GRMD también se vieron muy afectados, aunque no pudimos relacionar esto con la disfunción de la válvula mitral.
Al igual que en otros estudios (25, 26, 29) que evaluaron cambios histopatológicos específicos, la gravedad de la lesión tendió a aumentar con la edad. A pesar de esta tendencia general, algunos perros de edad avanzada presentaban pocas lesiones, si es que las tenían (Tabla 3), en consonancia con la marcada variación fenotípica observada en la miocardiopatía por DMD (51, 52). Los corazones portadores tenían niveles más bajos de afectación, y los perros normales tenían las puntuaciones más bajas. La falta de asociaciones regionales en nuestro estudio puede deberse a que los perros fueron evaluados en un solo momento en lugar de longitudinalmente. El hecho de que muchos de nuestros perros fueran mayores y tuvieran lesiones en todas las secciones examinadas y que hubiera relativamente pocos perros en el grupo de rango de edad potencialmente crítico de 12 a 24 m también puede haber impedido la detección de diferencias regionales en el desarrollo de lesiones. Dicho esto, nuestro estudio tuvo una clara ventaja en el sentido de que se incluyeron corazones de perros de muchas edades y etapas de progresión de la enfermedad, mientras que en la DMD, la biopsia cardíaca de rutina no se realiza comúnmente, y las autopsias también son poco comunes, lo que puede causar que se pasen por alto las lesiones fuera de la fibrosis crónica.
Al cuantificar la fibrosis mediante la tinción tricrómica en perros adultos (>6 m), los que estaban a 6-12 m tenían significativamente menos fibrosis que cualquiera de los dos grupos de mayor edad. Inesperadamente, los perros >24 m tenían menos tinción cuantitativa de colágeno que los de 12 a 24 m, a pesar de que la mitad de estos perros más jóvenes tenían lesiones relativamente leves. El porcentaje proporcionalmente menor de tinción de colágeno puede haber ocurrido porque las lesiones, como la infiltración grasa, la fibrosis no compacta y la mineralización, no se tiñen con los métodos utilizados, y la grasa, en particular, aumentó en los perros más viejos. Es importante destacar que esto demuestra que los métodos dirigidos únicamente a la detección de la fibrosis pueden subestimar la gravedad fenotípica en perros mayores con GRMD. La puntuación semicuantitativa del área total de la lesión transversal y los porcentajes de secciones que mostraban varias lesiones demostraron más claramente una fuerte correlación con la edad y la progresión de la enfermedad. Esta puntuación también puso de manifiesto la gran variación fenotípica de las lesiones cardíacas en los perros con DMGR, similar a la variación de la enfermedad del músculo esquelético (2). En particular, un varón de 17 m de edad no presentaba lesiones cardíacas. En este caso, todas las tareas de puntuación semicuantitativa fueron realizadas por un solo patólogo. Es probable que este método tenga una mayor variabilidad entre operadores, lo que lo hace poco confiable para comparar los resultados entre estudios sin un acuerdo más sólido sobre la puntuación. Tener varios intérpretes para cada diapositiva con una puntuación de consenso probablemente mejoraría la reproducibilidad de los resultados.
Incluso más que la fibrosis, la infiltración grasa fue una característica de la progresión de la miocardiopatía en perros mayores con GRMD. Si bien se puede observar cierta infiltración de grasa con el envejecimiento normal, este cambio fue particularmente pronunciado en los perros GRMD, como se observa con otras miocardiopatías caninas crónicas (45, 53-56). La metaplasia lipomatosa (grasa) también se observa con afecciones degenerativas crónicas en el corazón de perros y humanos, con mayor frecuencia con miocardiopatía isquémica crónica y reemplazo de cicatrices isquémicas (57, 58), con una mayor propensión asociada a taquicardia ventricular y arritmias (53, 59). Aunque no podemos descartar una respuesta específica a la deficiencia de distrofina, la aparición de un cambio graso similar en una variedad de enfermedades sugiere que se trata de una reacción general a la degeneración y remodelación miocárdica crónica.
Curiosamente, se observó necrosis coagulativa en algunos perros con GRMD en ausencia de trombosis vascular. La severidad de estos cambios se correlacionó con el grado de engrosamiento vascular. Dado que el suministro vascular coronario a los ventrículos difiere entre el perro y el hombre (60), es difícil hacer inferencias con respecto a la patogénesis de la enfermedad cardíaca con DMD. Sin embargo, hemos visto previamente un síndrome de infarto agudo de miocardio en perros con DMG (61) que parece análogo a una afección en DMD (62). Esto ha llevado a especular que los cardiomiocitos deficientes en distrofina están operando en un estado de hipoxia funcional (61, 63, 64) y que un músculo deficiente en distrofina tiene una capacidad reducida para compensar el aumento de las demandas metabólicas (65, 66). La necrosis coagulativa se asocia con anoxia/hipoxia, que a menudo ocurre después de la isquemia, el infarto o la toxicosis. Las lesiones se detectan histológicamente a las ~12-24 h después del evento, se infiltran en láminas de macrófagos dentro de las 48-72 h y contienen focos de proliferación vascular y de células intersticiales entre 10 días y 6 semanas (41, 42). Encontramos cada una de estas lesiones en todos los grupos de edad de GRMD mayores de 6 m, de acuerdo con el rango completo de necrosis cardíaca y cicatrización descrito por Malvestio et al. (29). Teniendo en cuenta que la trombosis vascular no es una característica de la DMD/GRMD, es más probable que estos cambios ocurran como consecuencia de la hipoxia no oclusiva. Extendiendo la importancia potencial de la enfermedad vascular/hipóxica en la miocardiopatía GRMD, también encontramos una correlación positiva entre la hipertrofia arteriolar y las puntuaciones semicuantitativas de lesiones transversales más graves. Los ratones mdx deficientes en distrofina también tienen una mayor formación de neointimal, con engrosamiento de la pared y lúmenes estrechos debido a la proliferación del músculo liso vascular (67). En principio, estos cambios podrían ocurrir debido a lesiones degenerativas crónicas en el músculo liso deficiente en distrofina y podrían ser un factor en el síndrome miocárdico agudo que se observa en la DMD/GRMD. Si bien el aumento del grosor de la pared y el tejido conectivo son un cambio de envejecimiento reportado en las arteriolas cardíacas de los perros senescentes (68), los perros normales en este estudio tenían significativamente menos hipertrofia de músculo liso que los perros GRMD, lo que indica que este cambio es parte de la progresión de la enfermedad.
Se ha demostrado que la deficiencia de distrofina en el músculo liso vascular tanto en ratones mdx como en perros GRMD tiene consecuencias funcionales, incluida la alteración de la vasoregulación simpática y la reducción de la atenuación de la vasoconstricción durante la contracción (67, 69-72). Esto se debe en parte a la pérdida de nNOS sarcolemal en el músculo esquelético y cardíaco, lo que conduce a una disminución de la vasodilatación inducida por el óxido nítrico. Sin embargo, la expresión selectiva de distrofina en el músculo liso vascular rectificó parcialmente las respuestas vasorreguladoras (72) en ratones mdx, lo que sugiere que la distrofina del músculo liso puede tener un papel funcional primario en la vasorregulación. En combinación con los tipos de degeneración observados en los corazones de los perros GRMD de nuestro estudio, estos cambios vasculares podrían apoyar la hipótesis de los «dos golpes» para las lesiones en la deficiencia de distrofina (73), con isquemia funcional relacionada con una vasoregulación alterada combinada con una mayor susceptibilidad al estrés metabólico que conduce a una supervivencia alterada de los cardiomiocitos.
Las anomalías estereotipadas del ECG son comunes en los pacientes con DMD y GRMD. Los cambios degenerativos descritos en las fibras de Purkinje de los niños afectados (43) y de los perros (27) se han propuesto como un posible factor contribuyente. Urasawa et al. (27) describieron una marcada vacuolación anormal en las fibras de Purkinje asociada con cambios degenerativos ultraestructurales en beagles jóvenes cruzados con la mutación GRMD (CXMDJ). También detectamos un aumento de la vacuolización de la fibra de Purkinje, comenzando con los perros más jóvenes con GRMD, aunque esta lesión no estaba presente en todos los perros con GRMD, y los perros normales también tenían vacuolización de la fibra de Purkinje. Curiosamente, los perros portadores de este estudio no tenían vacuolización de la fibra de Purkinje, a pesar de que también tienen anomalías en la conducción (35). Además, el grado de vacuolación no se correlacionó con la gravedad de la lesión transversal en nuestros perros. Debido a la naturaleza retrospectiva de este estudio, no se dispuso de ECG para correlacionar la gravedad vacuolar con las diferencias de conducción o arritmia.
El patrón de cambios en la RMC en los pacientes con DMD tiende a ser paralelo a la distribución de los cambios histopatológicos, comenzando en la pared basal y subepicárdica posterior del VI (44). A pesar de que la calidad de las imágenes de la LGE fue insuficiente para localizar las lesiones en la región subepicárdica, los resultados anatomopatológicos fueron consistentes con los hallazgos de la LGE. Además, las evaluaciones semicuantitativas de la puntuación histopatológica de la lesión y la gravedad de la RTG se correlacionaron fuertemente, lo que valida aún más la asociación entre nuestros hallazgos patológicos y de RMC. Por el contrario, el porcentaje cuantitativo de fibrosis no se correlacionó con la LGE. Al igual que con los cambios en las fibras de Purkinje, no tuvimos la oportunidad de determinar si había una asociación entre los hallazgos del ECG, como la aparición de ondas Q profundas, con la fibrosis septal. Esto requeriría un estudio prospectivo longitudinal detallado.
Si bien los datos reportados aquí ampliaron sustancialmente los estudios patológicos previos de la miocardiopatía GRMD, las limitaciones incluyeron la incapacidad de emparejar perfectamente la edad de los perros en todos los grupos de enfermedades, el bajo número de perros portadores, la variación en la gravedad fenotípica y la necesidad de usar corazones de control normales de perros fuera de la colonia. La disponibilidad cardíaca y la edad en todos los grupos de enfermedades se vieron limitadas por la disponibilidad de perros que murieron por otras razones. Dado que los perros portadores y normales son sacrificados con poca frecuencia a edades tempranas, estos grupos, en particular, carecían de controles exactos de la misma edad. Aquí, evaluamos una cohorte separada de perros sabuesos fuera de nuestra colonia. Aunque se esperarían diferencias mínimas entre los corazones de los perros normales dentro y fuera de la colonia, el alojamiento y el manejo variables podrían haber alterado el fenotipo cardíaco, por ejemplo, se excluyeron dos perros debido a la enfermedad de Chagas confirmada por PCR, lo que sugiere que todos los perros normales pueden haber estado expuestos a infecciones no presentes en nuestra colonia. Eso también puede explicar la inflamación linfoplasmocítica inesperada en algunos corazones de este grupo.
Al igual que en estudios anteriores, la patología cardíaca fue limitada o ausente en nuestros perros con GRMD <6 m, y tampoco se esperarían cambios en perros normales, por lo que la incapacidad de comparar directamente probablemente tuvo un impacto mínimo. Los perros portadores que no se utilizan para la cría son adoptados rutinariamente fuera de la colonia, lo que limita nuestro acceso al tejido de este grupo. Los números más bajos dificultaron nuestra capacidad para detectar la significación entre este grupo de enfermedades y el GRMD y los perros normales; Sin embargo, las tendencias son intrigantes y se justifican más estudios.
Las conclusiones extraídas de los estudios no longitudinales también están siempre limitadas por la variación fenotípica en la expresión de la enfermedad entre los perros. En nuestra cohorte, tuvimos un número bajo de perros y un alto grado de variación fenotípica en el rango de edad aparentemente crítico de 6 a 12 m, mientras que el grupo de 12 a 24 m parecía tener una gravedad general más leve, incluido un perro sin lesiones. Esto probablemente confundió las diferencias entre los grupos de edad. La enfermedad leve o no detectable en perros de esta edad que no habían recibido ningún tratamiento específico para el corazón pone de manifiesto la importancia de no depender de un solo animal para determinar los efectos del tratamiento.
Este estudio proporciona la mayor revisión patológica e histopatológica macroscópica de la miocardiopatía GRMD hasta la fecha. Nuestros hallazgos resaltan las diferencias en la gravedad de la enfermedad y sugieren que la puntuación semicuantitativa es preferible a la cuantificación de la fibrosis para evaluar la gravedad general de la lesión. La enfermedad es universalmente progresiva, pero debido a la dificultad de detectar lesiones pre-mortem tempranas, todavía existe debate sobre la secuencia de progresión de la lesión cardíaca en la DMG y, por extensión, en la DMD. Con base en los hallazgos publicados anteriormente y los resultados reportados aquí, sugerimos que dos factores interactúan entre sí. Las deficiencias metabólicas subyacentes en el músculo cardíaco, como la desregulación del calcio, la fragilidad de la membrana, la mala respuesta a la hipoxia y las anomalías mitocondriales, colocan a las fibras bajo una tensión metabólica constante. Con el tiempo, esto puede conducir a la necrosis de fibras individuales, mineralización y abandono, con transición grasa en algunas fibras, particularmente en áreas de tensión (es decir, pared basoinferior del VI). Además, el estrés episódico ante los cambios vasculares que hemos descrito podría producir infarto no trombótico y pérdida de focos mayores de miocardio compatibles con grandes lesiones agudas/subagudas en algunos perros. Los episodios secuenciales de daño pueden dar lugar a un ciclo escalonado de daño, reparación y estabilización, con aumento de la tensión, metaplasia grasa y disminución de la reserva con el tiempo.
Declaración de disponibilidad de datos
Los datos brutos que respaldan las conclusiones de este artículo serán puestos a disposición por los autores, sin reservas indebidas.
Declaración de Ética
El estudio en animales fue revisado y aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Texas A&M.
Contribuciones de los autores
SS, JK, BW y L-JG contribuyeron a la concepción y diseño del estudio, incluyendo protocolos de recolección de muestras. El SS y el peso corporal contribuyeron a la interpretación de los cambios histológicos. SS desarrolló las categorías de interpretación, recogió los corazones y las muestras, escribió el primer borrador y las principales revisiones del artículo, y escaneó y leyó las diapositivas. SF desarrolló la macro Image J. SF y SS recogieron los datos de la imagen J. L-JG realizó las imágenes de RMC, la recopilación de datos de LGE y la interpretación. GS realizó el análisis estadístico. SS, JK, GS y L-JG escribieron secciones del documento. Todos los autores contribuyeron a la revisión del manuscrito y leyeron y aprobaron la versión enviada.
Financiación
Este trabajo fue parte de la tesis doctoral de SS, apoyada por una beca de la Fundación Zoetis-Morris Animal (subvención número D14CA-903). El escaneo digital de portaobjetos contó con el apoyo del generoso equipo compartido por el GI Lab de la Universidad de Texas A&M. Amanda Bettis y Heather Heath-Barnett se encargaron del cuidado dedicado de los perros y del mantenimiento de la colonia.
Conflicto de intereses
JK reporta honorarios personales de Solid Biosciences como consultor remunerado, fuera del trabajo presentado.
El resto de los autores declaran que la investigación se llevó a cabo en ausencia de relaciones comerciales o financieras que pudieran interpretarse como un potencial conflicto de intereses.
Nota del editor
Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo, o afirmación que pueda ser hecha por su fabricante, no está garantizado ni respaldado por el editor.
Material complementario
El material complementario para este artículo se puede encontrar en línea en: https://www.frontiersin.org/articles/10.3389/fvets.2021.759585/full#supplementary-material
Referencias
1. Valentine BA, Winand NJ, Pradhan D, Moise NS, de Lahunta A, Kornegay JN, et al. Distrofia muscular ligada al cromosoma X canina como modelo animal de distrofia muscular de Duchenne: una revisión. Am J Mol Genet. (1992) 42:352–6. doi: 10.1002/ajmg.1320420320
Resumen de PubMed | Texto completo de CrossRef | Google Académico
2. Kornegay JN, Bogan JR, Bogan DJ, Childers MK, Li J, Nghiem P, et al. Modelos caninos de distrofia muscular de Duchenne y su uso en estrategias terapéuticas. Genoma de Mamm. (2012) 23:85–108. doi: 10.1007/s00335-011-9382-y
Resumen de PubMed | Texto completo de CrossRef | Google Académico
3. Hoffman EP, Brown RH, Kunkel LM. Distrofina: producto proteico del locus de la distrofia muscular de Duchenne. Celda. (1987) 51:919–28. doi: 10.1016/0092-8674(87)90579-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
4. Frankel K, Rosser R. La patología del corazón en la distrofia muscular progresiva: la fibrosis epimiocárdica. Hum Pathol. (1976) 7:375–86. doi: 10.1016/S0046-8177(76)80053-6
Resumen de PubMed | Texto completo de CrossRef | Google Académico
5. Heymsfield SB, McNish T, Perkins JV, Felner JM. Secuencia de cambios cardíacos en la distrofia muscular de Duchenne. Am Corazón J. (1978) 95:283–94. doi: 10.1016/0002-8703(78)90358-7
Resumen de PubMed | Texto completo de CrossRef | Google Académico
6. Spurney CF. Miocardiopatía de la distrofia muscular de Duchenne: comprensión actual y direcciones futuras. Nervio muscular. (2011) 44:8–19. doi: 10.1002/mus.22097
Resumen de PubMed | Texto completo de CrossRef | Google Académico
7. Prosser BL, Ward CW, Lederer WJ. Señalización X-ROS: transducción rápida de mecanoquimio en el corazón. Ciencia. (2011) 333:1440–5. doi: 10.1126/science.1202768
Resumen de PubMed | Texto completo de CrossRef | Google Académico
8. Viola HM, Adams AM, Davies SM, Fletcher S, Filipovska A, Hool LC. La comunicación funcional alterada entre el canal de calcio tipo L y las mitocondrias contribuye a la inhibición metabólica en el corazón mdx. Proc Natl Acad Sci. (2014) 111:E2905–14. doi: 10.1073/pnas.1402544111
Resumen de PubMed | Texto completo de CrossRef | Google Académico
9. Fanchaouy M, Polakova E, Jung C, Ogrodnik J, Shirokova N, Niggli E. Vías de afluencia anormal de Ca2+ inducida por el estrés en cardiomiocitos mdx distróficos. Calcio celular. (2009) 46:114–21. doi: 10.1016/j.ceca.2009.06.002
Resumen de PubMed | Texto completo de CrossRef | Google Académico
10. Markham LW, Brinkmeyer-Langford CL, Soslow JH, Gupte M, Sawyer DB, Kornegay JN, et al. Los perfiles genéticos del metabolismo cardíaco y del músculo esquelético GRMD son distintos. BMC Med Genom. (2017) 10:21. doi: 10.1186/s12920-017-0257-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
11. Klietsch R, Ervasti JM, Arnold W, Campbell KP, Jorgensen AO. El complejo distrofina-glicoproteína y la laminina se colocalizan en el sarcolema y los túbulos transversos del músculo cardíaco. Circ Res. (1993) 72:349–60. doi: 10.1161/01.RES.72.2.349
Resumen de PubMed | Texto completo de CrossRef | Google Académico
12. Iwata Y, Pan Y, Hanada H, Yoshida T, Shigekawa M. Complejo de distrofina-glicoproteína purificado del músculo cardíaco del hámster. Comparación de los complejos de los músculos cardíacos y esqueléticos de hámster y conejo. J Mol Cell Cardiol. (1996) 28:2501–9. doi: 10.1006/jmcc.1996.9999
Resumen de PubMed | Texto completo de CrossRef | Google Académico
13. Holland A, Ohlendieck K. Perfil proteómico de la fenocopia mdx deficiente en distrofina de la miocardiopatía asociada a la distrofinopatía. BioMed Res Int. (2014) 2014:1–15. doi: 10.1155/2014/246195
Resumen de PubMed | Texto completo de CrossRef | Google Académico
14. Birnkrant DJ, Ashwath M, Noritz GH, Merrill MC, Shah TA, Crowe CA, et al. Variabilidad de la función cardíaca y pulmonar en la distrofia muscular de Duchenne/Becker: un informe inicial. J Neurol Infantil. (2010) 25:1110–5. doi: 10.1177/0883073810371003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
15. Jin JB, Carter JC, Sheehan DW, Birnkrant DJ. La discordancia fenotípica cardiopulmonar es común en la distrofia muscular de Duchenne. Pediatr Pulmonol. (2019) 54:186–93. doi: 10.1002/ppul.24205
Resumen de PubMed | Texto completo de CrossRef | Google Académico
16. Posner AD, Soslow JH, Burnette WB, Bian A, Shintani A, Sawyer DB, et al. La correlación de la disfunción muscular esquelética y cardíaca en la distrofia muscular de Duchenne. J Neuromusc Dis. (2016) 3:91–9. doi: 10.3233/JND-150132
Resumen de PubMed | Texto completo de CrossRef | Google Académico
17. Hor KN, Mah ML, Johnston P, Cripe TP, Cripe LH. Avances en el diagnóstico y manejo de la miocardiopatía en la distrofia muscular de Duchenne. Neuromusc Disord. (2018) 28:711–6. doi: 10.1016/j.nmd.2018.06.014
Resumen de PubMed | Texto completo de CrossRef | Google Académico
18. Birnkrant DJ, Bushby K, Bann CM, Alman BA, Apkon SD, Blackwell A, et al. Diagnóstico y tratamiento de la distrofia muscular de Duchenne, parte 2: tratamiento respiratorio, cardíaco, de salud ósea y ortopédico. Lancet Neurol. (2018) 17:347–61. doi: 10.1016/S1474-4422(18)30025-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
19. Fayssoil A, Nardi O, Orlikowski D, Annane D. Miocardiopatía en la distrofia muscular de Duchenne: patogénesis y terapéutica. Heart Fail Rev. (2010) 15:103–7. doi: 10.1007/s10741-009-9156-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
20. Bostick B, Yue Y, Long C, Marschalk N, Fine DM, Chen J, et al. La expresión cardíaca de una mini-distrofina que normaliza la fuerza del músculo esquelético solo restaura parcialmente la función cardíaca en ratones mdx envejecidos. Mol Ther. (2009) 17:253–61. DOI: 10.1038/mt.2008.264
Resumen de PubMed | Texto completo de CrossRef | Google Académico
21. Łoboda A, Dulak J. Estrategias terapéuticas musculares y cardíacas para la distrofia muscular de Duchenne: pasado, presente y futuro. Informes de farmacia. (2020) 72:1227–63. doi: 10.1007/s43440-020-00134-x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
22. Perloff JK, Roberts WC, de Leon AC, O’Doherty D. Electrocardiograma distintivo de la distrofia muscular progresiva de Duchenne. Am J Med. (1967) 42:179–88. doi: 10.1016/0002-9343(67)90017-4
Resumen de PubMed | Texto completo de CrossRef | Google Académico
23. Moise SN, Valentine BA, Brown CA, Erb HN, Beck KA, Cooper BJ, et al. Miocardiopatía de Duchenne en un modelo canino: estudios electrocardiográficos y ecocardiográficos. J Am Coll Cardiol. (1991) 17:812–20. doi: 10.1016/S0735-1097(10)80202-5
Resumen de PubMed | Texto completo de CrossRef | Google Académico
24. James J, Kinnett K, Wang Y, Ittenbach RF, Benson WD, Cripe L. Las anomalías electrocardiográficas en pacientes muy jóvenes con distrofia muscular de Duchenne preceden a la aparición de la disfunción cardíaca. Neuromuscul Disord. (2011) 21:462–7. doi: 10.1016/j.nmd.2011.04.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
25. Valentine BA, Cummings JF, Cooper BJ. Desarrollo de la miocardiopatía tipo duchenne: estudios morfológicos en un modelo canino. Am J Pathol. (1989) 135:671–8.
26. Yugeta N, Urasawa N, Fujii Y, Yoshimura M, Yuasa K, Wada MR, et al. Afectación cardíaca en la distrofia muscular ligada al cromosoma X canina basada en Beagle en Japón (CXMDJ): estudios electrocardiográficos, ecocardiográficos y morfológicos. BMC Cardiovascul Disord. (2006) 6:1–13. doi: 10.1186/1471-2261-6-47
Resumen de PubMed | Texto completo de CrossRef | Google Académico
27. Urasawa N, Wada MR, Machida N, Yuasa K, Shimatsu Y, Wakao Y, et al. Degeneración vacuolar selectiva en fibras de Purkinje caninas deficientes en distrofina a pesar de la preservación de proteínas asociadas a la distrofina con sobreexpresión de Dp71. Circulación. (2008) 117:2437–48. doi: 10.1161/CIRCULATIONAHA.107.739326
Resumen de PubMed | Texto completo de CrossRef | Google Académico
28. Miyazato LG, Beretta DC, Engracia Filho JR, Moraes FR, Moraes JR. Implicación de los sistemas orgánicos en la distrofia muscular ligada al cromosoma X del golden retriever. Braz J Vet Pathol. (2011) 4:87–94. Disponible en línea en: http://lareferencia.redclara.net/vufind/Record/BR_625bbab58155f201733038b302714389
29. Malvestio L, Martins I, Moares F, Moares JRE. Evolución histopatológica de la miocardiopatía en un modelo canino de distrofia muscular de Duchenne. J Adv Vet Res. (2015) 5:121–6. Disponible en línea en: http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.933.1085&rep=rep1&type=pdf
30. Nigro G, Somma S, Comi L, Politano L, Papparella S, Restucci B, et al. Bases estructurales de la miocardiopatía en portadores de Duchenne/Becker. Ann NY Acad Sci. (1995) 752:108–10. doi: 10.1111/j.1749-6632.1995.tb17412.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
31. van Westrum S, Hoogerwaard E, Neurología DL. Anomalías cardíacas en un estudio de seguimiento en portadores de distrofia muscular de Duchenne y Becker. Neurol. (2011) 77:62-6. doi: 10.1212/WNL.0b013e318221ad14
Resumen de PubMed | Texto completo de CrossRef | Google Académico
32. Holloway S, Wilcox D, Wilcox A, Dean J, Berg J, Goudie D, et al. Esperanza de vida y muerte por miocardiopatía entre los portadores de distrofia muscular de Duchenne y Becker en Escocia. Corazón. (2008) 94:633–6. doi: 10.1136/hrt.2007.125948
Resumen de PubMed | Texto completo de CrossRef | Google Académico
33. Hoogerwaard EM, Wouw PA, Wilde AAM, Bakker E, Ippel PF, Oosterwijk JC, et al. Afectación cardíaca en portadores de distrofia muscular de Duchenne y Becker. Neuromusc Disord. (1999) 9:347–51. doi: 10.1016/S0960-8966(99)00018-8
Resumen de PubMed | Texto completo de CrossRef | Google Académico
34. Cooper BJ, Gallagher EA, Smith CA, Valentine BA, Winand NJ. Expresión en mosaico de distrofina en portadores de distrofia muscular ligada al cromosoma X canina. Laboratorio de Investigación. (1990) 62:171–8.
35. Kane AM, DeFrancesco TC, Boyle MC, Malarkey DE, Ritchey JW, Atkins CE, et al. Estructura y función cardíaca en mujeres portadoras de un modelo canino de distrofia muscular de Duchenne. Res Vet Sci. (2013) 94:610–7. doi: 10.1016/j.rvsc.2012.09.027
Resumen de PubMed | Texto completo de CrossRef | Google Académico
36. Cerqueira MD, Weissman NJ, Dilsizian V, Jacobs AK, Kaul S, Laskey WK, et al. Segmentación miocárdica estandarizada y nomenclatura para imágenes tomográficas del corazón. J Cardiovasc Magn Reson. (2002) 4:203–10. doi: 10.1081/JCMR-120003946
37. Paladar BM, Denoël SR, Roba JL. Un método simple para realizar un examen histopatológico de rutina del tejido de conducción cardíaca en el perro. Toxicol Pathol. (1995) 23:56–62. doi: 10.1177/019262339502300107
Resumen de PubMed | Texto completo de CrossRef | Google Académico
38. Guo L-J, Soslow JH, Bettis AK, Nghiem PP, Cummings KJ, Lenox MW, et al. Historia natural de la miocardiopatía en perros adultos con distrofia muscular golden retriever. J Am Heart Assoc. (2019) 8:e012443. doi: 10.1161/JAHA.119.012443
Resumen de PubMed | Texto completo de CrossRef | Google Académico
39. Northup DW, Liere EJ, van Stickney JC. El efecto de la edad, el sexo y el tamaño corporal en la relación peso-peso corporal del corazón en el perro. Anat Rec. (1957) 128:411–7. doi: 10.1002/ar.1091280305
Resumen de PubMed | Texto completo de CrossRef | Google Académico
40. Bienvenu JG, Drolet R. Estudio cuantitativo de la masa ventricular cardíaca en perros. Can J Vet Res. (1991) 55:305–9.
41. Dewald O, Ren G, Duerr GD, Zoerlein M, Klemm C, Gersch C, et al. De ratones y perros: diferencias específicas de la especie en la respuesta inflamatoria tras el infarto de miocardio. Am J Pathol. (2004) 164:665–77. doi: 10.1016/S0002-9440(10)63154-9
Resumen de PubMed | Texto completo de CrossRef | Google Académico
42. Grant Maxie M, Robinson WF. Sistema Cardiovascular. En: Jubb, Kennedy & Palmer’s Pathology of Domestic Animals (Patología de los animales domésticos de Jubb, Kennedy y Palmer). 5ª ed.
43. Nomura H, Hizawa K. Estudio histopatológico del sistema de conducción del corazón en la distrofia muscular progresiva de Duchene. Pathol Int. (1982) 32:1027–33. doi: 10.1111/j.1440-1827.1982.tb02082.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
44. Bilchick KC, Salerno M, Plitt D, Dori Y, Crawford TO, Drachman D, et al. Prevalencia y distribución de la cicatriz regional en segmentos miocárdicos disfuncionales en la distrofia muscular de Duchenne. J Cardiovasc Magn Reson. (2011) 13:1–8. doi: 10.1186/1532-429X-13-20
Resumen de PubMed | Texto completo de CrossRef | Google Académico
45. Tidholm A, Jönsson L. Caracterización histológica de la miocardiopatía dilatada canina. Veterinario Pathol. (2005) 42:1–8. doi: 10.1354/vp.42-1-1
Resumen de PubMed | Texto completo de CrossRef | Google Académico
46. Wagner S, Knipp S, Weber C, Hein S, Schinkel S, Walther A, et al. El corazón en la distrofia muscular de Duchenne: detección precoz de la alteración del rendimiento contráctil. J Cell Mol Med. (2012) 16:3028–36. doi: 10.1111/j.1582-4934.2012.01630.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
47. Politano L, Nigro V, Nigro G, Jama PV. Desarrollo de miocardiopatía en mujeres portadoras de distrofias musculares de Duchenne y Becker. JAMA. (1996) 275:1335–8. doi: 10.1001/jama.1996.03530410049032
Resumen de PubMed | Texto completo de CrossRef | Google Académico
48. Nigro G, Comi LI, Politano L, Bain RJI. Incidencia y evolución de la miocardiopatía en la distrofia muscular de Duchenne. Int J Cardiol. (1990) 26:271–7. doi: 10.1016/0167-5273(90)90082-G
Resumen de PubMed | Texto completo de CrossRef | Google Académico
49. Bornaun H, Muhtar Yilmazer M, Dedeoglu S, Dedeoglu R. Análisis ecocardiográfico exhaustivo de la estructura y funciones del ventrículo izquierdo en niños con distrofia muscular de Duchenne. Irán J Pediatr. (2018) 28:e62204. doi: 10.5812/ijp.62204
50. Sanyal SK, Johnson WW, Dische MR, Pitner SE, Beard C. Degeneración distrófica del músculo papilar y del miocardio ventricular. Una base para el prolapso de la válvula mitral en la distrofia muscular de Duchenne. Circulación. (1980) 62:430–8. doi: 10.1161/01.cir.62.2.430
Resumen de PubMed | Texto completo de CrossRef | Google Académico
51. Desguerre I, Christov C, Mayer M, Zeller R, Becane H-M, Bastuji-Garin S, et al. Heterogeneidad clínica de la Distrofia Muscular de Duchenne (DMD): definición de subfenotipos y criterios predictivos mediante seguimiento a largo plazo. PLoS UNO. (2009) 4:e4347. doi: 10.1371/journal.pone.0004347
Resumen de PubMed | Texto completo de CrossRef | Google Académico
52. Pettygrove S, Lu Z, Andrews JG, Meaney FJ, Sheehan DW, Price ET, et al. Concordancia entre hermanos para las características clínicas de las distrofias musculares de Duchenne y Becker. Nervio muscular. (2014) 49:814–21. doi: 10.1002/mus.24078
Resumen de PubMed | Texto completo de CrossRef | Google Académico
53. Meurs KM. Miocardiopatía del perro bóxer: una actualización. Vet Clin N Am Small Anim Pract. (2004) 34:1235–44. doi: 10.1016/j.cvsm.2004.05.003
Resumen de PubMed | Texto completo de CrossRef | Google Académico
54. Lobo L, Carvalheira J, Canada N, Bussadori C, Gomes J, Faustino A. Caracterización histológica de la miocardiopatía dilatada en perros de montaña de Estrela. Veterinario Pathol. (2010) 47:637–42. doi: 10.1177/0300985810364511
Resumen de PubMed | Texto completo de CrossRef | Google Académico
55. Agudelo C, Svoboda M, Husnik R, Dvir S. Lipomatosis cardíaca en animales domésticos: una revisión. Veterinario Med. (2013) 58:252–9. doi: 10.17221/6806-VETMED
56. Everett RM, McGann J, Wimberly HC, Althoff J. Miocardiopatía dilatada de Doberman Pinschers: evaluación histomorfológica retrospectiva del corazón de 32 casos. Veterinario Pathol. (1999) 36:221–7. doi: 10.1354/vp.36-3-221
Resumen de PubMed | Texto completo de CrossRef | Google Académico
57. Nucifora G, Aquaro GD, Masci PG, Barison A, Todiere G, Pingitore A, et al. Metaplasia lipomatosa en la miocardiopatía isquémica: conocimiento actual y perspectiva clínica. Int J Cardiol. (2011) 146:120–2. doi: 10.1016/j.ijcard.2010.09.090
Resumen de PubMed | Texto completo de CrossRef | Google Académico
58. Baroldi G, Silver MD, De RM, Parodi O, Pellegrini A. Metaplasia lipomatosa en cicatriz ventricular izquierda. Can J Cardiol. (1997) 13:65–71.
59. Samanta R, Pouliopoulos J, Thiagalingam A, Kovoor P. Papel del tejido adiposo en la patogénesis de las arritmias cardíacas. Ritmo cardíaco. (2016) 13:311–20. doi: 10.1016/j.hrthm.2015.08.016
Resumen de PubMed | Texto completo de CrossRef | Google Académico
60. Kato T, Yasue T, Shoji Y, Shimabukuro S, Ito Y, Goto S, et al. Diferencia angiográfica en la arteria coronaria de hombre, perro, cerdo y mono. Ruta Interntl. (1987) 37:361–73. doi: 10.1111/j.1440-1827.1987.tb00371.x
Resumen de PubMed | Texto completo de CrossRef | Google Académico
61. Schneider S, Coleman A, Guo L-J, Tou S, Keene BW, Kornegay JN. Sospecha de infarto agudo de miocardio en un perro con deficiencia de distrofina. Neuromusc Disord. (2016) 26:361–6. doi: 10.1016/j.nmd.2016.02.005
Resumen de PubMed | Texto completo de CrossRef | Google Académico
62. Hor KN, Johnston P, Kinnett K, Mah ML, Stiver C, Markham L, et al. Progresión de la miocardiopatía de Duchenne que se presenta con dolor torácico y elevación de troponina. J Neuromuscul Dis. (2017) 4:307–14. doi: 10.3233/JND-170253
Resumen de PubMed | Texto completo de CrossRef | Google Académico
63. Sander M, Chavoshan B, Harris SA, Iannaccone ST, Stull JT, Thomas GD, et al. Isquemia muscular funcional en músculo esquelético neuronal deficiente en óxido nítrico sintasa de niños con distrofia muscular de Duchenne. Proc Natl Acad Sci. (2000) 97:13818–23. doi: 10.1073/pnas.250379497
Resumen de PubMed | Texto completo de CrossRef | Google Académico
64. Rando TA. El estrés oxidativo y la patogenia de las distrofias musculares. Am J Phys Med Rehab. (2002) 81:S175. doi: 10.1097/00002060-200211001-00018
Resumen de PubMed | Texto completo de CrossRef | Google Académico
65. Nghiem PP, Bello L, Stoughton WB, López SM, Vidal AH, Hernandez BV, et al. Los cambios en el metabolismo muscular se asocian con la variación fenotípica en la distrofia muscular del golden retriever. Yale J Biol Med. (2017) 90:351–60.
66. Schneider SM, Sridhar V, Bettis AK, Heath-Barnett H, Balog-Alvarez CJ, Guo L-J, et al. Metabolismo de la glucosa como biomarcador preclínico para el modelo golden retriever de distrofia muscular de Duchenne. Mol Imaging Biol. (2018) 20:780–8. doi: 10.1007/s11307-018-1174-2
Resumen de PubMed | Texto completo de CrossRef | Google Académico
67. Rauch U, Shami A, Zhang F, Carmignac V, Durbeej M, Hultgårdh-Nilsson A. Aumento del engrosamiento neointimal en ratones mdx deficientes en distrofina. PLoS UNO. (2012) 7:E29904. doi: 10.1371/journal.pone.0029904
Resumen de PubMed | Texto completo de CrossRef | Google Académico
68. Tomanek RJ, Aydelotte MR, Torry RJ. Remodelación de vasos coronarios durante la crianza en beagles de raza pura. Circ Res. (1991) 69:1068–74. doi: 10.1161/01.RES.69.4.1068
Resumen de PubMed | Texto completo de CrossRef | Google Académico
69. Kodippili K, Hakim CH, Yang HT, Pan X, Yang NN, Laughlin MH, et al. La atenuación dependiente del óxido nítrico de la vasoconstricción inducida por la noradrenalina se ve afectada en el modelo canino de distrofia muscular de Duchenne. J Physiol. (2018) 596:5199–216. doi: 10.1113/JP275672
Resumen de PubMed | Texto completo de CrossRef | Google Académico
70. Harricane M-C, Fabbrizio E, Lees D, Prades C, Travo P, Mornet D. La distrofina no influye en la arquitectura citoesquelética regular, pero es necesaria para el rendimiento contráctil en las células aórticas del músculo liso. Cell Biol Interntl. (1994) 18:947–58. doi: 10.1006/cbir.1994.1015
Resumen de PubMed | Texto completo de CrossRef | Google Académico
71. Dye WW, Gleason RL, Wilson E, Humphrey JD. Propiedades biomecánicas alteradas de las arterias carótidas en dos modelos murinos de distrofia muscular. J Appl Physiol. (2007) 103:664–72. doi: 10.1152/japplphysiol.00118.2007
Resumen de PubMed | Texto completo de CrossRef | Google Académico
72. Ito K, Kimura S, Ozasa S, Matsukura M, Ikezawa M, Yoshioka K, et al. La expresión de distrofina específica del músculo liso mejora la vasoregulación aberrante en ratones mdx. Hum Mol Genet. (2006) 15:2266–75. doi: 10.1093/hmg/ddl151
Resumen de PubMed | Texto completo de CrossRef | Google Académico
73. Rando TA. Papel del óxido nítrico en la patogénesis de las distrofias musculares: una hipótesis de «dos aciertos» de la causa de la necrosis muscular. Microsc Res Tech. (2001) 55:223–35. doi: 10.1002/jemt.1172
Resumen de PubMed | Texto completo de CrossRef | Google Académico
Palabras clave: miocardiopatía, distrofinopatía, distrofia muscular golden retriever (DMG), distrofia muscular de Duchenne (DMD), historia natural
Cita: Schneider SM, Sansom GT, Guo L-J, Furuya S, Weeks BR y Kornegay JN (2022) Historia natural de los cambios histopatológicos en la miocardiopatía de la distrofia muscular del Golden Retriever. Frente. Vet. Sci. 8:759585. doi: 10.3389/fvets.2021.759585
Recibido: 16 de agosto de 2021; Aceptado: 28 de diciembre de 2021;
Publicado: 17 febrero 2022.
Editado por:
David Bruyette, Anivive Lifesciences, Estados Unidos
Revisado por:
José Manuel Verdes, Universidad de la República, Uruguay
Inès Barthélémy, Univ Paris-Est Creteil, Francia
Derechos de autor © 2022 Schneider, Sansom, Guo, Furuya, Weeks y Kornegay. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia Creative Commons Attribution License (CC BY).
*Correspondencia: Sarah M. Schneider, Sarah.Schneider@uga.edu
†Dirección actual: Sarah M. Schneider, Departamento de Patología, Universidad de Georgia, Athens, GA, Estados
Unidos Shinji Furaya, Universidad de Yamanashi, Chuo, Japón
Renuncia: Todas las afirmaciones expresadas en este artículo son únicamente las de los autores y no representan necesariamente las de sus organizaciones afiliadas, ni las del editor, los editores y los revisores. Cualquier producto que pueda ser evaluado en este artículo o afirmación que pueda hacer su fabricante no está garantizado ni respaldado por el editor.
Date de alta y recibe nuestro 👉🏼 Diario Digital AXÓN INFORMAVET ONE HEALTH
Date de alta y recibe nuestro 👉🏼 Boletín Digital de Foro Agro Ganadero
Noticias animales de compañía
Noticias animales de producción
Trabajos técnicos animales de producción
Trabajos técnicos animales de compañía