par Patrick PLA, Université Paris-Saclay

SOMMAIRE :
Introduction
Détermination, prolifération et migration des myoblastes
Fusion des myoblastes
Différenciation finale
Les cellules satellites
La production de cellules musculaires striées à partir de cellules iPS
Introduction
La musculature des membres humains matures a été bien décrite depuis la fin du XVème et le début du XVIème siècle. Léonard de Vinci et Vésale ont réalisé des dessins anatomiques complexes qui ont contribué, parallèlement à de nombreuses années de dissections de cadavres, à faire la description détaillée de la musculature du membre supérieur.
Le muscle strié squelettique est un tissu contractile qui occupe environ 40 % du poids corporel d’un humain et qui est distribué dans tout le corps. Chez l’homme, une fonction musculaire dysfonctionnelle entraîne une grande variété de troubles physiologiques, allant des crampes musculaires courantes aux myopathies sévères (par exemple voir Savarese et al., 2020). Le muscle squelettique a des propriétés fonctionnelles hétérogènes qui sont spécifiques pour un type de muscle. Les muscles des membres et du tronc interviennent dans la posture du corps, la locomotion et la respiration ; tandis que les muscles craniofaciaux contrôlent principalement l’expression faciale, la parole, l’activité alimentaire et le mouvement des yeux.
La plupart des muscles squelettiques du tronc et des membres sont dérivés de cellules précurseurs myogéniques ou myoblastes qui migrent à partir des somites au cours du développement embryonnaire tandis que la musculature de la tête, provient principalement du mésoderme céphalique et aussi des cellules de crêtes neurales (il n’y a de toute manière pas de somites dans la tête).
Au cours de la différenciation, les myoblastes s’alignent et fusionnent en une unité fondamentale : la fibre musculaire. Les fibres musculaires individuelles sont de très longs syncytia pouvant atteindre plusieurs centimètres.
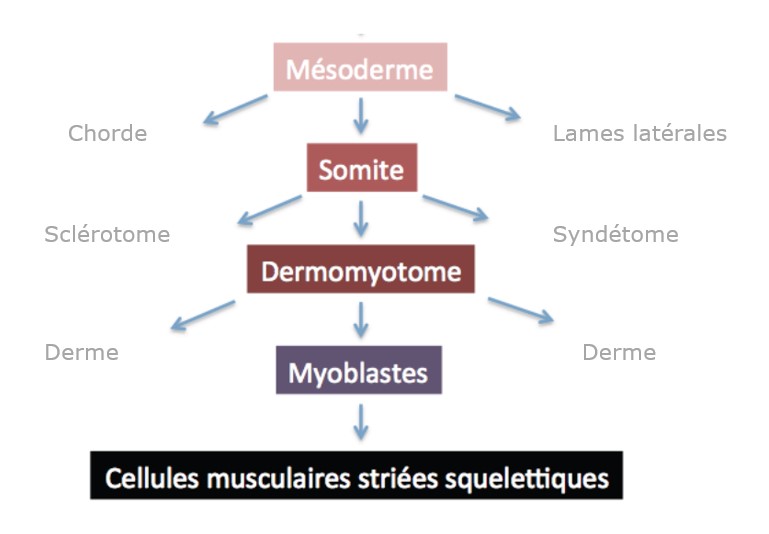
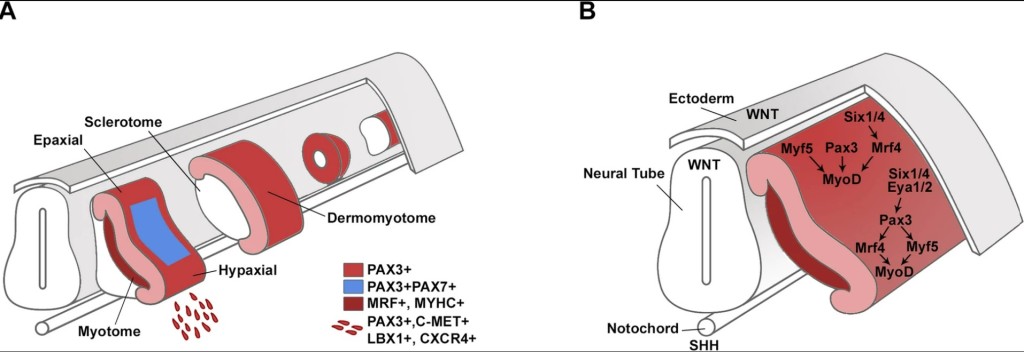
La musculature du corps (en excluant la tête) est constituée d’une composante épaxiale et hypaxiale. La composante épaxiale est composée des muscles profonds du dos qui proviennent uniquement du myotome. La composante hypaxiale comprend les muscles de la paroi ventrolatérale du corps, des ceintures, des membres et de la langue. Les cellules des muscles des membres et de la langue et des muscles latéraux de la ceinture scapulaire sont dérivées des myoblastes qui ont migré à partir du somite. En revanche, les muscles de la paroi corporelle ventrolatérale (muscles intercostaux et abdominaux) et les muscles de la ceinture scapulaire médiale sont formés directement à partir du myotome, sans migration. Signalons qu’une partie des muscles de la ceinture scapulaire, le trapèze et le muscle sternocleidomastoideus, proviennent du mésoderme des lames latérales.
La base du mécanisme d’action des muscles squelettiques est la conversion de l’énergie chimique en énergie cinétique grâce à l’interaction actine-myosine.
La machinerie contractile des cellules musculaires striées est basée sur un impressionnant réseau de filaments minces (à base d’actine) et épais (à base de myosine), disposés en unités répétitives, les sarcomères qui font 2 µm de longueur environ. Un contrôle rigoureux de la disposition de ces systèmes de filaments est nécessaire pour une conversion efficace de la force produite par l’interaction myosine-actine en contraction au niveau macroscopique. Chez les patients atteints de la myopathie de Duchenne, les sarcomères ne sont pas bien alignés ce qui contribue à rendre dysfonctionnelle la contraction musculaire.
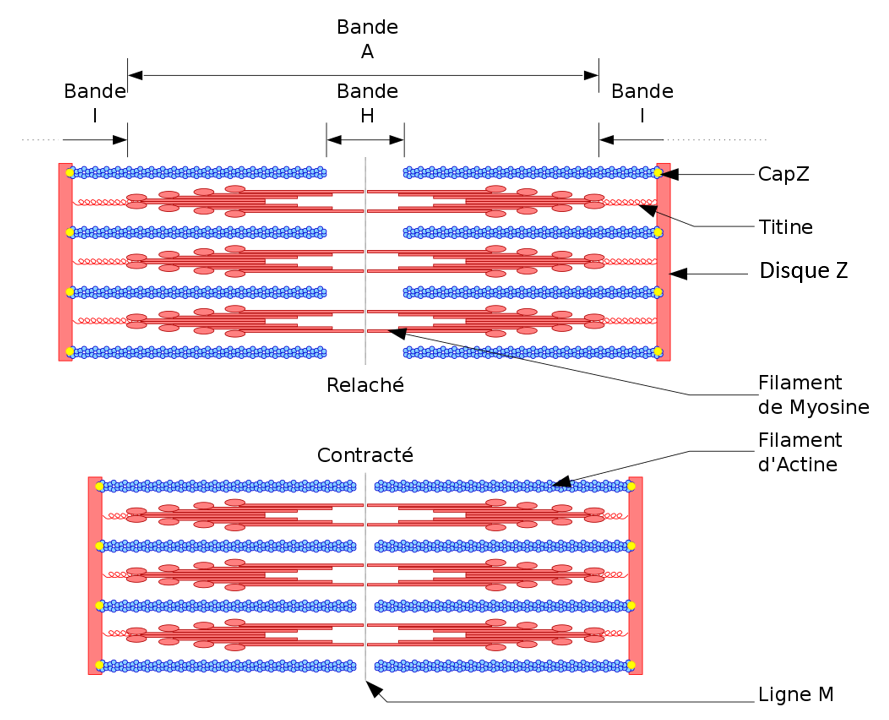
Chaque sarcomère peut être divisé axialement en différentes zones en fonction de son ultrastructure : la bande I (isotrope) où seuls des filaments fins d’actine sont présents, la bande A (anisotrope) qui contient des filaments d’actine et les filaments épais de myosine qui se chevauchent, le disque Z qui borde le sarcomère à ses extrémités, ancrant les extrémités barbelées (+) des filaments d’actine, et la bande H au centre, où seuls les filaments de myosine sont présents et réticulés. Les filaments minces sont orientés de manière antiparallèle au niveau des disques Z et associées par de multiples interactions moléculaires, impliquant notamment l’α-actinine. En fait, plus de 50 protéines font partie des disques Z matures, et elles sont considérées comme l’une des structures macromoléculaires les plus complexes dans les organismes vivants (Luther, 2009). Les disques ne jouent pas uniquement un rôle dans le maintien de l’architecture des myofibrilles, mais jouent également un rôle dans la signalisation, la mécanodétection et la mécanotransduction. Les protéines du disque Z ont récemment été identifiées comme étant la cible de multiples phosphorylations, modulant ainsi directement les interactions et la dynamique des protéines.
La détermination, la prolifération et la migration des myoblastes
Peu de temps après leur formation, les somites se subdivisent en sclérotome mésenchymateux ventral (qui donne les vertèbres) et en dermomyotome épithélial dorsal. Ce dernier compartiment contient des progéniteurs des cellules musculaires striés squelettiques, les myoblastes (aux côtés du derme et de la graisse brune) et maintient l’expression de Pax3 (Lepper et Fan, 2010) contrairement au sclérotome (qui se met à exprimer Pax1).
Signalons que se forme entre le dermomyotome et le sclérotome, une petite population de cellules formant le syndétome, exprimant le gène Scleraxis et qui donne naissance aux tendons, fonctionnellement importants pour la fonction des muscles (Brent et al., 2003).
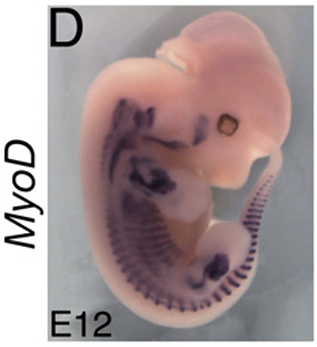
Peu de temps après sa formation, le dermomyotome se divise en un domaine épaxial dorsal et hypaxial ventral. La myogenèse primaire y commence lorsque les cellules dermomyotomales activent l’expression du facteur myogénique Myf5. L’expression d’un autre facteur myogénique, MyoD, est activée un peu plus tardivement. Ces cellules myogéniques précoces se délaminent du dermomyotome et contribuent à la formation des premiers muscles embryonnaires, les myotomes (Denetclaw et al., 1997). Ces myofibres primaires servent de base à la formation des muscles matures.
La structuration appropriée des somites et du dermomyotome puis du myotome repose sur plusieurs voies de signalisation telles que FGF, WNT et SHH qui ont été identifiées dans des études complémentaires réalisées sur des embryons de souris, de poulet et de poisson zèbre (Groves et al., 2005; McDermott et al., 2005 ; Hamade et al., 2006 ; Brunelli et al., 2007). Ces voies de signalisation convergent pour faire exprimer Pax3 et ensuite pour enclencher le programme myogénique. Notamment, Wnt1 et Wnt3a, produits dans le tube neural dorsal, adjacent au site de la myogenèse épaxiale, activent préférentiellement l’expression de Myf5 tandis que Wnt6 et Wnt7a, produits dans l’ectoderme dorsal, induisent préférentiellement l’expression de MyoD (Ikeya et Takada, 1998, Brunelli et al., 2007). Wnt1 et Wnt3a agissent via la voie de signalisation canonique β-caténine alors que Wnt6 et Wnt7a agissent via une voie non canonique (impliquant PKC).
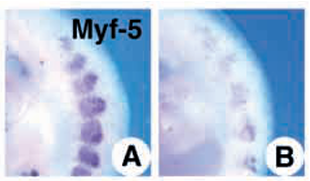
Les cellules de crêtes neurales qui migrent à proximité du dermomyotome (notamment sa partie épaxiale) produisent également Wnt1 et cette contribution est nécessaire à une bonne myogénèse (Serralbo et Marcelle, 2014).
Wnt6 produit par l’ectoderme active aussi l’expression de Paraxis dans le dermomyotome ce qui lui permet de conserver pendant un moment une structure épithéliale, contrairement au sclérotome donnant les vertèbres, dont les cellules subissent rapidement une transition épithélio-mésenchymateuse sous l’influence de Shh produit par la chorde (Linker et al., 2005). Néanmoins, l’action d’une faible concentration de Shh est nécessaire pour activer correctement l’expression de Pax3 dans le dermomyotome (Cairns et al., 2008).
Dans le domaine hypaxial plus ventral, les Wnt (notamment Wnt7a) produits par l’ectoderme doivent agir pour activer l’expression des facteurs myogéniques mais l’action des BMP inhibiteurs produits par le mésoderme des lames latérales doit être empêchée par la production locale de Noggin (Gerhart et al., 2011).
Ce qui vient d’être décrit est valable uniquement pour les précurseurs des muscles striés squelettiques provenant des somites. Dans la tête, où il n’y a pas de somites, les cellules musculaires proviennent du mésenchyme céphalique et les signaux inducteurs sont différents. Les Wnt sont des inhibiteurs de la détermination musculaire et ils doivent être inhibés par Frzb (qui capture les Wnt avant qu’ils ne puissent atteindre leur récepteur) pour que les muscles se développent (Tzahor et al., 2003).
Les embryons mutants perte-de-fonction Pax3 présentent un phénotype musculaire sévère dans le tronc et les membres (Relaix et al., 2003).
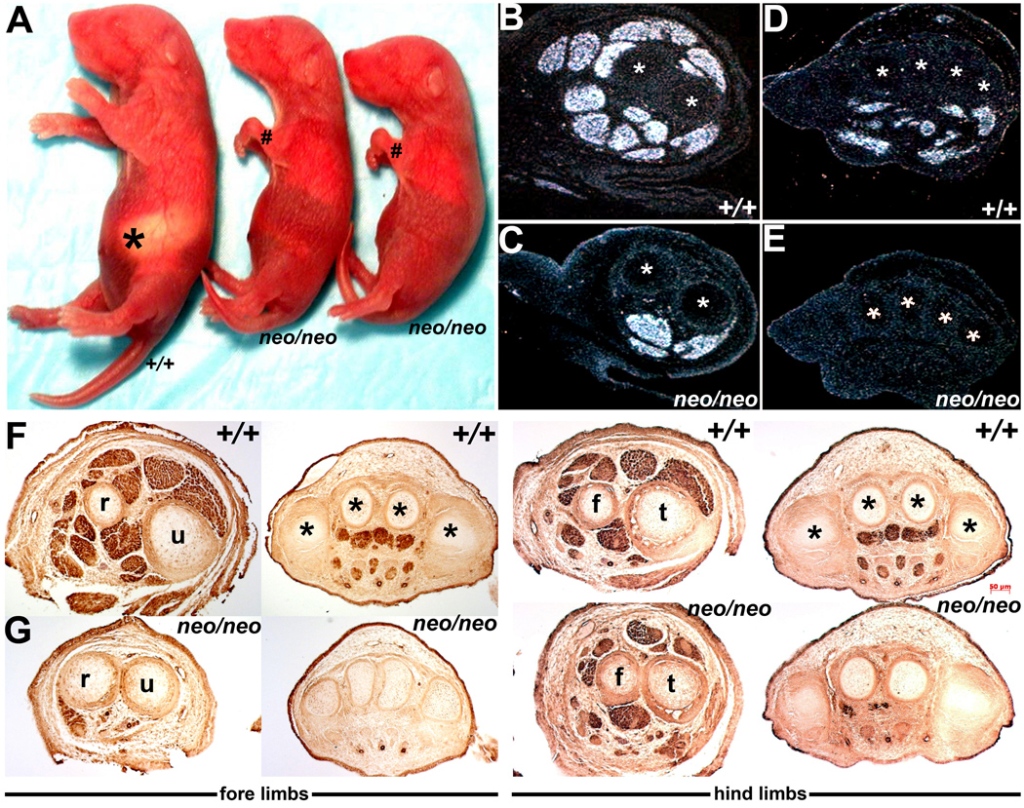
On étudie les nouveau-nés âgés de 2 jours de souris témoins et de souris Pax3neo/Pax3neo qui sont homozygotes pour un allèle qui réduit la quantité de Pax3 fonctionnel produit. (A) Les souriceaux Pax3neo/Pax3neo se distinguent facilement de leurs congénères de type sauvage (+/+) par des membres sous-dimensionnés et gravement malformés et le manque de lait ingéré (astérisque). (B–E) Analyse par hybridation in situ de l’expression de MyoD dans les membres antérieurs de type sauvage E15.5 (B,D) et Pax3neo/Pax3neo (C,E) au niveau du cubitus (u)/radius (r) (indiqué via * en B,C) et des os des phalanges (indiqué par * en D,E). La plupart des masses musculaires MyoD-positives sont absentes dans les membres antérieurs réduits. Les astérisques indiquent les os servant de référence pour montrer des niveaux de section comparables. (F, G) Immunomarquage reconnaissant une actine musculaire à divers niveaux sur une section médiale-latérale le long des membres antérieurs et postérieurs de type sauvage (F) et Pax3neo/Pax3neo (G) à E13.5 jours de développement. Les embryons mutés sont déjà anormaux à ce stade de développement précoce et les masses musculaires αSMA-positives sont soit très réduites (membres postérieurs) soit complètement absentes (membres antérieurs) dans les embryons hypomorphes. Abréviations : f, péroné ; t, tibia. Source : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2292838/#!po=23.6842
En revanche, les embryons mutants Pax7 ne présentent pas de défauts myogéniques au cours du développement (Relaix et al., 2004). Ceci est cohérent avec l’expression retardée de Pax7 dans les cellules exprimant Pax3 dans l’embryon de souris, et des activités redondantes à ce stade entre ces deux facteurs de transcription qui sont évolutivement proches (Soleimani et al., 2012). L’exigence de Pax3 pour le bon développement du dermomyotome est associée à son rôle pour assurer la survie cellulaire. En effet, en l’absence de Pax3, les cellules du dermomyotome subissent une apoptose (Mansouri et al., 2001 ; Zhou et al., 2008).
Des lignées de souris génétiquement modifiées contenant différents allèles de Pax3 ont permis de comprendre le rôle de Pax3 dans la myogenèse et de découvrir certains de ses gènes cibles directs. L’allèle gain de fonction Pax3 Pax3-FKHR qui code une protéine de fusion, comprenant le domaine de liaison à l’ADN de Pax3 et le domaine d’activation transcriptionnelle de FOXO1, sauve le phénotype mutant Pax3 montrant que Pax3 fonctionne comme un activateur transcriptionnel (Relaix et al., 2003). La modulation de l’expression des gènes opérant en aval de Pax3 selon son activité transcriptionnelle en présence de chacun de ses allèles, a permis l’identification de gènes cibles directs de Pax3 comme Myf5, Fgfr4, Itm2a, Dmrt2 et c-Met (Bajard et al., 2006 ; Lagha et al., 2013 ; Sato et al., 2010).
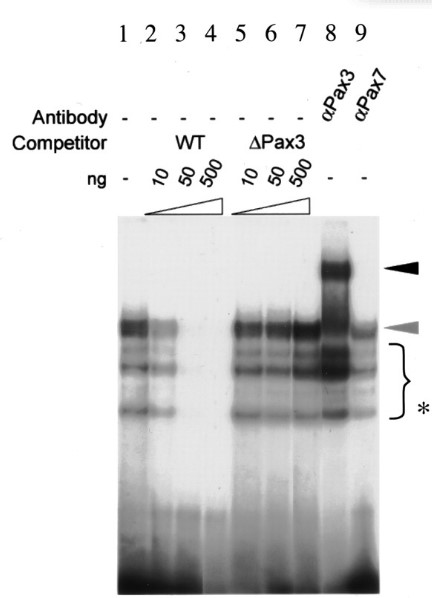
Il y a aussi des régulations génétiques secondaires qui renforcent et stabilisent les niveaux d’expression. Par exemple, Dmrt2 est nécessaire à la bonne activation de Myf5, bien que Dmrt2 et Myf5 soient des cibles directs de Pax3 (Sato et al., 2010).

En plus de son rôle de facteur de transcription, Pax3 est impliqué dans le remodelage de l’accessibilité de la chromatine au niveau des loci myogéniques (Magli et al., 2019). Cela se produit en coopération avec Six4 et le membre de la famille de domaines TEA 2 (TEAD2).
Il existe des réseaux génétiques distincts dans les progéniteurs pré-myogéniques entre ceux de la tête et ceux des muscles du tronc/des membres au cours du développement embryonnaire. Le facteur de transcription Pax3 régule la myogenèse des membres, tandis que le facteur de transcription T-box Tbx1, le facteur de transcription à homéodomaine Pitx2 et Tcf21 jouent un rôle important dans la spécification des cellules progénitrices des muscles de la tête.
Le développement du lignage musculaire est ensuite contrôlé par les MRF ou les facteurs de régulations myogéniques incluant MYF5, MYOD, myogénine (MYOG) et MRF4 (également connu sous le nom de Myf6). Ils font partie de la famille des facteurs de transcription hélice-boucle-hélice, qui se lient aux séquences spécifiques appelées boîtes E (E-box) trouvés dans de nombreux promoteurs de gènes impliqués dans la myogenèse. Les MRF sont connus pour leur capacité à convertir les cellules non myogéniques en cellules musculaires en activant l’expression des gènes spécifiques du muscle. Par exemple, l’expression ectopique de MyoD ou de Myf5 dans la moitié gauche du tube neural d’un embryon de poulet (introduction de l’ADN exogène par électroporation in ovo) aboutit à la formation de cellules musculaires à l’intérieur du côté gauche du tube neural à la place des neurones ! Ces facteurs myogéniques sont donc suffisants pour induire le lignage musculaire strié squelettique.
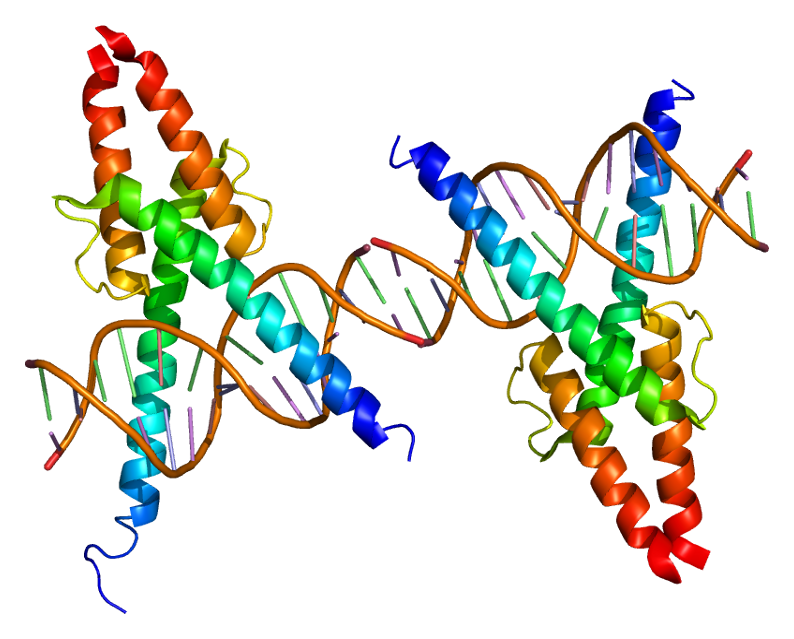
MyoD ne se trouve pas tout seul ses cibles d’ADN. Dans les myoblastes, MyoD est associé avec Mef2 et KAP1. KAP1 sert d’échafaudage et recrute les coactivateurs p300 et LSD1, en plus de plusieurs corépresseurs dont G9a et l’histone déacétylase HDAC1. La conséquence de ce recrutement mélangeant coactivateur/corépresseur est de réduire au silence les régions promotrices sur les gènes musculaires. Ce n’est que lorsque la kinase MSK1 phosphoryle KAP1 que les corépresseurs précédemment liés à l’échafaudage sont libérés, permettant à MyoD et Mef2 d’activer la transcription (Singh et al., 2015). L’expression de MyoD n’est donc pas suffisante pour faire se développer une cellule musculaire. Il faut aussi que le contexte cellulaire aboutisse à le laisser agir.
Myf5 et MyoD et dans une moindre mesure Mrf4 sont des facteurs importants pour la détermination myogénique, tandis que la myogénine est induite plus tard dans la différenciation et est nécessaire au développement du muscle mature. Les animaux MyoD -/- ont un muscle squelettique normal et la perte de MyoD est compensée par une expression prolongée de Myf5 (Megeney et al., 1996). Les animaux Myf5 -/- meurent peu après la naissance d’une insuffisance respiratoire due à une cage thoracique mal formée, mais de manière similaire aux animaux MyoD -/-, ils ont un muscle squelettique relativement normal avec une expression inchangée de MyoD, myogénine et Mrf4. Les souris myogénine -/- meurent périnatalement d’une insuffisance respiratoire due à une réduction sévère de tous les muscles squelettiques, caractérisée par une abondance de myoblastes et mais des myofibres rares, avec une incapacité à induire la chaîne lourde de la myosine musculaire (MyHC), suggérant que ces myoblastes sont engagés dans la lignée myogénique mais ne parviennent pas à se différencier et à former des myofibres.
Une fois déterminés, les myoblastes doivent proliférer et pour certains d’entre eux migrer sur une longue distance. Chez l’embryon humain, les myoblastes migrent dans le bourgeon du membre supérieur à la 7ème semaine de gestation. L’étude des myoblastes apporte un éclairage intéressant sur les choix entre différents processus cellulaires : proliférer ou migrer ? Proliférer ou se différencier ? Migrer ou se différencier ?
La différenciation des cellules musculaires striées squelettiques a été beaucoup étudiée in vitro dans les myoblastes de souris C2C12. En présence de FGF dans leur milieu de culture, ces cellules prolifèrent et restent indifférenciées. Si on enlève le FGF, la prolifération s’arrête et les cellules fusionnent pour former des myotubes.
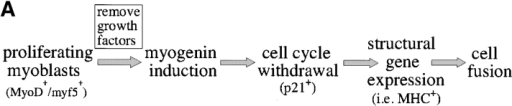
Le FGF maintient l’expression du répresseur transcriptionnel Msx1 qui inhibe la myogenèse. La voie de signalisation FGF aboutit également à la phosphorylation de MyoD ce qui inhibe sa capacité à activer la transcription des gènes impliqués dans la différenciation. L’expression du récepteur aux FGF, FGFR4 est activée in vivo directement par Pax3 qui est au sommet de la cascade génétique lors de la détermination des myoblastes dans le somite et aussi directement par MyoD (Lagha et al., 2008).
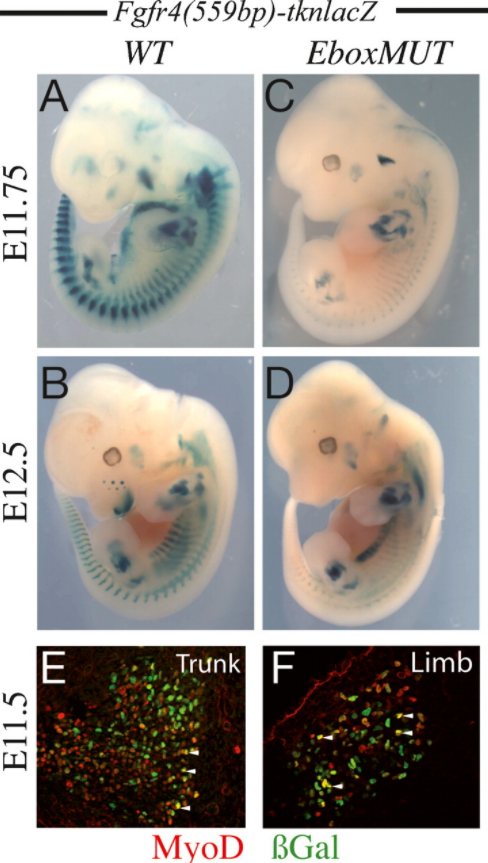
Un autre interrupteur est celui évoqué plus haut lors de la présentation de MyoD : dans les myoblastes prolifératifs, MyoD est associé avec Mef2 et KAP1. KAP1 sert d’échafaudage et recrute les coactivateurs p300 et LSD1, en plus de plusieurs corépresseurs dont G9a et l’histone déacétylase HDAC1. La conséquence de ce recrutement mélangeant coactivateur/corépresseur est de réduire au silence les régions promotrices sur les gènes musculaires. Au moment de la fin de la phase de la prolifération et le début de la différenciation, la kinase MSK1 phosphoryle KAP1 et les corépresseurs précédemment liés à l’échafaudage sont libérés, permettant à MyoD et Mef2 d’activer la transcription de leurs gènes cibles différenciateurs (Singh et al., 2015).
Ces régulations sont essentielles car au cours du développement, il faut laisser le temps aux myoblastes de proliférer suffisamment pour fournir assez de « matière première cellulaire » avant d’engager l’étape suivante qui est la fusion des myoblastes. De même, une différenciation trop précoce ne laisse pas le temps aux myoblastes de migrer correctement dans le bourgeon de membre.
De nombreuses voies de signalisation régulent le timing de la différenciation myogénique. Deux membres de la superfamille des facteurs de croissance transformants β (TGFβ), le TGFβ et la myostatine (aussi connue sous le nom de GDF8) sont des inhibiteurs puissants de la prolifération (Liu et al., 2020). TGFβ et myostatine activent les facteurs de transcription SMAD2 et SMAD3 par phosphorylation dépendante du récepteur de leurs extrémités C-terminale, favorisant leur interaction avec SMAD4. S’ensuit une translocation nucléaire et l’interaction avec les éléments de réponse dans les promoteurs et les enhancers des gènes cibles. La myostatine fait aussi baisser la phosphorylation de la sérine 473 sur Akt. Cette phosphorylation est habituellement stimulatrice de la prolifération donc l’effet de la myostatine aboutit bien à inhiber la prolifération (Liu et al., 2020).
Une famille a été découverte dans laquelle des individus sur quatre générations avaient une mutation du site d’épissage dans le gène codant la myostatine. Beaucoup des membres de la famille étaient des athlètes professionnels et un enfant de 4 ans était capable de tenir deux haltères avec ses bras complètement étendus. La mutation dans le site d’épissage laisse un intron qui contient un codon STOP aboutissant à une myostatine tronquée, non fonctionnelle. Ainsi, la prolifération des myoblastes a été plus importante et plus longue que d’habitude au cours du développement, générant des muscles plus gros (Schuelke et al., 2004). Dans le cas de la race ovine Texel, c’est une mutation dans le 3’UTR de l’ARNm de la myostatine qui le fait reconnaitre par des microARN exprimés dans les myoblastes (miR1 et miR206), ce qui aboutit à l’inhibition de sa traduction et à une masse musculaire plus importante que d’habitude.

La voie de signalisation activée par c-Met, un récepteur tyrosine kinase, est essentielle pour la prolifération et la migration des myoblastes, notamment dans le bourgeon de membre. Son ligand HGF est exprimé dans le mésenchyme des membres. Plusieurs voies de signalisation peuvent être activés en aval de c-Met : la voie MAPK (ERK, JNK et p38 MAPK), l’axe PI3K-AKT, la voie STAT et la voie IkB- NFkB. Le rôle de c-Met dans le développement musculaire est ainsi multiforme. Une mutation nulle de c-Met aboutit à ce que les précurseurs musculaires restent dans le dermomyotome mais cela n’affecte pas leur prolifération, tandis qu’une mutation qui perturbe la liaison de c-Met à l’un de ses effecteurs, GRB2, inhibe la prolifération des myoblastes seulement après leur migration dans le membre en développement. Ainsi, c-Met a des effets différents sur le développement musculaire en fonction du contexte cellulaire et de la voie effectrice en aval de son activation.
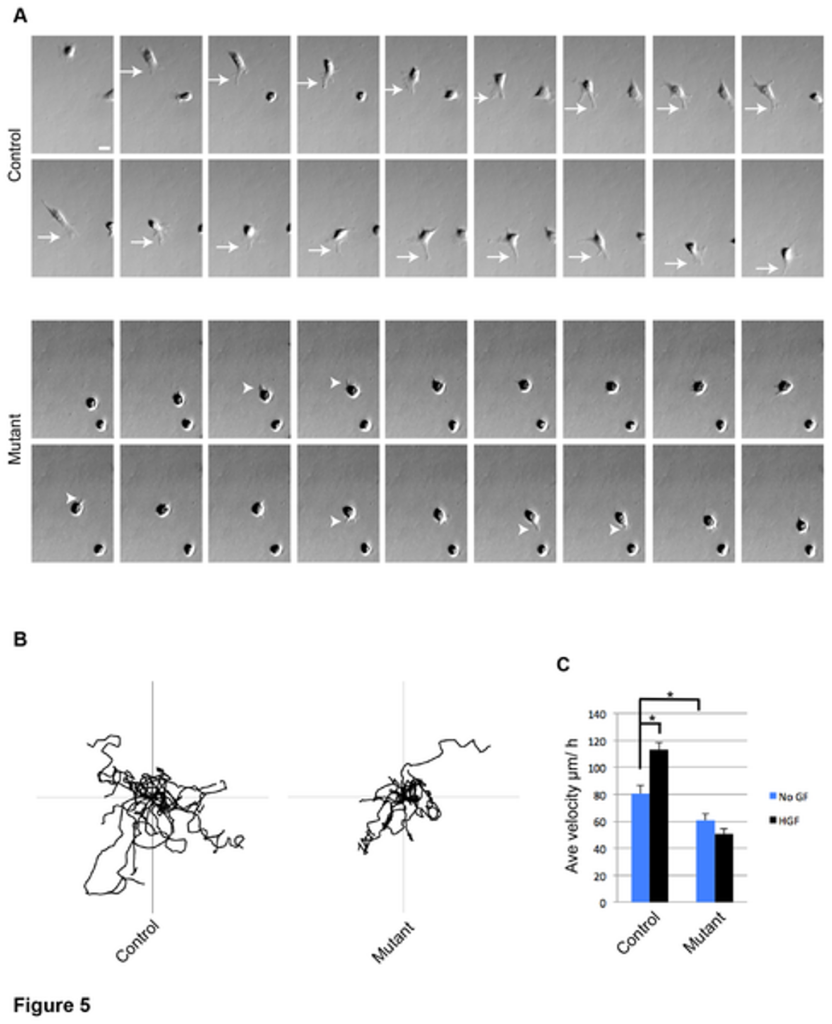
A) Séquence de microscopie à images de contraste montrant des myoblastes vivants exprimant (control) ou n’exprimant pas (mutant) c-Met, dans des milieux de migration. Des images des mêmes cellules ont été capturées toutes les 4 minutes pendant 68 minutes (flèches, lamellipodes dans la cellule témoin ; pointes de flèches, saillies membranaires dans la cellule mutante ; barre d’échelle = 20 µm. B) Traces montrant les chemins migratoires de 15 myoblastes sauvages (avec c-Met) ou mutants (sans c-Met). Positions des cellules enregistrées toutes les 4 minutes pendant 6 h (Axes = ± 300 µm). C) Vitesses moyennes des myoblastes dans les milieux de migration sans ou avec supplément de HGF, le ligand de c-Met, à 4 ng/ml. Les images ont été prises toutes les 4 minutes, les mesures de vitesse ont été enregistrées sur 6h. Source : https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0081757
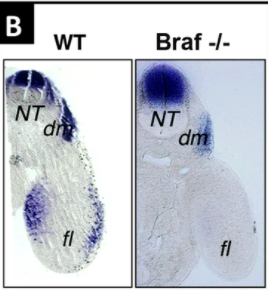
En tout cas, en aval de c-Met, la protéine de signalisation intracellulaire BRAF est indispensable au bon développement des myoblastes car si on délète son gène spécifiquement dans les cellules ayant activé Pax3 (ce qui inclue les myoblastes), les bourgeons de membres se retrouvent sans myoblastes.
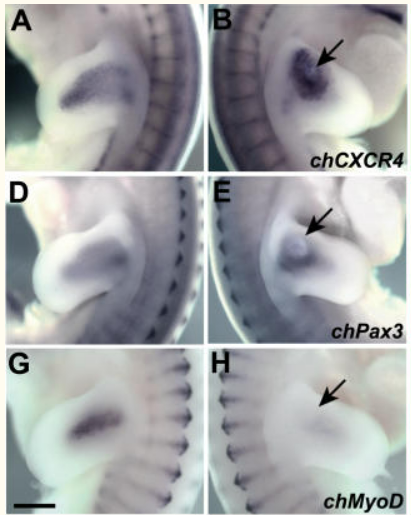
Autre facteur contrôlant la migration des myoblastes : le ligand SDF1 et son récepteur CXCR4 (Vasyutina et al., 2005).
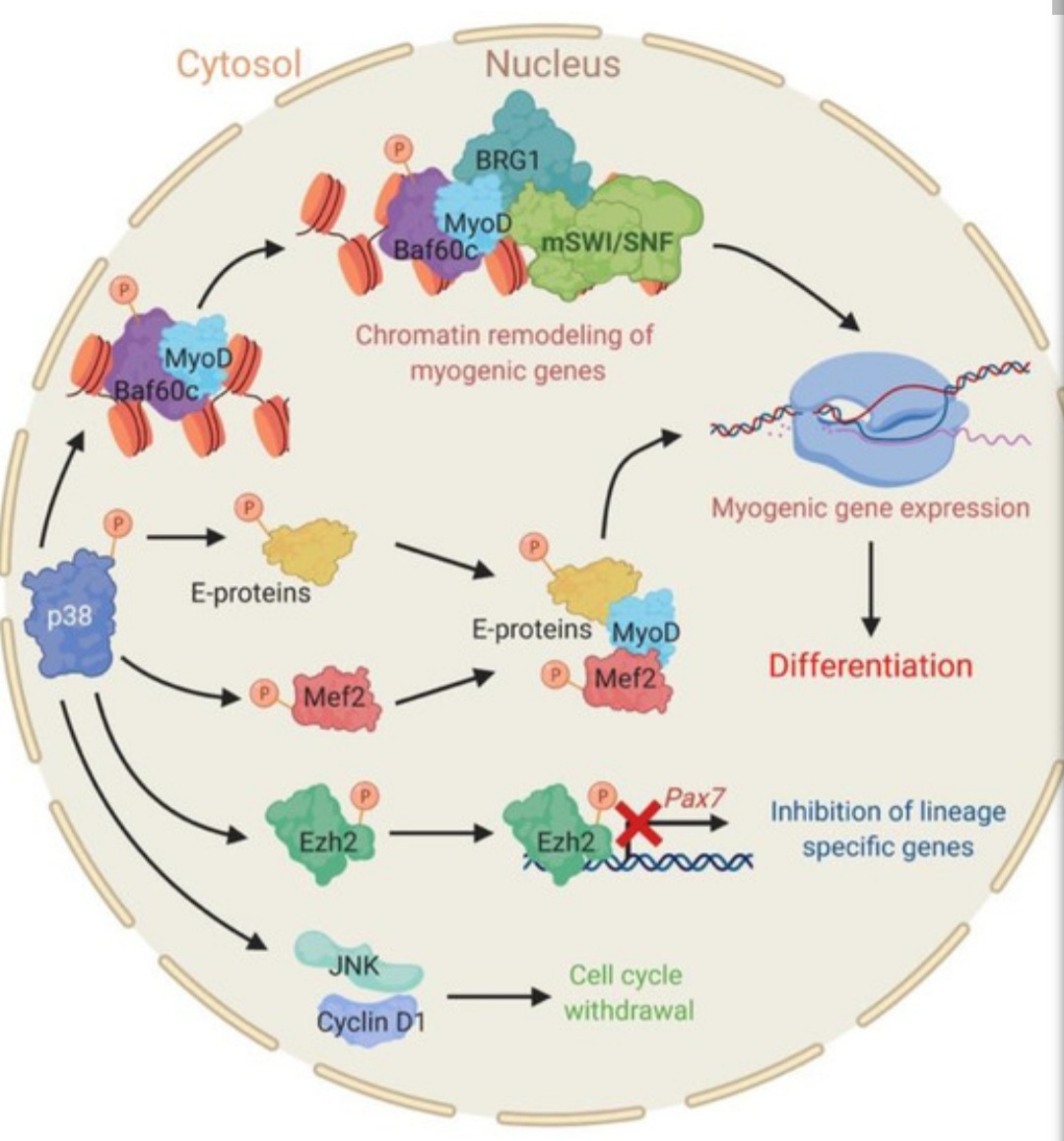
Lors de la fin de la phase de migration et de prolifération, MyoD devient actif comme nous l’avons vu. Parmi ces cibles, notons p21 qui éteint l’activité des kinases dépendantes des cyclines et sort définitivement les cellules musculaires du cycle cellulaire (Guo et al., 1995). La transition vers la phase de différenciation est aussi marquée par l’augmentation de l’activité de p38, une sérine/thréonine kinase de la famille MAPK. Elle phosphoryle de multiples cibles qui aboutissent à remodeler la chromatine (via le complexe SWI/SNF), à potentialiser l’action de MyoD en phosphorylant son co-facteur Mef2, à éteindre l’expression des gènes précoces du lignage musculaire tel Pax7 en phosphorylant Ezh2 et à faire sortir la cellule du cycle cellulaire via son action inhibitrice sur JNK et cycline D1 (Padilla-Benavides et al., 2020).
L’étape suivante : la fusion des myoblastes peut commencer.
La fusion des myoblastes
La fusion de myoblastes isolés en fibres multinucléées est une étape cruciale dans la formation, la croissance et aussi la réparation des muscles squelettiques. C’est un processus hautement dynamique, dans lequel les cellules subissent une reconnaissance, une adhésion, une formation de pores, un échange de matériel cytoplasmique et enfin une fusion membranaire.
L’adhérence initiale des myoblastes avant la fusion dépend de la M-cadhérine (Zeschnigk et al., 1995).
La fusion de myoblastes de mammifères nécessite la fusion de deux bicouches lipidiques apposées et implique plusieurs classes de protéines fortement exprimées, incluant le cytosquelette, des récepteurs de phagocytose et des protéines de réparation membranaire détectant le calcium. Myomaker (Millay et al., 2013) et Myomerger sont des protéines membranaires essentielles à la fusion des myoblastes. Myomaker est requis par les deux cellules de fusion, tandis que le besoin de Myomerger n’est qu’unilatéral (Quinn et al., 2017).
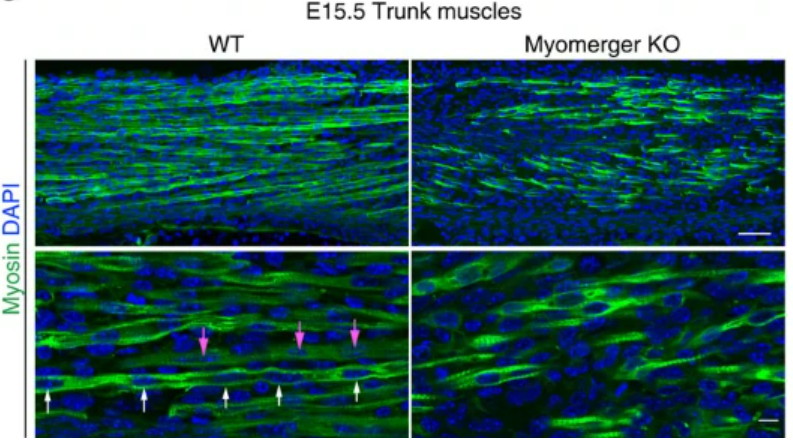
Signalons que Myomaker a la propriété remarquable de favoriser la fusion des cellules hétérologues aux cellules musculaires in vitro, c’est-à-dire qu’il suffit de faire exprimer Myomaker a des cellules n’appartenant pas au lignage musculaire pour les faire fusionner avec des myoblastes matures.
Des mutations dans les gènes codant Myomaker et Myomixer sont la cause du syndrome de Carey-Fineman-Ziter caractérisé par des faiblesses musculaires ou des paralysies (entre autres).
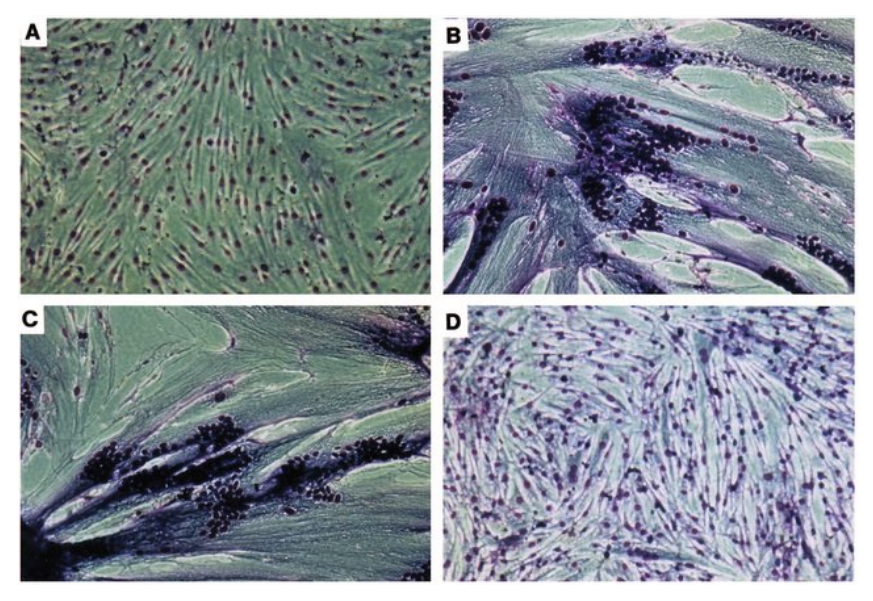
De fines projections remplies d’actine ont été observées lors de la fusion des myoblastes chez le poisson zèbre ou chez la drosophile. Ces structures semblent être des filopodes, qui sont de fines projections de faisceaux d’actine entourées d’une membrane qui sont importants pour les comportements cellulaires tels que la recherche de chemins pendant la migration, l’interaction avec la matrice extracellulaire et la communication de cellule à cellule. La participation à la fusion des myoblastes serait donc un nouveau rôle pour les filopodes. La présence de Myomaker et Myomerger a été observée dans ces filopodes musculaires.
L’intégrine β1 participe à la fusion des myoblastes et à l’assemblage du cytosquelette des myofibres au cours de la myogenèse embryonnaire. L’analyse de la myogenèse du poulet et de la souris a montré que l’intégrine α3 joue aussi un rôle important dans la mise en place des myofibrilles.
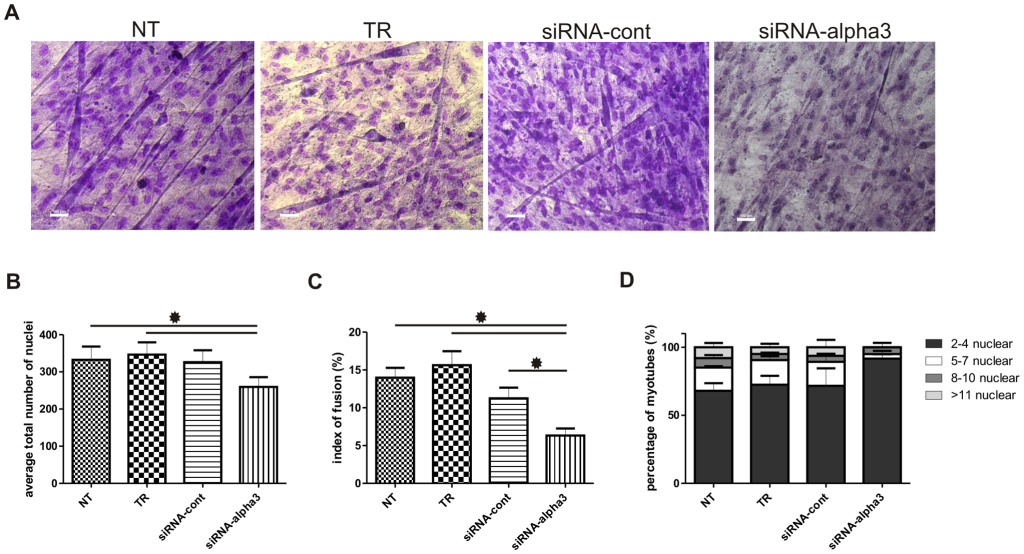
A) Coloration de Pappenheim des myoblastes en fusion. B) nombre total de noyaux calculé au jour 12 de la culture des myoblastes. C) indice de fusion analysé au jour 12 de la culture dans les myoblastes témoins et expérimentaux indiqués en pourcentage de noyaux de myotubes sur le nombre de tous les noyaux. D) proportion de myotubes à 2 à 4, 5 à 7, 8 à 10 et > 11 noyaux par au nombre de tous les myotubes. NT – myoblastes de contrôle non transfectés, TR – myoblastes de contrôle cultivés dans un milieu additionné de réactif de transfection, siRNA-cont – myoblastes de contrôle transfectés avec siRNA contrôle (séquence aléatoire), siRNA-α3 – myoblastes transfectés avec siRNA qui baisse l’expression de l’intégrine α3. * p≤0,05. Source : https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0061760
Étant donné que le dimère d’intégrine α3β1 est capable de former des complexes avec les tétraspanines CD9 et CD81, la fonction de ces protéines a également été suivie. Il a été montré que CD9 et CD81 participent à la fusion des myoblastes C2C12, de même qu’un autre ligand d’intégrine, ADAM12 aussi appelé Meltrine (Tachibana et Hemler, 1999; Kurisaki et al., 2003). Signalons que l’autre nom de CD9 est Juno et nous l’avons rencontré impliqué dans la fusion entre l’ovocyte et le spermatozoïde lors de la fécondation. Il s’agit de la même fonction mais dans un autre contexte.
La fusion dépend aussi du facteur de transcription NFAT2C car la déplétion de ce facteur donne naissance à des souris avec des muscles plus petits avec moins de noyaux par cellule. C’est également le cas en absence de myogénine (MyoG), l’un des MRF (Ganassi et al., 2020)
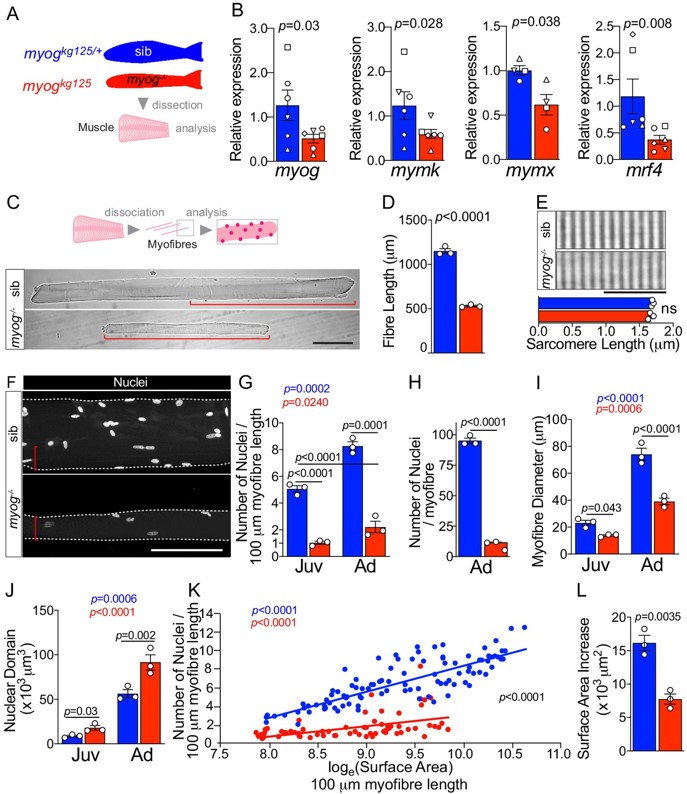
(A) Schéma du traitement des muscles du tronc pour l’analyse, le rose représente le muscle du poisson-zèbre où l’étude a été menée. Les couleurs identifient les échantillons des souches (myogkg125/+, bleu) ou myog-/- (myogkg125, rouge) dans toute la figure. (B) L’analyse RT-qPCR montre une diminution de la quantité des ARNm myog, mymk, mymx et mrf4 chez l’adulte myog-/-. Les formes des symboles désignent des échantillons appariés sib et myog-/-. (C) Schéma de l’isolement des myofibres pour l’analyse morphométrique (en haut) et des images représentatives (en bas) montrant des myofibres myog-/- plus petites (parenthèses rouges) par rapport à la fratrie du même âge. Barre d’échelle = 100 µm. (D) Mesure de la longueur absolue des myofibres. (E) Images représentatives et mesure de la longueur du sarcomère non modifiée sur des myofibres fraîchement isolées. Barre d’échelle = 10 µm. (F) Des images représentatives de myofibres adultes fixes isolées montrent une réduction de la taille de myog-/- (parenthèses rouges). Barre d’échelle = 100 µm. (G–J) Quantification du nombre de noyaux/100 µm (G), du nombre absolu de noyaux par myofibre (H), du diamètre de la myofibre (I) et de la taille du domaine nucléaire (volume de myofibre par noyau) (J) montrant des changements significatifs dans myofibres des stades juvénile (Juv, 1 mois) et adulte (Ad, 8 mois) au sein des génotypes (p coloré) ou parmi (p noir). (K) La relation entre le nombre de noyaux et la loge (surface) indique un mode de croissance différent entre le groupe et le myog-/- (c. p) (L) L’augmentation de la surface (SA) du stade juvénile au stade adulte (=Ad_SA – Juv_SA) indique un taux de croissance réduit dans les myog-/-. Source : https://elifesciences.org/articles/60445
Différenciation finale
Le sarcomère est l’unité fondamentale des fibres musculaires, et médie la contraction dépendante de l’ATP et le relâchement. Alors que les composants des sarcomères sont bien compris, la mécanique et la séquence de leur mise en place reste en débat. Un processus clé dans la myofibrillogenèse est la polymérisation de l’alpha-actinine dans les disques Z qui flanquent la bande A contenant de la myosine.
Au cours de la maturation des fibres musculaires, l’expression de la chaîne lourde de la myosine embryonnaire passe le relais à l’expression des isoformes de la chaîne lourde de la myosine adulte. Elles participent à des fibres musculaires avec un profil spécifique : soit un profil oxydatif, à contraction lente ou soit un profil glycolytique, à contraction rapide (Khodabukus, 2021).
Les stades finaux de la myogenèse sont contrôlés par TGFβ, le facteur de croissance des hépatocytes (HGF), WNT (van der Velden et al., 2006) et la signalisation du facteur de croissance analogue à l’insuline (IGF) (Chargé et Rudnicki, 2004).

Les facteurs de transcription impliqués sont notamment Myf5, MyoD, Myomaker et MyoG pour faciliter la fusion des cellules progénitrices musculaires, l’hypertrophie des myofibres et l’innervation par les motoneurones ce qui génère une cellule musculaire complètement fonctionnelle (Zhang et al., 2020).
Les chaperons moléculaires, qui contrôlent la conformation des protéines lors de leur maturation ont récemment été impliqués dans la myofibrillogenèse. Le chaperon spécifique au muscle unc45b chez Caenorhabditis elegans coopère avec hsp90 pour plier le domaine moteur globulaire N-terminal (S1) des myosines sarcomériques. La déplétion de son orthologue chez le poisson zèbre entraîne l’absence d’intégration de la myosine dans le sarcomère. Des études in vitro dans des myoblastes de mammifères cultivés ont confirmé ce rôle. Chez Xenopus tropicalis, la mutation dicky ticker cause un phénotype alliant défaut dans la structure musculaire de la queue mais aussi une absence de battement cardiaque. Il s’avère que ce mutant présente une mutation faux sens dans le gène codant la protéine chaperon unc45b.
La myoglobine musculaire est une protéine essentielle des cellules musculaires striées (squelettiques mais aussi cardiaques) qui permet de stocker localement de l’O2 qui peut ainsi être mobilisé rapidement.
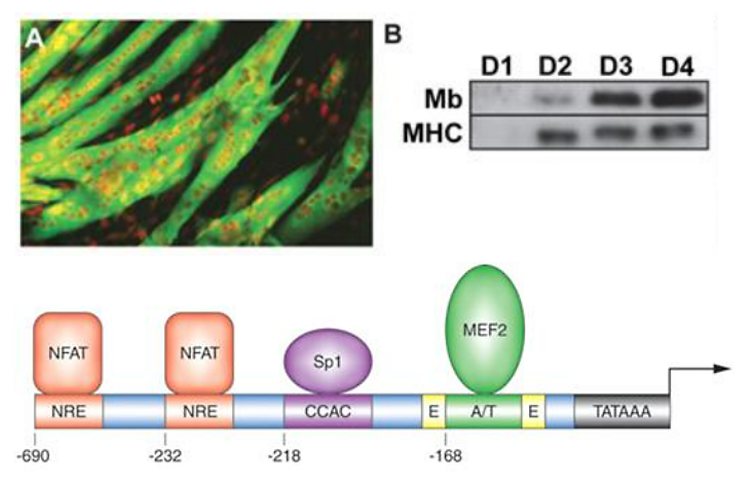
La différenciation d’une cellule musculaire striée squelettique n’est complète que si elle forme une synapse fonctionnelle avec un motoneurone.
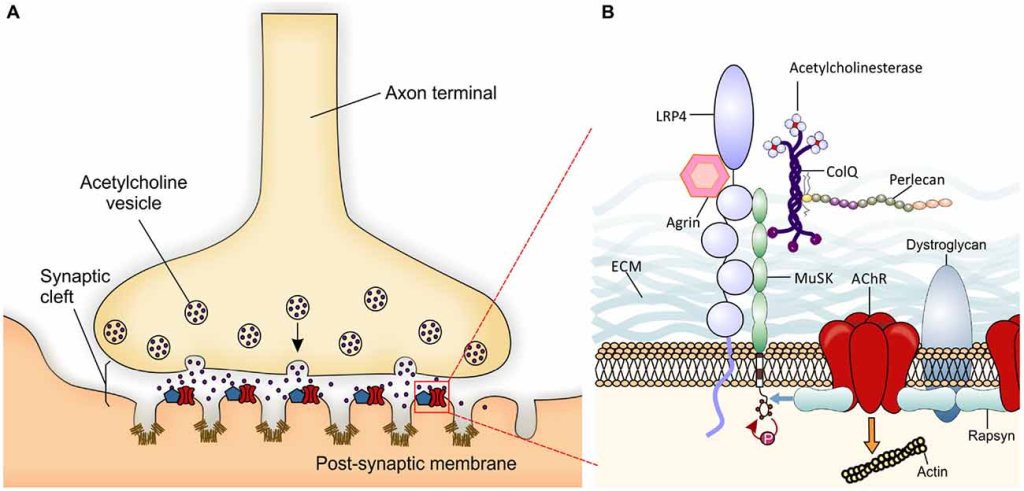
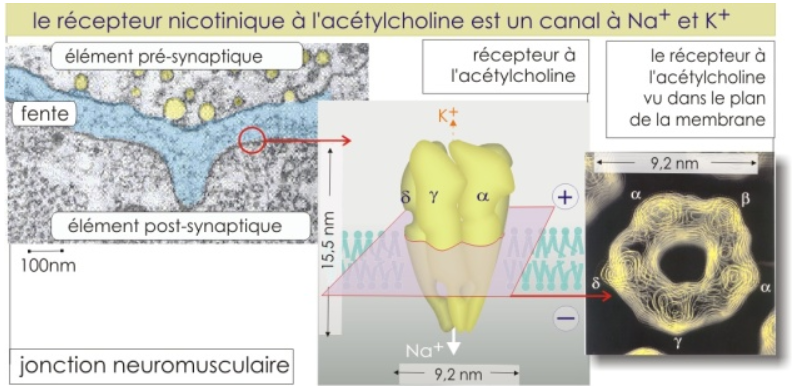
L’innervation des fibres musculaires induit la formation d’amas denses de récepteurs à l’acétylcholine AChR formant des jonctions neuromusculaires (JNM) stables dans la région médiane des fibres musculaires. On estime que la membrane plasmique musculaire des JNM contient entre 10.000 et 20.000 récepteurs AChR par µm2 tandis que le reste de la membrane plasmique en contient 10/µm2.
L’agrine est une protéine secrétée par le cône de croissance axonal. Son récepteur est Lrp4 à la surface des cellules musculaires et cette interaction permet d’activer MuSK, un récepteur tyrosine kinase. Les souris avec une déplétion du gène codant l’agrine (agrin–/–) sont incapables de former des JNM ; cependant, ces souris peuvent former des amas d’AChR non situés en face d’un axone (appelés amas aneuraux) avant l’innervation (Lin et al., 2001). À l’inverse, les amas aneuraux ne se forment pas chez les souris Lrp4-/- ou MuSK–/–, et leurs fibres musculaires présentent une distribution uniforme des AChR avec une région d’innervation plus large contenant des terminaisons des motoneurones hautement ramifiées (Choi et al., 2013). L’agrine neuronale n’induit pas de clusters AChR dans les cellules musculaires MuSK–/–. Cependant, la sensibilité à l’agrine peut être restaurée par l’expression de MuSK de type sauvage (Zhou et al., 1999). Fait intéressant, la formation de synapses peut être sauvée chez les souris agrin–/– avec une surexpression ectopique de MuSK (Kim et Burden, 2008). Ensemble, cela suggère l’importance de MuSK pour la préparation des clusters de AChR avant l’innervation, tandis que l’agrine est nécessaire pour le clustering AChR neuronal et la formation de JNM.
La formation de la jonction neuromusculaire est également influencée par d’autres composants extracellulaires. Par exemple, MuSK possède un domaine riche en cystéine (CRD) qui partage une homologie avec le récepteur des WNT, Frizzled. En conséquence, les protéines WNT se lient et activent MuSK avant l’innervation, lorsque l’agrine neurale n’est pas encore présente. Cette signalisation peut réguler le guidage axonal et induire la formation d’amas AchR aneuraux en préparation des amas neuraux définitifs.
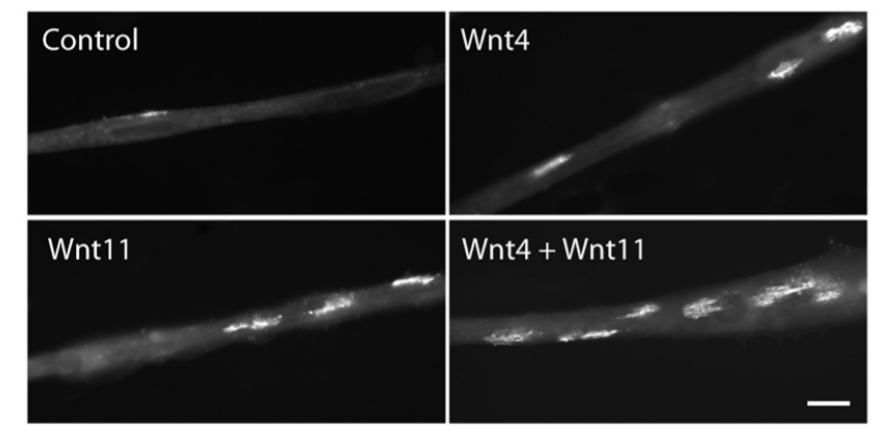
De plus, les voies WNT canoniques et non canoniques sont affectées chez des souris transgéniques avec des délétions du domaine CRD de MuSK qui ne peuvent plus se lier à Wnt (Messeant et al., 2017). Vangl2, impliqué dans la voie Wnt/PCP (polarité cellulaire planaire) interagit directement avec MuSK (Boëx et al., 2022).
De nombreux composants de la matrice extracellulaire (MEC) ont des rôles régulateurs importants dans la myogenèse et la synaptogenèse. Au sein de la lame basale synaptique, les molécules de la MEC aident à guider le processus d’innervation et sont essentielles à la formation de la densité post-synaptique ainsi qu’à l’organisation et au maintien des appositions fonctionnelles des éléments pré- et post-synaptiques. Le complexe glycoprotéique associé à la dystrophine (DGC), à travers sa sous-unité α-dystroglycane, organise un échafaudage fonctionnel dans la lame basale comprenant du perlecan, de l’acétylcholinestérase/ColQ et de la laminine qui stabilise les clusters AChR (Jacobson et al., 2001). La DGC relie en outre des réseaux de laminines et de collagènes entre eux et les ancre à la membrane plasmique musculaire par le sous-complexe sarcoglycane-sarcospan et au cytosquelette intracellulaire par la dystrophine (Jacobson et al., 2001). Les souris dépourvues de ColQ, de collagène XIII, de collagène IV ou de collagène VI présentent également des terminaisons nerveuses et/ou des JNM immatures (Sigoillot et al., 2016). Les patients atteints de la myopathie de Duchenne ont des mutations dans le gène codant la dystrophine qui est sur le chromosome X (ce qui explique que les garçons qui n’ont qu’un seul chromosome X sont nettement plus affectés que les filles).
Même une fois différenciées, les cellules musculaires peuvent répondre aux stimuli de leur environnement et ajuster leur taille et leur fonctionnement. Par exemple, à la suite d’une sollicitation importante, il y a une augmentation de la masse musculaire par croissance hypertrophique qui est médiée par une augmentation de la production globale de protéines (Bolster et al., 2003). À la base de ces changements on trouve l’activation de la kinase mTOR, qui phosphoryle la kinase S6K et 4E-BP, impliquées dans le contrôle de la traduction (Battaglioni et al., 2022; Csibi et al. ., 2010). mTOR a également été impliqué dans la régulation de la production de protéines en stimulant la biogenèse des ribosomes (Chaillou, 2019; Fyfe et al., 2018).
Les cellules souches musculaires adultes : les cellules satellites
Tout d’abord vous pouvez lire
un chapitre de présentation générale des cellules souches
Les cellules souches musculaires résidentes, appelées cellules satellites, sont situées entre la lame basale et la membrane plasmique des myocytes différenciés. Les cellules satellites fournissent des noyaux pour la croissance musculaire postnatale et l’hypertrophie musculaire, mais aussi des cellules pour la réparation et la régénération du tissu musculaire chez l’adulte.
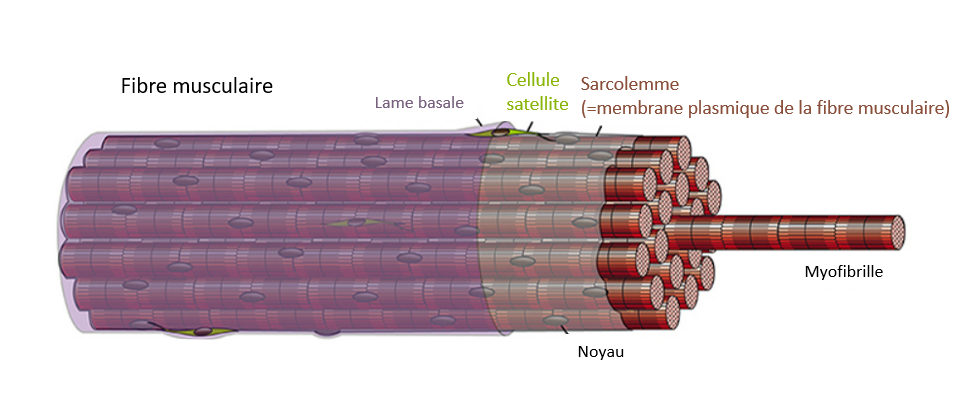
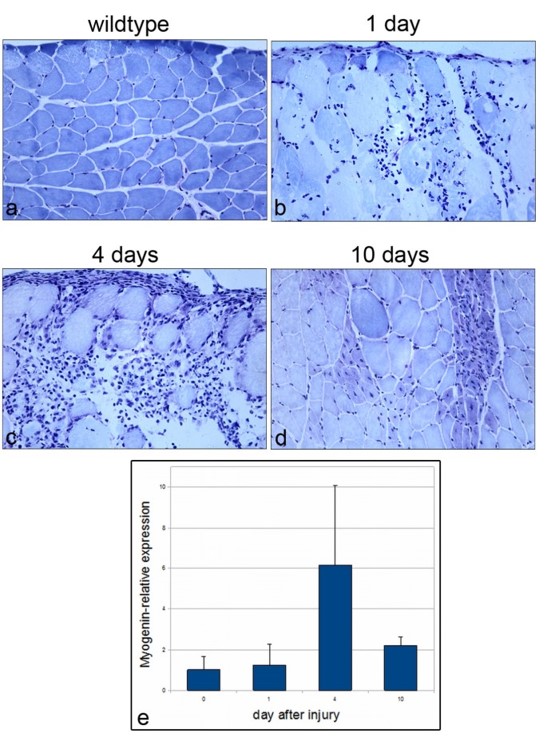
Durant le développement embryonnaire des muscles, un sous-ensemble de myoblastes exprimant Pax7 se localise sous la lame basale où ils finissent par devenir des cellules satellites (Dumont et al., 2015). Le facteur de transcription Pax7 est considéré comme le principal marqueur des cellules satellites quiescentes chez plusieurs espèces de Vertébrés et son expression est maintenue pendant la progression vers l’activation et la prolifération, avant une baisse d’expression au début de la différenciation myogénique (Berberoglu et al., 2017 ; Chen et al., 2006 ; Hammond et al., 2007 ; Seger et al., 2011 ; Zammit et al., 2006). Des mutations nulles pour Pax7 affectent gravement le maintien de cellules satellites et la régénération musculaire chez les Vertébrés (Berberoglu et al., 2017 ; Oustanina et al., 2004 ; Relaix et al., 2006). La voie de signalisation BMP est essentielle pour le maintien de l’expression de Pax7 dans les cellules satellites et dans les précurseurs musculaires en prolifération qui est essentielle pour empêcher l’engagement de ces cellules vers la différenciation (Friedrichs et al., 2011).
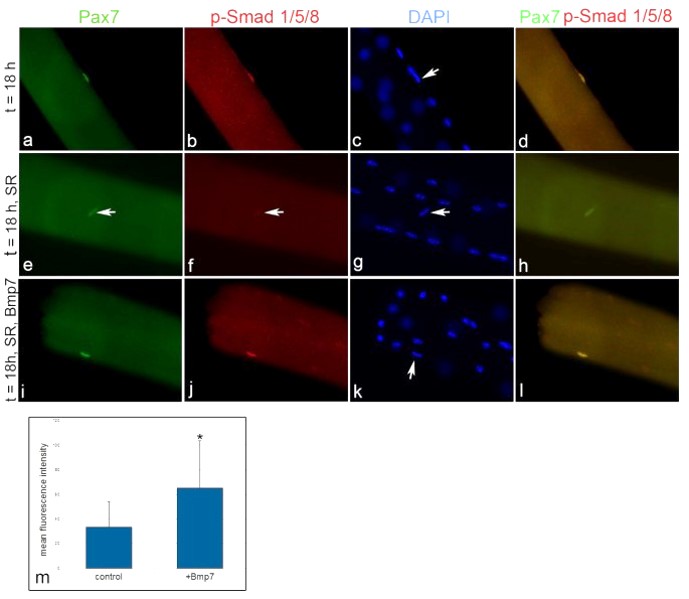
La différenciation des cellules est activée par Chordine qui empêche BMP4 d’agir sur son récepteur, comme lors de l’induction neurale ! L’augmentation des taux de BMP4 dans la dystrophie musculaire de Duchenne (DMD) peut exacerber les symptomes car pas assez de cellules se différencient pour compenser la perte des cellules à cause de la maladie (Shi et al, 2013).
Dans les cellules satellites, Pax7 se lie à sa séquence de reconnaissance sur l’ADN et y est stabilisé par une histone H3 avec une lysine 4 (H3K4) diméthylée. Il recrute alors l’histone méthyltransférase qui convertit H3K4 diméthylée en H3K4 triméthylée ce qui lui permet de passer à une phase de transcription active (McKinnell et al. 2008).
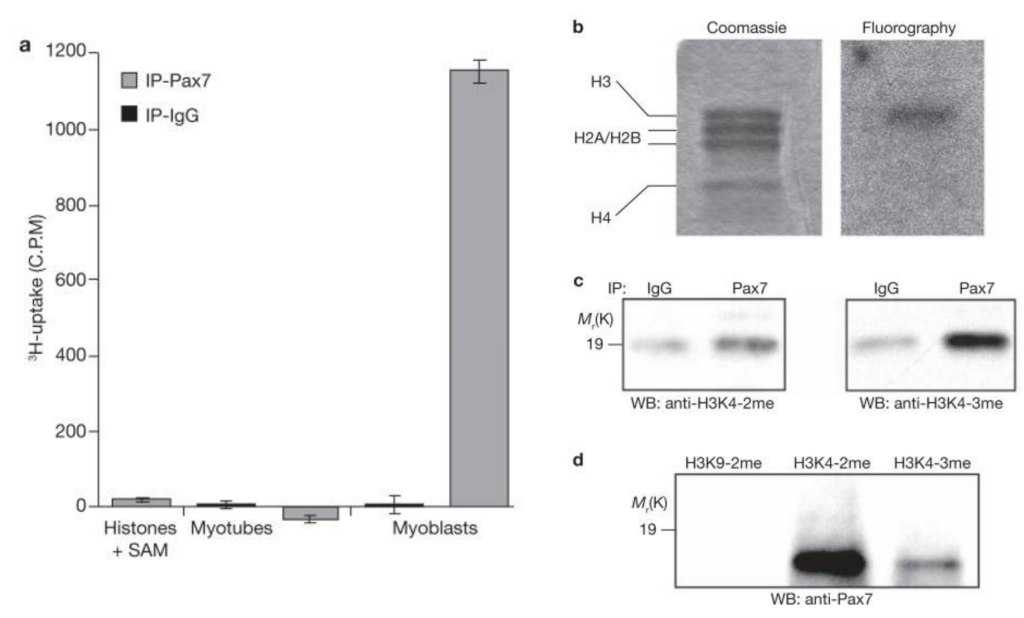
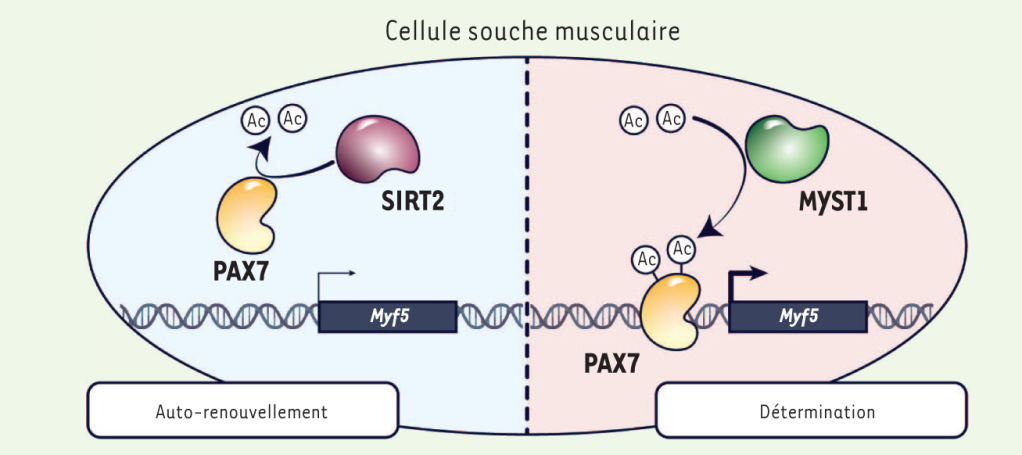
L’acétylation de Pax7 sur ses lysines 105 et 193 stimule ses capacités à activer la transcription des gènes cibles et notamment de Myf5 dont l’expression est augmentée dans les précurseurs musculaires alors que dans les cellules souches son expression est très faible. L’acétylation de Pax7 est éliminée dans les cellules satellites capables d’autorenouvellement par SIRT2 mais dans les précurseurs musculaires qui perdent leur caractère de cellules souches, MYST1 acétyle Pax7 sans que SIRT2 ne puisse éliminer cette modification post-traductionnelle, ce qui aboutit à l’activation de l’expression de Myf5 (Sincennes et al., 2021).
Les cellules satellites quiescentes ont peu de mitochondries activées et génèrent de faibles niveaux d’ATP (Rocheteau et al., 2012; Rodgers et al., 2014). Pour gérer les ressources énergétiques disponibles, les cellules satellites quescientes maintiennent probablement de faibles taux de synthèse des protéines, médiée en partie par la phosphorylation du facteur d’initiation de la traduction eIF2α (Zismanov et al., 2016). La phosphorylation de la sous-unité eIF2α du complexe eIF2 transforme eIF2 en un inhibiteur compétitif du facteur d’échange de nucléotides guanine eIF2B ce qui empêche le recyclage du complexe ternaire méthionyl-ARNt initiateur eIF2-GTP (eIF2-GTP-tRNAMet) nécessaire pour délivrer le premier acide aminé au ribosome. L’inactivation génétique de la phosphorylation de eIF2α (P-eIF2α) dans les cellules satellites conduit à une augmentation de la synthèse protéique globale, à l’activation du programme myogénique et à l’échec de l’auto-renouvellement.
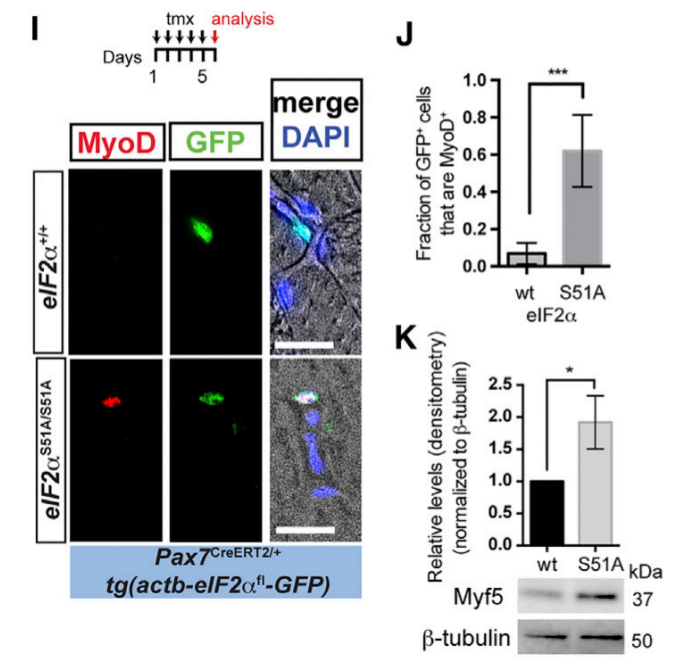
(J) Fraction des cellules GFP+ qui sont MyoD+ en (I). Western-blot contre Myf5 et la β-tubuline à partir de lysats cellulaires de cellules GFP+ triées à partir de souris exprimant la GFP dans les cellules satellites de souris sauvages ou mutantes comme précédemment après injection au tamoxifène. Les niveaux relatifs de Myf5 normalisés à la β-tubuline sont indiqués. Source : https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(15)00458-0
L’inhibition pharmacologique de la déphosphorylation de eIF2α avec la petite molécule sal003 maintient de faibles niveaux de synthèse protéique et permet l’expansion ex vivo de cellules satellites en culture qui conservent leur potentiel régénératif (Zismanov et al., 2016).
Tout en maintenant de faibles niveaux de synthèse des protéines, les cellules satellites au repos répriment également la traduction de facteurs de transcription spécifiques qui maintiennent les cellules satellites «amorcées» pour activer le programme myogénique et le cycle cellulaire. Les transcrits Myf5 sont réprimés par miR-31 et s’accumulent dans des granules d’ARN cytoplasmique (Crist et al., 2012), qui nécessitent par ailleurs P-eIF2α pour leur assemblage et leur maintenance (Zismanov et al., 2016). Les transcrits MyoD (Myod1) sont réprimés par l’activité des protéines de liaison à l’ARN TTP (ZFP36; Hausburg et al., 2015) et STAUFEN 1 (STAU1; de Morrée et al., 2017), et les facteurs nécessaires pour activer le cycle cellulaire, comme Dek, sont réprimés par miR-489 (Cheung et al., 2012).
Les cellules satellites sont au repos mitotique (quiescence) et activent le programme myogénique et le cycle cellulaire en réponse à une lésion musculaire. L’expression de MyoD qui n’était pas présente dans les cellules satellites est alors activée dans les nouveaux myoblastes en prolifération.
La MEC joue un rôle dans le réveil des cellules souches musculaires quiescentes en G0 et leur ré-entrée dans le cycle cellulaire. Par exemple, les lésions des muscles squelettiques (mêmes distantes) induisent la libération du facteur de croissance des hépatocytes (HGF) de la MEC environnante, ce qui amorce la prolifération des cellules souches musculaires (Rodgers et al., 2017). Notez que HGF est le ligand du récepteur c-Met et nous avions vu plus haut qu’il était aussi important pour le développement des myoblastes.
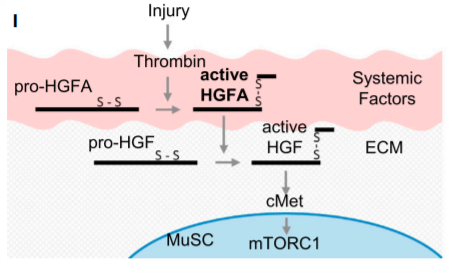
Le HGFA active circule dans le sang et catalyse le clivage du pro-HGF en HGF actif dans les tissus de tout le corps. Le pro-HGF est stocké notamment dans la MEC à proximité des cellules souches musculaires (MuSC) appelée aussi cellules satellites. Transformé en HGF actif, il va se lier au récepteur c-Met à la surface de ces cellules et les sortir de leur quiescence et les rendre prêtes à proliférer en cas de besoin. Source : https://www.cell.com/cell-reports/pdf/S2211-1247(17)30427-8.pdf
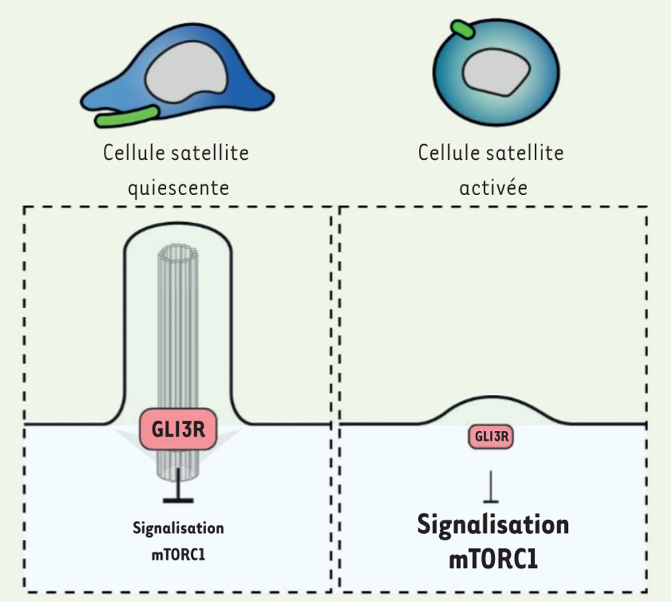
Les cellules satellites activées présentent aussi des cils primaires réduits par rapport aux cellules satellites quiescentes. Cela module le contrôle du facteur de transcription GLI3 sous sa forme répressive qui est peu abondant dans les cellules activées alors qu’il est très abondant dans les cellules quiescentes. Cette baisse de quantité de la forme répressive de GLI3 permet d’activer à un haut niveau la voie de signalisation mTORC1 ce qui active la synthèse protéique et le métabolisme des cellules satellites activées.
Les cellules satellites activées présentent une capacité proliférative remarquable et permettent d’augmenter rapidement la population de progéniteurs myogéniques nécessaires pour régénérer efficacement le muscle. De plus, cette phase proliférative est marquée par des divisions cellulaires symétriques, qui entraînent l’expansion du pool de cellules satellites, et des divisions cellulaires asymétriques, médiées en partie par une voie de signalisation EGFR-AuroraA kinase, qui assurent juste l’auto-renouvellement des cellules satellites sans expansion (Wang et al. , 2019).
Des protéines impliquées dans la régulation du cytosquelette peuvent aussi être impliqués dans le développement des cellules satellites. La cofiline est une protéine modulatrice de l’actine intracellulaire qui se lie et dépolymérise l’actine F filamenteuse et inhibe la polymérisation de l’actine G monomère d’une manière dépendante du pH. Le gène CFL2 code une isoforme de la cofiline spécifique du muscle squelettique localisée dans les filaments minces, où il exerce son effet sur l’actine, en partie par le biais d’interactions avec les tropomyosines. Son expression est modulée par la méthylation de son promoteur au cours du développement musculaire. Elle est exprimée dans les cellules satellites quiescentes, éteintes lors de la prolifération des cellules satellites activées puis réexprimées par la suite lors de la différenciation. Une étude in vitro sur des cellules satellites du poulet montre que son inhibition forcée dans les cellules satellites active leur prolifération et inhibe l’apoptose (Ran et al., 2021).
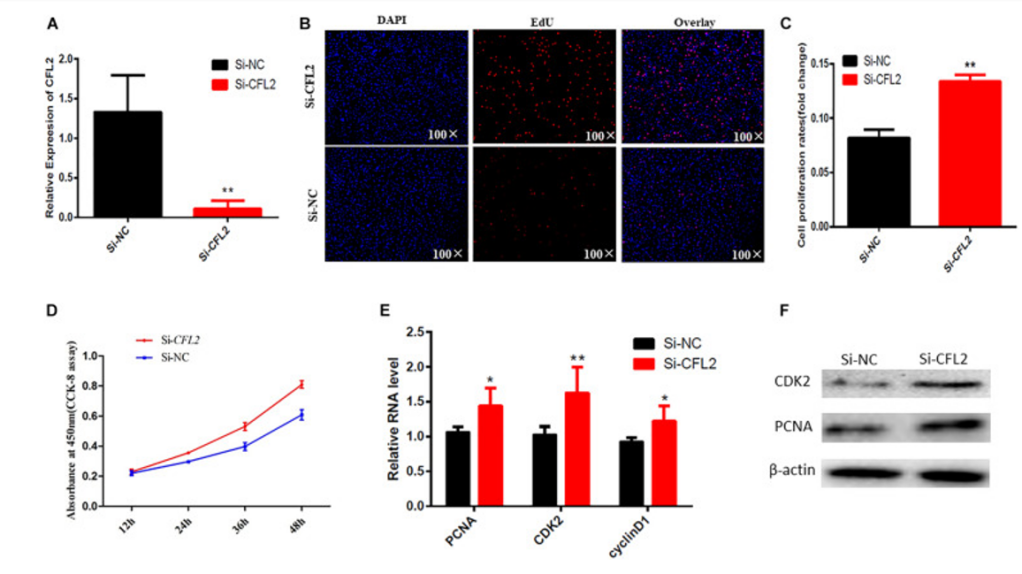
Des études récentes ont révélé que les cellules satellites sont une population fonctionnelle hétérogène dans différents muscles et dépendant non seulement des types de fibres mais aussi de l’origine embryonnaire. Ainsi, les cellules satellites isolées du muscle extensor digitorum longus (EDL), qui proviennent du somite, sont différentes dans leur détermination, de leur différenciation et leur auto-renouvellement par rapport aux cellules satellites du muscle masséter (MAS) qui proviennent du mésoderme crânien. Les cellules satellites du muscle nasopharyngien de la tête prolifèrent constitutivement et contribuent au renouvellement myonucléaire sans lésion musculaire, alors que ces phénomènes sont rarement observés dans les muscles des membres. L’hétérogénéité de la population de cellules satellites parmi les muscles peut donc être à l’origine de phénotypes physiopathologiques spécifiques régionaux des maladies musculaires où certains muscles sont plus rapidement affectés que d’autres.
La base de ces différences de comportement réside dans des programmes génétiques légèrement différents selon la localisation et l’origine du muscle. Par exemple, Hoxa10 est exprimé dans les cellules satellites des membres mais pas dans les cellules satellites de la tête. Le gène Hox exprimé dans les cellules satellites correspond bien au gène Hox exprimé dans les cellules musculaires différenciées voisines ce qui permet aux cellules satellites de garder la mémoire de leur position et des caractéristiques des muscles qu’elles vont régénérer (Yoshioka et al., 2021).
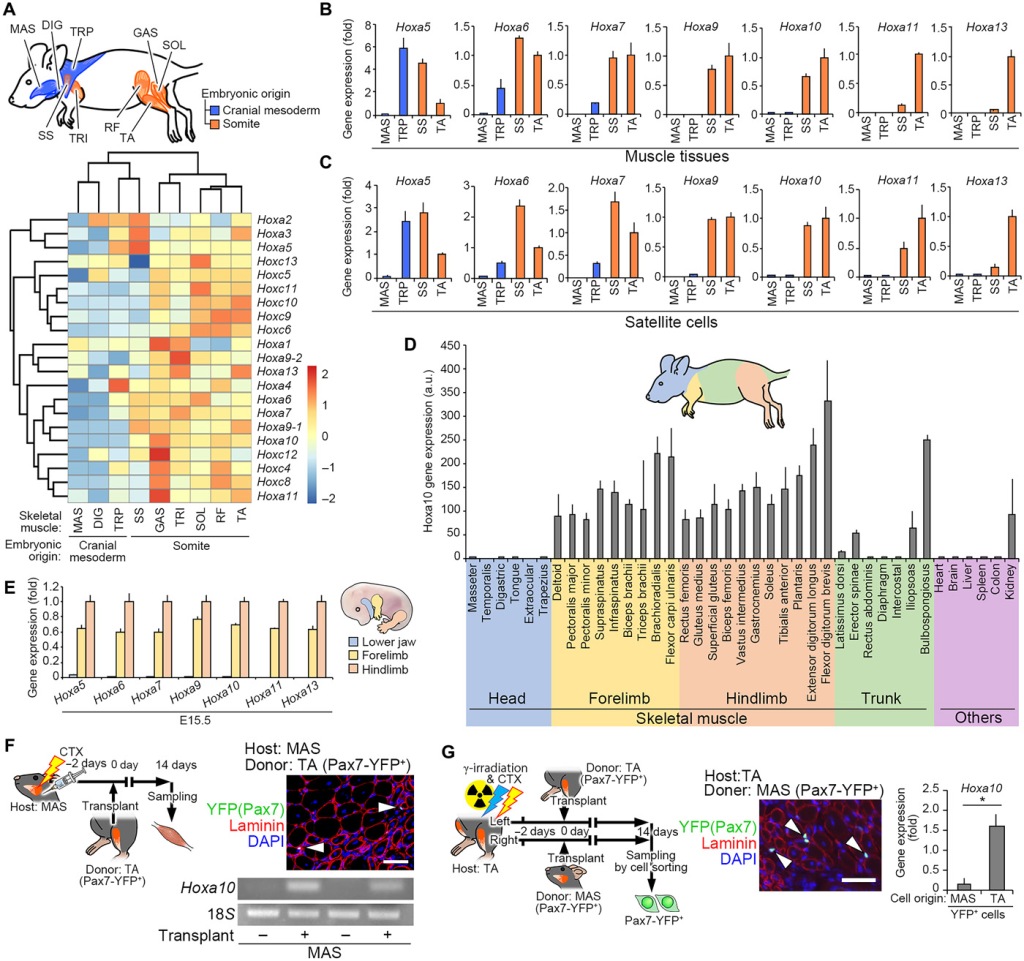
(A) Schéma des muscles de la tête dérivés du mésoderme crânien et des muscles des membres dérivés des somites chez la souris adulte. La carte thermique (heatmap) générée à partir de l’analyse des puces à ADN montre les patrons d’expression des gènes de cluster Hox-A et Hox-C. (B et C) Analyse RT-qPCR des gènes Hoxa5-13 exprimés dans les tissus musculaires (B) et les cellules satellites en culture (C) chez des souris adultes. (D) Analyse RT-qPCR de l’expression du gène Hoxa10 dans les tissus musculaires, notamment la tête, les membres antérieurs, les membres postérieurs, le tronc et d’autres organes de souris adultes. a.u., unités arbitraires. (E) Analyse RT-qPCR de l’expression du gène Hoxa5-13 dans la mâchoire inférieure, les membres antérieurs et postérieurs à E15.5. Les muscles adultes et leurs cellules satellites conservent des identités régionales basées sur l’expression des gènes Hox dont la distribution récapitule presque parfaitement leur origine embryonnaire, que nous appelons « mémoire positionnelle ». (F) Illustration schématique du test de transplantation. Des homogénats de muscle TA (donneur : souris Pax7-YFP) ont été greffés dans du muscle MAS (hôte : souris WT) pré-blessé avec une injection de CTX. Image immunohistochimique représentative des sections transversales MAS pour la laminine, YFP (Pax7) et DAPI. Barre d’échelle, 50 µm. Une image représentative d’une électrophorèse sur gel d’agarose contenant des produits PCR des gènes Hoxa10 et 18S 14 jours après la transplantation. (G) Illustration schématique du test de transplantation. Des tissus musculaires TA (hôte : souris WT) ont été localement exposés à 18 Gy d’irradiation et injectés de CTX avant la transplantation d’homogénats de tissus musculaires MAS ou TA (donneur : souris Pax7-YFP). Barre d’échelle, 50 µm. Des cellules satellites YFP+ greffées ont été re-triées à partir de muscles TA de souris hôtes 14 jours après la transplantation. Analyse qPCR pour l’expression du gène Hoxa10. Dans tous les cas de transplantation, les cellules satellites maintiennent leur identité régionale montrant que le programme génétique régionalisé est définitivement déterminé. Source : https://www.science.org/doi/10.1126/sciadv.abd7924
Signalons que les cellules satellites dépendent pour leur développement d’autres cellules de leur niche. Bien évidemment, les cellules musculaires striées squelettiques voisines agissent sur elles et maintiennent leur quiescence ou inhibent la différenciation des cellules issues des cellules satellites. On a mis en évidence certaines molécules de signalisation paracrine produites par les cellules musculaires différenciées à destination des cellules satellites comme Dkk3 (Dickkopf-3), un inhibiteur de la voie Wnt et qui restreint la régénération musculaire. Lorsqu’un muscle est lésé, la production de Dkk3 diminue fortement ce qui lève cette inhibition et les cellules satellites peuvent sortir de leur quiescence. En cas d’obésité ou de diabète de type 2, cette baisse de l’expression de Dkk3 se fait moins bien ce qui porrait expliquer la capacité atténuée des patients atteints de ces pathologies à régénérer leurs muscles (Xu et al., 2023).
Un type de cellule mésenchymateuse appelé progéniteur fibroadipogénique (FAP) dans le tissu musculaire squelettique et qui génère des cellules graisseuses blanches semble important pour maintenir les capacités des cellules satellites dans le temps, sans doute via un effet paracrine (Formicola et al. 2014). La présence accrue de FAP dans la niche des cellules satellites a des effets anti-épuisements de ces cellules souches et elle réduit les effets des dystrophies musculaires de Duchenne (Formicola et al. 2014). Justement dans de nombreuses maladies musculaires, telles que la dystrophie musculaire de Duchenne et lors de la sarcopénie qui accompagne le vieillissement, l’abondance et la capacité de régénération des cellules satellites sont diminuées, ce qui entraîne une altération de la régénération musculaire et une perte nette de la masse musculaire (Brack et Muñoz-Cánoves, 2016). Tout mécanisme permettant de freiner cette évolution est donc d’un intérêt thérapeutique important.
Un point intéressant sur l’évolution des muscles chez l’Homme
La formation de chaque muscle individuel est étroitement réglementée et, en général, se produit avec un haut degré de fidélité. Cela se reflète dans la symétrie miroir des muscles formés sur les côtés gauche et droit du corps. Cependant, des variations peuvent survenir et les muscles peuvent être absents ou il peut y avoir des variations mineures de la taille des muscles et/ou des sites d’insertion, non seulement entre les individus mais aussi au sein d’un individu, entre les côtés droit et gauche du corps. L’un des muscles les plus variables, le fléchisseur de l’avant-bras, le long palmaire (PL), est absent chez 15% de la population. Il est intéressant de noter que cette incidence varie selon les ethnies, chez les femmes et dans l’avant-bras gauche par rapport à droite. Chez les animaux tétrapodes, le PL est impliqué dans la mise en charge des membres supérieurs lors des déplacements à quatre pattes, rôle qui est réduit chez les Homo sapiens bipèdes. L’état sous-développé ou l’absence du PL chez l’homme correspond probablement à la régression progressive d’un organe vestigial. D’un point de vue développemental, on ne sait pas si l’absence de PL est causée par la régression d’un faisceau musculaire naissant ou si un précurseur du muscle mature ne se forme jamais.
La production de cellules musculaires striées à partir de cellules souches induites
Les dérivations de cellules musculaires striées squelettiques à partir des cellules iPS humaines relèvent généralement de l’une des deux approches suivantes : l’utilisation de transgènes dans lesquelles les iPS sont directement reprogrammées dans des cellules progénitrices myogéniques par surexpression de facteurs de transcription spécifiques au muscle (Kodaka et al., 2017) ou l’administration de petites molécules, telles que des inhibiteurs de FGF2 et de GSK3β, qui activent ou inhibent les voies de signalisation myogéniques (Jiwlawat et al., 2018).
Les approches basées sur les transgènes génèrent des progéniteurs myogéniques à partir des iPS ou de leurs dérivés mésodermiques par surexpression transitoire ou constitutive de gènes-maîtres régulateurs de la myogenèse, tels que PAX7 ou MYOD1. La surexpression de gènes myogéniques exogènes a été réalisée par transfection d’ARNm, ainsi que par transduction avec des adénovirus ou des lentivirus. Grâce à ces méthodes, jusqu’à 90 % des cellules s’engagent dans une identité myogénique et peuvent se différencier en cellules progénitrices des cellules musculaires striées. L’utilisation de gènes rapporteurs de fluorescence co-exprimés avec des facteurs de transcription peut permettre une purification supplémentaire des cellules par tri cellulaire activé par fluorescence (FACS) (Rao et al., 2018). Alternativement, l’activation de facteurs de transcription endogènes (par exemple, PAX7) à l’aide de la méthodologie CRISPR/Cas9 peut conduire à une reprogrammation épigénétique stable des iPS et à la génération de cellules progénitrices myogéniques (Kwon et al., 2020). Les progéniteurs résultants dérivés à l’aide d’approches basées sur les transgènes survivent et sont fonctionnels lorsqu’ils sont implantés dans des souris immunodéprimées (Kwon et al., 2020), tandis que les tissus modifiés en 3D générés à partir de ces cellules peuvent devenir des muscles fonctionnels avec la capacité de survivre et de se contracter in vivo (Rao et al., 2018). Néanmoins, ces méthodes de différenciation ne reflètent pas un développement normal et malgré la capacité d’obtenir un grand nombre de progéniteurs myogéniques humains, les préoccupations réglementaires concernant la modification génétique des cellules peuvent limiter leur utilisation thérapeutique potentielle (Jiwlawat et al., 2018).
Une deuxième approche, connue sous le nom de différenciation dirigée, imite le développement myogénique par l’ajout séquentiel de petites molécules pour activer ou supprimer des voies de signalisation spécifiques. Par exemple, CHIR-99021 active la signalisation WNT via l’inhibition de GSK3β, LDN-193189 inhibe la signalisation BMP, et HGF et IGF1 activent leurs voies de signalisation respectives (Chal et al., 2016).
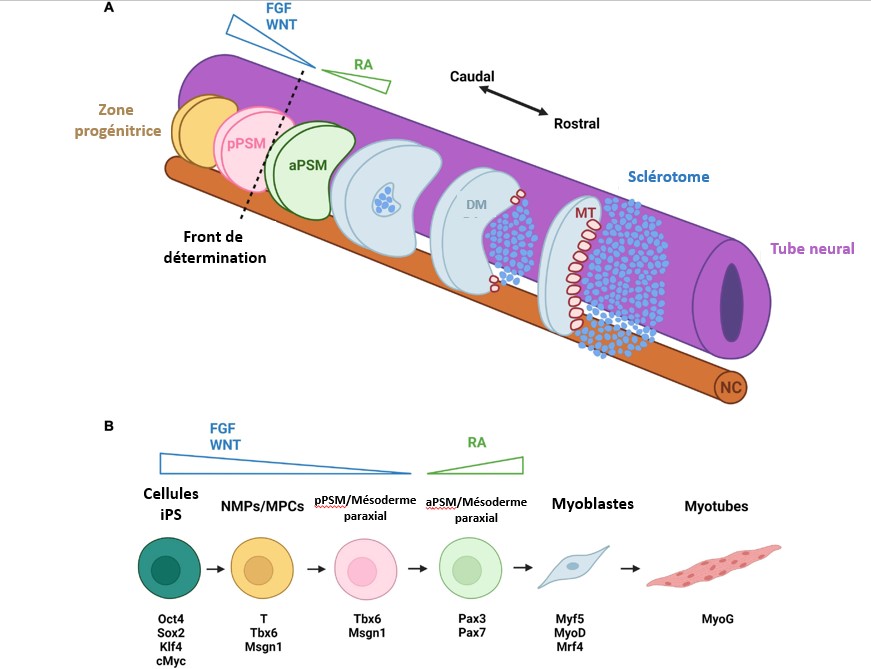
Les protocoles de différenciation dirigée nécessitent un temps de culture beaucoup plus long et présentent des rendements considérablement plus faibles et une plus grande hétérogénéité des cellules myogéniques par rapport aux méthodes basées sur les transgènes (Kodaka et al., 2017 ; Jiwlawat et al., 2018). La pureté des progéniteurs myogéniques peut être augmentée en triant les cellules à l’aide de marqueurs de surface cellulaire tels que CDH13 (Nalbandian et al., 2021), FGFR4 (Nalbandian et al., 2021), ERBB3 et NGFR. Cependant, l’utilisation de FACS diminue encore le rendement cellulaire. Des protocoles récents pour l’expansion et la cryoconservation de progéniteurs myogéniques dérivés de iPS triés par FACS peuvent offrir des moyens d’obtenir des quantités de cellules nécessaires pour des applications thérapeutiques (van der Wal et al., 2018).
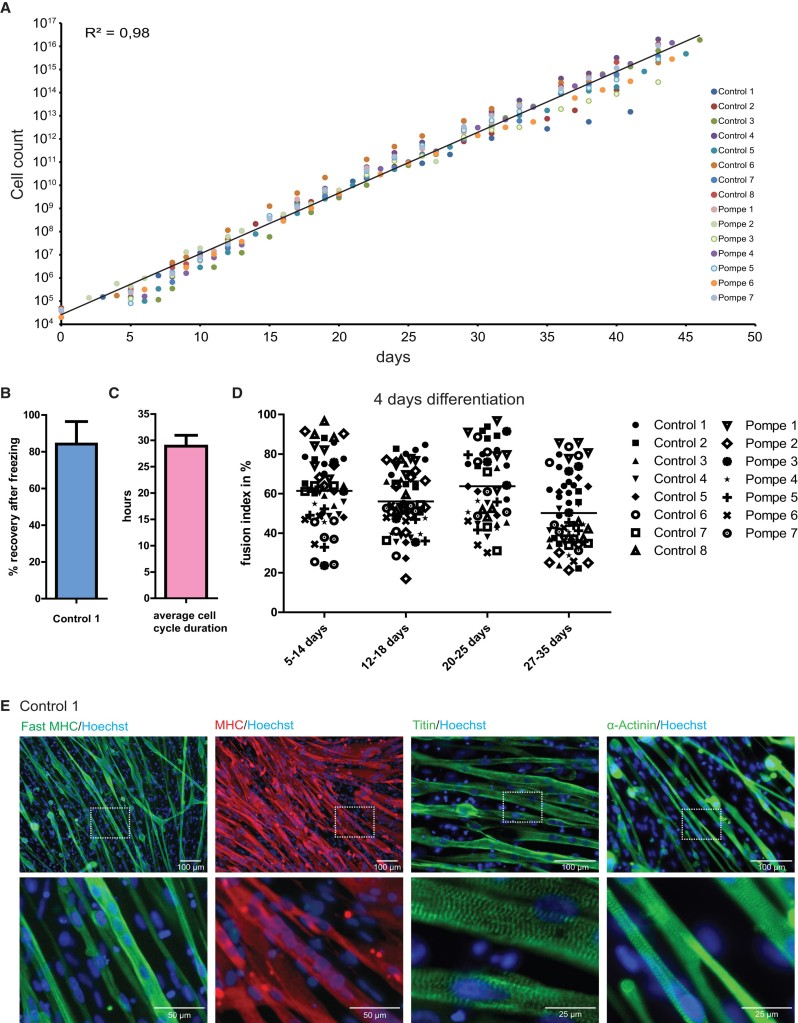
(A) Courbes de prolifération de progéniteurs myogéniques dérivés de 15 lignées iPS dérivées de témoins sains ou de patients atteints de la maladie de Pompe (une maladie métabolique musculaire), cultivés dans un milieu de prolifération. Une ligne de tendance exponentielle a été tracée et un R2 a été calculé à partir de tous les points de données, qui ont montré des taux de prolifération similaires pour toutes les lignées cellulaires.
(B) Récupération des progéniteurs myogéniques de contrôle de la congélation. Les données sont des moyennes ± SD de trois cultures indépendantes.
(C) Durée moyenne du cycle cellulaire de toutes les lignées cellulaires indiquées en (A). Les données sont des moyennes ± SD de toutes les lignées cellulaires indiquées en (A).
(D) Après expansion pour le nombre de jours indiqué sur l’axe X, la différenciation des muscles squelettiques a été induite pendant 4 jours en passant au milieu de différenciation. L’indice de fusion a été quantifié après coloration pour le CMH et le Hoechst. Les valeurs individuelles des champs aléatoires par lignée cellulaire (n = 3 à 5 champs par lignée cellulaire) sont représentées sous forme de symboles. Les valeurs moyennes de toutes les lignées cellulaires par période d’expansion sont indiquées sous forme de lignes horizontales.
(E) Au jour 8 de différenciation, les myotubes ont encore maturé comme indiqué par l’immunomarquage du MHC (chaine lourde de la myosine), de la titine et de l’alpha-actinine, ainsi qu’un motif strié caractéristique et des contractions spontanées (visibles sur des vidéos). Les noyaux colorés au Hoechst sont en bleu. Source : https://www.cell.com/stem-cell-reports/fulltext/S2213-6711(18)30154-1
Des analyses transcriptomiques ont montré que les progéniteurs myogéniques dérivés de iPS sont immatures sur le plan du développement et arrêtés entre les stades des cellules souches musculaires embryonnaires et fœtales (Nayak et al., 2021). Néanmoins, ils peuvent fusionner avec succès dans des myotubes qui présentent des comportements fonctionnels clés des cellules différenciées, y compris la génération de flux transitoires de calcium et de force contractile et une réponse robuste à l’acétylcholine (Skoglund et al., 2014; Rao et al., 2018), bien qu’à des niveaux inférieurs par rapport aux myotubes humains primaires (Rao et al., 2018). De nouvelles avancées dans la maturité des cellules musculaires striées squelettiques dérivées des iPS conduiront à une meilleure modélisation des maladies humaines in vitro.
Des start-up de biotechnologies se sont lancés dans la production de viande in vitro à partir de cellules souches bovines (voir ici un exemple). La faisabilité est démontrée mais le défi reste la production à grande échelle et le coût (le premier burger avec du steak haché entièrement développé en laboratoire avait coûté 300.000 $ en 2013). Il reste que c’est une solution pour lutter contre la production de gaz à effet de serre qui est problématique dans l’élevage bovin.
LA CARTE MENTALE
Lien vers des exercices sur le développement des cellules musculaires
AUTRE RESSOURCE :
Page sur la contraction musculaire sur le site Planet-Vie
Page sur la différenciation des cellules musculaires sur le site Planet-Vie
Conférence de Margaret Buckingham à l’Académie des Sciences
EN DIRECT DES LABOS :
Rôle de FGF19 pour lutter contre la perte de masse musculaire
QUELQUES EQUIPES DE RECHERCHE FRANCOPHONES QUI TRAVAILLENT SUR LE SUJET :
Développement et fonction du système neuromusculaire – IGFL Lyon
- Adhérences cellule-cellule
- Arabidopsis thaliana
- Axe antéro-postérieur chez la drosophile
- Caenorhabditis elegans
- Concepts principaux
- Contrôle de la traduction
- Contrôle de la transcription
- Contrôle génétique et épigénétique
- Croissance et guidage axonal
- Des modèles animaux moins classiques
- Développement de l’oeil des Vertébrés
- Développement et évolution
- Et l’Humain ?
- Exercices sur l’ovogenèse, la spermatogenèse et la fécondation
- Exercices sur le contrôle de l’expression des gènes
- Exercices sur le développement des bourgeons de membre
- Exercices sur le développement des muscles striés squelettiques
- Exercices sur les cycles et les divisions cellulaires
- Exercices sur les étapes du développement, les inductions embryonnaires et la mise en place des axes de polarité
- Exercices sur les matrices extracellulaires, le cytosquelette et les adhérences cellule-cellule
- Exercices sur les voies de signalisation
- Glossaire
- Glossaire des termes liés à la génétique
- Glossaire des termes liés au cytosquelette, la matrice extracellulaire, l’adhérence et la migration cellulaire
- Hématopoïèse et développement des cellules du système immunitaire
- Histoire de la biologie cellulaire et de la biologie du développement
- L’acide rétinoïque
- L’apoptose
- L’organogenèse
- L’ovogénèse prépare le développement embryonnaire
- La drosophile
- La fécondation
- La formation des somites
- La gastrulation
- La métamorphose chez les Hexapodes et les Amphibiens
- La neurogénèse chez les mammifères adultes
- La neurulation
- La poule
- La souris
- La superfamille TGFβ et ses voies de signalisation
- La voie de signalisation de l’auxine et ses rôles
- La voie de signalisation Hedgehog
- La voie de signalisation Hippo et ses composants YAP/TAZ
- La voie de signalisation Notch
- Le clivage
- Le cytosquelette
- Le destin des cellules et les réseaux de régulation génique
- Le développement des bourgeons de membre
- Le développement des organes génitaux et des cellules germinales
- Le développement du cortex
- Le méristème apical caulinaire en phase végétative et lors de la formation d’une fleur
- Le poisson zèbre
- Le xénope
- Les cellules des crêtes neurales
- Les cellules et les gènes en action dans le développement
- Les cellules souches
- Les cellules tumorales
- Les cycles et les divisions cellulaires
- Les étapes du développement
- Les étapes du développement embryonnaire d’Arabidopsis thaliana et leur contrôle
- Les inductions embryonnaires et les gradients de morphogène
- Les matrices extracellulaires animales
- Les organismes modèles
- Les outils pour étudier l’expression et la fonction des gènes
- Les parois des cellules végétales
- Les techniques et les outils pour la biologie cellulaire
- Les transitions épithélio-mésenchymateuses et les migrations cellulaires
- Les vésicules extracellulaires
- Les voies de signalisation
- Les voies de signalisation FGF
- Mise en place des axes chez les Vertébrés
- Structures et processus cellulaires
- Voies de signalisation WNT