HS的遗传方式较为复杂。主要是常染色体显性遗传(约占75%),其次是常染色体隐性遗传(约占25%)和不典型性遗传。基因位于8号和12号染色体短臂上。也有部分HS缺乏明显的家族史,与基因突变有关,其后代约一半患HS。
遗传方式上的多样性造成临床表现不同。即使在同一个家系中,有些患病个体溶血程度会有很大差异。典型的常染色体显性遗传纯合子患者很少,可能因致命的重度贫血而难以生存。HS有较高的自发性基因突变率,新生突变多发生在CpG岛(基因组中富含CpG的单拷贝非甲基化基因座),导致缺失或插入,以常染色体隐性遗传方式传给后代。
球形红细胞的形成是由于膜蛋白垂直与水平连接的缺陷导致膜脂微囊泡自发释出,也因脾脏的作用使红细胞膜组分进一步丢失的结果。构建膜蛋白垂直和水平连接的主要组分是血影蛋白,与之相连的是锚蛋白、带3蛋白、带4.1蛋白和带4.2蛋白(前述),并由此构成两种球形化机制:血影蛋白或锚蛋白缺陷途径所致的和带3蛋白或带4.2蛋白缺陷途径导致带3蛋白缺乏所致的细胞球形化机制(图1)。因此,这些膜蛋白的缺失影响膜骨架网络与脂质双层膜的水平连接,使未被骨架连接(支持)的脂质区侧向移动,向外 “生芽”形成膜泡状突起并以脂质微囊泡形式释出,导致红细胞膜的完整丢失,表面积减少,再由大球形细胞再变成小球形细胞。
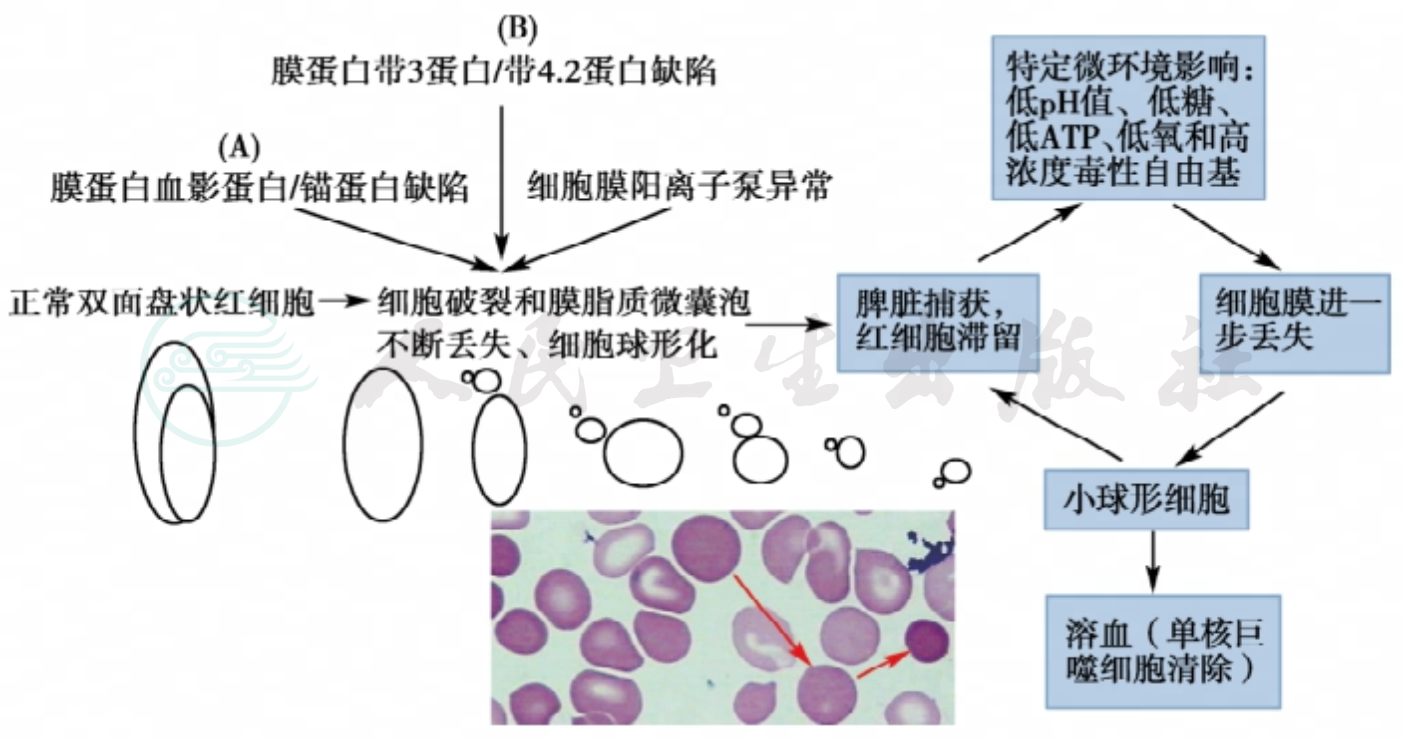
图1 红细胞球形化和脾的作用
注:HS红细胞的特点是细胞膜表面积的减少,膜表面积的减少是由膜脆性增加引起,脆性增加又是膜蛋白缺陷使膜囊泡化和释放,导致细胞球形变;A为血影蛋白或锚蛋白缺陷致使膜骨架蛋白密度减低,脂质双层失去稳定性并释放含有带3蛋白的微囊泡;B为带3蛋白或带4.2蛋白缺陷导致带3蛋白缺乏,脂质稳定性也丧失,释放不含带3蛋白的微囊泡;A、B途径的结果均使红细胞膜丢失、表面积减少、细胞球形化、变形性降低,这一异常红细胞在脾脏被捕获或滞留,并在脾脏不利的环境中促使红细胞膜进一步的丢失而形成更为典型的小球形细胞;红色箭头示意球形红细胞有大到小的变化。
另一方面,红细胞内侧膜的缺陷,使钠钾-ATP酶或钙镁-ATP酶等阳离子泵功能异常,细胞内钠钙滞留,渗透压增高,水分进入增加,消耗更多的ATP,使细胞容积增加而膜表面积相对缺失,膜表面积/体积比进一步降低,也促使球形形成。
球形细胞的形成还与脾脏的微环境有关。脾脏微环境具有低pH、低糖、低ATP、低氧和巨噬细胞产生的局部高浓度毒性自由基的特定环境,均增加HS异常红细胞的代谢强度,促使红细胞膜的进一步丢失和球形形态的进一步形成(见图1)。HS红细胞在脾索平均滞留10~100分钟,进入脾脏的血液有1%~10%滞留在充血的脾索,其余的血流快速进入静脉循环。经过脾脏而逃逸的HS红细胞呈现典型的深染小球形红细胞或中央浅染区消失的小红细胞。球形细胞是变形性降低的较为僵硬的细胞,脾脏是破坏球形细胞的主要脏器。膜表面积减少的球形细胞因不能通过脾窦而被扣留、蓄积于红髓,使红髓充盈肿大是HS脾大的病理基础。
脾切除后球形红细胞有所减少或依然存在,但红细胞被过早破坏的过程停止。
HS的病因主要是红细胞膜的遗传性缺陷,但其异常方式和机制较为复杂。正常红细胞膜是由双层磷脂和多种膜蛋白与膜骨架蛋白构成。膜骨架蛋白主要有血影蛋白(收缩蛋白)、锚蛋白、带4.1蛋白、带4.2蛋白、带4.3蛋白和肌动蛋白。膜骨架蛋白通过锚蛋白(一部分通过带4.1蛋白)固定于脂质双分子层中,带4.1蛋白通过带4.3蛋白或锚蛋白的结合而加固上述蛋白的连接。HS患者红细胞膜骨架蛋白由于基因突变而表达缺失(表1)。大多数锚蛋白突变为移码突变或无义突变,导致锚蛋白分子缺陷、锚蛋白缺乏或者两者都有。结果使未被膜骨架蛋白支持的膜脂质丢失,膜表面面积减少(相当于细胞体积出现减少或相对性减少),变形性降低,同时红细胞膜通透性增加、钠水滞留、细胞的双凹盘形增厚,向球形细胞发展。这些异常红细胞被脾脏扣留和吞噬,最终导致溶血和贫血。
表1 HS的分子病因(膜蛋白垂直作用障碍)

红细胞渗透脆性是通过红细胞在渗透压逐渐降低的盐溶液中的溶解程度而显示的红细胞特征。正常红细胞由于胞膜的盈余使得细胞呈现圆盘状和丰富的表面积,能通过膨胀增大容积,具有一定的抗脆性度,而球形细胞的容积已达其相应表面积的最大程度,故比正常红细胞破裂所需浓度高的盐水溶液中即被破坏。红细胞脆性增高是HS球形细胞增多的一个实验室特征。一些HS红细胞脆性试验(新鲜血液标本)正常,而血液经过温育后(37℃,24小时)再进行红细胞脆性试验,则明显增高,曾被看为诊断HS的一个标准试验。这是由于HS红细胞在温育后加重了原本存在的膜渗漏和不稳定性缺陷,使得其比正常红细胞更易丢失膜表面积而显露出脆性方面的缺陷,红细胞脆性明显增高。
(一)膜蛋白缺陷的种类
导致HS的膜蛋白缺陷有多种:血影蛋白(收缩蛋白、谱蛋白)、锚蛋白、带3蛋白(溶质载体家族4阴离子交换体成员-1)、带4.1蛋白、带4.2蛋白、带4.9蛋白、Rh抗原缺乏以及不明原因的缺陷。常见的血影蛋白α、β基因分别位于1q22-23和14q23-24,锚蛋白基因位于8p11.2,带3蛋白位于17q21-22,带4.1蛋白位于1p33-34.2,编码带4.2蛋白的EPB42定位于15q15-21。这些基因突变的结果是相应的膜蛋白缺乏或异常。我国HS缺陷的膜蛋白多见的是带4.1蛋白,其次是血影蛋白和带3蛋白;欧美国家以锚蛋白、血影蛋白和带3蛋白的缺陷为多见,日本则以4.2蛋白缺陷为多见。
(二)膜蛋白的分子病变
易患血红蛋白病和红细胞酶病的特定人群有高频率的突变热点,而HS中分子缺陷极不一致。鉴定HS膜蛋白基因序列多为点突变,少数为mRNA加工异常或低表达等突变体,一般还有突变后发生的膜蛋白缺乏。
1.α血影蛋白缺乏
血影蛋白是红细胞膜骨架中含量最丰富和分子量最大的蛋白,由α、β两个亚单位组成异二聚体并进一步交联形成四聚体或更高级的交联体,自身交联缺陷是引起HE(包括遗传性热异形性红细胞增多症)的病因,复合杂合子或不影响α、β链自身交联的纯合子缺陷则引起严重的HS。因此,HS的部分患者有血影蛋白的缺乏。
α血影蛋白缺乏常见于常染色体隐性遗传HS。血影蛋白α链第969位Ala被Asp置换的点突变,可以发生正常α血影蛋白合成减少或分子不稳定。由于红系细胞中α血影蛋白的合成量是β血影蛋白的3~4倍,故一个等位基因失活仍可有正常量α血影蛋白与β血影蛋白结合成异二聚体被装配在膜上,临床上表现为无症状的分子缺陷携带。如果为α血影蛋白纯合子或双杂合子,则装配在膜上的血影蛋白明显减少,临床上表现为严重的溶血。
2.β血影蛋白缺乏
常见于常染色体显性遗传HS。血影蛋白β链第202位Trp被Arg置换而发生的点突变,使β血影蛋白合成减少或分子不稳定,失去了与带4.1蛋白的结合功能,同时影响到与肌动蛋白的结合。除了点突变,还有移码突变等。β血影蛋白缺乏的临床表现呈多样性。临床上,血影蛋白缺乏的严重程度与红细胞球形变程度、耐受剪切力的程度、溶血程度和切脾后的反应性相关。
3.锚蛋白缺乏
在常染色体隐性遗传和显性遗传HS中均有锚蛋白缺乏(约见于30%~60%的HS患者),约20%为新生突变(无家族史),也是典型显性遗传的HS最常见病因。锚蛋白通过血影蛋白-2.1-带3蛋白的连接成为血影蛋白垂直连接膜上的主要骨架(通过血影蛋白提供膜骨架的主要连接,通过带3蛋白提供膜脂质双层的连接),破坏这些连接的任何一个蛋白异常都可以导致细胞膜的稳定性降低。典型的HS最常见的原因是锚蛋白异常,突变多发生在锚蛋白基因编码区,少数在启动子上,结果都导致锚蛋白减少,成为红细胞膜稳定性降低的主要原因。当锚蛋白原发性缺乏时,连接的血影蛋白则出现继发性缺乏,两者同步缺陷的程度基本相等,两者同时缺乏较为常见。常染色体显性遗传HS这两种蛋白为轻度缺乏,隐性遗传HS这两种蛋白为重度缺乏。8号染色体锚蛋白基因位点发生缺失或易位时,还可以表现为智力发育迟缓、特殊面容和性腺发育不全。
4.带3蛋白缺乏
在HS中,带3蛋白缺乏仅见于常染色体显性遗传HS患者(约见于20%~40%的HS患者),有50余种突变。突变在带3蛋白的胞质区、穿膜区和膜外区三个结构域都有发生。在常见突变的穿膜区肽链上的多个精氨酸发生突变,影响带3蛋白合成后的折叠和插入内质网组装进入红细胞膜,从而影响二聚体(不能与带2.1蛋白结合)与四聚体(四聚体阴离子通道功能障碍)的转换,使异常的带3蛋白随膜脂微囊泡脱落而丢失。较多患者还伴有带4.2蛋白的缺乏。带3蛋白缺陷患者大多为杂合子,红细胞除了球形特征外,还易见蘑菇样或螯状形态,临床表现轻度至中度贫血。带3蛋白缺陷纯合子见于双亲为轻型HS,临床表现严重,可见新生儿水肿、严重贫血甚至危及生命,但此型很少见。
5.带4.2蛋白缺乏
带4.2蛋白缺陷见于常染色体隐性遗传HS,缺陷基因在日本人群中常见。带4.2蛋白通过多种方式(与带3蛋白结合稳定锚蛋白与带3蛋白的连接、与带4.1蛋白结合组成细胞骨架中的结合复合物等)维持膜骨架垂直与水平的连接,带4.2蛋白发生的点突变(如第142位的Ala被Thr置换)或移码突变,即可影响膜骨架蛋白与膜结合减弱,使膜丢失形成球形细胞、口形细胞等,临床上表现为轻度和中度贫血。继发性带4.2蛋白缺乏还见于带3蛋白突变和胆管梗阻患者。后者也可以出现红细胞的形态改变,如靶形、靴刺形(spur)。
6.带4.1蛋白缺乏
带4.1蛋白是细胞骨架与脂质双层相连的重要垂直连接点,也是膜骨架网络水平连接三联复合物(血影蛋白、肌动蛋白和带4.1蛋白)的主体组分。带4.1蛋白原发缺陷性HS,形态上表现球形和球口形,也可以呈咬痕样变化。国外报道的带4.1蛋白仅见于HE,但在部分HS中有继发性缺陷。
1.血红蛋白和红细胞相关指数
溶血发作时,Hb常在90g/L以下,MCV稍低、一半以上患者MCHC增高、RDW稍高。据报道,MCHC指标在诊断HS的敏感性为82%,特异性达98%。以MCV<80%,MCHC>354g/L和RDW>14%作为联合指标,诊断的敏感性为66%,特异性高达100%。
2.外周血球形细胞
血片有数量和大小不一的球形细胞,可以是轻度球形而红细胞仍有中心浅染区。一般为胞体小、圆形、深染、中央淡染区消失,细胞平均直径6.4μm(正常7.2μm)、平均厚度2.6μm(正常2.13μm)。通常HS的球形细胞在20%以上(图3),且球形细胞增多的程度与溶血的严重性有关。我国HS诊疗指南将球形细胞增多界定为>10%。
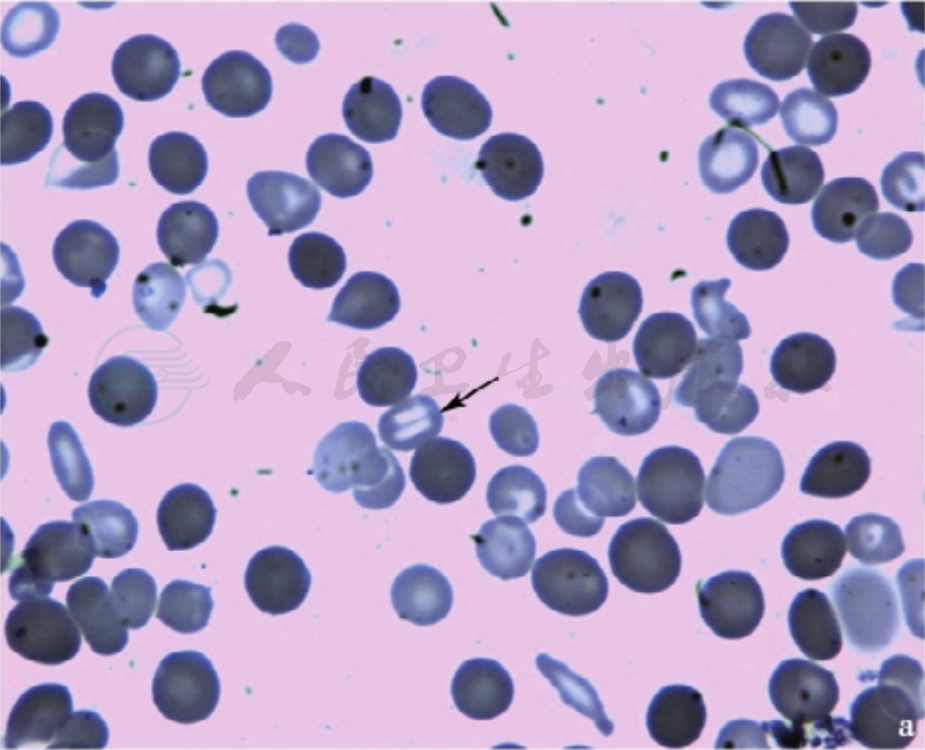
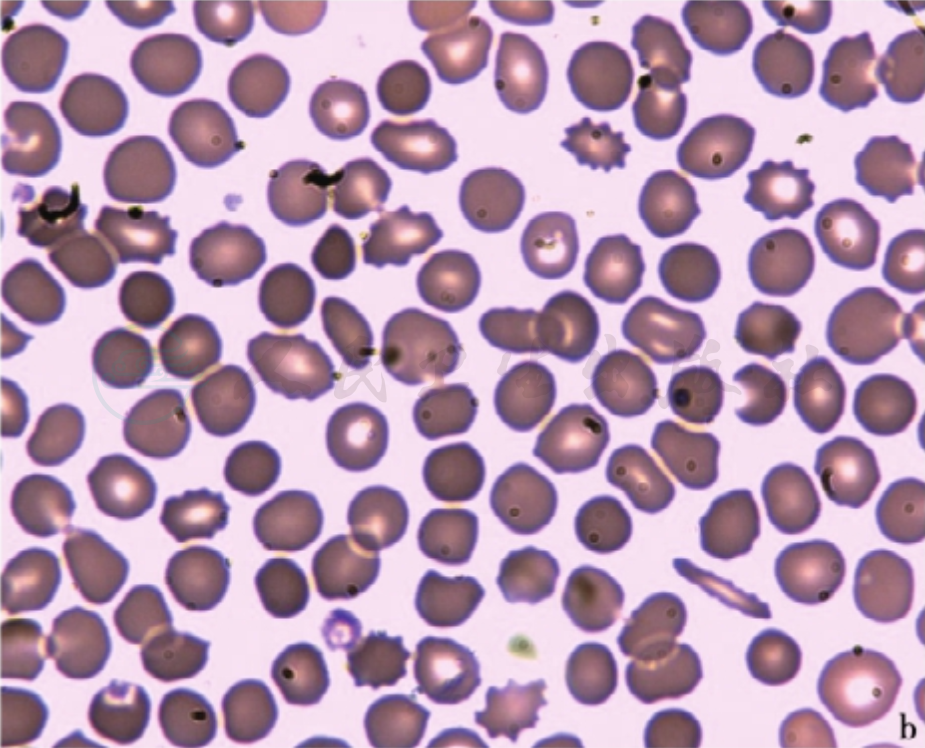
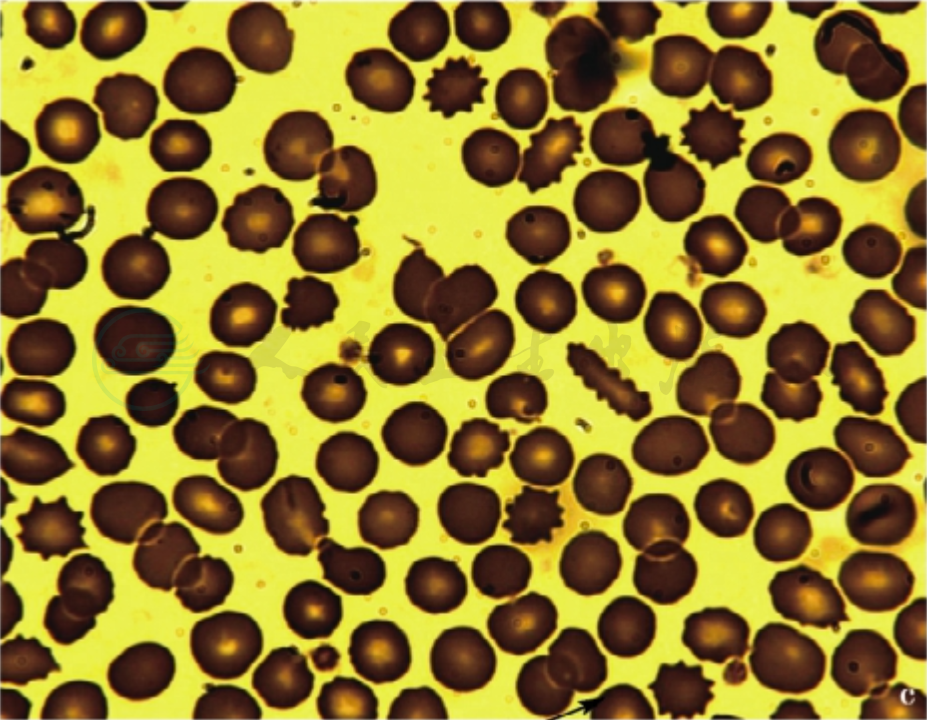

图3 外周血不同形态的球形细胞
注:a.除了许多典型球形细胞外,还见球口形红细胞(如箭头指处);b、c.除了许多典型球形细胞外,还见多个球棘形红细胞;d.显著大小不一的球形细胞,为3M6D的女性患儿,贫血(Hb 71~92g/L)和脾肿大(肋下1cm)3个月,白细胞和血小板计数正常,网织红细胞计数20.0%,Coombs试验阴性。骨髓中晚幼红细胞轻度增多(38%),球形细胞占40%。红细胞渗透脆性:开始溶血0.54%,完全溶血0.40%(对照分别为0.44%和0.36%)。
也有认为中央淡染区消失的浓染红细胞增多(>4%)有诊断意义。此外,还可见球形化过程中的过渡阶段细胞,如球口形红细胞、杯形红细胞和碗形红细胞。而且,形态学异常与骨架蛋白缺乏的类型有关,如带4.2蛋白缺乏者多见球口形红细胞,带3蛋白缺乏的HS者易见形如蘑菇形或螯状或有凸起的钳夹状球形红细胞(图2),血影蛋白(β)和锚蛋白共同缺乏者易见不规则的异形及球棘形红细胞。
3.网织红细胞计数
网织红细胞明显增高,通常在5%~20%之间。发生再障危象时,网织红细胞降低或消失。
4.白细胞和血小板
白细胞计数正常或稍高,中性分叶核粒细胞百分比稍高,血小板正常或稍低。细胞分类中,还可见异形和嗜多色性红细胞,偶见有核红细胞。
5.红细胞渗透脆性和自体溶血试验
红细胞渗透脆性试验增高。不管何种原因所致的球形红细胞增多,反映在实验室的主要标记是以低渗盐水渗透性溶解的敏感性增加为特征。正常人开始溶血为0.42%~0.46%,完全溶血为0.28%~0.32%;HS开始溶血为0.50%~0.75%,完全溶血为0.32%~0.44%。如果开始溶血在0.50%以下,但高于正常的0.08%仍有参考意义。轻型患者,将血液标本经37℃温育后再行红细胞渗透脆性试验,由于敏感性进一步提高而呈现阳性,这一试验在欧洲曾被作为HS诊断的金标准。自体溶血试验,溶血明显增高,但为加入葡萄糖而获得纠正。
6.骨髓细胞学和病理学
骨髓增生活跃或明显活跃,红系为主,中晚幼红细胞生成增多,红细胞形态改变同血片(见图3)。骨髓可染铁增加,包括铁粒幼细胞增加。红系造血再生障碍危象时有核红细胞显著减低。
骨髓切片造血细胞增加。主要特征有三个方面:一是中晚幼红细胞增加;二是切片静脉窦和主质内出血区的红细胞多为着色深和圆形,正常所见的新月形、棒形和不规则形红细胞减少;三是巨噬细胞铁增加。
7.红细胞膜蛋白电泳和分子
应用聚丙烯酰胺凝胶电泳可以发现带3蛋白、带4.2蛋白、血影蛋白和锚蛋白等骨架蛋白缺少。在80%的HS患者中可以检出一种至多种膜蛋白的部分缺乏或完全缺乏。
尽管致病基因和遗传突变的多样性,影响了分子检查和诊断的常规应用,但用分子检查血影蛋白、锚蛋白、带3蛋白和带4蛋白的基因缺陷,仍有应用前景。基因突变检查可以提供原发缺陷还是继发缺陷、隐性遗传还是非隐性遗传以及新生突变方面的信息。
8.流式细胞免疫表型
用相应单抗可以检测带3蛋白、血影蛋白和锚蛋白,检测结果可靠,可以作为HS实验室检查的一线项目(过筛试验)。













