维生素A(简称VA)是与人体视觉和免疫等功能相关的一种脂溶性维生素。健康人平均每日应摄入量因年龄、体重、代谢状况和特殊生理情况(如妊娠和哺乳)等而异。WHO推荐成年人每日膳食摄入量标准为500~600μg视黄醇当量;美国为1000μg;我国为800μg。
VA缺乏症(vitamin A deficiency)是WHO公布的全球4大营养缺乏病之一,尤其是发展中国家,其不同人群中患病率为6%~50%。据统计,VA缺乏是许多发展中国家引起失明的主要原因,每年约有50万学龄前儿童因VA缺乏而致盲。VA缺乏在印度尼西亚、印度、孟加拉和非洲等经济不发达国家仍相当严重。印度农村地区0~6岁的学龄前儿童约10%有VA缺乏,在印度低经济收入家庭,0~12岁儿童VA缺乏的患病率为27.5%。在墨西哥,农村约10%的儿童患有VA缺乏,而处在边缘性缺乏的比例高达25%~30%,患病率有随社会经济水平增高而降低的趋势。拉丁美洲和Caribbean地区,5岁以下儿童中VA缺乏与边缘性缺乏的患病率为6%~36%,据初步估计这些地区学龄前儿童中约有1450万人患病。全球约有1亿儿童为VA边缘性缺乏状态,这些儿童虽无急性缺乏的临床体征,但与VA充足的儿童相比,其死亡率和严重感染率较高。我国居民膳食动物性食物比例偏低,VA的来源主要依靠植物性食物中的胡萝卜素。第二次全国营养调查资料表明,我国各类人群中VA的摄入量均低于供给量标准,尤其是在绿叶蔬菜缺乏的季节,VA缺乏较为常见,继发于疾病的VA缺乏或亚临床缺乏的发生率则更高,几乎所有蛋白质热能营养不良患儿均伴有不同程度的VA缺乏。慢性肾功能不全接受血液和腹膜透析的患者,血清VA降低,需给予补充。
维生素A又名视黄醇(retinol)。广义的VA实际上是指具有VA生物活性的一类物质。
(一) 视黄醛是体内VA的活性形式
在自然界中,全反式视黄醇是VA类物质存在的最基本形式,其中绝大多数以棕榈酸酯的形式存在,其他在自然界中较为常见的是视黄醇磷酸酯以及有生物活性的甘露糖视黄醇磷酸盐等。视黄醇末端的-CH2OH在体内可被氧化成-CHO,称视黄醛(retinal),与食物中的视黄醇具有同样的生物活性,而视黄醛是人体内组成生理活性型VA的主要形式。视黄醛末端的-CHO在人体内可被氧化成-COOH,称为视黄酸(retinoic acid),它具有VA的一些生理功能,但与视黄醇和视黄醛的生物学活性功能不同。各种维生素A及其衍生物分子式见图6-36-1,β胡萝卜素转化为维生素A的过程见图6-36-2,维生素A的主要代谢转化途径见图6-36-3。

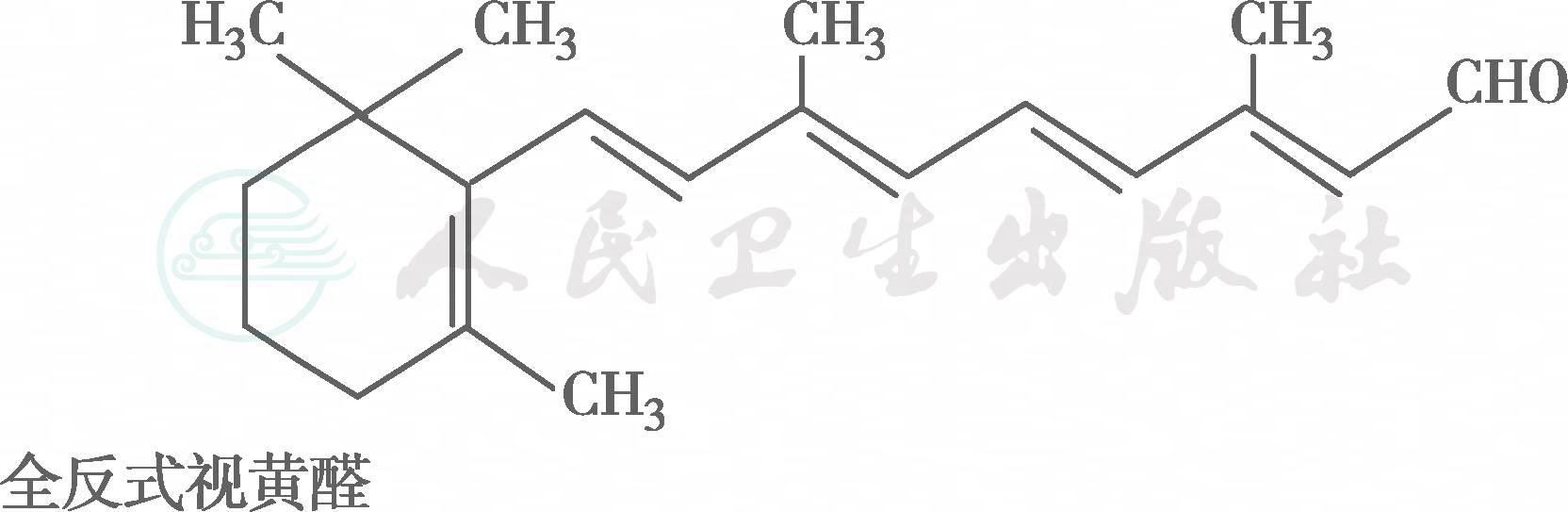

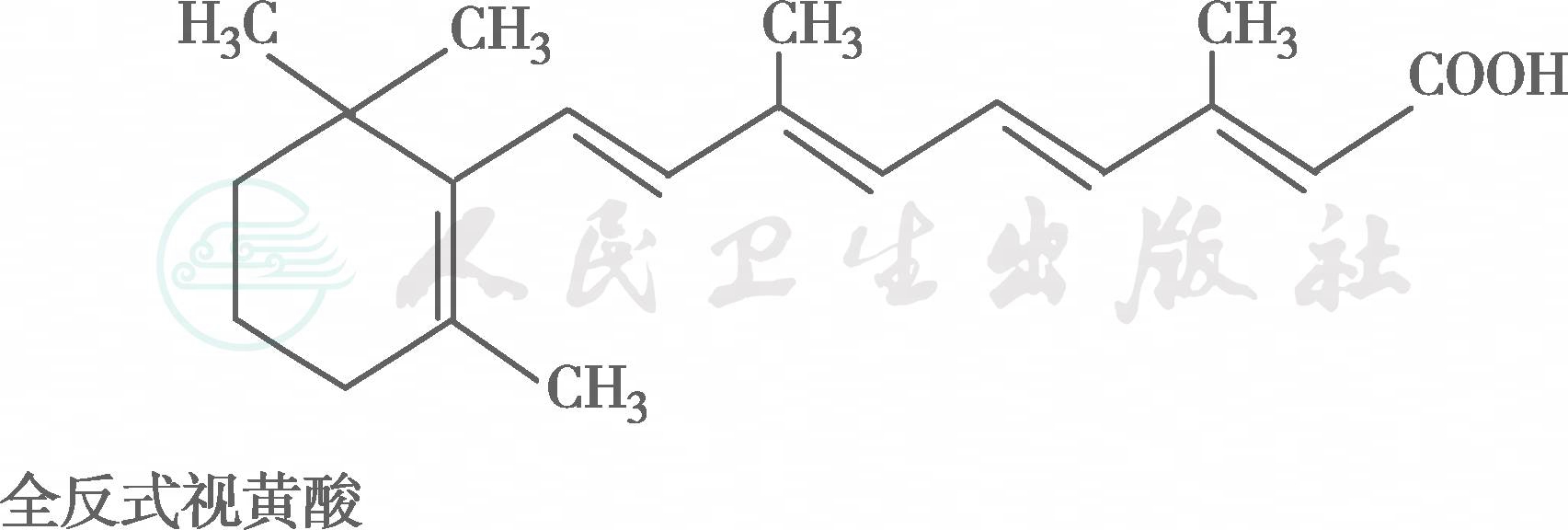

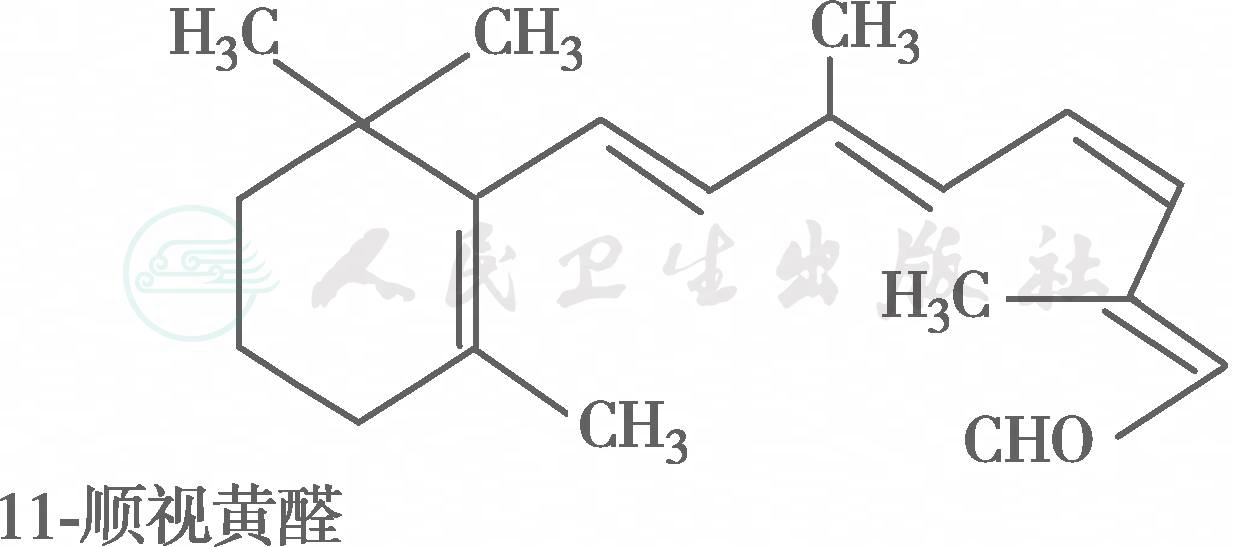
图6-36-1 各种维生素A及其衍生物分子式
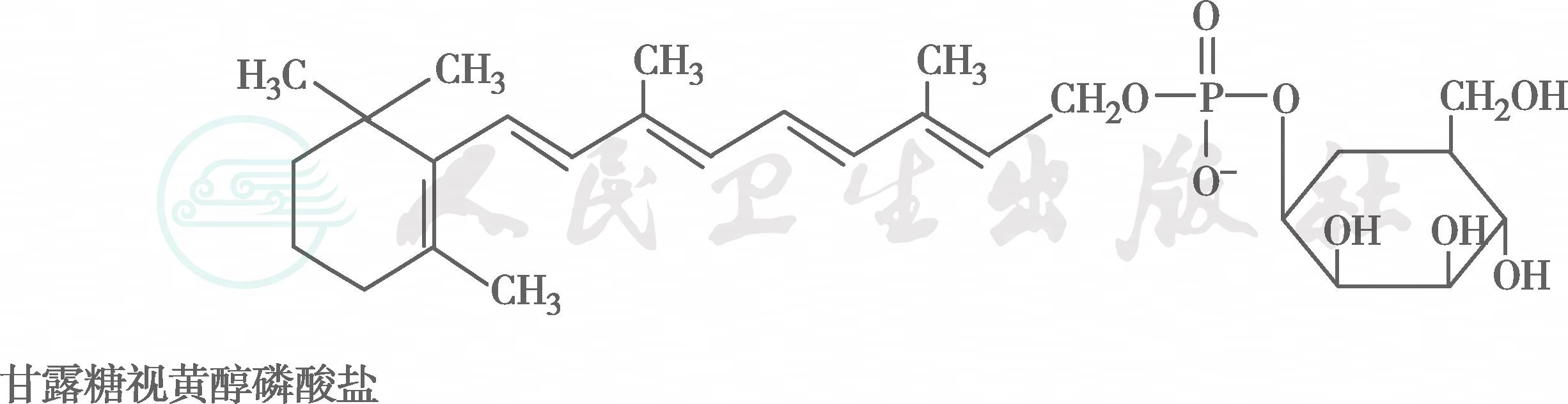
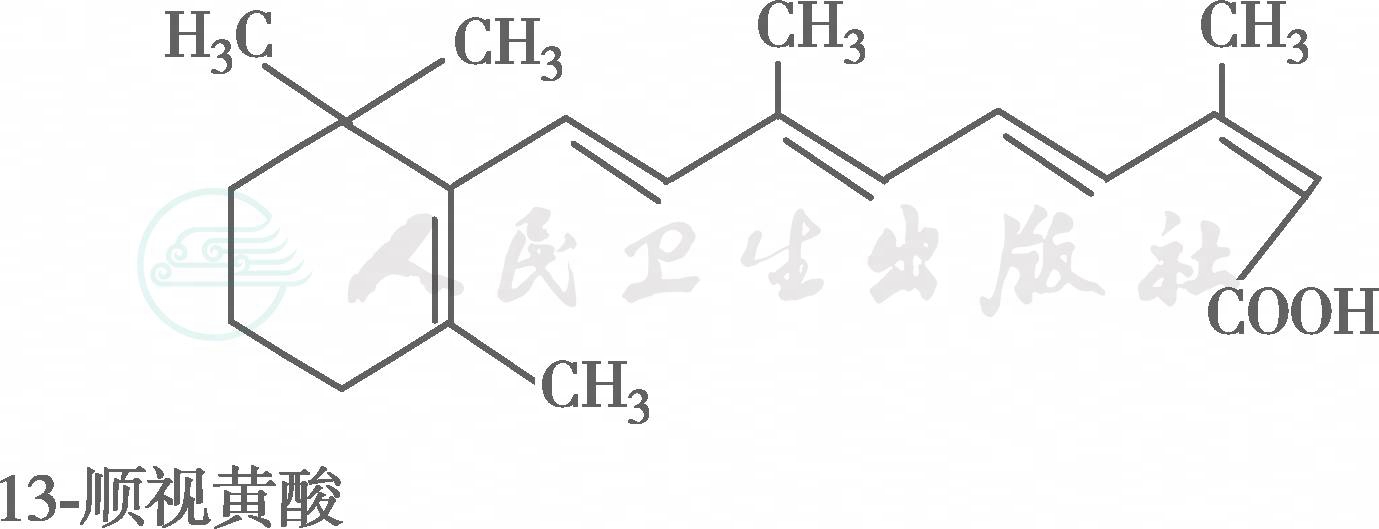
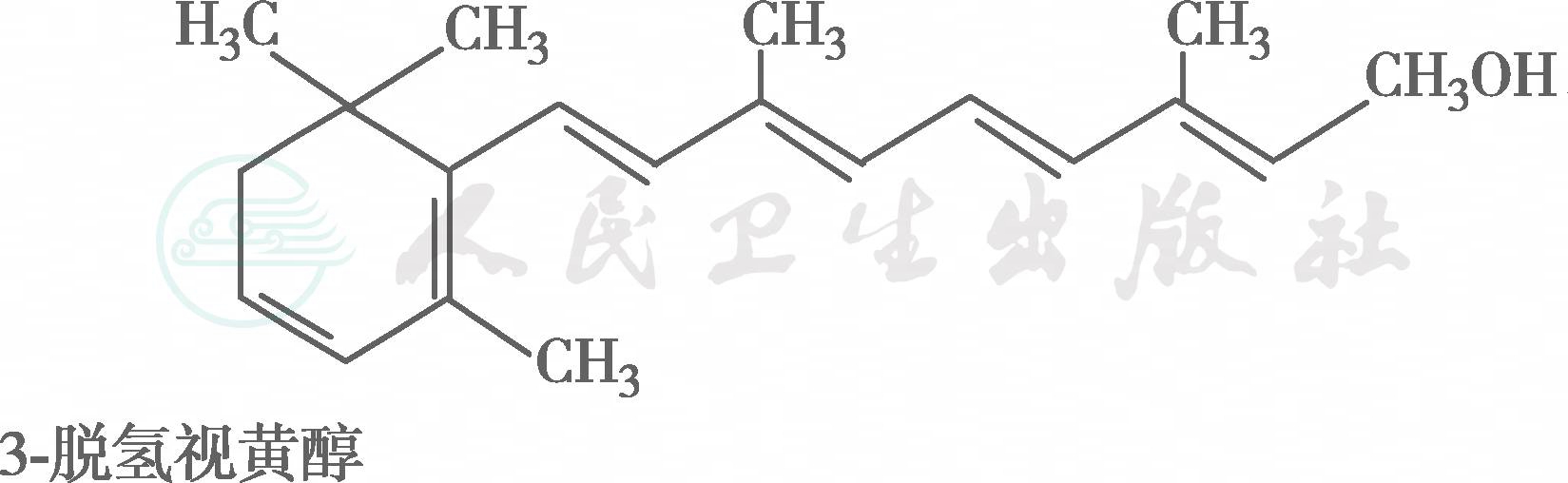
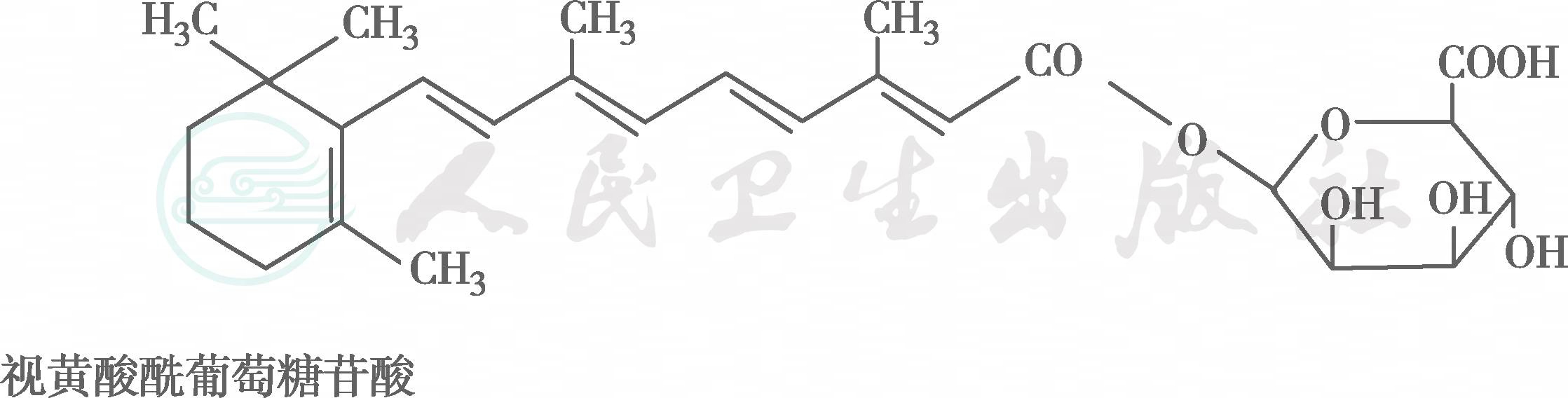
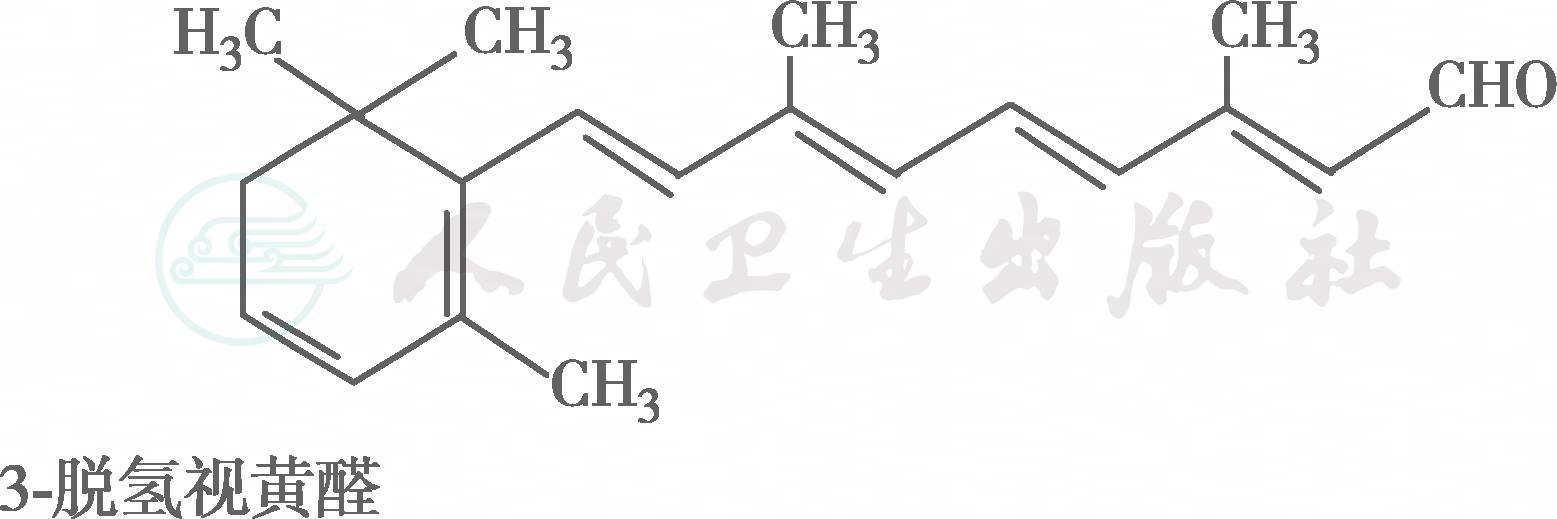
图※6-36-1(续)
有氧条件下,VA及其衍生物易氧化,氧化剂如MnO2等可使视黄醇氧化为视黄醛或视黄酸,还原剂如硼氢化锂又可将视黄酸还原为视黄醛或视黄醇,但在人体内只存在视黄醇和视黄醛的氧化或还原的转换,视黄酸则不能还原为视黄醛,它只能被迅速代谢为视黄酸酰-β-葡萄糖苷酸(retinoyl β-glucuronide),并主要通过胆汁排出,因此认为视黄酸很可能是一种VA排出体外的前体。在淡水鱼的眼中存在3-脱氢视黄醇和3-脱氢视黄醛,它是以葡糖苷酸的形式分泌的。自然界中存在的异构体最重要的是11-顺视黄醛,为与视觉有关的VA活性形式。此外,13-顺视黄酸是用于临床治疗的主要形式(accutane,isotretinoin,又称异维甲酸)。
VA及其衍生物极易被氧化破坏,尤其在高温条件下更甚,其易氧化性按酯、醇、醛、酸形式依次减弱。脂肪酸酸败可引起VA及胡萝卜素严重破坏,但在食物中富含磷脂、VE和抗坏血酸等抗氧化剂时较为稳定;VA类在无氧条件下对碱较稳定,但对酸不稳定,可使其脱氢或形成重组双键产物;在光和(或)碘的作用下,催化双键异构,全反式可变为较稳定的11-顺式异构体。强光的作用还可引起二聚化,形成鲸醇(kitol)或其多聚体;VA类物质在紫外光下具有很强的吸光性,紫外光可促进其氧化破坏,以不同形式存在的VA(如棕榈酸酯或磷酸酯)以及各种异构体的紫外吸收光光谱均不相同。因此,用高效液相色谱法可分离VA的同系列物和代谢产物。
(二) 类胡萝卜素在体内转化为VA
植物组织内的黄、红色素,有很多属于类胡萝卜素(carotenoid),能在人体内分解为VA,具有VA的生理作用的类胡萝卜素为植物中的VA前体,又称为VA原(pro-vitamin A),自然界中有六百多种类胡萝卜素,但只有50种左右能转化为VA,其中最主要的VA原为β-胡萝卜素,它常与叶绿素并存,在类胡萝卜素中分解为VA的效率最高。其他还有α-胡萝卜素、γ-胡萝卜素和玉米黄等亦能形成少量的VA。β-胡萝卜素分子的两端均为β-紫罗酮环,并含有4个异戊二烯侧键。因此,在理论上,一分子β-胡萝卜素在C15和C15之间先加氧断裂为醛,接着被还原为醇,即可形成两分子的VA。α-胡萝卜素和γ-胡萝卜素以及玉米黄等的一个紫罗酮环在结构上存在差异,从而只有一个环及侧键可转变为视黄醇,即只能形成一分子VA。但实际上膳食中β-胡萝卜素只有1/6可转变为VA。以前,VA用国际单位(U)表示,现在以FAO/WHO联合专家委员会提出的视黄醇当量(RE)数值计算,即1U VA=0.3μg RE;1μg VA=1.0μg RE;1μg β-胡萝卜素=0.167μg RE;1μg其他VA原类胡萝卜素=0.084μg RE。

图6-36-2 β胡萝卜素转化为维生素A的过程

图6-36-3 维生素A的主要代谢转化途径
注:单向箭头示不可逆反应;双向箭头示可相互转换的化合物;虚线箭头示在活体反应中尚未完全建立或仅初步建立的可能反应
(三) VA以微粒形式被吸收
食物中的视黄基酯和VA原类胡萝卜素经胃内的蛋白分解消化作用而从食物中释出,并与其他脂质聚合,在小肠中经胆汁和胰脂酶的共同作用,水解为视黄醇和胡萝卜素烃,被小肠绒毛上皮细胞吸收。胡萝卜素难溶于水,在肠道以脂性溶液为主时溶解度最高。但小肠的环境主要是水溶性的,因而含胡萝卜素的脂类需在其他物质的作用下,形成微胶粒溶液才能被小肠黏膜细胞吸收。胆汁对于胡萝卜素的吸收极其重要,其作用强于其他表面活性剂。胆盐不但促进胡萝卜素运输至肠细胞,协助其与细胞表面结合,而且还促进胡萝卜素的分解。食物中的磷脂亦有助于形成微胶粒溶液而有利于其吸收。VE及其他抗氧化剂可保护胡萝卜素侧链的共轭双键系统免于氧化,维持其生物活性。
胡萝卜素进入小肠黏膜细胞后,在胞质内β-胡萝卜素双氧化酶作用下,将氧加入到中间位置的C15和C15双键上,将其对称地分解为二分子的视黄醛;亦可从偏侧分裂成β-脱辅基胡萝卜醛,其中的一种可进一步降解成视黄醛;β-胡萝卜素双氧化酶还可以缓慢地将9-顺式β-胡萝卜素转变为9-顺式和全反式视黄醛的混合物。这一过程尚需要Fe2+、含巯基物质如谷胱甘肽、胆盐及磷脂酰胆碱等参与。生成的视黄醛在乙醇脱氢酶和NADH的作用下还原为视黄醇,并可再酯化为酯(主要是与棕榈酸结合而生成视黄基棕榈酸酯)。小肠和肝内都存在胡萝卜素双氧化酶,但其活性以小肠较高,以器官计,肠为肝的2倍,以组织的重量计,肠组织的活性比肝脏高4~7倍。
血浆中的主要类胡萝卜素包括玉米黄、叶黄素、番茄红素、隐黄质、α-胡萝卜素和β-胡萝卜素以及许多其他痕量化合物。β-胡萝卜素通常占血浆总类胡萝卜素的15%~30%。血浆中类胡萝卜素的总浓度及各个组分的相对浓度取决于摄入的膳食量及其种类。未被吸收的胡萝卜素由粪便排出。淋巴液的β-胡萝卜素(约70%)以视黄醇酯的形式运输(尤以棕榈酸酯为主),其余(约30%)为β-胡萝卜素原形式。血浆中的β-胡萝卜素则被低密度脂蛋白运输。胡萝卜素可以视黄醇酯的形式贮存于肝、脂肪组织、肾、皮肤及血管的粥样硬化斑块中,但其贮存于肝等器官组织的量受到明显限制。而肝脏对VA的吸收和贮备能力很强,大鼠实验证明,无论摄入量多大,最多能将30μg RE/d的胡萝卜素贮存于肝脏,VA则可达6000μg RE/d。
VA在小肠中的吸收方式为主动吸收,此为一耗能过程,比胡萝卜素的吸收速率快7~30倍。人摄入VA后3~5小时即达吸收高峰。食物中的VA多以视黄醇酯的形式存在,其中主要为棕榈酸或硬脂酸酯形式。在肠道中经胰液或绒毛刷状缘中的视黄醇酯水解酶分解为视黄醇游离形式进入小肠黏膜细胞,又经肠细胞微粒体中的酯酶酯化为VA棕榈酸酯。足量脂肪的摄入有利于VA的吸收,健康人摄入足量脂肪(>10g/d),其VA的吸收率>80%。小肠中胆汁的乳化作用亦为VA吸收的必要条件。抗氧化剂如VE以及磷脂酰胆碱可防止VA的氧化破坏而促进其吸收,矿物油及肠道寄生虫均不利于其吸收。
(四) 多种因素影响VA贮存
影响肝脏对VA贮存的因素很多,主要包括摄入量、肝脏的贮存效率以及被贮存的VA的释放效率,此外,亦受膳食组分及内分泌因素的影响。肠道对VA的吸收力很强,摄入量大或摄入速度很快时,肝脏中VA酯与脂蛋白的结合已达饱和,过量的VA酯可进入血浆中。在生理摄入量下,血浆中的VA则以视黄醇的形式为主。在大鼠实验中,若短时给予15 000μg RE,4周后又给予无VA膳食3周,血浆中VA酯仍远高于正常,而VA维持正常水平,这说明肝脏对VA的移出存在两种作用:一种为代谢作用,肝脏将超出贮备能力的剩余VA酯逸入血流而排出;另一种为释放作用,由于组织需要,VA酯从肝中水解释放出VA经血流至靶组织。当对缺乏VA的人体给予大剂量VA时,只有很短时间的保护作用,亦说明短时间过量摄入时,肝脏首先以代谢作用为主进行代谢。
肝脏可储存大量VA,内源性VA的消耗速度很慢(分解代谢速度)。当无外源性VA补充时,每日肝脏中损失率仅为肝VA总贮存量的0.5%。由于肝内储存的及外源性VA均能为靶组织所利用,因此,VA的更新率受肝贮存量的影响。肝脏并非VA唯一的贮存器官,肾脏VA的贮存量相当于肝脏的VA贮存量的1%。由于肾脏是RBP降解场所,肾的贮存可能反映视黄醇结合蛋白(retinol binding protein,RBP)被代谢而释放出的VA的量。VA在肾脏以游离视黄醇的形式存在,肾脏将超出贮量的VA再酯化后,可随脂蛋白运回肝脏。在肾上腺中VA的含量也很高,尤其在肾皮质的束状带,含量约相当于肝脏的1/10。眼色素上皮组织内的VA以酯式存在,专为视网膜使用而储备,其耗竭速度比肝脏要慢。
高蛋白膳食增加VA的利用和消耗;反之,低蛋白膳食增加VA的储存。其原因可能是:①在缺乏蛋白质时,机体对VA的利用相对减少;②蛋白质不足使RBP的合成相对减少,不利于肝脏中储存的VA与RBP的结合,阻碍VA从肝脏释放和运输到血流中供组织利用。
(五) VA以复合物形式转运
正常情况下,VA必须与蛋白质相结合,使之稳定并具有水溶性。细胞表面有一种专一的受体可结合RBP,因而细胞可识别VA-RBP-TTR复合体。当过量摄入VA超过肝脏对其贮存能力时,VA酯进入血流,不能与有限的RBP结合而与血浆中非特异性的低密度脂蛋白相结合,对细胞产生毒性。
人类血浆中存在3种RBP。一种为VA-RBP-TTR,其分子量70 000Da,由于分子量较大不能从肾脏滤过。如前所述,因为VA是一种不稳定物质,它对于类脂结构的细胞膜是一种很强的表面活性剂,因此VA与RBP结合的意义在于去除前者的表面活性,降低其细胞毒性。而VA-RBP与TTR结合的意义则在于避免在肾脏的过滤作用中RBP及视黄醇的丢失。第二种为释放出VA而离开靶细胞表面的变性ApoRBP,分子量为21 000Da,既不能再与视黄醇或TTR结合,亦不能再与靶细胞上RBP的专一受体结合。ApoRBP可在肾小球中滤过和在肾小管中被重吸收,为肾皮质细胞所摄取,并在其溶酶体中分解为氨基酸。全RBP-TTR复合体随血流到肠黏膜、膀胱、角膜及上皮组织等靶细胞后,在细胞膜表面有一种专一的受体可与RBP结合,并将VA释放出来,VA进入细胞内。由于这种专一受体的存在,细胞不仅可从VA-RBP-TTR复合物,而且还可从holo-RBP中摄取VA,VA进入靶细胞后,立即与细胞内各种特殊的类VA结合蛋白相结合。
(六) 视黄酸途径是VA分解的基本方式
无论消化道摄入或注射外源性VA后,均可循视黄酸代谢途径进行分解代谢,其代谢产物经肠道及尿中排出。视黄酸途径是VA分解代谢的基本途径,而视黄酸是VA排出体外的前体。
外源性VA还可经肾脏代谢从尿中排出。大鼠经胃给予标记的视黄醇或酯后,在肾脏中除摄入物外尚有全反式视黄酸及5,6环氧视黄酸,但在血浆中并未发现后者,因此这种氧化作用可能仅在靶组织(如肾脏)中发生。在尿中VA的代谢产物中,2/3的VA异戊二烯侧链无改变,β-紫罗酮环部分可被氧化,脱去甲基;亦有C15氧化成CO2;有的侧链氧化分解为CO2及短链产物。摄入外源性VA后,24小时尿可排出摄入剂量的8.7%,其中一半为脂溶性的,另一半为水溶性的。水溶性代谢物目前仍不很清楚,估计为VA代谢物与短肽的结合物。
一般可参考我国或2005年美国的饮食指南进行补充,成年人VA的膳食供给量标准为800μg/d。大量膳食调查资料表明,我国许多地区居民VA摄入不足。为了防止VA缺乏流行,必须注重食物构成的改变,这是预防VA缺乏症最有效的方法。VA最好的食物来源是动物性食物如黄油、蛋类、肝与其他动物内脏。植物性食物中的β-胡萝卜素在人体内也可以转化为VA(6μgβ-胡萝卜素可转化为1μgVA),故在经济不发达的农村或贫困居民中,注意摄取富含β-胡萝卜素的食物同样有较好的预防作用。深色的蔬菜和水果中胡萝卜素的含量极为丰富,表6-36-4是部分食物中胡萝卜素含量。
表6-36-4 部分食物的胡萝卜素含量(μg/100g)

亦可采用VA强化食品进行预防,如在脱脂奶中用乳化的VA来强化,也可在面粉制品或糖果中补充VA,但应严格控制强化剂量,切勿乱加、滥加。孕后期一次性口服20万IU VA可预防新生儿VA缺乏。













