10 Chapitre 10 – Les pathologies
Les pathologies
Partie A: Les maladies obstructives
Partie B: Les maladies interstitielles
Partie C: L’œdème pulmonaire
Partie D: L’atélectasie
Partie E: Les maladies neuromusculaires
Partie F: Les maladies vasculaires
Partie G: Les maladies tégumentaires
Partie H: Les chocs cardiovasculaires
Partie I: Les maladies cardiovasculaires
Partie A: Les maladies obstructives
Les maladies pulmonaires obstructives chroniques
La MPOC (Maladie pulmonaire obstructive chronique) est une maladie respiratoire causée surtout par le tabagisme et caractérisée par une obstruction progressive et partiellement réversible des voies respiratoires, de l’hyperinflation pulmonaire*, des manifestations systémiques et des exacerbations de fréquence avec sévérité croissantes. Les 2 maladies se classant comme MPOC sont l’emphysème et la bronchite chronique. Parfois les patients ont des caractéristiques et des présentations cliniques des deux maladies (coexistence de l’emphysème et de la bronchite chronique). On doit cependant les décrire de façon individuelle, car il existe des points distincts pour chacune des deux maladies.
Bronchite chronique : diagnostic basé sur la présentation clinique.
Toux productive chronique pendant 3 mois et pour 2 années (ou plus) consécutives. Le patient peut avoir périodiquement des exacerbations durant la progression de la maladie suite à des infections respiratoires. (Bronchite asthmatique : hyperréactivité des voies).
La bronchite chroniques’explique en fonction d’une réduction du rayon des voies respiratoires :
- Inflammation chronique et œdème des murs des voies périphériques;
- Production excessive de mucus et accumulation
- Élargissement de l’appareil sécrétant du mucus : Hypertrophies et hyperplasies des glandes sécrétrices
- Blocage muqueux (mucus plug) partiel ou total des voies respiratoires;
- Bronchospasmes;
- Emprisonnement d’air* et hyperinflation*
- Moins probable, occasionnellement vu en stage final
Emphysème : Diagnostic pathologique (confirmation Dx post-mortem). On note une destruction du parenchyme pulmonaire des espaces d’aires distales aux bronchioles terminales.
L’emphysème s’explique par une diminution de la lumière des voies respiratoires et du débit expiratoire :
- Destruction des murs alvéolaires et l’élargissement des espaces terminaux
- Réduction de la pression motrice
- Destruction des capillaires pulmonaires
- Cause une hypertension pulmonaire
- Perte de support des structures entourant les voies respiratoires
- Surtout les bronchioles respiratoires
- Emprisonnement d’air et hyperinflation
Il y a deux types d’emphysèmes : Centrilobulaire (associé aux fumeurs) et Panlobulaire (déficience de protéines a1-antitrypsine).
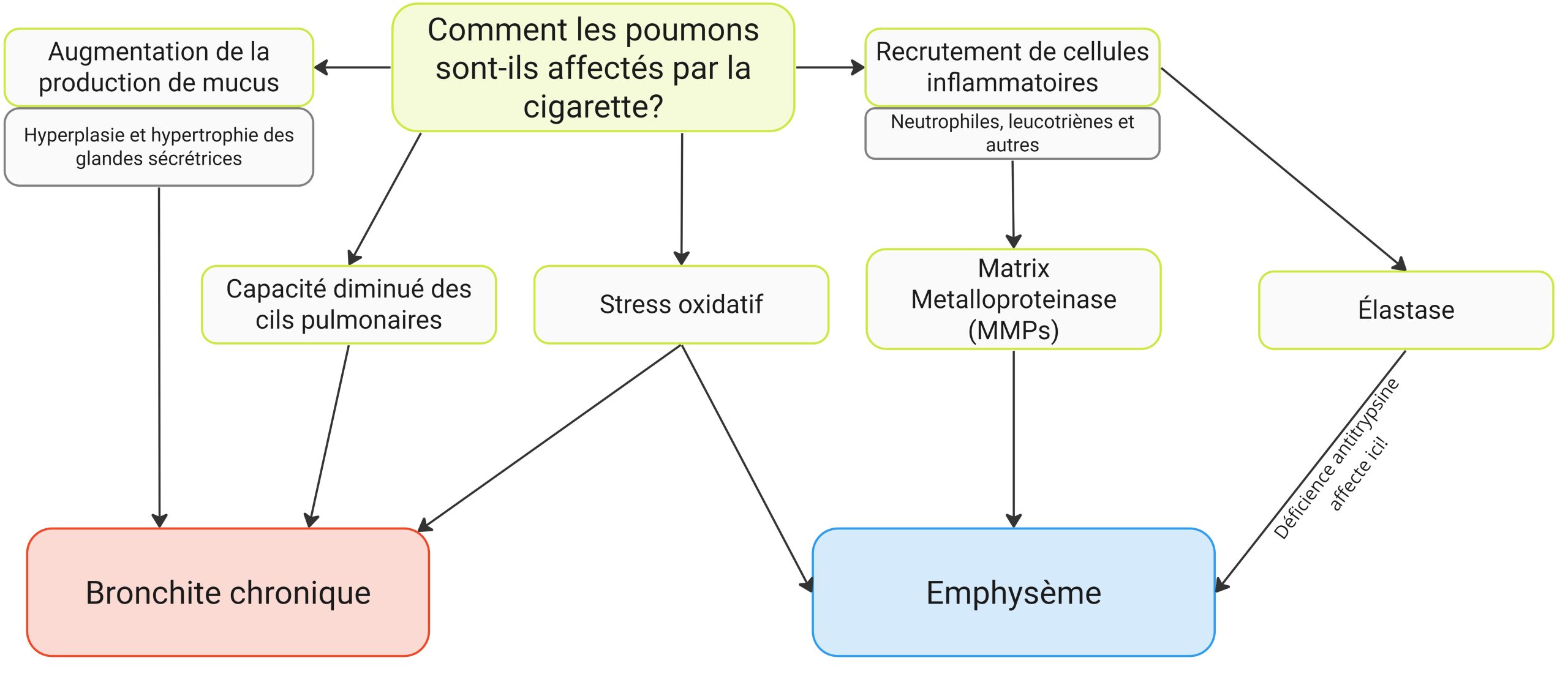
Le tabagisme est la principale cause d’une MPOC. Le tabac est à l’origine d’une surproduction de mucus qui tapisse les parois des voies aériennes et en réduit considérablement le calibre. Cet excès de sécrétions favorise les infections bronchiques. Une infection peut causer plus de dommages aux voies aériennes en augmentant encore plus la production de mucus. Le tabac détruit également les sacs alvéolaires à partir desquels l’oxygène circule du poumon vers le sang, rendant les poumons moins efficaces.
Parmi les causes moins fréquentes de MPOC, on retrouve une rare affection génétique appelée déficience en alpha-1 antitrypsine, la pollution de l’air, une exposition professionnelle à des poussières et à des substances chimiques et de fréquentes infections des voies respiratoires inférieures pendant l’enfance.
Évaluation du patient :Le portrait clinique du patient souffrant d’emphysème versus celui souffrant de bronchite chronique est très différent. Il est important de comprendre les nuances entre ces pathologies afin de bien repérer et identifier les signes et symptômes. Il est commun pour les 2 pathologies de noter: la dyspnée, la dyspnée à l’effort, l’utilisation des muscles accessoires, une diminution de l’entrée d’air et des sibilances expiratoires.
Bronchite chronique: toux et production de sécrétions, matité au frémitus, crépitements gras, hippocratisme digital et un embonpoint.
Emphysème: hyperrésonnance au frémitus, thorax en tonneau, signe de Hoover, diminution de l’excursion du diaphgrame, respiration à lèvres pincés et poids généralement bas.
Hypoxémie : l’atteinte de la maladie au niveau pulmonaire n’est pas uniforme et le sang n’est pas distribué de façon totalement efficace aux endroits mieux ventilés ce qui cause une perturbation V/Q et donc de l’hypoxémie.
Hypercapnie : Certains patients auront de l’hypercapnie. Cette rétention de CO2 s’explique par :
- Augmentation du travail respiratoire
- Anormalité du centre de stimulation respiratoire centrale
- Perturbation V/Q
- Réduction de l’efficacité du diaphragme et fatigue.
Diagnostic: Afin d’apposer un diagnostique de MPOC, on doit évaluer les antécédents et faire des tests diagnostic:
Les antécédents pertinents: consommation de tabagisme ou exposition à la fumé secondaire, l’essoufflement, la toux, la production de mucus et l’incidence des pathologies pulmonaire dans la famille.
Test de fonction pulmonaire:
- Un rapport de VEMS/CVF de moins de 0.7, après l’administration d’un bronchodilatateur indique une obstruction à l’écoulement d’air qui n’est pas entièrement réversible et qui doit être présente pour établir un diagnostic de MPOC.
- Il est possible de noter de l’hyperinflation et/ou de l’entrappement d’air dans certains cas. On devra évaluer le ERV, le RV et le TLC afin de faire la distinction entre les 2.
- Le DLCO sera affecté avec les emphysémateux
Radiographie pulmonaire:
- L’hyperinflation est une composante assez présente chez les patients, particulièrement chez les emphysémateux
- Patron alvéolaire typique chez les bronchites chronique en exacerbation
Test:
- La plupart des personnes atteintes de déficit en alpha1-antitrypsine sont diagnostiquées après avoir développé la MPOC ou une maladie du foie connexe. Un test génétique est utilisé pour diagnostiquer le déficit en alpha1-antitrypsine. Il sert à déterminer si votre gène d’alpha1-antitrypsine est fonctionnel.
- Index Reid (ratio) avec bronchite chronique
- Définition : Index Reid: épaisseur relative des glandes muqueuses / épaisseur totale du mur alvéolaire.
Il est possible avec cette pathologie de noter beaucoup d’exacerbation de la maladie. Une exacerbation consiste à une aggravation des symptômes de la maladie. On note 2 portraits typiques lorsqu’on parle d’exacerbation de cette pathologie :
- Infectieux
- Symptomatique
Lorsqu’on parle d’une atteinte infectieuse, on associe les symptômes à une infection, principalement bactérienne et associé à un de ces pathogènes :
- Streptococcus pneumonia
- Moraxella catarrhalis
- Haemophilus influenza
Il va de soi que le portrait infectieux est plutôt associé à une évaluation de patient qui aura des crépitements gras.
L’atteinte symptomatique s’exprime plus par une aggravation des symptômes du patient. Plusieurs causes peuvent expliquer ceci dont :
- Les changements de température
- La qualité de l’air
- L’endurance et / ou activité physique
- L’anxiété
- Le changement d’environnement
- La consommation de produit du tabac
- Et bien plus!
Traitement: La MPOC ne se guérit pas, mais elle peut être traitée ainsi que les complications (capacité fonctionnelle, exacerbations, hospitalisations, etc.). Un traitement adéquat de la MPOC inclut :
- D’arrêter de fumer pour ralentir la progression de la MPOC et se tenir à l’écart des places enfumées ou polluées;
- De prendre des médicaments contre la MPOC pour prévenir et atténuer vos symptômes, pouvant inclure comprimés, inhalateurs et oxygène;
- D’apprendre à développer de nouveaux comportements de santé qui sont nécessaires pour vivre avec la maladie sur une base quotidienne;
- De s’inscrire à un programme de réadaptation respiratoire pour apprendre à mieux respirer grâce à des exercices.
Le « GOLD standard of care” est en charge de partager les meilleures pratiques en termes de traitements et de diagnostique face aux gens atteints de la MPOC.
L’asthme
La société canadienne de thoracologie définit l’asthme comme suit : ‘’L’asthme est une atteinte inflammatoire des voies aériennes caractérisé par des symptômes paroxystiques ou persistants, comme la dyspnée, l’oppression thoracique, les sibilances, la production de mucus et la toux, associés à une obstruction variable du passage de l’air et à l’hyperréactivité. À des degrés divers, des voies aériennes à des stimuli endogènes ou exogènes’’. Selon la SCT, l’établissement d’un diagnostic d’asthme s’effectue à partir de l’anamnèse (histoire) et des mesures objectives de la fonction respiratoire chez les patients de six ans ou plus.
Tout comme la MPOC, l’asthme a aussi une initiative globale afin de guide la prise en charge des patients asthmatique. Il s’agit de l’association GINA https://ginasthma.org/reports/
Durant une crise d’asthme, il se produit une série de changements pathologiques ou structuraux qui mène à une réduction du rayon des voies :
- Constriction des muscles lisses (hyperplasie et hypertrophie) des voies bronchiques (bronchospasmes);
- Hypertrophie et hyperplasie des cellules sécrétrices menant à une production excessive de sécrétions blanchâtres et épaisses;
- Inflammation des murs bronchiques;
- Œdème de la muqueuse (éosinophiles et lymphocytes)
- Dommage épithélial (épaississement de la membrane basale)
Plusieurs événements reliés sont responsables de l’hyperactivité des voies aériennes et de l’augmentation de la Raw
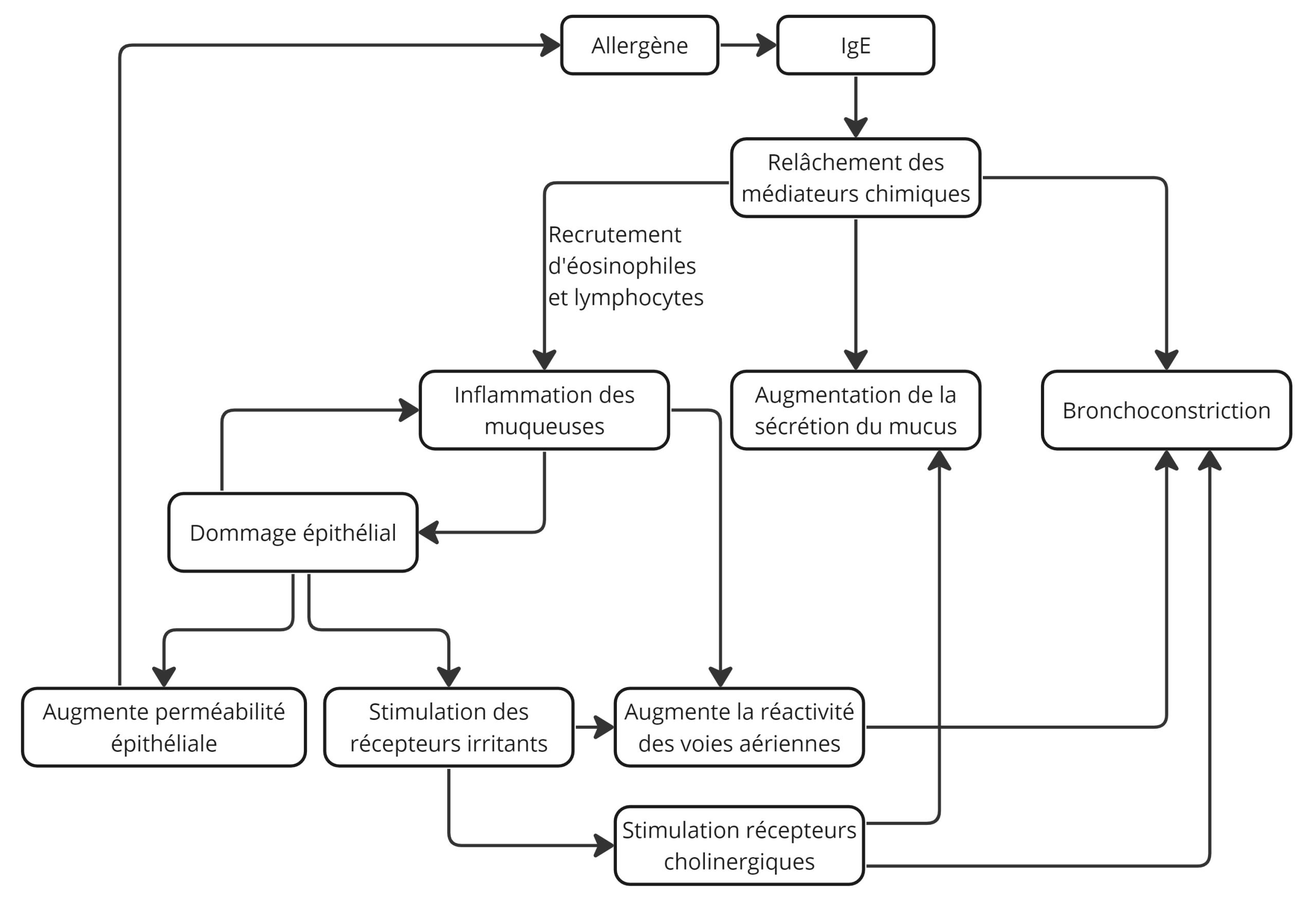
Une caractéristique importante observée chez l’asthme extrinsèque est le retour de l’obstruction des voies aériennes 3 à 8 heures après la phase initiale, soit une réaction tardive. On appelle ce phénomène une réponse biphasique.
Il y a définitivement une association significative entre l’asthme et les allergies, mais cette association n’est pas universelle pour toutes les personnes souffrant d’asthme. Plusieurs individus diagnostiqués ayant de l’asthme n’ont pas de signes ou symptômes associés avec l’atopie (prédisposition héréditaire à produire de manière excessive des immunoglobulines qui sont de type E, au contact d’allergènes, et de développer des manifestations d’hypersensibilité immédiate comme l’asthme, le rhume des foins…).
Dans ce groupe, les crises d’asthme sont souvent précipitées par d’autres stimuli. C’est pour cette raison qu’on fait souvent la distinction entre l’asthme extrinsèque (allergique ou asthme atopique) et l’asthme intrinsèque. De plus, certains facteurs augmentent la prédisposition d’un individu à développer de l’asthme tels que : la génétique, l’obésité, le sexe et l’âge, l’environnement (exposition à des allergènes durant l’enfance ou à la fumée de la cigarette de la mère enceinte), le reflux gastrique, l’alimentation (préservatif), certains médicaments (aspirine) et bien d’autres.
L’asthme extrinsèque :
- Asthme associé à des allergies (réaction d’hypersensibilité type 1)
- Réaction antigène anticorps avec relâchements de médiateurs chimiques
- Associé à une histoire familiale, ‘’ hay fever’’, eczéma, skin testing +
- Se manifeste habituellement à l’enfance
L’asthme intrinsèque (non allergique ou non atopique):
- L’asthme qui n’est pas associé à des allergies
- Réaction antigène anticorps : rôle moins important
- Pronostic moins favorable se manifeste à l’âge adulte
- Facteurs associés à l’asthme intrinsèque : exercices, infections respiratoires, air froid, irritants chimiques, fumée de la cigarette, drogue, stress émotionnel, poussière et polluant de l’air, etc.
Évaluation: Les symptômes suivants sont typiques avec les patients asthmatiques. On devrait questionner le patient sur ces questions afin de confirmer, ou non, la présence d’un diagnostic d’asthme, particulièrement lorsque la pathologie n’a pas encore été confirmé.
- Épisode fréquent de dyspnée, d’oppression thoracique, de sibilances ou de toux;
- Aggravation des symptômes la nuit et au petit matin;
- Symptômes accompagnant une infection virale des voies respiratoires, ou apparaissant après l’exercice ou lors de l’exposition à des pneumallergènes ou à des irritants;
- Symptômes apparaissant chez les jeunes enfants après qu’ils ont joué ou ri;
- Diminution des symptômes après l’utilisation de bronchodilatateurs ou de corticostéroïdes.
Examen physique :
- Tachypnée (stimulation des chémorécepteurs périphériques, anxiété)
- Tachycardie et hypertension
- Utilisation des muscles accessoires (inspiration et expiration)
- Position tripode
- Cyanose
- Rétraction (particulièrement chez les enfants)
- Toux et production accrue de sécrétions blanches, épaisses et tenaces (purulent : éosinophiles et WBC +++)
- Pouls paradoxal
- Réduction du frémitus tactile
- Respiration à lèvres pincés
- Auscultation : Réduction de l’entrée d’air, diminution des sons cardiaques, sibilances et crépitements gras*.
Diagnostic: La spirométrie pré vs post est la meilleure façon de faire le diagnostic de l’asthme. La particularité des patients asthmatiques est qu’ils ont une réversibilité lorsqu’on administre des bronchodilatateurs. Ainsi, on verra une amélioration des tests après un bronchodilatateur à courte durée d’action. On peut se fier au graphique suivant qui exprime les nouvelles directives afin de poser le diagnostic de l’asthme
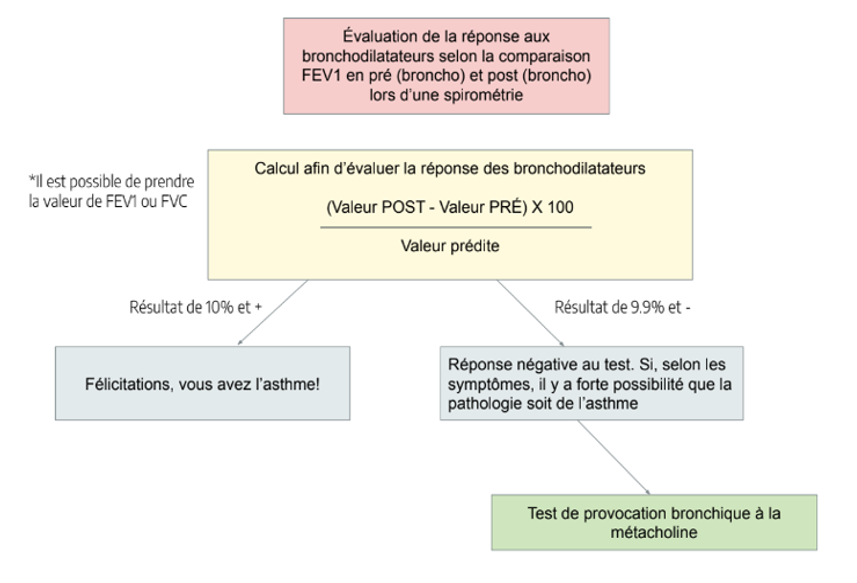
Il est aussi possible de faire un test de métacholine si la spirométrie pré et post Ventolin n’est pas concluante, mais que les symptômes vont en lien avec l’asthme. La métacholine est utilisé afin de stimuler les voies aériennes et produire une réactivité de celles-ci. Au niveau de la radiographie pulmonaire, il est possible de noter de l’entrappement d’air chez certains patients. On notera donc une augmentation des volumes pulmonaires au rayon-x. Dans les prises de sang, il sera possible de noter une augmentation du compte d’éosinophiles.
ABG : Il est typique d’avoir une hypoxémie chez ces patients causés par un V/Q mismatch qui perdure. Lors de la phase de compensation, on note plus une alcalose respiratoire expliqué par la stimulation de certains récepteurs (J, périphériques, etc.).
| pH | CO2 | O2 | HCO3 | SaO2 |
| ↑ | ↓ | ↓ | N | ↓ |
Lors de la phase de décompensation, c’est un équilibre acidobasique ou une acidose respiratoire qui s’impose.
| pH | CO2 | O2 | HCO3 | SaO2 |
| N ou ↓ | N ou ↑ | ↓ | N | ↓ |
Traitement: Les traitements vont variés selon la sévérité de l’asthme. C’est l’organisme GINA (Global initiatives for asthma) qui dicte les meilleures pratiques. Chez les patients âgés de 12 ans et plus, le médicament de première ligne qui est recommandé est une faible dose de corticostéroïdes avec du formoterol. Les nouvelles études appuie le besoin d’offrir un corticostéroïdes à faible dose lors d’une crise d’asthme, ce qui est sensiblement nouveau dans la littérature, mais qui fait amplement du sens lorsqu’on regarde la physiopathologie de l’asthme. Plus de détails sur les traitements sont disponible sur le site web de l’organisme GINA.
La bronchiectasie
On définit la bronchiectasie comme étant une dilatation irréversible des voies aériennes causée par de l’inflammation et par une destruction des parois aériennes.
L’infection et l’obstruction sont les deux problèmes majeurs qui contribuent au développement des voies aériennes dilatées. Les voies aériennes sont généralement remplies d’un montant considérable de sécrétions purulentes.
- L’infection déclenche le processus inflammatoire.
- L’implication de la bronchiectasie dépend de la localisation et de l’étendue de l’infection : localisée ou elle peut être dans plus d’une région pulmonaire bilatérale.
- Il peut y avoir un défaut dans l’habilité des voies à se dégager ou à se protéger contre un pathogène bactérien.
- Anormalité de la structure des cils qui atteignent les voies inférieures, muqueuses nasales et réduction de la motilité des sécrétions.
- Syndrome Kartagener : sinusite, bronchiectasie et dextrocardie.
Cette pathologie est bilatérale dans approximativement 50% des cas et elle a une préférence pour les régions basales des poumons. Il y a trois différents types de dilatation avec la bronchiectasie : cylindrique, varicose, cystique (sacculaire). On peut aussi observer des changements microscopiques représentés par une ulcération et une métaplasie de l’épithélium bronchique.
Lorsque les voies aériennes sont devenues irréversiblement dilatées, leur mécanisme de défense contre les infections diminue et la fonction des cils vibratiles est perdue dans le site atteint. Des bactéries colonisent les voies aériennes agrandies et les sécrétions s’accumulent dans les sacs dilatés. Durant la maladie, le patient va avoir des périodes d’exacerbation à la suite d’infections des voies respiratoires, car le mécanisme de défense est altéré.
Cependant, les fonctions pulmonaires demeurent relativement normales durant la maladie à moins qu’une large région soit atteinte ou qu’il y ait une coexistence de bronchite chronique. En fin de stage, on peut retrouver : de l’hyperinflation, atélectasie, consolidation et fibrose.
Il existe plusieurs causes menant à cette pathologie. Malheureusement, on remarque une prévalence plus élevée chez les jeunes (adolescent) dans certains pays développés. On note 4 catégories distinctes expliquant le développement de cette pathologie :
- Obstruction bronchique acquise
- Aspiration d’objet
- Tumeurs au niveau des voies aériennes
- Infections (aspergiose, complications post opératoire)
- Obstruction congénitale
- Anormalités trachéo-bronchiques
- Anormalités vasculo-bronchiques
- Anormalités lymphato-bronchiques
- Atteinte immunitaire
- Insuffisance en IgA ou IgG
- Trouble sévère de la glande thyroïde
- Leucocytose
- Gestion inadéquate des sécrétions
- Certains syndromes dont : Kartagener, Young
- Fibrose kystique complexe
Certains pathogènes bactériens sont plus susceptibles de se retrouver dans les poumons des patients atteints de bronchiectasie, dont le streptococcus pneumonia, haemophilus influenzae, pseudomonas aeruginosa ainsi que les organismes anaérobiques.
Évaluation du patient nous révèle que:
- Toux et ↑ production de sécrétions (toux sèche dans 10 à 20% des cas)
- Sécrétions purulentes avec 3 couches distinctes
- Dyspnée
- Crépitements entendus dans les régions atteintes
- Hyperinflation (dans certains cas)
- Hippocratisme digital
- Hypertension pulmonaire et Cor pulmonale (dans certains cas)
- o Distension de la veine jugulaire
- o Œdème périphérique
- Hémoptysie
- o Le montant de sang fourni par les artères bronchiques augmente suite à un processus inflammatoire aérien. Les artères augmentent aussi en diamètre et en nombre avec la formation de nouvelles anastomoses entre les artères bronchiques et pulmonaires. (L’érosion inflammatoire et le traumatisme aux sites de ces changements vasculaires sont responsables pour l’hémoptysie rencontrée chez les patients atteints de cette maladie).
- Patron obstructif, mais peut avoir un portrait plus restrictif lors de la pathologie avancée
Diagnostic: Le test de fonction pulmonaire note généralement un patron obstructif. Il est cependant possible de voir un patron restrictif, particulièrement au stade avancé La radiographie pulmonaire révèle de l’hyperinflation, diaphragme aplati, cœur long et allongé lors de la présentation obstructive. Il est possible de voir les changements suivants lors d’une présentation restrictive; infiltrats, opacité, perte de volume, atélectasie/consolidation. Il est possible d’évaluer les sécrétions afin de confirmer les 3 couches de sécrétions distinctes.
ABG : Il est typique d’avoir une hypoxémie chez ces patients causés par un V/Q mismatch qui perdure.
| pH | CO2 | O2 | HCO3 | SaO2 |
| N | ↑ | ↓ | ↑ | ↓ |
Les traitements reposent principalement sur la prévention des exacerbations via la vaccination et la cessation tabagique. La gestion des sécrétions est aussi importante via de l’hygiène bronchique, des mucolytiques ou de la physiothérapie respiratoire.
La fibrose kystique
La fibrose kystique est une maladie génétique caractérisée par une anomalie dans la fonction des glandes exocrines. Au niveau du poumon, on se rappel que le liquide de la surface bronchique se compose d’eau et de mucus. Les canaux ioniques (CFTR) servent à la sécrétion active du chlore vers ce liquide. Ce mouvement du chlore entraîne un mouvement de sodium et d’eau. Cette présence d’eau permet d’hydrater adéquatement le liquide de la surface bronchique pour permettre un déblaiement mucociliaire efficace. Chez un client atteint de la fibrose kystique, il y a mutation du gène CFTR. Ceci entraîne un défaut dans la synthèse d’une protéine membranaire qui joue un rôle dans la fonction des canaux ioniques. Il en résulte une rétention cellulaire des ions de chlore et d’eau qui mène à une défectuosité d’hydratation du mucus et une hyperviscosité des sécrétions épithéliales. La viscosité du mucus devient trop importante et les cils ne peuvent pas déplacer le mucus à une vitesse convenable. Cette atteinte a un impact majeur au niveau pulmonaire, car la présence d’un mucus anormalement épais conduit à l’obstruction chronique des bronches ainsi qu’à la non-évacuation des poussières et des bactéries. Les infections respiratoires sont fréquentes et il y a inflammation à l’épithélium bronchique.
Au niveau du système digestif : Le mucus a tendance à bloquer les fins canaux du pancréas, empêchant les enzymes digestives produites par le pancréas de se déverser dans l’intestin et d’exercer leur activité. Les aliments n’étant que partiellement digérés, des carences importantes surviennent, qui peuvent donner lieu à un retard de croissance.
Au niveau des glandes sudoripares : Normalement, le corps réabsorbe le sel de la solution saline de la transpiration au fur et à mesure de sa montée à la surface. Les glandes sudoripares chez un CF ne sont pas capables de faire cette réabsorption de sel. On obtient comme résultat une peau au goût salé et le patient souffrant de CF est sujet à la déshydratation.
La maladie a aussi des répercussions majeures sur le foie et les organes reproducteurs (blocage des canaux déférents : 95% des hommes sont stériles)
Cette maladie touche l’ensemble des organes revêtus d’un épithélium glandulaire. Il y a atteint au chromosome 7, plus particulièrement au gène CFTR (cystic fobrosis transmembrane conductance regulator) qui code une protéine dont la fonction est essentielle à l’organisme. Elle est transmise génétiquement par un trait autosomique récessif. L’atteinte est au chromosome 7.
L’évaluation du patient révèle:
- Patron respiratoire obstructif
- Toux productive avec production de sécrétions vertes et épaisses
- Crépitements gras / sons bronchiques anormaux à l’auscultation
- Hippocratisme digital
- Cyanose
- Thorax en tonneau (dans certains cas)
- Cor pulmonale (dans certains cas)
- o Distension de la veine jugulaire
- o Œdème périphérique
- Respiration à lèvres pincés (lors de cas obstructifs grave)
Le diagnostic de la maladie repose évidement sur l’analyse génétique afin de confirmer la fibrose kystique. On note alors une mutation au gène CFTR. Il est possible de faire le test de fonction pulmonaire qui démontre un patron obstructif. Il est aussi possible de noter de l’hyperinflation lors de cas sévère. La radiographie à tendance à avoir un patron alvéolaire causé par le surplus de sécrétions ainsi qu’une cardiomégalie lorsqu’un cor pulmonale s’est développé. Le test de sudation peut aussi démontrer la pathologie lorsqu’on note un résultat de chlore supérieur à 60 mEq/L ( à noter que la norme est sous 30 mEq/L).
Certains pathogènes sont plus propice à venir infecter les patients atteint de la fibrose kystique. Ainsi, l’analyse bactérienne devient très pertinente. Les principaux organismes à gram positif qui touche ces patients sont: le staphylococcus aureus et l’haemophilus influenza. Du côté des gram négative, on parle plus de la pseudomonas aeruginosa, le stenotrophomonas maltophilia et le Burkholderia cepacia complex.
Les traitements pour la fibrose kystique sont basés sur une approche qui tend à réduire les conséquences cliniques de la maladie et à traiter les complications lorsqu’elles se produisent.
- Drainage broncho-pulmonaire
- Antibiotiques : Tobramycin (inhalatoire), azithromycin et autres
- Ibuprofène : haut dosage (enfant)
- Bronchodilatateurs
- Diminuer la viscosité des sécrétions = Dornase Alfa (pulmozyne). Le mécanisme d’action: mucolytique peptide qui diminue ADN extracellulaire lorsqu’administré chez le patient ayant des sécrétions purulentes. Il diminue la viscosité et adhésivité des sécrétions respiratoires infectées.
- Diurétiques : Amiloride, typiquement administré via inhalation. Le mécanisme d’action: diurétique épargneur de potassium; bloque la réabsorption du Na+ (+ eau) aux cellules… le Na= demeure dans le mucus.
- Autres : oxygénothérapie, hydrations adéquates, diète spéciale : hyper calorique et suppléments de vitamines (A,D,E et K) , et enzymes pancréatiques: Flozyme, cotazym, Salofalk
Plusieurs recherches sont dans le milieu afin de trouver un traitement pour la pathologie. Le médicament Trikafta est maintenant disponible Canada et semble prometteur dans la gestion des symptômes de la pathologie.
Obstruction des grosses voies respiratoires
Les maladies obstructives que nous avons étudiées jusqu’à maintenant affectent les voies respiratoires en dessous de la carène. Cependant, il existe également des maladies ou atteintes médicales qui se situent au niveau des grosses voies respiratoires, soit au niveau du pharynx, du larynx, la trachée et les bronches souches. Les voies respiratoires peuvent être affectées suite à un problème d’origine aiguë (infection : dysfonctionnement des cordes vocales, épiglottite, dommage thermique ou encore aspiration de corps étranger, subaiguë ou encore chronique (tumeur ou laryngo-trachéobronchomalacie).
Plusieurs tests nous permettent de vérifier les grosses voies respiratoires afin de poser un diagnostic, par exemple l’utilisation de la bronchoscopie afin d’explorer l’anatomie des voies supérieures est d’une grande utilité. Cependant, on se sert également des fonctions pulmonaires afin d’évaluer le degré d’obstruction.
Laryngo-trachéo-bronchomalacie: Le suffixe malacie (malacia) vient du grec malakia, malakos et signifie mollesse ou mou. La présentation clinique entre une laryngomalacie, trachéomalacie ou bronchomalacie varie selon la région anatomique qui est atteinte des voies respiratoires supérieures, soit au niveau extrathoracique ou intrathoracique. La majorité des cas de trachéomalacie sont d’origine intrathoracique, principalement d’origine congénitale. La laryngomalacie, ou larynx mou est la cause congénitale la plus fréquente de respiration bruyante, ou stridor associée à des difficultés d’alimentation chez les nouveau-nés. Les tissus supraglottiques, situés au-dessus des cordes vocales, sont trop souples. L’épiglotte relevée (en forme de tube ou d’oméga) est typique de cette pathologie. Dans les cas graves, l’épiglotte est basculée en arrière jusqu’à toucher le pharynx, en obstruant totalement les voies aériennes.
La trachéomalacie survient lorsque les parois de la trachée s’affaissent. Cela peut se produire parce que les parois de la trachée sont faibles ou parce que quelque chose y presse. La trachée entière peut être affectée, ou seulement un petit morceau de celle-ci.
- Si la partie effondrée de la trachée est à l’extérieur de la cage thoracique, la présentation du test de fonction pulmonaire sera celle d’une obstruction extrathoracique variable.
- Si la partie effondrée de la trachée se situe où la trachée est à l’intérieur du thorax, la présentation du test de fonction pulmonaire sera celle d’une obstruction intrathoracique variable.
- Si la partie effondrée de la trachée dépasse, la zone où la trachée est à l’intérieur du thorax se ramifie dans les deux poumons, on parle de bronchomalacie ou trachéobronchomalacie. La présentation du test de fonction pulmonaire sera celle d’une obstruction intrathoracique variable.
- La trachéobronchomalacie se définit comme un ramollissement excessif des anneaux cartilagineux et/ou de la paroi membraneuse postérieure entraînant une réduction du diamètre antéro-postérieur de plus de 50 % d’une portion ou de l’ensemble des voies aériennes.
Les dysfonctionnements des cordes vocales correspondent à des mouvements paradoxaux ou dysfonctionnels des cordes vocales et sont définis comme une adduction des cordes vocales à l’inspiration et une abduction à l’expiration; ils provoquent une obstruction des voies respiratoires à l’inspiration et un stridor qui est souvent confondu avec l’asthme.
Il n’existe pas d’étiologie unique, mais plusieurs étiologies dont l’hypersensibilité laryngée, l’asthme, le reflux gastrique et rarement des troubles neurologiques, tels que des crises de paniques ou encore des incidents soudains qui coupent le souffle. Le dysfonctionnement des cordes vocales est le plus souvent observé chez la femme de 20 à 40 ans. L’étiologie n’est pas évidente, mais il semble associé à l’anxiété, à la dépression, au trouble de stress post-traumatique et aux troubles de la personnalité.
L’aspiration de corps étrangé est un accident fréquent chez le jeune enfant et peut se produire dès le 5° mois de vie. Les corps étrangers inhalés sont très divers.
Certains cas sont évidents.
- L’enfant inhale un corps étranger qui se coince dans le larynx et entraîne une asphyxie mortelle en quelques minutes avant qu’aucune aide ne puisse arriver. C’est heureusement exceptionnel…!
- L’enfant inhale au cours du repas ou de ses jeux un objet en présence de témoins. Brutalement, il suffoque, fait de violents efforts de toux sous forme de quintes coqueluchoïdes, se cyanose et en quelques instants, retrouve une respiration normale. C’est le “syndrome de pénétration” qui se calme le plus souvent assez rapidement.
- Il faut alors faire une radiographie pour situer l’endroit du blocage et une bronchoscopie pour retirer l’objet.
D’autres cas sont plus difficiles à diagnostiquer.
- Le syndrome de pénétration a été très discret : 2 ou 3 secousses de toux puis plus rien.
- Ou bien, le syndrome de pénétration n’a été constaté par aucun témoin, l’enfant jouant seul dans sa pièce. Dès lors, la mère ne remarque rien, si ce n’est parfois la disparition insolite du nez du nounours ou d’un œil de la poupée…!
- L’enfant respire normalement quelques jours ou quelques semaines et puis brutalement se met à tousser. Cette toux est souvent variable dans le temps et avec la position de l’enfant. Des signes respiratoires et infectieux (fièvre) apparaissent. Le médecin consulté évoquera une crise d’asthme, une bronchite, une laryngite voire une coqueluche et différents traitements seront proposés : antibiotiques, corticostéroïdes, théophylline, antitussifs, etc. Sans grand succès. Certes une amélioration sera obtenue temporairement, mais les rechutes seront inéluctables tant que le diagnostic correct n’aura pas été posé.
Le siège de l’arrêt du corps étranger dans l’arbre respiratoire peut modifier les signes cliniques.
- Dans l’hypopharynx, ce sont les troubles de déglutition qui prédominent.
- Dans le larynx, l’asphyxie est rapidement mortelle.
- Dans la trachée, c’est une toux permanente. L’objet est souvent mobile avec la respiration et audible à l’ auscultation.
- Dans les bronches, la symptomatologie est variable. Le corps étranger peut être creux ou plat et dans ce cas ne pas gêner le libre passage de l’air.
Dans certains cas, l’objet s’enclave et obstrue tout à fait la lumière bronchique. L’air ne peut donc pas pénétrer dans le territoire pulmonaire correspondant. Les alvéoles ne sont plus ventilées et le parenchyme pulmonaire concerné se rétracte, ce collapse : c’est l’atélectasie.
Dans d’autres cas, à l’inspiration, l’air arrive à s’infiltrer entre l’objet et les parois grâce à la dilatation de la bronche, mais à l’expiration, il ne peut plus sortir. En effet, la bronche se contracte, enserre un peu plus l’objet inhalé et l’air reste emprisonné, trappé, dans les alvéoles. À l’inspiration suivante, une nouvelle bouffée d’air pénètre, s’immisce derrière le corps étranger et se trouve également bloquée. Ce phénomène de soupape provoque un emphysème pulmonaire.
Partie B: Les maladies interstitielles
Les pathologies interstitielles: en gros
Les pneumopathies interstitielles diffuses sont un groupe hétérogène de maladies qui sont caractérisées par un épaississement du septum alvéolaire, une prolifération de fibroblastes, un dépôt de collagène et, si le processus n’est pas enrayé, par une fibrose pulmonaire. Elles possèdent, entre autres, deux grandes composantes pathologiques communes: un processus inflammatoire des murs et espaces alvéolaires et un processus de cicatrisation. En général, les maladies pulmonaires interstitielles produisent un patron restrictif (et parfois mixte). Cependant, parce qu’il peut y avoir de l’inflammation et de la constriction des muscles lisses des petites voies respiratoires, on peut aussi y retrouver des manifestations associées à un patron obstructif.
2 composantes majeures :
- Processus inflammatoire (alvéolite): Aiguë : Caractérisé par de l’œdème et infiltration d’une variété de cellules blanches (neutrophiles, éosinophiles, macrophages et lymphocytes) dans les murs alvéolaires et l’espace interstitiel. Peut aussi avoir de l’inflammation bronchique avec épaississement et augmentation de sécrétions. Chronique : caractérisé par l’infiltration de cellules blanches, surtout monocytes, macrophages et lymphocytes, et peut avoir des fibroblastes dans les murs alvéolaires et dans l’espace interstitiel.
- Processus de cicatrisation: Fibrose
Stage final : Les manifestations distinctives d’alvéolites seront absentes lorsque la maladie est présente pour un temps suffisamment long et qu’elle est associée à un processus significatif de fibrose. On retrouve une voie commune finale qui est caractérisée par des régions avec contractions et des régions démontrant la formation de kystes aériens (apparence honeycomb).
Un groupe imposant de maladies se retrouve dans cette catégorie de maladies. Dans certains cas, on connaît l’étiologie de l’insulte primaire et, dans d’autres cas, l’étiologie demeure inconnue. En fait, les pneumopathies interstitielles diffuses peuvent être classées selon différents critères (p. ex., aiguë versus chronique, non granulomateuse versus granulomateuse, cause connue versus cause inconnue, une maladie pulmonaire primitive versus secondaire à une maladie systémique, antécédent de tabagisme versus pas d’antécédent de tabagisme).
Il existe plus de 150 maladies dans ce groupe. Elles sont classifiées d’après leur étiologie, le type de cellules inflammatoires qui prédominent et la présence de certains critères pathologiques qui aident à différencier une maladie d’une autre.
Exposition:
- Pneumoconiose : Asbestose, Silicose, Bérylliose et Charbon
- Iatrogène : médicaments, drogues et radiation
- Pneumonie d’hypersensibilité : Farmers lung
Maladies des tissus conjonctifs/collagènes :
- Sclérodermie
- Arthrite rhumatoïde
- Lupus érythémateux systémique (SLE)
- Wegener et Goodpasture
Maladies interstitielles d’étiologie inconnues:
- Sarcoïdose
- Fibrose pulmonaire idiopathique (IPF)
L’évaluation du patient:
Les répercussions qui nous touchent particulièrement sont :
- ↓Cst et ↓VT
- Diffusion alvéolo-capillaire altérée
- Anormalités des petites voies respiratoires
- Échange gazeux
- Hypertension pulmonaire
Signes et symptômes généraux:
- Dyspnée, surtout à l’effort, Tachypnée, hypopnée
- Toux sèche (parfois productive, hémoptysie et accompagnée de sibilances)
- Crépitements fins inspiratoires (bilatéraux surtout aux bases), présence de sons bronchiques anormaux, matité, pectoriloquie
- Hippocratisme digital
- Signes d’hypertension pulmonaire avec insuffisance du cœur droit : distension de la veine jugulaire et œdème pédale.
- Signes associés à une maladie du tissu conjonctif : inflammation ou déformation des joints ou érythème
Le diagnostic repose sur le test de fonction pulmonaire qui démontrera un patron restrictif, et ainsi une diminution des volumes pulmonaires. La radiographie sera aussi pertinente en permettant de voir:
- Beaucoup de variabilité entre les différentes étiologies
- ↓ volume pulmonaire
- Patron réticulaire ou réticulo-granulaire (marques linéaires et petits nodules)
- Granulomes
- Formation de cavité et kystes aériens (forme ‘’honeycomb’’)
- Ground glass
Pour l’ABG, il est typique d’avoir une hypoxémie chez ces patients causés par un trouble de diffusion à l’exercice qui perdure.
On peut voir un portrait léger, souvent associé à la stimulation des récepteurs pulmonaires (J ++)
| pH | CO2 | O2 | HCO3 | SaO2 |
| ↑ | ↓ | ↓ | N | ↓ |
On peut voir un portrait plus sévère avec une compensation rénale
| pH | CO2 | O2 | HCO3 | SaO2 |
| N | ↑ | ↓ | ↑ | ↓ |
Les traitements dépendent vraiment de la fibrose pulmonaire qui touche le patient. On traite principalement :
- Prévention : Cessation du tabagisme, vaccination, activité physique, etc.
- Symptômes : Antibiotiques, oxygénothérapie, bronchodilatateur, etc
- Autres : transplantation, réhabilitation pulmonaire, etc.
Les maladies interstitielles d’origine inorganiques
Les particules inorganiques : pneumoconioses
- Résultent habituellement d’un contact prolongé dû à l’occupation.
- Certaines pneumoconioses continuent à progresser même lorsque l’exposition à la particule a été discontinuée.
- Nécessitent une poussière organique ou inorganique de grosseur spécifique pour se loger dans les bronchioles respiratoires et les alvéoles (0.5-5.0 microns).
- Aucun traitement efficace – prévention est la clé
La pneumoconiose des mineurs de charbon est provoquée par l’inhalation de poussière de charbon. Les dépôts de poussière produisent des macrophages chargés de poussière autour des bronchioles (macules de charbon). Elle n’entraîne habituellement pas de symptômes, mais peut évoluer vers une fibrose pulmonaire progressive massive avec altération de la fonction pulmonaire.
Les macrophages alvéolaires phagocytent la poussière, libèrent les cytokines qui stimulent l’inflammation et s’accumulent dans l’interstitium du poumon autour des bronchioles et des alvéoles (macules de charbon). Les nodules de charbon se développent alors que le collagène s’accumule. On peut observer une fibrose, mais elle est habituellement limitée aux zones adjacentes aux macules de charbon. Un petit pourcentage de patients atteints de la pneumoconiose des mineurs de charbon développe une fibrose pulmonaire diffuse (macule de charbon moins toxique que la silicose).
Deux formes de pneumoconiose des mineurs de charbon sont décrites:
- La forme simple, avec des macules/nodules (petites tâches) de charbon individuel : 1 à 2 % progressent vers une fibrose pulmonaire.
- La forme compliquée, avec une coalescence des macules/nodules vers une fibrose pulmonaire progressive massive : les nodules fusionnent pour former des masses parenchymateuses noires, élastiques qui confluent habituellement dans les zones pulmonaires postérieures supérieures. Les masses peuvent envahir et détruire les vaisseaux et les voies respiratoires. La fibrose pulmonaire progressive massive peut continuer à se développer et progresser même après l’arrêt de l’exposition à la poussière de charbon.
La pneumoconiose des mineurs de charbon est provoquée par l’inhalation chronique de poussière de charbon riche en carbone (anthracite et bitumineux), généralement sur une période ≥ 20 ans.
Évaluation du patient :
- Souvent asymptomatique
- Toux chronique
- Crachats noirs (même si le patient ne fume pas)
- Dyspnée progressive (forme compliquée) : hypertension pulmonaire, cor pulmonale et défaillance respiratoire
Le diagnostic dépend des antécédents d’exposition à la poussière de charbon. Radiographie ou TDM du thorax : multiples petites densités nodulaires. Des anomalies en nid d’abeilles ont également été rapportées
Le traitement est généralement symptomatique. Parfois, une oxygénothérapie et une rééducation fonctionnelle respiratoire sont nécessaires. Restriction d’une exposition ultérieure. Les masques respiratoires ne fournissent qu’une protection limitée.
La silicose est provoquée par l’inhalation de poussière (libre) de silice cristalline et est caractérisée par une fibrose pulmonaire nodulaire. La silicose chronique ne donne que peu de symptômes au début ou seulement une dyspnée modérée, mais avec le temps, elle peut évoluer, atteindre presque la totalité du poumon et entraîner une dyspnée, une hypoxémie, une hypertension artérielle pulmonaire et une insuffisance respiratoire. La silicose chronique est la forme la plus fréquente et ne se développe généralement qu’après des décennies d’exposition.
La silicose aiguë et la plus rare silicose accélérée sont provoquées par des expositions intenses à la poussière de silice pendant de courtes périodes (plusieurs mois ou années). Les mineurs atteints de silicose ont 30 fois plus de risque de contracter une tuberculose et une infection mycobactérienne non tuberculeuse, en comparaison avec la population générale avec des manifestations pulmonaires et extra pulmonaires. Les macrophages alvéolaires phagocytent les particules inhalées de silice libre et pénètrent dans les lymphatiques et le tissu interstitiel. Les macrophages entraînent la libération de cytokines, de facteurs de croissance et d’oxydants, stimulant l’inflammation parenchymateuse, la synthèse de collagène, et, finalement, la fibrose.
Lorsque les macrophages meurent, ils libèrent la silice dans le tissu interstitiel autour des petites bronchioles, provoquant la formation d’un nodule silicotique qui progresse en une zone dense cicatricielle fibrohyaline, avec un aspect classique en peau d’oignon, entourée par une couche externe de cellules inflammatoires. La progression de la maladie en une forme plus sévère dépend de la quantité et de la durée d’Exposition aux fibres de silicoses.
- La plus ancienne atteinte pulmonaire professionnelle connue et la plus toxique.
- Inhalation de minuscules particules de silicium habituellement sous forme de quartz.
- Les travailleurs les plus exposés sont ceux qui :
- Déplacent ou font exploser de la roche et du sable (mineurs, ouvriers des carrières, tailleurs de pierres)
- Utilisent de la roche contenant de la silice ou des abrasifs (sableurs, potiers; verriers; fondeurs, tailleurs de pierres précieuses, prothésistes dentaires et travailleurs de la céramique; potiers.
Évaluation du patient :
- Début asymptomatique
- Une dyspnée d’effort qui évolue en une dyspnée permanente.
- Une toux productive (coexistant avec une bronchite chronique professionnelle (industrielle) ou liée au tabagisme).
- Le murmure vésiculaire à l’auscultation diminue à mesure que la maladie progresse et une condensation pulmonaire, une hypertension artérielle pulmonaire et une insuffisance respiratoire avec ou sans insuffisance cardiaque droite peuvent se développer.
- Les patients qui ont une silicose évolutive rapide ont les mêmes symptômes que ceux qui présentent une silicose chronique, mais ceux-ci sont d’apparition plus rapide, soit une progression rapide de la dyspnée, une perte de poids et une fatigue, avec des crépitants diffus bilatéraux.
Le diagnostic repose sur l’histoire professionnelle d’exposition à la silice cristalline
- Radiographie ou TDM du thorax :
- Opacités arrondies ou des nodules multiples de 1 à 3 mm habituellement observés dans la partie supérieure du poumon
- Les ganglions lymphatiques hilaires et médiastinaux calcifiés sont fréquents et prennent parfois un aspect caractéristique en coquille d’œuf qui permet de distinguer la silicose des autres atteintes pulmonaires.
- Parfois, biopsie tissulaire pour confirmation
Le traitement repose sur le retrait de l’exposition, lorsque possible. Les mesures préventives les plus efficaces de la silicose doivent être prises au niveau des entreprises :
-
- la suppression de la poussière, des processus d’isolement, la ventilation et l’utilisation d’abrasifs ne contenant pas de silice.
- les masques respiratoires protègent imparfaitement et, bien qu’utiles, ils ne sont pas une solution adéquate.
- la surveillance des travailleurs exposés au moyen de questionnaires standardisés, d’une spirométrie et d’une radiographie du thorax est recommandée. La fréquence de la surveillance dépend du degré de l’intensité d’exposition. D’autres mesures préventives comprennent le sevrage tabagique et la vaccination contre le pneumocoque et la grippe.
L’asbestose est une forme de fibrose pulmonaire interstitielle liée à l’inhalation des fibres d’amiante.
L’amiante est un silicate naturel fibreux dont on utilise les propriétés structurelles et les propriétés de résistance à la chaleur dans les matériaux de construction et du bâtiment, les freins automobiles et certains textiles. Le patient présentant une asbestose est à risque plus élevé de cancer du poumon, soit plus spécifiquement au cancer de la plèvre.
Les macrophages alvéolaires tentant de phagocyter les fibres inhalées libèrent des cytokines et des facteurs de croissance qui provoquent une inflammation, des lésions oxydatives, un dépôt de collagène et, finalement, une fibrose. Les fibres d’amiante peuvent également être directement toxiques pour le tissu pulmonaire. Le risque est dose-dépendant, lié à la durée, à l’intensité de l’exposition et au type, à la longueur et à l’épaisseur des fibres inhalées. Les travailleurs de la construction navale, du textile et du bâtiment, les employés chargés du désamiantage et les mineurs exposés aux fibres d’amiante. Une exposition peut survenir chez les membres de la famille d’employés exposés et environnementalement chez les personnes vivant près des gisements à ciel ouvert.
Évaluation du patient :
- L’asbestose est longtemps asymptomatique
- Dyspnée progressive, une toux non productive et une fatigue.
- La maladie progresse chez >10% des patients après l’arrêt de l’exposition.
- L’asbestose avancée peut entraîner un hippocratisme digital, des crépitants des bases et, dans les cas sévères, une symptomatologie d’insuffisance ventriculaire droite.
Diagnostic :
- Exposition
- Radiographie du thorax, de préférence TDM du thorax haute résolution : des opacités linéaires réticulées habituellement dans la périphérie des lobes inférieurs. Les opacités sont souvent bilatérales et accompagnées par des plaques pleurales.
- Parfois, lavage bronchoalvéolaire et biopsie pulmonaire en cas de doute : présence de corps asbestosiques.
Traitements :
- Arrêt de l’exposition
- Arrêt du tabagisme
- Vaccination anti-pneumocoque et contre la grippe
- Soins de support: Il n’existe aucun traitement spécifique
La bérylliose aiguë et chronique est provoquée par l’inhalation de poussières ou de fumées de composés ou de produits dérivés du béryllium. La bérylliose aiguë est à présent rare; la bérylliose chronique est caractérisée par la formation de granulomes disséminés dans tout l’organisme, en particulier les poumons, les ganglions intrathoraciques et la peau.
La bérylliose aiguë est une pneumopathie chimique rare. La bérylliose chronique reste une maladie fréquente dans les industries qui utilisent du béryllium et les alliages de béryllium. Elle se distingue de la plupart des pneumoconioses, car c’est une maladie d’hypersensibilité à médiation cellulaire. Les lymphocytes T dans les poumons ou d’autres organes reconnaissent le béryllium, prolifèrent et forment des clones de lymphocytes T. Une granulomatose diffuse du poumon et des ganglions lymphatiques hilaires. L’exploitation et l’extraction minière du béryllium, la production d’alliage, les machines d’alliage de métaux, l’électronique, les télécommunications, la fabrication des armes nucléaires, les industries de défense, l’industrie aéronautique, automobile, spatiale, de la ferraille, la bijouterie, les prothèses dentaires, les ordinateurs et le recyclage des produits électroniques. De faibles quantités de béryllium sont toxiques et sont ajoutées à de nombreux alliages de cuivre, aluminium, nickel, magnésium, les travailleurs ne sont pas toujours conscients de l’exposition et des risques.
Évaluation du patient :
- Présentation souvent asymptomatique pendant plusieurs mois
- Les patients qui présentent une bérylliose chronique ont souvent une dyspnée (progressive), douleur thoracique, une toux, des sueurs nocturnes, une fatigue et une perte de poids.
- Les symptômes peuvent se développer en quelques mois après la première exposition ou >30 ans après l’arrêt de l’exposition.
Diagnostic:
- Le diagnostic repose sur l’anamnèse, le test de prolifération des lymphocytes au béryllium et éventuellement la biopsie.
- Radiographie ou TDM : montre généralement des opacités nodulaires pulmonaires dans les zones moyennes et supérieures, associées avec des adénopathies hilaires et médiastinales.
- Lavage bronchoalvéolaire : un test de prolifération lymphocytaire anormal (BeLPT :beryllium lymphocyte proliferation test) effectué sur du sang et/ou du liquide de lavage bronchoalvéolaire.
Traitements :
- Patient symptomatique : corticostéroïdes
- Soutien : oxygénothérapie, réadaptation pulmonaire, ventilation mécanique et traitement de l’insuffisance du cœur droit
- Dans des stades très sévères de bérylliose chronique, parfois la transplantation pulmonaire a été indiquée
L’alvéolite allergique
L’alvéolite allergique est aussi appelée une pneumonie d’hypersensibilité et est une maladie interstitielle assez répandue. On la défini comme étant une réponse des poumons à des antigènes spécifiques contenus dans les poussières organiques et inorganiques. Il s’agit une réaction d’hypersensibilité qui se déclenche chez un patient. Typiquement une réaction de type 3, mais peut aussi être de type 4.
Les agents responsables sont communément des microorganismes ou une protéine provenant d’un animal ou d’un aliment; certains composés chimiques peuvent aussi être la cause
- Actinomycète thermophilique présent dans le foin
- Microorganismes présents dans les humidificateurs et les airs conditionnés
- ‘bird breeder’s or fanciers lung’ causé par les protéines des oiseaux
Évaluation du patient :
- Forme aiguë: dyspnée, fièvre, toux, frissons, infiltrats sur la radiographie : infiltrats, formation de granulome, fibrose alvéolaire et bronchiolite chez 50% des gens atteint. Peut être observée 4 – 8 heures après l’exposition. Il peut y avoir présence de nausées, vomissements et anorexie
- Forme chronique: dyspnée à l’effort, toux productive, léthargie, perte de poids. À la radiographie : patron réticulaire et présence de nodules
Le diagnostic de cette maladie se repose principalement sur l’histoire du patient afin de trouver la cause aux différents symptômes. On peut aussi se baser sur les données des différents tests tels que la radiographie et les fonctions pulmonaires. Une particularité de cette pathologie est la présence de Ag dans le sang.
Il y a peu de traitement pour cette pathologie, il suffit de retirer l’environnement responsable des symptômes (si possible) et de traiter les symptômes. La majorité des cas, les corticostéroïdes seront nécessaires.
Maladies interstitielles d’origine auto-immune
Il s’agit de désordres dans lesquels il y a inflammation de plusieurs systèmes qui sont d’origine immunologique. Les organes atteints varient d’une maladie à l’autre, mais habituellement le poumon est impliqué. Cependant, ces maladies affectent aussi les bronchioles ce qui peut mener à un processus obstructif ou mixte.
Certains facteurs augmentent les chances qu’une personne développe une maladie auto-immune. Ces facteurs sont : la prédisposition génétique, l’environnement (infection virale, drogues), l’ethnicité ainsi que le sexe à la naissance.
Le lupus érythémateux disséminé (SLE), est une maladie systémique qui touche particulièrement les reins, le cœur, les poumons et la peau. Il s’agit d’une réaction de type 3 et production d’auto-anticorps à une variété de composantes tissulaires (érythrocytes, plaquettes, lymphocytes). On note du dommage tissulaire suite à la déposition des complexes immunitaires et à l’activation du complément, surtout dans les membranes basales (du rein et de la peau) et dans les murs vasculaires
Cette pathologie touche les femmes (d’ordre de 70-90%), typiquement ceux dans l’âge de procréer. Certaines études ont noté un lien entre le développement de la pathologie face à certains déclencheurs environnementaux et lors de la prise de certains médicaments (dont des traitements pour l’hypertension).
Évaluation du patient relève:
- Épisodes d’exacerbations et rémissions
- Fièvre, malaise, faiblesse, anorexie, perte de poids
- Arthralgie et arthrite
- Infections (immunité à médiation cellulaire diminuée)
- Lésions de la peau (érythème en papillon)
- Implication rénale (glomérulonéphrite, insuffisance rénale)
- L’inflammation des membranes séreuses cause l’épanchement pleural et péricardique
Le diagnostic s’exprime avec la présence d’anticorps antinucléaires lors de la prise de sang, ainsi que les différents signes et symptômes.
Les traitements sont sélectionnés selon la gravité des symptômes et peuvent être des anti-malariques (associé à une diminution des symptômes), des anti-inflammatoires ainsi que la gestion des symptômes.
La polyarthrite rhumatoïde est une maladie causant l’inflammation des articulations. Le développement de cette pathologie dépend de : prédisposition génétique, facteurs environnementaux, réaction d’hypersensibilité type 3. Malgré que cette pathologie soit auto-immune, les récentes études ont démontré des corrélation génétique qui peuvent venir appuyer la propagation de la pathologie. Certains facteurs environnementaux ont aussi été étudiés afin d’expliquer le développement de cette pathologie dont les infections virales, le tabagisme, certains médicaments et la sédentarité.
L’évaluation du patient peut démontrer une douleur dans les articulations, la présence de nodules à la radiographie, des épanchements pleurales et péricardiques.
Le diagnostic s’exprime avec la présence de facteurs rhumatoïdes (RF) lors de la prise de sang, ainsi que les différents signes et symptômes.
Les traitements sont sélectionnés selon la gravité des symptômes et peuvent être des anti-malariques (associé à une diminution des symptômes), des anti-inflammatoires ainsi que la gestion des symptômes.
La sclérose systémique progressive, aussi appelé sclérodermie est une maladie caractérisée par une fibrose diffuse et une vascularisation anormale à l’intérieur de la peau. Elle affecte principalement le tractus gastro-intestinal, le cœur, les reins et les poumons.
L’évaluation du patient peut démontrer:
- Épaississement cutané généralisé (apparence cireuse)
- Phénomène de Raynaud (spasmes des artérioles, plutôt aux extrémités)
- Dysfonction de l’œsophage (dysphagie, reflux gastrique)
- Arthralgie
- Fibrose pulmonaire, épanchement pleural, hypertension pulmonaire
Le diagnostic s’exprime avec la présence d’anticorps antinucléaires lors de la prise de sang, ainsi que les différents signes et symptômes.
Le traitement est généralement symptomatique et fonction des organes atteints. Aucun médicament n’influe significativement sur le cours naturel de la sclérodermie, mais divers médicaments sont utiles dans le traitement de symptômes spécifiques ou de systèmes d’organes. Corticostéroïdes / pénicillamine (inhibe le croisement du collagène et a des propriétés immunosuppressives et anti-inflammatoires) et méthotrexate /nifédipine
Le syndrome de Goodpasture est une combinaison d’hémorragie alvéolaire diffuse et d’une glomérulonéphrite associée avec la déposition linéaire d’immunoglobuline dans les poumons et les reins. La pathologie s’explique par une réaction cytotoxique de type II et par la présence d’anticorps anti-GBM sanguins. Certains facteurs déclenchants ont été associés à la maladie : infections, la fumée de cigarette et la génétique
L’évaluation du patient peut démontrer de l’hémoptysie sévère, une dyspnée, une défaillance rénale, de l’anémie, de l’hématurie et de la protéinurie. Il est commun de noter un patron alvéolaire à la radiographie suite à la présence d’hémoptysie sévère.
Le diagnostic s’exprime avec la présence d’anti-GBM lors de la prise de sang, ainsi que les différents signes et symptômes.
Le traitement est basé sur l’échange plasmatique permettant de diminuer le compte d’anti-GBM qui est en cause dans cette présentation. Les corticostéroïdes sont aussi une ligne de traitement importante. On doit aussi considérer l’intubation lorsque la présence d’hémoptysie sévère est présente.
La granulomatose avec polyangéite, aussi appelé la granulomatose de Wegner est une forme de vascularite nécrosante; désordre qui affecte les voies respiratoires supérieures, des poumons et souvent des reins. Il s’agit d’une réaction d’hypersensibilité de type 3 et/ou 4.
L’évaluation du patient est semblable au syndrome de Goodpasture avec la présence d’hémoptysie, de dyspnée et d’hématurie. On note une atteinte au sinus et aux voies aériennes supérieures.
Le diagnostic s’exprime avec la présence de granulomes à la radiographie ainsi que les différents signes et symptômes.
Le traitement est basé sur l’utilisation des corticostéroïdes. On doit aussi considérer l’intubation lorsque la présence d’hémoptysie sévère est présente.
Maladies interstitielles d’origine inconnues
La sarcoïdose est une maladie inflammatoire caractérisée par une infiltration d’un ou plusieurs organes et tissus par des granulomes. La sarcoïdose touche le plus souvent les personnes entre 20 et 40 ans, mais parfois les enfants et les adultes plus âgés. À l’échelle mondiale, la prévalence est plus grande chez les Noirs américains et les Européens du Nord, en particulier chez les Scandinaves. Le poumon et le système lymphatique sont les organes habituellement affectés par la maladie, mais d’autres organes peuvent être atteints également. L’étiologie est inconnue, mais elle est considérée comme résultant d’une réponse inflammatoire anormale à un antigène (Ag) environnemental chez une personne génétiquement prédisposée. L’Ag non identifié est le médiateur d’une réponse immunitaire à médiation cellulaire caractérisée par l’accumulation de lymphocytes T et de macrophages, la libération de cytokines. Ces cytokines sont lors responsable du processus inflammatoire qui s’en suit.
On note une grande quantité de granulomes au niveau pulmonaire dans cette pathologie. Il est important de se rappeler que des granulomes sont des amas de cellules et macrophages. Ces ganglions sont aussi présent dans le système lymphatique.
Malgré que la maladie est d’origine inconnue, certaines études proposent des déclencheurs qui semblent être en cause avec la sarcoïdose dont :
- Propionibacterium acnes et des mycobactéries (potentiellement la protéine Mycobacterium tuberculosis)
- Moisissures et certaines substances non identifiées présentes sur le lieu de travail dégageant des odeurs de moisi
- Pesticides
L’évaluation du patient peut démontrer au niveau pulmonaire, une toux, de la dyspnée et une sensation d’inconfort à la poitrine. Les autres symptômes différentiels sont la perte de poids, une fatigue extrême et des épisodes d’augmentation rapide des symptômes.
Le diagnostic s’exprime avec la présence de granulomes à la radiographie. Il est aussi possible de voir une atteinte lymphatiques à la radiographie via une congestion qui semble provenir des hiles. Les signes et symptômes sont aussi très pertinent. Puisque cette maladie est d’origine inconnue, il est plus difficile de faire le diagnostic.
Le traitement est basé sur la gestion des signes et symptômes. On peut aussi administrer des immunosuppresseurs afin de diminuer la réponse du corps. Les anti-inflammatoires sont aussi recommandés.
La fibrose pulmonaire idiopathique (FPI) est caractérisé par un processus inflammatoire qui n’a pas de cause connue. Cette pathologie affecte principalement les hommes de plus de 50 ans. Plus l’âge augmente, plus l’incidence de cette pathologie augmente. On note une association de facteurs inconnus environnementaux, génétiques et autres contribuent probablement au dysfonctionnement des cellules épithéliales alvéolaires ou à leur reprogrammation, ce qui induit une fibroprolifération anormale dans le poumon. Cette pathologie démontre un portrait clinique plus important que les autres maladies interstitielles. La détérioration des patients atteint peut se faire très rapidement, et l’implication pulmonaire via le processus inflammatoire est très important.
L’évaluation du patient démontre que la FPI se développe généralement en 6 mois à plusieurs années et comprend une dyspnée et une toux non productive. On note aussi de l’hippocratisme digital dans la majorité des cas et un cor pulmonale peut se développé.
Le diagnostic s’exprime par un patron réticulaire diffus et sévère à la radiographie ainsi que la présence de kystes focaux. Ceci sont caractérisés par une destruction de la membrane alvéolaire.
Le traitement est basé sur la gestion des signes et symptômes. On peut aussi administrer des immunosuppresseurs afin de diminuer la réponse du corps. Les anti-inflammatoires sont aussi recommandés. La transplantation pulmonaire est aussi commune avec cette pathologie.
Partie C: L’œdème pulmonaire
L’œdème pulmonaire est une condition pathologique au cours de laquelle il y a un mouvement excessif de fluide du système vasculaire pulmonaire vers les espaces extravasculaires et aériens des poumons. On note 2 raisons principales qui explique l’œdème pulmonaire, même si d’autres explications sont possibles. Les 2 types d’œdème sont : œdème cardiogénique (aussi appelé œdème pulmonaire classique) et l’œdème non-cardiogénique (aussi appelé le syndrome de déstresse respiratoire aigüe; ARDS). En temps normal, une pression hydrostatique d’environ 10-15 mm Hg tend à faire sortir le fluide des capillaires pulmonaires vers les espaces interstitiels. Cette force est contrecarrée par une force osmotique colloïdale d’environ 25-30 mm Hg. Cette dernière a tendance à garder le fluide à l’intérieur des capillaires pulmonaires. Cette pression osmotique colloïdale est connue sous le nom de pression oncotique et est produite par les particules d’albumine et de globuline retrouvées dans le sang. La stabilité du fluide à l’intérieur des capillaires pulmonaires et celle à l’intérieur des compartiments interstitiels sont donc déterminées par la balance entre la pression hydrostatique et la pression oncotique.
L’équation de Starling
Le mouvement de fluide qui rentre et qui sort des capillaires est exprimé par l’équation de Starling:
J = K (Hc – Hi) – (Oc – Oi)
J = mouvement net de fluide vers l’extérieur des capillaires
K = facteur de la perméabilité des capillaires
Hc = pression hydrostatique à l’intérieur des capillaires
Hi = pression hydrostatique à l’intérieur des espaces interstitiels
Oc = pression oncotique à l’intérieur des capillaires
Oi = pression oncotique à l’intérieur des espaces interstitiels
Quoique conceptuellement précieuse, cette équation a des utilisations de pratique très limitées. Des quatre pressions mentionnées ci-dessus, seule la pression oncotique capillaire est connue avec certitude et elle est de 28 mmHg.
Il existe différentes formes d’œdème qui s’explique par l’équation de Starling. Il est important d’être en mesure de comprendre l’origine de l’œdème, car l’évaluation sera bien différente tout dépendant de son origine.
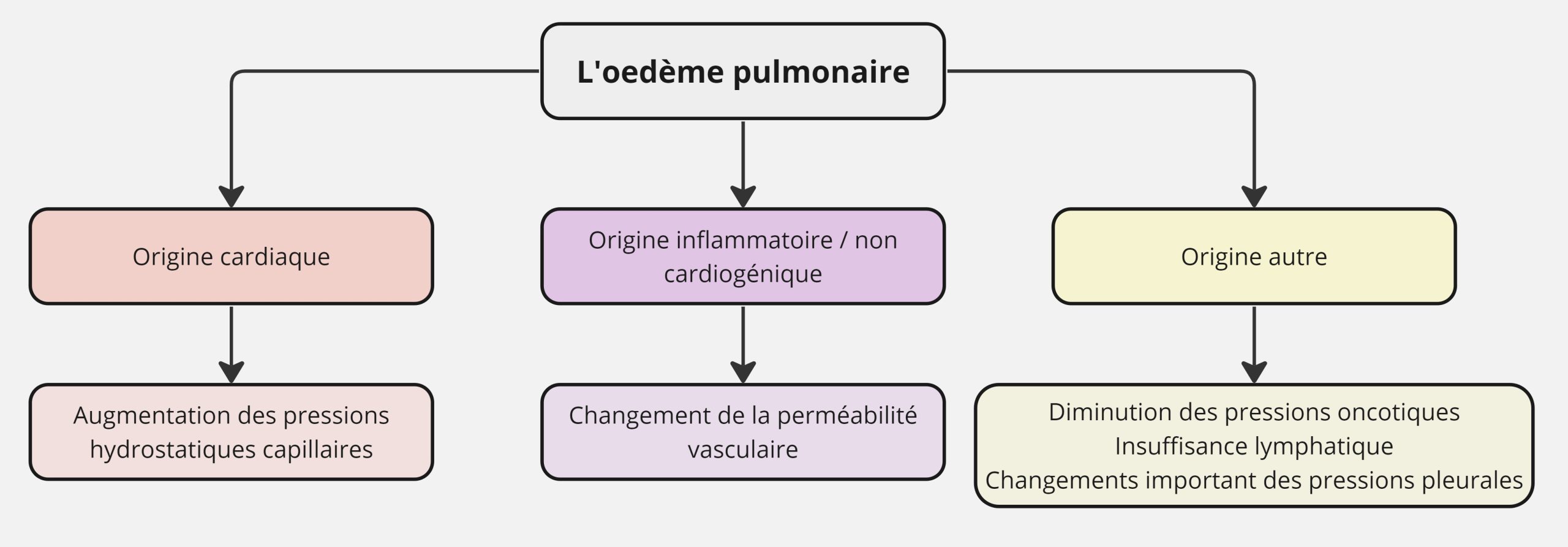
L’œdème cardiogénique
Ce type d’œdème s’explique par un engorgement au niveau des capillaires pulmonaires forçant les pressions hydrostatiques capillaires à augmenté à un niveau où on note un mouvement de fluide en dehors du compartiment vasculaire. La cause est généralement associée à une problème cardiaque. On pourrait penser à une défaillance du cœur gauche par exemple qui causerait un engorgement vasculaire qui résulterait en une augmentation des pressions hydrostatiques capillaires.
Dans certains cas, l’œdème s’explique grâce à un choc cardiogénique. Il faut aller revoir cette théorie afin de bien expliquer les symptômes associés au choc. On peut aussi voir le portrait classique de l’évaluation du patient qui comporte :
- Patron respiratoire Cheyne Stokes: généralement chez les cas sévères
- Orthopnée +/- dyspnée nocturne
- Toux avec sécrétions rosée et mousseuses
- Crépitements fins à l’auscultation
- Sibilances expiratoires à l’auscultation lorsque l’œdème cardiogénique est sévère
- Augmentation du frémitus tactile
Il n’est cependant pas rare de voir un patient qui démontre une défaillance du cœur droit accompagné de sa condition, ainsi, on notera les signes et symptômes suivants :
- Distension de la veine jugulaire
- Œdème périphérique
Plusieurs tests diagnostic peuvent être fait afin de confirmer la pathologie. Il va de soi que l’histoire et les signes et symptômes seront pertinent afin d’apposer le bon diagnostic.
| FEV1/FVC | FVC | TLC | FRC | RV | DLCO |
| N ou ↑ | ↓ | ↓ | ↓ | ↓ | ↓ |
À la radiographie pulmonaire, on notera un patron vasculaire. Ceci s’explique par un engorgement des vaisseaux sanguins qui est visible à partir des hiles. On note aussi des “Kerley B lines” qui sont caractérisées par de fines petites lignes qui sont visibles en périphéries. Dans certains car, on sera en mesure de voir une cardiomégalie ou encore des effusions pleurales.
Analyse sanguine:
- Peptide cérébral natriurétique (Brain natriuretic peptide 32 – BNP)
- Il s’agit d’une hormone qui est sécrétée par le cœur lorsque celui-ci ne fonctionne pas comme normal. Contrairement à la TNT qui est sécrétée lorsque les cellules du myocarde souffrent d’un manque d’O2, le BNP est produit lorsque le cœur note un débalancement de nutriment (Na, K, Cl) qui est typiquement vu chez ces patients.
- La norme du BNP est : ≤ 100 ug/ml. Un résultat supérieur à 100 ug/ml est suffisant pour appuyer le diagnostic d’un œdème cardiogénique.
Il est typique d’avoir une hypoxémie chez ces patients causés par un V/Q mismatch.
| pH | CO2 | O2 | HCO3 | SaO2 |
| ↑ | ↓ | ↓ | N ou ↓ | ↓ |
Il est possible de noter des changements hémodynamiques tels que:
| CVP | PAP | PCWP | C.O. | PVR | SVR |
| ↑
Si cœur droit atteint |
↑ | ↑ | N
Si choc sera ↓ |
↑ | N
Si choc sera ↑ |
Les traitements seront axés sur la cause de l’œdème cardiogénique. Les causes sont souvent; diminution de la force du muscle cardiaque, augmentation de la post-charge du cœur (vasoconstriction périphérique) ou une augmentation de la pré-charge du cœur (volume sanguin). Il sera aussi important de traiter les symptômes. Étant donné que les symptômes sont principalement respiratoire, notre rôle comme thérapeute respiratoire sera crucial. Dans le cas d’une présentation clinique hypoxémique avec peu ou pas de travail respiratoire, le meilleur traitement est la pression positive en fin d’expiration (PEEP). Si le patient ne démontre pas de travail respiratoire, la pression inspiratoire n’est pas nécessairement recommandée et donc le BiPAP ne serait pas la meilleure option pour ces patients. Cependant, si le patient démontre un travail respiratoire important ou encore un trouble ventilatoire (CO2), il est pertinent d’offrir une pression de support.
Nous avons mentionné qu’il est possible de noter des sibilances à l’auscultation chez ces patients. Contrairement à des sibilances d’origine asthmatique (bronchoconstriction), ces sibilances ne sont pas causées par le même phénomène. En effet, les sibilances qui sont entendus sont causées par le fait que la présence de liquide est si importante, qu’elle diminue le rayon des voies aériennes. Ainsi, dans cette situation, administrer des bronchodilatateurs n’est pas une ligne de traitement, car ce n’est pas la bronchoconstriction qui cause les sibilances. Il faut plutôt maximiser la diminution de l’œdème afin de diminuer ces sibilances. Étant donné leur origine, on appel ces sibilances des sibilances cardiaques.
Une autre composante importante dans la gestion du patient atteint d’œdème cardiogénique est la diminution du volume vasculaire. Souvent, cette condition s’explique par une accumulation inappropriée de fluides. L’origine peut être une diète riche en sel ou encore une dysfonction rénale pour ne nommer que ces 2 là. Une bonne recommandation serait donc de diminuer ce surplus à l’aide de diurétique. En milieu clinique, un diurétique grandement utilisé est celui qui agira sur l’anse de Henley. Principalement pour sa filtration qui sera importante et aussi son début d’action qui sera rapide. Évidement qu’on doit prendre en considération l’hémodynamie avant d’offrir une telle thérapie.
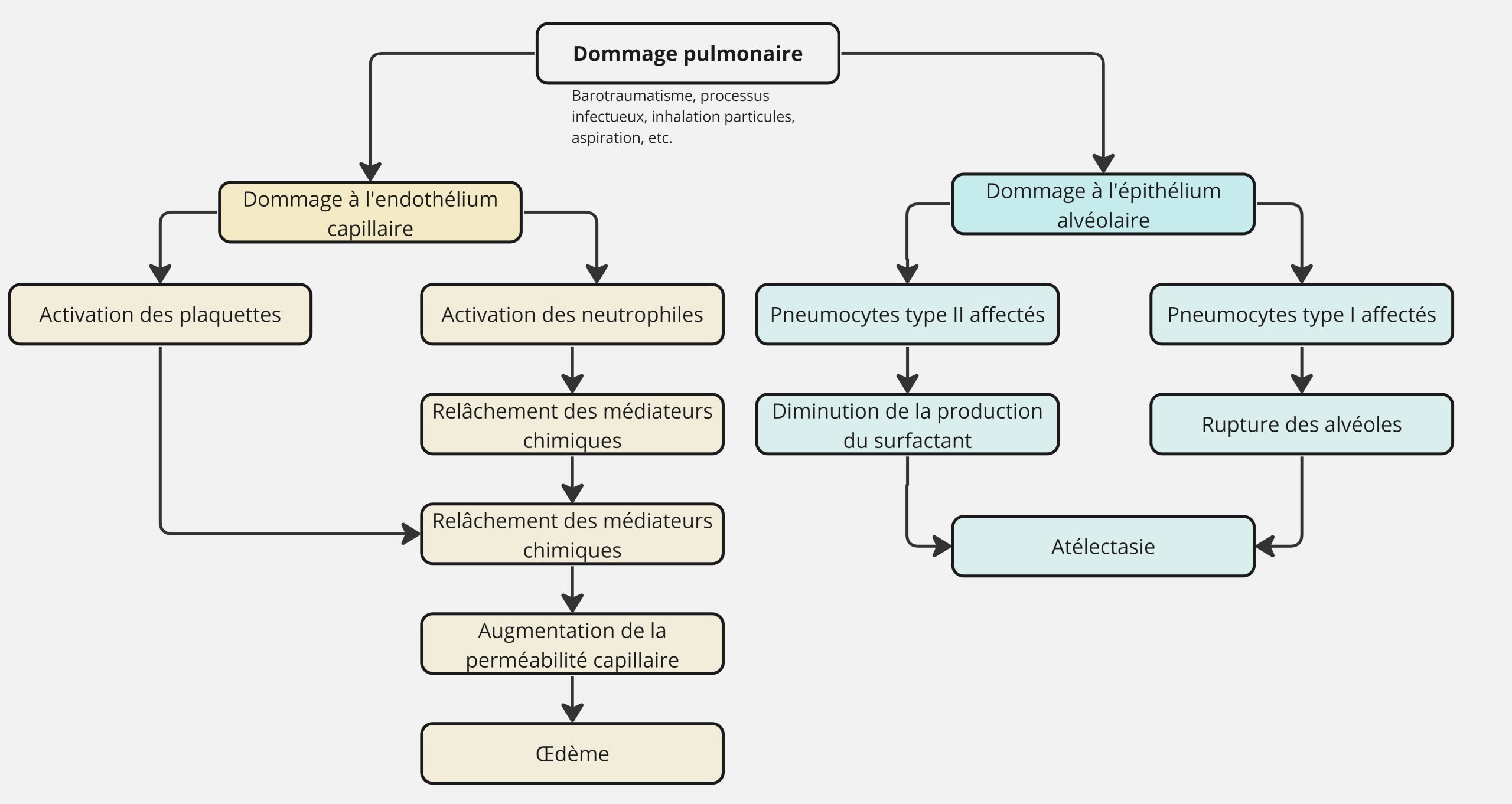
L’œdème non-cardiogénique (inflammatoire)
Cette pathologie peut s’expliquer par un dommage aux cellules épithéliales alvéolaires de type 1 suite à un contact direct avec une substance toxique, par exemple, l’inhalation de gaz toxiques, hydrocarbures, aspiration de contenu gastrique, noyade d’eau douce ou salée. Il peut aussi s’expliquer par un dommage endothélial capillaire qui augmente la perméabilité. On peut penser aux endotoxines bactériennes, molécule graisseuse, fluide amniotique, drogues (héroïne, ASA, diurétiques thiazides), dommage mécanique aux cellules endothéliales (augmentation de la stimulation du SNS causée par ↑ ICP), etc.
On appelle ce type d’œdème le SDRA: (SDRA = Syndrome de détresse respiratoire aiguë / ARDS = Acute respiratory distress syndrom) souvent appelé la phase exsudative (premières 24 heures jusqu’à 1 semaine), du fluide peut être observé dans l’espace interstitiel et dans les alvéoles. Des saignements répandus dans le poumon et de l’atélectasie peuvent aussi être présents causant la déplétion du surfactant alvéolaire. La présence de leucocytes (neutrophiles et macrophages), de fibrine et de débris cellulaire est aussi apparente formant les membranes hyalines, une caractéristique importante de ce syndrome.
Au fur et à mesure que le syndrome progresse (phase proliférative : 1 – 2 semaines du début) la régénération et/ou fibrose commence à réaliser une réparation tissulaire. Les cellules type 2 se divisent (hyperplasie) pour remplacer les cellules type 1 endommagée. Dans cette phase il y a accumulation des fibroblastes. Dans le cas d’une pathologie sévère, la phase fibroblastique (3 – 4 semaines du début) cause le développement de tissu cicatriciel (fibrose). Des changements vasculaires peuvent accompagner la fibrose. Une prolifération de la tunique interne et moyenne des petits vaisseaux est présente ainsi que l’apparition de micro-thrombus. La membrane alvéolo-capillaire est épaissie et la diffusion de l’oxygène est altérée. Durant les différentes phases, on observe une diminution de la compliance pulmonaire et diminution de la FRC. Ceci entraîne une fatigue ventilatoire (acidose respiratoire).
L’évaluation du patient atteint d’œdème dit non-cardiogénique va varier, dépendant de la gravité de la pathologie. On note cependant ces symptômes comme étant typique pour des cas de ARDS :
- Hypoxémie réfractaire
- Crépitements fins à l’auscultation
- Sons bronchiques anormaux ou crépitements gras dans certains cas
- Patron restrictif ++
- Travail respiratoire augmenté
- Cyanose
- Matité à la percussion
Le diagnostic de la maladie repose sur les critères suivants. Le patient doit rencontrer 2 ces 4 composantes :
- Avoir une histoire récente d’un processus infectieux (généralement dans les 7 derniers jours)
- Patron alvéolaire au rayon-x pulmonaire avec présence de bronchogrammes aériens
- Ne doit pas être d’origine cardiaque ou s’expliquer par une défaillance du cœur
- Doit avoir des problèmes oxygénatoire
- ARDS léger : PaO2/FiO2 ≤ 300
- ARDS modéré : PaO2/FiO2 ≤ 200 avec une PEEP ≥ 5cmH20
- ARDS sévère : PaO2/FiO2 ≤ 100 avec une PEEP ≥ 5cmH20
Le traitement de cette pathologie reposera principalement sur la gestion de l’agent déclencheur. Il est impératif de trouver la cause du processus infectieux qui cause un tel processus inflammatoire, sans quoi les effets perdureront et l’état du patient sera très difficile à gérer plus le temps passera. Au niveau pulmonaire, il sera important d’offrir un support respiratoire afin de maintenir des échanges gazeux appropriés. Typiquement, l’oxygène à haut débit ou l’intubation et la ventilation mécanique sont utilisés et recommandés. Le but de ces 2 thérapies est d’améliorer les échanges gazeux. Le choix de la thérapie reposera principalement sur l’évaluation de la gravité des symptômes du patient.
Lorsque la ventilation mécanique est le choix optimal, il est important de considérer la grande diminution de compliance qui sera noté avec ces patients. Ainsi, afin de minimiser les dommages aux poumons, il est capital de protéger le poumon et d’opter pour une ventilation dite protectrice. Ce genre de ventilation minimisera les dommages (baro/volu/biotraumatisme) qui pourraient aggraver d’avantage la condition du poumon ainsi que le processus inflammatoire. Des méthodes afin d’améliorer l’oxygénation sont souvent nécessaire afin d’avoir un seuil de PaO2 acceptable. Tel que vu dans le chapitre sur la ventilation mécanique, on pourrait penser à des stratégies telles que: le recrutement pulmonaire, la “best PEEP”, la paralysie, la position prône ainsi que les vasodilatateurs pulmonaires.
Les autres traitements incluent; les corticostéroïdes, l’administration du surfactant, la ventilation à haute fréquence et bien plus!
L’atélectasie
L’atélectasie est défini comme étant une condition où il n’y a pas de ventilation dans une région du poumon. On pense rapidement au rapport ventilation / perfusion qui sera grandement affecté. L’atélectasie peut s’expliquer par différentes causes.
Atélectasie obstructive: Ce type d’atélectasie est causé par une obstruction qui gène le passage de l’air de façon si importante qu’il n’y a pas de gaz qui est capable d’aller dans les alvéoles. On pourrait penser à un bouchon muqueux, par exemple, qui viendrait complètement obstruer un bronchiole. Les alvéoles en aval n’auraient pas d’air et on sera en mesure de noter de l’atélectasie à cette région.
On peut aussi noter de l’atélectasie de façon dite passive. Il y a 4 différentes forme de voir de l’atélectasie passive se développer.
L’atélectasie de compression: causé par une diminution de la pression négative dans l’espace pleural. Une telle condition pourrait survenir lors d’une tumeur ou encore de l’air ou liquide dans l’espace pleural. En perdant cette force négative, le poumon aura tendance à se collapser sur lui-même, causant ainsi des régions où l’on notera de l’atélectasie.
L’atélectasie passive elle s’explique par une perte graduelle du volume dans l’alvéole. On peut penser à de l’hypopnée qui amènerait une diminution des volumes pulmonaires. Ce genre d’atélectasie survient assez fréquemment dans un contexte de gestion des patients post-opératoire.
L’atélectasie adhésive survient lorsque qu’il y a une atteinte au surfactant. L’absence d’air dans les alvéoles s’explique par une réduction ou absence du surfactant.
L’atélectasie cicatricielle s’explique par un processus fibrotique très sévère qui cause une diminution si importante des volumes pulmonaire qu’on note maintenant une absence de volume. Il est possible de voir ce type d’atteinte lorsqu’on a présence de maladies interstitielles.
L’évaluation du patient révèle des crépitements fins à l’auscultation, un frémitus tactile augmenté, une tachypnée ainsi qu’une diminution de l’expansion thoracique. On remarque régulièrement de l’hypoxémie chez c’est patient, ce qui s’explique par un débalancement du ratio ventilation et perfusion.
Le diagnostic sera basé principalement sur l’histoire qui a apporté les symptômes ainsi que la radiographie. On sera en mesure de noter une diminution du volume pulmonaire ainsi qu’une opacité à la région atteinte.
Le traitement de l’atélectasie sera dépendant de la cause. Il est important de comprendre comment s’est produit l’atélectasie afin d’être en mesure d’appliquer le bon plan. Les thérapies de recrutement sont une bonne option pour ces patients. Qu’ils soient intubés (recrutement statique ou escalier) ou non intubé (breath stacking ou IN/EX), il est possible d’améliorer les volumes d’une façon ou une autre. On se doit aussi de penser à l’oxygénothérapie lorsque la saturation est basse.