5.5: Adición Oxidativa en Acción- Hidrogenación
- Page ID
- 78623
La hidrogenación catalítica es una reacción tremendamente importante. Es un paso esencial en la síntesis de muchos productos químicos finos, así como productos a granel. En la hidrogenación catalítica, se agregan un par de átomos de hidrógeno a través de un doble enlace, convirtiendo un alqueno en un alcano.
En general, la reacción requiere un gran exceso de hidrógeno gaseoso, a menudo bajo alta presión. La reacción se puede realizar en condiciones homogéneas o heterogéneas. Las reacciones homogéneas emplean un catalizador soluble. Los catalizadores solubles son aquellos que se disuelven bajo las condiciones de reacción; a menudo proporcionan un control superior sobre la reacción. Los catalizadores heterogéneos no se disuelven; son sólidos que se asientan en el fondo de la reacción, como arena en un lecho de lago. Una de las ventajas de los catalizadores heterogéneos es que pueden filtrarse fácilmente lejos del resto de la reacción, haciendo que la purificación del producto sea mucho más sencilla.
Indicar si las siguientes mezclas son homogéneas o heterogéneas.
a) Kool-aid b) un vaso de pop con hielo c) jugo de naranja d) jugo de arándano
- Responder a
-
homogéneo
- Respuesta b
-
heterogéneo
- Respuesta c
-
heterogéneo
- Respuesta d
-
homogéneo
Debido a la importancia de la hidrogenación, a lo largo de los años se han desarrollado una serie de catalizadores que son capaces de realizar la reacción. Hay una serie de motivaciones para trabajar en el desarrollo de catalizadores. Una razón es la velocidad: cuanto más rápido es el catalizador, más producto se puede fabricar y más económico es el proceso. Otra razón es la selectividad. Supongamos que hay dos dobles enlaces presentes en una molécula. A lo mejor sólo quieres hidrogenar uno de estos dobles enlaces. Al elegir el catalizador adecuado, es posible que pueda hacerlo.
Echemos un vistazo a algunos ejemplos diferentes de catalizadores con diferentes selectividades.
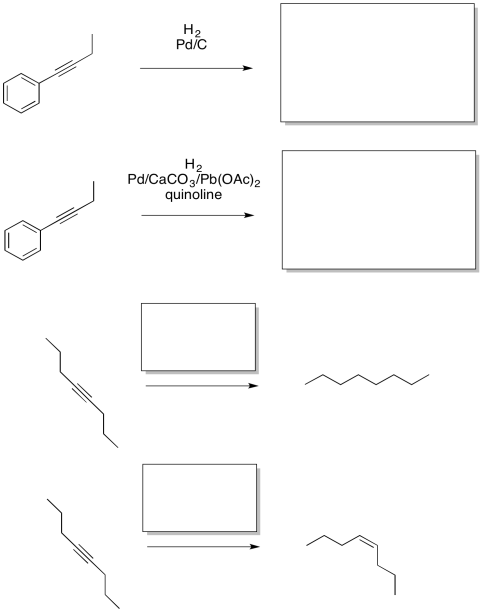
Quizás el catalizador más utilizado es el paladio metálico, un catalizador heterogéneo. Muy a menudo, los metales caros como el paladio no se utilizan en su estado puro. Por ejemplo, el paladio a menudo se dispersa sobre un “soporte sólido”, como el carbono. Hay un par de beneficios de hacerlo. Primero, el costoso metal paladio se estira un poco más al mezclarlo con carbono, que es mucho más económico. Por lo general, esta mezcla es de aproximadamente 5% de paladio y 95% de carbono, aunque se pueden usar diferentes composiciones. Además, el uso de un soporte sólido ayuda a extender las partículas metálicas espacialmente. Cuando el metal no está todo aglomerado, tiene una mayor área de superficie. Eso significa que hay más lugares disponibles para que hidrógeno y alquenos se unan y se sometan a la reacción de hidrogenación. Por último, un soporte sólido a menudo sintoniza la reactividad del metal que se le pega. El soporte sólido podría cambiar la velocidad de la reacción o alterar la selectividad debido a las interacciones entre el metal y el soporte.
El paladio sobre carbono, o Pd/C, proporciona un ejemplo de lo que entendemos por selectividad. Es muy bueno para agregar hidrógeno a los alquenos. También puede hidrogenar alquinos. Sin embargo, no es muy bueno para hidrogenar dobles enlaces más estables, como los de los dienos conjugados, o en benceno u otros aromáticos. En contraste, el óxido de platino es mucho más general, hidrogenando alquenos regulares y también conjugados.
En las condiciones adecuadas, el óxido de platino puede incluso ser utilizado para hidrogenar benceno. Eso suele significar muy alta presión de gas hidrógeno.
Además, la hidrogenación con paladio no funciona muy bien con los carbonilos. Por lo general, no reduce aldehídos o cetonas. Quizás recuerdes que otros agentes reductores (compuestos que agregan hidrógeno a los átomos de carbono) como LiAlH 4 pueden reaccionar con carbonilos con bastante facilidad, por lo que el paladio con hidrógeno es muy complementario a esos reactivos. Incluso el Pto 2 no puede inducir que el hidrógeno se agregue a través de un carbonilo, aunque otro catalizador heterogéneo, uno feroz llamado Raney Nickel, puede hacer el trabajo.
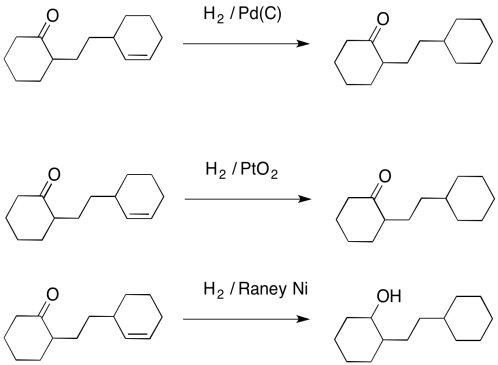
Sin embargo, ni siquiera Raney Nickel funciona muy bien en la hidrogenación de carbonilos más estables, como amidas, ésteres y ácidos carboxílicos. Esos son los que se encuentran al fondo de la enérgica “colina de esquí”, por lo que son los carbonilos menos reactivos. Son difíciles de hidrogenar, y generalmente se dejan solos.
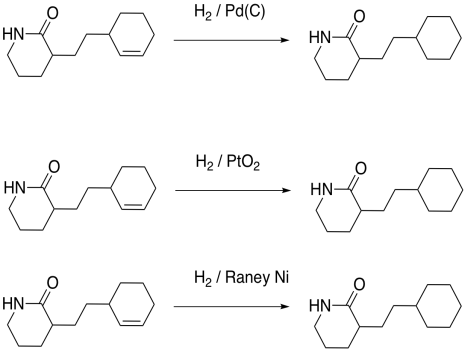
Por otro lado, al paladio le va bien con algunos compuestos aparentemente relacionados, que contienen iminas y grupos nitro. Aunque estos grupos contienen múltiples enlaces y nitrógeno, no tienen la misma estabilidad que las amidas. Las iminas y los grupos nitro se comportan un poco más como simples compuestos carbonílicos cuando se trata de hidrogenación.
Proporcionar productos para las siguientes reacciones.
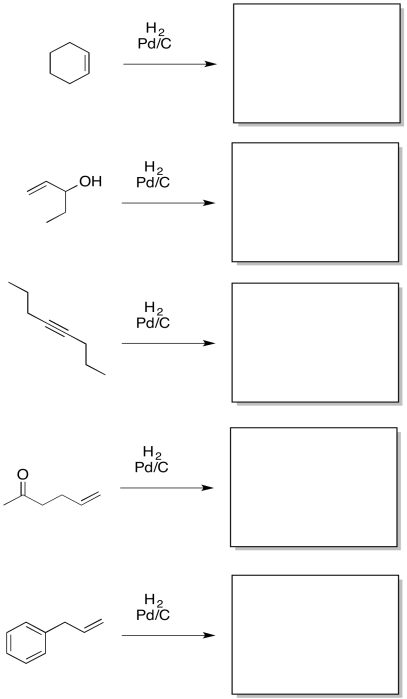
- Responder
-
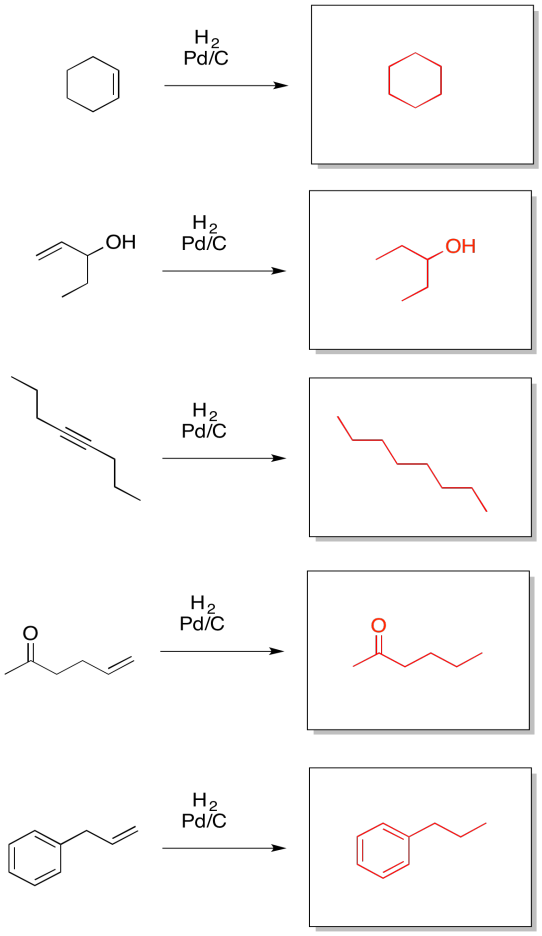
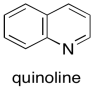
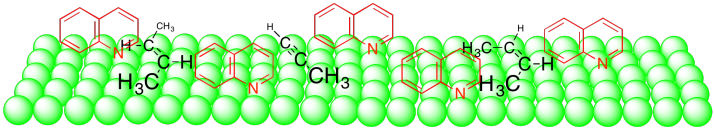
Podemos hacer que el catalizador de paladio sea aún más selectivo preparándolo de una manera diferente. El catalizador de Lindlar es un ejemplo muy dramático de cómo se puede ajustar la reactividad usando diferentes composiciones. Para hacer el catalizador de Lindlar, el paladio se soporta sobre carbonato de calcio en lugar de carbono, junto con otros componentes, como el acetato de plomo y la quinolina. Ese último componente resulta ser la clave del catalizador de Lindlar. Se sintoniza la reactividad para que el catalizador pueda reaccionar con alquinos pero no con alquenos.
Como resultado, si un compuesto se hidrogena con un catalizador de paladio en presencia de quinolina, se produce un alqueno. Sin la quinolina, se obtendría un alcano.
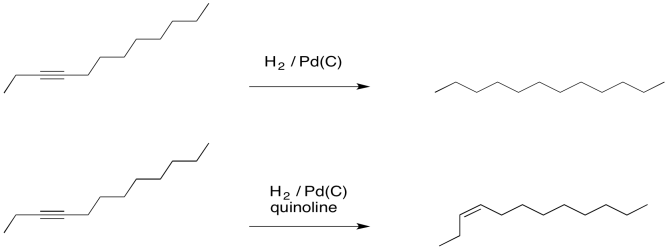
Normalmente, si un catalizador hidrogena un alquino, no se observa alqueno. Eso se debe a que el alqueno también reacciona en las mismas condiciones y se convierte rápidamente en un alcano.
No tan rápido, dices. Si solo agregamos un equivalente de hidrógeno (es decir, una molécula de hidrógeno por cada molécula de alquino) entonces la reacción se detendrá después de formar un alqueno. Eso es muy inteligente de tu parte. Sin embargo, te has perdido un par de conceptos importantes. En primer lugar, nunca estamos tratando con moléculas individuales cuando ejecutamos una reacción; en cambio, estamos tratando con un gran número de moléculas a la vez. Eso significa que nos ocuparemos de las distribuciones estadísticas. Tal vez algunas moléculas de hidrógeno reaccionan con alquino para producir alqueno. A lo mejor algunas moléculas siguen adelante y reaccionan con ese alqueno para producir alcano. Ahora bien, si solo agregamos suficiente hidrógeno para que cada alquino reaccione con un H 2, y algunos de ellos ya han reaccionado con dos, entonces alguien quedará fuera. También habrá algo de alquino sobrante. Eso significa que hemos hecho una mezcla de alquino, alqueno y alcano.
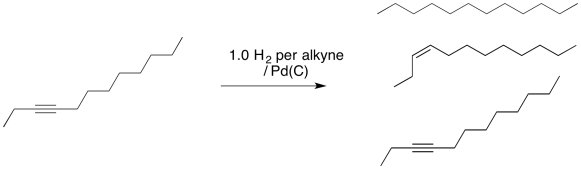
El otro concepto que falta es que las reacciones de hidrogenación generalmente se ejecutan bajo una alta presión de gas hidrógeno. Eso significa que se necesitan muchos equivalentes de hidrógeno para impulsar la reacción.
¿Cómo cambia tan dramáticamente el catalizador la presencia de quinolina? Parece que la respuesta se basa en el hacinamiento estérico. Aunque los alquenos son planos, y no parecen muy concurridos, pueden estar abarrotados en comparación con un alquino, que es lineal. Esa diferencia hace que los alquinos sean aún más reactivos que los alquenos con respecto a la hidrogenación.
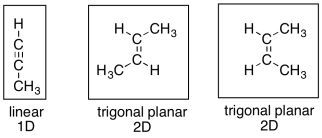
Cuando estos compuestos se unen a la superficie del catalizador, el alquino ocupa menos espacio que los alquenos. En su mayoría se encuentra a lo largo de una dimensión, mientras que los alquenos se extienden en dos dimensiones.
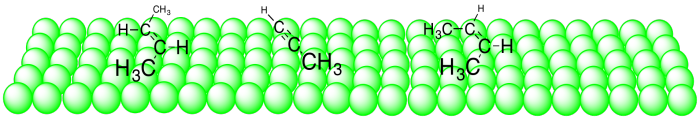
La quinolina parece simplemente ocupar espacio cuando se une a la superficie del catalizador. Como resultado, el alqueno más ancho no puede unirse tan bien como el alquino estrecho.
Entonces resulta que el catalizador de Lindlar es un gran problema. Proporciona una reacción muy selectiva: producción de un alqueno a partir de un alquino. Además, no solo hace cualquier alqueno. Sólo produce cis-alquenos. Eso es porque los átomos de hidrógeno son ambos entregados desde la superficie del metal. El alquino se une a la superficie del metal y acepta los átomos de hidrógeno de esa superficie. Como resultado, ambos hidrógenos terminan en el mismo lado del nuevo doble enlace. El alqueno formado es entonces un cis-alqueno.
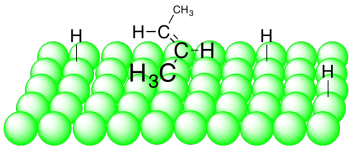
La adición de dos átomos de hidrógeno al mismo lado de la molécula no se limita al catalizador de Lindlar. Es una característica general de la hidrogenación catalítica. Como resultado, las hidrogenaciones catalíticas suelen ser diastereoselectivas; dan como resultado la formación de un diastereómero, pero no del otro.
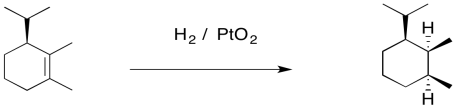
Proporcione los reactivos o productos faltantes para las siguientes reacciones.
- Responder
-
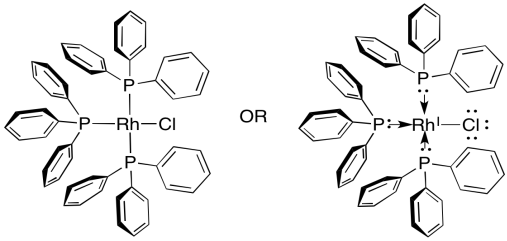
¿Qué pasa con los catalizadores homogéneos? El más común es el catalizador de Wilkinson, (Ph 3 P) 3 rHCl. El catalizador de Wilkinson, como Pd/C, es bueno para reaccionar con alquenos pero dejando solos los enlaces polares. También es altamente selectivo, reaccionando sólo con los alquenos menos abarrotados estéricamente. Sólo reacciona con alquenos monosustituidos y disustituidos. Si un alqueno tiene menos de dos hidrógenos unidos al doble enlace, el catalizador de Wilkinson lo deja solo.
En contraste, el catalizador de Crabtree, [(COD) (PCy 3) (py) Ir] PF 6 es un catalizador mucho más reactivo. En parte, eso se debe a que es un catalizador catiónico más electrófilo; el PF 6 es un contraión no reactivo. Además, el catalizador de Crabtree contiene un ligando alqueno sacrificial. La DQO es ciclooctadieno, un ligando bidentado que contiene dos dobles enlaces. ¿Qué le sucede a ese ligando cuando el catalizador se expone al hidrógeno? Se hidrogena, claro. Sin dobles enlaces, ya no puede ser un ligando. Eso deja al catalizador con dos sitios de coordinación abiertos, aunque realmente estos sitios están ocupados por moléculas solventes. Sin embargo, las moléculas de disolvente se unen solo de manera floja y pueden dejar fácilmente espacio para un alqueno.
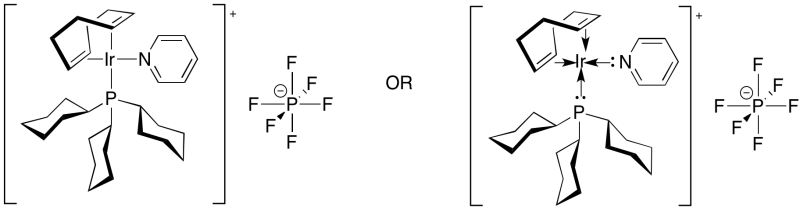
Como resultado, el catalizador de Crabtree es mucho menos sensible al hacinamiento estérico. A diferencia del catalizador de Wilkinson, es perfectamente capaz de hidrogenar alquenos trisustituidos o incluso tetrasubstituidos.

Proporcione los reactivos o productos faltantes en las siguientes reacciones.
- Responder
-
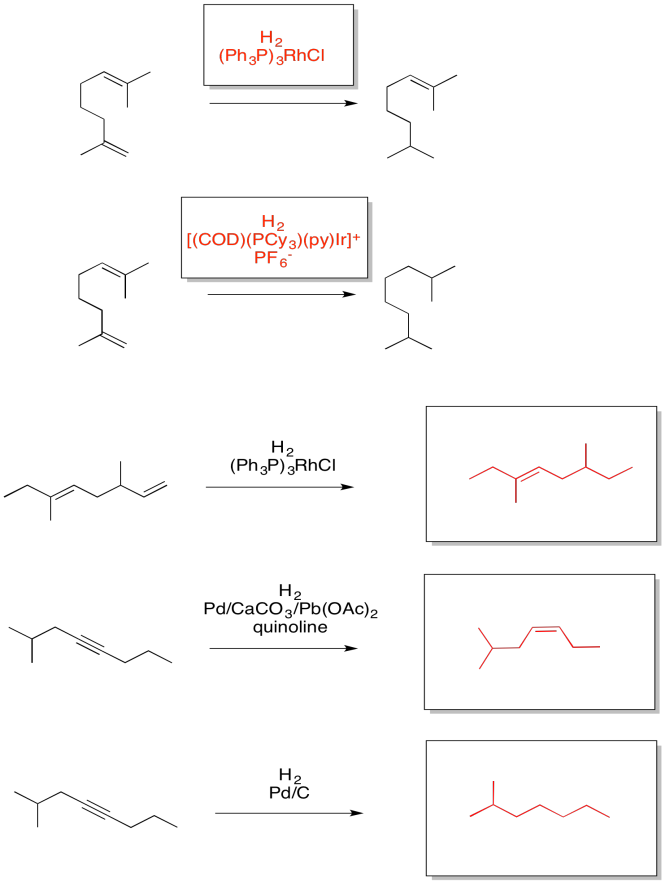
Proporcionar productos para las siguientes reacciones.
- Responder
-
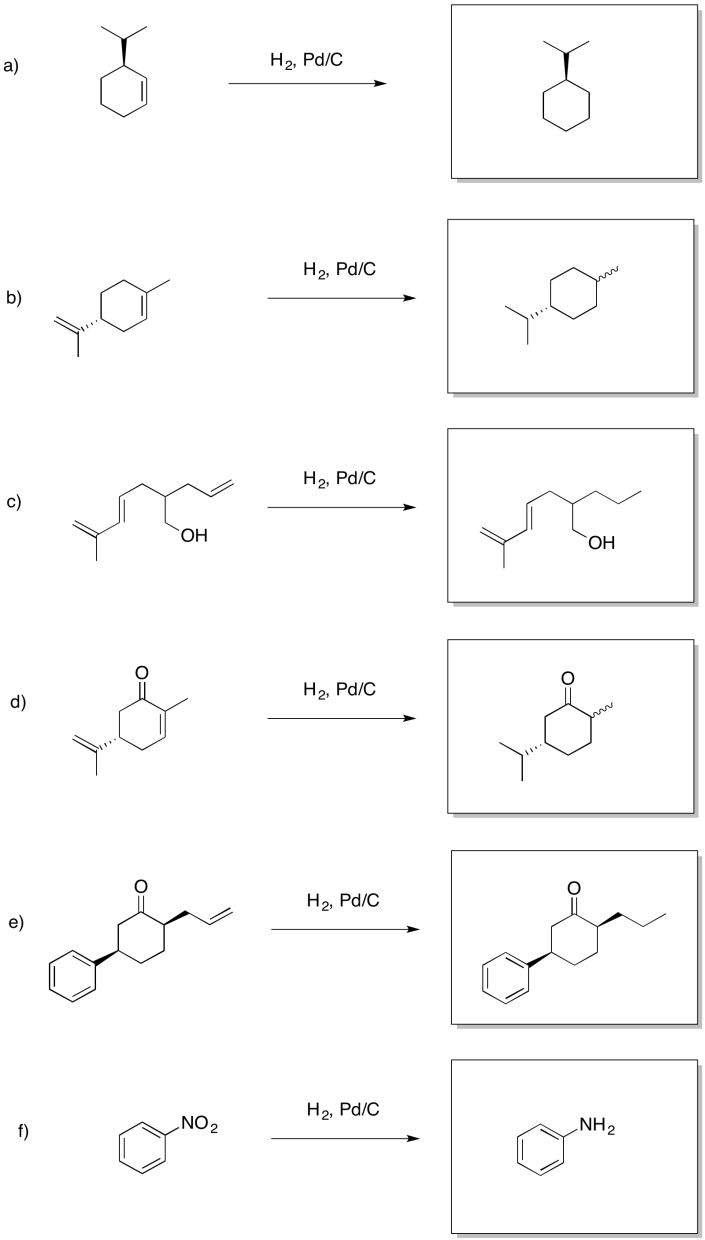
Proporcionar productos para las siguientes reacciones.
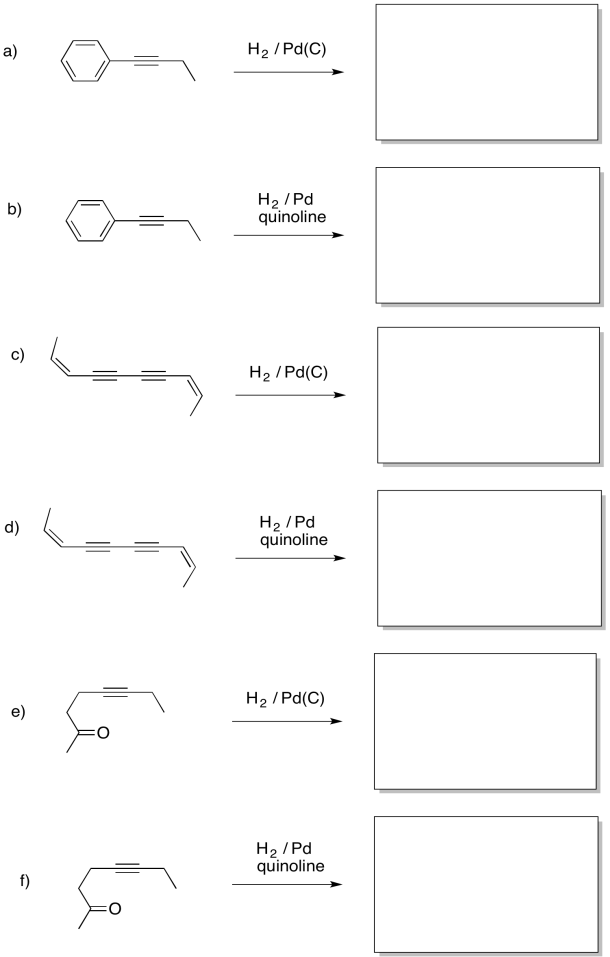
- Responder
-
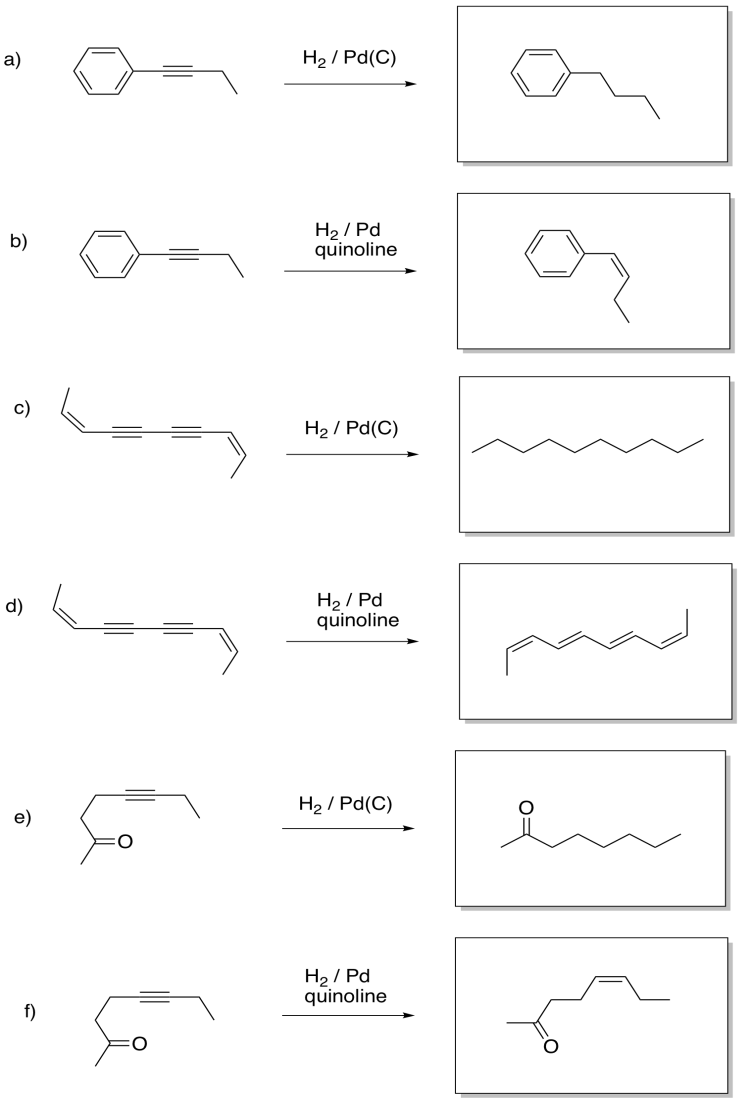
Proporcionar reactivos para las siguientes reacciones.
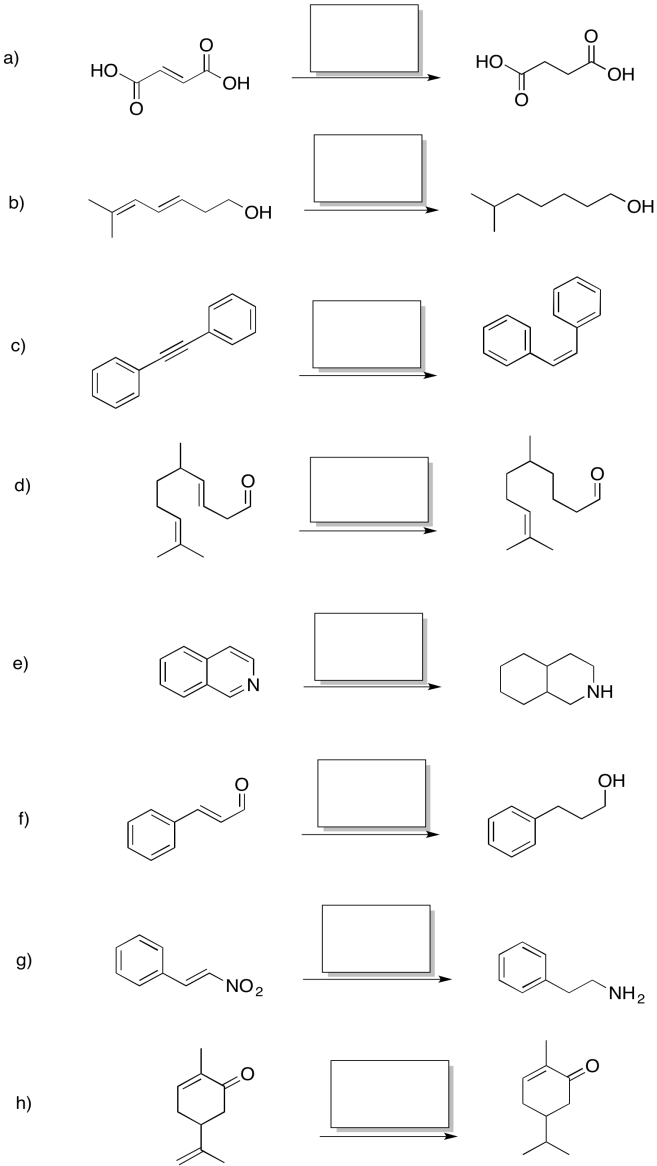
- Responder
-