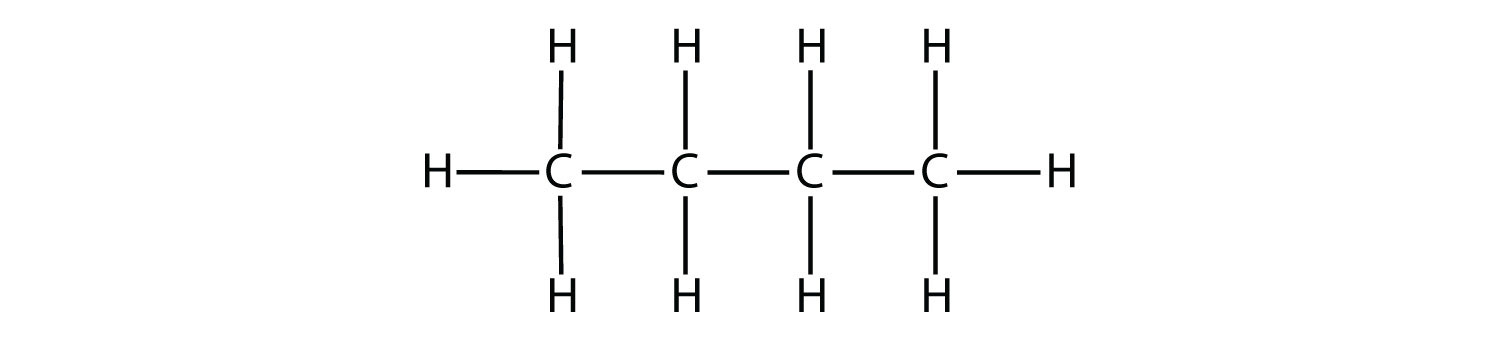
9.1: Hidrocarburos alifáticos
- Page ID
- 72503
- Definir e identificar alcanos, alquenos, alquinos e hidrocarburos cíclicos.
- Enumere algunas propiedades de los hidrocarburos.
- Identificar y nombrar alcanos simples (de cadena recta) dadas fórmulas y escribir fórmulas para alcanos de cadena lineal dados sus nombres.
- Definir isómeros estructurales y geométricos.
- Escriba fórmulas estructurales condensadas y dibuje fórmulas de ángulo de línea dadas fórmulas estructurales completas para alcanos, alquenos, alquinos e hidrocarburos cíclicos.
Los compuestos orgánicos más simples son aquellos compuestos por sólo dos elementos: carbono e hidrógeno. Estos compuestos se denominan hidrocarburos. Los hidrocarburos mismos se separan en dos tipos: hidrocarburos alifáticos e hidrocarburos aromáticos. Los hidrocarburos alifáticos son hidrocarburos basados en cadenas de átomos de C. Existen tres tipos de hidrocarburos alifáticos. Los alcanos son hidrocarburos alifáticos con solo enlaces covalentes simples. Los alquenos son hidrocarburos que contienen al menos un doble enlace C—C, y los lquines son hidrocarburos que contienen un triple enlace C—C. Ocasionalmente, encontramos un hidrocarburo alifático con un anillo de átomos de C; estos hidrocarburos se denominan cicloalcanos (o cicloalquenos o cicloalquinos). Debido a que los alcanos tienen el número máximo de átomos de H posible de acuerdo con las reglas de los enlaces covalentes, los alcanos también se denominan hidrocarburos saturados.
La palabra saturado tiene el mismo significado para hidrocarburos que para las grasas y aceites de la dieta: la molécula no tiene dobles enlaces carbono-carbono (C=C).
Alcanos
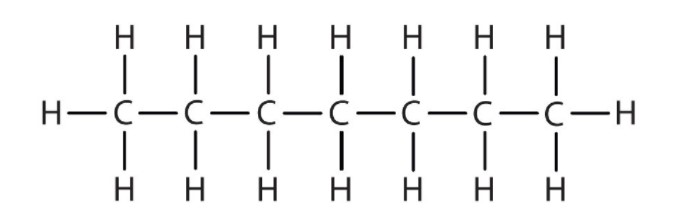
Los alcanos más simples tienen sus átomos de C unidos en una cadena lineal; estos se llaman alcanos normales. Se nombran de acuerdo al número de átomos de C en la cadena. El alcano más pequeño es el metano:
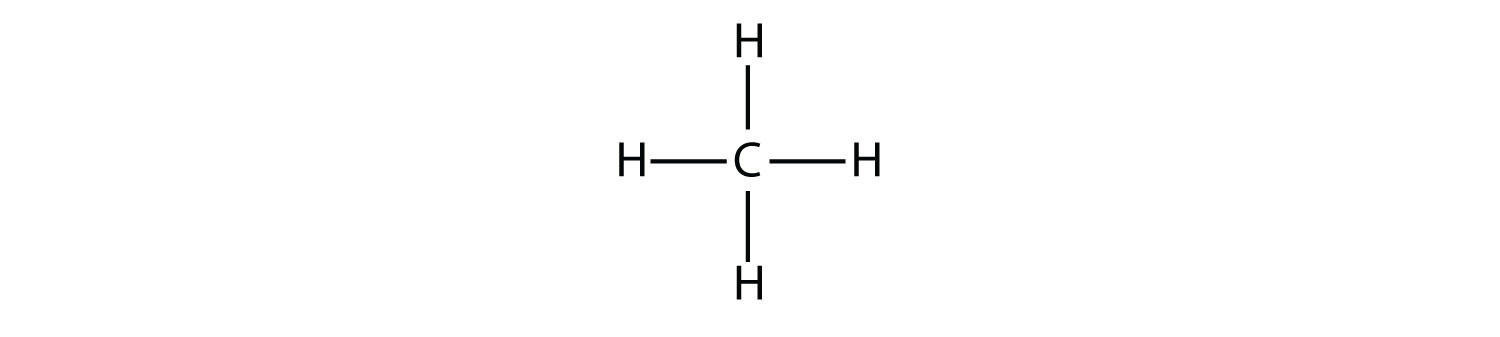
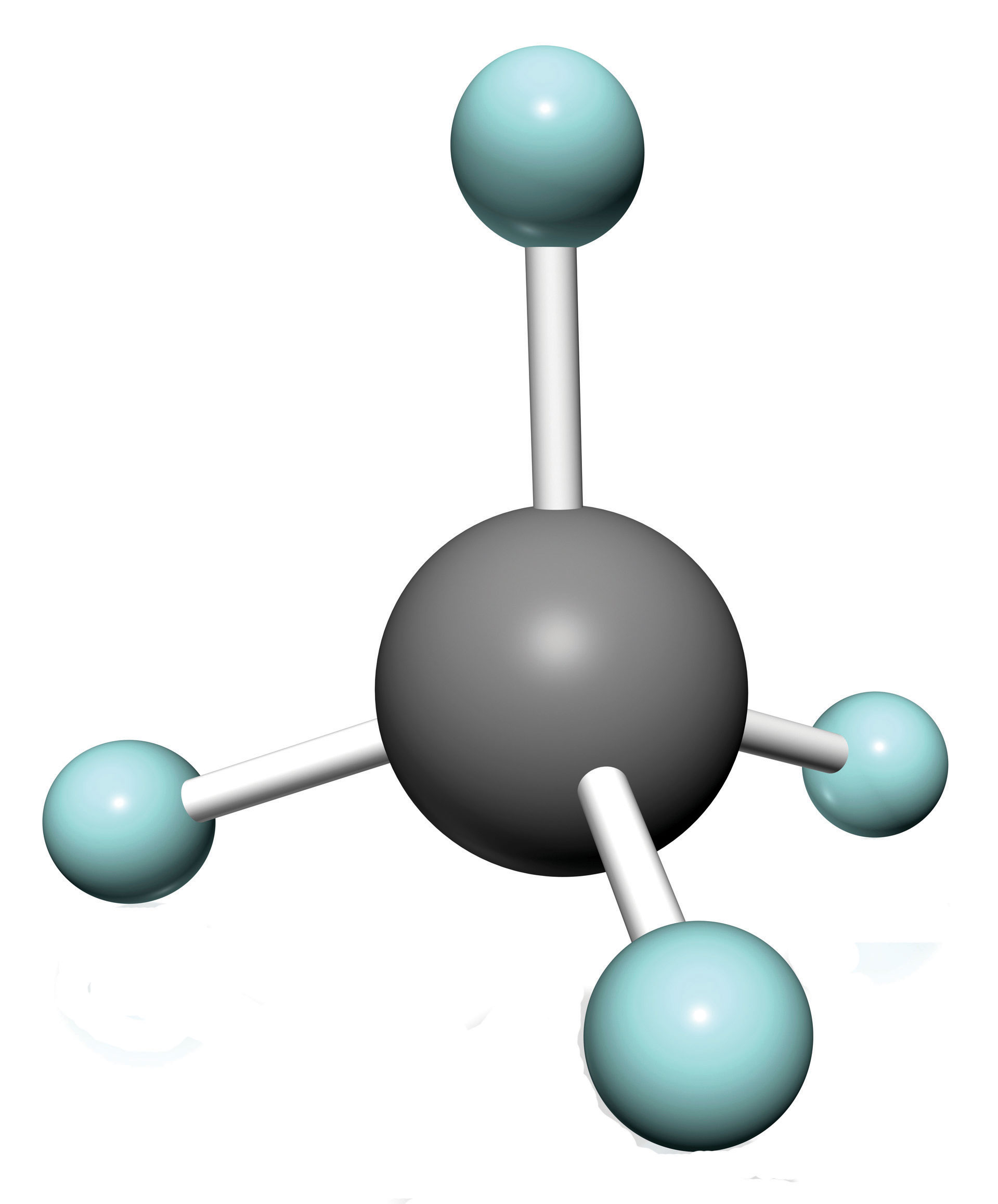
Los diagramas que representan alcanos se denominan fórmulas estructurales porque muestran la estructura de la molécula. A medida que las moléculas se hacen mayores, las fórmulas estructurales se vuelven cada vez más complejas. Una forma de evitar esto es usar una fórmula estructural condensada, que enumera la fórmula de cada átomo de C en la cadena principal de la molécula.
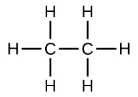
Las fórmulas condensadas muestran átomos de hidrógeno justo al lado de los átomos de carbono a los que están unidos, como se ilustra para el butano:

La fórmula condensada final es una fórmula de ángulo de línea (o dibujo lineal), en la que los átomos de carbono están implícitos en las esquinas y extremos de las líneas, y se entiende que cada átomo de carbono está unido a suficientes átomos de hidrógeno para dar a cada átomo de carbono cuatro enlaces. Por ejemplo, podemos representar pentano (CH 3 CH 2 CH 2 CH 2 CH 3) e isopentano [(CH 3) 2 CHCH 2 CH 3] de la siguiente manera:

| Fórmula estructural | 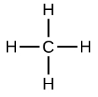 |
 |
|
|---|---|---|---|
| Modelo de Bola y Palo |  |
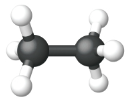 |
|
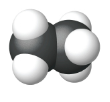
| Modelo de Relleno de Espacio | 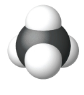 |
 |
|
| Nombre | Metano | Etano | Propano |
| Fórmula estructural condensada | CH 4 | CH 3 CH 3 | CH 3 CH 2 CH 3 |
| Fórmula molecular | CH 4 | C 2 H 6 | C 3 H 8 |
| Dibujo de ángulo de línea |  |
 |
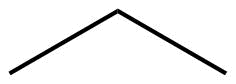 |
Proporcionar la fórmula molecular, la fórmula estructural completa, la fórmula estructural condensada y la fórmula de ángulo de línea para un alcano de cadena lineal con 8 átomos de carbono.
Soluciones
| fórmula estructural | Explicación | Contestar |
|---|---|---|
| Fórmula molecular |
La fórmula general para un alcano es C n H 2 n + 2 Para un alcano con 8 átomos de carbono, C 8 H (2 × 8) + 2 = C 8 H 18. |
C 8 H 18. |
| Fórmula estructural completa | Ocho carbonos primero se unieron entre sí y todos los enlaces restantes al hidrógeno para cumplir con la regla del octeto. | C 1 -C 2 -C 3 -C 4 -C 5 -C 6 -C 7 - C 8 |
| Fórmula estructural condensada |
Los átomos de carbono terminales (C 1 y C 8) están unidos a tres átomos de hidrógeno cada uno y los seis átomos de carbono medios están unidos a dos átomos de hidrógeno cada uno. Los seis átomos de carbono medios están todos unidos a dos átomos de hidrógeno, por lo que la fórmula estructural se puede simplificar aún más. |
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 CH 3 (CH 2) 6 CH 3 |
| Dibujo de ángulo de línea | Ocho átomos de carbono están implícitos en las esquinas y extremos de las líneas, y se entiende que cada átomo de carbono está unido a suficientes átomos de hidrógeno para dar a cada átomo de carbono cuatro enlaces. |
Proporcione la fórmula molecular, la fórmula estructural completa, la fórmula estructural condensada y la fórmula de ángulo de línea para un alcano de cadena lineal con 7 átomos de carbono.
Serie Homóloga
El metano (CH 4), el etano (C 2 H 6) y el propano (C 3 H 8) son el comienzo de una serie de compuestos en los que dos miembros cualesquiera de una secuencia difieren en un átomo de carbono y dos átomos de hidrógeno, es decir, una unidad CH 2. Los primeros 10 miembros de esta serie se dan en la Tabla\(\PageIndex{1}\).
| Fórmula molecular | Fórmula estructural condensada | Nombre |
|---|---|---|
| CH 4 | CH 4 | metano |
| C 2 H 6 | CH 3 CH 3 | etano |
| C 3 H 8 | CH 3 CH 2 CH 3 | propano |
| C 4 H 10 | CH 3 CH 2 CH 2 CH 3 | butano |
| C 5 H 12 | CH 3 CH 2 CH 2 CH 2 CH 3 | pentano |
| C 6 H 14 | CH 3 (CH 2) 4 CH 3 | hexano |
| C 7 H 16 | CH 3 (CH 2) 5 CH 3 | heptano |
| C 8 H 18 | CH 3 (CH 2) 6 CH 3 | octano |
| C 9 H 20 | CH 3 (CH 2) 7 CH 3 | nonano |
| C 10 H 22 | CH 3 (CH 2) 8 CH 3 | decano |
Los paréntesis en las fórmulas estructurales condensadas indican que la agrupación encerrada de átomos está unida al átomo de carbono adyacente.
Considera la serie en la Figura\(\PageIndex{2}\). La secuencia comienza con C 3 H 8, y se agrega una unidad CH 2 en cada paso subiendo la serie. Cualquier familia de compuestos en la que los miembros adyacentes difieran entre sí por un factor definido (aquí un grupo CH 2) se denomina serie homóloga. Los miembros de dicha serie, llamados homólogos, tienen propiedades que varían de manera regular y predecible. El principio de homología da organización a la química orgánica de la misma manera que la tabla periódica da organización a la química inorgánica. En lugar de una desconcertante matriz de compuestos de carbono individuales, podemos estudiar algunos miembros de una serie homóloga y de ellos deducir algunas de las propiedades de otros compuestos de la serie.
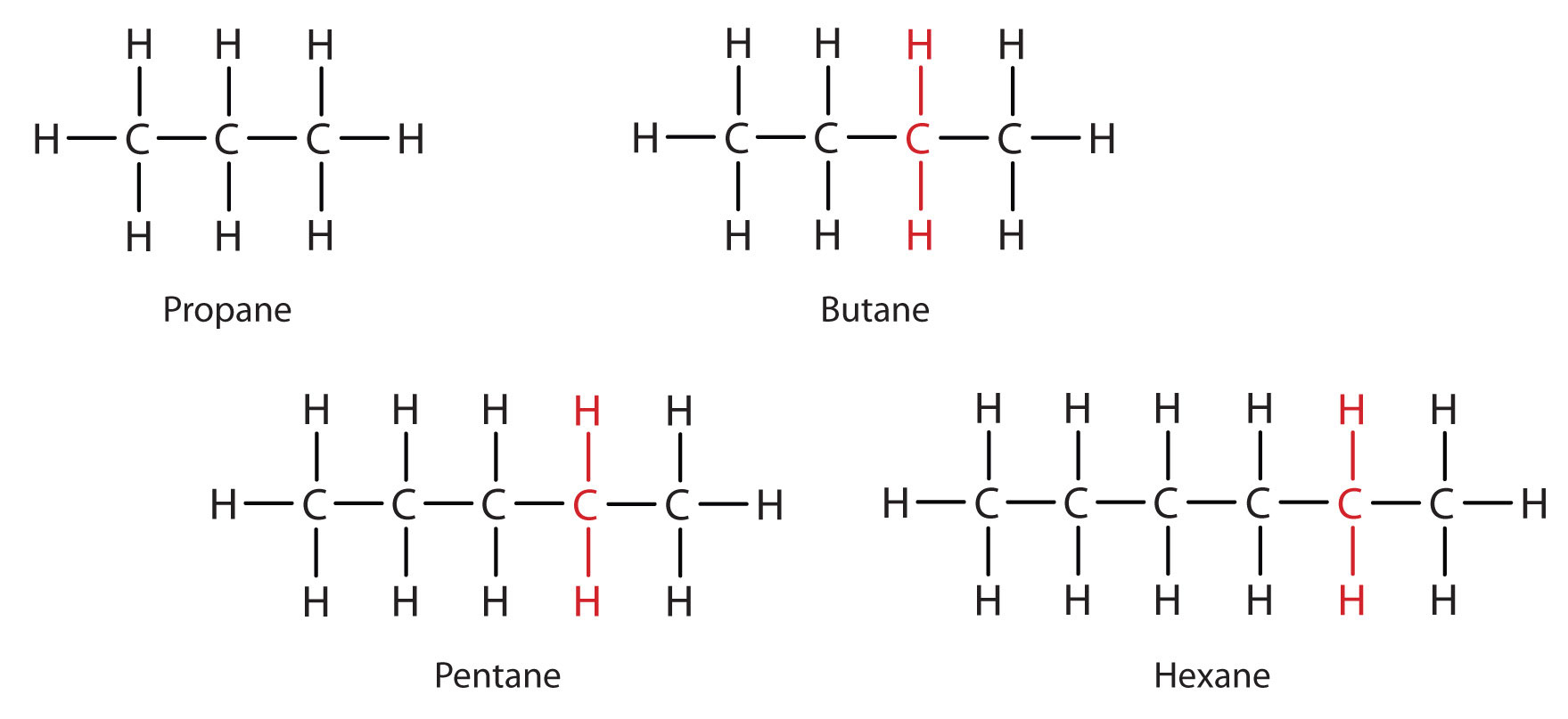
El principio de homología nos permite escribir una fórmula general para alcanos: C n H 2 n + 2. Usando esta fórmula, podemos escribir una fórmula molecular para cualquier alcano con un número dado de átomos de carbono. Por ejemplo, un alcano con ocho átomos de carbono tiene la fórmula molecular C 8 H (2 × 8) + 2 = C 8 H 18.
Nombramiento (Nomenclatura IUPAC)
Una forma sistemática de nombrar hidrocarburos y otros compuestos orgánicos ha sido ideada por la Unión Internacional de Química Pura y Aplicada (IUPAC). Estas reglas, utilizadas a nivel mundial, se conocen como el Sistema de Nomenclatura de la IUPAC. Un nombre de tallo en la Tabla\(\PageIndex{1}\) indica el número de átomos de carbono en la cadena continua más larga (LCC). Entonces se nombran los átomos o grupos unidos a esta cadena carbonada, llamados sustituyentes, con sus posiciones indicadas por números.
| Vástago | Número de átomos de C |
|---|---|
| metanfetamina | 1 |
| eth- | 2 |
| prop- | 3 |
| pero- | 4 |
| reprimido | 5 |
| hex- | 6 |
| hept- | 7 |
| oct- | 8 |
| no- | 9 |
| dec- | 10 |
Una cadena continua (no ramificada) de átomos de carbono a menudo se llama cadena lineal aunque la disposición tetraédrica alrededor de cada carbono le da una forma de zigzag. Los alcanos de cadena recta a veces se llaman alcanos normales, y sus nombres reciben el prefijo n -. Por ejemplo, el butano se llama n-butano. No vamos a usar ese prefijo aquí porque no forma parte del sistema establecido por la Unión Internacional de Química Pura y Aplicada.
¿Cuál es el nombre de un alcano de ocho carbonos?
Solución
El tallo que se refiere a ocho átomos de carbono es oct más el sufijo -ano para un alcano, por lo que la respuesta es Octano.
Proporcione el nombre para los siguientes compuestos:
a. alcano de siete carbonos
b. alcano de seis carbonos
- Contestar
-
a. heptano
b. hexano
Alcanos de cadena ramificada con isomerismo
Uno de los aspectos interesantes de la química orgánica es que es tridimensional. Una molécula puede tener una forma en el espacio que puede contribuir a sus propiedades. Las moléculas pueden diferir en la forma en que están dispuestos los átomos; la misma combinación de átomos se puede ensamblar de más de una manera. Estos compuestos se conocen como isómeros. Los isómeros son moléculas con las mismas fórmulas moleculares, pero diferentes disposiciones de átomos. Analizaremos algunas posibilidades de isómeros para alcanos y alquenos.
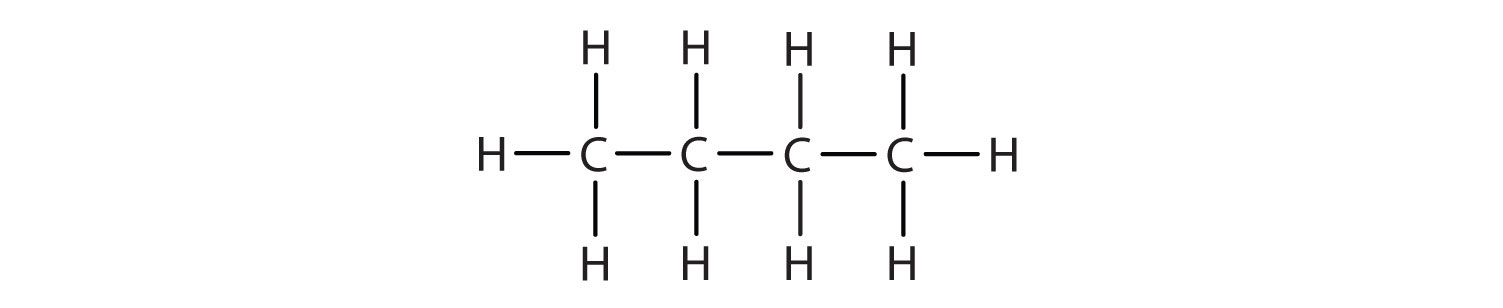
Podemos escribir la estructura del butano (C 4 H 10) encadenando cuatro átomos de carbono en una fila,
—C—C—C—C—
y luego agregar suficientes átomos de hidrógeno para dar a cada átomo de carbono cuatro enlaces:
El butano compuesto tiene esta estructura, pero hay otra manera de juntar 4 átomos de carbono y 10 átomos de hidrógeno. Coloca 3 de los átomos de carbono en una fila y luego ramifica el cuarto del átomo de carbono medio:
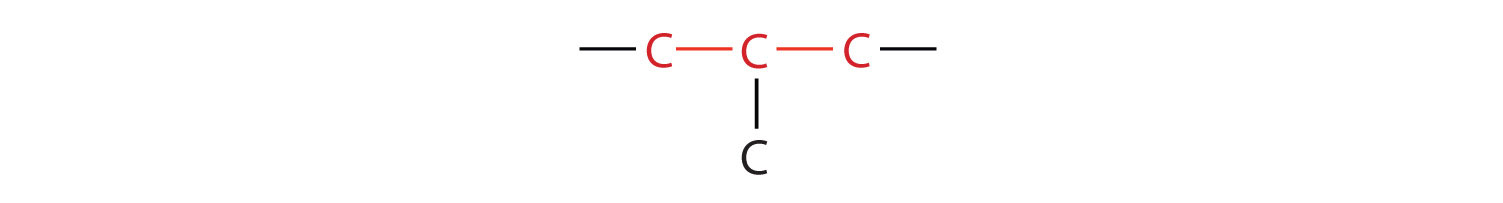
Ahora agregamos suficientes átomos de hidrógeno para dar a cada carbono cuatro enlaces.
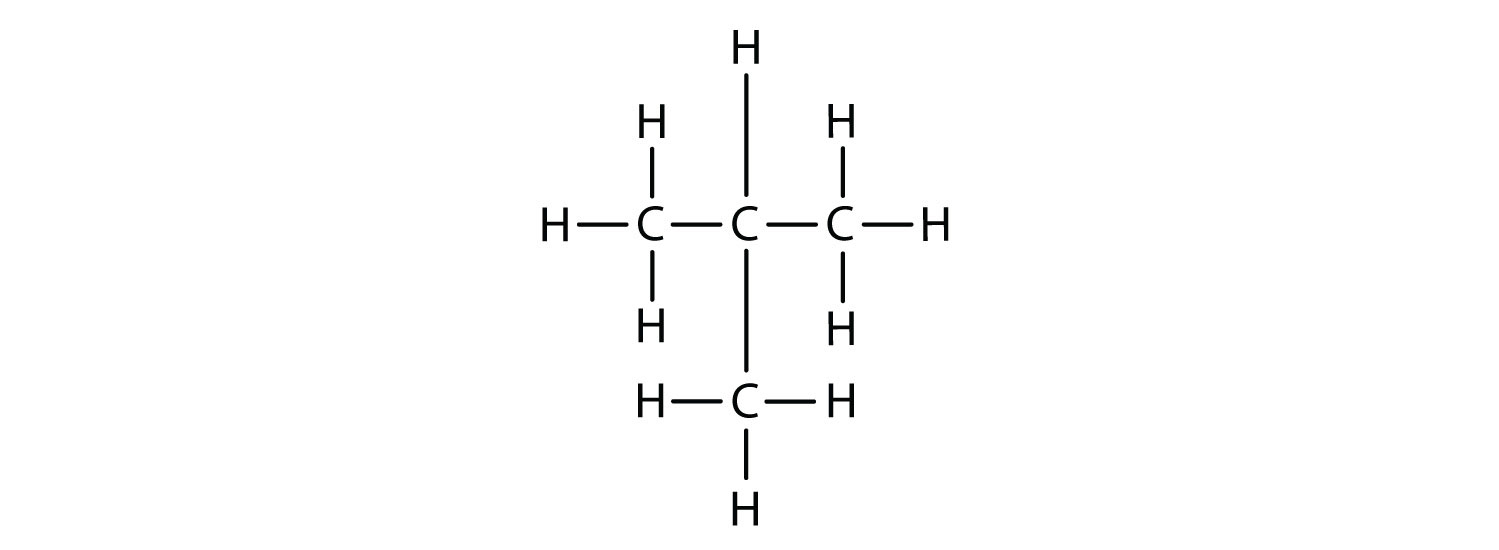
Existe un hidrocarburo que corresponde a esta estructura, lo que significa que dos compuestos diferentes tienen la misma fórmula molecular: C 4 H 10. Los dos compuestos tienen diferentes propiedades, por ejemplo, uno hierve a −0.5°C; el otro a −11.7°C. Los diferentes compuestos que tienen la misma fórmula molecular se denominan isómeros.
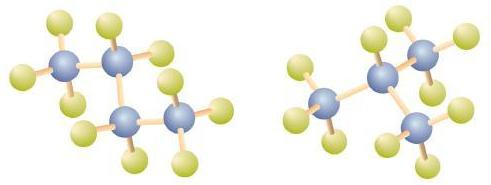
Observe que C 4 H 10 se representa con una cadena doblada en la Figura\(\PageIndex{4}\). La cadena de cuatro carbonos puede doblarse de varias maneras porque los grupos pueden rotar libremente alrededor de los enlaces C-C. Sin embargo, esta rotación no cambia la identidad del compuesto. Es importante darse cuenta de que doblar una cadena no cambia la identidad del compuesto; todos los siguientes representan el mismo compuesto, butano:
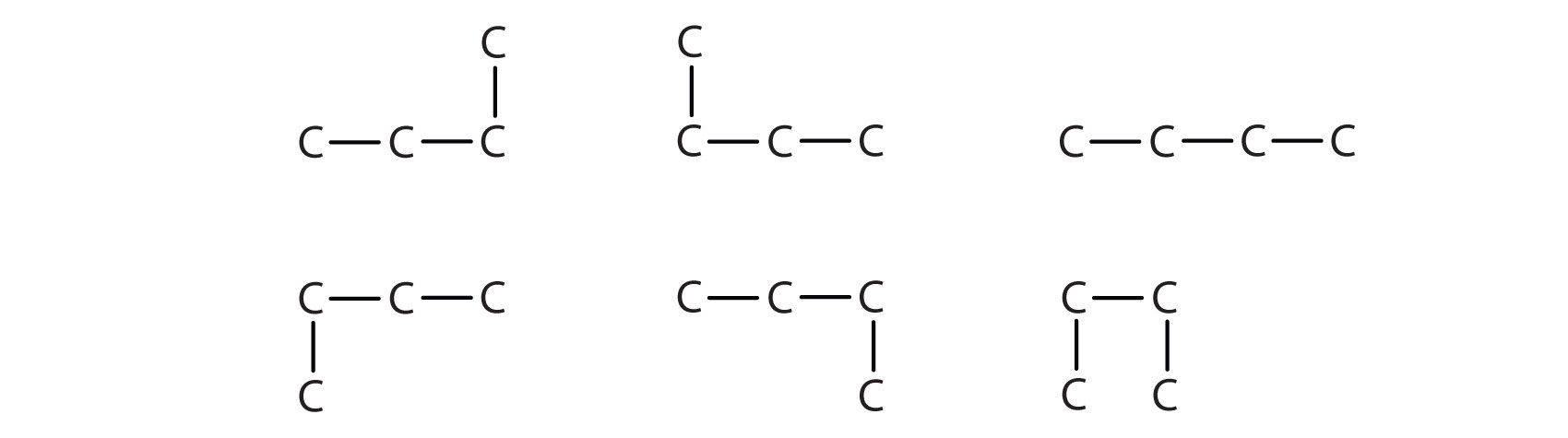
La estructura del isobutano muestra una cadena continua de tres átomos de carbono solamente, con el cuarto unido como una ramificación del átomo de carbono medio de la cadena continua, que es diferente de las estructuras del butano (compare las dos estructuras en la Figura\(\PageIndex{4}\).
A diferencia de C 4 H 10, los compuestos metano (CH 4), etano (C 2 H 6) y propano (C 3 H 8) no existen en formas isoméricas porque solo hay una manera de disponer los átomos en cada fórmula para que cada átomo de carbono tenga cuatro enlaces.
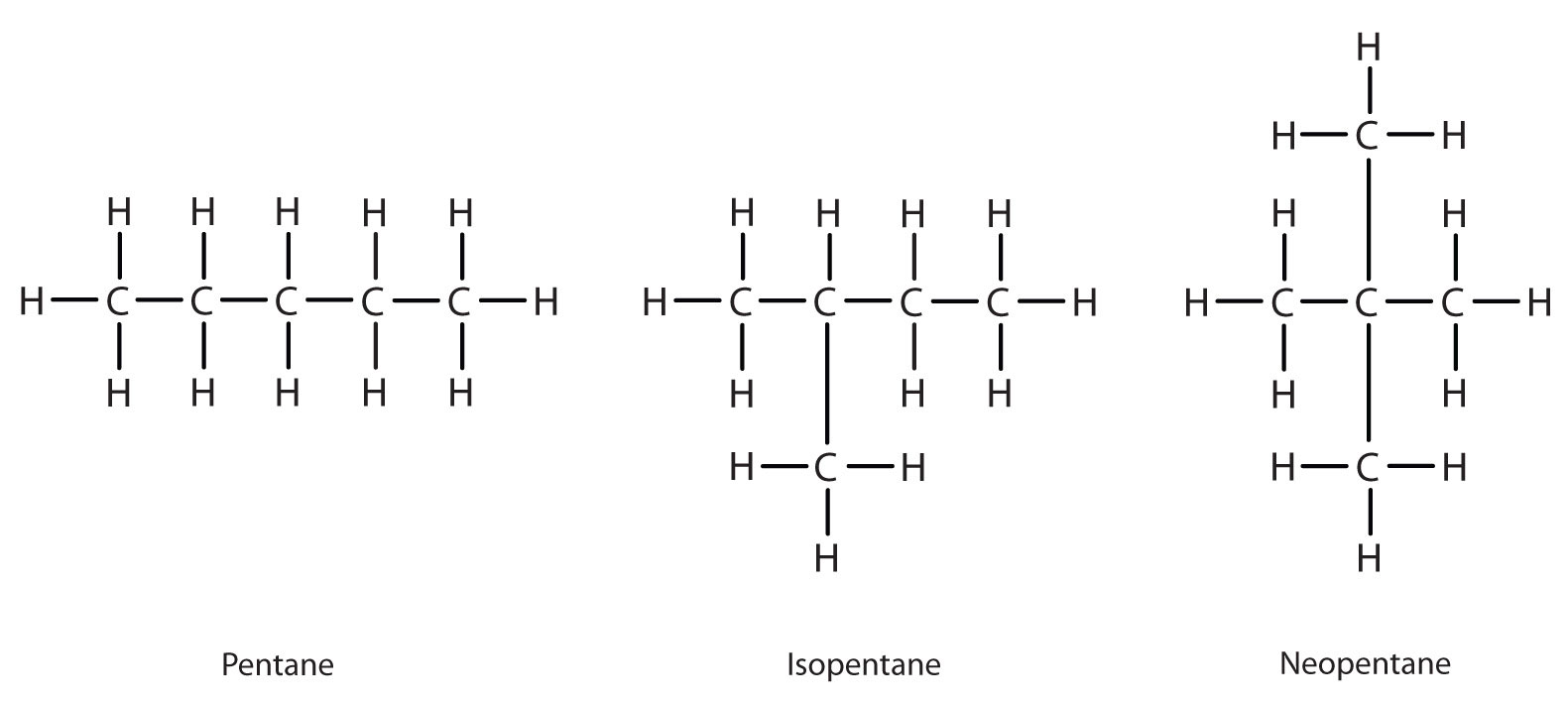
Siguiente más allá de C 4 H 10 en la serie homóloga es pentano. Cada compuesto tiene la misma fórmula molecular: C 5 H 12. El compuesto en el extremo izquierdo es pentano porque tiene los cinco átomos de carbono en una cadena continua. El compuesto en el medio es isopentano; al igual que el isobutano, tiene una ramificación de un CH 3 del segundo átomo de carbono de la cadena continua. El compuesto en el extremo derecho, descubierto después de los otros dos, recibió el nombre de neopentano (del griego neos, que significa “nuevo”). Aunque los tres tienen la misma fórmula molecular, tienen diferentes propiedades, incluyendo puntos de ebullición: pentano, 36.1°C; isopentano, 27.7°C; y neopentano, 9.5°C.
Nombrar alcanos ramificados
Ya aprendiste los fundamentos de la nomenclatura: los nombres de los primeros 10 hidrocarburos normales. Aquí, agregaremos algunos pasos al procedimiento para que puedas nombrar hidrocarburos ramificados.
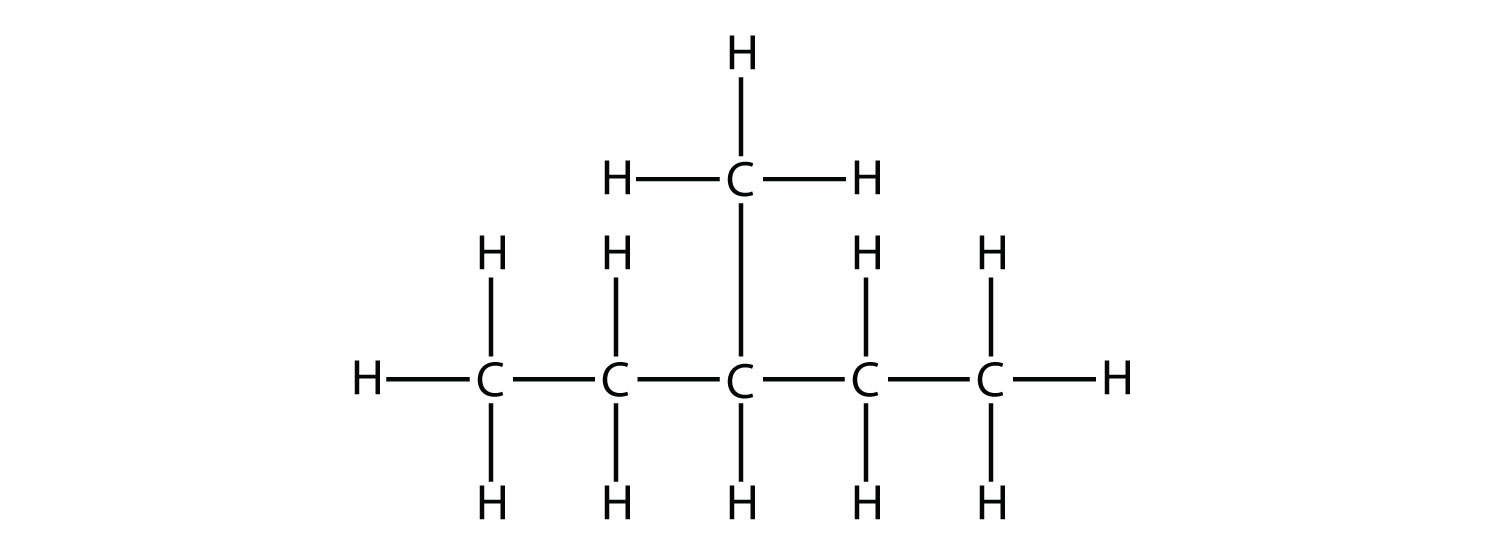
Primero, dada la estructura de un alcano, identificar la cadena continua más larga de átomos de C. Tenga en cuenta que la cadena más larga no se puede dibujar en línea recta. La cadena más larga determina el nombre padre del hidrocarburo. Por ejemplo, en la molécula
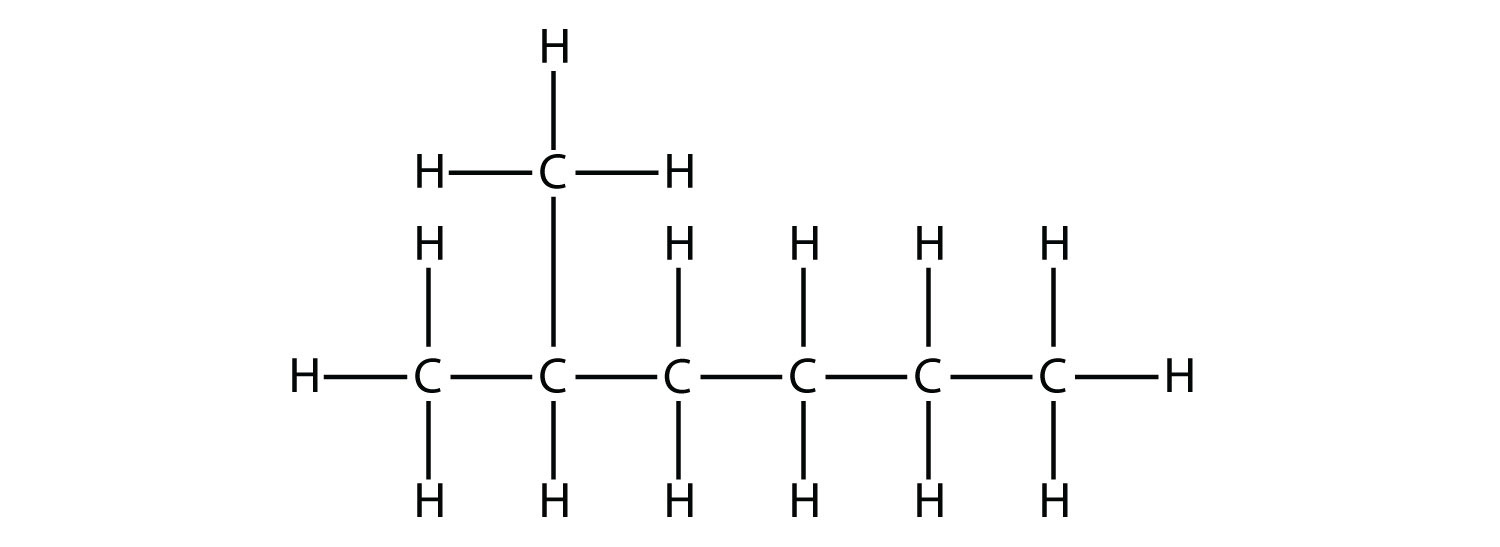
la cadena más larga de carbonos tiene seis átomos de C. Por lo tanto, se denominará como hexano. Sin embargo, en la molécula
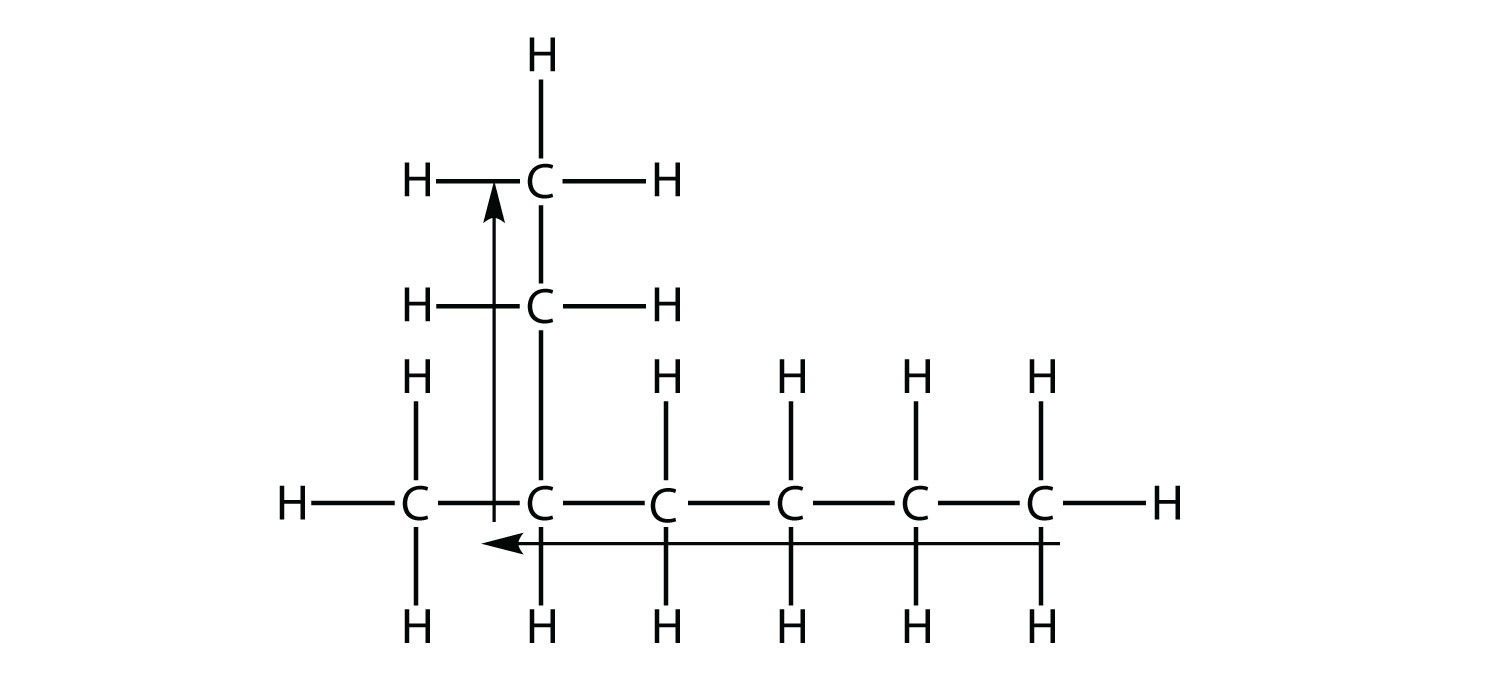
la cadena más larga de átomos de C no es seis, sino siete, como se muestra. Entonces esta molécula será nombrada como heptano.
El siguiente paso es identificar las ramas, o sustituyentes, en la cadena principal. Los nombres de los sustituyentes, o grupos alquilo, se derivan de los nombres de los hidrocarburos parentales; sin embargo, en lugar de tener el extremo - ane, el nombre del sustituyente tiene el final - yl. Tabla\(\PageIndex{3}\), enumera los nombres de los sustituyentes para los cinco sustituyentes más pequeños.
| Fórmula de sustituyentes | Número de átomos de C | Nombre del sustituyente |
|---|---|---|
| CH 3 | 1 | metilo - |
| CH 3 CH 2 | 2 | etilo - |
| CH 3 CH 2 CH 2 | 3 | propil - |
| CH 3 CH 2 CH 2 CH 2 | 4 | butilo - |
| CH 3 CH 2 CH 2 CH 2 CH 2 CH | 5 | pentil - |
| y así sucesivamente | y así sucesivamente | y así sucesivamente |
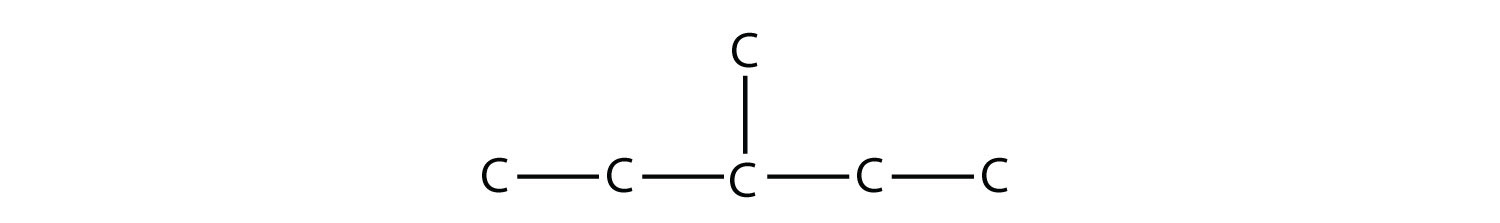
Al nombrar el hidrocarburo ramificado, el nombre del sustituyente se combina con el nombre parental del hidrocarburo sin espacios. No obstante, es probable que haya un paso más. Se debe numerar la cadena más larga del hidrocarburo y se debe incluir la posición numérica del sustituyente para dar cuenta de posibles isómeros. Al igual que con los dobles y triples enlaces, la cadena principal está numerada para dar al sustituyente el menor número posible. Por ejemplo, en este alcano
la cadena más larga tiene cinco átomos de C de largo, por lo que es un pentano. Hay un sustituyente de un carbono en el tercer átomo de C, por lo que hay un grupo metilo en la posición 3. Indicamos la posición usando el número, al que le sigue un guión, el nombre del sustituyente y el nombre del hidrocarburo parental, en este caso, 3-metilpentano. Ese nombre es específico de ese hidrocarburo en particular y ninguna otra molécula. ¡La nomenclatura de química orgánica es muy específica!
Es común escribir la fórmula estructural de un hidrocarburo sin los átomos de H, para mayor claridad. Así que también podemos representar 3-metilpentano como
donde se entiende que cualquier enlace covalente no escrito son enlaces con átomos de H. Con esta comprensión, reconocemos que la fórmula estructural para 3-metilpentano se refiere a una molécula con la fórmula de C 6 H 14.
Nombra esta molécula.
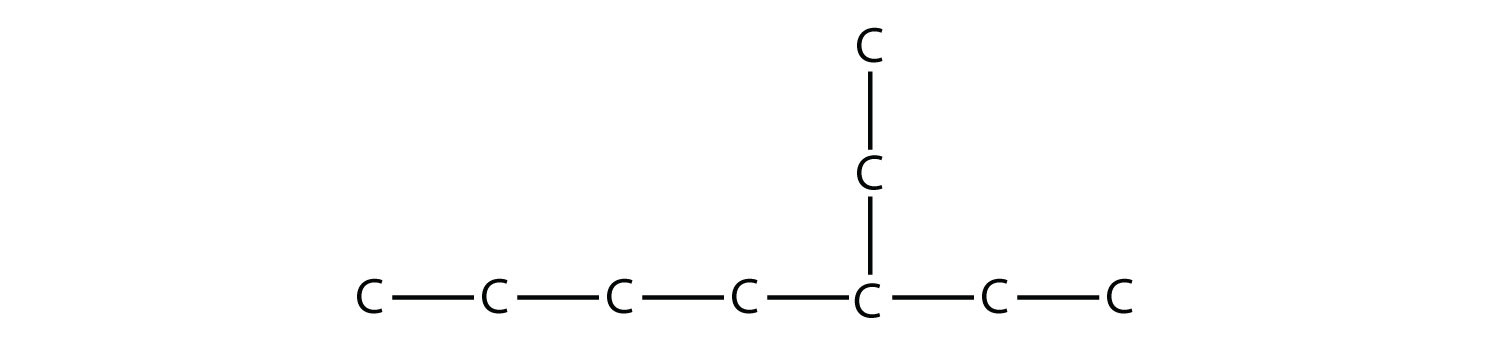
Solución
La cadena carbonada continua más larga tiene siete átomos de C, por lo que esta molécula será nombrada como heptano. Hay un sustituyente de dos carbonos en la cadena principal, que es un grupo etilo. Para dar al sustituyente la numeración más baja, numeramos la cadena desde el lado derecho y vemos que el sustituyente está en el tercer átomo de C. Entonces este hidrocarburo es 3-etilheptano.
Nombra esta molécula.
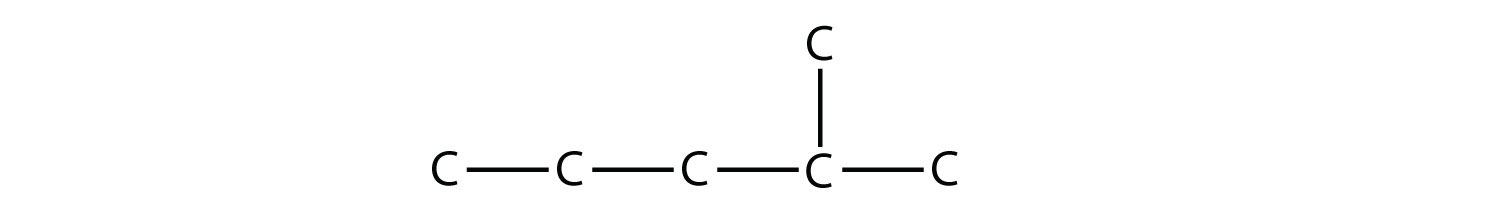
Contestar
2-metilpentano
Los hidrocarburos ramificados pueden tener más de un sustituyente. Si los sustituyentes son diferentes, entonces dale a cada sustituyente un número (usando los números más pequeños posibles) y enumere los sustituyentes en orden alfabético, con los números separados por guiones y sin espacios en el nombre. Así que la molécula
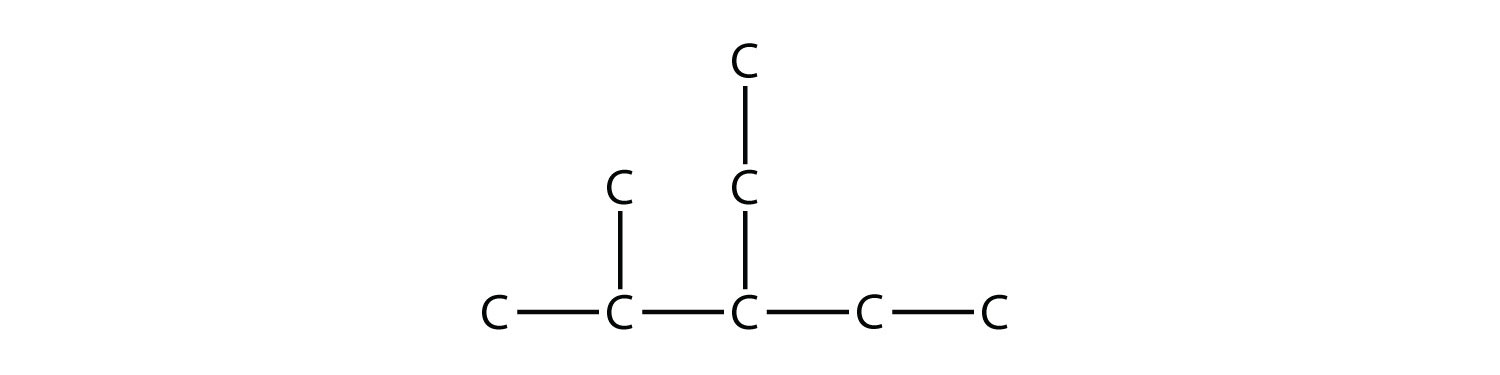
es 3-etil-2-metilpentano.
Si los sustituyentes son iguales, entonces usa el nombre del sustituyente solo una vez, pero usa más de un número, separado por una coma. Además, ponga un prefijo numérico antes del nombre del sustituyente que indique el número de sustituyentes de ese tipo. Los prefijos numéricos se listan en la Tabla\(\PageIndex{4}\). El número de los valores de posición debe estar de acuerdo con el prefijo numérico antes del sustituyente.
| Número del mismo sustituyente | Prefijo numérico |
|---|---|
| 2 | di - |
| 3 | tri- |
| 4 | tetra - |
| 5 | penta - |
| y así sucesivamente | y así sucesivamente |
Considera esta molécula:
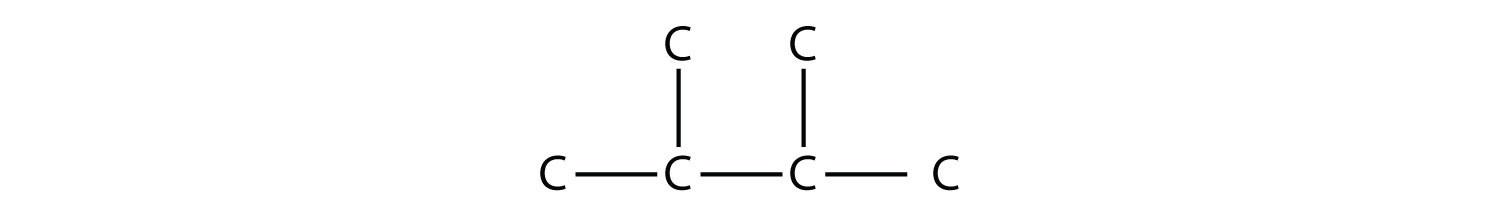
La cadena más larga tiene cuatro átomos de C, por lo que es un butano. Hay dos sustituyentes, cada uno de los cuales consiste en un solo átomo de C; son grupos metilo. Los grupos metilo están en el segundo y tercer átomos de C de la cadena (sin importar en qué extremo parte la numeración), por lo que llamaríamos a esta molécula 2,3-dimetilbutano. Anote la coma entre los números, el guión entre los números y el nombre del sustituyente, y la presencia del prefijo di - antes del metilo. Otras moléculas, incluso con un mayor número de sustituyentes, se pueden nombrar de manera similar.
Nombra esta molécula.
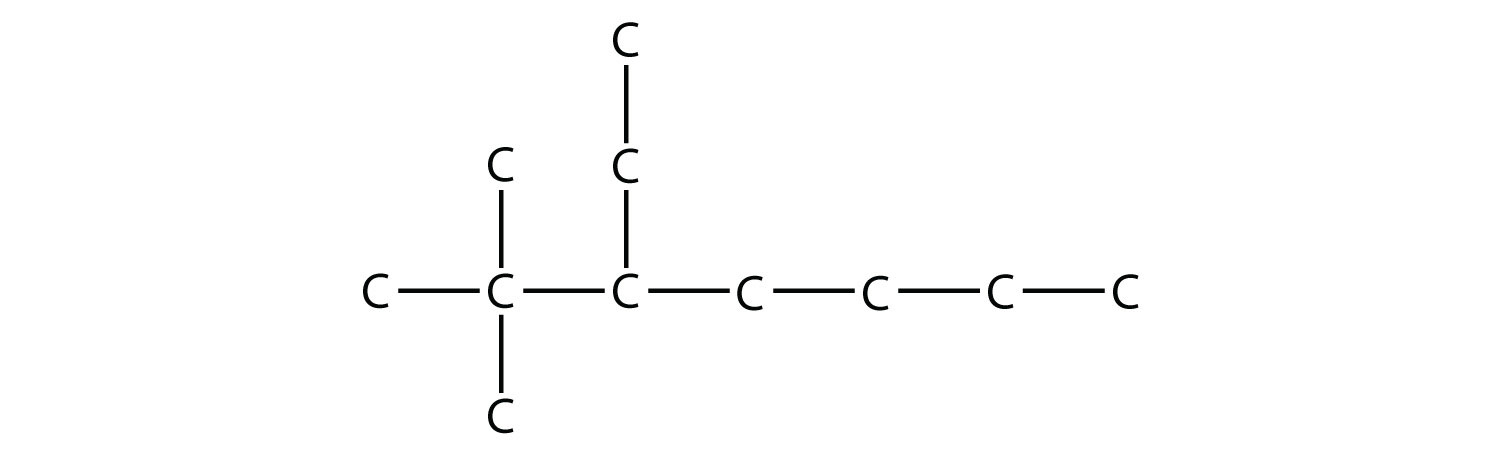
Solución
La cadena más larga tiene siete átomos de C, por lo que denominamos a esta molécula como heptano. Encontramos dos sustituyentes de un carbono en el segundo átomo de C y un sustituyente de dos carbonos en el tercer átomo de C. Entonces esta molécula se llama 3-etil-2,2-dimetilheptano.
Nombra esta molécula.
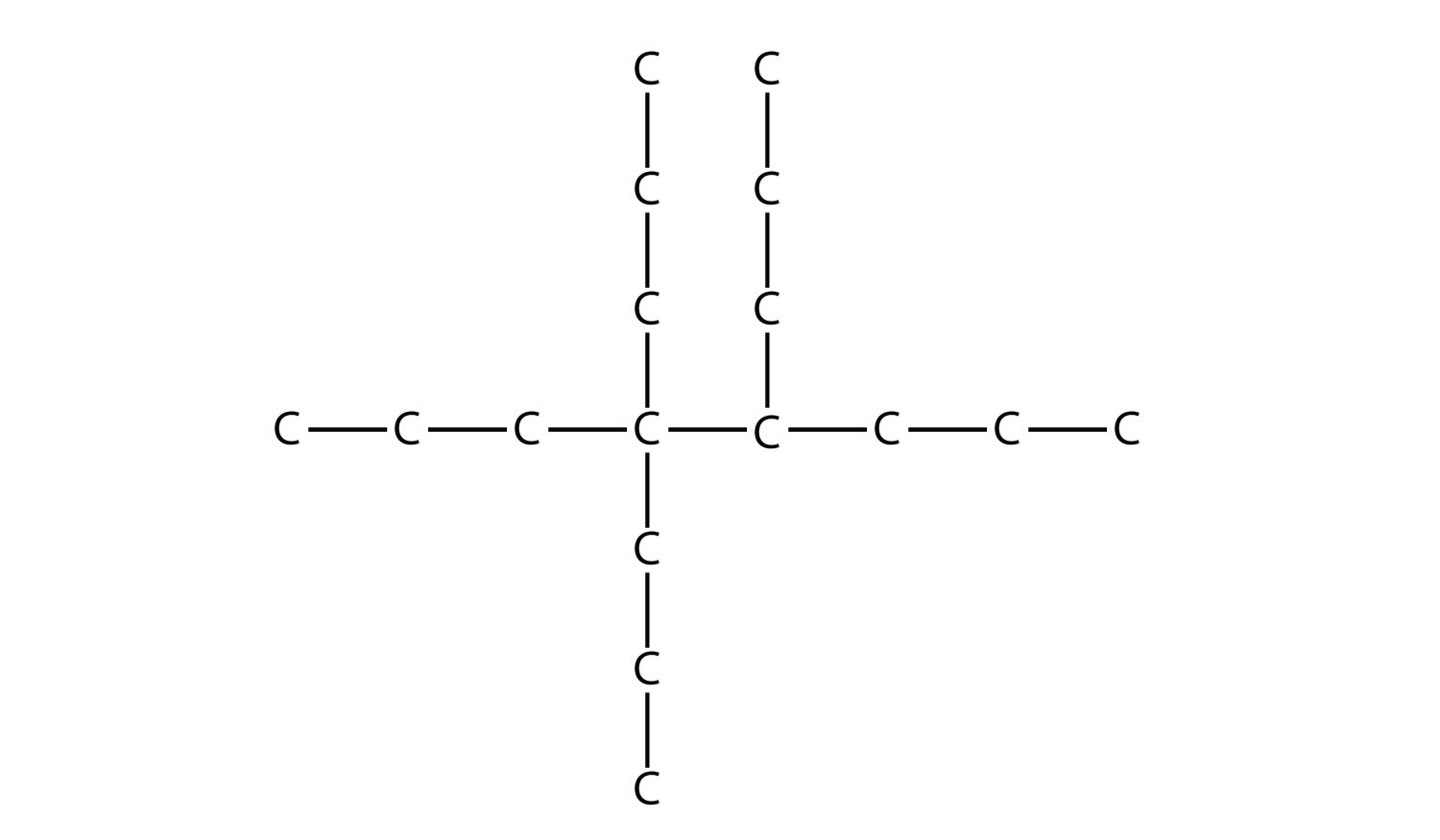
Contestar
4,4,5-tripropiloctano
Propiedades de Alkanes
Todos los alcanos están compuestos por átomos de carbono e hidrógeno, y tienen enlaces, estructuras y fórmulas similares; los alcanos no cíclicos tienen una fórmula de C n H 2n +2. El número de átomos de carbono presentes en un alcano no tiene límite. Un mayor número de átomos en las moléculas conducirá a atracciones intermoleculares más fuertes (fuerzas de dispersión) y correspondientemente diferentes propiedades físicas de las moléculas. Propiedades como el punto de fusión y el punto de ebullición (Tabla\(\PageIndex{5}\)) suelen cambiar de manera suave y predecible a medida que cambia el número de átomos de carbono e hidrógeno en las moléculas.
| alcano | Fórmula molecular | Punto de fusión (°C) | Punto de ebullición (°C) | Fase en STP 4 | Número de isómeros estructurales |
|---|---|---|---|---|---|
| metano | CH 4 | —182.5 | —161.5 | gas | 1 |
| etano | C 2 H 6 | —183.3 | —88.6 | gas | 1 |
| propano | C 3 H 8 | —187.7 | —42.1 | gas | 1 |
| butano | C 4 H 10 | —138.3 | —0.5 | gas | 2 |
| pentano | C 5 H 12 | —129.7 | 36.1 | líquido | 3 |
| hexano | C 6 H 14 | —95.3 | 68.7 | líquido | 5 |
| heptano | C 7 H 16 | —90.6 | 98.4 | líquido | 9 |
| octano | C 8 H 18 | —56.8 | 125.7 | líquido | 18 |
| nonano | C 9 H 20 | —53.6 | 150.8 | líquido | 35 |
| decano | C 10 H 22 | —29.7 | 174.0 | líquido | 75 |
| tetradecano | C 14 H 30 | 5.9 | 253.5 | sólido | 1858 |
| octadecano | C 18 H 38 | 28.2 | 316.1 | sólido | 60,523 |
Los alcanos son moléculas relativamente estables, pero el calor o la luz activarán reacciones que implican la ruptura de enlaces simples C—H o C—C. La combustión es una de esas reacciones:
\[\ce{CH4}(g)+\ce{2O2}(g)⟶\ce{CO2}(g)+\ce{2H2O}(g) \nonumber \]
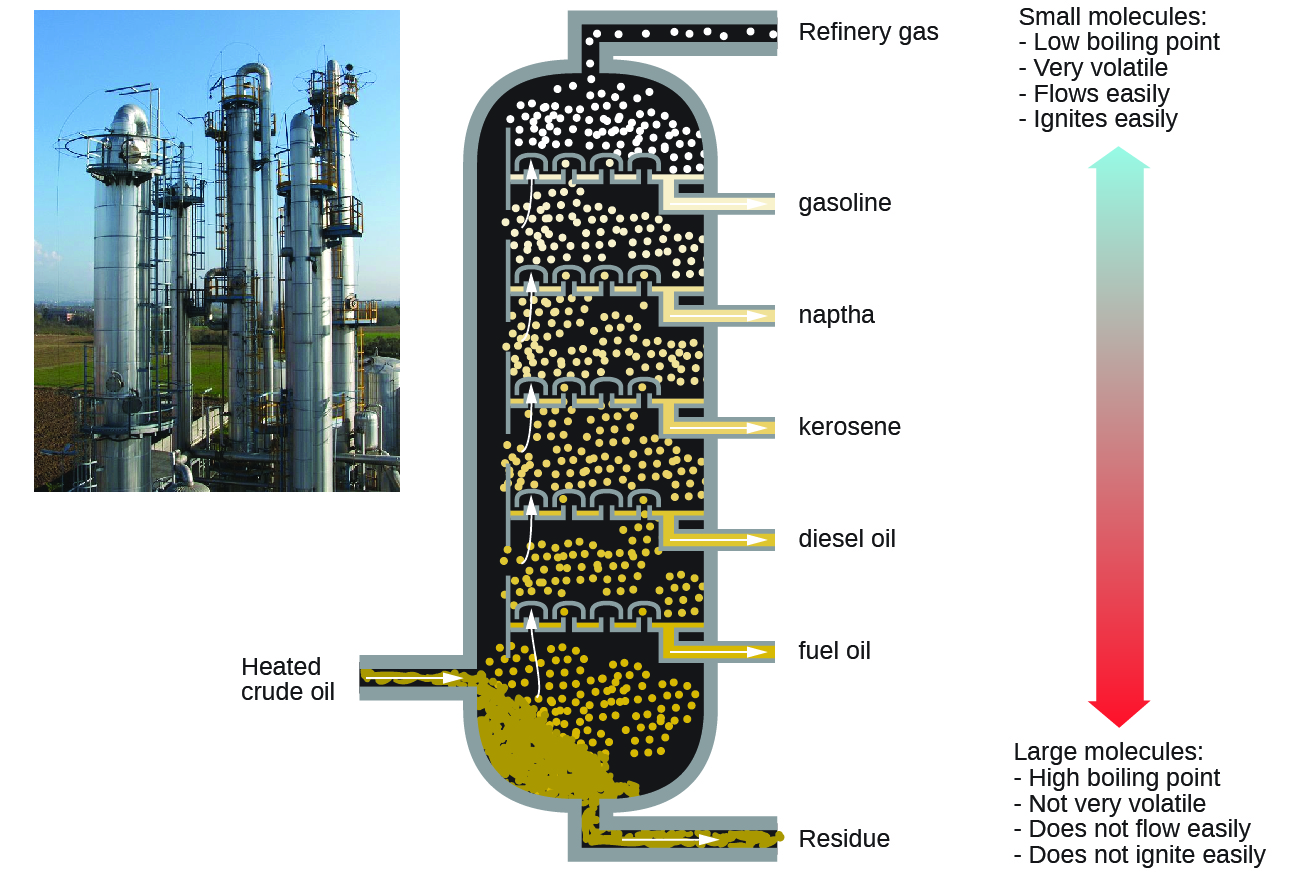
Los alcanos se queman en presencia de oxígeno, una reacción de oxidación-reducción altamente exotérmica que produce dióxido de carbono y agua. Como consecuencia, los alcanos son excelentes combustibles. Por ejemplo, el metano, CH 4, es el principal componente del gas natural. El butano, C 4 H 10, utilizado en estufas y encendedores de camping es un alcano. La gasolina es una mezcla líquida de alcanos de cadena continua y ramificada, cada uno de los cuales contiene de cinco a nueve átomos de carbono, además de diversos aditivos para mejorar su desempeño como combustible. El queroseno, el gasóleo y el fuel oil son principalmente mezclas de alcanos con masas moleculares más altas. La principal fuente de estos combustibles alcanos líquidos es el petróleo crudo, una mezcla compleja que se separa por destilación fraccionada. La destilación fraccionada aprovecha las diferencias en los puntos de ebullición de los componentes de la mezcla (Figura\(\PageIndex{10}\)). Se puede recordar que el punto de ebullición es una función de las interacciones intermoleculares, lo cual fue discutido en el capítulo sobre soluciones y coloides.
En una reacción de sustitución, otra reacción típica de alcanos, uno o más de los átomos de hidrógeno del alcano se reemplaza por un átomo o grupo de átomos diferente. No se rompen enlaces carbono-carbono en estas reacciones, y la hibridación de los átomos de carbono no cambia. Por ejemplo, la reacción entre etano y cloro molecular representada aquí es una reacción de sustitución:
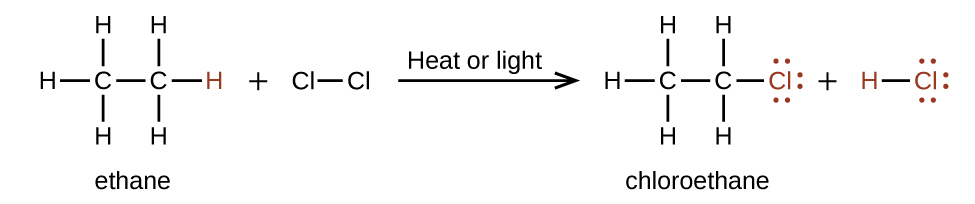
La porción C-Cl de la molécula de cloroetano es un ejemplo de un grupo funcional, la parte o resto de una molécula que imparte una reactividad química específica. Los tipos de grupos funcionales presentes en una molécula orgánica son determinantes principales de sus propiedades químicas y se utilizan como medio para clasificar compuestos orgánicos como se detalla en las secciones restantes de este capítulo.
Hidrocarburos cíclicos
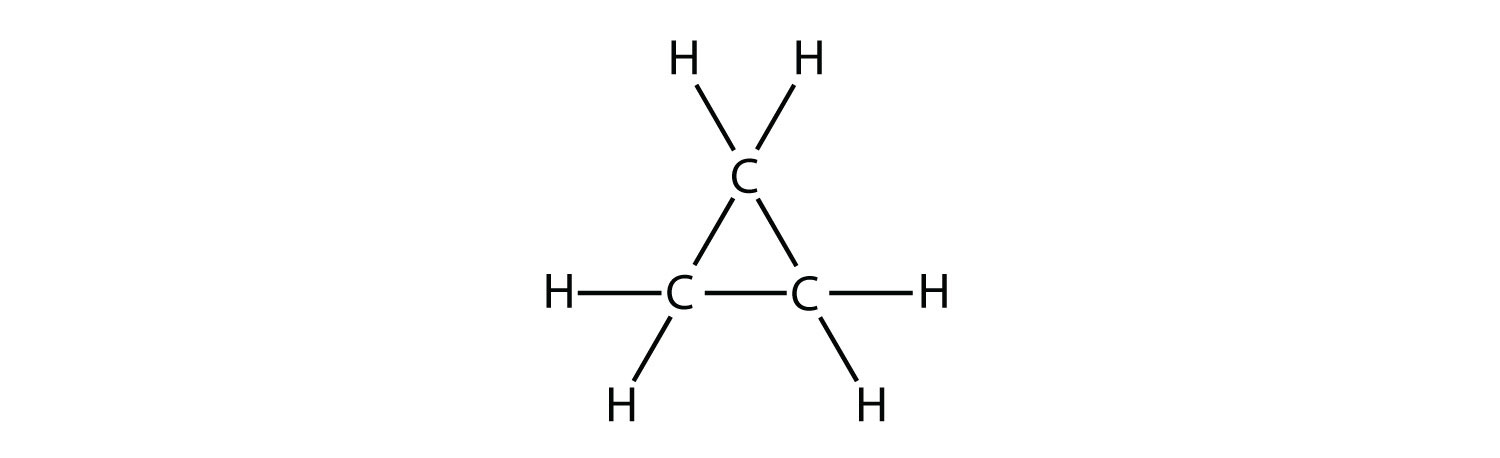
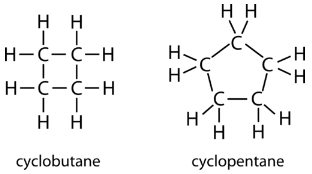
Un hidrocarburo cíclico es un hidrocarburo en el que la cadena de carbono se une a sí misma en un anillo. Un cicloalcano es un hidrocarburo cíclico en el que todos los enlaces carbono-carbono son enlaces simples. Al igual que otros alcanos, los cicloalcanos son compuestos saturados. Los cicloalcanos tienen la fórmula general\(\ce{C_{n}H_{2n}}\). El cicloalcano más simple que se muestra a continuación es el ciclopropano, un anillo de tres carbonos.
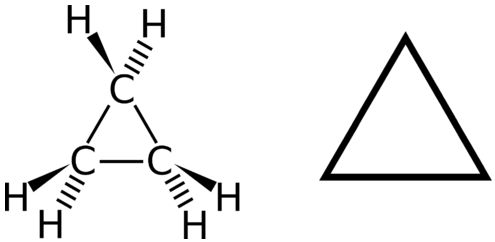
Las fórmulas estructurales de los hidrocarburos cíclicos se pueden representar de múltiples maneras, dos de las cuales se muestran anteriormente. Cada átomo se puede mostrar como en la estructura de la izquierda de la figura anterior. Una taquigrafía conveniente es omitir los símbolos del elemento y solo mostrar la forma, como en el triángulo de la derecha. Se entiende que los átomos de carbono son los vértices del triángulo.
Los átomos de carbono en los cicloalcanos aún están\(sp^3\) hibridados, con un ángulo de enlace ideal de\(109.5^\text{o}\). Sin embargo, un examen de la estructura del ciclopropano muestra que la estructura triangular da como resultado un ángulo de\(\ce{C-C-C}\) unión de\(60^\text{o}\). Esta desviación del ángulo ideal se llama tensión de anillo y hace que el ciclopropano sea una molécula bastante inestable y reactiva. La tensión del anillo disminuye para el ciclobutano, con un ángulo de unión de\(90^\text{o}\), pero aún es significativo. El ciclopentano tiene un ángulo de unión de aproximadamente\(108^\text{o}\). Esta cepa de anillo mínima para ciclopentano lo convierte en un compuesto más estable.
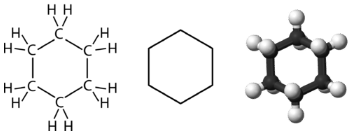
El ciclohexano es un cicloalcano de seis carbonos que se muestra a continuación
Las tres representaciones de ciclohexano son algo engañosas porque la molécula no es plana. Con el fin de reducir la tensión del anillo y lograr un ángulo de enlace de aproximadamente\(109.5^\text{o}\), la molécula se frunce. El fruncimiento del anillo significa que todos los demás átomos de carbono están por encima y por debajo del plano. La siguiente figura muestra dos posibilidades para la molécula de ciclohexano frunciado. Cada una de las estructuras se llama conformación. A la conformación de la derecha se le llama conformación de barco, mientras que a la de la izquierda se le llama conformación de silla.
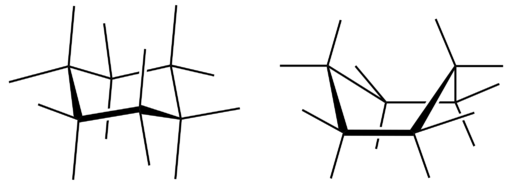
Si bien ambas conformaciones reducen la tensión del anillo en comparación con una molécula plana, se prefiere la silla. Esto se debe a que la conformación de la silla resulta en menos interacciones repulsivas entre los átomos de hidrógeno. Sin embargo, la interconversión se produce fácilmente entre las dos conformaciones.
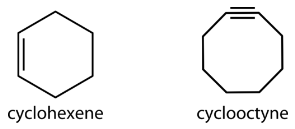
También existen cicloalcanos más grandes, pero son menos comunes. Los hidrocarburos cíclicos también pueden ser insaturados. Un cicloalqueno es un hidrocarburo cíclico con al menos un doble enlace carbono-carbono. Un cicloalquino es un hidrocarburo cíclico con al menos un triple enlace carbono-carbono. A continuación se muestran las fórmulas estructurales simplificadas para ciclohexeno y ciclooctina.
Hidrocarburos no saturados: Alquenos y Alquinos
Alquenos
Los compuestos orgánicos que contienen uno o más dobles o triples enlaces entre átomos de carbono se describen como insaturados. Los hidrocarburos insaturados tienen menos del número máximo de átomos de H posible. Las moléculas de hidrocarburos insaturados que contienen uno o más dobles enlaces se denominan alquenos. Los átomos de carbono unidos por un doble enlace están unidos entre sí por dos enlaces, un enlace σ y un enlace π. Los enlaces dobles y triples dan lugar a una geometría diferente alrededor del átomo de carbono que participa en ellos, dando lugar a importantes diferencias en la forma y propiedades moleculares. Las diferentes geometrías son responsables de las diferentes propiedades de las grasas insaturadas frente a las saturadas.
La palabra no saturadas tiene el mismo significado para hidrocarburos que para las grasas y aceites de la dieta: la molécula tiene al menos un doble carbono-carbono (C=C) o triple enlace (C = C).
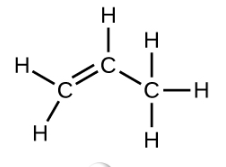
El eteno, C 2 H 4, es el alqueno más simple. Cada átomo de carbono en el eteno, comúnmente llamado etileno, tiene una estructura plana trigonal. El segundo miembro de la serie es propeno (propileno) (Figura\(\PageIndex{16}\)); los isómeros de buteno siguen en la serie. Cuatro átomos de carbono en la cadena de buteno permiten la formación de isómeros basados en la posición del doble enlace, así como una nueva forma de isomería.
| Fórmula estructural | 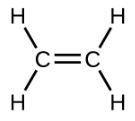 |
 |
 |
|---|---|---|---|
| Modelo de Bola y Palo |  |
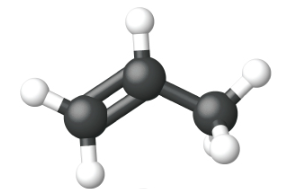 |
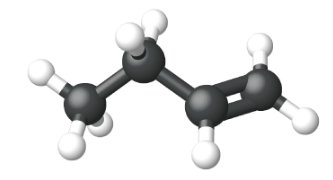 |
| Modelo de Relleno de Espacio | 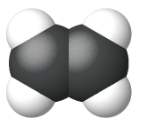 |
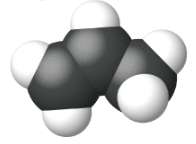 |
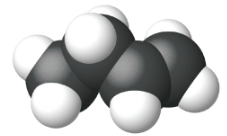 |
| Nombre | eteno | propeno | 1-buteno |
| Fórmula estructural condensada | CH 2 CH 2 | CH 2 CHCH 3 | CH 3 CH 2 CHCH 2 |
| Fórmula molecular | C 2 H 2 | C 3 H 6 | C 4 H 8 |
| Dibujo de ángulo de línea | 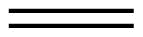 |
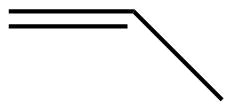 |
 |
El nombre de un alqueno se deriva del nombre del alcano con el mismo número de átomos de carbono. La presencia del doble enlace se significa reemplazando el sufijo -ane por el sufijo -ene. La ubicación del doble enlace se identifica nombrando el menor de los números de los átomos de carbono que participan en el doble enlace:
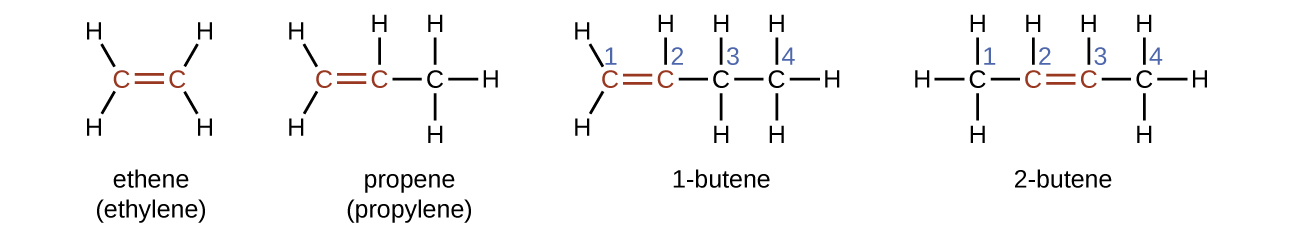
Alquinos
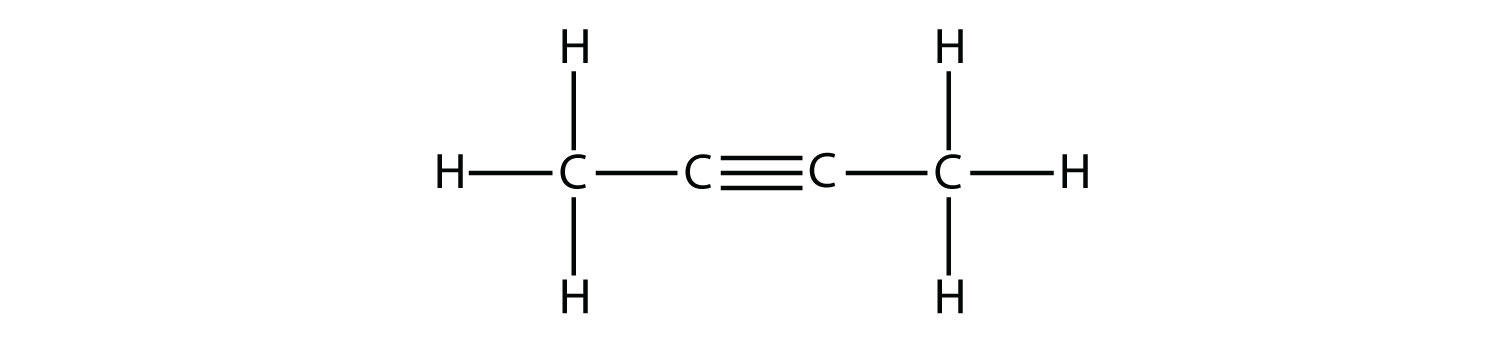
Las moléculas de hidrocarburos con uno o más enlaces triples se denominan alquinos; constituyen otra serie de hidrocarburos insaturados. Dos átomos de carbono unidos por un triple enlace están unidos entre sí por un enlace σ y dos enlaces π. Los carbonos hibridados sp involucrados en el triple enlace tienen ángulos de enlace de 180°, dando a este tipo de enlaces una forma lineal, similar a una barra.
El miembro más simple de la serie de alquinos es el etino, C 2 H 2, comúnmente llamado acetileno. La estructura de Lewis para el etino, una molécula lineal, es:
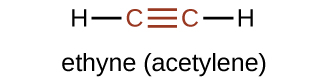
La nomenclatura IUPAC para alquinos es similar a la de los alquenos excepto que se usa el sufijo -ino para indicar un triple enlace en la cadena. Por ejemplo,\(\mathrm{CH_3CH_2C≡CH}\) se llama 1-butino.
Nombrar Alquenos y Alquinos
Los alquenos y alquinos se nombran de manera similar. La mayor diferencia es que al identificar la cadena de carbono más larga, debe contener el doble o triple enlace C—C. Además, al numerar la cadena principal, el doble o triple enlace obtiene el menor número posible. Esto significa que puede haber sustituyentes con números más largos o más altos que los permitidos si la molécula fuera un alcano. Por ejemplo, esta molécula
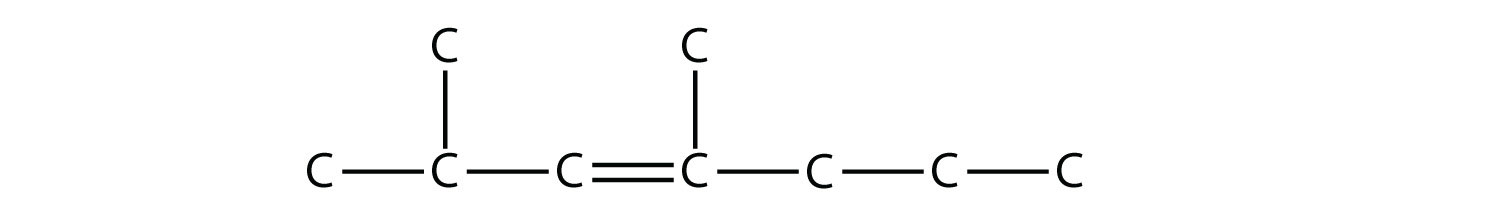
es 2,4-dimetil-3-hepteno (anotar el número y los guiones que indican la posición del doble enlace).
Nombra esta molécula.
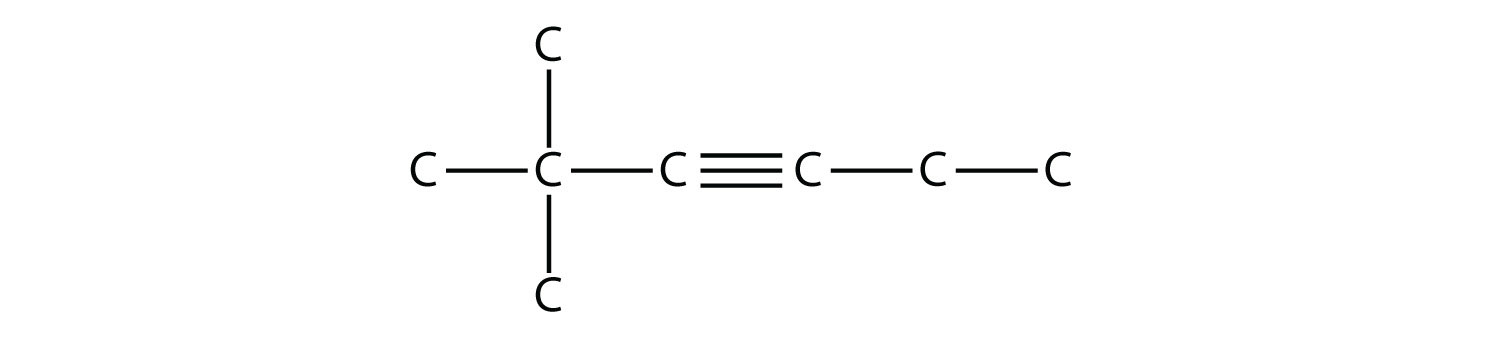
Solución
La cadena más larga que contiene el triple enlace C-C tiene seis átomos de C, por lo que esta es una molécula de hexino. El triple enlace comienza en el tercer átomo de C, por lo que este es un 3-hexino. Finalmente, hay dos grupos metilo en la cadena; para darles el menor número posible, numeramos la cadena desde el lado izquierdo, dando a los grupos metilo la segunda posición. Entonces el nombre de esta molécula es 2,2-dimetil-3-hexino.
Nombra esta molécula.
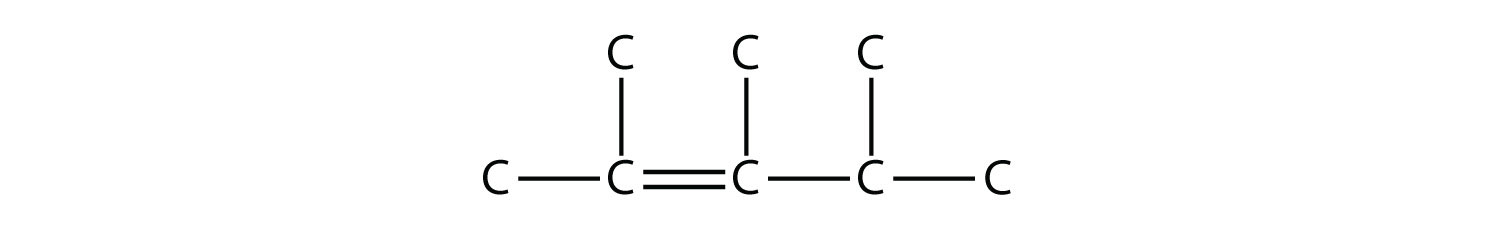
- Contestar
-
2,3,4-trimetil-2-penteno
Identificar la molécula como un alcano, un alqueno o un alquino.
Solución
1. La molécula tiene al menos un triple enlace carbono-carbono (C = C) por lo que es un alquino.
2. La molécula tiene un doble enlace carbono-carbono (C=C) por lo que es un alqueno.
3. La molécula solo tiene enlaces simples carbono-carbono por lo que es un alcano.
Identificar la molécula como un alcano, un alqueno o un alquino.
- Contestar
-
1. alcano, 2. alqueno, 3. alquino
Propiedades de Alquenos y Alquinos
El etileno (el nombre industrial común para el eteno) es una materia prima básica en la producción de polietileno y otros compuestos importantes. Más de 135 millones de toneladas de etileno se produjeron en todo el mundo en 2010 para su uso en las industrias de polímeros, petroquímicos y plásticos. El etileno se produce industrialmente en un proceso llamado craqueo, en el que las cadenas largas de hidrocarburos en una mezcla de petróleo se rompen en moléculas más pequeñas.
Los halógenos también pueden reaccionar con alquenos y alquinos, pero la reacción es diferente. En estos casos, el halógeno reacciona con el doble o triple enlace C-C y se inserta en cada átomo de C involucrado en los múltiples enlaces. Esta reacción se denomina reacción de adición. Un ejemplo es
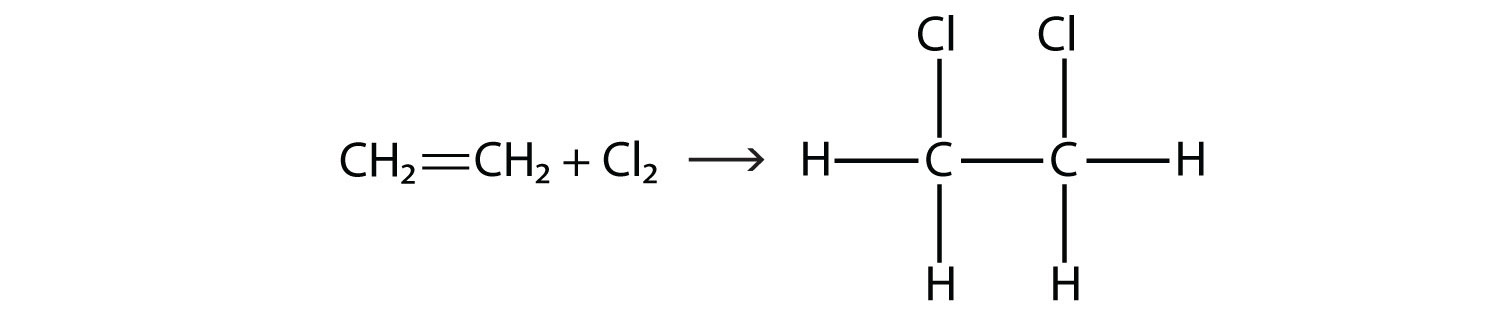
Las condiciones de reacción suelen ser suaves; en muchos casos, el halógeno reacciona espontáneamente con un alqueno o un alquino.
El hidrógeno también se puede agregar a través de un enlace múltiple; esta reacción se llama reacción de hidrogenación. En este caso, sin embargo, las condiciones de reacción pueden no ser suaves; pueden ser necesarias altas presiones de gas H2. Normalmente se emplea un catalizador de platino o paladio para conseguir que la reacción proceda a un ritmo razonable:
\[CH_{2}=CH_{2}+H_{2}\overset{metal\: catalyst}{\rightarrow} CH_{3}CH_{3} \nonumber \]
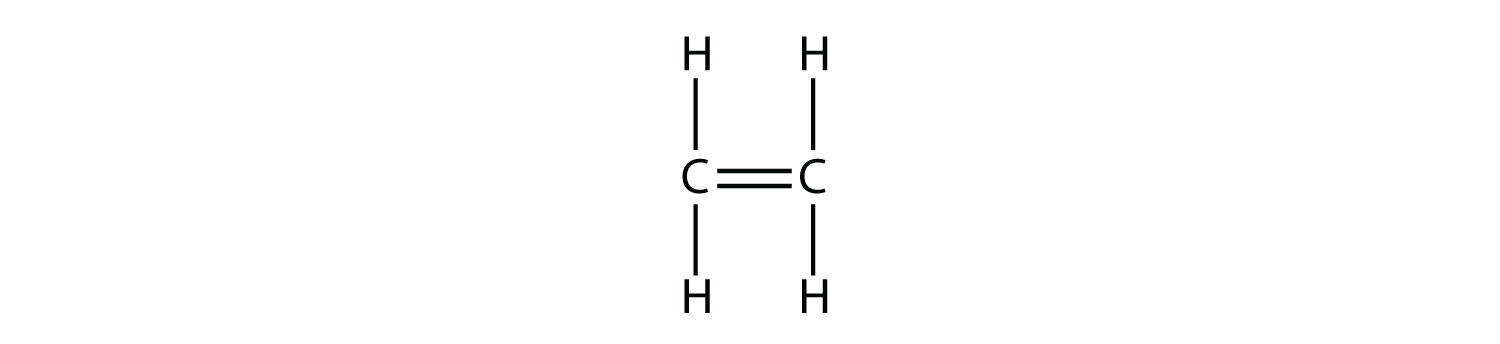
Isómeros geométricos (cis-trans) Isómeros
Con una molécula como el 2-buteno, se puede observar un tipo diferente de isomería llamado isomería geométrica. Los isómeros geométricos son isómeros en los que el orden de enlace de los átomos es el mismo pero la disposición de los átomos en el espacio es diferente. El doble enlace en un alqueno no es libre de rotar debido a la naturaleza del enlace pi. Por lo tanto, existen dos formas diferentes de construir la molécula de 2-buteno. La imagen de abajo muestra los dos isómeros geométricos, llamados cis -2-buteno y trans- 2-buteno.
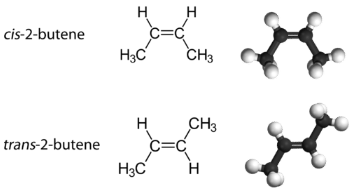
El isómero cis tiene los dos átomos de hidrógeno individuales en el mismo lado de la molécula, mientras que el isómero trans los tiene en lados opuestos de la molécula. En ambas moléculas, el orden de unión de los átomos es el mismo. Para que los isómeros geométricos existan, debe haber una estructura rígida en la molécula para evitar la libre rotación alrededor de un enlace. Si el doble enlace en un alqueno fuera capaz de rotar, los dos isómeros geométricos anteriores no existirían. Además, los dos átomos de carbono deben tener cada uno dos grupos diferentes unidos para que haya isómeros geométricos. El propeno no tiene isómeros geométricos porque uno de los átomos de carbono tiene dos hidrógenos individuales unidos a él.
Las propiedades físicas y químicas de los isómeros geométricos son generalmente diferentes. Mientras que el cis-2-buteno es una molécula polar, el trans--2-buteno es no polar. El calor o la irradiación con luz se puede utilizar para lograr la conversión de un isómero geométrico a otro. La entrada de energía debe ser lo suficientemente grande como para romper el enlace pi entre los dos átomos de carbono, que es más débil que el enlace sigma. En ese punto, el ahora enlace sencillo es libre de rotar y los isómeros pueden interconvertir.
Al igual que con los alquenos, los alquinos muestran isomería estructural comenzando con 1-butina y 2-butina. Sin embargo, no hay isómeros geométricos con alquinos porque solo hay otro grupo unido a los átomos de carbono que están involucrados en el triple enlace.
Resumen
- Los alcanos simples existen como una serie homóloga, en la que los miembros adyacentes difieren en una unidad CH 2.
- Las fórmulas químicas condensadas muestran los átomos de hidrógeno (u otros átomos o grupos) justo al lado de los átomos de carbono a los que están unidos.
- Las fórmulas de ángulo de línea implican un átomo de carbono en las esquinas y extremos de las líneas. Se entiende que cada átomo de carbono está unido a suficientes átomos de hidrógeno para dar a cada átomo de carbono cuatro enlaces.
- Los alcanos tienen tanto nombres comunes como nombres sistemáticos, especificados por la IUPAC.
- Se dan nombres y estructuras de hidrocarburos cíclicos típicos.
- Se definen isómeros estructurales y geométricos.
- Se dan ejemplos de isómeros de alcano y alqueno.
Colaboradores y Atribuciones
- OpenSTAX
- TextMap: Beginning Chemistry (Ball et al.)
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Henry Agnew (UC Davis)