9.11: Reducción de Alquenos - Hidrogenación Catalítica
- Page ID
- 75939
Objetivo de aprendizaje
- reconocer reacciones orgánicas de oxidación y reducción
- predecir los productos/especificar los reactivos para la hidrogenación (reducción) de alquenos
Introducción
La adición de hidrógeno a un doble enlace carbono-carbono para formar un alcano es una reacción de reducción que también se llama hidrogenación catalítica. La hidrogenación de un doble enlace es una reacción termodinámicamente favorable porque forma un producto más estable (menor energía). En otras palabras, la energía del producto es menor que la energía del reactivo; así es exotérmica (se libera calor). El calor liberado se llama calor de hidrogenación, que es un indicador de la estabilidad de una molécula. La regioselectividad no es un problema porque el mismo grupo (un átomo de hidrógeno) está unido a cada uno de los carbonos vinílicos. La fuente más simple de dos átomos de hidrógeno es el hidrógeno molecular (H 2), pero mezclar alquenos con hidrógeno no resulta en ninguna reacción discernible. Aunque la reacción de hidrogenación global es exotérmica, una alta energía de activación impide que se produzca en condiciones normales. Esta restricción puede ser eludida por el uso de un catalizador, como se muestra en las reacciones a continuación.
La visión O-chem de la oxidación y la reducción
Para la química inorgánica, el flujo de electrones se cuenta fácilmente con el cambio en los números de oxidación de los metales y no metales. Las expresiones “LEO dice GER” para “La pérdida de electrones es oxidación y la ganancia de electrones es reducción” o “RIG DE ACEITE” para “La oxidación es pérdida y reducción es ganancia” pueden ser guías útiles para reconocer reacciones de oxidación y reducción para la química inorgánica. Sin embargo, para la química orgánica, la mayoría de los reactivos y productos son neutros por lo que el flujo de electrones es más difícil de rastrear. Para los compuestos orgánicos, las reacciones de oxidación y reducción pueden reconocerse al menos de tres formas diferentes.
1) La oxidación es un aumento en el número de enlaces carbono a oxígeno o una disminución en el número de enlaces carbono a hidrógeno.
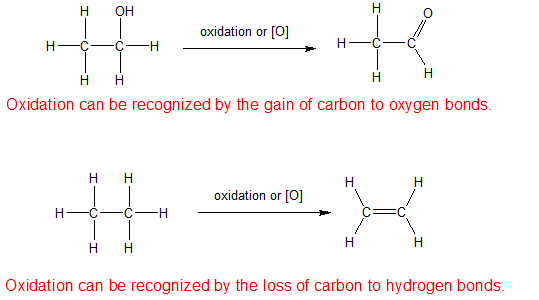
2) La reducción es lo opuesto a la oxidación por lo que es una disminución en el número de enlaces carbono a oxígeno o un aumento en el número de enlaces carbono a hidrógeno.
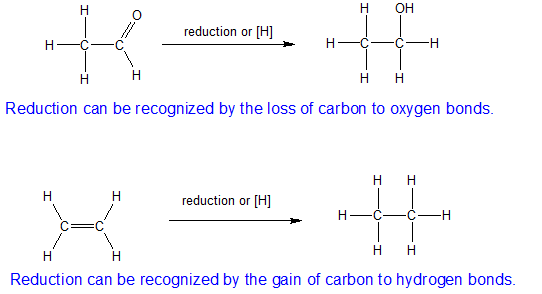
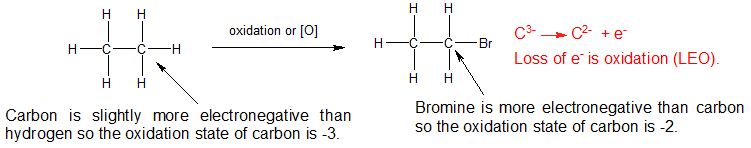
3) Para reacciones que no impliquen un cambio en la unión del carbono con el oxígeno y el hidrógeno, entonces necesitamos mirar las diferencias en la electronegatividad. Los electrones compartidos se asignan al elemento más electronegativo para determinar los números de oxidación.
El Catalizador
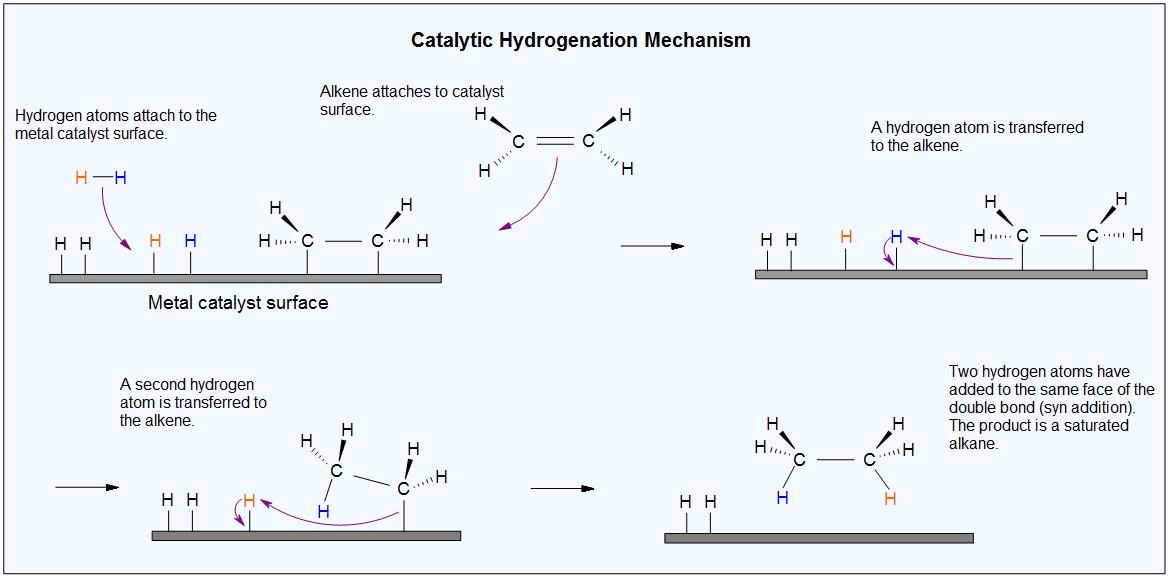
La reacción entre hidrógeno (H 2) gas y un alqueno (un doble enlace carbono-carbono) requiere un catalizador metálico activo. Un catalizador aumenta la velocidad de reacción al disminuir la energía de activación de la reacción. Aunque el catalizador no se consume en la reacción, se requiere acelerar la reacción lo suficiente para que se observe en una cantidad de tiempo razonable. Los catalizadores comúnmente utilizados en la hidrogenación de alquenos son: platino, paladio y níquel. El catalizador metálico actúa como superficie sobre la que tiene lugar la reacción. Esto aumenta la tasa al poner los reactivos muy cerca unos de otros, facilitando las interacciones entre ellos. Con este catalizador presente, el enlace sigma de H 2 se rompe, y los dos átomos de hidrógeno en su lugar se unen al metal (ver #2 en la figura siguiente). El\(\pi\) enlace del alqueno se debilita ya que también interactúa con el metal como se muestra en el paso #3 del diagrama a continuación.
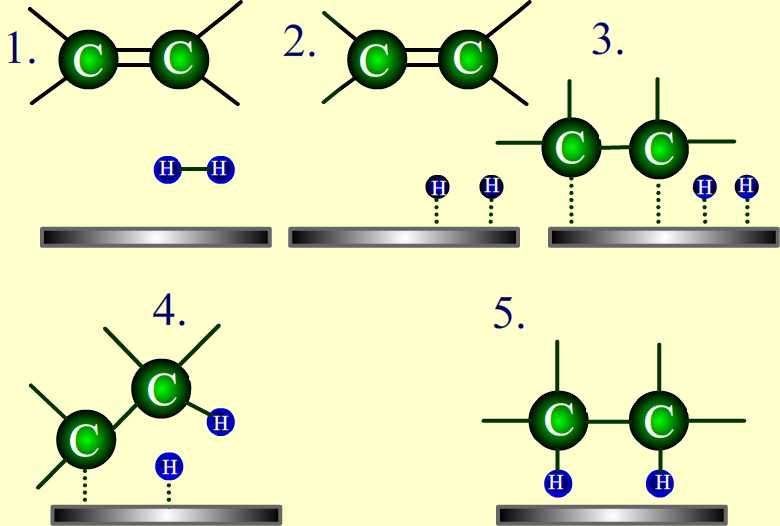
Dado que ambos reactivos están unidos al catalizador metálico, los átomos de hidrógeno se pueden añadir fácilmente, uno a la vez, a los carbonos previamente dobles enlazados como se muestra en las etapas #4 y #5 anteriores. La posición de ambos reactivos unidos al catalizador hace que los átomos de hidrógeno estén expuestos solo a un lado del alqueno. Esto explica por qué los átomos de hidrógeno se suman al mismo lado de la molécula, llamado syn-adición.
Estabilidad de alquenos e hidrogenación catalítica
Como se muestra en el diagrama de energía de reacción a continuación, la hidrogenación de alquenos es exotérmica, y se libera calor correspondiente al ΔE (color verde).
Este calor de reacción se puede utilizar para evaluar la estabilidad termodinámica de alquenos que tienen diferentes números de sustituyentes alquilo en el doble enlace. Por ejemplo, en la siguiente tabla se enumeran los calores de hidrogenación para tres alquenos C 5 H 10 que dan el mismo producto alcano (2-metilbutano). Dado que un gran calor de reacción indica un reactivo de alta energía, estos calores son inversamente proporcionales a las estabilidades de los isómeros alquenos. A una aproximación aproximada, vemos que cada sustituyente alquilo en un doble enlace estabiliza este grupo funcional en un poco más de 1 kcal/mol.
| Isómero alqueno | (CH 3) 2 CHCH=CH 2 3-metil-1-buteno |
CH 2 =C (CH 3) CH 2 CH 3 2-metil-1-buteno |
(CH 3) 2 C=CHCH 3 2-metil-2-buteno |
|---|---|---|---|
| Calor de Reacción (ΔHº) |
—30.3 kcal/mol | —28.5 kcal/mol | —26.9 kcal/mol |
Estereoquímica de la hidrogenación catalítica
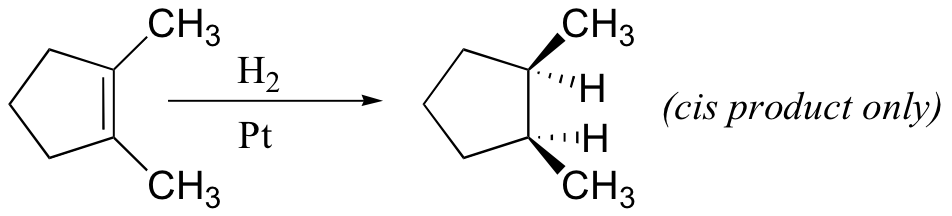
A partir del mecanismo que se muestra a continuación, se espera que la adición de hidrógeno ocurra con sin-estereoselectividad ya que ambos reactivos se acercan al mismo lado de la superficie del catalizador.
Por ejemplo, el 1,2-dimetilciclopenteno se reduce a 1,2-dimetilciclopentano durante la hidrogenación catalítica.
Ejercicios
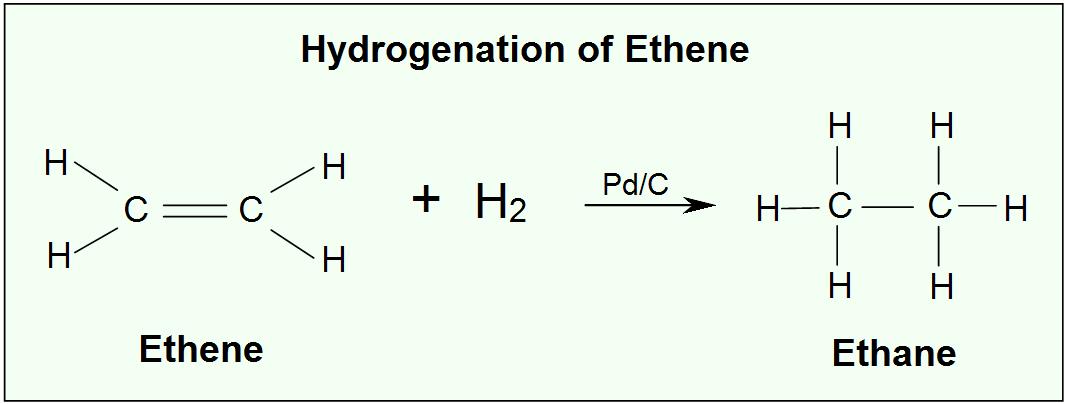
- Utilizar la hidrogenación catalítica de eteno con óxido de platino para responder a las siguientes preguntas.
- 0.500 mol de eteno reacciona con _______ mol de hidrógeno.
- El eteno está siendo _______; mientras que _______ está siendo oxidado.
- El número de oxidación del carbono en el eteno es _______; en etano es _______.
- Cuando 1.000 g de cierto triglicérido (grasa) se trata con gas hidrógeno en presencia del catalizador de Adams', se encuentra que el volumen de gas hidrógeno consumido a 99.8 kPa y 25.0°C es de 162 mL. Un experimento separado indica que la masa molar de la grasa es de 914 g mol −1. ¿Cuántos dobles enlaces carbono-carbono contiene el compuesto?
- El bromobuteno reacciona con gas hidrógeno en presencia de un catalizador de platino. ¿Cuál es el nombre del producto?
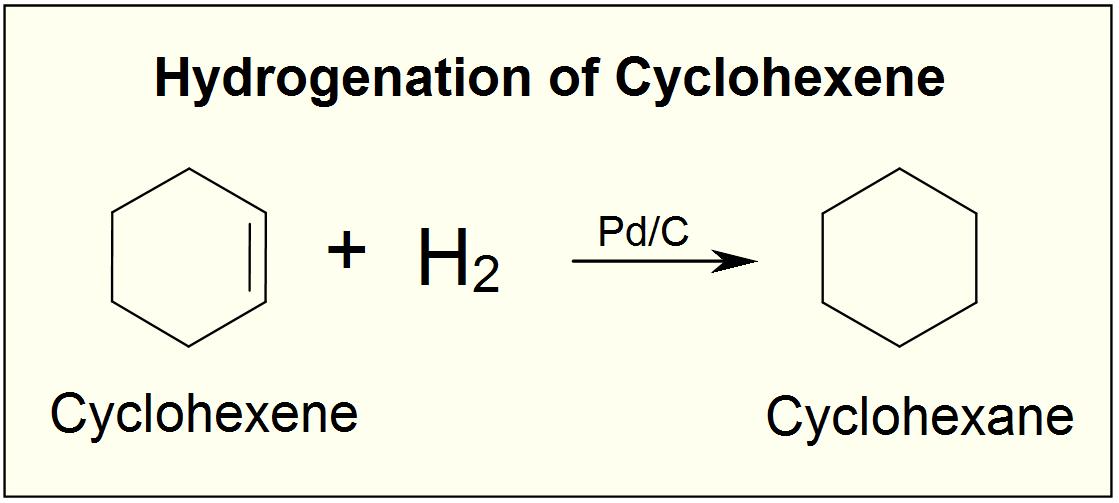
- El ciclohexeno reacciona con gas hidrógeno en presencia de un catalizador de paladio. ¿Cuál es el nombre del producto?
- ¿Cuál es la estereoquímica de una reacción de hidrogenación de alquenos?
- Al mirar sus calores de hidrogenación, ¿es generalmente más estable el isómero cis o trans?
- El 2-cloro-4-etil-3metilciclohexeno reacciona con gas hidrógeno en presencia de un catalizador de platino. ¿Cuál es el nombre del producto?
- Predecir los productos si los siguientes alquenos reaccionaron con hidrógeno catalítico.

Responder
-
1. a. 0.500 mol de gas hidrógeno
b. Se está reduciendo el eteno; mientras que el hidrógeno está siendo oxidado.
c. El número de oxidación del carbono en el eteno es −2; en etano es −3.
2. Cantidad de hidrógeno consumido
Cantidad de grasa utilizada
Relación de moles de hidrógeno consumidos a moles de grasa
Así, la grasa contiene seis dobles enlaces carbono-carbono por molécula.
3. Bromobutano
4. Ciclohexano
5. Syn-adición
6. Trans
7. 2-cloro-4-etil-3metilciclohexano
8.

9.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
Organic Chemistry With a Biological Emphasis by Tim Soderberg (University of Minnesota, Morris)