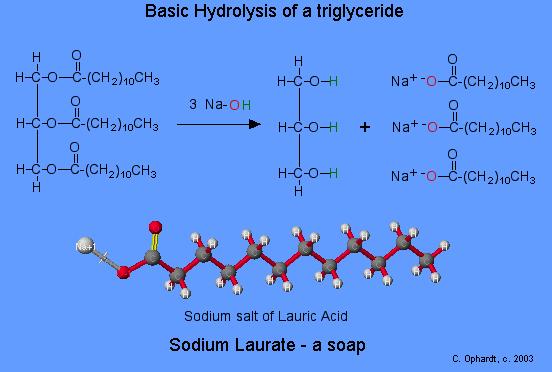
22.6: Química de Éster
- Page ID
- 76514
Introducción
Los ésteres se sintetizan fácilmente y abundan de forma natural. Los ésteres son frecuentemente la fuente de sabores y aromas en muchas frutas y flores.
Los ésteres también constituyen la mayor parte de las grasas animales y aceites vegetales, los glicéridos (ésteres de ácidos grasos de glicerol). El jabón es producido por una reacción de saponificación (hidrólisis básica) de una grasa o aceite.
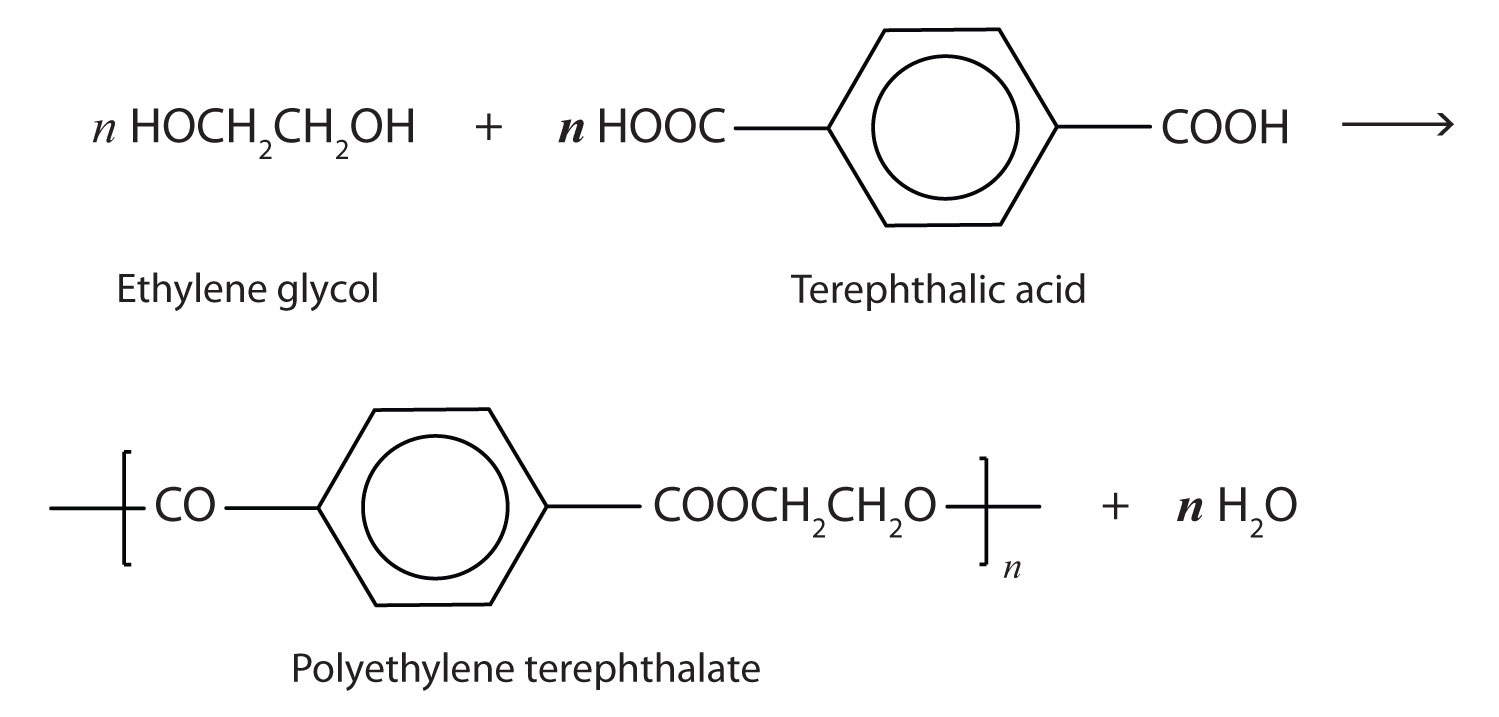
Los ésteres también están presentes en una serie de moléculas biológicas importantes y tienen varias aplicaciones comerciales y sintéticas. Por ejemplo, las moléculas de poliéster hacen excelentes fibras y se utilizan en muchas telas. Un tubo de poliéster tejido, que es biológicamente inerte, se puede utilizar en cirugía para reparar o reemplazar secciones enfermas de vasos sanguíneos. El PET se utiliza para hacer botellas para refrescos y otras bebidas. También se conforma en películas llamadas Mylar. Cuando se recubre magnéticamente, la cinta Mylar se utiliza en casetes de audio y video. Las arterias sintéticas pueden estar hechas de PET, politetrafluoroetileno y otros polímeros.
El poliéster más importante, el tereftalato de polietileno (PET), está hecho de monómeros de ácido tereftálico y etilenglicol:
Síntesis de Ésteres
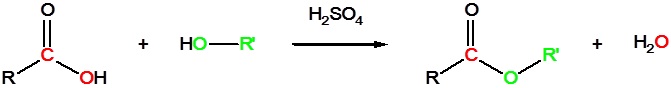
Los ácidos carboxílicos pueden reaccionar con alcoholes para formar ésteres en presencia de un catalizador ácido como se muestra en la reacción a continuación.
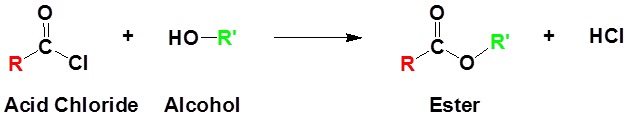
Los cloruros de ácido reaccionan con alcoholes para formar ésteres como se muestra en la reacción a continuación.
Los anhidridos de acido también reaccionan con alcoholes para formar esteres como se muestra en la reaccion a continuación.
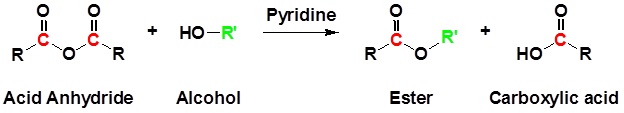
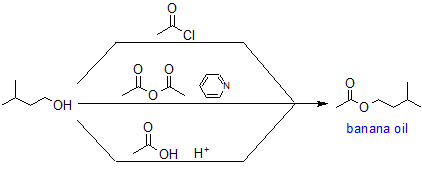
Como ejemplo, la síntesis de aceite de plátano (acetato de isoamilo) es un ejemplo de estas dos reacciones.
Ejemplo: Síntesis de ésteres
Los ésteres también se pueden sintetizar a partir de reacciones de transesterificación. La transesterificación se discute en la siguiente sección sobre Reactividad de Ésteres
Reactividad de Ésteres
Los ésteres pueden hidrolizarse a ácidos carboxílicos en condiciones ácidas o básicas. La hidrólisis básica se puede utilizar para convertir grasas y aceites en jabón y se llama reacción de saponificación. Los ésteres se pueden convertir en amidas a través de una reacción de aminólisis. Los ésteres pueden experimentar reacciones de transesterificación para formar diferentes ésteres aplicando el principio de LeChatlier a esta reacción de equilibrio. Los ésteres se pueden reducir para formar alcoholes o aldehídos dependiendo del agente reductor. Los ésteres también reaccionan con compuestos organometálicos para formar alcoholes terciarios. A continuación se muestra el mapa de reacción para los ésteres.
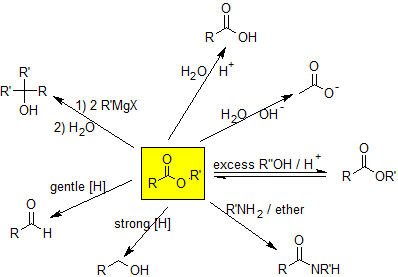
Hidrólisis Ester
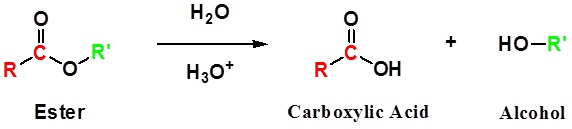
La hidrólisis de ésteres requiere un catalizador ácido o promoción de bases para que ocurra. Los ésteres son menos reactivos que los haluros de acilo y los anhidridos de ácido porque el grupo alcóxido es un grupo lábil pobre con su carga negativa completamente localizada en un solo átomo de oxígeno.
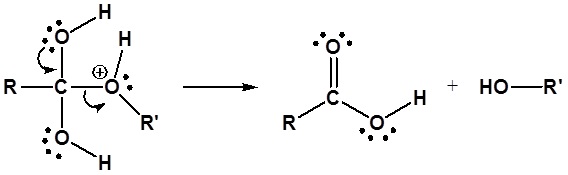
Hidrólisis de éster - Catalizado por ácido
Los ésteres se pueden dividir de nuevo en un ácido carboxílico y un alcohol por reacción con agua y una cantidad catalítica de ácido como se muestra en la reacción a continuación.
La hidrólisis catalizada por ácido del benzoato de etilo se muestra a continuación como ejemplo.
Ejemplo: Hidrólisis de éster catalizada por ácido
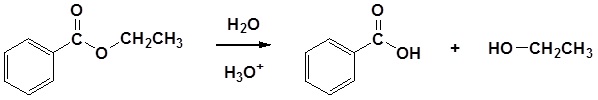
El mecanismo para la reacción de hidrólisis catalizada por ácido comienza con la protonación del oxígeno carbonílico para aumentar la reactividad del éster. El agua nucleofílica reacciona con el átomo de carbono carbonílico electrófilo para formar el intermedio tetraédrico. Las reacciones de transferencia de protones ocurren para crear un buen grupo de salida cuando el carbonilo se reforma. A continuación se muestra el mecanismo completo.
1) Protonación del Carbonil
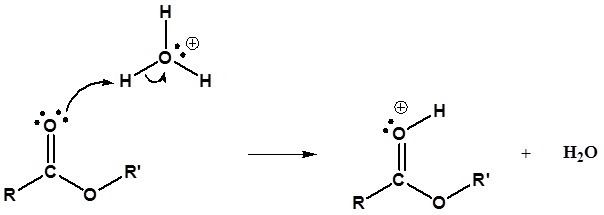
2) Reacción nucleofílica por agua
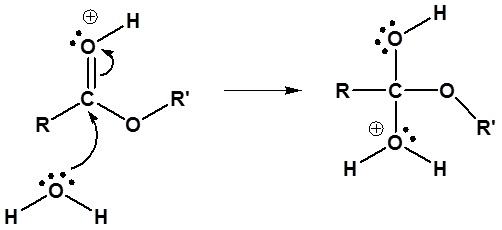
3) Transferencia de protones
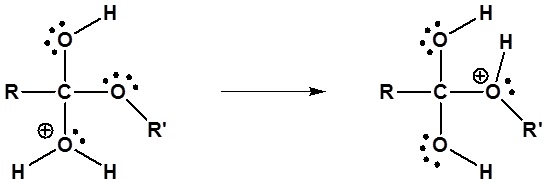
4) Dejando la eliminación del grupo
Hidrólisis Ester - Base promovida
Los ésteres se pueden dividir de nuevo en un ácido carboxílico y un alcohol por reacción con agua y una base. La reacción se llama saponificación del latín sapo que significa jabón. El nombre viene del hecho de que el jabón solía mí hecho por la hidrólisis éster de las grasas. Debido a las condiciones básicas, se hace un ion carboxilato en lugar de un ácido carboxílico. Los iones hidróxido se consumen en la reacción por lo que se describe como “promovida por base”.
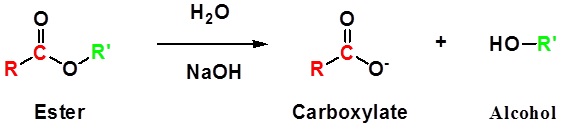

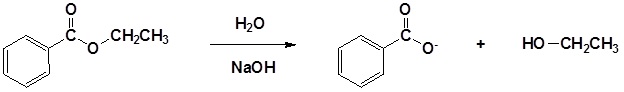
La hidrólisis promovida por base del benzoato de etilo se muestra a continuación como ejemplo.
Ejemplo: Hidrólisis promovida por base de ésteres
El mecanismo para la reacción de hidrólisis promovida por bases comienza con el hidróxido nucleófilo reaccionando con el átomo de carbono carbonílico electrófilo para formar el intermedio tetraédrico. Las reformas de carbonilo con la pérdida del grupo lábil alcóxido. A continuación, el alcóxido desprotonata el ácido carboxílico resultante. A continuación se muestra el mecanismo completo.
1) Reacción nucleofílica por hidróxido
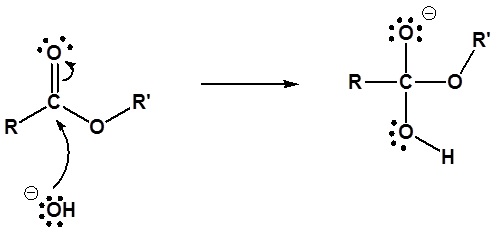
2) Dejando la eliminación del grupo
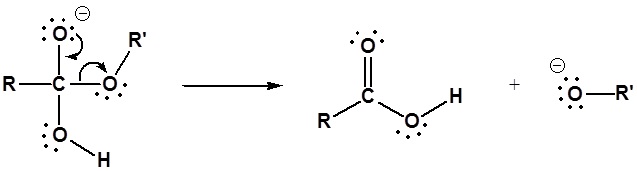
3) Desprotonación
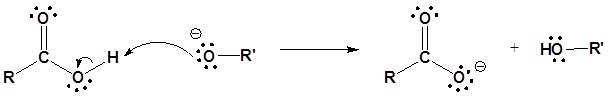
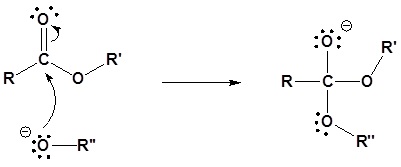
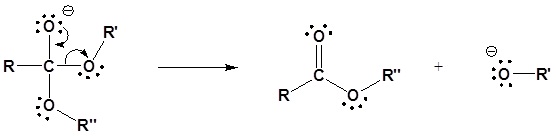
Reacciones de sustitución de acilo nuclefílico de ésteres
Los derivados de ácido carboxílico se pueden sintetizar a partir de ésteres mediante el mecanismo de sustitución de acilo nucleofílico previamente discutido.
Síntesis de Éster: Trans-Esterificación
La transesterificación es la conversión de un éster de ácido carboxílico en un éster de ácido carboxílico diferente. Cuando un éster se coloca en un gran exceso de un alcohol junto con la presencia de un ácido o una base puede haber un intercambio de grupos alcoxi. El gran exceso de alcohol se utiliza para impulsar la reacción hacia adelante. El método más común de transesterificación es la reacción del éster con un alcohol en presencia de un catalizador ácido como se muestra a continuación.
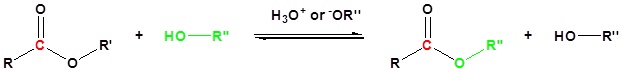
La transesterificación de acetato de etilo a acetato de metilo y benzoato de metilo a benzoato de etilo se muestran a continuación como ejemplos.
Ejemplo: Reacciones de transesterificación
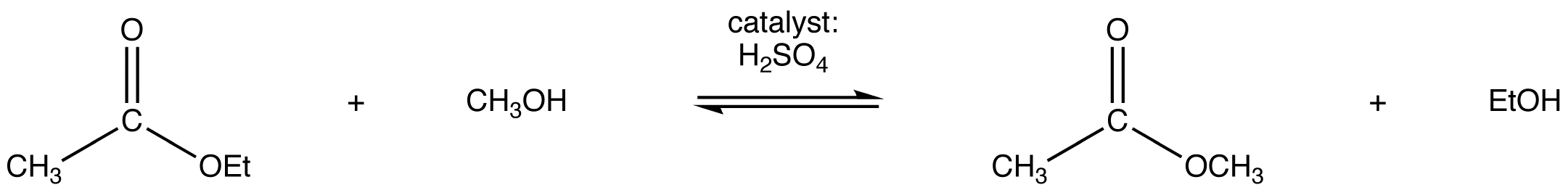
En condiciones ácidas, el mecanismo de reacción comienza con la protonación del oxígeno carbonílico lo que aumenta la reactividad del éster. Un alcohol luego reacciona con éster protonado para formar el intermedio tetraédrico. Después de varias transferencias de protones, el carbonilo se reforma para producir un nuevo éster. A continuación se muestra el mecanismo completo para la transesterificación de etil actetae a acetato de metilo.
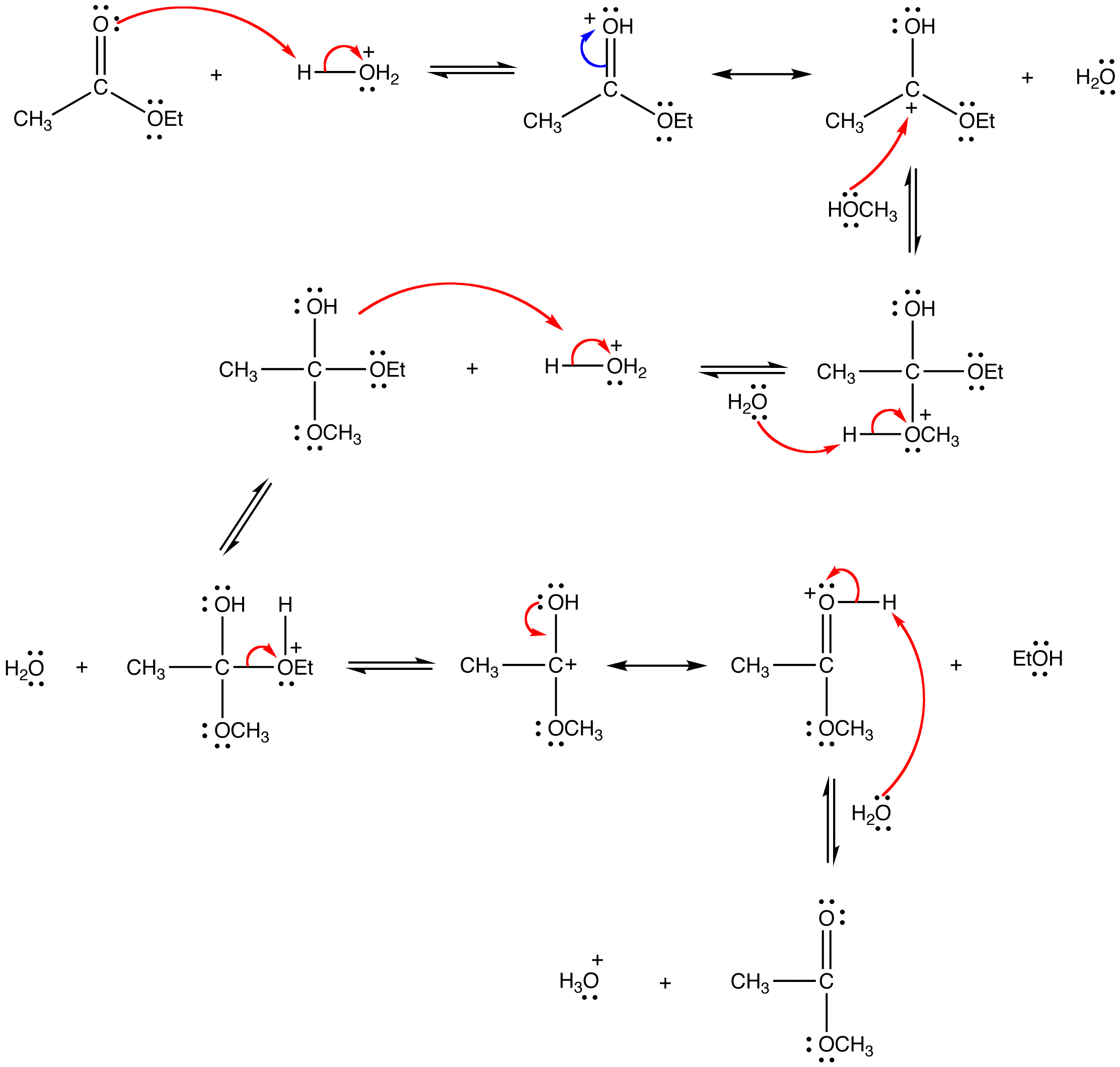
Dado que tanto los reactivos como los productos son un éster y un alcohol, la reacción es reversible y la constante de equilibrio es cercana a una. En consecuencia, el principio de Le Chatelier tiene que ser explotado para impulsar la reacción a su finalización. La forma más sencilla de hacerlo es usar el alcohol como disolvente también.
En condiciones básicas, el mecanismo comienza con la reacción nucleofílica del alcóxido con el carbono carbonilo para producir el intermedio tetraédrico. El carbonilo se reforma con la pérdida del grupo lábil para producir un nuevo éster.
1) Reacción nucleofílica por un alcóxido
2) Dejando la eliminación del grupo
Aminólisis: Conversión de Ésteres en Amidas
Los ésteres reaccionan con amoníaco y 1 o 2 o alquil aminas para producir amidas en una reacción llamada aminólisis.
La aminólisis del benzoato de etilo se muestra a continuación como ejemplo. El mecanismo para esta reacción es análogo a la reacción de hidrólisis promovida por base de los ésteres mostrada anteriormente.
Ejemplo: Aminólisis de Ésteres
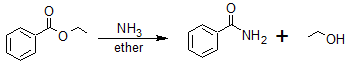
Reacciones de reducción de éster
Reducción de Éster a 1 o Alcohol
Los ésteres se pueden convertir a 1 o alcoholes usando LiAlH 4, mientras que el borohidruro de sodio (NaBH 4) no es un agente reductor lo suficientemente fuerte como para realizar esta reacción.
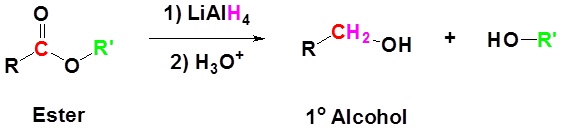
La reducción del benzoato de etilo a alcohol bencílico y etanol se muestra como ejemplo.
Ejemplo: Reducción de éster a un alcohol de 1 o
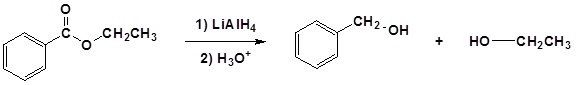
El mecanismo comienza con un nucleófilo hidruro que reacciona con el carbono éster carbonilo para formar el intermedio tetraédrico. El carbonilo se reforma para producir un aldehído con la pérdida del ion alcóxido. El aldehído resultante se somete a una reacción posterior con un nucleófilo hidruro para formar otro intermedio tetraédrico. El carbonilo no es capaz de reformarse, porque no hay grupos de salida estables. Por lo tanto, el alcóxido (intermedio tetraédrico) es protonado para producir un alcohol primario. A continuación se muestra el mecanismo completo.
1) Reacción nucleofílica por el hidruro
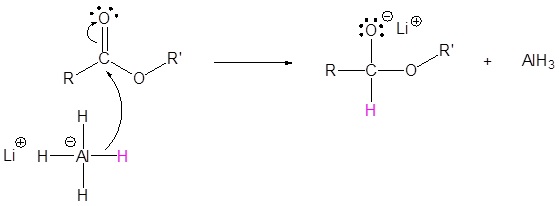
2) Dejando la eliminación del grupo
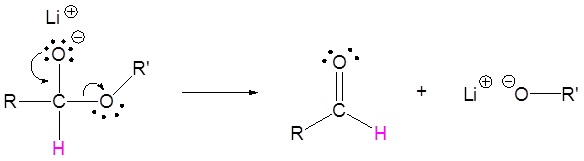
3) Reacción nucleopílica por el anión hidruro
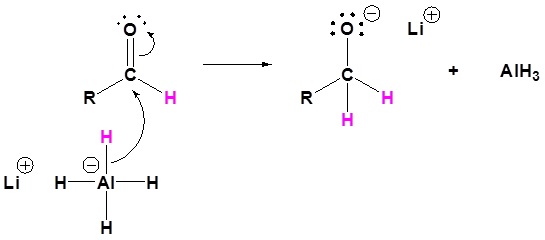
4) El alcóxido está protonado
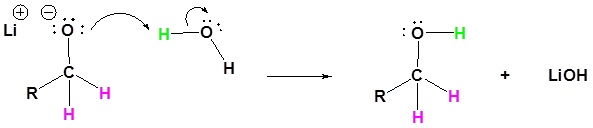
Reducción de Éster a Aldehído
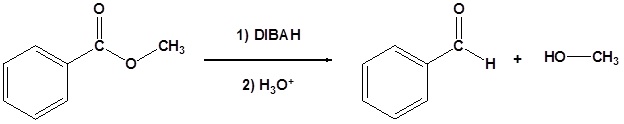
Los ésteres se pueden convertir en aldehídos usando hidruro de diisobutilaluminio (DIBAH). La reacción generalmente se lleva a cabo a -78 o C para evitar la reacción con el producto aldehído.
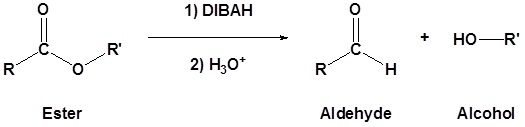
La reducción del benzoato de metilo para formar benzaldehído se muestra como ejemplo. El mecanismo es análogo al mecanismo LiAlH 4 mostrado anteriormente con la importante diferencia de que la reacción se detiene después de que se produce el aldehído debido a que el agente reductor DIBAH no es lo suficientemente fuerte como para reducir el aldehído a bajas temperaturas.
Ejemplo: Reducción de éster a un aldehído
Reacciones de éster con compuestos organometálicos
Reactivos Grignard
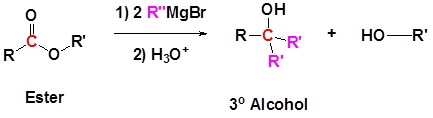
Los ésteres reaccionan con reactivos de Grignard para formar alcoholes terciarios. Esta reacción es análoga a la reacción discutida para cloruros de ácido con reactivos de Grignard. El primer equivalente del reactivo de Grignard produce una cetona que reacciona con el segundo equivalente del reactivo de Grignard para producir un alcohol terciario. En efecto, el reactivo de Grignard se suma dos veces como se muestra en la reacción a continuación.
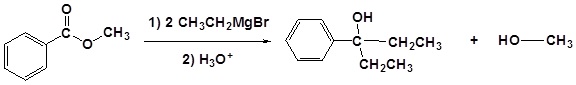
La reacción del benzoato de metilo con un reactivo de Grignard para producir 3-fenil-3-pentanol.
Ejemplo: Reacción de éster con un reactivo de Grignard
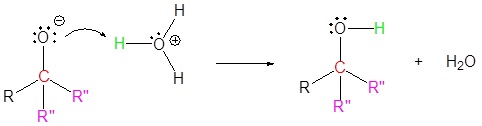
El mecanismo comienza con un nucleófilo de carburo del reactivo de Grignard que reacciona con el carbono éster carbonilo para formar el intermedio tetraédrico. El carbonilo se reforma para producir una cetona con la pérdida del ion alcóxido. La cetona resultante se somete a una reacción posterior con un nucleófilo de carburo del reactivo de Grignard para formar otro intermedio tetraédrico. El carbonilo no es capaz de reformarse, porque no hay grupos de salida estables. Por lo tanto, el alcóxido (intermedio tetraédrico) es protonado para producir un alcohol terciario. A continuación se muestra el mecanismo completo.
1) Reacción nucleofílica
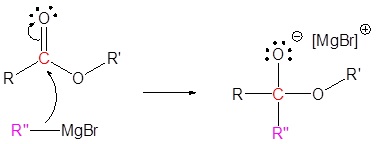
2) Dejando la eliminación del grupo
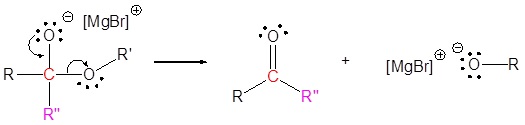
3) Reacción nucleofílica
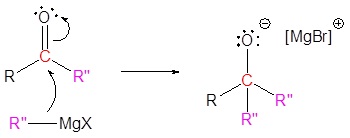
4) Protonación
Ejercicio
8. ¿Por qué la hidrólisis alcalina de un éster no es un proceso reversible? ¿Por qué la reacción con un ión hidróxido y un ácido carboxílico no produce un éster?
9. Extraer el producto de la reacción entre la siguiente molécula y LiAlH 4, y el producto de la reacción entre la siguiente molécula y DIBAL.

10. Preparar las siguientes moléculas a partir de ésteres y Grignards?
(a)
b)
c)
- Contestar
-
8. La reacción entre un ácido carboxílico y un ion hidróxido es una reacción ácido-base, que produce agua y un anión carboxilato.
9.

10.
(a)

b)

c)

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
- Charles Ophardt, Professor Emeritus, Elmhurst College; Virtual Chembook
- Gamini Gunawardena from the OChemPal site (Utah Valley University)