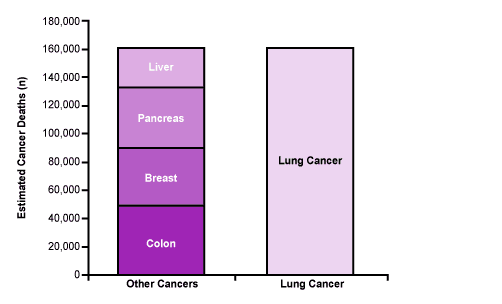
El cáncer de pulmón es uno de los principales problemas de salud pública a nivel mundial con aproximadamente unos 222,500 casos nuevos cada año, siendo la principal causa de muerte por cáncer en Estados Unidos de América, donde es el responsable de unas 155,870 muertes al año, superando incluso las muertes causadas por los cánceres de mama, colón, páncreas e hígado combinados (Figuras 1 y 2).
Figura 1: Estadísticas de cáncer EEUU 2017.

Figura 2: Muertes estimadas por tipo de cáncer (2016).
La mayoría de los casos nuevos (55%) son detectados en etapas avanzadas de la enfermedad (Estadio IIIB-IV) y el 40% se detectan en estadio IV (metastásico), sólo un 15% llegan en estadio localizado, el 22% con diseminación regional y un 7% permanece sin estadificar, aunque esta última proporción es probablemente más alta en nuestro medio.
La tasa de supervivencia general a 5 años es aproximadamente 21%, pero la enfermedad avanzada con metástasis a distancia sigue siendo incurable con una supervivencia de 4.7% a 5 años.
El tabaquismo sigue siendo el responsable en el 85 al 90% de los casos cáncer de pulmón (9 de cada 10 casos) y los cánceres de pulmón en nunca fumadores (menos de 100 cigarrillos en toda la vida) son principalmente adenocarcinomas que afectan desproporcionalmente a mujeres que a hombres.
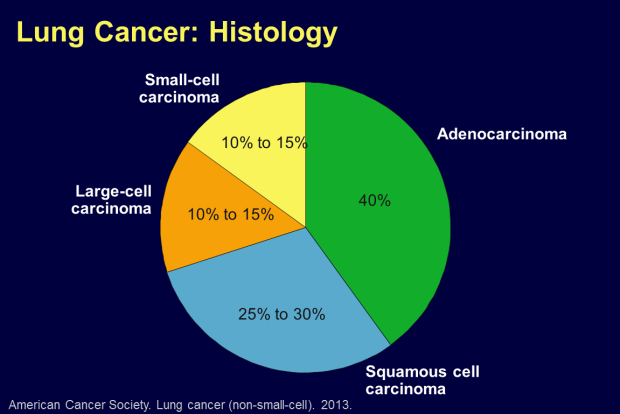
El cáncer pulmonar de células no pequeñas (CPCNP), el tipo histológico más frecuente de cáncer de pulmón, representa el 85% de todos los casos nuevos detectados cada año (Figura 3 y 4), el tratamiento actual adecuado se basa en la identificación de su histología (escamosa vs no escamosa) así como marcadores moleculares, principalmente mutaciones expresadas por los tumores no escamosos que los hacen vulnerables a quimioterapéuticos específicos; y es que a diferencia de años anteriores (1970-2009) cuando por mucho tiempo el tratamiento del CPCNP se centraba en quimioterapia a base de platino y en las que aún con los fármacos de tercera generación se alcanzaban supervivencias no mayores de 10 meses, actualmente se dispone de efectivas terapias moleculares dirigidas a esos blancos, principalmente orales, con pocos efectos adversos comparado con la quimioterapia tradicional citotóxica y aunque no son una cura, logran prolongar la supervivencia general (hasta 30 meses) y libre de progresión (hasta 85% al año) y la calidad de vida en el CPCNP avanzado (Estadio IIIB-IV).
Figura 3: Clasificación actual del cáncer de pulmón. Modificado de la de OMS (2004) por IASLC/ATS/ERS (2011).
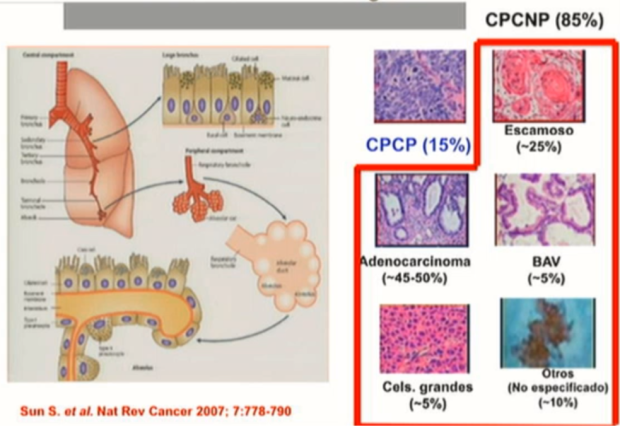
Figura 4: Distribución de la Histologia en CPCNP
No todos los CPCNP expresan estas mutaciones (aproximadamente el 60% al menos una) y como es difícil predecirlo, la Sociedad Americana de Oncología Clínica recomienda las pruebas de alteraciones moleculares para EGFR, KRAS, reordenamientos ALK , reordenamientos ROS1 y niveles de expresión PD-L1 en adenocarcinomas en estadios avanzados, por lo que todos los pacientes con CPCNP deben tener suficientes especímenes de biopsia del tumor primario o metastásico para buscar estas anomalías genéticas mediante estudio molecular. El escrutinio para KRAS resulta más económico así que debería ser el primero, si esta positivo se puede obviar la búsqueda de EGFR, pues como ya dijimos son mutuamente excluyentes y se determinaría resistencia a TKI. No se preocupen que la lista seguirá creciendo sin duda alguna, y con ello el costo de tratar a estos pacientes (ahora sí, preocupémonos)
El receptor del factor epidérmico de crecimiento (EGFR) pertenece a la familia de receptores de tirosin-cinasa (a la cual también pertenecen ERB-2(HER2), ERB3 Y ERB 4), el cual exhibe una sobreexpresión o una activación aberrante y traduce la avidez del tumor por los oncogenes y sus señalizaciones para su supervivencia, está presente en el 15% de los CPCNP en EEUU, pero hasta en el 31.2% en poblaciones latinas (México). El EGFR es más prevalente en mujeres, etnia asiática, adenocarcinomas y nunca fumadores. Se han desarrollado contra él moléculas que inhiben la actividad de la tirosin-cinasa intracelular ligada a este receptor, los inhibidores de tirosin-cinasa (TKI) como erlotinib (Tarceva), gefitinib (Iressa) o afatinib (Gilotrif) y más recientemente icotinib (por el momento aprobado sólo en China). Poco tiempo después se describió resistencia a los TKI al parecer relacionada a la presencia de otras mutaciones mutuamente excluyentes (KRAS o la amplificación de MET). Hoy en día hay disponibles pruebas séricas o de orina incluso, además se dispone de una prueba especial para detectar resistencia a los TKI (EGFR T790M) y hasta se cuenta con una alternativa para estos casos resistentes (osimertinib).
Los reordenamientos en el gen de la Cinasa del linfoma anaplásico (ALK) sólo se encuentran en el 4% de los CPCNP en forma de translocación EML4-ALK, dicha fusión codifica para una proteína asociada a microtúbulos y tiene un dominio de tirosin cinasa (la ALK), que permiten señalización permanente mitogénica y transformación maligna, es excluyente con EGFR, ocurre predominantemente en jóvenes, adenocarcinomas y en nunca fumadores o fumadores leves y los tumores con esta fusión exhiben una respuesta terapéutica dramática a la terapia dirigida contra ALK, Inhibidores de ALK, como crizotinib (Xalkori) y ceritinib (Zykadia).
Las mutaciones de la familia RAS se presentan en el 20% de los CP (aproximadamente 16% en México), principalmente en los adenocarcinomas y el 90% de los casos se localizan en el KRAS. La activación de esta mutación que codifican para GTPasas involucradas en la señalización del receptor de factor epidérmico de crecimiento y por lo tanto cruciales en la proliferación celular y la supervivencia, haciendo que los tumores mutantes para KRAS sean independientes de la señalización dependiente de EGFR y por lo tanto resistentes a sus TKI. La mutación KRAS es mutuamente exclusiva con EGFR y principalmente se observa en adenocarcinomas de fumadores.
Muchos pacientes con CPCNP tendrán otras mutaciones para las cuales ya se han desarrollado terapias blanco, algunas en proceso de aprobarse o se usan como segunda línea en pacientes que no han respondido al tratamiento establecido:
ROS 1: Para algunos pacientes con esta mutación está recomendado crizotinib en vez de la quimioterapia tradicional.
BRAF V600: Para estos pacientes, los inhibidores de BRAF como vemurafenib o dabrafenib (ya aprobados para melanoma) pueden ser terapias alternativas.
RET: Los inhibidores de RET como cabozantinib o vandetanib (aprobados para cáncer de tiroides) son en veces utilizados en sustitución de quimioterapia de segunda línea.
HER2: Los pacientes con esta particular mutación se podrían beneficiar del uso de afatinib o trastuzumab (utilizado en el tratamiento del cáncer de mama), agregado a la quimioterapia.
Inmunoterapia en CPCNP:
La inmunoterapia también se ha convertido en una herramienta poderosa en algunos CPCNP avanzados, aproximadamente un 25% de estos pacientes tienen tumores que expresan altos niveles del ligando de muerte programada (PD-L1), mutación que los hace vulnerables al anticuerpo monoclonal pembrolizumab (Keytruda). En un enorme estudio aleatoriado de pacientes con CPCNP avanzado en los que almenos la mitad de los tumores expresaron PD-L1, pembrolizumab se asoció con una mejor sobrevida con pocos efectos adversos serios comparada con la quimioterapia tradicional basada en platino.
Bevacizumab (Avastin) es otro anticuerpo monoclonal humanizado que se une y bloquea al factor de crecimiento vascular endotelial (VEGF), y que se usa en combinacion de la quimioterapia tradicional en pacientes elegibles desde hace algunos años en adenocarcinomas y otros tumores no escamosos en los que mejora la sobrevida.
En conclusión, el uso de terapia blanco e inmunoterapia en el CPCNP avanzado se asocia con altas tasas de respuesta (60-80% vs 20-30%), respuesta terapéutica más rápidas (2 meses vs 6 meses), mejor calidad de vida, mejor supervivencia libre de progresión (10-13 meses vs 5-6 meses) y mayor supervivencia en general, comparada con la quimioterapia tradicional citotóxica. Por lo tanto, en virtud que nuestros pacientes sean beneficiados con esas bondades que esta innovación ofrece, nuestro estándar de tratamiento debe basarse en la histología del tumor y el estatus mutacional más completo posible ( EGFR, ALK , ROS1 y niveles de expresión de PD-L1 ) para determinar la respuesta al tratamiento, eso implica más y mejores biopsias.
Bibliografia:
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017. CA Cancer J Clin. 2017;67:7-30
- American Cancer Society. Cancer facts and fi gures 2017. Available at: http://www.cancer.org/research/cancerfactsstatistics/ cancer-facts-and-fi gures-2017. Accessed January 17, 2017.
- Sun S, Schiller JH, Gazdar AF. Lung cancer in never smokers—a different disease. Nat Rev Cancer. 2007;7:778-790. 6. Subramanian J, Govindan R. Lung cancer in never smokers: a review. J Clin Oncol. 2007;25:561-570.
- US Food and Drug Administration. Cobas EGFR mutation test v2. Available at: http://www.fda.gov/Drugs/InformationOnDrugs/ ApprovedDrugs/ucm504540.htmhttp://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm504540.htm. Accessed January 17, 2017.
- Sacher AG, Paweletz C, Dahlberg SE, et al. Prospective validation of rapid plasma genotyping for the detection of EGFR and KRAS mutations in advanced lung cancer. JAMA Oncol. 2016;2:1014-1022.
- Leora Horn, MD, MSc, FRCPC Metastatic Non-Small-Cell Lung Cancer
Release Date:December 02, 2016, en https://www.clinicaloptions.com/Oncology/Treatment%20Updates/inPractice%20Oncology/Modules/Metastatic_NSCLC/Pages/Page%202.aspx
- Consultation Checklist for Patients With Advanced NSCLC en file:///C:/Users/clinica103/Downloads/CCO_Expert_Insights_in_NSCLC_Worksheet.pdf