E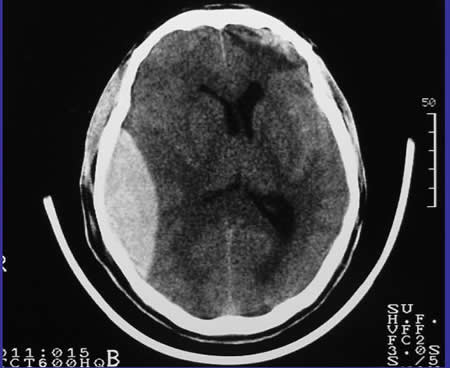 s una hemorragia venosa o arterial que se situa entre el cráneo y la duramadre, complicación que puede ocurrir después de traumatismos craneoencefálicos (TCE) aparentemente banales.
s una hemorragia venosa o arterial que se situa entre el cráneo y la duramadre, complicación que puede ocurrir después de traumatismos craneoencefálicos (TCE) aparentemente banales.
Su identificación y evacuación quirúrgica precoz es muy importante ya que puede dar lugar de forma brusca, e incluso tras un intervalo lúcido variable, a una compresión cerebral y herniación.
Son lesiones neuroquirúrgicas de extrema gravedad y peligro de muerte (Luna y col., 1997).
Epidemiología
El conocimiento de la epidemiología del hematoma epidural traumático puede ayudar en el desarrollo de medidas de salud pública dirigidas a la prevención y la detección temprana de esta enfermedad en la población.
Ocurre en aproximadamente el 1% de todos los traumatismos craneoencefálicos (TCE) que ingresan y en el 22% de los casos con fractura de cráneo.
Es cuatro veces más frecuente en el sexo masculino.
De 2208 pacientes en el período 2001-2004, 89 pacientes tuvieron un hematoma epidural traumático (Cheung y col., 2007)
Aproximadamente la mitad que los hematomas subdurales agudos.
Ocurre generalmente en adultos jóvenes, y es raro antes de la edad de 2 años o después de los 60 (quizás porque la dura es más adherente a la tabla interna en estos grupos).
Más raro aún es la presentación en recién nacido que se da con mayor frecuencia en madres nulíparas (Heyman y col., 2005).
Localización
La localización más frecuente es a nivel temporal 60% con epicentro sobre pterion.
La localización frontal, parietal, occipital y fosa posterior se produce en 5-10% de los casos cada uno de ellos.
Los de fosa posterior pueden presentarse desde signos y síntomas leves que pueden progresar hacia un deterioro rápido hasta la muerte súbita ya que el volumen de la fosa posterior es limitado.
El hematoma epidural bilateral de la fosa posterior se ha descrito hasta 1997 en nueve casos (Gelabert y col., 197).
La presencia de un trauma importante a nivel de la protuberancia occipital debe alertar de que se produzca (Prusty y col., 1995; Khwaja y col., 2001).
En un 30 % de los casos, se evidencia una hidrocefalia obstructiva (Roka, y col., 2008).
Se ha descrito la parálisis bilateral del sexto par como presentación (Johnston y Choudhari. 2003).
En una serie de 19 casos, el intervalo lúcido estuvo presente en ocho (42,10%) casos. En la mitad de los casos, la evolución clínica fue aguda.
La rigidez de nuca y somnolencia fueron los signos clínicos más comunes.
La fractura del hueso occipital, se presentó en 57,89%.
Las lesiones asociadas intracraneales estaban presentes en siete (36,84%) de estos casos.
Dos (11,1%) de estos pacientes murieron a pesar de una cirugía de emergencia.
La Escala de Coma de Glasgow antes de la operación y la presencia de lesiones asociadas supratentoriales fueron importantes factores pronósticos (Mahajan y col., 1993).
Datos epidemiológicos de Sao Paulo-Brasil
Se presenta con mayor frecuencia en los hombres, en la cuarta década de la vida y está más relacionado con las caídas. A su ingreso, una gran parte presentaba un GCS de 13 a 15 y la afectación de la región parietal en la mayoría de los casos (Araujo y col., 2012).
Benin-Nigeria
En 61 pacientes con TAC a causa de accidentes de tráfico, entre 2002-2004 se detectó un hematoma epidural en 5 (8,2%).Más del 80% de los hematomas subdurales y epidurales se asociaron con fracturas de cráneo (Eze y col., 2011).
Clasificación
Traumático
Espontáneo
Raro pero puede ocurrir en la presencia de las malformaciones vasculares durales, coagulopatías, tumores hemorrágicos.
También se han descrito en el lupus sistémico, la cirugía abierta del corazón, hemodialisis y sinusitis (Spennato y col., 2011).
Postoperatorios
A su vez se pueden distinguir dos subtipos:
1.- Hematomas de > 40 cc
2.- Menos de 40 cc. con un cuadro clínico de inicio insidioso y diferentes características radiológicas en comparación con el traumático y los hematomas espontáneos (Pichierri y col., 2012).
Los hematomas epidurales postoperatorios alejados del campo operatorio algunas veces son vistos como una complicación tras drenaje ventricular, derivación ventrículo-peritoneal o craneotomía suboccipital. El mecanismo de formación a distancia de la craniotomía en la fase postoperatoria no está clara (Paiva 2010).
Según la edad
Hematoma epidural del recien nacido
Hematoma epidural en niños
Hematoma epidural en adultos
Etiopatogenia
La hemorragia entre la tabla interna del cráneo y la duramadre se origina con mayor frecuencia por un desgarro de la arteria meníngea mediao una de sus ramas (85% ), esto es por causa, en su mayoría, a una fractura del hueso temporal, aceleración angular de la cabeza, disminución o aumento súbito de cualquiera de los diámetros craneales.
La hemorragia despega la duramadre de la superficie interna del hueso y produce un hematoma que puede aumentar de tamaño y comprimir el cerebro subyacente.
El hematoma epidural también puede deberse a conductos venosos óseos rotos en el punto de fractura o laceración de los senos venosos mayores de la duramadre.
Como la presión venosa es baja, los hematomas epidurales venosos sólo suelen formarse cuando una fractura deprimida del cráneo ha despegado la duramadre del hueso y dejado un espacio en el que se puede formar un hematoma.
Clínica
La pérdida breve de conciencia seguida de un intervalo lúcido (que dura desde unos cuantos minutos hasta horas) con posterior pérdida de conciencia , hemiparesia y dilatación de la pupila ipsilateral se presenta con una frecuencia de < 10 a 27 %.
El 60 % no presentan pérdida de conciencia inicial. Este tipo de hematoma es más frecuente en adultos jóvenes y puede desarrollarse en ausencia de fractura de cráneo, especialmente en niños e individuos jóvenes, pues en estos el cráneo es más elástico que en los adultos.
Otros síntomas y signos serían los siguientes:
Midriasis del lado del hematoma (60 % de los casos) por compresión del tercer par craneal (signo de compresión de la región superior del meséncefalo, que pueden consistir en hemiparesia o rigidez descerebración y por último datos de afección del tallo encefálico y muerte). Al final se desarrolla una hernia transtentorial.
Tumefacción en piel cabelluda de región temporo-parietal. Otorrea homolateral al sitio del hematoma Cefalea unilateral de las lesiones
Alteraciones sensitivas, hemihipoestesia, afasia hemianopsia homónima.
Posturas especiales, giro de cabeza, desviación conjugada de mirada hacia el lado de lesión.
Ataque de convulsiones generalizadas
Signos de parálisis del tercer par craneal, ptosis palpebral, midriasis y estrabismo divergente.
Los hematomas epidurales pueden clasificarse según la aparición de hipertensión endocraneana:
1. Agudo: Cuando la hipertensión endocraneana es en las primeras 48 horas post trauma.(lo más frecuente)
2. Subagudo: cuando los signos aparecen entre el segundo día y una semana postrauma.
3. Crónico: Los signos son visibles después de una semana; en ocasiones puede haber afectación del tercer y sexto par craneal dando parálisis completa del ojo afectado.
Se puede agravar con un aumento agudo de presión endocraneana, los signos en este caso serían los siguientes:
Respiración irregular Bradicardia Hipertensión ocasional
La hemiparesia ipsilateral se puede producir por compresión del pedúnculo cerebral opuesto en la incisura tentorial (fenómeno de Kernohan o de incisura tentorial). Kernohan y Woltman lo describieron en 1929. Clínicamente se traduce por una focalidad ipsilateral, y en apariencia incongruente, a la lesión original. Esta lesión anatomopatológica, denominada Hendidura de Kernohan (Kernohan’s notch) debido a su apariencia de muesca o surco, está bien documentada mediante RM en un trabajo de J. Giménez-Pando en la revista Neurocirugia 2004 Aug;15(4):384-7, concluyendo que ante un paciente con focalidad neurológica ipsilateral a una lesión expansiva supratentorial en el cual la TC no explique la clínica, una RM podría demostrar lesión del pedúnculo cerebral contralateral.
Diagnóstico
En la RX de cráneo no se muestra la fractura en el 40 % de los casos.
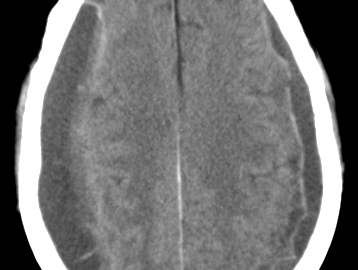
TAC cerebral y craneal
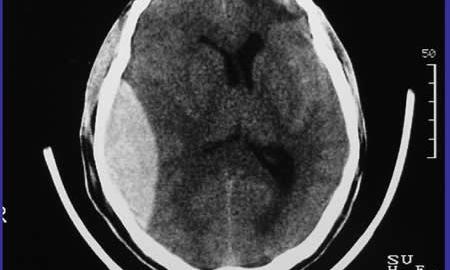
La lesión es biconvexa de alta densidad entre el cráneo y la masa encefálica, en el 84% de casos. En el 11% convexo y luego de distribución recta y en el 5 % se asemeja al hematoma subdural.
Es generalmente uniforme en su densidad, bordes definidos, contiguo con la tabla interna. En raras ocasiones el hematoma epidural es isodenso y solamente se visualiza tras la inyección de contraste (3).
Si se han identificado fracturas craneales aunque el TAC cerebral sea normal, la presión intracraneal (PIC) sea normal se realizará TAC de control en los días siguientes para descartar un hematoma epidural tardío y por supuesto un TAC inmediato ante cualquier deterioro clínico-neurológico (5).
Diagnóstico Diferencial
Incluye una presentación posttraumática descrita por Denny-Brown consistente en un intervalo lúcido; seguido de bradicardia y vómitos. Teoría: una forma de síncope vagal, pero que debe ser diferenciada del hematoma epidural.
Tratamiento
Craniotomía con evacuación de hemorragia y control del vaso sangrante y anclaje dural.
Indicación quirúrgica.-
1. Paciente con síntomas focales o de presión intracraneal elevada 2. Asintomáticos mayores de 1cm. de anchura. 3. En edad pediátrica mayor agresividad en la indicación quirúrgica 4. Todos los de fosa posterior
Tratamiento conservador.-
En los casos de hematomas subagudos o crónicos sin efecto masa y que el estado neurológico sea bueno. Pueden administrarse corticoides.
TAC inmediato en caso de deterioro. TAC de control en 1 semana. TAC de control en 1 a 3 meses para documentar la resolución del hematoma.
Pronóstico
El retraso en el diagnóstico y tratamiento están íntomamente relacionados con el aumento de la mortalidad y el mal resultado funcional (Pereira y col., 2005).
Mortalidad entre 20-55% en serie antiguas.
Con la rápidez en el diagnóstico y tratamiento se ha llegado a reducir hasta un 5-10%.
La falta de intervalo lúcido empeora el pronóstico.
El 20% de pacientes también tienen un hematoma subdural agudo en la autopsia o la intervención, con una mortalidad entre el 25-90%.
Casos Clínicos
1.-
Paciente de 26 años, sufre accidente de moto sin pérdida de conciencia.Desde entonces cefalea de predominio frontal. Exploración neurológica:Consciente , orientado y sin focalidad neurológica Exámenes complementarios:TAC cerebral pequeño hematoma epidural laminar occipital izquierdo.
Actitud conservadora.
2.-
Paciente de 18 años, sufre accidente de moto con pérdida de conciencia.Desde entonces comatosa Exámenes complementarios:TAC cerebral hematoma epidural frontotémporoparietal
En el TAC con ventana ósea se aprecia la fractura.
Indicación quirúrgica: Craneotomía – Evacuación.
3.-
Neonato que tras parto mediante fórceps presentaba en días siguientes hipotonía.
Para descartar afectación cerebral se solicitó una RM cerebral que mostraba un hematoma epidural subyacente al cefalohematoma parietal derecho.
Indicación quirúrgica: Craneotomía – Evacuación.
Bibliografía
Araujo, João Luiz Vitorino, Ulisses do Prado Aguiar, Alexandre Bossi Todeschini, Nelson Saade, and José Carlos Esteves Veiga. 2012. “Epidemiological Analysis of 210 Cases of Surgically Treated Traumatic Extradural Hematoma.” Revista Do Colegio Brasileiro De Cirurgioes 39 (4) (August): 268–271.
Cheung, Phoebe S Y, Jenny M Y Lam, Janice H H Yeung, Colin A Graham, y Timothy H Rainer. 2007. «Outcome of traumatic extradural haematoma in Hong Kong». Injury 38 (1) (Enero): 76-80. doi:10.1016/j.injury.2006.08.059.
Eze, K C, and F O Mazeli. 2011. “Computed Tomography of Patients with Head Trauma Following Road Traffic Accident in Benin City, Nigeria.” West African Journal of Medicine 30 (6) (December): 404–407.
Gelabert, M, A Prieto, y A G Allut. 1997. «Acute bilateral extradural haematoma of the posterior cranial fossa». British Journal of Neurosurgery 11 (6) (Diciembre): 573-575.
Heyman R, Heckly A, Magagi J, Pladys P, Hamlat A: Intracranial epidural hematoma in newborn infants: clinical study of 15 cases. Neurosurgery 57:924-929; discussion 924-929, 2005.
Johnston, N J, y K A Choudhari. 2003. «Bilateral sixth nerve palsy: a rare presentation of postoperative posterior fossa extradural haematoma». British Journal of Neurosurgery 17 (3) (Junio): 272-273.
Khwaja, H A, y P J Hormbrey. 2001. «Posterior cranial fossa venous extradural haematoma: an uncommon form of intracranial injury». Emergency Medicine Journal: EMJ 18 (6) (Noviembre): 496-497.
Luna F, Falndez Zbinden B, Morales M, Holzer Maestri F, Martinez C. Hematoma extradural: revisión de 100 casos operados. Rev chil neuro-psiquiatr. 1997;35(2):229-32
Mahajan, R K, B S Sharma, V K Khosla, M K Tewari, S N Mathuriya, A Pathak, y V K Kak. 1993. «Posterior fossa extradural haematoma–experience of nineteen cases». Annals of the Academy of Medicine, Singapore 22 (3 Suppl) (Mayo): 410-413.
Paiva, Wellingson Silva, Arthur Maynart Pereira Oliveira, Almir Ferreira de Andrade, Roger Schmidt Brock, y Manoel Jacobsen Teixeira. 2010. Remote postoperative epidural hematoma after subdural hygroma drainage. Case Reports in Medicine 2010: 417895. doi:10.1155/2010/417895.
Pereira CU, Santos EAS, Cavalcante S, Serra MV, Pascotto D, Fontora EAF. Hematoma extradural intracraniano. J bras neurocir. 2005;16(1):25-34.
Pichierri, Angelo, Andrea Ruggeri, Pasquale Donnarumma, and Roberto Delfini. 2012. “Postoperative Extradural Hematomas.” Journal of Neurological Surgery. Part A, Central European Neurosurgery (November 8). doi:10.1055/s-0032-1326939.
Prusty, G K, y A Mohanty. 1995. «Posterior fossa extradural haematoma». Journal of the Indian Medical Association 93 (7) (Julio): 255-258, 254.
Roka, Y B, P Kumar, P Bista, G R Sharma, y P Adhikari. 2008. «Traumatic posterior fossa extradural haematoma». JNMA; Journal of the Nepal Medical Association 47 (172) (Diciembre): 174-178.
Spennato, P. et al., 2011. Spontaneous intracranial extradural haematoma associated with frontal sinusitis and orbital involvement. Neurological Sciences: Official Journal of the Italian Neurological Society and of the Italian Society of Clinical Neurophysiology. Available at:http://www.ncbi.nlm.nih.gov/pubmed/21904864
1. Agrawal D, Cochrane DD: Traumatic retroclival epidural hematoma-a pediatric entity? Childs Nerv Syst, 2006.
3. Mendonca R, Lima TT, Dini LI, Krebs CL: Bilateral isodense epidural hematoma: case report. Arq Neuropsiquiatr 63:862-863, 2005.
4. Paterakis KN, Karantanas AH, Hadjigeorgiou GM, Anagnostopoulos V, Karavelis A: Retroclival epidural hematoma secondary to a longitudinal clivus fracture. Clin Neurol Neurosurg 108:67-72, 2005.
5. Radulovic D, Janosevic V, Rakic M, Durovic B, Slavik E, Lakicevic N: [Delayed epidural hematoma after mild head injury]. Vojnosanit Pregl 62:679-682, 2005.




 Entidad clínica descrita en 1965 por Hakim y Adams. Fué descrito originalmente en Colombia en la tesis de grado No.957 de la Universidad Javeriana de Bogotá (marzo de 1964), que fue elaborada bajo la dirección y asesoría del neurocirujano colombiano Salomón Hakim Dow, quien a la sazón prestaba sus servicios en el Hospital Militar Central de Bogotá. La autora – Olga de Heredia- fue compañera de estudios del editor de Tensiómetro Virtual. La tesis llevó el título de Algunas observaciones sobre la presión del LCR. Síndrome hidrocefálico en el adulto, con presión normal del líquido céfalo-raquídeo. Posteriormente el doctor Hakim –junto al neurocirujano Raymond Adams (profesor de la Universidad de Harvard), hizo al año siguiente una publicación indexada del estudio en la revista Journal of Neurological Sciences. De allí salió la famosa Válvula (programada) de Hakim, a la que este profesor ha dedicado su vida, perfeccionándola constantemente.
Entidad clínica descrita en 1965 por Hakim y Adams. Fué descrito originalmente en Colombia en la tesis de grado No.957 de la Universidad Javeriana de Bogotá (marzo de 1964), que fue elaborada bajo la dirección y asesoría del neurocirujano colombiano Salomón Hakim Dow, quien a la sazón prestaba sus servicios en el Hospital Militar Central de Bogotá. La autora – Olga de Heredia- fue compañera de estudios del editor de Tensiómetro Virtual. La tesis llevó el título de Algunas observaciones sobre la presión del LCR. Síndrome hidrocefálico en el adulto, con presión normal del líquido céfalo-raquídeo. Posteriormente el doctor Hakim –junto al neurocirujano Raymond Adams (profesor de la Universidad de Harvard), hizo al año siguiente una publicación indexada del estudio en la revista Journal of Neurological Sciences. De allí salió la famosa Válvula (programada) de Hakim, a la que este profesor ha dedicado su vida, perfeccionándola constantemente.
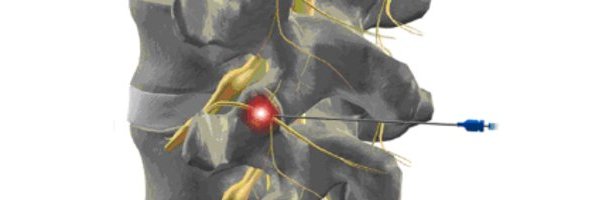
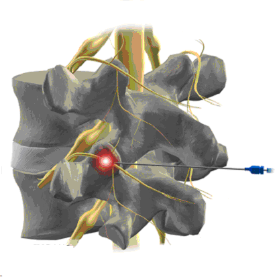 El síndrome facetario se puede definir de forma muy general como, dolor o disfunción proveniente principalmente de las articulaciones facetarias (o articulaciones interapofisiarias) y tejidos blandos adyacentes.
El síndrome facetario se puede definir de forma muy general como, dolor o disfunción proveniente principalmente de las articulaciones facetarias (o articulaciones interapofisiarias) y tejidos blandos adyacentes.