Alcanos
Los alcanos son hidrocarburos formados únicamente por enlaces simples, tienen una formula molecular que satisface la expresión general CnH2n + 2; donde el valor de n solo puede ser un número entero positivo, lo que quiere decir que cada átomo de carbono ha completado su capacidad máxima de enlaces con átomos de hidrógeno, por ello también se les conoce como hidrocarburos saturados.
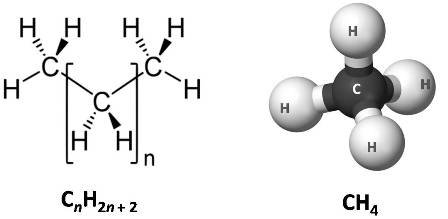
Estructura general de los alcanos. Por ejemplo el metano. Fuente: wikipedia.com, editadas por el autor.
Si tomamos como ejemplo la molécula más simple de los alcanos, el metano, notaremos que el único átomo de carbono que contiene forma cuatro enlaces simples con cada uno de los átomos de hidrógeno. Y en orden al incremento del número de átomos de carbono, junto al metano los primeros compuestos de esta familia son el etano (C2H6) y el propano (C3H8).
Nomenclatura
Como es de esperarse, las posibles combinaciones entre átomos de carbono e hidrógeno son enormes, por lo que la necesidad de dar un nombre único a cada molécula requiere la utilización de diferentes términos. Las normas de la IUPAC para asignar nombre a los alcanos no ramificados se basa en la cantidad de átomos de carbono que estos poseen, para ello se utiliza un prefijo correspondiente a esta cantidad y se le adiciona el sufijo –ano.
Para las primeras cuatro moléculas de esta familia los prefijos son: met, et, prop y but, según tengan uno, dos, tres o cuatro átomos de carbono. Así, los nombres de estos compuestos serían: metano (CH4), etano (CH3-CH3), propano (CH3-CH2-CH3) y butano (CH3-CH2-CH2-CH3). Para compuestos con un número mayor de átomos de carbono se utilizan los prefijos numéricos penta (5), hexa (6), hepta (7), octa (8), y así en lo sucesivo.
A los hidrocarburos lineales a partir de las cadenas que contienen cinco átomos de carbono se les acompaña del prefijo n- en la nomenclatura sistemática, así para el alcano lineal con cinco átomos de carbono su nombre sería n-pentano. Los alcanos no ramificados que difieren entre sí solo por la introducción sucesiva de grupos CH2 constituyen una serie homóloga.
En el caso que a un alcano pierda un átomo de hidrogeno, este se convierte en un sustituyente o un radical, y en el mismo se cambia la terminación –ano en el nombre por –ilo, de esta forma, cuando el metano pierde un hidrógeno, -CH3, se nombra como metilo, y los mismo ocurre con las demás moléculas. Si este radical se encuentra unido a una cadena lineal, constituyen en conjunto un hidrocarburo ramificado, y para nombrarlo se debe añadir un número que indique la posición del radical, es decir, a que átomo de carbono se encuentra unido en la cadena. Por ejemplo:
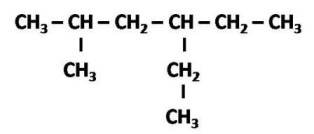
Para nombrar el compuesto la numeración se inicia contando los átomos de carbonos, comenzando desde el extremo de la cadena donde se encuentre el radical más cercano. De este modo el nombre del compuesto sería 2-metil, 4-etilhexano.
Propiedades
Puntos de ebullición y fusión
En los alcanos se presentan interaciones intermoleculares del tipo Van der Waals, y como se caracterizan por presentar enlaces simples, los puntos de ebullición y fusión están determinados principalmente por el peso de la molécula. En los hidrocarburos saturados las interacciones más fuertes se traducen en puntos de ebullición más altos, y el punto de fusión aumenta dependiendo no solo del tamaño de la molécula sino también de su capacidad de ajuste en el retículo cristalino.
La estructura del alcano también influye, un alcano lineal presenta mayor punto de ebullición que uno ramificado con el mismo peso molecular, esto debido al área de contacto, mientras mayor sea esta mayor será la interacción intermolecular con las moléculas vecinas.
Reactividad
Los alcanos muestran una reactividad bastante baja, comparados con los hidrocarburos insaturados que son más reactivos, frente a especies iónicas y otras de tipo polar. Al mismo tiempo, prácticamente no tienen interacción con sustancias ácidas y alcalinas.
Polaridad
Debido a que la molécula de los alcanos solo presenta enlaces covalentes, que unen dos átomos iguales o dos átomos que apenas difieren en electronegatividad, prácticamente son moléculas no polares. Además, de que sus enlaces son muy simetricos, lo que cancela cualquier polaridad débil que se presente.
Solubilidad
Debido a su escaza polarización, los alcanos tampoco establecen puentes de hidrogeno con otras moléculas polares, como el agua. Por lo que este tipo de compuesto son hidrofóbicos. Sin embargo, en disolventes no polares presentan una excelente solubilidad.
Fuente industrial
Como la mayoría de los compuestos orgánicos, la principal fuente de extracción de alcanos es el petróleo, junto con el gas natural. Otra fuente industrial importante es el carbón, por medio de procesos como la hidrogenación, se puede convertir en gas sintético.
El gas natural contiene los alcanos más volátiles, es decir, los de bajo peso molecular, está constituido principalmente de metano y cantidades progresivamente menores de otros gases como el etano y el propano y otros de cadena más larga.
Ejemplos y aplicaciones de algunos alcanos lineales
Combustibles
La energía de oxidación que liberan los hidrocarburos los hace ideales para su aplicación como combustibles. El propano y el butano son gases muy empleados como combustibles en el hogar, empleados para proveer calefacción y cocinar.

Propano y butano se usan como gas de cocina. Fuente: pxhere.com, licencia CC0.
Los alcanos de cadena más larga se encuentran en estado líquido a condiciones atmosféricas, y son muy empleados en la elaboración de combustibles líquidos como la gasolina; es el caso de n-octano, todos conocemos la clasificación de la gasolina según el octanaje, lo que hace referencia a la concentración de octano en la misma.

El octanaje de la gasolina depende de la concentración de octano. Fuente: torange.biz, licencia CC-BY 4.0
Lubricantes
Dada la viscosidad que adquieren los alcanos de cadenas más larga, mayor a 18 C, son muy utilizados en la elaboración de aceites lubricantes. Además, su propiedad hidrofóbica los hace repeler el agua, haciéndolos ideales para proteger las partes metálicas de las maquinarias. Los aceites de motor generalmente resultan de la mezcla de hidrocarburos de diferentes viscosidad, los que conocemos como multigrados, se suelen mezclar hidrocarburos de baja densidad, para que fluyan mejor cuando el motor esta frio, con hidrocarburos de viscosidad más alta para un mejor funcionamiento a la temperatura de operación del motor, minimizando así el desgaste entre las piezas móviles del motor.

Aceite de motor. Fuente: wikipedia.com, licencia CC BY-SA 3.0
Ceras
A los alcanos lineales también se les conoce con el nombre de parafinas. Las ceras de parafina son alcanos con cadenas de aproximadamente 25 a 30 átomos de carbonos, se encuentran en estado sólido con aspecto ceroso, blanco y con bajo punto de fusión, por lo que son la materia prima para la elaboración de velas. Los alcanos más pesados y en estado líquido se utilizan en la preparación de cera líquida, muy empleada en la industria de alimentos para lubricar moldes para hornear, también se aplica sobre frutas y otros productos que requieren de una capa protectora que a la vez les confieren un aspecto brillante.

Vela de parafina. Fuente: pixabay.com, dominio público.
Asfaltos
Los alcanos más pesados, de 40 átomos de carbono o más, que están presentes en el petróleo constituyen los asfaltos. Por su peso, estos compuestos tienen una consistencia más pastosa o semisólida, por lo que han conseguido una especial aplicación en la construcción de carreteras, ya que en caliente es muy manejable, y mezclado con grava, al enfriarse produce una mezcla solida especial para este uso.

Asfaltado de una calle. Fuente: pixnio.com, licencia CC0.

Referencias
Morrison y Boyd (1996). Química orgánica. Quinta edición.
Wikipedia.com. Alcano.
wikipedia.com. Parafina.
Diaz, R. (s.f). Usos y aplicaciones de los alcanos principales.
Posted from my blog with SteemPress : https://moronej.000webhostapp.com/2019/03/alcanos
¡Felicitaciones!
Te participamos que puedes invertir en el PROYECTO ENTROPÍA mediante tu delegación de Steem Power y así comenzar a recibir ganancias de forma semanal transferidas automáticamente a tu monedero todos los lunes. Entra aquí para más información sobre cómo invertir en ENTROPÍA.
Apoya al trail de @Entropia y así podrás ganar recompensas de curación de forma automática. Entra aquí para más información sobre nuestro trail.
Puedes consultar el reporte diario de curación visitando @entropia.
Atentamente
El equipo de curación del PROYECTO ENTROPÍA
Gracias equipo de @entropia!