查看更多
密码过期或已经不安全,请修改密码
修改密码
壹生身份认证协议书
同意
拒绝

同意
拒绝

同意
不同意并跳过






非酒精性脂肪性肝病(NAFLD)发病率逐年上升,我国NAFLD总体患病率为29.6%,且与肥胖率上升趋势平行[1]。NAFLD不仅与肝代谢障碍有关,更与脂肪组织代谢紊乱密切相关。近年来研究[2]证实,肝组织和脂肪组织以及肌肉组织之间存在器官因子的调节网络,其通过自分泌和旁分泌形式,参与体内代谢过程。肝脏和脂肪组织作为内分泌器官,其分泌的肝因子与脂肪因子在糖脂代谢、炎症反应等方面发挥重要作用。脂代谢紊乱是NAFLD发生过程中的重要环节,因此阐明肝因子和脂肪因子介导的脂代谢在NAFLD中的作用机制具有重要意义。
肝脏脂代谢过程包括脂质摄取与生产、输出与氧化,肝脂质含量受以下几个方面影响:(1)脂肪组织来源的游离脂肪酸(free fatty acid, FFA)向肝脏递送;(2)从饮食摄取;(3)肝内从头脂肪生成(de novo lipid synthesis, DNL);(4)脂质氧化和分泌,前三者为肝内脂质的主要来源,后者为肝内脂质的主要去路[3-5]。肝脏摄取与生产、输出与氧化之间相互协调,共同维持肝脏脂稳态,其中一个或多个平衡被打破均可导致肝脏脂肪变。因此维持肝脏脂代谢平衡是防治NAFLD的重要环节(图 1)。
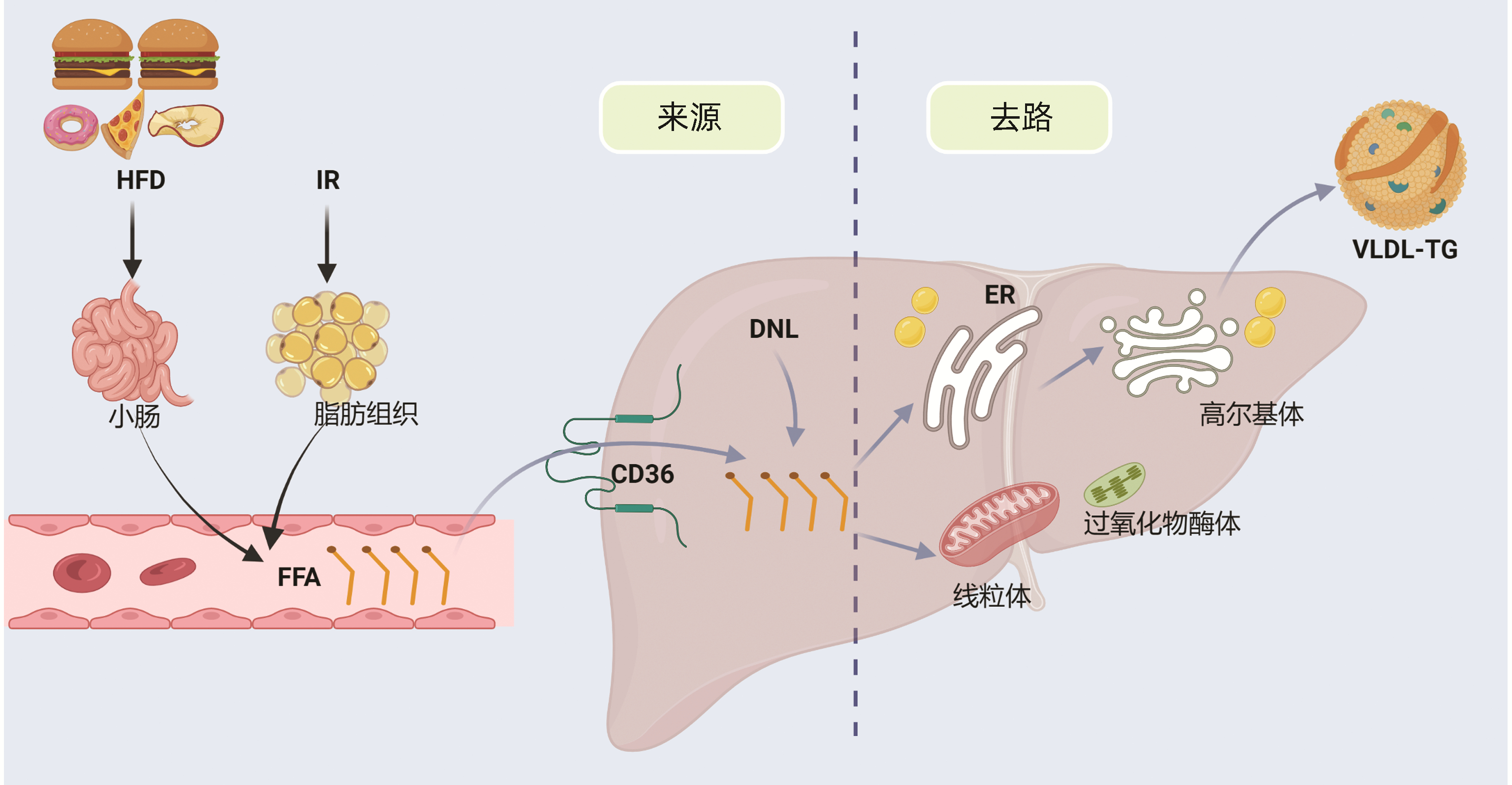
注:HFD,高脂饮食;IR,胰岛素抵抗;ER,内质网;VLDL-TG,极低密度脂蛋白甘油三酯。
研究[6-7]显示,肥胖型NAFLD患者肝脏TG约60%来源于脂肪组织分解产生的FFA。肥胖型NAFLD患者由于脂肪组织对胰岛素的敏感性下降,导致其分解产生的FFA增多,后者可通过门静脉大量进入肝脏。
肝脏中脂质易受膳食脂质含量的影响,肝脏中15%~20%TG来自膳食脂肪酸。NAFLD动物模型中常采用的HFD在几天内可引起啮齿动物发生肝脂肪变性[8]。随机对照试验研究[9-10]表明,采用地中海饮食干预后,NAFLD患者的脂肪肝指数、内脏脂肪指数、胰岛素水平、肝脂肪含量等均较对照组明显下降。
健康个体中,DNL从禁食状态的5%上升到进食后4 h的23%。而在合并高甘油三酯血症和高胰岛素血症的NAFLD患者中,DNL在禁食状态下明显升高(约26%)[11]。一项使用同位素追踪剂研究[12]显示,肥胖型NAFLD患者其肝脏TG可来自外周FFA、DNL、膳食摄入,其比例分别为59.0%±9.9%、26.1%±6.7%、14.9%±7.0%,表明脂肪组织分解途径在NAFLD中的主导地位。
肝脏中脂质主要以分泌VLDL-TG形式运出肝外,此过程涉及VLDL-TG在内质网的组装、合成及高尔基体的分泌,其中微粒体脂肪转移蛋白、载脂蛋白B-100/48(apolipoprotein B-100/48, ApoB-100/48)、外被蛋白Ⅰ/Ⅱ等是重要的调控蛋白因子[13]。在健康个体中,肝脏VLDL-TG分泌与FFA、体质量呈正相关;在NAFLD患者中,肝脏VLDL-TG分泌速率代偿性增加,血清VLDL-TG清除速率降低,导致高甘油三酯血症[14],提示VLDL-TG的分泌对肝脂质和全身血脂水平具有调控作用。研究[15]表明,胆固醇转运蛋白能够降低肝脏VLDL-TG分泌速率,从而介导并加重了HFD诱导的肝脂肪变。
肝脏FFA氧化主要涉及线粒体β氧化,肝细胞含有丰富的线粒体,当大量FFA超过肝脏自身处理能力或当肝脏FFA氧化能力降低时,FFA在肝脏大量聚集,一方面过量的脂质在细胞内沉积引起脂质过氧化反应,另一方面大量FFA对肝细胞产生脂毒性[16],促使肝细胞内丰富的内质网发生内质网应激,后者通过IRE1α-XBP1途径抑制VLDL-TG分泌促进肝细胞脂肪变[17],通过PERK-eIF2α-ATF4途径使硬脂酰辅酶A去饱和酶-1、脂肪酸合酶(fatty acid synthase, FASN)等限速酶减少,进一步加重肝脂质稳态失衡[18]。以上研究表明肝脏FFA氧化减少可能导致脂肪变、脂质过氧化、氧化应激、内质网应激、细胞死亡等一系列打击事件发生,共同驱动NAFLD发生发展。
肝细胞因子是肝脏分泌的蛋白质,可通过自分泌、旁分泌和内分泌途径调节糖脂代谢,在NAFLD发生发展中起重要作用[19]。目前研究较多的肝因子有成纤维细胞生长因子21(fibroblast growth factor 21, FGF21)、血管生成素样蛋白3/4/6/8(angiopoietin like protein, ANGPTL3/4/6/8)、视黄醇结合蛋白4、胎球蛋白A/B(Fetuin-A/B)、硒蛋白P(selenoprortein,SeP)、白细胞衍生趋化因子2、sparc相关模块化钙结合蛋白1、卵泡抑素、性激素结合球蛋白、生长分化因子15等,它们在糖脂代谢、炎症、促纤维化等方面具有多种作用。
脂肪因子是脂肪组织分泌的激素物质,参与全身胰岛素分泌代谢、食欲控制、能量消耗、脂肪分布等多种代谢活动[20]。目前已有600余种脂肪因子家族,近年来确定的新的脂肪因子有趋化素、白脂素、网膜素、鸢尾素、视黄醇结合蛋白4、锌-α2-糖蛋白等,新型脂肪因子在脂肪组织、肝脏、心血管等组织代谢中具有重要作用。
FGF21是成纤维细胞生长因子家族成员之一,主要由肝脏分泌,在NAFLD、2型糖尿病等代谢性疾病中具有重要作用[21]。(1)FGF21以剂量依赖形式显著降低啮齿动物和人类血浆TG含量。FGF21能够降解白色脂肪组织(white adipose tissue, WAT)和棕色脂肪组织(brown adipose tissue, BAT)中富含TG的脂蛋白[22],促进WAT发生棕色化,并可激活BAT,从而降低血浆FFA、TG水平。(2)FGF21能够降低肝脏内TG含量,其机制为:FGF21上调ApoB 100、ApoE和微粒体脂肪转移蛋白表达,促进肝脏VLDL-TG分泌速率;同时FGF21促进过氧化物酶体增殖物激活受体γ共激活剂1α(peroxisome proliferator-activated receptor gamma coactivator 1α, PGC1α)、酰基辅酶A氧化酶1和肉毒碱棕榈酰基转移酶表达,增强脂质氧化[23]。(3)临床研究表明,血浆FGF21水平与肝脏TG含量密切相关。一项为期3年的前瞻性研究[24]发现血清高FGF21水平是NAFLD的危险因素。
Fetuin-A是由肝细胞分泌的血清蛋白,属于胱抑素超家族蛋白酶抑制剂成员,在脂肪酸代谢、IR、急性炎症反应等多种生理过程中发挥关键作用[25]。临床研究[26]显示,与正常受试者相比,NAFLD患者肝脏Fetuin-A表达明显增加,且与糖脂代谢异常有关。与瘦型NAFLD相比,肥胖型NAFLD患者血清Fetuin-A水平显著增加;一项台湾横断面研究[27]显示,血清Fetuin-A浓度与瘦型NAFLD风险呈正相关。上述证据均表明NAFLD患者Fetuin-A水平升高可能是早期预测疾病风险的良好血清生物标志物。此外,Fetuin-A也是诊断IR相关代谢紊乱的早期预测生物标志物,Fetuin-A抑制胰岛素受体底物(insulin receptor substrate,IRS)表达,下调4型葡萄糖转运蛋白表达,最终造成血糖升高[28]。
Fetuin-A蛋白表达与甾醇调节元件结合蛋白、FASN呈正相关,而甾醇调节元件结合蛋白、FASN在肝脏DNL、脂质合成过程中起重要作用[29]。此外,Fetuin-A是Toll样受体4(toll-like receptor 4,TLR4)的内源性配体,促进炎性因子表达,Fetuin-A与FFA结合,形成的复合物对TLR4受体亲和力增加,激活IκB激酶、c-Jun N-末端激酶途径启动核因子κB释放[30],造成各种炎性因子、趋化因子释放增加,促进NAFLD发生发展。
ANGPTL3/8属于血管内皮生长因子家族成员,在肝脏特异表达[31]。ANGPTL3/8是脂蛋白脂肪酶的生理性抑制剂,是血浆TG清除率的调节剂。ANGPTL3被前蛋白转化酶蛋白水解切割后产生活性N端结构域,并与ANGPTL8形成复合物,共同抑制脂蛋白脂肪酶表达,同时还根据营养状态将循环中TG分配到特定组织供其利用[32]。研究[34]表明,降低ANGPTL8表达具有改善葡萄糖耐量的作用[33]。一项临床队列研究[35]显示,ANGPTL3水平与IR的稳态模型评估(HOMA-IR) 呈正相关(r=0.28,P < 0.05);与健康对照者相比,NAFLD患者肝脏ANGPTL3/8表达明显升高,且与脂肪变程度相关。
SeP是由肝脏合成和分泌的糖蛋白,属于硒元素转运蛋白家族,具有将硒元素从肝脏转运至其他器官的功能[36]。目前SeP的临床研究存在相互矛盾的结果。来自不同国家的研究表明,血清SeP升高与NAFLD、代谢综合征的发生关系密切。我国一项病例对照研究[37]纳入79例NAFLD患者和79例正常受试者,结果显示NAFLD患者SeP水平升高,且NAFLD的患病率和检出率随SeP水平升高而增加,同时NAFLD严重程度亦与血清SeP有关。此外,血清SeP水平与NAFLD的危险因素呈正相关,如:体质量指数(BMI)、ALT、AST和血清尿酸等;韩国一项前瞻性队列研究[38]纳入120例少肌性肥胖患者,其中并发NAFLD 60例,结果显示与非NAFLD肥胖者相比,内脏肥胖型NAFLD患者和代谢综合征患者血清SeP水平更高,且血清SeP水平与内脏脂肪面积、HOMA-IR和臂-踝脉波速度呈正相关,与肝衰减指数呈负相关。然而一项来自希腊的病例对照研究[39]纳入了31例经肝脏穿刺确诊的NAFLD患者和27例正常受试者,其中单纯脂肪变者15例,非酒精性脂肪性肝炎(NASH)者10例,确诊NASH者6例,结果发现与对照组、单纯脂肪变组相比,NASH患者血清SeP水平较低,与上述研究结果相反,这可能与该研究样本量较少、其他研究多采用血清无创诊断模型或B超诊断NAFLD有关。
Chen等团队[37]进一步进行体内外实验验证,无论是HFD喂养的C57BL/6J NAFLD小鼠还是棕榈酸诱导的HepG2脂肪变细胞,其血清和肝脏SeP水平均高于空白对照组;采用siRNA沉默SeP蛋白发现,AMPK/ACC信号通路被激活,HepG2细胞内TG减少,相反过表达SeP蛋白发现,AMPK/ACC信号通路被抑制,HepG2细胞脂质积累增多。基于此推测AMPK/ACC信号通路可能是SeP与NAFLD发病关系密切的关键分子途径。
趋化素作为新型脂肪因子,在炎症和代谢障碍等方面发挥关键作用。肥胖相关临床研究[40]显示,血清高水平趋化素与BMI呈正相关,其机制可能是:趋化素促进脂肪细胞发生肥大,导致脂肪组织中炎症和血管生成障碍,最终造成机体肥胖。一项纳入56例经肝活检确诊NAFLD的横断面研究[41]发现,趋化素水平在BMI ≥ 40 kg/m2、肝细胞气球样变、NASH患者中明显升高,提示趋化素可能是肝脂肪变性、气球样变和NAFLD活动评分的预测因子。另一项临床研究[42]证实,与健康对照组相比,NAFLD患者血清趋化素水平升高,与NAFL相比,NASH患者血清趋化素水平显著升高。且趋化素水平与HOMA-IR、NAFLD活动评分、肝细胞气球样变性呈正相关。然而,趋化素在血清和肝脏中的水平存在不一致现象。Pohl等[43]发现NASH患者肝脏趋化素mRNA表达降低,进一步体外培养LX-2细胞、HepG2细胞和人原代肝星状细胞,采用基因芯片技术发现肝X受体(liver X receptor,LXR)激动剂T0901317能够降低LX-2细胞和HepG2细胞中趋化素蛋白表达,LXR在NAFLD患者中被激活,其内源性激动剂是胆固醇的氧化产物,后者会导致肝损伤。因此,LXR的高度激活可能是NASH患者肝脏趋化素mRNA低表达的原因。基础研究[44]表明,外源性补充趋化素可减轻HFD诱导的NASH模型鼠肝脏氧化应激,与过量趋化素通过CMKLR1受体促进JAK2/STAT3磷酸化有关,提示外源性重组趋化素可能成为治疗NASH的靶点。
白脂素是WAT在空腹或禁食状态下分泌的脂肪因子,通过血液循环到达靶器官对全身糖脂代谢产生影响。(1)白脂素是具有中枢作用的促食欲激素。循环中白脂素穿过血脑屏障并通过cAMP依赖性途径直接激活促食欲神经元,同时抑制下游阿片-促黑素细胞皮质素原厌食神经元,最终导致食欲增加和肥胖[45]。(2)白脂素调节外周组织葡萄糖代谢。白脂素上调骨骼肌肌管中4型葡萄糖转运蛋白mRNA和蛋白质表达,促进骨骼肌对葡萄糖的摄取[46];在禁食条件下白脂素通过与嗅觉受体734结合激活下游cAMP-PKA通路,促进糖异生基因葡萄糖6磷酸酶和磷酸烯醇丙酮酸羧激酶1表达,刺激肝细胞释放葡萄糖。给予白脂素抗体后能够阻断白脂素/嗅觉受体734对糖异生的促进作用[47]。(3)白脂素能够降低肝脏TG水平。Hekim等[48]给予Balb/C糖尿病模型小鼠腹腔注射不同浓度白脂素(1 μg/kg或10 μg/kg 4次,间隔3天),实验结束时发现高剂量白脂素明显降低肝脏TG、胆固醇和低密度脂蛋白。此外,临床研究[49]发现肥胖型NAFLD儿童及青少年血清白脂素明显升高,且白脂素水平与BMI、腰臀比、空腹血糖、ALT呈正相关,是NAFLD发生的独立危险因素。上述研究提示白脂素可能是预测NAFLD的新型生物标志物。
鸢尾素是由运动诱导产生的肌因子和脂肪因子,与NAFLD、肥胖等代谢性疾病密切相关。(1)鸢尾素促进WAT褐变,减少WAT体积。一项来自人类供体内脏WAT研究[50]显示,鸢尾素增加内脏脂肪细胞的线粒体能量代谢,增加皮下WAT中线粒体解偶联蛋白1、PGC1α、PR结构域蛋白16、跨膜蛋白26、白细胞分化抗原137 mRNA和蛋白表达,促进WAT发生棕色化。Chen等[51]给予HFD喂养的C57BLKS/J小鼠腹腔注射鸢尾素(0.8 ng·g-1·d-1)持续14天,实验结束时采用MRI测量WAT体积显著减小,血糖、胆固醇水平明显降低;多项研究[52-53]发现鸢尾素可能通过p62/Nrf2/HO-1通路、p38 MAPK通路、ERK通路促进WAT棕色化。(2)鸢尾素变化趋势对于预测NAFLD有重要意义。与对照组相比,NAFLD患者血清鸢尾素水平更高,且随着脂肪变性和纤维化程度的增加而增加[54]。鸢尾素水平与我国肥胖患者的肝脏TG含量成负相关[55]。此外,在儿童队列研究[56]中,鸢尾素水平与马铃糖蛋白样磷脂酶蛋白3突变呈正相关,而马铃糖蛋白样磷脂酶蛋白3是NAFLD发生发展过程中的重要表观遗传学分子。基础实验[57]证实,鸢尾素治疗能够降低高碳水高脂肪饮食喂养大鼠的血糖、血脂水平,促进PGC1α表达,提示鸢尾素可能成为治疗NAFLD的新靶点。
综上所述,肝因子和脂肪因子参与了肝脂代谢的多个环节,其血清水平与NAFLD进展密切相关。在临床研究中,由于NAFLD诊断方法、肝因子和脂肪因子检测试剂盒、观察指标的差异,同类研究存在结果相矛盾现象;而基础研究和临床研究存在不统一现象,可能与外源性补充肝因子或脂肪因子的浓度与内源性生理剂量之间的差异有关。因此需要多中心、跨学科的临床研究探讨肝因子、脂肪因子与NAFLD之间的相关性;同时需要进一步实验研究,更好模拟生理状态下肝脏和脂肪组织之间的相互作用,并继续阐述肝因子和脂肪因子在NAFLD中的关键靶点和通路,为临床治疗提供证据。
查看更多