甲状腺球蛋白和甲状腺球蛋白抗体临床诊疗专家共识与建议

赵来,主任技师,1992年毕业于张家口医学院检验系,现任隆化县医院检验科副主任,承德市重点医学学科带头人,河北省临床检验生化专业委员会常委,主要从事临床生化、肿瘤标记物检验和内分泌疾病实验诊断。主持市科技支撑计划课题获市科技进步二等奖一项,三等奖两项。
【摘要】甲状腺球蛋白测定是分化型甲状腺癌临床治疗决策和随访的基础。但甲状腺球蛋白的测量和测定结果解释,需要考虑许多因素。就这些问题,本文综合2013年和2014年各种临床文献对原指南予以更新。在对现有文献进行广泛分析的基础上,对高敏甲状腺球蛋白测定的分析和临床问题进行回顾和讨论。甲状腺球蛋白测定仍然是一项非常复杂的实验,存在许多缺陷和干扰因素,尤其是抗甲状腺球蛋白抗体的影响,需要给予评估,必要时予以适当处理。本专家共识制定了53个实用的分级建议,用于指导高敏甲状腺球蛋白和TgAb在实验室和临床实践中应用,填补了当前指南的不足。
【关键词】高灵敏甲状腺球蛋白测量;抗甲状腺球蛋白抗体;分化型甲状腺癌;随访
一、临床意义与背景
分化型甲状腺癌(DTC)是最常见的内分泌恶性肿瘤,随着时间的推移,患病率不断增加。血清甲状腺球蛋白和甲状腺球蛋白抗体测量是临床管理DTC患者不可或缺的实验,新的实验技术达到了出色的分析性能,同时可以大大简化我们的随访方案,节省成本,减轻患者的不适。然而,许多因素可能会影响血清Tg和TgAb的测量,实验室专家和临床医生之间的严格双向沟通是优化甲状腺生物标志物检测的关键。为此我们对DTC的实验和临床诊断提供新的和分级建议。
甲状腺球蛋白测量结合颈部超声(CUS)目前被认为是分化型甲状腺癌(DTC)术后随访的标配。甲状腺球蛋白(Tg)是一种大分子糖蛋白,储存在甲状腺的滤泡胶体中,作为甲状腺激素合成的底物。Tg的产生于正常的和分化良好的恶性甲状腺细胞,在除外健康和良性病理甲状腺组织,适合用作“肿瘤标记物”,高灵敏度甲状腺球蛋白(hsTg)检测方法提高了分析灵敏度,并在较低的检测范围内提供了更精密的Tg测量,这对临床实践具有相当大的意义。然而,经研究发现,高达25%的DTC患者在初次诊断时存在抗甲状腺球蛋白自身抗体(TgAb),这使DTC患者的随访受到很大影响。最近,出现了许多关于克服TgAb干扰的新方法,主要基于液相色谱-串联质谱(LC-MS/MS)Tg分析。遗憾的是,目前的管理指南没有关于克服TgAb干扰的hsTg分析方法及其应用中存在不足的具体建议。此外,DTC治疗最近从甲状腺全切除术和碘-131(I-131)治疗(即甲状腺全消融)的系统组合转向低风险DTC的单侧甲状腺腺叶切除术,以及在其他情况下选择性地使用甲状腺切除术后I-131治疗。因此,残余甲状腺叶或未消融的甲状腺残余物的存在是Tg阳性结果的重要因素,迫切需要新的理论来解读Tg结果。2013年和2014年,国际专家小组发布了两份临床文件,详细说明了TgAb对hsTg测量的影响和处理建议。并陆续出现了关于hsTg和TgAb测量和影响分析的重要文献。因此,参与DTC患者管理的国际跨学科专家小组(见文本框1)致力于提供一个单一的、全面的、更新的文件,包含基于文献的针对分析和临床问题的专家意见建议。因为缺乏实质性的证据,这一共识声明并不作为指南而应用,仅作为专家意见供临床医生选择。必要时应该首先参考相关指南。
二、意见建议形成方法
1. 议题:在小组讨论开始时,确定了12个主要问题来指导达成共识的过程。(1)关于甲状腺球蛋白试验分析方面的问题;(2)目前有哪些甲状腺球蛋白检测方法?(3)甲状腺球蛋白检测的相关分析特征是什么?(4)如何定义高灵敏度甲状腺球蛋白检测?(5)高灵敏度甲状腺球蛋白检测中可能出现哪些干扰,如何检测?
2. 关于甲状腺球蛋白临床试验方面的问题:(1)高灵敏甲状腺球蛋白测量的适应症是什么?(2)高灵敏度的甲状腺球蛋白测定是否会导致甲状腺球蛋白测定的适应症发生变化?(3)在DTC随访期间,高敏甲状腺球蛋白应在何时以及多久测量一次?(4)高灵敏度甲状腺球蛋白检测能否用于仅接受手术治疗的患者?(5)使用高灵敏度甲状腺球蛋白检测能代替TSH刺激试验吗?(6)在TgAb存在的情况下,能否推荐使用高灵敏度的甲状腺球蛋白测定?(7)TgAb浓度的测量可以用作“替代肿瘤标志物”吗?(8)TgAb阳性患者采用何种随访方式?(9)当高灵敏度甲状腺球蛋白检测无法进行时,应如何治疗患者?
3. 文献检索策略:对于上述每个选项,每个作者自愿为此提供文献支持。不受时间或语言限制的情况下,在PubMed、Web of Science和Scopus中通过使用一个或多个合适的搜索标准和术语以及通过筛选相关选定论文中的参考文献进行文献检索。截至(包括)2023年1月的文献。对标题/摘要进行筛选并剔除重复,基于筛选标准对纳入和筛除的文献执行复核。
4. 文本框1. 共识小组工作流程和共识的建立:目前的共识小组是来自内分泌学、核医学和实验室医学领域的专家。共识小组还包括一名来自甲状腺癌患者组织的代表。文献作者根据专业知识和临床实践记录与专家进一步接触。由于新冠肺炎疫情,所有的交流都以电子方式进行,主要是通过电子邮件,并就个别问题进行视频会议。对于每组问题,一个核心作者组产生一个初始文件(分析方面,临床方面),用作基础文本进行电子讨论。文件在小组中反复传阅,直到就所有问题达成共识,如有不同意见,应咨询第三方有经验的评审员,以达成一致意见。由于这一讨论过程没有与任何相关的专业协会进行沟通,一些共识被认为缺乏证据或对官方准则来说争议太大,因此没有得到这些协会的认可(见表1)。
表1. 专家小组成员基于可用证据等级定义建议的强度


5. 结果的处理:更新的建议标记*,新增的建议标记**。
6. 达成共识的局限性:因疫情的影响。无法举行现场讨论会议,这不可避免地会改变讨论的切实性。此外,基于证据的共识往往诉诸于“专家意见”,因此显示出较弱的证据等级。
三、关于高灵敏度甲状腺球蛋白分析方面的问题与建议
1. 高灵敏度的甲状腺球蛋白免疫检测(IMAs),被推荐用于监测DTC患者,优于传统的甲状腺球蛋白检测。B级**
2. 对于DTC患者,不应常规应用RIA和MS(质谱方法)方法测定甲状腺球蛋白。C级**
3. 制造商按照CLSI指南要求评估和报告定量限(OQ),作为分析测量的灵敏度。C*级
4. 制造商应提供所采用方案的实验细节。B级
5. 在临床实践中引入甲状腺球蛋白检测之前,应在本实验室验证LOQ。C级
6. 血清甲状腺球蛋白应通过BCR@457参考物质校准的有效免疫测定法进行测量。A级
7. 为使检测获得最佳的精密度,每次应在同一实验室使用相同的检测方法进行甲状腺球蛋白测量。如果检测方法不可避免地发生变化,则每位患者都有必要重新确定基准水平。A级*
8. 必须参加认证的(国际)国家质量评价计划。B级*
9. 根据CLSI指南确定的LOQ值<0.2ug/L定义为高度敏感的甲状腺球蛋白免疫测定分析法(IMA)。C级*
10. 临床决策限可能与LOQ不同,应在大量的代表性患者群中建立,并由甲状腺医疗团队根据其自身的DTC患者群进行调整。C级**
11. 与任何Tg检测一样,在进行高灵敏度Tg检测时,应常规检测是否存在TgAb。A级
12. 建议首先使用IRP 65/93校准且经过验证的定量TgAb免疫分析法。C级
13. 在DTC患者中,高于LOQ的TgAb值可能会干扰甲状腺球蛋白测定。C级*
14. 实验室应验证在其患者群体中制造商提供的LOD、LOQ和参考范围。C级
15. 实验室应报告TgAb的两个参考范围:一个是基于无甲状腺疾病人群中存在的TgAb,应用于自身免疫性甲状腺疾病的诊断;另一个是LOQ,应用于DTC患者的正常上限。C级
16. 为了保证临床治疗的连续一贯性,TgAb浓度的测量应在同一实验室使用相同的检测方法。B级
17. 检测TgAb干扰的常规回收试验不足以准确预测对现代高灵敏度甲状腺球蛋白检测的干扰。D级
18. 目前,还没有克服TgAb干扰的方法以供临床使用,使得甲状腺球蛋白测量具有足够的准确性和灵敏度,是否仍需要某种替代方法,尚有争议。C级
19. 在TgAb阳性患者中,无法检测高敏感甲状腺球蛋白时,不鼓励在常规基础上额外使用MS、RIA检测甲状腺球蛋白或甲状腺球蛋白微量回收实验,应仅在选定的个别病例中考虑应用。C级**
20. 不建议对嗜异性抗体(HAb)进行常规筛查。C级*
21. 如果临床怀疑HAb干扰,可以使用专用的、市售HAb阻断管来测试HAb的存在,实验结果如甲状腺球蛋白水平降低≥20%被认为是HAb阳性;然而,这种定量测量的Tg水平不是可靠的,不应报告给临床医生。而且,封闭剂可能并非在所有情况下都有效,在这些情况下,应考虑使用不同的检测方法或进行系列血清稀释或PEG沉淀来测量Tg。C级*
22. 在证实有嗜异性抗体(HAb)干扰的情况下,IMA分析Tg浓度不可靠。C级**
23. 排除高剂量钩状效应的浓度应由制造商确定,并由当地临床实验室验证。B级**
24. 如果临床怀疑存在hook效应,应在报告甲状腺球蛋白浓度之前进行血清或洗脱液稀释。B级**
25. 如果怀疑生物素干扰,建议在中断生物素摄入72小时或更长时间后重新采集样本。除此之外,还应考虑进行系列稀释试验、通过链霉亲和素包被的微粒去除过量的生物素,或者与其他不基于生物素-链霉亲和素结合的方法进行比较,例如具有不同原理的IMAs、质谱法或放射免疫法测定。C级**
26. 当使用基于高灵敏度甲状腺球蛋白链霉亲和素法检测时,应常规询问患者是否摄入了含生物素的产品,并建议患者在采样前72小时停用生物素。C级**
27. 存在生物素干扰的情况下,基于链霉亲和素的高灵敏度甲状腺球蛋白测定不能被认为是可靠的。C级**
四、目前甲状腺球蛋白检测有哪些方法?
甲状腺球蛋白水平最初通过竞争性放射免疫测定法(RIA)进行测量,由于更高的灵敏度和实际原因(即自动化),免疫测定法(IMAs)广泛取代了RIA。许多市售Tg-IMAs能够定量检测非常低的Tg浓度(约0.1pg/L),在hsTg测定法出现之前,被称为hsTg-IMAs或第二代Tg-IMAs。只有在停用甲状腺激素(THW)或重组人促甲状腺激素(rhTSH)刺激后,Tg的诊断灵敏度才达到最高水平。hsTg检测的使用在很大程度上消除了DTC随访中常规促甲状腺激素刺激的需要。最近,液相色谱-串联质谱法(LC-MS/MS)Tg检测(Tg-MS)开始应用。它们基于胰蛋白酶消化、免疫捕获和Tg特异性肽的定量。这消除了TgAb和嗜异性抗体(HAb)的干扰,但没有消除体内生物学干扰。遗憾的是,Tg-MS检测尚未标准化和验证,并未得到广泛应用,目前未能在TgAb阳性患者中显示出优越于hsTg的临床敏感性。
五、Tg分析的相关特征是什么?
在测量甲状腺癌患者的Tg时,需要考虑几个分析问题。
1. 分析灵敏度(检测能力):功能灵敏度(FS)是作为检测能力的一种度量指标,最初用于评估TSH分析的灵敏度,后来用于Tg分析。
美国国家临床生物化学学会(NACB)的FS指南方案建议通过两个不同批次的试剂和校准品测量临床相关浓度范围内的TgAb阴性患者、以及6个月内的患者血清样本来确定精确度。目标是确定与CV为20%相对应的Tg浓度为FS。这种方法被确定的分析性能更具有临床相关性,因为FS酷似Tg在临床实践中每隔一定时间监测DTC患者。制造商“事实上”没有使用现行的NACB指南来定义其Tg分析的FS,因为按照NACB指南确定FS是费时成本大,而且实施起来很麻烦(表2)。检测限(LOD)和定量限(OQ)是制造商和临床实验室更常用的在低分析物浓度下测定分析特征的方法之一(表2)。检测极限(LOD)是区别于空白极限的最低分析物浓度。定量限(LOQ)是在总容许误差的预定准确度目标内,可靠测量的最低分析物浓度。总容许误差代表一种分析质量要求,它为单次测量或单次测试结果中容许的不精确性(随机误差)和偏差(系统误差)设定了一个限值。对于Tg,由欧洲临床化学和实验医学联合会建议为29.8%,最大允许值为44.8%。用总误差准确确定LOQ,最小实验意味着使用两个试剂批次、一个检测系统、三天、至少四个独立低水平样品、每天三次重复,每个试剂批次至少测试36个低浓度样品(3天×4个独立低水平样品×3次重复)。对于每个试剂批次和每个结果测量,偏差与观察到的标准偏差相结合,得出总误差。LOQ为满足准确度目标的总误差的样本水平。值得注意的是,所指的协议是基于最低可接受的实验设计要求。适当的做法是增加检测物的水平和/或将重复次数增加到最小值以上,以提高所得LOQ估计的稳健性。由于未能监测试剂批次间随时间的变化,LOQ受到限制,可能使用掺有腺组织Tg的人工基质,而不是含天然Tg的人血清。因此,任何参与DTC患者长期Tg测量的实验室都应该能够初步验证制造商确定的LOQ,并尽可能随着时间的推移建立该方法的FS。在日常实践中,专家小组建议采用LOQ来定义Tg的最低可检测值和可报告量。临床实验室还应在内部验证制造商的LOQ声明。参与DTC患者长期Tg测量的专业实验室应能够初步确认制造商确定的LOQ,并随着时间的推移建立该方法的FS。
表2. 各厂商常用甲状腺球蛋白免疫测定分析灵敏度评估确定

注:缩写:AS,分析灵敏度;CV,变异系数;FS,功能灵敏度;LOQLOQ,即定量限。
表3. 各厂商常用甲状腺球蛋白免疫测定的主要分析特征(信息更新至2023年2月)
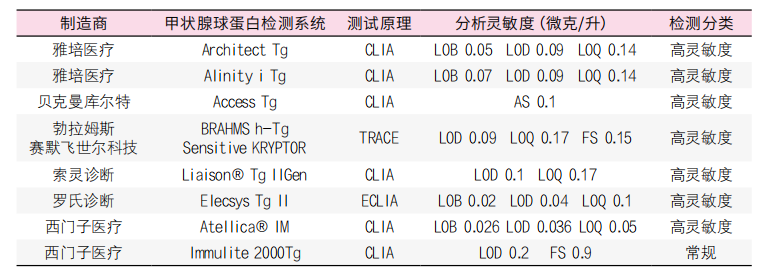
注:功能灵敏度或LOQ高于0.2g/L的Tg分析归类为常规分析;功能灵敏度或LOQ为0.2g/L或更低的Tg分析称为高灵敏度分析。所有方法都使用认证参考物质BCR® 457进行校准,计量单位用µg/L。缩写:AS,分析灵敏度;CLIA,化学发光分析;ECLIA,电化学发光分析法;FS,功能灵敏度;LOB,空白限;LOD,检测限;LOQ,定量限;Tg,甲状腺球蛋白;TRACE,时间分辨放大的穴状发射技术(注:Diasorin Liaison®和Atellica®IM仅在欧洲销售)。
2. 标准化和当前分析注意事项:甲状腺球蛋白是一种大的、异质的碘化糖蛋白,不同的分析方法应用不同的抗体。因此,不同的分析会产生不一致的甲状腺球蛋白浓度。认证参考材料(CRM 457)的引入已将方法间的差异从40%-60%降低到约30%。因此,在不影响监测的情况下。在随访期间,Tg测定尽可能在同一实验室进行。如果分析系统变更不可避免,建议通过新旧分析系统的Tg平行测量,以便重新确定监测的基准水平。同样,分析中捕获和标记抗体的连续性对于保证分析结果的前后可比性是必要的;这些方面的任何变化都需要对患者基准水平进行重新确定。
3. 如何定义高灵敏度甲状腺球蛋白检测?“高灵敏度”Tg检测的适宜临床标准应该是,DTC随访期间,常规TSH刺激试验被取消。许多研究证明,超过95%的DTC患者的无TSH刺激hsTg水平≤0.2ug/L。此外,目前推荐非刺激hsTg值为0.2ug/L,在动态风险分层系统中对治疗的反应为良好。此外,将LOQ≤0.2pg/L的Tg IMAs定义为“高度敏感”似乎是合理的(表3)。需要指出的是,分析灵敏度是一个技术参数,而临床医学决定水平应在大量临床病例研究中得出,且不同于分析灵敏度。然而,较高的分析灵敏度不仅能检测较低浓度的Tg,而且与常规分析相比,显示出较小的误差和较好的向重复性。
4. 高灵敏度甲状腺球蛋白检测中可能出现哪些干扰,如何检测?它与常规抗体一样,hsTg IMAs可能会受到TgAb和HAb或生物素等外源物质的干扰。然而,特别是在TgAb的情况下的临床实践,文献中显示对hsTg检测中可能不太严重。
5. 甲状腺球蛋白抗体:在诊断时,高达25%的DTC患者的TgAb测试呈阳性。当然,在临床实践中确诊时间是可变的,因为在一些国家,多达一半的DTC是通过病理分析而不是术前诊断的。因此,手术后TgAb结果会与术前出现不同,这也导致了文献中报道的阳性率不同。无论如何,TgAb的存在可能导致广泛Tg-IMA中Tg浓度降低或无法检测。值得注意的是,即使通常认为TgAb浓度越高,对Tg浓度的干扰就越强(反之亦然)。低浓度的TgAb也可能会掩盖hsTg检测非常低的Tg浓度。有两种检测TgAb干扰的方法:测定Tg的回收率或直接测量抗体。
6. 回收试验:回收试验的优点是区分升高的TgAb是否导致“体外”干扰,或者这些干扰是否与IMA测量无关。在传统的Tg回收试验中,当使用含有40-50μg/LTg的血清缓冲液时,回收率>70%-80%被认为是可接受的。然而,只有强干扰才会被检测到,这使对低浓度Tg(即≤1微克/升)的干扰不适用。近年来,通过添加低Tg浓度(即1-5微克/升)的血清进行的Tg“微小回收”试验已经被引入。然而,最近发表的一项关于1120份血清样本的研究报告显示,“微小回收”实验对于大多数患者中没有任何优势。此外,在TgAb阳性但回收试验中未显示干扰的患者中,不能排除结合TgAb的甲状腺球蛋白因快速生物清除,导致甲状腺球蛋白的血液浓度降低。
六、甲状腺球蛋白抗体的直接测量
最初,TgAb免疫测定是为自身免疫性甲状腺疾病的诊断而开发的。不幸的是,TgAb测定显示出不同的灵敏度,并且在测量抗体的精密度方面也有所不同。因此,当使用制造商的参考区间时,仍被视为“正常”的低浓度TgAb也可能对Tg测量造成了显著干扰。
值得注意的是,在DTC患者中测量TgAb有助于排除对Tg分析的潜在干扰,并且使用LOD或LOQ作为临界值可能更适合检测DTC患者中的来自TgAb的干扰。使用较低的TgAb检测限值将提供更高的准确性,即测量的TgAb浓度确实代表个体患者中的潜在相关干扰源。因此,尽管支持制造商提供TgAb分析的LOD和LOQ,但这些数据不能替代本地评估。表4给出了市售TgAb IMAs的LOD、LOQ和参考区间。然而,一些作者主张从临床数据中获得更高的TgAb阈值,以减少假阳性结果。重要的是,由于Tg和TgAb的异质性,没有一种单一的检测方法可以准确地预测给定样品中的TgAb是否会干扰Tg测量。TgAb阳性样品的含量在不同的检测方法之间存在显著差异。此外,尽管大多数TgAb检测制造商声称已根据国际参考标准(IRP)65/93进行了标准化,但仍可见到较大的变异性,相关系数为0.25至0.82.因此,在某些情况下,建议使用一种以上的TgAb检测系统。使用相同的检测系统利于测量TgAb浓度的随访,当检测系统不可避免变更时,建议对TgAb值重新确定基准水平。当TgAb作为肿瘤标志物时,这一点尤其重要(见下文)。
1. 甲状腺球蛋白测定中有没有克服TgAb干扰的方法?在一些作者声称甲状腺球蛋白RIA法对TgAb干扰的抵抗力更强。但是,另有学者对这些数据提出了质疑。实际上,一些实验室已经对TgAb阳性患者采用RIA或LC-MS/MS或Tg回收实验。同样,通过IMA测量TgAb阴性样品中的Tg;或RIA或LC-MS/MS或TgAb阳性样品的微量回收试验。然而,Tg RIAs可用受限,并且在大多数分析中,分析灵敏度并不理想。同样,目前Tg-MS在患有器质性疾病且Tg在0.1和0.5ug/之间的患者中产生假阴性结果的比例也不容忽视。
对大多数患者进行常规的Tg微量回收试验,并没有获得比TgAb IMA试验更多的优势。此外,由于Tg-TgAb复合物的加速清除导致的低Tg值不能通过这些方法解决。因此,LOQ<0.2ug/L的Tg IMAs仍然是TgAb阴性患者的主要指标,而阳性患者TgAb应主要作为肿瘤标志物进行监测。反之亦然。如果可行,Tg-MS、Tg-RIA或Tg微量回收试验应仅在特定病例中考虑(即,不一致的生化和临床数据)。还应注意的是,最近有报道称,在检测不到hsTg(即<0.2ug/L)的TgAb阳性患者中,器质性疾病(尤其是远处转移)的风险较低。因此,hsTg检测可能用来准确追踪TgAb阳性患者。
表4. 各厂商常用抗甲状腺球蛋白抗体免疫测定的主要分析特征(信息更新至2023年2月)
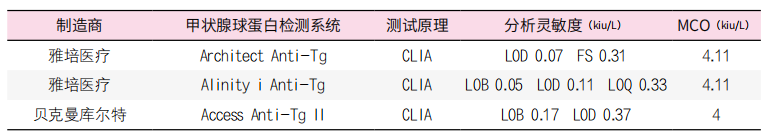
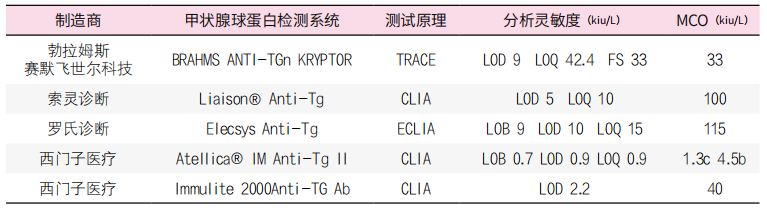
注:缩写:CLIA,化学发光免疫分析;ECLIA,电化学发光免疫分析;FS,功能灵敏度;LOD,检测限;LOQ,定量限;MCO,厂商cut-off;TgAb,抗甲状腺球蛋白抗体;TRACE,时间分辨放大的穴状发射技术。a 所有方法均采用国际参考物质65/93进行校准,并使用国际单位(kIU/L),BRAHMS ANTI-TGn使用kAU/L;b 所有测试结果来自表观健康的受试者;c 提示自身免疫性甲状腺疾病(注:Diasorin Liaison®和Atellica®IM仅在欧洲销售)。
2. 嗜异性抗体Hab:由于HAb的存在,约1%的患者表现出对Tg测量的干扰。这些hab可以结合动物抗原,并在捕获和检测抗体之间形成桥接,导致Tg-IMAs中Tg测量值的假性升高(或假性降低,但很少)。HAb的干扰可通过各种方法进行评估,如:(1)用市售的嗜异性封闭管进行样品处理;(2)由于样品的连续稀释测试结果缺乏线性,怀疑有干扰;(3)使用不同的IMAs或替代方法进行测试;(4)聚乙二醇沉淀(PEG)去除HAb,(5)Tg-MS。使用多种策略评估有无HAb干扰是最有效的方法。但HAb干扰的评估不宜常规应用,应在Tg结果和临床表现不一致的情况下进行。
3. 钩状效应:由于过量的抗原耗尽了捕获抗体的结合能力,IMA易受钩状效应的影响,导致在具有非常高的分析物而血清测量值极低。排除钩状效应的浓度应由制造商确定,并在当地验证。目前可用的Tg分析方法均能很好地预防钩状效应,但偶尔也在高负荷转移性疾病患者(即Tg>1000ug/L)和在细针冲洗中测量Tg时,血清或洗脱稀释液(通常1:10体积/体积)或回收试验检测中出现钩状效应。
4. 生物素干扰:影响某些Tg和TgAb分析结果的另一问题是生物素的干扰。生物素(或维生素H)是一种水溶性维生素,由肠道中的细菌合成,天然存在于谷物、猪肉和鸡蛋等食物中。生物素的日摄入量为30微克,很容易从正常饮食中获得。
由于生物素与抗生物素蛋白及其衍生物具有很强的非共价结合,因此在当前的免疫分析中被广泛用于将抗原-抗体复合物捕获到固相上。生理血浆浓度(0.3-0.7ng/mL)的生物素不会影响免疫测定。相反,临床试验表明,在化妆品中广泛使用生物素(高达20mg/天),以及用于治疗进行性多发性硬化病的非常高剂量的生物素(高达300mg/天),在免疫测定中具有更广泛的影响,存在误诊和/或不当干预的风险。干扰的程度与干扰相关的生物素浓度是相关的(即竞争法或直接测定法,一步或两步法)。试剂制造商提供了上述生物素摄入后可能发生干扰的临界值和时间范围(根据生物素的剂量/日和治疗持续时间,从8到72小时)。某些制造商正在生产“免受生物素干扰”的IMAs,一些改良的检测方法已经在应用。如果怀疑生物素干扰,建议在患者停用生物素一段时间后重新收集标本。如果无法重新采集样本,且需要确认生物素干扰,则应考虑进行系列稀释试验,通过链霉亲和素包被的珠子去除多余的生物素,或与非基于生物素-链霉亲和素结合的方法进行比对测试。
七、关于hsTg检测临床方面的问题
1. 血清甲状腺球蛋白测定用于监测初级治疗后的DTC患者。A级**
2. 对于没有甲状腺癌证据的常规检查,首次就医时,血清甲状腺球蛋白测量不宜作为基础水平测试。F级**
3. 血清甲状腺球蛋白测量并不能用来区分良性和恶性结节。F级**
4. 血清甲状腺球蛋白测定可作为评估甲状腺毒症、先天性甲状腺功能减退和破坏性甲状腺炎的辅助指标。B级**
5. 使用高灵敏度的甲状腺球蛋白检测不会改变甲状腺球蛋白测量的适应症。A级
6. 医生应在手术后至少4周,在131-I治疗后至少4个月才能测量甲状腺 球蛋白;否则应谨慎解释测试结果。C级*
7. 甲状腺球蛋白测量应每隔3-24个月进行一次;综合确诊时间、初始阶段病情和对治疗的反应为每个患者确定个体化的检测频率。C级
8. TSH应始终同时测定,以便能够在后续检查中评估TSH刺激是否具有可比性。A级**
9. 在部分腺叶切除术后的DTC患者中,用高灵敏度或常规方法测定甲状腺球蛋白并不是疾病复发的可靠指标。如果进行,应结合促甲状腺激素浓度和超声检查结果评估测试结果。E级*
10. 高灵敏度的甲状腺球蛋白检测也可用于甲状腺全切除术后未接受131I治疗的DTC患者的随访。非顽固性或复发性疾病的患者甲状腺球蛋白浓度较低,随着时间的推移逐渐稳定或下降。对这些患者进行高灵敏度甲状腺球蛋白检测的一大好处在于提高了较低范围结果的精确度和准确度。C级*
11. 尚未接受131-I消融术的顽固性或复发性甲状腺癌的患者,准确的Tg值无法测定,应以超声检测作为随访,时间间隔根据风险、hsTg结果和变化趋势以及治疗反应而定。C级*
12. 在没有干扰的情况下,非刺激的高敏甲状腺球蛋白绝对值和变化趋势提供了重要的诊断和预后信息。A级**
13. 非刺激的高敏甲状腺球蛋白水平低于0.2ug/L的患者不需要TSH刺激的甲状腺球蛋白测量,主要是应每12-24个月测量一次非刺激的高敏甲状腺球蛋白。A级*
14. 对于非刺激的高敏甲状腺球蛋白水平在0.2-1ug/L之间的患者,应每3-6个月进行一次连续的非刺激的高敏甲状腺球蛋白检测。B级*
15. 非刺激的甲状腺球蛋白水平高于1ug/L的患者可能需要基于患者个体特征附加腺体功能或组织影像检查进行评估。A级**
16. 即使TgAb阳性,非刺激的高敏甲状腺球蛋白也能提供额外的危险分层信息。B级**
17. TgAb阳性且可检测到(即高于LOQ)非刺激的高敏甲状腺球蛋白的患者,癌症复发的风险性增加,需要额外的诊断程序和仔细的随访。B级**
18. TgAb阳性无法检测,低于LOQ非刺激的高敏甲状腺球蛋白的患者癌症复发的风险较低,可主要通过对高敏甲状腺球蛋白和TgAb的系列评估进行监测。B级**
19. TgAb浓度与肿瘤负荷无紧密的相关性。血清TgAb浓度的变化可以作为残留或进行性的良性或恶性甲状腺组织的随访标志物,必须保证使用的检测方法不变。B级
20. 当使用TgAb作为定性随访标志物时,变化趋势比绝对水平更重要。如果使用相同的分析系统,在重复测量血清中的TgAb浓度持续降低,说明患者无癌变。相反,持续的TgAb浓度增加提示顽固性癌症或恶性肿瘤复发B级*
21. 在TgAb阳性患者中,当无法进行高灵敏度的甲状腺球蛋白测量时,应根据血清TgAb浓度的变化趋势进行分期随访。C级*
22. 在大多数显示血清TgAb浓度显著降低的患者中,超声和TgAb的常规检测就足够了。C级。
23. 对于血清TgAb浓度居高不下或逐渐升高的患者,在随访期间应考虑进行额外的组织影像/腺体功能/两者同时检查。C级*
24. 同TgAb阴性的患者一样,根据现有指南,无需放射性碘治疗或扫描的TgAb阳性微癌患者的随访应主要依靠超声。D级。
25. 如果无法进行高灵敏度的甲状腺球蛋白测量,则应尽一切努力获得此类测量结果,必要时将血清样本送到外部实验室。C级。**
26. 如果不能获得高灵敏度的甲状腺球蛋白结果,当采用常规甲状腺球蛋白测量时,应参照各种国家和国际指南。C级**。

八、高灵敏甲状腺球蛋白检测和诊疗中的若干问题
1. 当前高灵敏甲状腺球蛋白测量的适应症是什么?不推荐使用Tg测量值对甲状腺结节患者进行甲状腺癌筛查。建议对于甲状腺全切除术和131-1治疗后的DTC患者的随访,统一进行甲状腺球蛋白测量。此外,在初始治疗后的DTC患者以及晚期DTC患者的随访中,可考虑定期进行血清Tg测量。而且,Tg测量可能对不明原因癌症患者的诊断有所帮助。除NACB指南外目前的临床指南不推荐术前测量Tg。尽管术前Tg的预后作用仍未得到证实,但其测量可以获得“基础”值,从而排除罕见的患者术后“假阴性”测试结果,这些患者是由于原本免疫反应性减弱、分泌Tg的能力降低而导致Tg的结果一直处于低水平。最后,Tg测量可分别用于诊断甲状腺毒性反应(即抑制合成Tg)、先天性甲状腺功能减退症(即甲状腺异位时可检测到Tg,甲状腺机能缺失时检测不到Tg)和破坏性甲状腺炎(即Tg升高)。
2. 高灵敏测量是否会导致甲状腺球蛋白测量的适应症发生变化?如第2.1节所述,使用hsTg分析方法进行Tg测量的适应症将保持与常规Tg分析相同。然而,hsTg测量基本上消除了对TSH刺激的需要。对其他适应症(如先天性甲状腺功能减退)结果的解释是否会因为检测灵敏度的提高而改变仍有待研究,尽管这似乎不太可能。
3. 在DTC随访期间,高敏甲状腺球蛋白应在何时以及多久测量一次?各种指南一致认为,应在每次DTC常规随访时进行(hs)Tg测量的时间和频率从3个月到12个月甚至24个月不等,取决于初次诊断后的时间、初始阶段、复发和死亡的风险以及对治疗的反应。然而,当样本在手术后不久(半衰期:24-30小时)和放射性碘治疗后4个月内采集时,Tg结果不可靠。此外,血清Tg可能在放射性碘治疗后数年内持续下降,因此,治疗后Tg随时间的变化趋势比单一绝对值更有意义。此外,应始终平行测定TSH,以评估TSH刺激在随访检查中是否具有可比性;与TSH水平正常的患者相比,TSH水平低或受抑制的患者的Tg明显较低,从而影响该方法的临床敏感性。最后,还应考虑TSH受体介导的Tg刺激的其他原因。
4. 高灵敏度甲状腺球蛋白检测能否用于仅接受手术治疗的患者?根据各种指南,仅通过部分腺叶切除术足以治疗低DTC风险类别的患者。在这些患者中,hsTg的测量就像常规Tg测量一样,没有多大意义,因为可检测的Tg浓度在很大程度上取决于剩余的甲状腺叶体积、当前的碘状态和TSH浓度。Park等人的研究表明,在这些患者中,Tg的增加并不能预测复发。此外,最近一项包括2455名患者的文献荟萃分析并不支持用血清Tg水平来监测接受部分腺叶切除术的低风险DTC患者。因此,对接受部分腺叶切除术患者的随访最好基于定期颈部超声(cUS)和细针活检(如有必要)。在其他中低风险病例中,现在一些指南建议不要在甲状腺全切除术后进行常规放射性碘治疗。一些作者探讨了甲状腺全切(接近)除术后无放射性碘治疗的Tg浓度随时间的变化。显示随着时间的推移,非复发患者的血清Tg浓度降低,复发患者的Tg水平不变或升高。虽然如此但应谨慎解读这些血清Tg结果,同时考虑TSH浓度和残余甲状腺体积。由于在低Tg水平下高度精确和可靠的hsTg分析可以更早地检测到甲状腺球蛋白升高的趋势。
5. 使用高灵敏度甲状腺球蛋白检测能代替TSH刺激试验吗?“TSH刺激的Tg结果阴性,在没有其他疾病复发的证据下,预示着DTC复发的风险非常低,即使使用灵敏度为0.4至1ug/L的方法难以测试到Tg,他的潜在优势也受到质疑。基础血清hsTg测量在DTC患者随访中的诊断性能也已得到广泛评估。在一项文献系统综述和荟萃分析中,乔瓦内拉等人证明基于hsTg<0.1ug/L的阴性预测值(NPV)为97%-99%。进一步的研究也证实了hsTg分析的较高NPV(至少为95%)。值得注意的是,最近的一项系统综述证实了非刺激hsTg在诊断(a)和预后(b)方面的NPV分别99.4%(95% CI98.9-99.9)99.4%(95% CI为98.8-100)。此外,rhTSH刺激的Tg的PPV高于1-2ug/L,相当于未刺激的hsTg<0.10-0.20ug/L,从而明确地指示hsTg测量的一个巨大优点,即在大多数患者中甲状腺球蛋白测量无需TSH的刺激。然而,一些作者强调hsTg的较低特异性和PPV,主张对非刺激的hsTg值在0.1-0.2和1ug/L之间的患者再进行rhTSH试验。然而,应考虑最低可检测的基础Tg值(即,值在0.1和1ug/L之间)与疾病复发或癌症死亡率的风险无显著相关。此外,在非刺激的患者中未检测到组织复发。此外,ZPhel等人表明,hsTg值降低或稳定与无器质性疾病迹象相关,而hsTg值升高与器质性疾病复发相关,因此,再行rhTSH刺激的临床意义值得可疑。只有hsTg值升高才需要进一步的诊断评估,这在许多研究中得到验证,并从其他类型癌症中得到同样结论。即使如此,使用超声进行成像也可能仅在Tg水平高于≥1ug/L时具有临床意义。更复杂的成像可用于甲状腺球蛋白倍增时间较短和/或器质性疾病的患者。
6. 在TgAb存在的情况下,能否推荐使用高灵敏度的甲状腺球蛋白测定?直到最近,TgAb的存在使得临床上Tg测量难以完成。近年来,hsTg检测的出现使得非常低浓度的Tg的检测成为可能。继而新的研究问世并评估了hsTg在TgAb阳性患者中的诊断潜力。McGrath及其同事在2015年比较了hsTg与常规Tg检测的实用性,并评估血清TgAb阳性对甲状腺球蛋白检测的影响。在3019例样本中,大多数为TgAb阴性(87%),48%的TgAb阴性样本血清Tg也阴性,表明取样时处于健康状态。值得注意的是,26%(n=104)的TgAb阳性样本在hsTg检测中Tg为阳性,但在常规Tg检测中为阴性,这些样本中的62.5%(n=65)存在临床相关复发或转移疾病。Trimboli和他的同事在2017年使用ROCHE Elecsys(CH)、BRAHMSKryptor(D)和BECKMANCOULTERAccess(US)分析系统测量的hsTg,即使存在TgAb也能够区分无病患者和有病患者。值得注意的是,在有TgAb和无TgAb的患者中,ROC曲线优化的临床阈值不同,后者分别较低(Elecsys:0.43vs0.12µg/L,Kryptor®:0.31vs0.15µg/L,Access®0.26vs0.20µg/L)。重要的是,在所有试验中,hsTg诊断截点都高于各自的LOQ值。最后,乔瓦内拉和他的同事评估了一个具有多重风险特征的DTC人群(n=798),使用BRAHMS Kryptor平台处理了1120个样本。甲状腺球蛋白在0.31pg/L和0.15pg/L的截点分别来自于TgAb阴性和TgAb阳性患者的ROC曲线分析,健康群体中检测不到高度敏感的甲状腺球蛋白,TgAb阳性(n=212)和TgAb阴性(n=796)患者结果没有差异.112例有器质性病变的患者中有16例(14%)出现TgAb阳性。这16名患者中有14名(87%)检测到未刺激的hsTg水平;只有两名颈部淋巴结转移量小且TgAb浓度显著升高的患者检测不到hsTg。总之,现有文献表明,即使Tg浓度的定量测量受到TgAb的不利影响,根据TgAb阳性或阴性结果对Tg测量进行定性评估是可行的。这仍需要进一步的研究来证实,总之,目前可用的数据表明,在随访期间DTC与TgAb测量的相关性降低,因为hsTg测定在大多数TgAb阳性患者中提供了足够有用的信息。尽管如此,在积累更多的证据之前,为稳妥而建议在评估hsTg的同时测量TgAb似乎是合理的。
7. TgAb浓度的测量可以用作“替代肿瘤标记物”吗?并未证明血清中TgAb的存在与总体预后确切相关。但发现TgAb浓度下降与甲状腺组织存量之间存在显著相关性。Won等人把TgAb阳性患者分为三个组:TgAb浓度下降至低于基线的50%,预后良好(即无复发);TgAb浓度下降0%-50%,无病存活率约为80%,TgAb水平上升,无病存活率为55%。这一点后来在大量研究中得到证实;最近的文献荟萃分析发现,持续和/或增加的TgAb浓度使癌症持续/复发的风险增加9.9倍,癌症死亡率比TgAb浓度下降的风险高15.2倍。斯潘塞和他的同事也对这一课题进行了广泛的文献综述得出类似的结论,即TgAb水平的变化趋势可以作为预后预测因素。尽管TgAb不能被视为“严格意义上的”肿瘤标志物,因为TgAb的血清浓度与患者的肿瘤负荷没有直接关系,但TgAb趋势仍可用于评估患者的顽固性/复发性疾病风险。
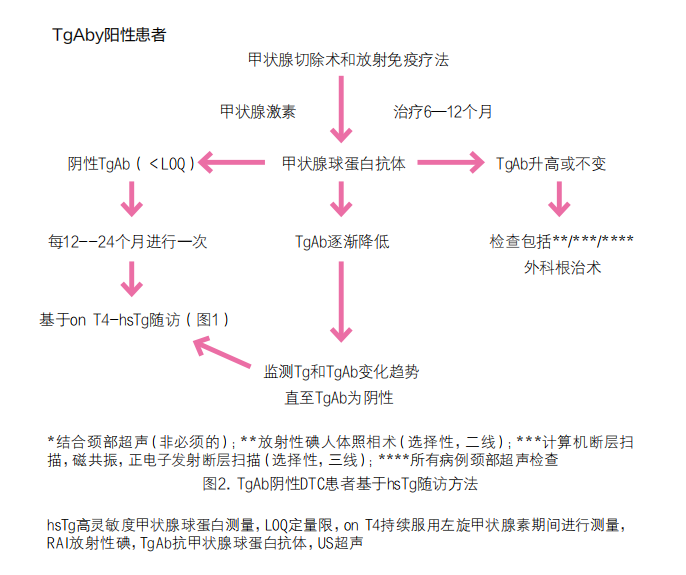
8. TgAb阳性患者适合随访方式是什么?当使用hsTg分析时,可以结合TgAb变化趋势对顽固性或复发性疾病的风险进行分层。当hsTg无法检测时,TgAb变化趋势是最适合的参数。应定期进行颈部超声检查,在特殊情况下,如侵袭性变异,尽管存有争议,仍可考虑诊断性放射性碘全身闪烁扫描(dxWBS)。特别是在dxWBS阴性的情况下,F-氟脱氧葡萄糖(FDG)正电子发射断层扫描/计算机断层扫描(PET/CT)也可应用。在该指南实施之前,应根据各种癌症特征、当地临床诊疗方案和患者意愿实施个性化诊断方法。
(1)TgAb浓度逐步降低:假设这些患者病情得到缓解,随访可能不太积极(即TgAb连续监测),尤其是如果TgAb水平显著下降(约50%或更多)。一旦检测不到TgAb浓度,应根据指南建议进行进一步随访。这也明确包括一旦TgAb消失,Tg水平变得可检测的患者,对此指南明确了其处理方案。
(2)TgAb浓度稳定和上升:这种情况,特别是当显著上升时,很可能存在顽固性/复发性疾病。对此常规的颈部超声检查应该通过上述的其他诊断程序和后续适当的治疗措施进行修正。
(3)随访期间新发TgAb阳性:TgAb阴性的DTC患者在随访期间可能新发阳性的可能,但在大多数情况下似乎没有影响。然而,对于持续阳性的患者,需要进行诊断检查。
(4)TgAb阳性的分化型甲状腺微小癌患者:这里仅对部分腺叶切除术而言,患者将有相当大的甲状腺残留,采用TgAb浓度的随访不可靠。由于在这种情况下(几乎)所有复发的疾病都是通过超声检测到的,因此理论上不支持TgAb阴性的微小癌患者进行更精细或额外的治疗和随访。
9. 当高灵敏度甲状腺球蛋白无法检测时,应如何治疗患者?目前,大多数hsTg只能在较大的、相对昂贵的自动化实验室分析平台上使用。这意味着这种分析很难普及。这不仅在发展中国家,而且欧洲或美国的小型医疗机构,出于自身的需要只在本部进行Tg检测,而不是将样本送到第三方实验室进行测量。而从随访质量的角度来看,应该尽一切努力开展hsTg方法检测或将样品送到第三方实验室来测量hsTg。尽管无条件测量hsTg的情况下,使得本文件中的任何建议都形同虚设,但现有的国际指南仍然主要基于发展中国家经济情况建议常规Tg分析。因此,如果hsTg无法测量,应遵循现有指南。
结论:hsTg测量进一步提升了检验医学在DTC随访中的重要性。然而,关于hsTg检测结果的测量和解释,需要考虑许多因素。此外,需要评估和考虑主要干扰源,尤其是TgAb,并在必要时采取适当的措施。为此,在当前指南对临床实践不能提供足够指导时,国际DTC专家小组制定了53项与hsTg和TgAb测量相关的专家处理建议。
(参考文献略)
本文编译自:欧洲内分泌学杂志,2023,(189):2,R11-R27.




