
Investigación científica
Genética para una medicina personal
Los expertos reunidos en el Desayuno A TU SALUD expusieron las últimas novedades en este campo: saber si un medicamento será eficaz y conocer la predisposición a sufrir una u otra enfermedad
Se cumplen diez años de la primera publicación del genoma humano en las revistas de mayor impacto científico como «Nature» y «Science». Una década en la que se ha intentado desgranar todos los beneficios que éste tiene para la salud. De hecho, en la actualidad ya se han secuenciado más de 2.600 genomas virales, 2.800 bacterias, 40 células superiores... Y es sólo el comienzo, pues otras 1.100 están en proceso de secuenciación. Los principales objetivos: el diagnóstico precoz, la identificación de individuos y la denominada farmacogenómica.
De todas estas áreas de aplicación se habló en el desayuno informativo A TU SALUD. Porque cada vez son más las personas que quieren y pueden conocer su riesgo de ser obesos, de sufrir un envejecimiento prematuro, cuáles son sus mecanismos de defensa frente al estrés o las probabilidades de una muerte súbita.
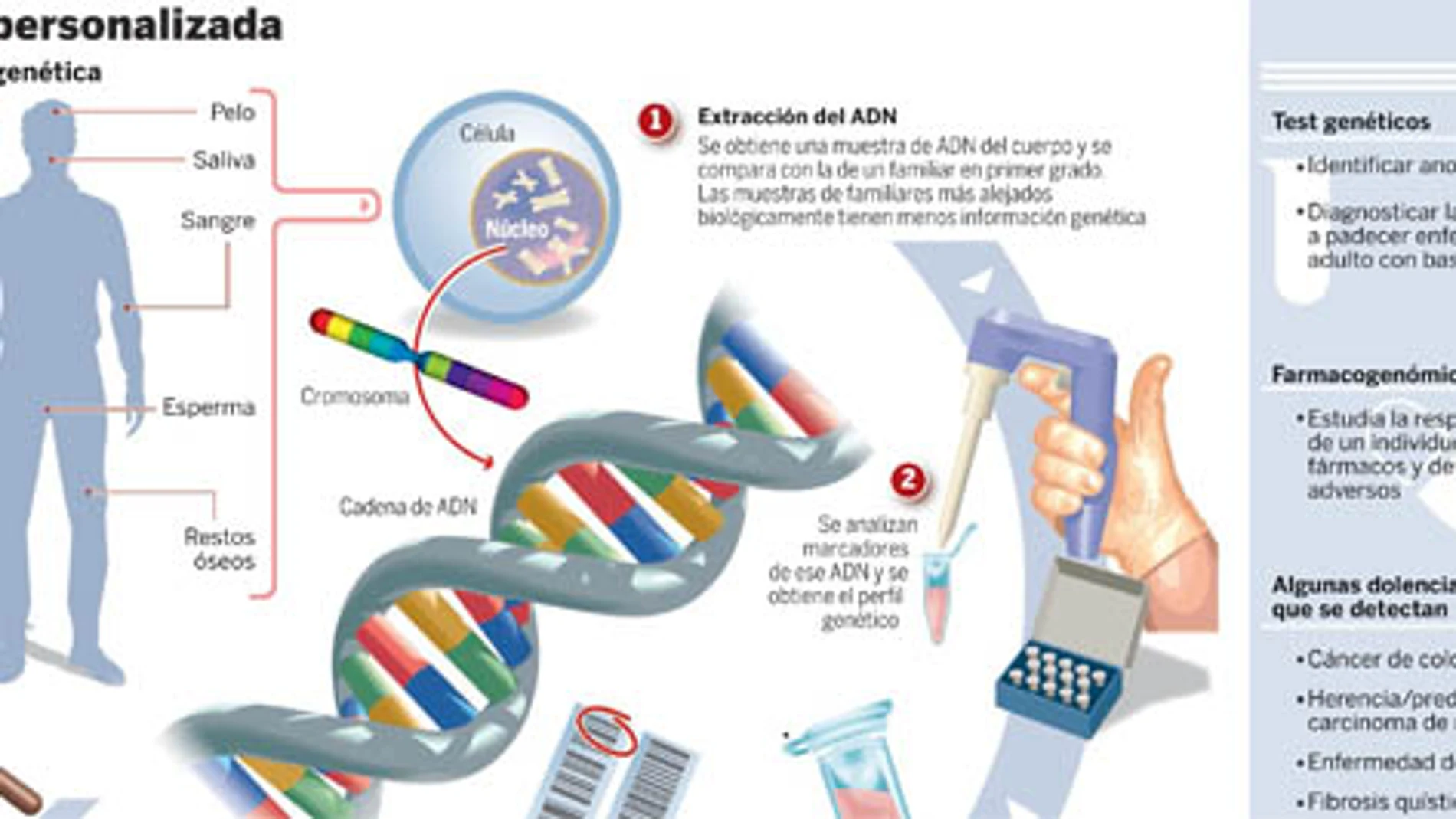
Otras de las desenmascaradas son las enfermedades hereditarias. Cáncer de mama, de ovario, enfermedades raras, males neurodegenerativos como el alzhéimer, fibrosis quística, enfermedad de Huntington o cáncer de colon son sólo algunas dolencias genéticas de una larga lista. Y todo mediante un test genético que ayuda a identificar si existe una mutación en un gen o cromosoma. No obstante, los expertos dejan claro que casi siempre se trabaja con probabilidades, nunca con certezas.
Rosario Cospedal, directora general de Genómica, explica que «además, tienen gran utilidad en el diagnóstico y la predicción de respuesta a un tratamiento determinado». Especialmente en oncología. «Cada vez se utiliza más la genómica aplicada. Los test de detección de virus o mutaciones que pueden provocar el desarrollo posterior de un cáncer, está dando sus frutos», añade Cospedal. Es aquí donde entra en juego la denominada farmacogenómica, que se ha convertido en el reto de la farmacología de este siglo. Se trata de conseguir un fármaco adaptado a cada individuo y saber si a priori va a ser eficaz.
Para Miguel Vega, director general de Allinky Biopharma, «la variabilidad en la respuesta a los fármacos está en las variaciones genéticas entre los pacientes, en concreto en los genes implicados en el metabolismo de medicamentos o en otros cuyas proteínas codificadas interaccionan con la actividad del fármaco». Vega añade que «la aplicación de la farmacogenómica en el sistema sanitario podría contribuir a la reducción de costes totales a medio plazo, principalmente por la reducción de los costes asociados a la administración de un fármaco o a una dosis no adecuados».
No obstante, todo esto no sería posible sin la inversión en la tecnología más puntera. «Contamos con una gran tecnología con el fin de empujar nuevas aplicaciones y generar kits de diagnóstico», aclara Félix Risco, director de Tecnología e Innovación de Genómica. Así trabajan también en la compañía Sylentis, que en la actualidad está centrada en el desarrollo de fármacos basados en la tecnología de silenciamiento génico del denominado RNAi. «Entre las patologías que se están estudiando se encuentran glaucoma, dolor ocular asociado al síndrome de ojo seco, enfermedad de Crohn, enfermedades relacionadas con el sistema nervioso central (daño en la espina dorsal) y enfermedades neurodegenerativas (enfermedad de Alzheimer), así como vías de administración alternativas de estos compuestos», concluye Ana Isabel Jiménez, directora de I+D de la empresa.
Criminalística
Otro campo por el que apuestan es el de la medicina legal y forense. De hecho, Genómica trabaja con la Guardia Civil en métodos de identificación genética. Se trata de perfiles genéticos de detenidos cuyos resultados se introducen en la base de datos identificativos obtenidos a partir del ADN. De esta forma se hacen también análisis de paternidad, maternidad, huella genética para niños adoptados, etc. Un terreno en el que, según explica Antonio Sevilla, director comercial de la compañía, se ha avanzado mucho en los últimos años. «Hasta 1990 las identificaciones se hacían prácticamente por huellas dactilares. Ahora con el enorme "boom"que hay se hace por perfiles genéticos».
Y apenas tardan un día y medio en obtener los resultados. La explicación del proceso es sencilla. Basta una muestra de pelo, saliva, sangre, esperma o restos óseos de los que se extrae el ADN. Posteriormente se amplifica un número determinado de marcadores genéticos que están distribuidos en diferentes regiones cromosómicas del genoma. Una vez detectados, se obtienen los perfiles genéticos de las personas del estudio, se comparan y valoran. Cospedal matiza que «en ocasiones si para hacerse la prueba no acuden con el familiar directos, sino, por ejemplo, con un primo segundo, la probabilidad no va a superar el 50 por ciento, por lo que no merece la pena realizar la prueba y se le comunica al paciente. No ocurre así en casos como el virus del papiloma humano, por ejemplo. En estos casos sí es aconsejable».
Sin embargo, tantas posibilidades como ofrecen los genes han hecho aflorar los negocios fraudulentos por parte de quienes sólo desean enriquecerse. Un ejemplo claro son los test que afirman que pueden detectar el riesgo de sufrir esquizofrenia, una dolencia de la que, a día de hoy, no existe evidencia cientifica de su vinculación con ciertos genes. Por este motivo, los expertos reunidos señalan la necesidad de contar con una regulación más estricta y potente, ya que en la actualidad, «contamos con la Entidad Nacional de Acreditación (ENAC), de garantía de calidad y fiabilidad», dice Cospedal. Sevilla añade que «preferiríamos una regulación más fuerte, porque no pueden existir kits diagnósticos cuyos marcadores no estén validados».
Miguel Vega. Director General de Allinky Biopharma
«Se aplicará en oncología, psiquiatría, y diabetes, entre otras»
Los factores genéticos tienen un importante papel en gran cantidad de enfermedades comunes y su determinación tendría el potencial de proporcionar información sobre patogénesis o revelar nuevas dianas o estrategias terapéuticas. Asimismo, podrían ser útiles como biomarcadores para diagnóstico, estratificación de pacientes y categorización pronóstica o terapéutica. Así nace el concepto de medicina personalizada.
Un posible escenario para 2020 es aquel en el que la prescripción de fármacos evolucione desde el diagnóstico basado en síntomas y signos, a una prescripción dirigida y complementada con el perfil genético individual. La posibilidad de asociar un polimorfismo genético con capacidad de respuesta a un medicamento permitirá determinar el tipo de metabolismo y riesgo de toxicidad o de fracaso terapéutico, diferenciando a cada paciente como individuo «respondedor» o «no respondedor» por su perfil molecular. Las áreas terapéuticas de aplicación incluirían oncología, psiquiatría, enfermedades cardiovasculares, inflamatorias crónicas y del sistema nervioso y diabetes, entre otras. Actualmente, los estudios de asociación con SNP (Polimorfismo de nucleótido simple) de todo el genoma con chips de alta densidad de SNP son eficaces para identificar genes involucrados en enfermedades complejas. Pero también existen variaciones estructurales en el número de copias de un gen (CNV, en sus siglas en inglés), que deben ser exploradas, pues son responsables de la variabilidad genética entre individuos. El Proyecto Genoma Humano muestra que poseemos un 99,9 por ciento de homología entre nuestros genomas.
Por otra parte, se espera que el avance en el conocimiento de marcadores validados permita identificar a aquellos que se relacionen con la predisposición a padecer ciertas dolencias, por lo que será posible desarrollar test de predicción de riesgo.
Rosario Cospedal. Directora general de genómica
«La farmacogenómica es la medicina personalizada»
Somos una empresa enfocada al sistema sanitario, aunque es verdad que la genómica se puede utilizar en otros campos, como medio ambiente, alimentación, etc. De ella resaltaría la importancia del diagnóstico precoz. Éste es fundamental para diagnosticar enfermedades correctamente y a tiempo. Esto evitaría muchas veces una patología y, sobre todo, ayudaría al médico sobre qué tratamiento hay que tomar. En el caso de una infección gastrointestinal, por ejemplo, en la que no se sabe qué bacteria está provocando la enfermedad y el médico no sabe qué tratamiento utilizar, un diagnóstico ajustado y específico puede orientar al especialista en ese momento. La farmacogenómica es la medicina personalizada. Los análisis genéticos son fundamentales para desarrollar fármacos a medida. Lo que hace la genómica funcional y la medicina personalizada es detectar qué pacientes tienen ciertas mutaciones que les va hacer responder o no al tratamiento. La idea es que la medicina esté cada vez más ajustada al perfil genético del individuo. En Genómica hemos sido pioneros en algunas tecnologías de ADN, de huella genética y de identificación de individuos. Destacaría el papel que tiene esta disciplina en el análisis de parentesco y huellas genéticas, muy importantes en la identificación de personas en la lucha contra el crimen o en la identificación de niños adoptados, por si en algún momento ocurriera un desastre o una desgracia se les podría identificar, de manera que una huella de una niño adoptado se podría ligar a la huella de su padre adoptivo. Hasta ahora no hemos sido conscientes, pero esto nos puede ayudar a resolver casos muy desagradables o realmente duros, y tener ese ADN identificado nos lo puede facilitar.
Ana Isabel Jiménez. Directora I+D de Sylentis
«La tecnología RNAi "silencia"los genes afectados»
Uno de los avances más importantes en la biología de las últimas décadas ha sido el descubrimiento de moléculas de RNA que regulan la expresión de genes. La principal función es como parte de la maquinaria de producción de proteínas. Los RNA mensajeros (mRNA) son intermediarios en la expresión de genes, transmitiendo información entre el DNA y la maquinaria de síntesis de proteínas.
La interferencia por RNA tiene gran importancia en el desarrollo y la diferenciación celular, cáncer y defensa frente a virus. Actualmente numerosas técnicas de biología molecular empleadas en investigación básica y terapia se basan en este proceso. Y es que estas moléculas de RNA interferente pueden ser siRNA (Small Interfering RNA) o microRNA según su procedencia. El siRNA es una herramienta inestimable en el estudio de las funciones de los genes, en la validación de las dianas terapéuticas, en el estudio del mecanismo de acción de medicamentos o como terapia para enfermedades de origen genético. Esta tecnología ofrece nuevas oportunidades en el desarrollo de fármacos, siendo de gran utilidad en el diseño de nuevos productos y en la validación de dianas terapéuticas en desarrollo.
El mercado potencial de esta tecnología está creciendo y las primeras terapias basadas en esta tecnología están en fases clínicas avanzadas. Las ventajas que ofrece frente a los fármacos actuales convierten al RNAi en una tecnología prometedora. Estas ventajas incluyen la capacidad de actuar a muy bajas concentraciones, mayor duración del efecto asociada a su mecanismo de acción, alta selectividad y la posibilidad de diseñar terapias para numerosas dianas, incluyendo las intracelulares. Además, ha demostrado ser muy eficiente para reducir la expresión de un gen y determinar el mecanismo de acción de fármacos.
✕
Accede a tu cuenta para comentar


