1. INTRODUCTION
L'épaule est l'une des applications les plus courantes de l'échographie musculo-squelettique en raison de la forte incidence des troubles de la coiffe des rotateurs liés à l'augmentation du vieillissement et des activités sportives. De nombreux articles traitant de la technique d'échographie des tendons de la coiffe des rotateurs ont déjà été publiés dans la littérature radiologique, rhumatologique et orthopédique et l'échographie est maintenant largement reconnue comme un moyen précis d'évaluer la maladie de la coiffe des rotateurs (Ptasznik 2001 ; Bouffard et al. 2000 ; Brasseur et al. 2000; Thain et Adler 1999; Bretzke et al. 1985; Collins et al. 1987; Crass et al. 1985; Hall 1986; Middleton et al. 1984; Middleton et al. 1986b; Mack et al. 1988a; Middleton 1989 ; Seibold et al. 1999 ; Teefey et al. 2000 ; Naredo et al. 2002). Avec un équipement approprié et des mains qualifiées, cette technique permet d'évaluer la pathologie de la coiffe des rotateurs avec une sensibilité et une spécificité élevées dans le diagnostic des déchirures partielles et de pleine épaisseur avec certains avantages spécifiques par rapport à l'imagerie par résonance magnétique, tels que des capacités de résolution plus élevées et la possibilité d'examiner les tissus dans des états statiques et dynamiques et avec le patient dans différentes positions.
En plus de la coiffe des rotateurs, l'intérêt est également croissant pour l'évaluation américaine d'une variété d'anomalies des structures articulaires et para-articulaires situées dans et autour de la zone de l'épaule (Martinoli et al. 2003). Ces conditions peuvent imiter cliniquement les déchirures de la coiffe des rotateurs et impliquent le plus souvent les articulations gléno-humérales et acromio-claviculaires et les structures des tissus mous autour de l'épaule, y compris les cavités articulaires, l'os et le cartilage articulaire, la bourse sous-acromiale sous-deltoïdienne, le labrum, les muscles et le nerfs suprascapulaire et axillaire. Dans ces cas, l'échographie est en mesure de rediriger le diagnostic si un examen complet de la région de l'épaule est effectué au lieu d'une simple évaluation de la coiffe des rotateurs. En outre, nous incluons dans ce chapitre un accent particulier sur l'évaluation échographique des nerfs du plexus brachial et du syndrome du défilé thoracique ainsi que sur l'évaluation échographique des tumeurs locales conduisant à un syndrome douloureux de l'épaule ou de l'omoplate.
Comme pour les autres sites du corps, une connaissance approfondie de l'anatomie, de la technique de numérisation appropriée et des résultats d'imagerie normaux est essentielle pour effectuer un examen précis de l'épaule avec US.
2. ANATOMIE CLINIQUE – ANATOMIE OSSEUSE ET ARTICULAIRE
La ceinture scapulaire est composée de l'omoplate, de la clavicule et de l'humérus proximal agissant comme une seule unité biomécanique. Trois articulations - les articulations gléno-humérale, acromio-claviculaire et sterno-claviculaire - et deux plans de glissement - le sous-acromial et le scapulo-thoracique - permettent une plus grande amplitude de mouvement dans l'épaule que ce qui est possible à toute autre articulation du corps, atteignant environ 180° dans presque toutes les directions de mouvement. Il est clair qu'un tel éventail de mobilité de l'épaule dépend de ces articulations et plans de glisse travaillant ensemble avec synchronicité, afin de permettre au bras et à la main d'être positionnés selon les besoins dans l'espace autour du corps.
3. ARTICULATION GLÉNO-HUMÉRALE
L'articulation gléno-humérale est une articulation « à rotule » composée de la fosse glénoïdienne relativement petite et plate et de la grande surface articulaire ronde de la tête humérale. (Fig. 1a, b). En raison d'un écart dans la taille et la courbure des surfaces articulaires, la cavité glénoïdienne ne couvre qu'une petite partie (environ un quart) de la tête humérale. Cette incongruité ainsi que la laxité relative de la capsule articulaire offrent une grande mobilité mais rendent l'articulation intrinsèquement instable et, par conséquent, sujette à la subluxation et à la luxation. Les surfaces articulaires de la tête humérale et de la fosse glénoïdienne sont recouvertes d'une couche de cartilage hyalin, plus épaisse en son centre dans l'humérus et plus fine sur ses bords extérieurs dans la glène. (Fig.1b). Dans l'humérus, le cartilage articulaire atteint le col anatomique, site d'attache de la capsule articulaire. Étroitement attaché à sa base à la périphérie de la glène, un rebord concentrique de fibrocartilage, le labrum, élargit et approfondit la concavité peu profonde de la glène osseuse, procurant à l'articulation une stabilité inhérente et limitant les excursions antérieures et postérieures de l'humérus. Semblable au ménisque du genou, le labrum glénoïdien a une forme triangulaire et est en continuité directe avec le cartilage hyalin de la cavité glénoïdienne (Fig.1b).
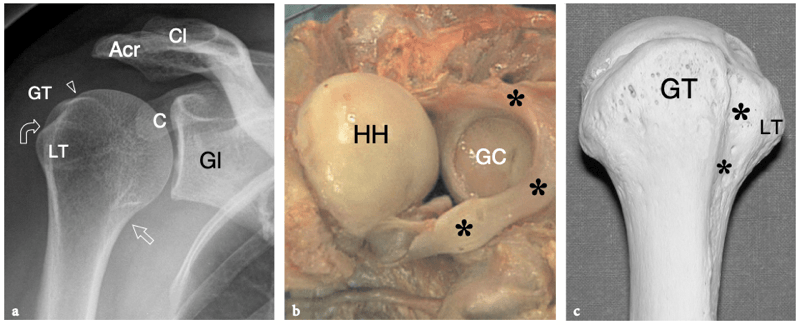
Fig. 1a–c. Anatomie articulaire glénohumérale. une radiographie tangentielle de face de l'épaule avec rotation externe du bras permet un bilan panoramique de l'articulation gléno-humérale et de l'espace sous-acromial. La surface articulaire convexe de la tête humérale se termine au col huméral (tête de flèche), où commence la grande tubérosité (GT). Notez la proéminence de la petite tubérosité (LT) et du sillon bicipital (flèche courbe). L'acromion (Acr) et la clavicule (Cl) sont placés sur la face crânienne de la tête humérale, tandis que le processus coracoïde (C) se trouve sur sa face médiale. Gl, glène osseuse ; flèche droite, col chirurgical de l'humérus. b Une vue cadavérique brute de l'épaule après ouverture et dissection de l'articulation gléno-humérale montre la plus grande tête humérale convexe (HH) et la plus petite cavité glénoïde concave (GC). Les deux semblent lisses et brillants en raison de la couverture cartilagineuse. La cavité glénoïdienne est entourée d'un labrum fibrocartilagineux épais (astérisques) pour assurer la stabilité de l'articulation. c La photographie de l'humérus proximal montre la montée des tubérosités grande (GT) et petite (LT) lorsqu'elles se renflent de chaque côté du sillon bicipital (astérisques).
Une capsule fibreuse lâche enveloppe l'articulation, s'étendant de la base de la coracoïde à travers la région supraglénoïde crânialement, sur le col anatomique de l'humérus latéralement, et dans le labrum en arrière et en bas, tandis que son insertion antérieure est variable et plus complexe. Sur la base de sa relation avec le labrum glénoïdien, on peut trouver trois types d'insertion capsulaire antérieure : le type 1, se fixant directement sur le labrum ; type 2, s'insérant plus médialement le long du col scapulaire, mais à moins de 1 cm du labrum ; type 3, à plus de 1 cm médialement du labrum. Avec le bras en position neutre, la partie inférieure de la capsule est relâchée et redondante et forme le récessus axillaire de l'articulation. La capsule de l'articulation gléno-humérale est investie par la membrane synoviale sur sa surface profonde et recouvre certaines structures intracapsulaires des tissus mous, dont le long chef du tendon du biceps. Plusieurs zones de la capsule sont renforcées par des ligaments. Ce sont le ligament coracohuméral et les ligaments glénohuméraux supérieur, moyen et inférieur. Le ligament coraco-huméral est une forte bande de tissu fibreux issue de la coracoïde et s'insérant sur les grandes et petites tubérosités pour renforcer la capsule lors de son passage sur la partie intra-articulaire du biceps. Les ligaments glénohuméraux s'étendent du bord antérieur de la cavité glénoïde à la petite tubérosité et agissent comme un frein à la rotation externe et à la translation antérieure de la tête humérale. La capsule de l'articulation gléno-humérale possède deux ouvertures pour le passage du tendon du biceps au-delà des tubérosités humérales et pour la communication avec le récessus sous-scapulaire.
Cet évidement communique avec l'articulation par une ouverture de la capsule fibreuse située entre les ligaments gléno-huméraux supérieur et moyen (évidement sous-scapulaire supérieur) ou entre les ligaments gléno-huméraux moyen et inférieur (évidement sous-scapulaire inférieur). Cet évidement sous-scapulaire supérieur est un petit évidement en forme de selle de l'articulation gléno-humérale qui recouvre le tendon sous-scapulaire. Il est situé en relation étroite avec la racine de la coracoïde et joue un rôle de protection du tendon sous-scapulaire lors du glissement sur le col scapulaire. L'évidement sous-scapulaire inférieur fait saillie entre les ligaments gléno-huméral moyen et inférieur et est situé en profondeur du muscle sous-scapulaire en raison de sa position plus inférieure (Petersilge et al. 1993). En résumé, la cavité articulaire gléno-humérale antérieure a trois extensions principales : la gaine du tendon du biceps en avant, le récessus sous-scapulaire en dedans et la poche axillaire en bas. (Fig. 2).
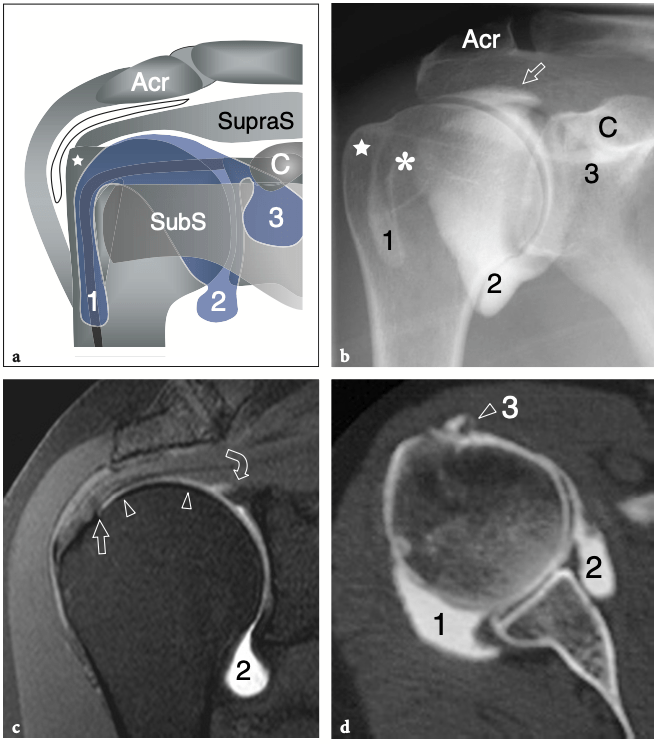
Fig. 2a–d. Cavité articulaire glénohumérale. a Le dessin schématique d'une vue antérieure à travers l'épaule montre l'extension de la cavité articulaire gléno-humérale (en bleu). Observez les trois principaux évidements de l'articulation : la gaine du tendon du biceps (1), la poche axillaire (2) et l'évidement sous-scapulaire (3). L'évidement du sous-scapulaire s'étend sous la coracoïde (C) et superficiel par rapport au sous-scapulaire (SubS). Le tendon sus-épineux (SupraS) forme la limite crânienne de la cavité articulaire gléno-humérale. La grosse tubérosité (étoile), sur laquelle s'insère le tendon sus-épineux, n'est pas investie par l'articulation. Acr, acromion. b Après injection intra-articulaire de produit de contraste, l'arthrographie permet de mettre en évidence l'aspect lacrymal du récessus bicipital (1) s'étendant entre la grande (étoile) et la petite (astérisque) tubérosité. La poche axillaire (2) apparaît comme le plus grand récessus de l'articulation, tandis que le récessus sous-scapulaire (3) n'occupe qu'un petit espace juste profond et inférieur à la pointe de la coracoïde (C). Plus crânialement, le produit de contraste délimite la face inférieure du sus-épineux ainsi que le bourrelet glénoïdien supérieur à l'insertion du long chef du tendon du biceps. Acr, acromion. c L'IRM coronale oblique en pondération T1 après injection intra-articulaire de gadolinium montre l'extension globale de la cavité articulaire sur le plan coronal. Au plus profond du tendon sus-épineux, la cavité articulaire est délimitée par un mince rebord hyperintense (têtes de flèches) atteignant le col huméral (flèche droite). Il délimite le profil du bourrelet glénoïdien supérieur (flèche courbe) et se dilate caudalement pour former la poche axillaire (2). d Image arthro-scanner transversale de l'épaule. Après injection de produit de contraste intra-articulaire, le récessus postérieur (1), le récessus sous-scapulaire (2) et la gaine tendineuse du biceps (3) sont représentés.
4. ARTICULATION ACROMIOCLAVICULAIRE
L'articulation acromio-claviculaire est une petite articulation synoviale située entre l'extrémité médiale de l'acromion et l'extrémité latérale de la clavicule. Il a une amplitude de mouvement limitée, il y a environ 20° entre les extrêmes de la position des épaules. Les surfaces articulaires de l'acromion et de la clavicule sont recouvertes d'une couche de cartilage hyalin et sont séparées par un disque de fibrocartilage en forme de coin qui divise la cavité articulaire partiellement ou complètement. La capsule de l'articulation acromio-claviculaire est attachée aux marges articulaires et est renforcée par des ligaments supérieurs et inférieurs. Caudalement, il reçoit également des fibres du ligament coracoacromial, qui se confond avec sa face inférieure. L'articulation acromio-claviculaire est en outre stabilisée contre la luxation vers le haut de la clavicule par le ligament coraco-claviculaire, qui relie le processus coracoïde à la surface inférieure de l'extrémité latérale de la clavicule. Le ligament coraco-claviculaire est constitué de deux composants - le ligament trapézoïdal antérolatéral et le ligament conoïde postéro-médial - et prend une apparence en forme d'éventail avec sa base située crânialement. Du point de vue physiologique, l'articulation acromio-claviculaire reçoit une charge de cisaillement crânio-caudale due à l'action musculaire. Parce que les surfaces articulaires de cette articulation sont orientées obliquement, la tension appliquée conduit la clavicule à glisser et à se déplacer crânialement. Cette tendance est combattue par les ligaments coraco-claviculaires, dont les dommages permettent la proéminence supérieure typique de l'extrémité de la clavicule.
5. ARTICULATION STERNOCLAVICULAIRE
L'articulation sterno-claviculaire est la seule articulation de la ceinture scapulaire avec le thorax. C'est une articulation peu profonde en forme de selle entre le manubrium du sternum et la première côte médialement et l'extrémité médiale de la clavicule latéralement. Les surfaces articulaires du manubrium et de la clavicule sont, au moins en partie, incongruentes, celle de la clavicule étant plus large que celle du manubrium. L'articulation sternoclaviculaire abrite un disque fibrocartilagineux divisant l'espace articulaire en cavités médiales et latérales, chacune bordée de sa propre membrane synoviale. Les ligaments costoclaviculaire et interclaviculaire renforcent l'articulation et s'opposent à sa tendance à l'instabilité antéropostérieure.
6. PLAN SCAPULOTHORACIQUE
Le plan scapulothoracique sépare le corps de l'omoplate et le muscle sous-scapulaire de la surface thoracique, constitué de la face superficielle du muscle dentelé antérieur qui recouvre les côtes. Ce plan de glissement permet à l'omoplate et à la cavité glénoïdienne de s'incliner en avant et en arrière autour de la cage thoracique lors des mouvements de l'épaule. De plus, l'articulation scapulothoracique a un rôle important dans l'abduction de l'épaule.
7. MUSCLES ET TENDONS
Du point de vue anatomique, les muscles de l'épaule peuvent être subdivisés en deux groupes principaux : les muscles intrinsèques (subscapularis, supraspinatus, infraspinatus, teres minor, teres major et deltoïde), qui naissent et s'insèrent sur le squelette du membre supérieur, et les muscles extrinsèques, qui relient le membre supérieur à la colonne vertébrale (trapèze, grand dorsal, releveur de l'omoplate et rhomboïde) ou à la paroi thoracique (dentelé antérieur, petit pectoral et grand pectoral). La pertinence clinique est majoritairement liée aux muscles intrinsèques et notamment aux muscles et tendons de la coiffe des rotateurs.
8. COIFFE DES ROTATEURS
Il existe quatre muscles de la coiffe des rotateurs : le sous-scapulaire, situé sur la face antérieure de l'épaule ; le sus-épineux, qui se trouve sur sa face supérieure ; et l'infraspinatus et le teres minor, qui sont situés sur l'épaule postérieure (Fig. 3). Ils naissent des faces antérieure et postérieure de l'omoplate. Le muscle sous-scapulaire tire son origine de la face antérieure du corps de l'omoplate. Le ventre musculaire donne naissance à une série de deux ou trois tendons intramusculaires qui se dirigent latéralement pour se rejoindre pour former le tendon sous-scapulaire. (Fig. 4). Ce tendon s'insère sur le tubercule mineur en une large bande et joue le rôle d'adducteur et de rotateur interne du bras. Ses fibres les plus crâniennes sont de localisation intra-articulaire et certaines de ses fibres superficielles recouvrent le sillon bicipital et atteignent la grosse tubérosité, fusionnant avec le ligament coracohuméral et transverse huméral. Le muscle sus-épineux prend naissance dans la fosse supra-épineuse de l'omoplate et passe sous l'acromion et au-dessus de l'articulation gléno-humérale avant de s'insérer sur la face supérieure de la grosse tubérosité. (Illustration 5a). Il est séparé de l'acromion, du ligament coracoacromial et du muscle deltoïde par la bourse sous-acromio-sous-deltoïdienne. Des études anatomiques indiquent que le sus-épineux est constitué de deux parties distinctes : ventrale et dorsale (Fig.5b) (Vahlensieck et al. 1994). La partie ventrale prend son origine dans la fosse supra-épineuse antérieure et s'insère en avant sur la grosse tubérosité pour agir comme un rotateur interne du bras. Cette portion ventrale peut avoir un site accessoire d'insertion sur le tubercule mineur. La partie dorsale du sus-épineux se trouve plus en arrière, avec des fibres musculaires provenant de la face postérieure de la fosse supra-épineuse et de la colonne vertébrale de l'omoplate, en supposant une configuration en forme de sangle composée de plusieurs petits feuillets tendineux qui fusionnent en une large attache s'insérant plus en arrière. sur le tubercule majeur. C'est la partie qui agit principalement comme un ravisseur d'épaule. Les différentes couches du tendon sus-épineux ont des propriétés mécaniques différentes, entraînant un cisaillement entre elles, et peuvent se tendre et se relâcher en fonction des mouvements de l'épaule. Sur l'épaule postérieure, le muscle infraspinatus provient de la fosse infraspinatus et donne naissance à un tendon large qui s'étend latéralement pour s'insérer sur le tubercule majeur, juste en arrière et en dessous du tendon supraspinatus (Fig. 6). Le muscle petit rond, le plus petit muscle de la coiffe des rotateurs, a un trajet plus oblique que celui de l'infraspinatus. Ce dernier muscle provient d'une bande étroite sur le bord latéral de l'omoplate et s'insère juste en arrière et en dessous de l'infraspinatus dans le segment le plus caudal de la grosse tubérosité. (Fig. 6). Les muscles postérieurs infraspinatus et teres minor agissent comme des rotateurs externes du bras.
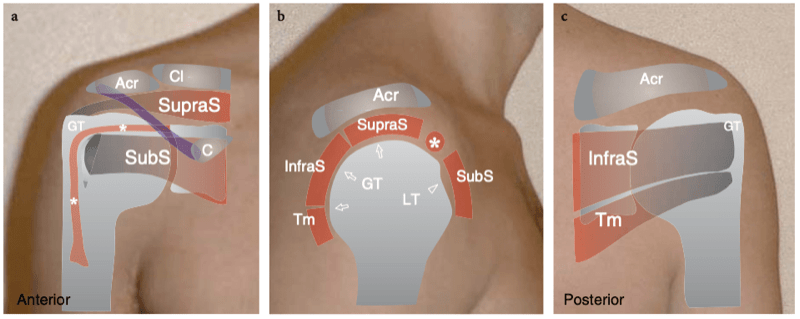
Fig. 3a–c. Images en projection des muscles et des tendons de la coiffe des rotateurs vus dans une vue antérieure (a), latérale (b) et postérieure (c) de l'épaule. Notez la relation entre le sus-épineux (SupraS), le sous-scapulaire (SubS), l'infraspinatus (InfraS), le petit rond (Tm) et la longue tête du tendon du biceps (astérisque) avec les principaux repères osseux palpables de l'épaule, y compris l'acromion (Acr ), la clavicule (Cl), la grosse tubérosité (GT), la petite tubérosité (LT) et l'apophyse coracoïde (C). Le ligament coracoacromial est représenté par une bande bleue recouvrant le biceps et le sus-épineux.
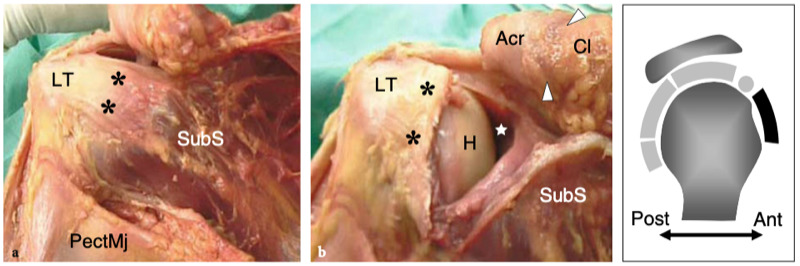
Figures 4a,b. Anatomie du sous-scapulaire. a Vue cadavérique brute à travers la face antérieure de l'épaule après ablation du muscle deltoïde. Le ventre musculaire du sous-scapulaire (SubS) a une origine large à partir de la fosse antérieure de l'omoplate et converge en un tendon plat et large (astérisques) qui s'insère sur la petite tubérosité (LT). Plus caudalement, un autre tendon large, celui du grand pectoral (PectMj), est parallèle au trajet du sous-scapulaire en s'insérant sur le glissement latéral du sillon intertuberculaire. b La vue cadavérique brute du même spécimen montrée en a après ablation de la jonction myotendineuse du sous-scapulaire montre une partie de la tête humérale (H) recouverte de cartilage et la cavité articulaire glénohumérale (étoile). Remarquez l'articulation acromio-claviculaire serrée (têtes de flèches) délimitée entre l'acromion (Acr) et l'extrémité claviculaire (Cl). Le dessin sur le côté droit de la figure indique la position du sous-scapulaire (en noir) par rapport aux autres tendons de la coiffe et au biceps (en gris) comme on le voit sur une vue latérale à travers l'épaule.
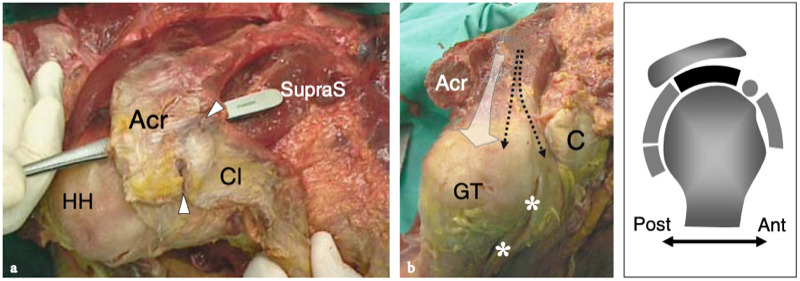
Figures 5a,b. Anatomie sus-épineuse. a Vue cadavérique brute à travers la face crânienne de l'épaule après ablation des muscles trapèze et deltoïde. L'origine du muscle sus-épineux (SupraS) de la fosse supra-épineuse de l'omoplate est affichée. Le muscle sus-épineux traverse l'espace sous-acromial en passant sous l'articulation acromio-claviculaire (têtes de flèches) pour converger, au-dessus de la tête humérale (HH), en un tendon fort qui s'insère dans la face crânienne de la grosse tubérosité. Observez l'orientation de l'acromion (Acr) et de la clavicule (Cl) par rapport au grand axe du sus-épineux. b Vue cadavérique brute par la face latérale de l'épaule après ablation du trapèze, du deltoïde et des structures formant l'articulation acromio-claviculaire. Le sus-épineux est représenté dans son grand axe. Le tendon se compose d'une partie antérieure plus petite (flèches en pointillés) et d'une partie postérieure plus grande (grande flèche). Les deux s'insèrent dans le trochiter (GT). Certaines fibres de la partie antérieure du sus-épineux peuvent même s'insérer dans le petit tubercule après avoir traversé l'intervalle et le tendon du biceps (astérisque). Notez l'acromion (Acr) et la coracoïde (C) de chaque côté du sus-épineux. Le dessin sur le côté droit de la figure indique la position du sus-épineux (en noir) par rapport aux autres tendons de la coiffe et au biceps (en gris) comme on le voit sur une vue latérale à travers l'épaule.
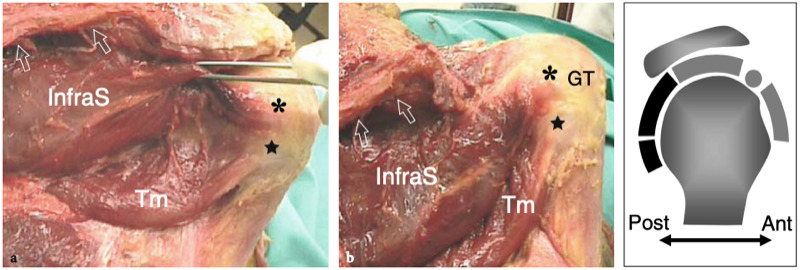
Figures 6a,b. Anatomie du sous-épineux et du petit rond. a,b Une vue cadavérique brute à travers la face postérieure de l'épaule après l'ablation du muscle deltoïde illustre l'origine distincte des muscles crânien infraspinatus (InfraS) et caudal teres minor (Tm) de la fosse sous-épineuse de l'omoplate. Ces muscles convergent pour s'insérer sur la face postérieure du trochiter (GT) par l'intermédiaire de deux tendons distincts (astérisque, sous-épineux ; étoile, petit rond). Crânien à eux, notez la position de l'épine scapulaire (flèches). Le dessin sur le côté droit de la figure indique la position de l'infraspinatus et du teres minor (en noir) par rapport aux autres tendons de la coiffe et au biceps (en gris) comme on le voit sur une vue latérale à travers l'épaule.
Considérés dans leur ensemble, les tendons des muscles de la coiffe des rotateurs sont larges et relativement plats, un peu semblables à des ceintures, et convergent vers la petite et la grande tubérosité pour créer une coiffe - communément appelée « coiffe des rotateurs » - qui recouvre l'humérus. tête en avant, en haut et en arrière (Fig. 7). Le tendon du sous-scapulaire est séparé des autres tendons de la coiffe des rotateurs par le complexe ligamenteux de l'intervalle des rotateurs et le tendon du long chef du biceps, qui se positionne entre lui et le sus-épineux. Les tendons de la coiffe des rotateurs ont une relation constante dans les différentes positions de l'humérus et, du fait de leur activité combinée, jouent un rôle important de stabilisateurs de la tête humérale dans la fosse glénoïdienne lors des mouvements du bras (pour cette raison, le les tendons de la coiffe des rotateurs sont également appelés « ligaments actifs »). L'abduction du bras lorsque l'humérus est maintenu près du côté du corps, par exemple, est principalement accomplie par la contraction du muscle deltoïde, mais la force de ce muscle est également dirigée vers le crâne, de sorte que la tête humérale se déplacerait vers le haut. . L'action combinée du sus-épineux, qui suit une force vectorielle plus horizontale que le deltoïde, redirige la tête humérale dans la cavité glénoïdienne, contrecarrant ainsi la tendance à la translation supérieure de la tête humérale.
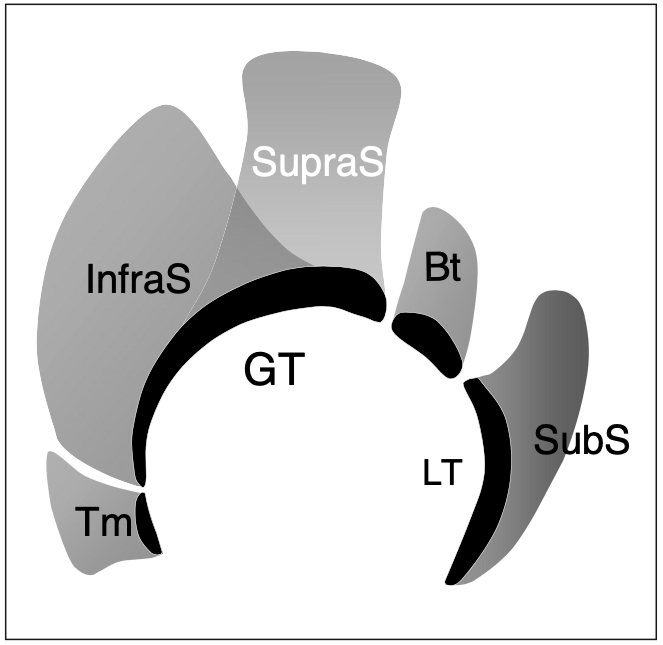
Fig. 7. Anatomie de la coiffe des rotateurs. Le dessin schématique d'une vue en perspective à travers la tête humérale illustre les tendons de la coiffe des rotateurs et le biceps lorsqu'ils se rapprochent des grandes (GT) et des petites (LT) tubérosités. Ces tendons sont relativement plats et forment un capuchon recouvrant la majeure partie de la circonférence de la tête humérale. Le sus-épineux (SupraS) et l'infraspinatus (InfraS) se rejoignent pour former un continuum de fibres s'insérant dans le tubercule majeur. Le tendon du petit rond (Tm) est étroitement apposé au bord inférieur de l'infraspinatus, tandis que le subscapularis (SubS) chemine séparément des autres tendons de la coiffe en raison de l'interposition du tendon du biceps (Bt) entre lui et le supraspinatus.
9. INTERVALLE BICEPS ET COIFFE DES ROTATEURS
Les tendons sous-scapulaire et supra-épineux sont séparés par un espace libre, communément appelé « intervalle de la coiffe des rotateurs ». Cet espace contient le long chef du tendon du biceps, les ligaments coraco-huméral et gléno-huméral supérieur. Le long chef du tendon du biceps prend son origine au niveau du tubercule supraglénoïdien avec des fibres provenant également de la face supérieure du bord glénoïdien, du labrum supérieur et de la capsule articulaire (Fig. 8a, b). La partie proximale de ce tendon est de localisation intra-articulaire et intra-synoviale : elle a un trajet curviligne et se réfléchit sur la face antéro-supérieure de la tête humérale, entre
les marges des tendons supraspinatus et subscapularis, pour descendre dans le sillon intertuberculaire, aussi appelé « sillon bicipital » ou « sulcus », entre la grande et la petite tubérosité (Cone et al. 1983) (Fig.8c). Le long de son parcours au-dessus de la tête humérale, le tendon du biceps a une section ovale, alors qu'il s'arrondit caudalement. Dans le sillon bicipital, le tendon du biceps est investi par une gaine synoviale dans le prolongement de la muqueuse synoviale de l'articulation gléno-humérale qui s'étend jusqu'à environ 3 à 4 cm au-delà de l'extrémité distale du sillon intertuberculaire. La gaine du tendon du biceps communique avec l'articulation gléno-humérale ; par conséquent, la distension liquidienne en son sein reflète souvent une maladie articulaire sous-jacente plutôt qu'une pathologie tendineuse. Dans la gouttière bicipitale, le tendon du biceps est accompagné de la branche ascendante de l'artère circonflexe antérieure. Sous le sillon bicipital, la jonction myotendineuse du long chef du biceps est située en profondeur du tendon aplati du muscle grand pectoral, qui s'insère dans la lèvre latérale du sillon intertuberculaire. Le biceps est avant tout un puissant supinateur et fléchisseur du coude, mais il contribue également à stabiliser l'articulation gléno-humérale, comme le fait la coiffe des rotateurs, et à fléchir l'épaule.
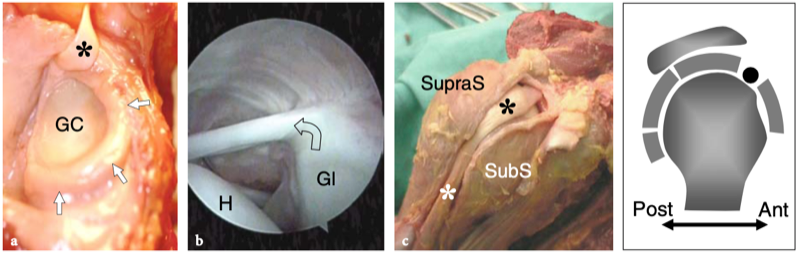
Fig. 8a–c. Tête longue de l'anatomie du tendon du biceps. une vue cadavérique grossière à travers la cavité articulaire gléno-humérale révèle la cavité glénoïde (GC) recouverte de cartilage hyalin et entourée d'un épais labrum fibrocartilagineux (flèches). Le tendon du biceps (astérisque) naît du sommet du rebord glénoïdien, en continuité avec le bourrelet glénoïdien supérieur. b Vue arthroscopique de l'articulation gléno-humérale montrant l'origine du long chef du tendon du biceps (flèche courbe) à partir de la face supérieure de la glène (Gl). H, tête humérale. c Une vue cadavérique grossière à travers l'humérus proximal montre le trajet curviligne du tendon du biceps (astérisques) lorsqu'il se reflète sur la face antéro-supérieure de la tête humérale, entre les tendons sus-épineux (SupraS) et sous-scapulaire (SubS) pour atteindre le sillon entre le tendon supérieur et la petite tubérosité, le sillon intertuberculaire. Le dessin sur le côté droit de la figure indique la position de la longue portion du tendon du biceps (en noir) par rapport aux tendons de la coiffe (en gris) comme on le voit sur une vue latérale à travers l'épaule.
Du fait de sa trajectoire curviligne et de sa réflexion sur la tête humérale, le tendon du biceps a une propension intrinsèque à se déplacer en dedans, notamment lors d'une forte contraction du muscle ou d'une rotation externe maximale. Pour résister à cette tendance, la conformation anatomique de la gouttière humérale et certains tendons et ligaments rencontrés à différents niveaux de son parcours jouent un rôle dans son maintien en bonne position. Dans l'intervalle de la coiffe des rotateurs, espace situé entre le sous-scapulaire et le tendon du sus-épineux – par lequel les arthroscopistes pénètrent dans l'articulation gléno-humérale afin d'éviter d'endommager les tendons de la coiffe – le biceps est stabilisé par une plaque fibreuse qui court au-dessus de lui et la capsule articulaire comme toit. Du superficiel au profond, cette structure de retenue se compose du ligament coracohuméral (qui s'étend jusqu'aux insertions du sous-scapulaire et du sus-épineux) et de certaines fibres du sus-épineux et du sous-scapulaire (qui sillonnent l'intervalle des rotateurs pour se fondre les unes dans les autres et s'unir à des parties de le ligament coracohuméral) (Fig. 9a, b). Des brins de tissu conjonctif lâche sont entrecoupés de ces fibres. A la face antérieure de l'intervalle des rotateurs, le chef médial du ligament coraco-huméral et le ligament gléno-huméral supérieur forment une écharpe antérieure autour du long chef du tendon du biceps qui s'insère au niveau de la petite tubérosité. Cette bande, communément appelée « poulie de réflexion », est plus flexible que la plaque fibreuse décrite ci-dessus (Weishaupt et al. 1999 ; Werner et al. 2000 ; Patton et al. 2001). Il prend une forme de croissant entourant la face antéro-médiale du tendon du biceps (Fig. 9c). Plus distalement, dans la gouttière bicipitale proximale, le tendon du biceps est en contact étroit avec le sous-scapulaire et est stabilisé par des bandes fibreuses qui en découlent. La composante superficielle de ces fibres forme le ligament huméral transverse qui, en continuité distale avec le ligament coracohuméral, relie les tubérosités transformant le sulcus du biceps en tunnel ostéofibreux. Le ligament huméral transverse est mince et faible et son rôle dans la stabilisation du biceps juste en aval de sa sortie de l'intervalle des rotateurs n'est pas considéré comme important à moins que le ligament coracohuméral ne soit déchiré (Patton et al. 2001 ; Bennett 2001).
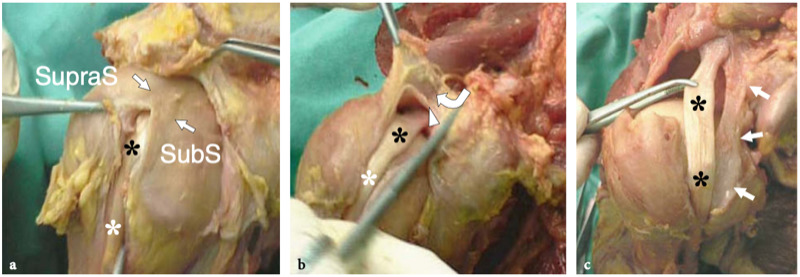
Fig. 9a–c. Anatomie de l'intervalle de la coiffe des rotateurs. Vues cadavériques brutes à travers la tête humérale. a Le long chef du tendon du biceps (astérisques) est retenu entre les tendons sus-épineux (SupraS) et sous-scapulaire (SubS) par une plaque fibreuse qui court au-dessus de lui et la capsule articulaire en toit (flèches), reflétant le ligament coraco-huméral et quelques fibres entrecroisées du sus-épineux et du sous-scapulaire. b Une dissection anatomique fine de la plaque fibreuse recouvrant le tendon du biceps (astérisques) met en évidence les fibres du ligament coraco-huméral (flèche courbe) recouvrant la capsule articulaire (tête de flèche). Notez la localisation intra-articulaire du tendon du biceps. c Au fur et à mesure que la dissection progresse avec une ablation plus importante de la capsule articulaire, le tendon du biceps (astérisques) devient visible jusqu'à son origine à partir du sommet du bord glénoïdien. Du côté médial du biceps, une bande fibreuse bien définie reflète le ligament gléno-huméral supérieur (flèches). Juste crânialement au sillon intertuberculaire, ce ligament passe profondément dans le tendon du biceps et rejoint la partie médiale du ligament coracohuméral (non représenté) pour former la poulie de réflexion.
L'autre ventre du biceps, le chef court, prend son origine à la pointe de l'apophyse coracoïde de l'omoplate, dans une localisation plus médiale que le chef long, en contact étroit avec le tendon du coracobrachial. Les ventres long et court du biceps continuent vers le bas dans deux ventres musculaires séparés qui se rejoignent juste en aval du tiers médian du bras pour former un long muscle fusiforme. Contrairement au chef long du biceps, le tendon du chef court a un trajet rectiligne et n'est pas investi par une gaine synoviale. Dans les rares cas où elle est impliquée dans une pathologie de l'épaule, celle-ci est le plus souvent lésée à la suite d'un traumatisme (c'est-à-dire d'une luxation antéro-inférieure de l'épaule) ou d'états inflammatoires.
10. MUSCLES DELTOÏDES ET EXTRINSEQUES DE L'ÉPAULE
En plus des muscles de la coiffe des rotateurs et des biceps, les muscles intrinsèques de l'épaule comprennent le grand rond et le deltoïde. Le muscle grand rond provient d'une zone ovale surélevée à la face dorsale de l'angle inférieur et du bord latéral adjacent de l'omoplate et s'insère dans la lèvre médiale du sillon intertuberculaire de la diaphyse humérale. Ce muscle agit comme un adducteur et un rotateur médial de l'humérus et joue un rôle dans la stabilisation de l'humérus proximal lors de l'abduction. Avec le tendon du grand dorsal, le grand rond fait partie de la paroi postérieure de l'aisselle. Le deltoïde est un muscle épais et puissant fourni par le nerf axillaire qui forme une sorte de toit au-dessus des tendons de la coiffe des rotateurs et de l'articulation gléno-humérale. Son nom vient du fait que sa forme ressemble à une lettre grecque inversée delta (∆). Ce muscle a une origine large du tiers latéral de la clavicule, de l'acromion et de la colonne vertébrale de l'omoplate, et s'insère sur la face antérolatérale de l'humérus au tiers moyen du bras. L'action du muscle deltoïde est multiple. En effet, il peut s'agir d'un fléchisseur et d'un rotateur médial de l'humérus avec ses fibres antérieures (en ce qu'il assiste le coracobrachial, le sous-scapulaire et le grand pectoral), d'un abducteur de l'humérus avec ses fibres médianes (assistant le sus-épineux) et d'un extenseur et rotateur latéral de l'humérus avec ses fibres postérieures (assistant les muscles infraspinatus et teres). Cependant, la fonction principale du muscle deltoïde est d'enlever l'humérus. Lorsque le sus-épineux est déchiré, l'abduction du bras devient le seul résultat d'une contraction du deltoïde, bien que la traction vers le haut du deltoïde entraîne une subluxation supérieure de la tête humérale.
Les muscles extrinsèques de l'épaule qui relient le membre supérieur à la colonne vertébrale sont le trapèze, le grand dorsal, le releveur de l'omoplate et les rhomboïdes. Parmi eux, le trapèze est le plus pertinent lors de l'examen de l'épaule avec échographie. Ce muscle est large, plat et recouvre le cou postérieur et la moitié supérieure du tronc postérieur de forme triangulaire (hypoténuse faisant face à la colonne vertébrale). Son nom vient du fait qu'il devient un trapèze lorsque les muscles des deux côtés sont considérés comme un seul muscle. Le trapèze a une large origine à partir de la protubérance occipitale externe, du ligament nuchae et des apophyses épineuses des vertèbres C7 à T12 et s'attache au tiers latéral de la clavicule, à l'acromion et à l'épine de l'omoplate. Le trapèze est alimenté par le nerf accessoire et certains nerfs cervicaux (III-VII) et a pour fonction principale l'élévation et la rotation de l'omoplate. Les muscles extrinsèques qui relient l'épaule à la paroi thoracique sont le grand pectoral, le petit pectoral et le dentelé antérieur. Le muscle grand pectoral est un muscle puissant en forme d'éventail recouvrant la majeure partie de la partie supérieure de la paroi thoracique et formant, avec sa partie latérale, la paroi antérieure de l'aisselle. Ce muscle est séparé du deltoïde plus crânien par un sillon, le triangle delto-pectoral, qui est traversé par la veine céphalique. (Illustration 10a). Le grand pectoral a trois têtes issues respectivement de la face antérieure de la moitié médiale de la clavicule (tête claviculaire), du manubrium et du corps du sternum et des cartilages costaux des côtes II à VI (tête sternocostale), et de l'aponévrose du muscle oblique externe (tête abdominale). Les fibres musculaires convergent latéralement en un large tendon trilaminaire qui traverse la jonction myotendineuse du chef long du biceps et s'insère sur la lèvre latérale du sillon intertuberculaire de l'humérus (Wolfe et al. 1992). Les couches tendineuses fusionnent et se tordent à 90 ° juste avant l'insertion du tendon au niveau de la lèvre latérale de la rainure bicipitale, où la lame postérieure s'insère crânialement et la lame antérieure comprend la partie la plus caudale de l'enthèse. (Fig. 10a, b). Distal aux tubérosités humérales, le tendon pectoral participe au maintien du tendon du long chef du biceps contre la face antérieure de la diaphyse humérale. L'action principale du grand pectoral est d'adduire et de faire pivoter l'humérus. Au plus profond du grand pectoral, le petit pectoral est un muscle triangulaire plus petit qui tire son origine des côtes III, IV et V et s'insère sur le bord médial de l'apophyse coracoïde. Il stabilise l'omoplate contre la paroi thoracique et constitue un repère utile pour les vaisseaux axillaires et les nerfs car il leur est juste superficiel.
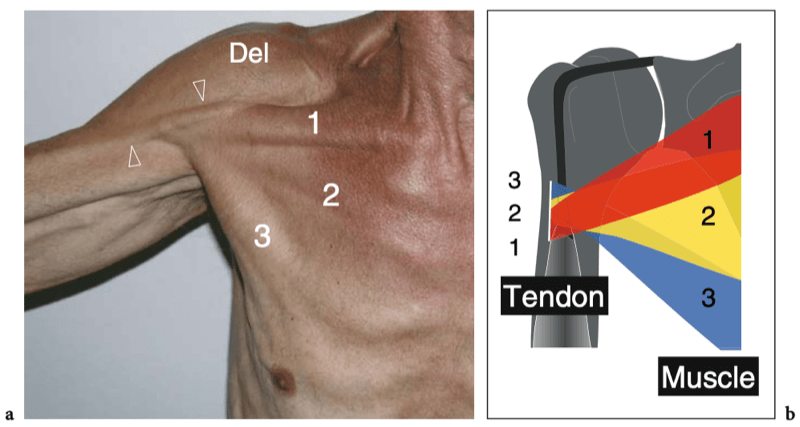
Fig. 10a,b. Anatomie du grand pectoral. a Photographie frontale du thorax prise alors que le patient gardait le bras en abduction et b dessin schématique corrélation d'une vue antérieure à travers l'épaule montrant l'orientation distincte de la tête claviculaire (1), de la tête sternocostale (2) et de la tête abdominale (3 ) du muscle grand pectoral. Ils convergent pour former un large tendon s'insérant dans la lèvre latérale du sillon intertuberculaire. Les contributions séparées à ce tendon se tordent les unes sur les autres de sorte qu'au niveau du pli axillaire les fibres tendineuses de la tête claviculaire passent superficielles à celles issues de la tête sternale et s'insèrent caudalement, alors que les fibres de la tête abdominale ont les fibres les plus crâniennes. fixation sur la diaphyse humérale. Notez la veine céphalique (têtes de flèches) lorsqu'elle traverse l'espace entre le deltoïde (Del) et la tête claviculaire du pectoral (1) - le triangle deltopectoral - où elle s'approfondit pour atteindre la veine sous-clavière.
Figure 11 illustre la relation anatomique entre les muscles intrinsèques et extrinsèques de l'épaule et les os au moyen d'une corrélation biunivoque entre des spécimens cadavériques et des images CT.
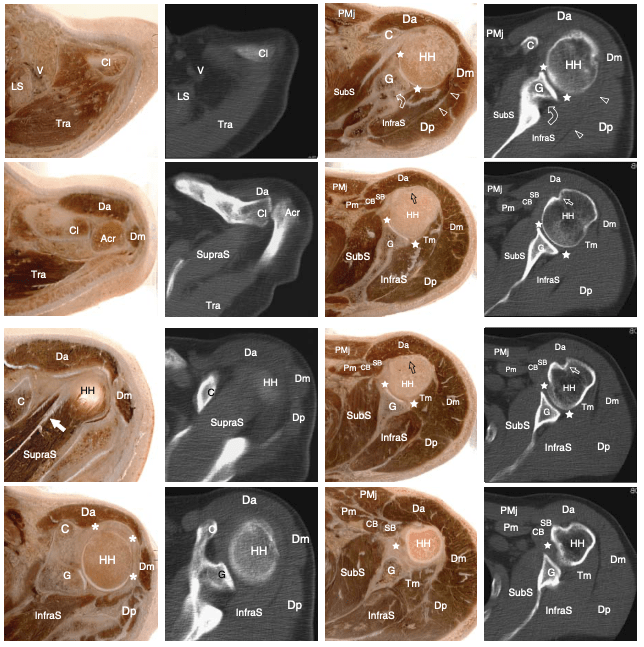
Fig. 11. Anatomie en coupe de l'épaule. Série de coupes cadavériques (à gauche) et images CT correspondantes (à droite) affichées en séquence de crânien à caudal. Acr, acromion ; Pointes de flèches, plan de clivage entre infraspinatus et deltoïde ; astérisques, coiffe des rotateurs ; C, processus coracoïde ; CB, coracobrachial ; cl, clavicule ; flèche incurvée, encoche spinoglénoïde ; Da, deltoïde, partie antérieure ; Dm, deltoïde, partie médiane ; Dp, deltoïde, partie postérieure ; G, glène ; LS, élévateur des omoplates ; HH, tête humérale ; InfraS, sous-épineux ; flèche ouverte, sillon bicipital ; Pm, petit pectoral ; PMj, grand pectoral ; SB, tête courte du biceps ; étoiles, bourrelet glénoïdien fibrocartilagineux ; SubS, sous-scapulaire ; SupraS, sus-épineux ; Tm, petit rond ; Tra, trapèze ; V, vaisseaux axillaires ; flèche blanche, faisceau antérieur de fibres du tendon sus-épineux.
11. BOURSES ET ESPACES DE GLISSEMENT
La connaissance de l'anatomie des récessus synoviaux et des bourses para-articulaires est un préalable essentiel pour éviter les erreurs de diagnostic et les écueils dans l'interprétation des résultats pathologiques. Trois espaces synoviaux principaux se trouvent autour de la zone de l'épaule : la cavité articulaire gléno-humérale, la bourse sous-acromio-sous-deltoïdienne et la cavité acromio-claviculaire. Dans des conditions normales, ces espaces sont séparés les uns des autres car la coiffe des rotateurs est interposée entre l'articulation gléno-humérale et la bourse sous-acromio-sous-deltoïdienne et la capsule acromio-claviculaire se trouve entre l'articulation acromio-claviculaire et la bourse sous-acromio-sous-deltoïdienne. Dans certains états pathologiques, comme un défaut de la coiffe des rotateurs ou de la capsule inférieure de l'articulation acromio-claviculaire, ces espaces peuvent communiquer.
L'espace sous-acromial, situé entre l'arc coraco-acromial et la tête humérale, contient les tendons de la coiffe des rotateurs, le long chef du tendon du biceps, la bourse sous-acromio-sous-deltoïdienne et une quantité variable de tissu conjonctif et de graisse (Fig. 12). La bourse sous-acromio-sous-deltoïdienne est une grande structure tapissée de synovie située en dessous de l'acromion et du ligament coraco-acromial qui recouvre la face supérieure du tendon du sus-épineux. (Fig. 13). Elle s'étend également médialement jusqu'à la coracoïde (bourse sous-coracoïdienne) et antérieurement pour recouvrir le sillon bicipital, alors que ses limites latérales et postérieures sont plus variables et atteignent environ 3 cm sous la grosse tubérosité (Bureau et al. 1996). Du point de vue fonctionnel, le rôle principal de la bourse sous-acromio-sous-deltoïdienne est de minimiser l'attrition de la coiffe contre l'arc coraco-acromial et le deltoïde lors des mouvements du bras. Pour faciliter le glissement, la bourse est entourée d'un mince plan de clivage de graisse péribursale. La bourse sous-coracoïdienne peut être séparée de la bourse sous-acromio-sous-deltoïdienne pour former une cavité individuelle. Dans ces cas, la bourse se situe juste en dessous et en dedans de la coracoïde et peut simuler une masse kystique lorsqu'elle est distendue par du liquide si l'examinateur n'est pas conscient de son existence. De plus, il faut veiller à ne pas le confondre avec le récessus sous-scapulaire adjacent de l'articulation gléno-humérale.
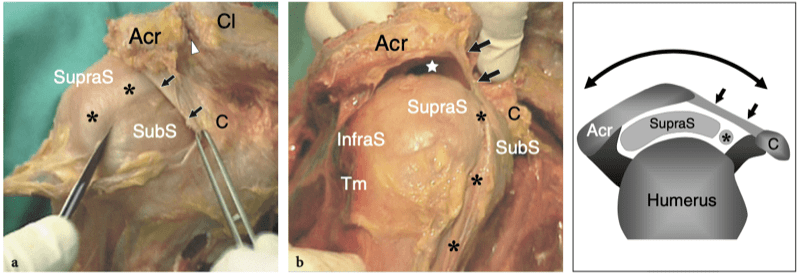
Fig. 12a–c. Arc coracoacromial. a,b Des vues cadavériques brutes sur la face antéro-supérieure (a) et la face latérale (b) de l'épaule avec une corrélation schématique en c montrent l'arc coracoacromial (double flèche incurvée en c), qui est formé par l'acromion (Acr) et le coracoïde (C) reliée par le ligament coracoacromial (flèches). Notez la position de l'articulation acromio-claviculaire (tête de flèche). Lors des mouvements d'épaule, le long chef du biceps (astérisques) et les tendons du sus-épineux (SupraS) glissent sous l'acromion et le ligament coraco-acromial. cl, clavicule ; SubS, sous-scapulaire ; Tm, teres minor. En b et c, l'espace sous-acromial (étoile) se révèle comme un espace libre sous-jacent à l'arc coraco-acromial, contenant le tendon sus-épineux, le tendon biceps et la bourse sous-acromiale sous-deltoïdienne.
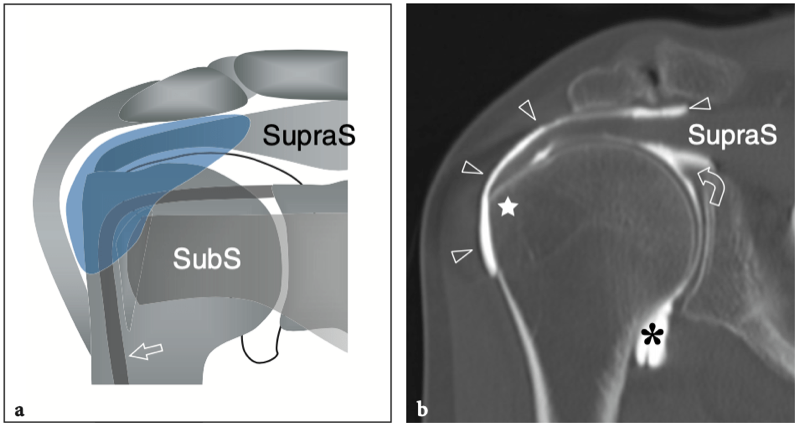
Figures 13a,b. Bourse sous-deltoïdienne sous-acromiale. un dessin schématique d'une vue antérieure à travers l'épaule montre la bourse sous-acromiale sous-deltoïdienne (en bleu). Cette grande bourse se situe dans l'espace sous-acromial, entre la face inférieure de l'acromion et du ligament coraco-acromial et la face supérieure du sus-épineux (SupraS). Il se prolonge également sous le muscle deltoïde pour recouvrir le trochiter et l'insertion du tendon sus-épineux, de l'infraspinatus en arrière et des tendons du biceps (flèche) et du sous-scapulaire (SubS) en avant. b L'arthroscanner coronal oblique de l'épaule après injection intra-articulaire de produit de contraste révèle les deux principaux espaces synoviaux de l'épaule : l'articulation gléno-humérale et la bourse sous-deltoïdienne sous-acromiale (têtes de flèches). Ces espaces sont séparés par le tendon sus-épineux (SupraS). Notez la taille considérable de la bourse, qui s'étend du dessous de l'articulation acromio-claviculaire jusqu'à environ 3 cm en dessous du bord latéral de la grosse tubérosité (étoile). Astérisque, poche axillaire ; flèche courbe, bourrelet glénoïdien supérieur.
En plus du plan de glissement sous-acromial, le plan scapulo-thoracique facilite le mouvement de l'omoplate par rapport à la paroi thoracique et la rotation de l'omoplate lors de l'abduction et de l'adduction du bras.
12. STRUCTURES NEUROVASCULAIRES
Les muscles de la coiffe des rotateurs reçoivent l'innervation du nerf suprascapulaire (supraspinatus et infraspinatus), du nerf sous-scapulaire (subscapularis) et du nerf axillaire (petit rond). L'examinateur doit être conscient du trajet anatomique des nerfs suprascapulaires et axillaires, car ces nerfs sont vulnérables aux blessures d'étirement et aux traumatismes et peuvent être impliqués par une compression extrinsèque (c. et le syndrome de l'espace quadrilatère. Le nerf musculo-cutané sera décrit ultérieurement.
13. NERF SUPRASCAPULAIRE
Le nerf suprascapulaire provient du tronc supérieur du plexus brachial (niveau C5-C6) et descend à travers le foramen suprascapulaire formé par l'échancrure supra-épineuse de l'omoplate et le ligament scapulaire transverse supérieur pour atteindre la fosse supra-épineuse. (Fig. 14). Ensuite, le nerf continue en bas jusqu'au muscle sus-épineux en passant par le tunnel formé par le ligament scapulaire transverse inférieur et l'échancrure spinoglénoïde pour se distribuer dans la fosse sous-épineuse. (Fig. 14). Dans la fosse sus-épineuse, le nerf suprascapulaire donne des branches motrices au muscle supra-épineux, tandis que l'innervation du muscle sous-épineux est assurée par des branches distales naissant dans la fosse sous-épineuse. Sur tout son parcours, le nerf suprascapulaire est accompagné des vaisseaux suprascapulaires.
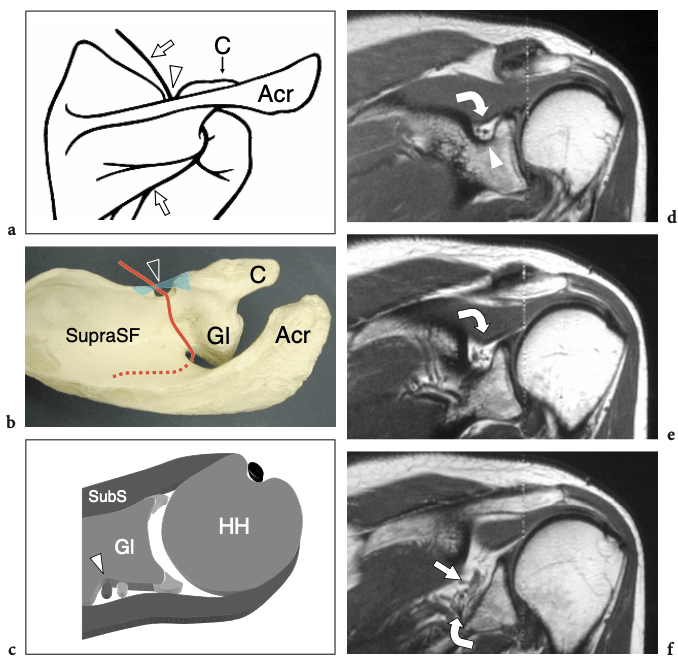
Fig. 14a–f. Nerf suprascapulaire. un dessin schématique illustre le trajet du nerf suprascapulaire (flèches) à partir de la vue postérieure de l'omoplate. Notez le nerf lorsqu'il traverse le foramen suprascapulaire (pointe de flèche). b Photographie sur la face supérieure d'une omoplate montrant le trajet du nerf suprascapulaire (en rouge) à travers la fosse supra-épineuse (SupraSF). Le nerf (ligne continue) pénètre dans la fosse sus-épineuse en passant par le foramen scapulaire et en profondeur jusqu'au ligament scapulaire transverse supérieur (tête de flèche). Ensuite, il passe le long de la base de la glène (Gl) et de la racine de l'acromion (Acr) pour atteindre la fosse sous-épineuse (ligne pointillée). C, coracoïde. c Le dessin schématique d'une vue transversale à travers l'épaule montre le nerf suprascapulaire (tête de flèche) et l'artère suprascapulaire lorsqu'ils traversent l'encoche spinoglénoïde, juste en profondeur du tendon sous-épineux. Notez la relation étroite du faisceau neurovasculaire suprascapulaire avec le labrum postérieur. SubS, sous-scapulaire ; HH, tête humérale ; Gl, glène osseuse. d–f Les images IRM coronales obliques pondérées en T1 affichées d'avant en arrière révèlent le faisceau neurovasculaire suprascapulaire (flèche courbe) lorsqu'il traverse l'encoche supra-épineuse (tête de flèche) juste en profondeur jusqu'au muscle supra-épineux, jusqu'à atteindre l'encoche spinoglénoïde (flèche droite) .
14. ARTÈRE ET NERF AXILLAIRES
L'artère axillaire prolonge l'artère sous-clavière au-delà du bord externe de la première côte. Il traverse en profondeur le muscle petit pectoral et est accompagné des cordons et des branches distales du plexus brachial et de la veine axillaire. L'artère axillaire peut être palpable dans la partie inférieure de l'aisselle, à proximité de la capsule articulaire gléno-humérale inférieure. Distale par rapport au bord latéral du petit pectoral, elle envoie trois branches : les artères sous-scapulaires et circonflexes antérieures et postérieures de l'humérus. Les artères circonflexes ont un trajet horizontal et s'anastomosent pour former un cercle autour de la face antérieure et postérieure du col chirurgical de l'humérus. L'artère humérale circonflexe antérieure est plus petite que la postérieure et s'étend en profondeur jusqu'au coracobrachial et au biceps et devant le col chirurgical de l'humérus. Il dégage une branche ascendante, l'artère arquée, qui accompagne le long chef du tendon du biceps dans le sillon intertuberculaire. L'artère humérale circonflexe postérieure est plus grande et traverse la paroi postérieure de l'aisselle à travers l'espace quadrilatère en association avec le nerf axillaire. C'est un point de repère pour la détection américaine du nerf.
Le nerf axillaire naît du cordon postérieur du plexus brachial (niveau C5-C6) près du processus coracoïde et progresse le long du bord inférolatéral du muscle sous-scapulaire pour se courber en dessous de la capsule articulaire gléno-humérale et passer dans la face postérieure du bras. Le nerf chemine en association avec l'artère circonflexe postérieure à travers l'espace quadrilatéral - un passage carré délimité par la longue tête du muscle triceps médialement, le col chirurgical de l'humérus latéralement, le muscle petit rond crânial et le muscle grand rond caudal (Fig. 15) (Loomer et Graham 1989). Il a deux branches terminales : antérieure et postérieure. La branche antérieure irrigue le muscle deltoïde antérieur et la peau sus-jacente ; la branche postérieure innerve le petit rond et le muscle deltoïde postérieur et se distribue à la peau recouvrant le deltoïde distal et le muscle triceps proximal.
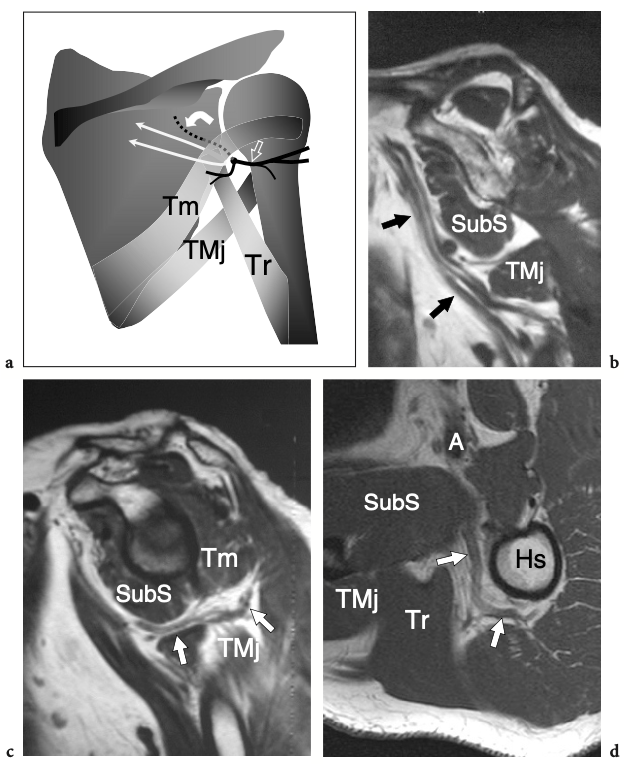
Fig. 15a–d. Nerf axillaire. un dessin schématique illustre le parcours du nerf axillaire et de ses branches depuis la vue postérieure de l'épaule. Pour atteindre l'épaule postérieure, le nerf axillaire (flèche courbe) traverse l'espace quadrilatéral (flèche droite) délimité par le petit rond (Tm), le grand rond (TMj), le chef long du triceps (Tr) et le col chirurgical de l'humérus. La double flèche grise récurrente imite l'élévation du teres minor pour rendre l'espace quadrilatère plus visible. b,c Les images IRM sagittales obliques pondérées en T1 montrent les cordes du plexus brachial (flèches noires) lorsqu'elles traversent la région axillaire en association avec les vaisseaux axillaires. Le nerf axillaire (flèches blanches) naît du cordon postérieur et est dirigé vers l'arrière. En c, le nerf axillaire est représenté en passant à côté de la limite inférieure du sous-scapulaire (SubS) puis en entrant dans l'espace quadrilatéral, entre le petit rond (Tm) et le grand rond (TMj). d IRM transversale pondérée en T1 sur le trajet du nerf axillaire (flèches) et de l'artère circonflexe postérieure. Notez le faisceau neurovasculaire qui entoure la face postéro-médiale du col chirurgical de l'humérus. A, artère axillaire.
15. STRUCTURES DE SORTIE THORACIQUE
La région du défilé thoracique comprend les nerfs du plexus brachial et l'artère et la veine sous-clavières. Ces structures neurovasculaires traversent des espaces restreints dans lesquels elles peuvent être comprimées, dont les plus importants sont le triangle interscalénique, l'espace costo-claviculaire et l'espace rétropectoral mineur. (Illustration 16a) (Demondion et al. 2000). L'artère sous-clavière et les nerfs du plexus brachial traversent le triangle interscalène, un espace bordé par le muscle scalène antérieur en avant, le muscle scalène moyen en arrière et la première côte en bas.
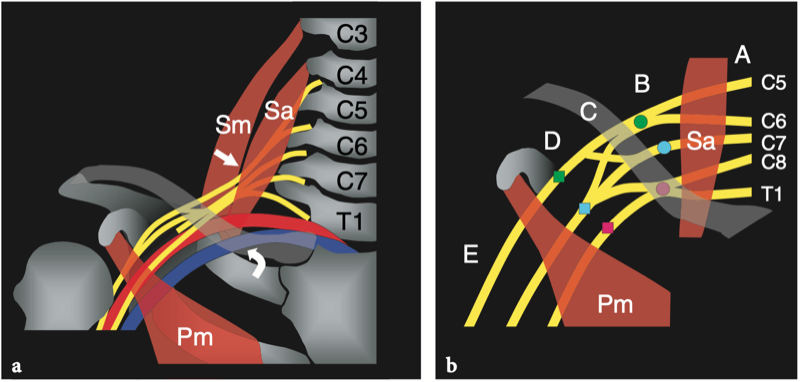
Figures 16a,b. Anatomie du défilé thoracique. un dessin schématique illustre l'anatomie normale idéalisée des nerfs du plexus brachial (en jaune) et les structures de la sortie thoracique. Après la sortie du foramen neural, les nerfs traversent un espace triangulaire (flèche) délimité par les muscles scalène antérieur (Sa) et scalène moyen (Sm) puis passent sous la clavicule et le muscle petit pectoral (Pm) pour atteindre l'aisselle. Semblable aux nerfs, l'artère sous-clavière (en rouge) traverse le triangle interscalénique. En revanche, la veine sous-clavière (en bleu) chemine devant le muscle scalène antérieur en traversant l'espace costo-claviculaire (flèche courbe). b Le dessin schématique montre les composants et les principaux repères du plexus brachial. Cinq branches primaires antérieures de C5 jusqu'aux racines T1 quittent le canal rachidien par les foramens intervertébraux et passent entre les muscles scalène antérieur (Sa) et scalène moyen. Au bord latéral des muscles scalènes, cinq racines s'unissent pour former les troncs supérieur (cercle vert), moyen (cercle bleu) et inférieur (cercle rouge). Ces troncs se divisent chacun en divisions antérieure et postérieure dans le plancher du triangle postérieur du cou au bord extérieur de la première côte. Les divisions se rejoignent ensuite pour former des cordons latéral (carré vert), médial (carré rouge) et postérieur (carré bleu), qui se ramifient en terminaison dans les nerfs radial, médian et ulnaire distal au bord inférieur du muscle petit pectoral (Pm) autour de l'axillaire artère. En fonction de leur position par rapport aux muscles scalènes, à la clavicule et au petit pectoral, les nerfs du plexus se distinguent en racines (A), troncs (B), divisions (C), cordons (D) et branches terminales (E ).
Les muscles scalènes sont des muscles respiratoires et agissent en soulevant la première côte et en pliant et en faisant tourner le cou. Le scalène antérieur prend son origine dans les tubercules antérieurs des processus transverses de C3 à C6 et s'insère dans le tubercule scalène de la première côte ; le scalène moyen, le plus long et le plus gros des muscles scalènes, naît des tubercules postérieurs des apophyses transverses de C2 à C7 et présente une large insertion sur la première côte, entre le sillon de l'artère sous-clavière et le tubercule scalène ; le scalène postérieur, qui n'est pas responsable des syndromes de compression neurovasculaire du membre supérieur, est plus profond, issu des tubercules postérieurs de C5 et C6 (éventuellement C7) et s'attachant aux deuxième et troisième côtes. Dans le triangle interscalénique, les nerfs du plexus brachial sont postérieurs, latéraux et supérieurs à l'artère. Les racines inférieures (C8 et T1) ont la relation la plus étroite avec l'artère. Ils se trouvent derrière. Contrairement à l'artère, la veine sous-clavière passe devant le muscle scalène antérieur, juste en dessous et latéralement au ligament costo-claviculaire et au-dessus de la première côte. Plusieurs variantes anatomiques dans la région des scalènes, y compris les muscles accessoires, une origine ou une insertion anormale des muscles scalènes antérieurs et moyens, des muscles entremêlés et une variété de bandes fibreuses, peuvent provoquer un rétrécissement de cet espace et un piégeage ultérieur du faisceau neurovasculaire. Après avoir traversé le triangle scalène, les structures neurovasculaires traversent un autre espace restreint, l'espace costoclaviculaire, entre la clavicule et la première côte. Dans cet espace, les cordons nerveux entretiennent une relation constante avec les vaisseaux axillaires. Ensuite, les nerfs pénètrent dans l'espace rétropectoral mineur, qui est un passage délimité par le muscle petit pectoral antérieur et le muscle sous-scapulaire postérieur, près de la coracoïde. Dans ce tunnel, les cordons nerveux cheminent juste au-dessus et en arrière de l'artère axillaire (Demondion et al. 2000).
16. NERFS DU PLEXUS BRACHIAL ET ANATOMIE VERTÉBRALE
L'anatomie du plexus brachial est complexe, impliquant de nombreux nerfs interconnectés. Étant donné que les nerfs du plexus sortent du canal rachidien par les foramens neuraux, une description préliminaire des apophyses transverses des vertèbres cervicales est essentielle pour une meilleure compréhension de la technique d'échographie requise (Martinoli et al. 2002).
Les apophyses transverses des vertèbres cervicales se projettent à partir des jonctions des pédicules et des lames et agissent principalement comme des attaches pour les muscles, tels que les muscles scalènes. Chaque processus a une forme en « U » formée par deux tubercules osseux proéminents, antérieur et postérieur, qui forment ses parois, et une lame mince, qui forme son plancher (Guha et al. 1996). Cette lame est percée par l'artère vertébrale, qui monte à travers les foramina transversaria de C6 à C3. Cette configuration se répète uniformément de C2 à C6, alors que C7 apparaît différente. Comme la vertèbre C7 représente une transition entre la configuration cervicale et thoracique, elle a un processus transverse plus large dans lequel le tubercule postérieur est plus gros et plus proéminent et le tubercule antérieur est absent ou rudimentaire (Fig. 17). Plus caudalement, la vertèbre T1 diffère des cervicales puisque ses apophyses transverses sont dirigées plus en arrière pour s'articuler avec la tête de la première côte. La côte chevauche la vertèbre immédiatement inférieure au foramen, donnant ainsi un aspect plat et lisse à sa face latérale. Lorsque les racines nerveuses quittent la colonne vertébrale, elles traversent le sillon entre les tubercules. Il faut considérer que chaque racine sort du foramen intervertébral en glissant sur l'apophyse transverse de son niveau vertébral correspondant (Guha et al. 1996). Ensuite, comme il y a huit nerfs cervicaux et seulement sept vertèbres cervicales, la racine C8 se situe au niveau de la vertèbre T1, et ainsi de suite.
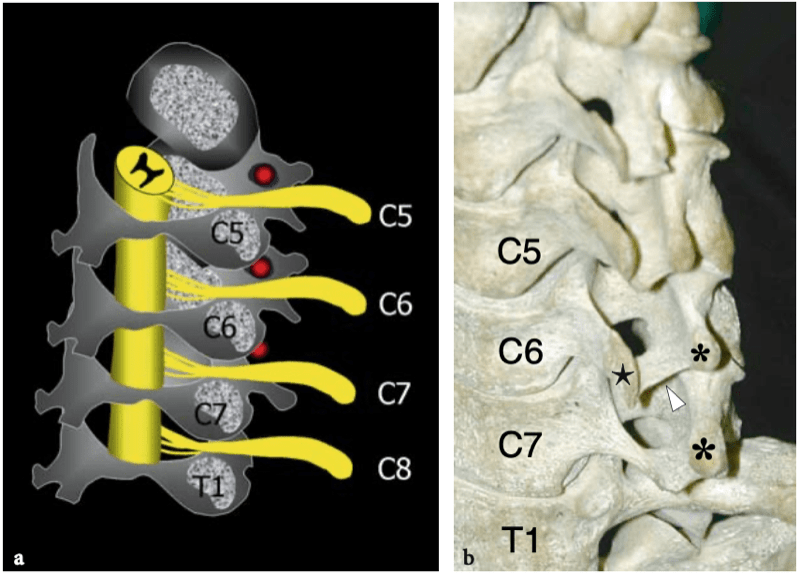
Figures 17a,b. Anatomie vertébrale : foramen neural. un dessin schématique de la colonne cervicale illustre la correspondance anatomique entre les processus transverses et les racines nerveuses. Chaque racine (en jaune) sort du foramen intervertébral en glissant sur l'apophyse transverse de son niveau vertébral correspondant. Parce qu'il y a huit nerfs cervicaux et seulement sept vertèbres cervicales, la racine C8 se situe au niveau de la vertèbre T1. La position de l'artère vertébrale (en rouge) par rapport aux tubercules osseux b La photographie du rachis cervical montre l'aspect typique des apophyses transverses, qui présentent des tubercules proéminents antérieurs (étoiles) et postérieurs (astérisques). A noter l'absence de tubérosité antérieure au niveau de C7 alors que la face latérale de T1 est plate sans proéminence osseuse.
Les nerfs du plexus brachial comprennent plusieurs composants, dont les racines, les troncs, les divisions, les cordons et enfin les nerfs périphériques du membre supérieur qui dérivent de l'union des racines ventrales de C5 jusqu'à T1. Dans la région paravertébrale, chaque racine a une structure individuelle (monofasciculaire).
En progressant vers la zone interscalène, les racines de C5 et C6 se rejoignent pour former le tronc supérieur, la racine de C7 émerge d'elle-même comme tronc intermédiaire et, dans la partie inférieure du cou, les racines de C8 et T1 forment le tronc inférieur du plexus. Plus distalement, dans la région supraclaviculaire, chaque tronc dégage deux branches divisionnaires, appelées divisions antérieure et postérieure, qui innervent respectivement les muscles fléchisseurs et extenseurs du membre supérieur. Dans l'aisselle, ces divisions se rejoignent en diverses combinaisons pour former les cordons du plexus brachial. La relation des cordons avec l'artère axillaire détermine leurs noms : les cordons latéral, médial et postérieur. Les nerfs axillaire et radial proviennent du cordon postérieur, le nerf musculo-cutané et une partie du nerf médian proviennent du cordon latéral, tandis que l'autre contribution des fibres au nerf médian et au nerf cubital provient du cordon médial.
17. ÉLÉMENTS ESSENTIELS DES ANTÉCÉDENTS CLINIQUES ET DE L'EXAMEN PHYSIQUE
Au départ, l'examinateur doit effectuer une brève évaluation clinique basée sur les antécédents du patient, un bref examen physique et un examen des études d'imagerie précédentes.
18. PATHOLOGIE DE LA COIFFE DES ROTATEURS
Tout d'abord, l'examinateur doit vérifier si des accidents antérieurs à l'épaule, y compris des traumatismes aigus, des microtraumatismes chroniques, des blessures liées au sport et des épisodes d'instabilité de l'épaule, se sont produits. Une attention particulière doit être accordée à l'emplacement, au type, à la gravité et aux circonstances de la douleur référée. Les patients atteints d'une pathologie de la coiffe des rotateurs se plaignent généralement de douleurs nocturnes et d'une incapacité à dormir du côté affecté. D'une manière générale, la localisation et l'irradiation de la douleur à l'épaule ne sont pas liées à l'atteinte d'un tendon spécifique. La plupart des patients sont assez précis dans la localisation de la douleur. Souvent, les patients présentant une déchirure du tendon sus-épineux se plaignent de douleurs irradiées le long de la face latérale du tiers supérieur et moyen du bras, à proximité de l'insertion du muscle deltoïde. La douleur distale au niveau du coude associée aux paresthésies est généralement liée à des troubles du plexus cervical ou brachial plutôt qu'à une pathologie isolée de la coiffe des rotateurs. Ensuite, il faut demander au patient quel type de mouvement produit de l'inconfort, ou l'examinateur doit tenter de produire de la douleur avec différentes manœuvres. Dans le syndrome de conflit antéro-supérieur, la douleur est rapportée lors d'activités ou de manœuvres nécessitant une abduction active et une élévation du bras vers l'avant. Une exacerbation de la douleur peut également être notée lors de l'élévation maximale du bras et de la rotation interne en conflit postéro-supérieur et lors de la rotation interne maximale et de l'adduction du bras en conflit antéro-médial.
Un examen physique de base de l'épaule affectée pour l'évaluation de la coiffe des rotateurs fait partie de l'étude américaine de routine (Moosikasuwan et al. 2005). L'examen commence par l'observation de la façon dont le patient se déshabille, car le fait de retirer la chemise est un indicateur de la gamme complète de mouvements que le patient est capable d'effectuer et est généralement limité dans la maladie de la coiffe des rotateurs. Ensuite, l'amplitude globale des mouvements de l'épaule peut être évaluée en demandant au patient de placer la face dorsale de la main derrière le dos le plus crânialement possible, entre les omoplates (rotation interne et extension) et derrière le cou (rotation externe et abduction). ). Le patient étant assis, l'épaule affectée est inspectée et simultanément palpée par l'examinateur. Le gonflement et la sensibilité autour de l'épaule, en particulier lorsqu'ils sont situés sur la face antérieure de l'articulation, reflètent plus probablement un épanchement dans la bourse sous-deltoïdienne sous-acromiale plutôt qu'un épanchement intra-articulaire. Dans les déchirures chroniques de la coiffe, un crépitement palpable sur la face crânienne de l'épaule peut être produit par une rotation de l'épaule avec le bras à 90° d'élévation. Une masse localisée des tissus mous sur la face crânienne de l'articulation acromio-claviculaire est souvent liée à un kyste provenant de l'articulation acromio-claviculaire qui se développe après une déchirure massive de la coiffe des rotateurs (signe de Geyser). Il faut veiller à le corréler avec la déchirure car les patients consultent généralement un médecin pour la masse et non pour le trouble sous-jacent. (Illustration 18a). L'ecchymose sur la face antérieure de l'épaule et du bras est typiquement corrélée à une déchirure aiguë du tendon du long chef du biceps mais elle peut également être appréciée en cas d'élargissement traumatique d'une déchirure antérieure des tendons sus-épineux ou sous-scapulaire. À l'exception du sous-scapulaire, l'atrophie des muscles de la coiffe des rotateurs peut être appréciée par l'inspection et la palpation. Bien qu'il faille toujours garder à l'esprit la survenue d'une rupture bilatérale de la coiffe, un examen comparatif des deux épaules à la recherche d'une asymétrie peut aider l'examinateur à évaluer l'atrophie musculaire. Sur l'épaule latérale, l'atrophie du deltoïde peut révéler une atrophie due à une neuropathie axillaire ou à une chirurgie antérieure avec décollement du deltoïde pour réparation de la coiffe des rotateurs. Sur l'épaule postérieure, l'atrophie des muscles infraspinatus et teres minor peut provenir de déchirures chroniques de la coiffe des rotateurs, d'une inutilisation, d'une arthrite glénohumérale et d'une paralysie du nerf suprascapulaire (Fig.18b). Chez les patients présentant une déchirure du tendon du biceps, le muscle rétracté peut être palpé comme une masse de tissu mou sur la face antérieure du tiers moyen du bras, imitant éventuellement un muscle hypertrophié, le soi-disant signe de Popeye. (Fig.18c). La détection du biceps rétracté peut être difficile chez les patients obèses. Les tendons de la coiffe des rotateurs peuvent être palpés systématiquement à la recherche d'une sensibilité focale en commençant en avant par le sous-scapulaire et le biceps, puis en se déplaçant vers l'arrière pour évaluer les insertions du sus-épineux et de l'infra-épineux dans les facettes supérieure et postérieure du trochiter. Enfin, l'articulation acromio-claviculaire est évaluée en appliquant une pression ferme dessus avec le pouce. Si cette pression génère de la douleur, la douleur doit être comparée à celle rappelée par le patient pour s'assurer de la concordance des symptômes. Une articulation acromio-claviculaire douloureuse peut indiquer une articulation arthritique ou traumatisée. La séparation de l'articulation acromio-claviculaire se traduit par la proéminence douloureuse de l'extrémité distale de la clavicule associée à une mobilité excessive de l'articulation.
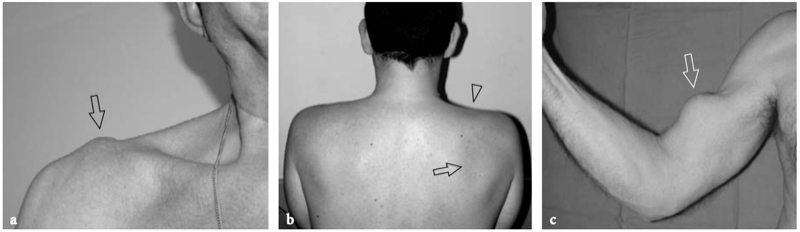
Fig. 18a–c. Découvertes physiques autour de l'épaule. un signe Geyser. La photographie de l'épaule droite montre une masse de tissu mou (flèche) sur la face crânienne de l'articulation acromio-claviculaire reflétant un kyste. Ce signe est pathognomonique d'une déchirure complète du tendon sus-épineux. b Amaigrissement du sus-épineux et de l'infra-épineux résultant d'une paralysie du nerf suprascapulaire. Par rapport au côté opposé, notez la perte en masse des muscles contenus dans les fosses sus-épineuse (tête de flèche) et sous-épineuse (flèche) de l'épaule droite. c Signe de Popeye. La photographie montre une grosseur proéminente (flèche) sur la face antérieure du bras moyen liée à une rupture du chef long du tendon du biceps. Ce signe résulte de la rétraction distale du ventre musculaire à cause de la déchirure du tendon.
L'amplitude globale des mouvements de l'épaule est fréquemment affectée chez les patients présentant des troubles de la coiffe des rotateurs. Dans ces cas, l'examen des mouvements passifs peut être utile pour différencier un vrai syndrome de conflit avec pathologie de la coiffe des rotateurs d'une capsulite rétractile (épaule gelée). Alors que dans la maladie de la coiffe des rotateurs sans capsulite rétractile secondaire, l'amplitude des mouvements est limitée pendant les mouvements actifs mais non passifs, le mouvement de l'épaule dans la capsulite rétractile est toujours perdu. Dans ce trouble, le mouvement est pour la plupart limité en rotation externe testée à la fois à 0° et à 90° d'abduction, bien que toutes les directions soient généralement impliquées dans une certaine mesure. Des tests cliniques spécifiques pour évaluer la résistance des tendons individuels de la coiffe des rotateurs ont été décrits dans la littérature orthopédique (Hawkins et Hobeika 1983). La fonction sus-épineuse peut être évaluée en testant la capacité du patient à résister à une force vers le bas appliquée à l'humérus avec le coude étendu et le bras dans une position de rotation interne et 45° de flexion vers l'avant (Illustration 19a). S'il est positif, le test génère de la douleur, de la faiblesse ou les deux symptômes. Ensuite, deux manœuvres d'impact, qui peuvent être effectuées avec le patient debout ou couché, peuvent aider l'examinateur à évaluer la douleur à l'épaule liée à une maladie de la coiffe des rotateurs ou à une tendinite du biceps. Le premier, appelé test de Neer, est obtenu avec une flexion avant gléno-humérale passive maximale avec l'épaule en rotation neutre pour obtenir un conflit du sus-épineux et du biceps contre le bord antérolatéral de l'acromion (Neer 1983). Le second, le test de Hawkins, est réalisé avec une flexion avant de 90°, une légère adduction horizontale et une rotation interne pour comprimer l'insertion du sus-épineux et de la bourse sous-acromiale sous le ligament coraco-acromial (Hawkins et Hobeika 1983). La rotation interne de l'épaule reflète l'action du tendon sous-scapulaire et peut être évaluée au moyen du « lift-off test » (Gerber et Krushell 1991). Pour éviter la contribution d'autres muscles (c.-à-d. grand pectoral, grand rond) à la rotation interne, ce test mesure la force du sous-scapulaire isolément en positionnant l'avant-bras derrière le dos du patient. Le patient est ensuite invité à lever sa main de la région lombaire, une action qui nécessite la contraction active du subscapularis (Fig.19b). L'incapacité à effectuer cette manœuvre indique une déchirure du sous-scapulaire. L'action combinée de l'infraspinatus et du teres minor est indifférenciable lors de la rotation externe de l'épaule. La capacité de ces muscles pris dans leur ensemble peut être estimée à l'aide du « signe du souffleur de cor », dans lequel le bras du patient est amené passivement à 90° d'abduction et de rotation externe complète. L'examinateur tient le coude pendant qu'on demande au patient de maintenir une rotation externe maximale. Toute perte de rotation externe active représente une faiblesse de la coiffe des rotateurs postérieurs, alors que l'incapacité à maintenir une rotation externe complète du bras en abduction suggère un important défaut de la coiffe des rotateurs postérieurs. La contraction du deltoïde postérieur pourrait donner un faux signe négatif de Hornblower. La réalisation bilatérale du test est utile pour éviter cet écueil potentiel (Hawkins et Hobeika 1983). Bien que les tests de force soient utiles pour étayer la suspicion clinique d'une maladie de la coiffe des rotateurs, ils se sont avérés avoir une sensibilité et une spécificité variables dans le diagnostic. Les sonologues doivent au moins les connaître car l'orthopédiste peut citer ces manœuvres dans la demande d'examen échographique. Chez les patients qui ont déjà subi une intervention chirurgicale pour des déchirures de la coiffe des rotateurs, l'examinateur doit passer un peu plus de temps à examiner le rapport chirurgical avant de commencer l'examen américain, car les procédures chirurgicales peuvent modifier l'anatomie locale. Il faut également garder à l'esprit que l'intervention chirurgicale peut avoir consisté en une acromioplastie et une bursectomie sans aucune suture des tendons déchirés. Dans ces cas, la discontinuité de la coiffe des rotateurs ne doit pas être interprétée à tort comme une déchirure.
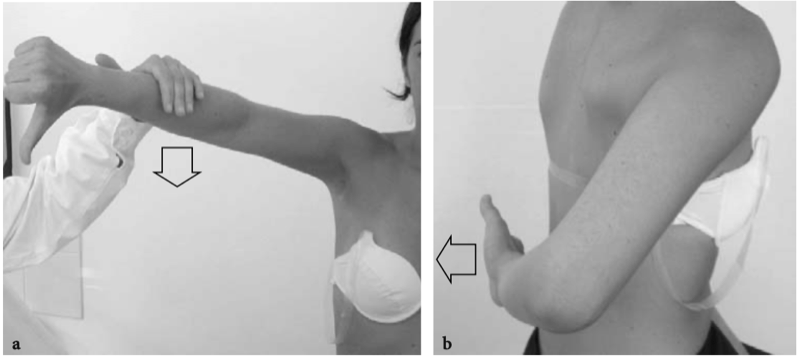
Figures 19a,b. Tests cliniques pour évaluer la force des muscles de la coiffe des rotateurs. a La force du sus-épineux est testée avec le bras du patient dans une position de 60° d'élévation vers l'avant avec l'épaule en rotation interne et le coude en extension. Une force vers le bas (flèche) appliquée par l'examinateur est résistée par le patient. b Un test de décollement est effectué pour évaluer la force du sous-scapulaire. Le patient est invité à soulever activement (flèche) la main de la région lombaire.
Bien que la radiographie conventionnelle soit quelque peu limitée dans l'évaluation de la coiffe des rotateurs et que ses résultats ne deviennent pathognomoniques que chez les patients présentant une déchirure chronique, les études d'imagerie antérieures doivent être revues avant de commencer l'examen échographique. Informer le patient ou le médecin référent la veille de l'examen garantira généralement la disponibilité de ces études. Les radiographies standard sont les études d'imagerie les plus courantes réalisées avant l'examen américain. Les changements pathologiques associés aux troubles de la coiffe des rotateurs comprennent des calcifications intratendineuses ou bursales, des éperons acromiaux, des érosions et une sclérose des tubérosités, un espace sous-acromial réduit avec une subluxation supérieure de la tête humérale et un acromion latéral descendant ou volant à basse altitude. Les ostéophytes huméraux inférieurs, les modifications arthrosiques et les ostéophytes sous-jacents de l'articulation acromio-claviculaire, ainsi que les modifications osseuses liées à des interventions chirurgicales antérieures peuvent également être appréciées. Dans la luxation antérieure de l'épaule, une fracture par compression sur la face postéro-latérale de la tête humérale - communément appelée fracture de Hill-Sachs - est considérée comme le résultat d'une impaction de la tête humérale déplacée contre la face antérieure du bord glénoïdien. De même, dans le cadre d'une luxation postérieure de l'épaule, une fracture par compression de la face antéro-médiale de la tête humérale, dite lésion inversée de Hill-Sachs ou de McLaughlin, peut être rencontrée en raison de l'impaction de l'humérus contre le rebord glénoïdien postérieur. Ces deux anomalies peuvent être détectées sur des radiographies simples et doivent rediriger l'examen échographique vers un problème d'instabilité. L'examinateur doit être conscient que la disponibilité de radiographies standard permet de gagner du temps et est essentielle pour l'interprétation adéquate d'images échographiques gênantes liées à des troubles qui peuvent être plus évidents sur des films simples.
19. DÉPART THORACIQUE ET PATHOLOGIE DU PLEXUS BRACHIAL
La pathologie du défilé thoracique est classiquement divisée en deux types principaux - vasculaire et neurogène - bien que les signes et symptômes de piégeage vasculaire et nerveux, tels que la douleur, l'engourdissement, les picotements, la faiblesse et d'autres troubles du membre supérieur, coexistent souvent en un seul tableau clinique. En général, les nerfs du plexus brachial sont plus souvent impliqués que les vaisseaux sous-claviers. Les syndromes du plexus brachial ressemblent souvent à des neuropathies de compression plus distales et sont souvent confondus avec une compression de niveau inférieur (c'est-à-dire, canal carpien, tunnel cubital). Pour les distinguer du piégeage distal de nerfs individuels, il faut considérer que les anomalies du système sensoriel et moteur rencontrées dans la pathologie du plexus brachial ne sont, en général, pas clairement attribuables à un seul nerf. Les patients présentant une atteinte du plexus supérieur (niveau C5-C7) se plaignent de douleurs dans la région du trapèze et de l'épaule, avec des symptômes irradiant le long de la face latérale de l'extrémité jusqu'au territoire d'innervation du nerf médian. Les symptômes moteurs comprennent une faiblesse de l'abduction de l'épaule (atteinte du deltoïde et du sus-épineux) et de la rotation externe (atteinte de l'infra-épineux et du petit rond). Dans les cas manifestes, les patients présentent un bras étendu et en rotation interne, un avant-bras en pronation et un poignet fléchi. En revanche, les patients présentant une atteinte du plexus inférieur (niveau C8-T1) ressentent des douleurs dans la région sus-claviculaire, dans la nuque et dans l'aisselle jusqu'à la zone de la main innervée par le nerf cubital, avec des troubles sensoriels dans les quatrième et cinquième doigts. Dans les maladies de longue date, la faiblesse musculaire peut impliquer les muscles ulnaires-innervés de la main et de l'avant-bras (flexor carpi ulnaris) entraînant une déformation de la main en griffe. Les traumatismes du cou, de la ceinture scapulaire voire du membre supérieur sont souvent associés à la survenue d'un syndrome du défilé thoracique lié à l'atteinte du plexus brachial. La névrite brachiale (syndrome de Parsonage Turner) peut également être suspectée lorsque l'apparition d'une douleur et d'un handicap à l'épaule fait suite à une maladie virale ou à une intervention chirurgicale antérieure non liée. En dehors des nerfs, si la veine sous-clavière est sélectivement comprimée, les symptômes sont principalement liés à une augmentation de la pression veineuse dans le membre supérieur. Le piégeage de l'artère sous-clavière est rare et se présente généralement avec une insuffisance artérielle et une extrémité froide.
Lors de l'examen d'un patient suspecté d'un syndrome du défilé thoracique, les résultats objectifs sont, dans de nombreux cas, peu nombreux. L'examen physique doit inclure une évaluation générale des systèmes musculo-squelettique et vasculaire du membre supérieur à la recherche de changements de température et de zones d'atrophie musculaire. La zone supraclaviculaire et infraclaviculaire doit être palpée pour détecter une sensibilité et un signe de Tinel irradié. Plusieurs tests de provocation peuvent être effectués avant et pendant l'examen américain, notamment la manœuvre d'Adson (Adson et Coffey 1927), le test d'hyperabduction ou manœuvre de Wright (Wright 1945), la manœuvre d'Eden ou position militaire (Eden 1939) et la Manœuvre de Roos (Roos 1976). En particulier, la manœuvre d'Adson est effectuée en maintenant le bras du patient vers le bas et en vérifiant le pouls radial pendant que le patient inspire profondément et garde la tête étendue et tournée vers l'extrémité impliquée. La manœuvre de Wright est obtenue avec le patient assis ou debout et l'épaule en hyperabduction et rotation externe. Si le test est positif, le patient se plaint de paresthésies aux extrémités et de toute modification du pouls artériel. Le test de Roos est réalisé au moyen d'une abduction de 3 minutes avec exercice (poings serrés). Lors de l'exécution de ces tests, l'examinateur doit être conscient que des résultats positifs peuvent également se produire chez des sujets normaux.
20. RÉSULTATS AUX ULTRASONS NORMAUX ET TECHNIQUE DE BALAYAGE
Lors de l'examen de l'épaule avec US, le positionnement approprié du patient est essentiel pour permettre à l'examinateur d'accéder simultanément à l'épaule du patient et au clavier US. Le positionnement doit être confortable pour le patient et l'examinateur, et permettre l'examen de l'épaule en un temps aussi court que possible. Différentes positions de patients ont été signalées pour l'examen échographique de l'épaule, reflétant probablement la préférence et l'habitude de l'examinateur. De nombreux échographistes examinent l'épaule en utilisant une approche antérieure, debout devant le patient alors qu'il est assis sur le lit d'examen. D'une manière générale, l'approche antérieure est plus facile à apprendre pour le débutant et offre une plus grande possibilité de corréler les images échographiques avec le positionnement de la sonde en fonction des repères cutanés. Au moins à notre avis, cela est particulièrement vrai lors de l'évaluation des structures antérieures, telles que le tendon du biceps et l'intervalle des rotateurs. D'autres échographistes préfèrent réaliser l'examen par voie dorsale avec le patient assis sur le lit ou sur un tabouret tournant. Cette approche permet à l'examinateur d'effectuer un bref examen physique et empêche une courbure arrière excessive de la colonne vertébrale, améliorant ainsi l'évaluation américaine du sus-épineux (Lyons et Tomlinson 1992). De plus, l'approche dorsale facilite le guidage du patient pour adopter différents positionnements du bras et augmente la stabilité pendant le balayage (Allen et Wilson 2001). En fonction de la taille de l'examinateur et du patient, un réglage approprié du niveau du lit permet un examen plus confortable, tandis qu'un tabouret tournant facilite l'approche des différents aspects de l'articulation. Une technique supplémentaire dans laquelle le patient est examiné en décubitus dorsal avec le bras pendant sur le côté du lit a été décrite pour une meilleure évaluation de la structure interne du sus-épineux (Turrin et al. 1997 ; Turrin et Capello 1997). L'examen échographique est bien toléré par les patients et même préféré à l'IRM (Middleton et al. 2004A). Les principales raisons de cette préférence incluent probablement un temps d'examen plus court, le manque d'inconfort lié au positionnement dans l'aimant, et un environnement libre avec contact avec le personnel médical et l'absence du sentiment d'isolement et d'anxiété qui est généralement produit lors de l'imagerie IRM examens (Middleton et al. 2004a).
Étant donné que la plupart des indications de l'échographie de l'épaule concernent la coiffe des rotateurs, la majeure partie de cette section se concentrera sur l'examen de ces tendons. Avant d'aborder l'anatomie US normale et la technique d'examen de la coiffe, quelques points importants doivent être pris en compte :
- L'échographie de la coiffe des rotateurs nécessite une technique standardisée rigoureuse pour obtenir une évaluation systématique et complète des tendons individuels en un temps d'examen court.
- Lors de l'examen échographique de la coiffe des rotateurs, il est indispensable de réaliser l'évaluation de chacune des quatre unités tendino-musculaires et du tendon du biceps au moyen de plans de balayage orientés selon leur grand axe et leur petit axe. Bien que cette approche puisse sembler ennuyeuse et fastidieuse, c'est la seule façon de garantir que des découvertes pathologiques subtiles ne soient pas manquées. Cela est vrai même pour les examinateurs qualifiés.
- Chaque tendon doit être évalué systématiquement de sa jonction myotendineuse à l'insertion osseuse et dans la bonne position lors de l'étirement maximal du tendon afin que les structures osseuses qui limitent l'accès échographique, telles que l'acromion et le processus coracoïde, en soient éloignées.
21. TENDON BICEPS ET COIFFE DES ROTATEURS
Outre le type d'abord utilisé, nous réalisons un examen échographique standard des tendons de la coiffe des rotateurs en commençant par le long chef du tendon du biceps comme référence clé initiale. L'examen du biceps est ensuite suivi d'un balayage des faces antérieure (sous-scapulaire), supérieure (supraspinatus) et postérieure (infraspinatus et teres minor) de la coiffe des rotateurs. Pour éviter toute confusion avec les plans d'espace du corps, nous préférons utiliser les termes « grand axe » et « petit axe » plutôt que « longitudinal » et « transversal » pour indiquer l'orientation du plan de balayage selon l'axe de la structure examinée.
22. TÊTE LONGUE DU TENDON DU BICEPS
Chez la plupart des patients, le tendon du biceps est évalué avec le bras en position neutre. Dans la plupart des cas, une légère rotation interne du bras peut être utile pour une évaluation plus précise. Le premier repère à identifier est osseux : le sillon intertuberculaire, également appelé « gouttière bicipitale ». Il se situe entre la petite et la grande tubérosité et a un aspect concave bien défini (Fig. 20a, b). Une fois le sillon trouvé, il faut vérifier son apparence, en regardant sa profondeur et la présence d'érosions corticales focales (Fig. 20c – e). Les deux tubérosités n'ont pas le même aspect, la moindre ayant un aspect plus pointu et la plus grande un aspect plus arrondi. Il faut prendre soin d'examiner le contenu du sillon bicipital. Cette cavité contient le long chef du tendon du biceps investi par sa gaine synoviale propre, ainsi que la branche ascendante de l'artère circonflexe antérieure, située sur le côté latéral du tendon, et du tissu graisseux. (Fig. 21). La visualisation de l'artère arquée dépend de sa taille et de son débit. Chez les patients plus jeunes, on le trouve presque invariablement. La conscience de sa présence peut éviter un diagnostic erroné d'hyperémie de la gaine tendineuse. Le ligament huméral transverse apparaît comme une très fine bande hyperéchogène recouvrant le sulcus (Fig.20b).
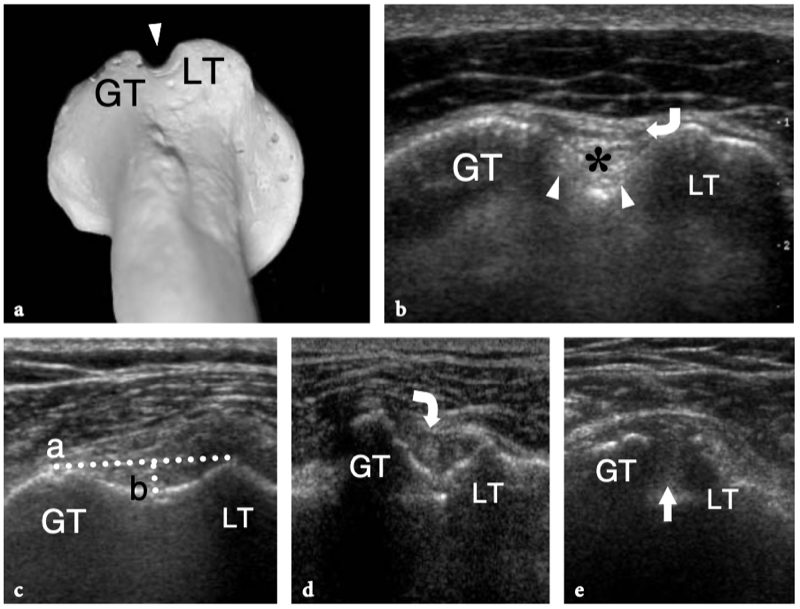
Fig. 20a–e. Sillon bicipital. a Une vue antérieure de l'humérus proximal dans une perspective caudale révèle le sillon bicipital (tête de flèche) situé entre la grande (GT) et la petite (LT) tubérosités. b L'image US transversale 12–5 MHz correspondante montre le tendon normal du biceps (astérisque) sous la forme d'une structure échogène arrondie contenue dans le sillon bicipital (têtes de flèches). Au-dessus du tendon, une couche droite hypoéchogène (flèche courbe) liée au ligament huméral transverse relie les tubérosités grande (GT) et petite (LT) transformant le sillon bicipital en tunnel ostéofibreux. L'aspect américain du sillon intertuberculaire ressemble étroitement au contour de l'os visible dans a. Dans ce cas, il a une taille et une forme normales. c Sillon intertuberculaire congénital peu profond. La rainure est plus large et a des parois plates. La profondeur de la rainure peut être mesurée sur des plans à petit axe. Une ligne (a) est d'abord tracée tangentielle aux tubérosités ; puis, la distance (b) entre cette ligne et le point le plus profond de la gouttière est calculée : une distance de 3 mm indique un sillon peu profond et peut être considérée comme une cause prédisposant à l'instabilité du tendon du biceps. d,e Ostéophytes du sillon bicipital conduisant à un sillon anormalement étroit et même à un véritable tunnel bicipital. La prolifération osseuse dans cette zone peut être associée à une attrition du tendon entraînant un rétrécissement progressif du biceps (flèche) et, éventuellement, sa rupture.
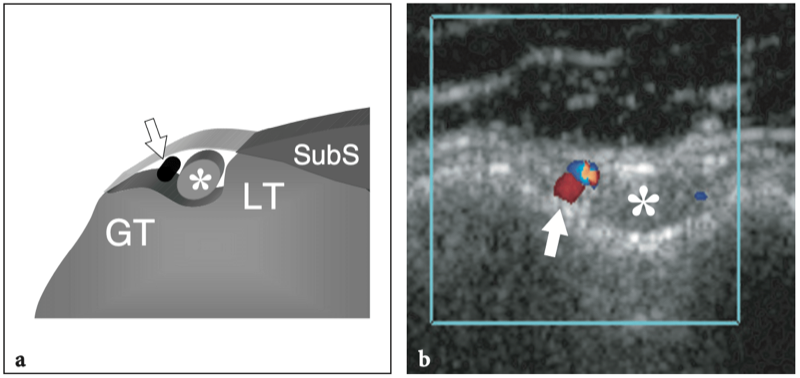
Figures 21a,b. Branche ascendante de l'artère circonflexe antérieure. a Dessin schématique d'une vue transversale à travers le sillon bicipital avec une corrélation d'imagerie Doppler couleur b montrant l'artère arquée (flèche) alors qu'elle chemine profondément vers le ligament huméral transverse et le long du tendon du biceps (astérisque). Notez les tubérosités grande (GT) et petite (LT) et l'insertion du tendon sous-scapulaire (SubS).
Les scanners petit axe sont les plans les plus utiles pour évaluer le tendon du biceps. Étant donné que ce tendon va du crâne au caudal et du superficiel au profond, une technique de balayage minutieuse est nécessaire pour le distinguer à la fois de la graisse adjacente (qui n'est pas affectée par l'anisotropie et apparaît toujours hyperéchogène) et du liquide de la gaine (Middleton et al. 1985 ). En fait, si le transducteur n'est pas maintenu parallèle au tendon, celui-ci peut apparaître artificiellement hypoéchogène imitant le fluide (Fig. 22a – c). Souvent, le transducteur doit être légèrement basculé pour assurer la meilleure visualisation de l'échotexture fibrillaire. En particulier, une légère inclinaison de la sonde (scans petit axe) ou une légère pression exercée avec son extrémité caudale sur la peau (scans grand axe) peuvent être utiles à cet effet. (Fig. 22c, d, f). Une fois que le tendon a atteint la réflectivité maximale, l'orientation du transducteur doit être maintenue constante tout en déplaçant la sonde de haut en bas. Crânialement, au niveau intra-articulaire, le tendon du biceps prend une forme plus ovale ou en croissant tout en se réfléchissant sur la tête humérale et recouvre le cartilage hyalin anéchoïque. Étant donné que le biceps est intrinsèquement beaucoup plus réfléchissant et anisotrope que le sus-épineux et le sous-scapulaire adjacents, de légers changements continus dans l'orientation du transducteur peuvent être utiles pour reconnaître le tendon dans sa partie intra-articulaire sur les balayages à petit axe. L'origine du tendon du biceps n'est pas visible en raison de problèmes d'accès. Par conséquent, les variantes anatomiques de l'origine du tendon du biceps ne peuvent pas être détectées par échographie. Le positionnement du patient en flexion postérieure peut cependant être utile pour visualiser une partie de sa partie la plus proximale émergeant du dessous de la couverture de l'acromion. Distale des tubérosités humérales, la longue portion du tendon du biceps se trouve devant la métaphyse humérale proximale. Il est important d'examiner ce niveau car même de petits épanchements ont tendance à remplir la partie la plus dépendante de la gaine tendineuse. (Fig. 23).
Fig. 22a–f. Anisotropie du tendon du biceps. a,c Images échographiques grand axe 12–5 MHz de la longue portion du tendon du biceps au niveau du sillon intertuberculaire avec corrélation de dessin schématique b,d. a,b Si l'examinateur maintient le transducteur parallèle à la peau, le tendon du biceps (têtes de flèches) apparaît légèrement hypoéchogène en raison d'une incidence oblique du faisceau échographique par rapport à ses fibres. c,d En poussant l'extrémité caudale de la sonde contre la peau, le tendon du biceps (têtes de flèches) présente une échotexture fibrillaire bien définie composée de multiples échos linéaires parallèles. e,f Les images US à axe court 12–5 MHz sur le tendon du biceps (tête de flèche) à l'aide d'un transducteur légèrement différent révèlent une structure d'apparence hypoéchogène (e) ou une structure d'apparence hyperéchogène (f) selon l'inclinaison de la sonde.
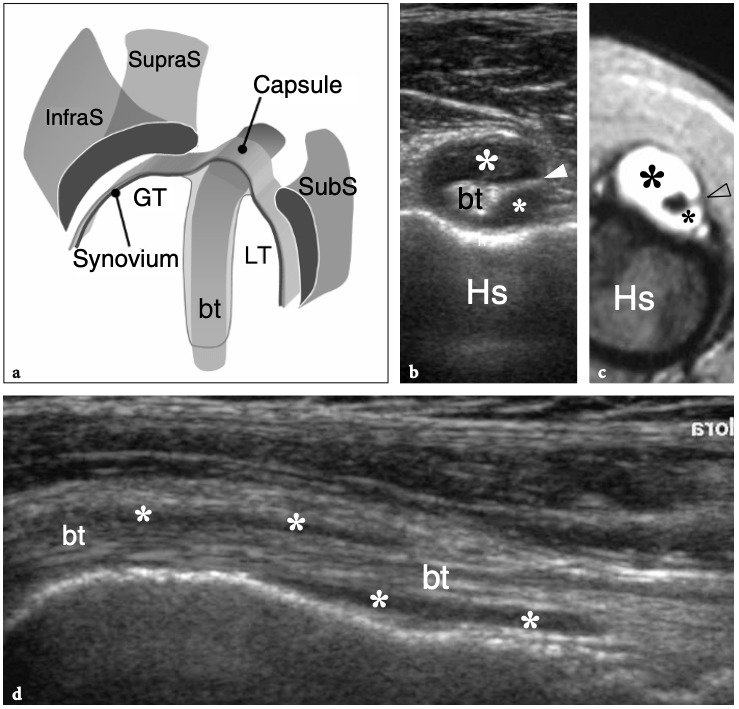
Fig. 23a–d. Gaine du tendon du biceps. un dessin schématique d'une vue coronale à travers l'épaule antérieure montre les relations de la longue tête du tendon du biceps (bt) avec les tendons de la coiffe des rotateurs, y compris le subscapularis (SubS), le supraspinatus (SupraS) et l'infraspinatus (InfraS). Dans sa partie intra-articulaire, le tendon du biceps est recouvert par la capsule de l'articulation gléno-humérale. Plus distalement, le biceps pénètre dans le sillon intertuberculaire, passant entre la grande (GT) et la petite (LT) tubérosités. A ce niveau, elle est investie par une gaine de membrane synoviale qui représente un prolongement antérieur de l'articulation gléno-humérale. b Image échographique petit axe 12–5 MHz sur le tendon du biceps (bt) obtenue à environ 2 cm sous la gouttière bicipitale avec une corrélation d'imagerie IRM transversale pondérée en T2 c montrant la gaine du tendon du biceps distendue par le liquide (astérisques). Notez le mésotendon (tête de flèche) reliant les couches viscérale et pariétale de l'enveloppe synoviale. Hs, diaphyse humérale. d L'image échographique 12 –5 MHz grand axe sur la longue portion extra-articulaire du tendon du biceps (bt) montre une petite quantité d'épanchement de la gaine (astérisques). L'extension longitudinale globale de la gaine du tendon du biceps est illustrée.
Dans cette zone, une petite quantité de liquide intragaine, insuffisante pour encercler le tendon, est une constatation normale et ne doit pas être indiquée dans le rapport. Plus caudalement, la jonction myotendineuse du tendon du biceps peut être appréciée comme une diminution progressive de la taille du tendon et une augmentation parallèle de la taille du muscle. Il se situe en profondeur du tendon du grand pectoral et latéralement à la courte tête du muscle biceps (Illustration 24a). La partie distale du biceps doit toujours être évaluée car une déchirure ou une calcification peut survenir à ce niveau. Dans l'évaluation du tendon du chef long du biceps, l'importance des scanners grand axe est limitée pour confirmer l'intégrité du tendon dans les cas douteux à partir de la visualisation de son échotexture fibrillaire. Le tendon pectoral est un tendon large et aplati qui se croise en avant du biceps pour s'insérer dans la lèvre latérale du sillon intertuberculaire, recevant les apports des trois chefs du muscle : claviculaire (couche superficielle), sternal (couche intermédiaire) et abdominal (couche profonde). couche). Lorsque le bras est en rotation interne, ce tendon prend une trajectoire arquée sur le biceps, alors qu'il devient droit en rotation externe. (Fig.24b,c). Il est mieux évalué avec le bras en abduction et en rotation externe pour stresser la région myotendineuse (Rehman et Robinson 2005). L'échographie est capable de distinguer les trois têtes du muscle grand pectoral, mais pas les composants individuels du tendon, car les trois couches tendineuses se mélangent sans tissu conjonctif significatif (Rehman et Robinson 2005).
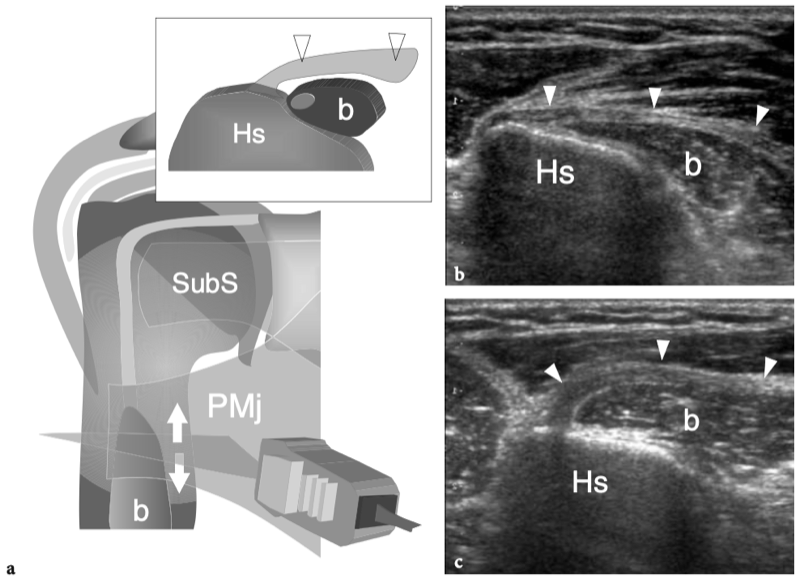
Fig. 24a–c. Tendon du grand pectoral. un dessin schématique d'une vue coronale à travers l'épaule antérieure et le haut du bras montre l'insertion humérale du grand pectoral (PMj) et les relations de son tendon avec la jonction myotendineuse du long chef du muscle biceps brachial (b) et le subscapularis plus crânien (SubS). En raison de sa large insertion, le tendon pectoral est mieux examiné au moyen de plans transversaux déplaçant la sonde de haut en bas sur lui (flèches). L'insert en haut à droite de l'image illustre la relation entre le tendon du grand pectoral (têtes de flèches) et la jonction myotendineuse sous-jacente du biceps brachial (b). Hs, diaphyse humérale. b,c Images échographiques transversales 12–5 MHz obtenues sur le grand axe du tendon du grand pectoral (têtes de flèches) tandis que le bras est maintenu b en rotation externe et c interne. En rotation externe, le tendon a une trajectoire rectiligne poussant la jonction myotendineuse du biceps vers la profondeur. En rotation interne, le tendon est relâché et a tendance à prendre une trajectoire arquée sur le biceps. Notez la position plus antérieure du biceps par rapport à l'insertion du pectoral sur la diaphyse humérale (Hs).
23. TENDON SOUS-SCAPULARIS
Après examen du biceps, le patient est invité à effectuer une rotation externe du bras afin d'évaluer le tendon sous-scapulaire sur la face antérieure de l'épaule. Cette manœuvre étire le sous-scapulaire et aide à déplacer son tendon du dessous du processus coracoïde vers une position plus superficielle pour un examen adéquat. (Fig. 25). Le balayage dynamique pendant la rotation interne et externe passive avec le bras en adduction peut également être utile pour évaluer l'intégrité du sous-scapulaire. Pendant que le bras est en rotation externe, l'examinateur doit se rappeler de neutraliser la tendance du patient à soulever et enlever le coude de la paroi latérale de la poitrine. Cela peut être facilement évité en gardant la main en supination tout en faisant pivoter le bras vers l'extérieur. Les conditions limitant la rotation externe, telles que le moulage de l'épaule, peuvent conduire à une mauvaise délimitation des structures antérieures. Chacune de ces contraintes doit être indiquée dans le rapport.
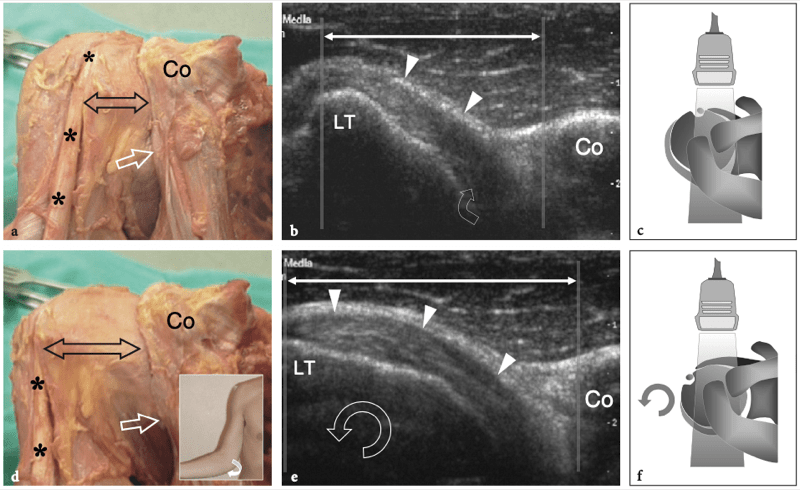
Fig. 25a–f. Tendon sous-scapulaire. a,d Vues cadavériques brutes sur le tendon sous-scapulaire après ablation du deltoïde et des structures formant l'arc coraco-acromial avec b,e images échographiques 12–5MHz grand axe correspondantes obtenues in vivo en gardant le bras a,b en position neutre et c ,d en rotation externe. Sur les images cadavériques, observez la relation du tendon sous-scapulaire (double flèche) avec le long chef du tendon du biceps (astérisques), l'apophyse coracoïde (Co) et le tendon conjoint du petit chef du biceps et du coracobrachial (flèche ). En position neutre et, plus encore, en rotation interne, l'aspect américain du tendon du sous-scapulaire (têtes de flèches) apparaît artéfactuellement hypoéchogène (flèche courbe) du fait de son parcours oblique de surface en profondeur jusqu'à disparaître, pour l'essentiel, sous la coracoïde. En revanche, en rotation externe (voir aussi encadré en d), le tendon est repositionné dans une localisation plus superficielle et latérale pour un examen adéquat. Notez l'insertion du tendon sous-scapulaire dans la petite tubérosité (LT). Les barres verticales grises indiquent l'extension globale du tendon telle qu'elle apparaît sur les images américaines. c,f Des dessins schématiques illustrent la relation entre la sonde et le tendon sous-scapulaire (en noir) tandis que le bras est maintenu c en position neutre et f en rotation externe (flèche courbe).
Lorsqu'elle est examinée sur son petit axe, la structure multipennée du tendon sous-scapulaire normal crée une série de fentes hypoéchogènes entre les fascicules qui ne doivent pas être confondues avec des déchirures tendineuses. (Fig. 26). En fait, ces fentes sont liées à des fibres musculaires interposées avec des faisceaux tendineux. Sur les scanners à petit axe, la petite tubérosité a un aspect plat se terminant par un contour lisse en pente descendante situé juste en caudale par rapport à l'insertion du tendon (Fig. 26). Un tel repère osseux serait utile lors de l'évaluation des déchirures partielles du sous-scapulaire car il indique la limite caudale de l'insertion du tendon. Étant donné que les déchirures partielles impliquent souvent la partie crânienne du tendon et préservent sa partie caudale, la vérification de la forme de la petite tubérosité augmenterait la confiance dans l'exclusion d'une déchirure complète. Sur son grand axe, le tendon sous-scapulaire a une forme convexe sur le profil curviligne de la tête humérale et est délimité par une couche échogène représentant la graisse sous-deltoïdienne (Fig. 27). Dans les scanners les plus médiaux, la tête humérale apparaît recouverte d'une couche de cartilage articulaire. Lors de l'examen du tendon du sous-scapulaire sur des plans à axe long, il faut être conscient que ce tendon est large et, par conséquent, nécessite que le transducteur soit balayé de haut en bas jusqu'à ce que sa pleine largeur soit démontrée. (Fig.27b). De plus, il faut savoir que l'insertion proprement dite du tendon sous-scapulaire implique une portion limitée du petit tubercule qui est placée latéralement, à proximité de la gouttière bicipitale. (Illustration 27a). En déplaçant la sonde médialement sur des plans transversaux, le processus coracoïde apparaît comme une structure hyperéchogène arrondie. Avec la rotation interne du bras, on voit disparaître le tendon sous-scapulaire sous l'occultation acoustique de la coracoïde (Fig. 25a – c). Les insertions du chef court du biceps (latéral), du coracobrachial et du petit pectoral (médial) sur l'apophyse coracoïde peuvent être appréciées en déplaçant la sonde caudalement vers l'os : le tendon du chef court du biceps est plus long que celle du muscle coracobrachial (Fig. 28). Au plus profond de ces structures extrinsèques, le ventre musculaire du sous-scapulaire, la face antérieure de la glène et le labrum antérieur peuvent être mis en évidence chez des sujets grêles. Lorsque des plans de petit axe sont obtenus, il faut veiller à ne pas confondre le ventre du muscle sous-scapulaire avec un épanchement hypoéchogène dans la partie antérieure dépendante de la bourse sous-deltoïdienne sous-acromiale ou de l'évidement articulaire antérieur. Surtout chez les patients obèses, l'évaluation échographique de ces dernières structures peut être problématique et nécessite des sondes à basse fréquence (7.5–5 MHz).
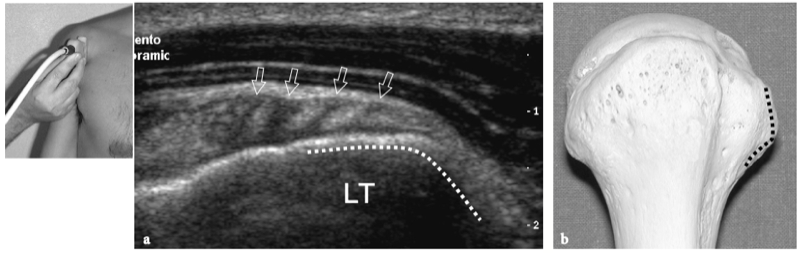
Figure 26a,b. Tendon sous-scapulaire normal. une image US sagittale 12–5 MHz sur le petit axe du tendon sous-scapulaire révèle une série de fentes hypoéchogènes (flèches) à travers la substance tendineuse reflétant sa structure multipennée. Observez l'aspect plat de la petite tubérosité (LT), qui se termine par un contour lisse en pente descendante (ligne pointillée) juste caudalement à l'insertion du tendon. b La photographie sur la face latérale de la tête humérale illustre la forme de la petite tubérosité (ligne pointillée) telle qu'illustrée par l'échographie. L'insert en haut à gauche de la figure indique le positionnement de la sonde.
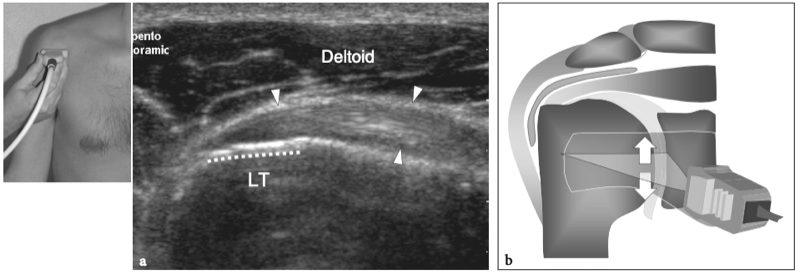
Figure 27a,b. Tendon sous-scapulaire normal. a Image US transversale 12–5 MHz sur le grand axe du tendon sous-scapulaire (têtes de flèches). Ce tendon est situé en profondeur du muscle deltoïde antérieur et juste en surface de la tête humérale. Il a une forme convexe et une échotexture fibrillaire bien définie. Notez la zone relativement petite (ligne pointillée) de la petite tubérosité (LT) sur laquelle le tendon s'insère. b Le dessin schématique d'une vue coronale à travers l'épaule antérieure illustre la technique d'examen. En raison de la large insertion du tendon, le transducteur doit être balayé (flèches) de haut en bas pour couvrir toute sa largeur. L'insert en haut à gauche de la figure indique le positionnement de la sonde.
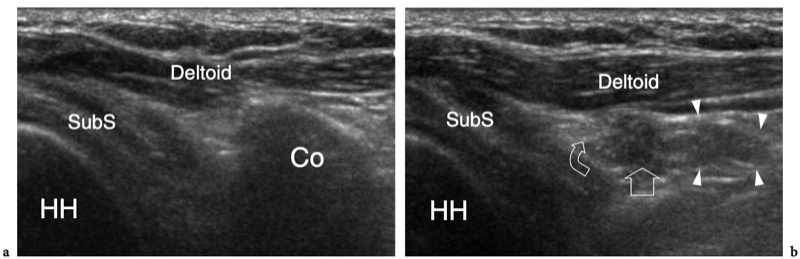
Figure 28a,b. Tête courte du tendon du biceps, du coracobrachial et du petit pectoral. a,b Images US transversales 12–5 MHz obtenues a au niveau de l'apophyse coracoïde de l'omoplate et b à environ 2 cm caudale de celle-ci. En a, la relation de la coracoïde (Co) avec la tête humérale (HH), le tendon sous-scapulaire (SubS) et le muscle deltoïde sont illustrés. La coracoïde est facilement identifiable à l'échographie du fait de sa position médiale par rapport à la tête humérale et de l'aspect hyperéchogène curviligne de sa surface osseuse. En b, on voit trois structures individuelles découlant de la coracoïde. De latéral à médial, ce sont : le tendon hyperéchogène du chef court du biceps (flèche courbe), la jonction myotendineuse hypoéchogène du coracobrachial (flèche droite) et celle du petit pectoral (têtes de flèches).
24. TENDON SUPRASPINATUS
En raison de sa position particulière entre l'arc acromio-claviculaire et la tête humérale, seule la partie distale du tendon sus-épineux peut être examinée en maintenant le bras du patient en position neutre. (Illustration 29a). Pour obtenir une visualisation plus complète de ce tendon, on demande au patient d'étendre le bras vers l'arrière, en plaçant la face palmaire de la main sur la face supérieure de l'aile iliaque avec le coude fléchi, dirigé vers l'arrière et vers la ligne médiane, de sorte que le l'acromion en est éloigné (Fig.29b). Avec cette manœuvre (communément appelée position modifiée de Crass ou Middleton), le tendon est représenté dans toute son étendue, incluant même la visualisation de sa jonction myotendineuse (Crass et al. 1988b ; Middleton et al. 1992). Lorsque le patient adopte cette position, le sus-épineux tourne et devient une structure plus antérieure (Fig.29b). Certains auteurs ont également proposé une rotation interne forcée pour l'imagerie du tendon sus-épineux sous contrainte. Cette position, appelée manœuvre d'effort ou position de Crass, est obtenue en gardant l'épaule en extension, en adduction et en rotation interne avec le coude fléchi, la paume tournée vers l'extérieur et les doigts pointant vers l'omoplate controlatérale (Crass et al 1987). Il ne doit pas y avoir d'espace entre le coude et la paroi latérale de la poitrine. Nous pensons que cette dernière position joue un rôle dans l'augmentation de la confiance diagnostique dans l'interprétation des résultats pathologiques subtils (c'est-à-dire, une déchirure d'épaisseur partielle) en appliquant plus de tension sur les fibres tendineuses intactes ou en éloignant le liquide de la bourse d'une déchirure pour mieux délimiter sa largeur . Cependant, l'examen du sus-épineux sous contrainte présente certains inconvénients : cette position est souvent mal tolérée par le patient et, dans de nombreux cas, ne permet pas une visualisation correcte et complète de toute la largeur du sus-épineux car la rotation interne excessive entraîne une évaluation plus difficile de son tiers antérieur et des structures de l'intervalle de la coiffe des rotateurs, trop déplacées en dedans. En plus du balayage statique, une évaluation dynamique du conflit sous-acromial peut être tentée en plaçant la sonde dans le plan coronal avec sa marge médiale à la marge latérale de l'acromion. Le patient est invité à enlever son bras pendant qu'il est en rotation interne. Avec cette manœuvre, le sus-épineux et la bourse peuvent être vus passer profondément à l'arc coracoacromial. Dans les conditions dégénératives, cette manœuvre permet d'apprécier le glissement difficile du tendon épaissi et de la bourse sous-acromiale sous l'acromion (Fig. 30).
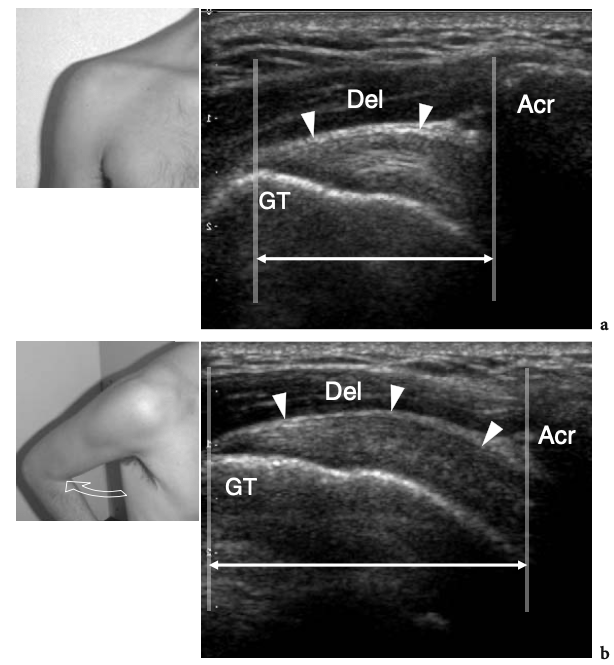
Figure 29a,b. Positionnement approprié pour la visualisation du tendon sus-épineux. Images échographiques grand axe 12–5 MHz obtenues sur le tendon sus-épineux (têtes de flèches) avec le bras a en position neutre et b fléchi au niveau du coude tout en gardant la main placée sur la crête iliaque postérieure et le coude dirigé vers l'arrière (Crass ou Middleton modifié positionner). Le tendon sus-épineux apparaît comme une structure échogène épaisse (têtes de flèches) émergeant du dessous de l'acromion (Acr) pour s'insérer dans le trochiter (GT). En b, l'acromion est éloigné du tendon et peut être représenté dans toute son étendue, incluant même la visualisation de sa jonction myotendineuse. Les barres verticales grises indiquent l'extension respective du tendon telle qu'elle apparaît sur les images américaines. Dans cette position, il est important de réaliser que le grand axe du tendon est orienté à environ 45° entre les plans sagittal et coronal. Del, deltoïde. Les inserts en haut à gauche de la figure indiquent le positionnement des bras.
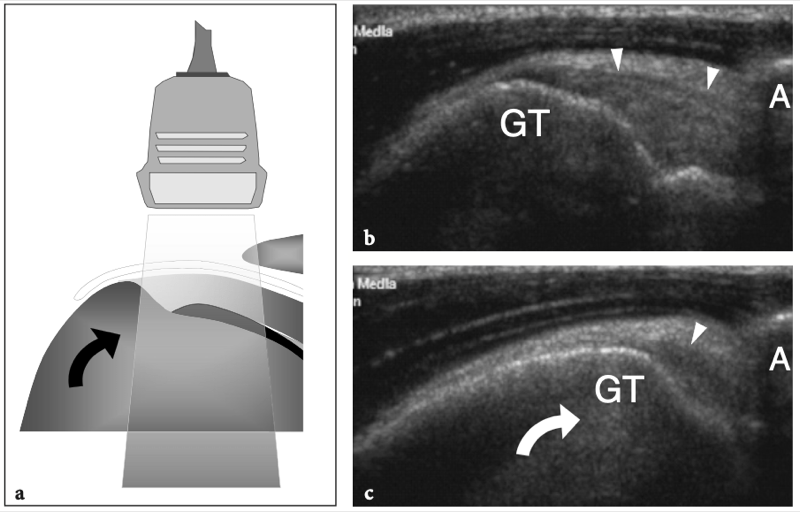
Figures 30a–c. Manœuvre de conflit sous-acromial. a Le transducteur est placé dans le plan coronal avec sa marge médiale sur le bord latéral de l'acromion. L'échographie dynamique est réalisée avec le bras b en position neutre puis c en abduction progressive en rotation interne. Avec cette manœuvre, l'échographie permet une visualisation directe des relations entre l'acromion (A), la tête humérale et le sus-épineux intermédiaire (têtes de flèches) et la bourse sous-deltoïdienne sous-acromiale pendant le mouvement actif de l'épaule (flèche), fournissant ainsi des informations sur les causes potentielles du syndrome de conflit d'épaule. GT, grosse tubérosité. Dans les états normaux, le passage du tendon sus-épineux n'est pas obstrué.
Sur les scanners à grand axe, le tendon du sus-épineux apparaît comme une structure convexe en forme de bec s'étendant profondément jusqu'à la graisse sous-deltoïdienne et la bourse sous-deltoïdienne sous-acromiale et superficielle jusqu'au cartilage articulaire, qui apparaît comme une bande hypoéchogène lisse se terminant au bord de la convexité de la tête humérale, le col huméral, où commence la grosse tubérosité (Illustration 31a). La forme de la tête humérale est un repère essentiel lors de l'examen du tendon sus-épineux et de son insertion sur la face crânienne du tubercule majeur. (Fig. 32). Semblable à d'autres tendons de la coiffe, le sus-épineux se situe entre deux cavités : l'articulation gléno-humérale, qui s'étend entre elle et le cartilage jusqu'au col huméral, et la bourse sous-acromiale sous-deltoïdienne qui se trouve juste au-dessus du tendon et en est généralement séparée par une fine couche hyperéchogène de graisse péribursale (Fig. 32). Dans des états normaux, ces cavités sont effondrées et, par conséquent, non visibles. Souvent, la bourse ne peut pas être séparée du tendon et peut parfois être vue bombée au-delà du bord latéral de la tubérosité (Illustration 31a). Dans de tels cas, il ne peut pas être confondu avec les fibres tendineuses superficielles. Ensuite, il ne faut pas confondre les fibres musculaires hypoéchogènes au niveau de la jonction myotendineuse avec une déchirure proximale. Le deltoïde recouvre la bourse et s'insère dans le bord latéral de l'acromion par un tendon très court (Fig. 29a, b). Le tendon sus-épineux normal a une épaisseur d'environ 6 mm. Des tendons plus gros peuvent parfois être observés chez les athlètes, alors que l'épaisseur de la coiffe des rotateurs chez les femmes et les patients âgés a tendance à être inférieure à celle des hommes actifs plus jeunes (Crass et al. 1988).
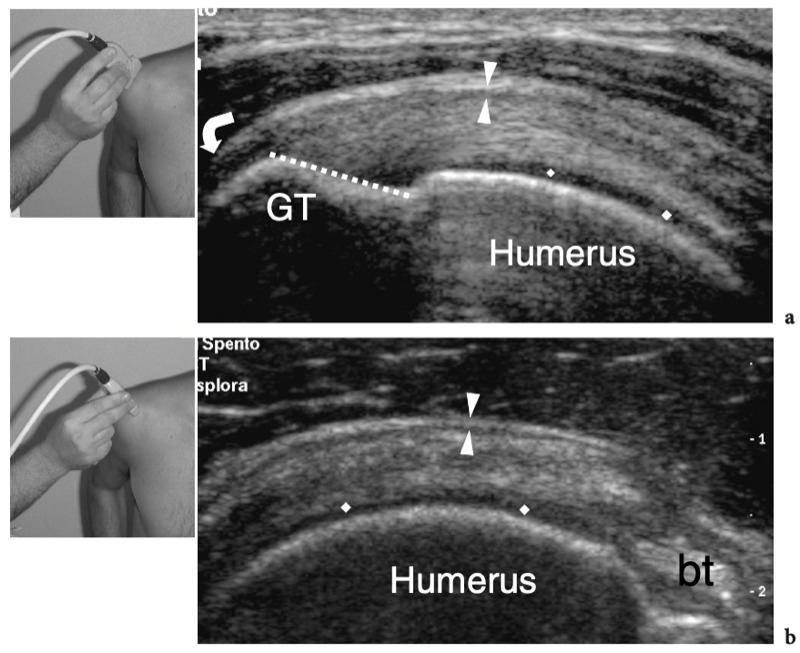
Figure 31a,b. Tendon sus-épineux normal. une image échographique grand axe 12–5 MHz sur le tendon sus-épineux. Ce tendon a une forme convexe en forme de bec caractérisée par un motif homogène d'échos de niveau moyen. Il repose sur le cartilage hypoéchogène (losanges) de la tête humérale avant de s'insérer dans la grosse tubérosité (GT). La bourse sous-acromiale sous-deltoïdienne (têtes de flèches) recouvre le tendon et peut s'étendre latéralement (flèche incurvée) pour se renfler au-delà du bord latéral de la tubérosité. Dans cette zone, la bourse ne peut être confondue avec les fibres tendineuses externes. b L'image échographique 12–5 MHz à petit axe sur le tendon sus-épineux montre la partie intra-articulaire échogène ovale du tendon du biceps (bt) située en avant et en dedans de celui-ci. Le tendon sus-épineux se situe entre le cartilage huméral (losanges) et la bourse sous-deltoïdienne sous-acromiale (têtes de flèches). Les inserts en haut à gauche de la figure indiquent le positionnement du transducteur.

Figure 32a,b. Repères anatomiques du tendon sus-épineux. a Photographie montrant une vue coronale de la tête humérale. Le col huméral (tête de flèche) sépare latéralement le tubercule majeur, où s'insère le tendon du sus-épineux, de la tête humérale, sur laquelle repose le tendon du sus-épineux. b Le dessin schématique d'une vue coronale à travers la tête humérale montre la position du tendon sus-épineux (SupraS) par rapport aux repères osseux décrits en a. Notez que l'insertion du tendon (ligne pointillée) s'étend du col huméral (tête de flèche) à l'angle supérolatéral de la grosse tubérosité (GT). Semblable aux autres tendons de la coiffe, le sus-épineux se situe entre deux cavités : l'articulation gléno-humérale (flèche droite) qui s'étend entre elle et le cartilage jusqu'au col huméral, et la bourse sous-acromiale sous-deltoïdienne (flèche courbe) située juste au-dessus du tendon et généralement séparée de celle-ci par une fine couche hyperéchogène de graisse péribursale. La bourse s'étend au-delà du bord latéral de la grosse tubérosité.
Lors de l'examen de l'épaule en flexion postérieure, des doutes peuvent surgir, surtout chez les débutants, sur l'orientation correcte de la sonde selon le grand axe réel du tendon. Pour résoudre ce problème, une astuce consiste à se référer à la partie intra-articulaire du biceps comme point de repère pour obtenir un positionnement correct du transducteur pour l'imagerie du sus-épineux. (Fig. 6.33). En fait, les deux tendons sont parallèles l'un à l'autre et le biceps intra-articulaire est facilement reconnaissable grâce à son schéma fibrillaire plus clairement défini. L'examinateur doit d'abord faire pivoter le transducteur jusqu'à ce que le biceps soit aussi allongé que possible sur l'image américaine (environ 45 % entre les plans coronal et sagittal) (Fig. 33a,b). Ensuite, la sonde est déplacée vers l'arrière sur le sus-épineux sans changer son orientation (Fig.33c,d). L'image résultante sera le long de l'axe du sus-épineux. Sur les scanners à grand axe, un site typique où l'anisotropie peut créer des pièges est la zone tendineuse recouvrant le col anatomique de l'humérus. Dans cette zone, l'anisotropie est produite par une trajectoire courbe divergente des fibres articulaires du tendon à l'approche de l'insertion et ne doit pas être confondue avec une déchirure partielle de la coiffe des rotateurs (Fig. 34). Il est important de basculer doucement le transducteur pour visualiser correctement cette partie du tendon, dans un plan perpendiculaire au faisceau US. En fait, les déchirures d'épaisseur partielle se produisent couramment sur ce site et ont une apparence similaire. Contrairement au sous-scapulaire, le tendon sus-épineux normal est composé d'une matrice homogène d'échos de niveau moyen, un aspect quelque peu différent des autres tendons du corps, qui ont une structure fibrillaire bien définie. (Illustration 31a). Ce schéma semble être le résultat d'une orientation variée des fibres car le sus-épineux et l'infra-épineux s'évasent et s'interdigitent. (Fig. 35).
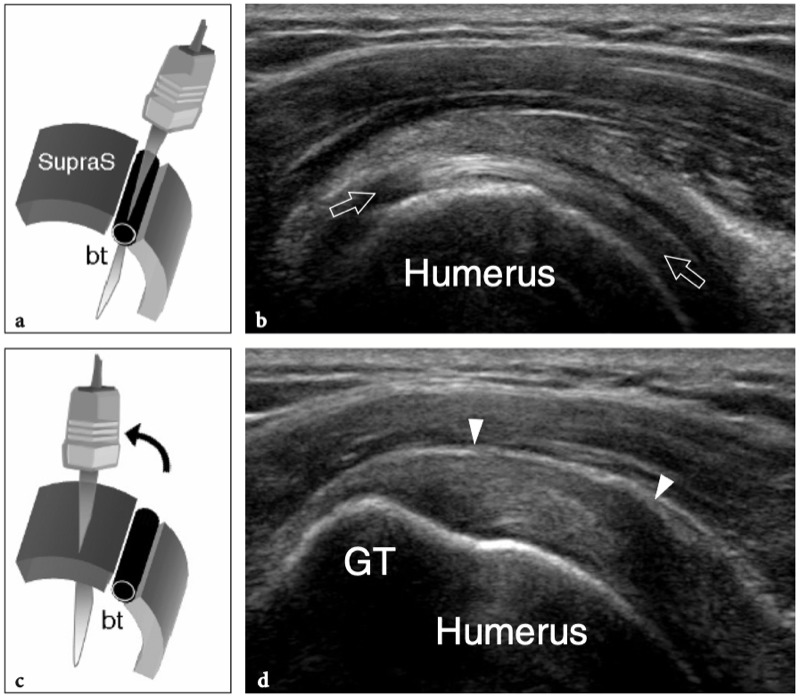
Fig. 33a–d. Orientation correcte du transducteur pour évaluer le tendon sus-épineux selon son grand axe. a,c Dessins schématiques au-dessus de l'épaule montrant le positionnement du transducteur et b,d images américaines 12–5 MHz correspondantes. a,b L'examinateur se réfère d'abord à la partie intra-articulaire du tendon du biceps comme point de repère en raison de son motif fibrillaire bien défini. Le transducteur est ensuite tourné dessus jusqu'à ce que le biceps apparaisse aussi allongé que possible dans le champ de vision de l'image US (flèches). c,d Après cela, la sonde est déplacée vers le haut et vers l'arrière sur le tendon sus-épineux (têtes de flèches) sans changer son orientation. L'image résultante est dans l'axe avec le sus-épineux. GT, grosse tubérosité.
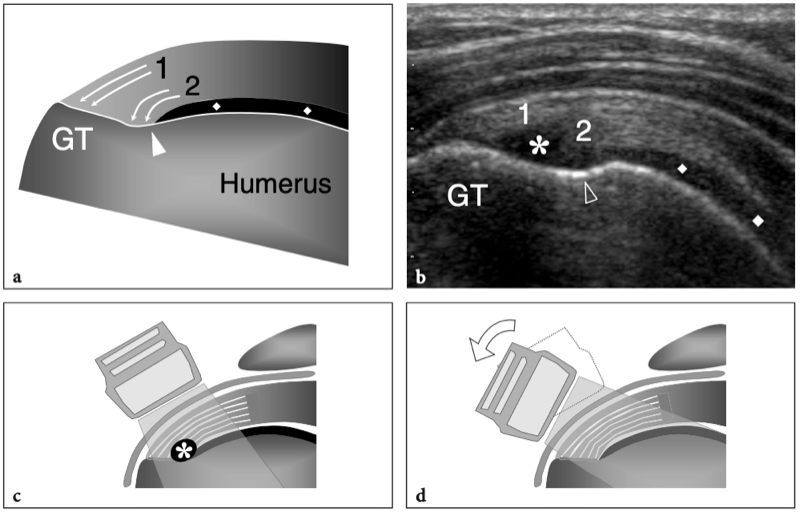
Figures 34a–d. Artefact hypoéchogène dans le tendon sus-épineux imitant la maladie. a Le dessin schématique à travers l'axe longitudinal du tendon sus-épineux avec b l'image US 12–5 MHz correspondante révèle un parcours droit des fibres tendineuses plus superficielles (1) à l'approche de l'insertion dans le trochiter (GT). En revanche, les fibres articulaires du tendon (2) adoptent une trajectoire courbe divergente dans la zone préinsertionnelle, conduisant éventuellement à un artéfact hypoéchogène (astérisque) lié à l'anisotropie. L'apparence de cet artefact imite étroitement une déchirure d'épaisseur partielle du côté articulaire du sus-épineux. Notez le cartilage huméral hypoéchogène (losange) et le col huméral (tête de flèche). c,d Les dessins schématiques à travers l'axe longitudinal du tendon sus-épineux illustrent le positionnement correct du transducteur pour corriger cet artefact. La sonde doit être légèrement basculée pour visualiser la partie préinsertionnelle du tendon dans un plan aussi perpendiculaire que possible au faisceau US.
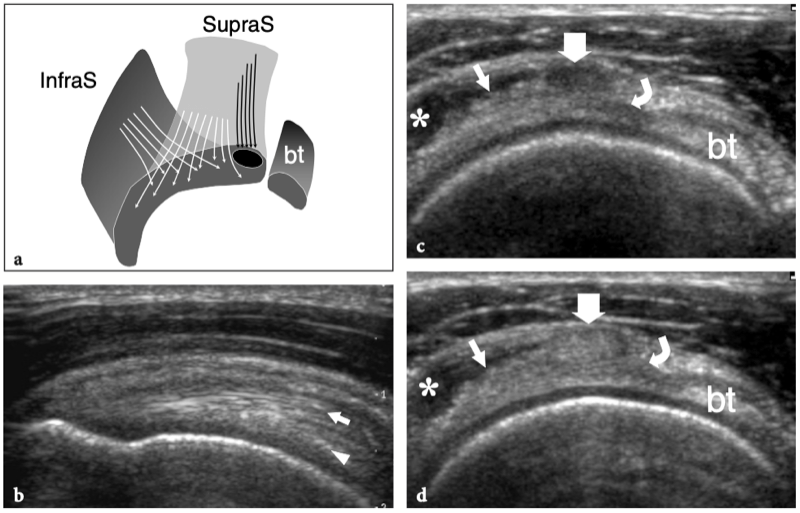
Figures 35a–d. Échotexture du tendon sus-épineux. un dessin schématique d'une vue latérale à travers la coiffe des rotateurs montre le tendon du sus-épineux (SupraS) composé d'un faisceau cylindrique de fibres (lignes noires) avec un parcours droit provenant de la partie antérieure du ventre musculaire et un composant plat (flèches blanches) qui se rétrécit vers l'arrière et infiltre la surface inférieure du tendon cylindrique. Ce dernier composant est prédominant et renferme des fibres entrecroisées issues des tendons sus-épineux et infra-épineux (InfraS). bt, tendon du biceps. b L'image US 12–5 MHz grand axe sur le tiers antérieur du sus-épineux montre le faisceau cylindrique antérieur (noir en a) caractérisé par une échotexture fibrillaire bien définie (flèche) par rapport au composant tendineux plat adjacent (tête de flèche). c,d Images échographiques transversales 12–5 MHz sur les deux tiers antérieurs du tendon sus-épineux obtenues avec une orientation légèrement différente du transducteur. Notez l'anisotropie intense affectant le faisceau cylindrique antérieur de fibres (grosse flèche). Ce composant tendineux apparaît alternativement comme une structure ovale hypoéchogène ou hyperéchogène, tandis que le composant plat adjacent situé en profondeur (flèche courbe) et latéral (flèche fine) conserve la même réflectivité malgré l'inclinaison du transducteur. L'astérisque indique les fibres musculaires appartenant à la jonction myotendineuse du tendon sus-épineux. bt, tendon du biceps.
En d'autres termes, lorsque le balayage est obtenu selon l'axe du tendon, le plan peut ne pas être dans l'axe réel des fibres du tendon pour produire des échos spéculaires intenses. Néanmoins, il existe une portion tendineuse plus fibrillaire en échotexture et anisotrope dans le sus-épineux : elle est située antérieurement et semble liée à un faisceau cylindrique de fibres à trajet rectiligne issu de la partie antérieure du ventre musculaire. Cette portion de tendon peut imiter un tendon du biceps en raison de sa forte anisotropie (Fig.35b,d). L'autre partie plate du tendon se rétrécit vers l'arrière et s'infiltre dans la face inférieure du tendon cylindrique. On observe parfois une bande hypoéchogène séparant les parties plane et cylindrique du tendon : il ne faut pas la confondre avec une déchirure de la coiffe des rotateurs.
Dans son petit axe, le sus-épineux présente une forme convexe et est composé d'une texture homogène d'échos de niveau moyen (Fig.31b). Comme le reste de la coiffe, le sus-épineux apparaît généralement plus échogène par rapport au muscle deltoïde sus-jacent. Les différentes portions du tendon (antérieur et postérieur) doivent être examinées séparément pour éviter les problèmes liés à l'anisotropie. Alors que le bord antérieur du supraspinatus est clairement apprécié, il n'y a pas d'interface claire entre le supraspinatus et l'infraspinatus en raison de la structure entrelacée de ces tendons. En fait, le sus-épineux et l'infra-épineux forment un continuum et ne peuvent être clairement distingués ni à l'échographie ni à l'arthroscopie. Si la sonde est déplacée trop vers l'arrière sur des plans à petit axe, une disposition multicouche des fibres tendineuses peut parfois être appréciée avec une orientation différente par rapport au sus-épineux (Fig. 36). Ces fibres appartiennent à l'infraspinatus et sont donc imagées hors du plan. Il ne faut pas les confondre avec la partie la plus postérieure du sus-épineux. Pour séparer la contribution des deux tendons, certains auteurs ont suggéré que le sus-épineux mesure environ 1.5 cm de largeur ; par conséquent, sur les plans à axe court, le premier 1.5 cm de la coiffe des rotateurs situé juste en arrière du tendon du biceps est censé représenter le tendon du sus-épineux et la partie postérieure suivante de la coiffe, l'infraspinatus (Fig. 37a, b) (Teefey et al. 1999, 2000a). Nous pensons que cette méthode présente des limites liées à la masse corporelle différente des sujets et à la structure complexe de ces tendons. Alternativement, on pourrait tenter d'obtenir des images échographiques plus proximalement, au niveau des jonctions myotendineuses de ces tendons : un plan de séparation entre eux peut parfois être observé (Fig.37c,d).
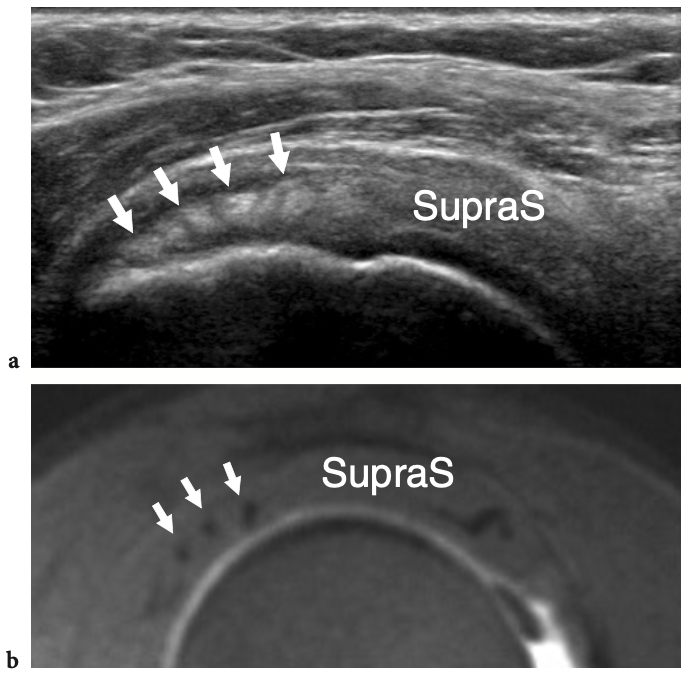
Figure 36a,b. Jonction tendon sus-épineux-infra-épineux. une image échographique grand axe 12–5 MHz au-dessus de la jonction tendon sus-épineux-infra-épineux obtenue tout en gardant la sonde orientée pour l'évaluation du tendon supra-épineux dans son axe long comme décrit à la Fig. 6.33. b Lors d'un déplacement postérieur excessif de la sonde, une disposition multicouche des fibres tendineuses (flèches) apparaît. Ces fibres ne doivent pas être confondues avec le tendon du sus-épineux postérieur (SupraS) car elles appartiennent à l'infraspinatus. Lorsque cette constatation est appréciée lors du balayage, le transducteur doit être déplacé vers l'avant pour examiner le sus-épineux ou doit être changé selon la position décrite sur la figure 42 pour examiner l'infraspinatus car ces fibres sont imagées hors du plan.
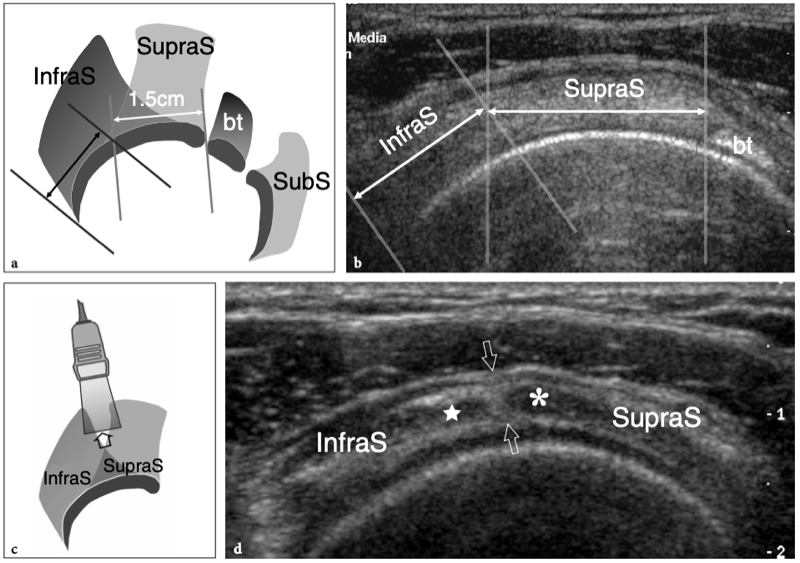
Figures 37a–d. Jonction tendon sus-épineux-infra-épineux. a Dessin schématique d'une vue latérale à travers la coiffe des rotateurs avec b image US 12–5 MHz correspondante obtenue selon l'axe court des tendons montre le sus-épineux (SupraS) et l'infraspinatus (InfraS) comme des structures entrelacées et fusionnées. Afin de les séparer quelque peu, on peut considérer que le tendon sus-épineux mesure environ 1.5 cm de large. Par conséquent, sur les plans à petit axe, les premiers 1.5 cm de la coiffe des rotateurs situés juste en position postérolatérale au tendon du biceps (bt) peuvent être référés au tendon sus-épineux et la partie postérieure suivante de la coiffe à l'infraspinatus. SubS, sous-scapulaire. c Dessin schématique d'une vue latérale à travers la coiffe des rotateurs avec d image US 12–5 MHz correspondante obtenue en plaçant le transducteur de manière proximale, au niveau de la jonction myotendineuse du sus-épineux (SupraS) et de l'infraspinatus (InfraS), révèle les deux muscles (astérisque et étoile) séparés par un plan de clivage hyperéchogène intermédiaire (flèches). Ce plan peut être considéré comme une séparation idéale entre le sus-épineux et l'infra-épineux.
En déplaçant le transducteur à un niveau plus proximal, le ligament coracoacromial peut être vu comme une bande fibrillaire joignant l'acromion à la coracoïde. Ce ligament est normalement droit ou légèrement convexe et peut être vu recouvrant la jonction myotendineuse du sus-épineux et du biceps (Fig. 38). Sur son petit axe, le ligament coraco-acromial est plus difficilement appréciable du fait d'une échogénicité similaire avec la graisse environnante et ne peut être mis en évidence qu'en cas de distension de la bourse liée à un conflit et à une bursite septique en signe d'échancrure sur la paroi de la bourse. En dedans de l'arc coracoacromial, le muscle sus-épineux peut être vu comme une structure trapézoïdale hypoéchogène située sous le trapèze plat. En continuité avec le tendon cylindrique, le tendon intramusculaire peut être mis en évidence comme une structure hyperéchogène située dans la partie antérieure du muscle sus-épineux. Le volume global du muscle et son échogénicité peuvent être évalués par échographie pour évaluer l'atrophie et l'infiltration graisseuse. Dans une étude quantitative sur des sujets sains, la section transversale du muscle sus-épineux s'est avérée plus grande du côté dominant et diminuait progressivement avec l'âge (Katayose et Magee, 2001).
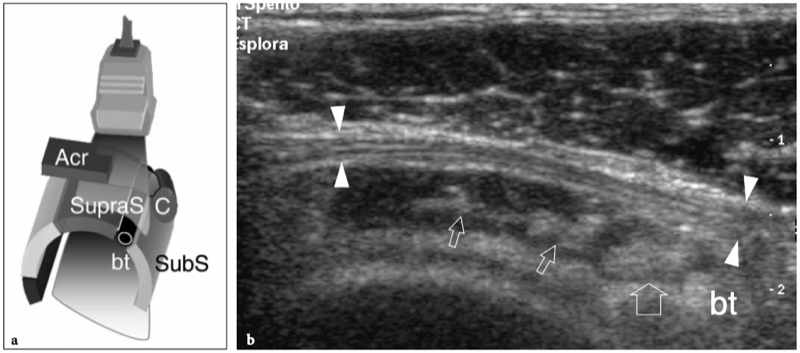
Figure 38a,b. Ligament coraco-acromial. a Dessin schématique d'une vue latérale à travers la coiffe des rotateurs montre le bon positionnement du transducteur pour examiner le ligament coracohuméral. Il doit être déplacé de manière proximale lorsqu'il est orienté dans le petit axe au-dessus du tendon antérieur du sus-épineux (SupraS). Acr, acromion ; C, coracoïde ; SubS, tendon sous-scapulaire. b L'image US 12–5 MHz correspondante montre le ligament coracohuméral (têtes de flèches) sous la forme d'une bande fibrillaire légèrement convexe qui recouvre la jonction myotendineuse du sus-épineux et du tendon du biceps (bt). Notez que le sus-épineux présente deux origines discrètes pour le faisceau cylindrique antérieur (grande flèche) et la composante postérieure du tendon plat (flèches fines).
25. TENDONS INFRASPINATUS ET TERES MINOR
L'examen des tendons infraspinatus et teres minor nécessite le positionnement du transducteur sur l'articulation gléno-humérale postérieure soit avec l'avant-bras en supination sur la cuisse homolatérale soit avec la main du patient sur l'épaule opposée. Nous pensons que la première approche fonctionne mieux car elle évite de repositionner le tendon trop en avant, ce qui peut rendre difficile la séparation de ses fibres du sus-épineux. En utilisant une telle approche postérieure, la colonne vertébrale de l'omoplate peut être un repère utile pour distinguer ces tendons (Fig. 39). Tout d'abord, il faut palper l'épine scapulaire et placer le transducteur dessus, dans une position plus médiale par rapport à la grosse tubérosité (Illustration 39a): en déplaçant le transducteur vers le haut dans le plan sagittal, la fosse supra-épineuse et le muscle supra-épineux peuvent se trouver en profondeur jusqu'au muscle trapèze (Fig.39b). Après cela, l'infraspinatus et le muscle teres minor peuvent être représentés comme des structures individuelles profondes du muscle deltoïde en déplaçant le transducteur vers l'épine scapulaire. (Fig.39c).
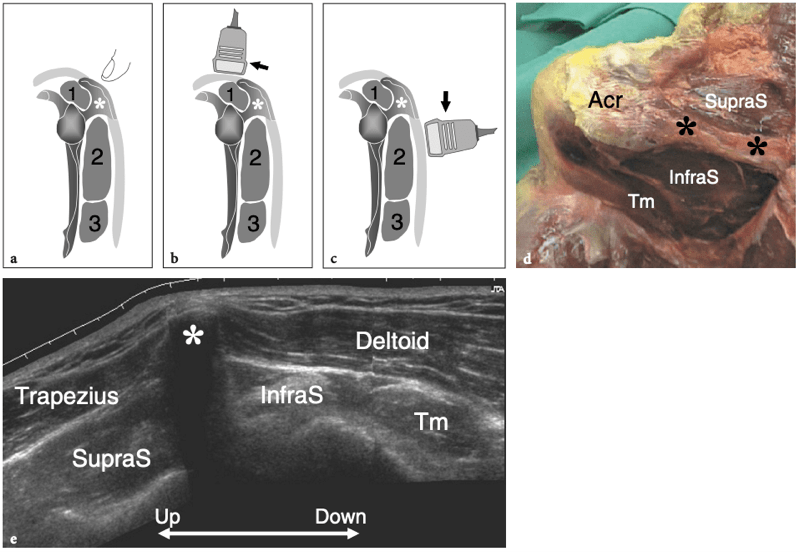
Fig. 39a–e. Repères anatomiques pour l'examen des muscles postérieurs. a–c Des dessins schématiques d'une vue sagittale à travers la face postérieure de l'épaule illustrent les relations entre l'épine scapulaire (astérisque), le supraspinatus (1), l'infraspinatus (2) et le teres minor (3). a Afin de distinguer les muscles postérieurs, l'épine de l'omoplate doit être considérée comme un repère palpable utile. b En déplaçant le transducteur vers le haut depuis l'épine scapulaire dans le plan sagittal, la fosse supra-épineuse et le muscle supra-épineux (1) peuvent être évalués profondément jusqu'au trapèze. c En déplaçant le transducteur vers le bas depuis l'épine scapulaire, les muscles infraspinatus (2) et teres minor (3) sont représentés comme des structures individuelles profondes jusqu'au deltoïde. d La vue cadavérique brute de l'épaule postéro-supérieure montre la position respective des muscles sus-épineux (SupraS), infraspinatus (InfraS) et teres minor (Tm) par rapport à l'épine scapulaire (astérisques) et à l'acromion (Acr). e L'image US à champ de vision étendu de 12 à 5 MHz obtenue dans le plan sagittal au-dessus de l'épaule postérieure montre l'épine scapulaire (astérisque) comme une proéminence osseuse en forme de doigt bien définie séparant le trapèze crânien et le sus-épineux du deltoïde caudal, muscles infraspinatus et teres minor.
Chacun de ces muscles est caractérisé par une aponévrose centrale et doit être évalué et comparé pour sa taille et son échogénicité (Illustration 40a). Le muscle petit rond est plus petit que l'infraspinatus et a une section transversale arrondie tandis que l'infraspinatus est d'apparence plus ovale. Dans certains cas, ces muscles sont fusionnés et présentent une aponévrose centrale allongée commune (Fig.40b). Un balayage systématique de ces muscles peut aider à exclure les modifications échotexturales liées aux déchirures des tendons et à la pathologie nerveuse. En fait, certaines maladies de l'épaule, telles que la neuropathie suprascapulaire, peuvent être reconnues sur la base de l'atrophie musculaire détectée dans ces scanners. Après avoir numérisé les muscles, le transducteur est balayé vers le tubercule majeur sur des plans sagittaux et les deux tendons peuvent être appréciés comme des structures hyperéchogènes individuelles résultant des muscles respectifs, le plus grand et le plus crânien étant l'infraspinatus, et le plus petit et caudal, le teres mineur (Fig. 41). Souvent, le profil de la face postérieure du trochiter peut montrer deux facettes séparées à l'insertion de ces tendons (Fig. 41).
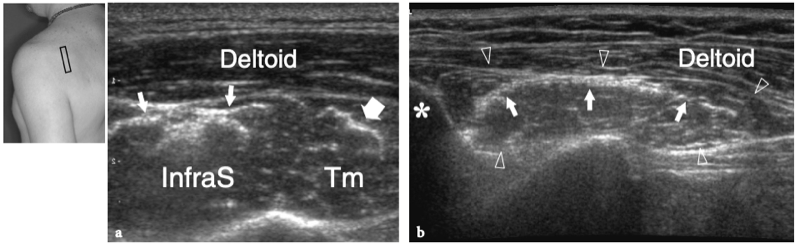
Figure 40a,b. Muscles sous-épineux et petit rond normaux. une image US sagittale 12–5 MHz sur la fosse sous-épineuse montre l'infraspinatus supérieur (InfraS) et le teres minor inférieur (Tm), chacun étant caractérisé par une aponévrose hyperéchogène individuelle (flèches). b Même plan de balayage chez un autre patient. On retrouve un seul muscle postérieur (têtes de flèches) formé par la réunion des deux ventres de l'infraspinatus et du teres minor. Observer la large aponévrose centrale de ce muscle (flèches). Astérisque, épine de l'omoplate. L'insert en haut à gauche de la figure indique le positionnement du transducteur.
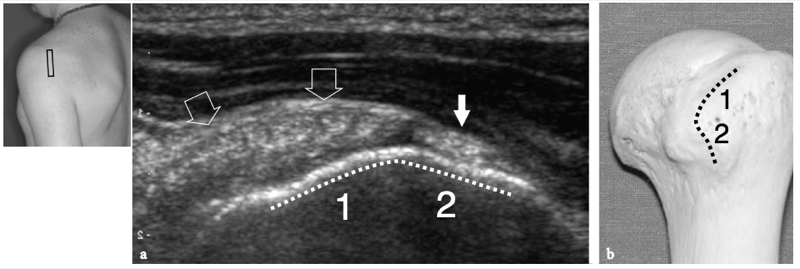
Figure 41a,b. Tendons normaux de l'infraspinatus et du teres minor. une image US sagittale 12–5 MHz sur le petit axe des tendons infraspinatus et teres minor. Ces tendons peuvent être vus provenant, respectivement, du plus grand muscle infraspinatus (flèches vides) et du plus petit muscle teres minor (flèche blanche). Notez deux facettes distinctes (1, 2) à la face postérieure du trochiter (ligne pointillée) pour l'insertion de ces tendons. b La photographie sur la face postérieure de la tête humérale illustre la forme de la grosse tubérosité (ligne pointillée) ainsi que les deux facettes (1, 2) pour l'insertion du tendon représentées avec US. L'insert en haut à gauche de la figure indique le positionnement du transducteur.
Sur les scanners à grand axe, le tendon sous-épineux apparaît comme une structure épaisse en forme de bec s'étendant profondément jusqu'au deltoïde et superficielle jusqu'à la face postérieure de la tête humérale, du labrum postérieur et de la glène osseuse. (Illustration 42a). Le tendon du petit rond, le plus petit tendon de la coiffe, a un trajet plus oblique que celui de l'infraspinatus et se pose de manière excentrée par rapport au muscle (Fig.42b). Par conséquent, la sonde doit être orientée obliquement pour l'imager dans son grand axe. Chaque tendon doit être examiné séparément. Il faut prendre soin d'évaluer le tendon sous-épineux jusqu'à son insertion. En effet, au moins lorsque le bras est maintenu en rotation interne, le tendon peut se projeter sur la face latérale plutôt que postérieure de l'épaule. Le balayage dynamique pendant la rotation interne et externe passive avec le bras en adduction peut aider l'examinateur à évaluer le niveau d'insertion et l'intégrité des deux tendons.
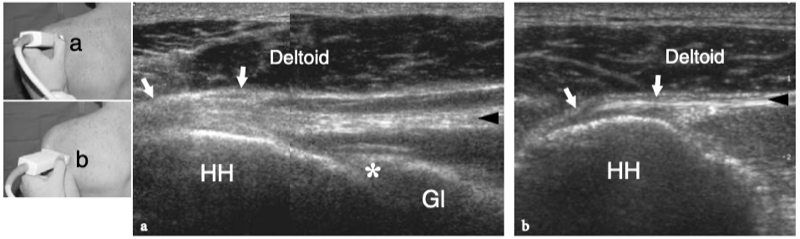
Figure 42a,b. Tendons normaux de l'infraspinatus et du teres minor. a,b Images échographiques transversales 12–5 MHz sur le grand axe de a l'infraspinatus et b les tendons du petit rond. a Le tendon sous-épineux prend naissance dans le muscle à partir d'une aponévrose centrale épaisse (tête de flèche) et apparaît comme une structure épaisse en forme de bec (flèches) s'étendant profondément jusqu'au muscle deltoïde et superficielle jusqu'à la face postérieure de la tête humérale (HH), la face postérieure labrum (astérisque) et la glène osseuse (Gl). b Immédiatement caudal par rapport à celui-ci, le tendon du petit rond (flèches) apparaît comme une structure fibrillaire plus petite apparaissant de manière excentrique par rapport au ventre musculaire (tête de flèche). Les inserts en haut à gauche de la figure indiquent le positionnement respectif du transducteur. Notez l'orientation légèrement oblique de la sonde nécessaire pour imager le tendon du petit rond le long de son grand axe,
26. INTERVALLE DE LA COIFFE DES ROTATEURS
Avant d'entrer dans la gouttière bicipitale, le tendon du biceps traverse « l'intervalle de la coiffe des rotateurs », espace libre délimité par les tendons sous-scapulaire et sus-épineux. Dans cet espace, le tendon du biceps est retenu à sa place par le ligament coraco-huméral, qui court au-dessus de lui en toit, et par le ligament gléno-huméral supérieur. (Fig. 43a, 44a). À l'échographie, le ligament coraco-huméral peut être apprécié comme une épaisse bande homogène de tissu échogène, resserrée entre le sous-scapulaire et le sus-épineux et située juste au-dessus du biceps. (Fig.43b). Souvent, on voit une fine couche hypoéchogène émergeant du bord profond du tendon sus-épineux et s'intercalant entre le ligament et le tendon du biceps, une découverte qui peut représenter la capsule articulaire (Fig.43b). Le ligament coraco-huméral est mieux représenté sur les coupes petit axe alors que le bras est maintenu en flexion postérieure, car cette position provoque une ouverture maximale de l'intervalle de la coiffe des rotateurs, étire le biceps contre le cartilage huméral et resserre le ligament. Une technique de balayage soigneuse est nécessaire pour ajuster l'orientation du transducteur afin d'éviter l'anisotropie : typiquement, le biceps est beaucoup plus anisotrope que le ligament coraco-huméral.
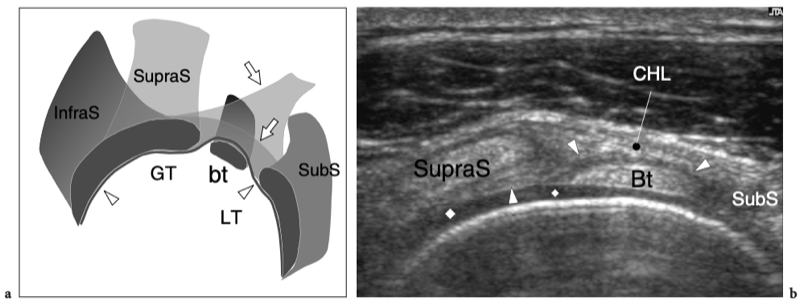
Figure 43a,b. Intervalle de la coiffe des rotateurs : niveau proximal. un dessin schématique illustre la relation du ligament coracohuméral (flèches) avec les tendons subscapularis (SubS) et supraspinatus (SupraS). Le ligament forme le toit de la partie intra-articulaire du tendon du biceps (bt). GT, grosse tubérosité ; LT, tubérosité moindre ; InfraS, sous-épineux. La capsule (têtes de flèches) de l'articulation gléno-humérale passe en profondeur aux tendons de la coiffe des rotateurs et au ligament coraco-huméral et en surface au tendon du biceps. b L'image US transversale 12–5 MHz correspondante montre la partie intra-articulaire échogène du tendon du biceps (bt) reposant sur le cartilage huméral (losange) entre les tendons sus-épineux et sous-scapulaire. Le ligament coracohuméral (CHL) est apprécié comme une bande de tissu échogène superficielle au biceps. Une fine couche hypoéchogène (têtes de flèches) bombée du bord profond du sus-épineux s'interpose entre le ligament et le biceps, reflétant éventuellement l'interface capsulaire.
Parfois, les structures d'intervalle peuvent former un grand espace de chaque côté du biceps qui ne doit pas être interprété à tort comme une déchirure. Moins de 1 cm distalement, la partie antérieure (médiale) du ligament coracohuméral rejoint le ligament glénohuméral supérieur pour former la « poulie de réflexion », qui s'insère dans la petite tubérosité (Fig. 44a, b). A ce niveau, le biceps est surélevé par rapport à l'os et prend une orientation oblique grâce à la poulie qui l'entoure de forme curviligne. Il est concevable que les fibres médiales profondes de la poulie qui infiltrent la surface inférieure du biceps sur ce plan puissent refléter les contributions du ligament gléno-huméral supérieur. Étant donné que le processus de subluxation du tendon a tendance à s'amorcer à cet endroit, les relations entre le biceps, le segment crânien de la gouttière et la partie supérieure du tendon sous-scapulaire doivent être soigneusement évaluées. Il faut veiller à ne pas confondre la double image produite par les structures poulies avec un écart longitudinal du biceps. Plus distalement, dans le sillon bicipital proximal, le biceps est en contact étroit avec le sous-scapulaire et est ici stabilisé par des bandes fibreuses qui en découlent (Fig.44c,d). Ces fibres forment le ligament huméral transverse, qui peut être décrit comme une fine couche échogène recouvrant le sulcus.
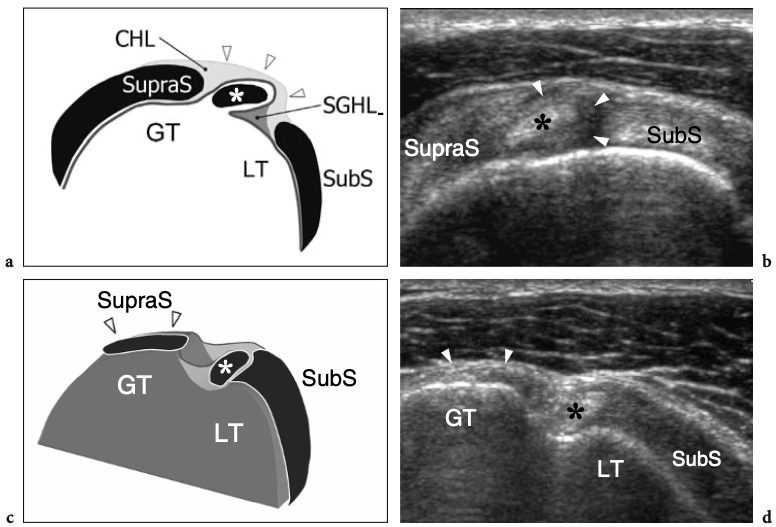
Figures 44a–d. Intervalle de la coiffe des rotateurs : niveaux intermédiaire et distal. a Dessin schématique avec b image US transversale 12–5 MHz correspondante du niveau intermédiaire de l'intervalle de la coiffe des rotateurs. La corde médiale du ligament coraco-huméral (CHL) et le ligament gléno-huméral supérieur (SGHL) forment une écharpe antérieure (têtes de flèches) autour du tendon du biceps (astérisque), appelée poulie de réflexion. Sur l'image US, notez que le biceps est surélevé à cet endroit par rapport à l'os et prend une orientation oblique en raison de la poulie qui l'entoure en forme de croissant. Les fibres profondes de la poulie qui infiltrent la face inférieure du tendon du biceps font partie du ligament gléno-huméral supérieur. SubS, sous-scapulaire ; SupraS, sus-épineux. c Dessin schématique avec d image US transversale 12–5 MHz correspondante du niveau distal de l'intervalle de la coiffe des rotateurs. A proximité de la gouttière bicipitale, le tendon du biceps (astérisque) est au contact de la petite tubérosité (LT) et du tendon sous-scapulaire (SubS) et est stabilisé par des bandes fibreuses qui en découlent. Les pointes de flèche indiquent l'insertion du tendon sus-épineux dans le trochiter (GT).
27. ÉPAULE AU-DELÀ DU MANCHETTE
Une fois l'évaluation systématique des tendons de la coiffe des rotateurs terminée, l'examen échographique doit être axé sur l'évaluation d'autres structures autour de l'articulation de l'épaule, y compris l'espace articulaire gléno-huméral, la bourse sous-acromiale sous-deltoïdienne et l'articulation acromio-claviculaire. Dans certains cas, des scanners supplémentaires peuvent être obtenus pour imager le labrum fibrocartilagineux (pour exclure une pathologie paralabrale), la morphologie de l'acromion (pour exclure un os acromial) et l'aisselle (pour l'évaluation des épanchements articulaires et des troubles de l'aisselle, y compris corps lâches intra-articulaires).
28. ESPACE SYNOVIAL GLÉNO-HUMÉRAL
Comme indiqué précédemment, la capsule articulaire glénohumérale s'étend des marges du labrum et du bord glénoïdien jusqu'au col anatomique de l'humérus. La capsule est laxiste et redondante pour permettre une large amplitude de mouvement du bras. Le grand évidement axillaire provient, par exemple, d'un repli profond de la capsule qui permet une élévation complète du bras sans étirer la capsule inférieure. Il en est de même pour les évidements antérieur et postérieur qui permettent une rotation externe et interne maximale du bras. Dans les états normaux, la petite quantité de liquide synovial contenue dans l'espace articulaire ne peut pas être reconnue par US. D'autre part, l'échographie a une sensibilité élevée pour apprécier même une quantité minimale de liquide pathologique à l'intérieur des principales cavités synoviales (c'est-à-dire la poche axillaire dépendante, les cavités postérieures et antérieures et la gaine de la longue portion du tendon du biceps).
Bien qu'une approche caudale à travers l'aisselle ait été décrite pour évaluer la poche axillaire, les coupes transversales postérieures sont généralement préférées pour une meilleure accessibilité. Une fois le tendon du petit rond localisé, le transducteur est déplacé plus caudalement pour étudier l'espace s'intercalant entre la métaphyse humérale et le col inférieur de l'omoplate, où se trouve la poche axillaire. Si elle est distendue par un épanchement considérable, cette poche est visible comme une zone remplie de liquide.
L'évidement postérieur est mieux examiné sur les balayages transversaux en plaçant le transducteur sur le tendon sous-épineux (Fig. 45). Un épanchement remplissant le récessus postérieur apparaît comme un croissant hypoanéchogène entourant la pointe du labrum postérieur. Dans les épanchements plus importants, le tendon sous-épineux peut être vu déplacé vers l'arrière par le liquide contenu dans la cavité. Dans les cas douteux, l'examinateur peut induire des changements dans la forme de l'évidement en déplaçant passivement le bras du patient vers l'extérieur et vers l'intérieur, ce qui entraîne une tension réduite/augmentée de la capsule postérieure et de l'infraspinatus sus-jacent. En raison de l'absence de vaisseaux intermédiaires et d'une accessibilité facile, les procédures d'aspiration ou d'injection à l'aiguille dans la cavité postérieure peuvent être effectuées en toute sécurité sous contrôle américain pendant que le patient est assis ou couché (Fessell et al. 2000 ; Zwar et al. 2004). Cet évidement peut être sélectionné pour un positionnement sûr de l'aiguille guidée par échographie pour l'arthrographie de l'épaule (Cicak et al. 1992 ; Valls et Melloni 1997).
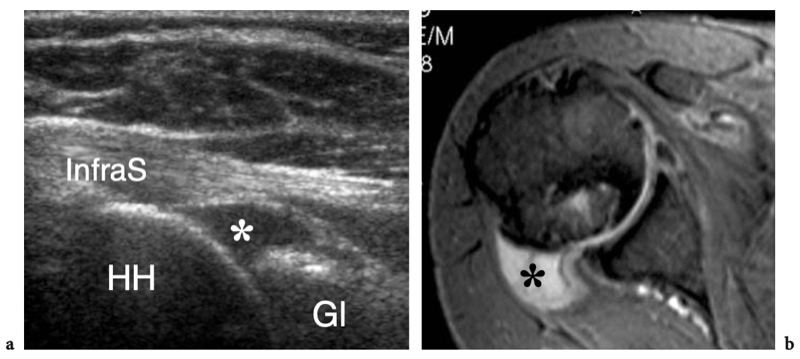
Figure 45a,b. Renfoncement postérieur de l'articulation gléno-humérale. a Image échographique transversale 12–5 MHz sur l'épaule postérieure avec corrélation d'imagerie IRM pondérée en T2* en écho de gradient b montrant un épanchement hypoéchogène (astérisque) distendant le récessus postérieur. Cet évidement est situé entre la tête humérale (HH) et la face postérieure de la glène osseuse (Gl), en profondeur du tendon et du muscle sous-épineux (InfraS).
L'évaluation échographique de la cavité antérieure est plus complexe en raison de sa localisation profonde et nécessite souvent un petit transducteur à réseau incurvé, des fréquences plus basses et une technique de balayage minutieuse. Lorsque du liquide est présent dans la cavité antérieure, il peut être apprécié sur les coupes transversales comme un halo hypoéchogène entourant le labrum antérieur. De même, le récessus sous-scapulaire (également connu sous le nom de bourse sous-scapulaire) est difficile à évaluer de manière fiable par échographie en raison de sa petite taille et des problèmes d'accès liés à sa localisation profonde par rapport à la pointe coracoïde. Il s'agit d'un petit évidement en forme de sac de selle situé entre le col antérieur de l'omoplate et le tendon sous-scapulaire qui peut s'étendre au-dessus du tendon pour recouvrir sa face antérieure. En coupe transversale ou sagittale, le principal repère à rechercher est la coracoïde : un épanchement dans le récessus sous-scapulaire peut être mis en évidence par une petite zone hypoanéchogène située juste en direction caudale et en arrière de l'os et adhérente au tendon sous-scapulaire. (Fig. 46). L'évidement sous-scapulaire ne doit pas être confondu avec la plus grande bourse sous-coracoïdienne qui s'étend plus caudalement et ne communique pas avec l'articulation gléno-humérale car il s'agit d'une extension de la bourse sous-deltoïdienne sous-acromiale. (Fig. 46b, 47) (Grainger et al. 2000). La bourse sous-coracoïdienne se situe en profondeur du tendon conjoint du chef court du biceps et du coracobrachial, dans une position plus médiale par rapport au tendon sous-scapulaire et à la coracoïde, et peut contenir un épanchement abondant en cas de rupture de la coiffe des rotateurs antérieurs. (Fig.47c). Il est préférable de l'examiner tout en gardant le bras du patient en adduction en scannant juste en bas et en dedans de la coracoïde. La distinction entre le récessus sous-scapulaire et la bourse sous-coracoïdienne est pertinente car les causes d'un épanchement du récessus sous-scapulaire peuvent être différentes des causes d'un épanchement de la bourse sous-coracoïdienne (qui est le plus souvent associée à des déchirures de la coiffe des rotateurs, y compris des déchirures de l'intervalle de la coiffe des rotateurs) (Grainger et al. 2000).
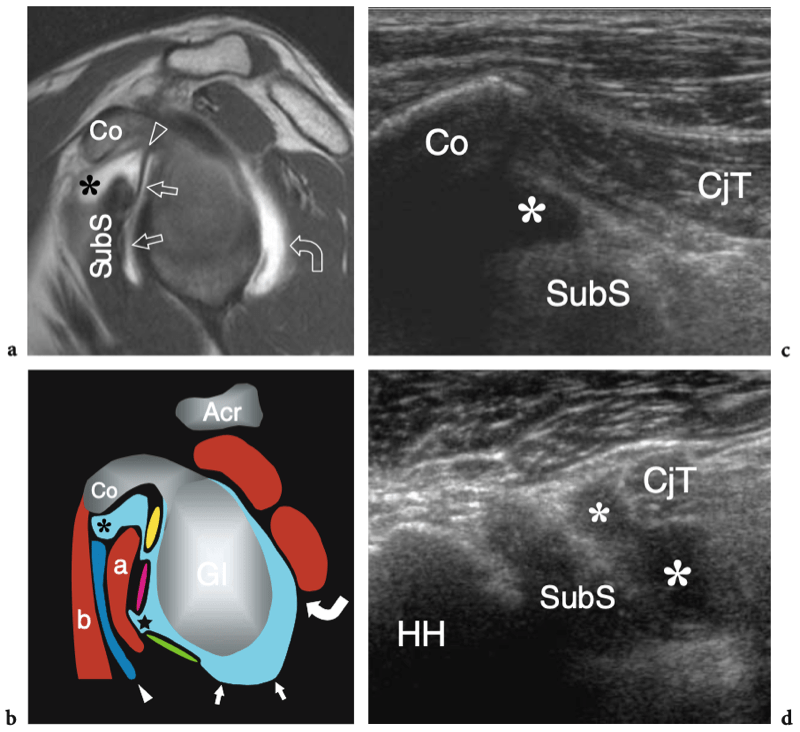
Fig. 46a-d. Renfoncement sous-scapulaire de l'articulation gléno-humérale. une image IRM sagittale oblique pondérée en T1 sur la glène révèle l'extension de l'évidement sous-scapulaire supérieur (astérisque) chez un patient présentant un épanchement articulaire. L'évidement sous-scapulaire est un petit évidement en forme de sacoche situé en avant de la capsule articulaire gléno-humérale, entre le col antérieur de l'omoplate et le sous-scapulaire (SubS) qui s'étend au-dessus de ce muscle pour recouvrir sa face antérieure. Notez la cavité articulaire glénohumérale antérieure (flèches droites) avec le ligament glénohuméral moyen (tête de flèche) et le récessus synovial postérieur (flèche courbe). b Le dessin schématique d'une vue sagittale oblique à travers la glène (Gl) illustre les relations des évidements glénohuméraux supérieur (astérisque) et inférieur (étoile) avec les cavités glénohumérales supérieure (en jaune), moyenne (en violet) et inférieure (en vert) ligaments. Observez que la cavité sous-scapulaire supérieure s'étend sous la coracoïde (Co) et au-dessus du sous-scapulaire (a) jusqu'à atteindre la face antérieure du muscle. Cet évidement ne doit pas être confondu avec la bourse sous-coracoïdienne adjacente (tête de flèche) qui s'interpose entre le sous-scapulaire et le coracobrachial et la tête courte du tendon du biceps (b) et a une plus grande extension caudale (voir Fig. 6.47). Notez les évidements axillaire (flèches) et postérieur (flèche courbe) de l'articulation gléno-humérale. Acr, acromion. Contrairement à la cavité sous-scapulaire supérieure, la cavité inférieure (étoile) est plus petite et se situe en profondeur du muscle sous-scapulaire. c Image échographique sagittale 12–5 MHz sur l'apophyse coracoïde (Co) montrant l'évidement sous-scapulaire supérieur (astérisque), qui est partiellement masqué par l'os intermédiaire et situé entre le tendon conjoint (CjT) de la tête courte du biceps et le coracobrachialis et la pointe du subscapularis (SubS). d L'image US transversale 12–5 MHz obtenue juste en dessous de la coracoïde illustre les relations entre le récessus sous-scapulaire supérieur (astérisques) avec le tendon conjoint du coracobrachial et le chef court du biceps (CjT) et le sous-scapulaire (SubS). HH, tête humérale.
Enfin, la gaine synoviale du long chef du tendon du biceps est formée par une extrusion de la membrane synoviale articulaire. Comme la gaine n'est qu'un prolongement de la cavité articulaire, un épanchement intra-articulaire peut entraîner la présence de liquide dans la gaine. Le liquide secondaire à une tendinite isolée du biceps est rare.
29. BOURSE SOUS-ACROMIALE SOUS-DELTOÏDE
La bourse sous-acromiale sous-deltoïdienne apparaît comme un complexe de 2 mm d'épaisseur composé d'une couche interne de liquide hypoéchogène entre deux couches de graisse péribursale hyperéchogène (van Holsbeeck et Strouse 1993). Dans les états normaux, la membrane synoviale de la bourse ne peut pas être représentée par US. Un épaississement hypoéchogène des parois de la bourse peut être observé dans une variété de troubles de l'épaule, parmi lesquels le conflit antéro-supérieur est le plus important. (Illustration 48a). Dans ces cas, la bourse prend un aspect pseudosolide et peut être difficile à délimiter du tendon sus-épineux sous-jacent, imitant quelque peu une tendinopathie dégénérative. Un signe d'encoche dans le profil supérieur de la bourse au point où elle passe profondément au ligament coracoacromial peut aider à cette différenciation (Fig.48b,c). Étant donné que le liquide intrabursal peut migrer en fonction de la gravité et du positionnement du bras, les différentes portions de la bourse doivent être systématiquement évaluées. Il faut également veiller à ne pas appliquer une pression excessive avec la sonde sur la bourse, afin de ne pas négliger les petits épanchements.
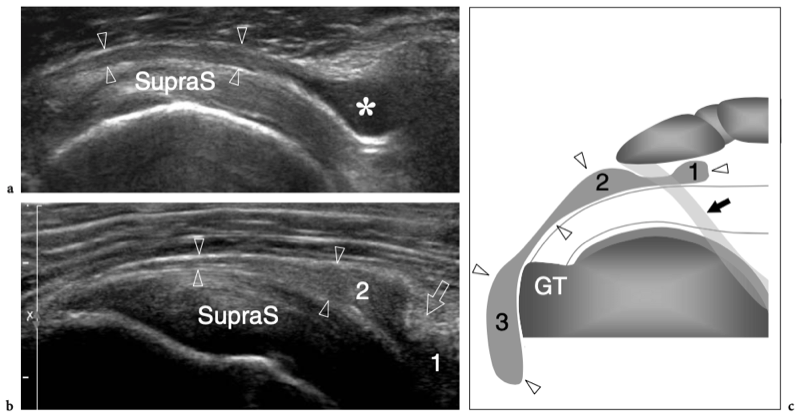
Figures 48a–c. Bursite sous-deltoïdienne sous-acromiale. a Les images américaines à petit axe et b à axe long 12–5 MHz sur le tendon sus-épineux (SupraS) montrent un épaississement hypoéchogène des parois de la bourse (têtes de flèches) et une petite quantité de liquide (astérisque) dans la lumière de la bourse. En a, l'épanchement a tendance à s'accumuler médialement, dans la partie dépendante de la bourse. En b, le profil supérieur de la bourse montre une échancrure profonde (flèche) au niveau de la jonction myotendineuse du sus-épineux (SupraS) reflétant la position du ligament coracoacromial. c Le dessin schématique d'une vue coronale à travers l'épaule illustre l'extension de la bourse sous-acromiale sous-deltoïdienne (têtes de flèches). Cette bourse est composée des bourses sous-acromiale (1) et sous-deltoïdienne (2), qui sont en continuité et peuvent s'étendre latéralement et inférieurement (3) voire 3 cm en dessous de la grosse tubérosité (GT). Semblable à celle vue en b, notez l'échancrure du profil de la bourse réalisée par le ligament coracoacromial (flèche).
Lorsque le patient est debout ou assis, le liquide a tendance à s'accumuler dans les parties les plus dépendantes de la bourse et, plus fréquemment, le long du bord latéral de la grosse tubérosité, produisant un signe typique de « larme » (Illustration 49a) (van Holsbeeck et Strouse 1993). Lorsqu'un épanchement est présent simultanément dans l'articulation gléno-humérale et la bourse, les plans transversaux antérieurs sont les mieux adaptés pour mettre en évidence le liquide dans les deux cavités. En utilisant ces plans, le liquide intra-articulaire peut être apprécié comme un halo hypoéchogène entourant la longue tête du tendon du biceps, tandis que le liquide de la bourse apparaît comme une collection en forme de croissant située juste en profondeur du muscle deltoïde antérieur. (Fig.49b). Les deux épanchements sont séparés par une fine structure hyperéchogène qui représente les parois bordant la gaine tendineuse du biceps et la bourse séreuse. Des collections plus abondantes ont tendance à remplir la partie de la bourse située en arrière du tendon sous-épineux. Dans ces cas, la détection de l'infraspinatus peut aider à distinguer les épanchements superficiels de la bourse des épanchements articulaires profonds (Fig.49c). La manifestation d'un épanchement dans les deux espaces synoviaux est, pour la plupart, un indicateur de rupture de pleine épaisseur de la coiffe des rotateurs. Un balayage dynamique effectué avec la sonde placée sur une cavité - soit la bourse ou un récessus articulaire - tout en comprimant l'autre avec la main peut révéler une communication entre les deux compartiments à la suite d'une déchirure de la coiffe des rotateurs.
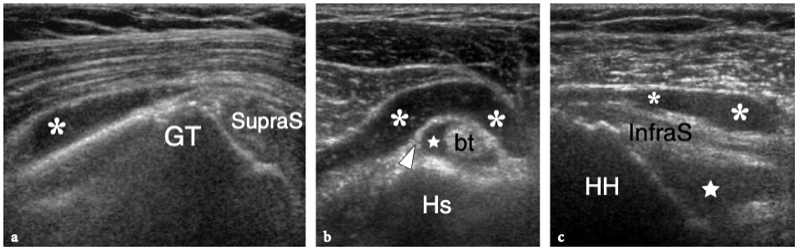
Figures 49a–c. Renfoncements dépendants de la bourse sous-acromiale sous-deltoïdienne. une image coronale 12–5 MHz US obtenue au niveau de la diaphyse humérale proximale, juste en aval du tendon sus-épineux (SupraS) et de la grande tubérosité (GT), révèle la poche latérale (astérisque) de la bourse distendue par un liquide, le so- appelé signe de larme. b Image échographique transversale 12–5 MHz sur l'épaule antérieure montrant un épanchement distendant la lumière de la bourse (astérisques) à la fois médialement et latéralement au tendon du biceps (bt). Une petite quantité de liquide (étoile) est également visible dans la gaine du tendon du biceps. A noter que les deux espaces sont séparés par un plan de clivage hyperéchogène (tête de flèche) : ils peuvent communiquer lors d'une rupture de pleine épaisseur de la coiffe des rotateurs. Hs, diaphyse humérale. c Image échographique transversale 12–5 MHz au-dessus de l'épaule postérieure montrant le tendon sous-épineux (InfraS) qui sépare la partie dépendante postérieure superficielle de la bourse (astérisques) de l'évidement synovial postérieur profond (étoile) de l'articulation gléno-humérale. HH, tête humérale.
30. ARTICULATION ACROMIOCLAVICULAIRE ET OS ACROMIALE
Pour examiner l'articulation acromio-claviculaire, le transducteur est placé au-dessus de l'épaule dans un plan coronal. La largeur de l'articulation est mesurée et comparée à celle du côté controlatéral. L'évaluation de l'articulation acromio-claviculaire doit être incluse dans l'étude de routine de l'épaule, car ses lésions peuvent mimer une maladie de la coiffe des rotateurs. En fait, cette articulation est intimement liée au tendon sus-épineux, qui passe directement sous l'articulation. Malgré une échogénicité similaire, le ligament acromio-claviculaire supérieur peut être distingué de la cavité articulaire sous-jacente à l'aide de sondes à haute fréquence et d'un balayage dynamique (Fig. 50a, b). Ce ligament forme une bande externe inextensible joignant les extrémités mobiles de la clavicule et l'acromion, aspect bien différent du contenu de l'articulation acromio-claviculaire qui est molle et peut changer de forme et de largeur avec les mouvements de l'épaule. Chez les jeunes sujets sains, le disque fibrocartilagineux interne peut rarement être apprécié comme une structure légèrement hyperéchogène, un aspect quelque peu similaire au ménisque du genou ou au bourrelet glénoïdien. (Fig.50c,d). Les ligaments coraco-claviculaires sont difficiles à détecter par échographie en raison de l'occultation acoustique de la clavicule sus-jacente.
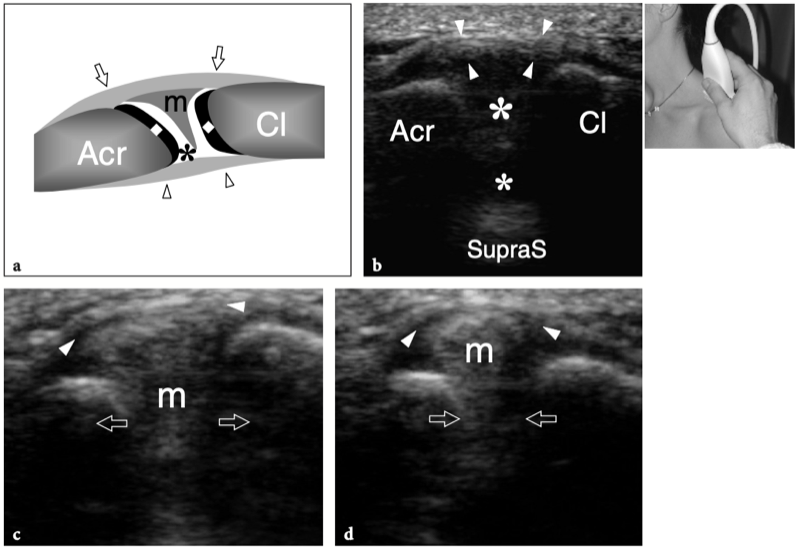
Fig. 50a–d. Articulation acromio-claviculaire. un dessin schématique d'une vue coronale à travers l'articulation acromio-claviculaire montre sa structure anatomique. L'articulation acromio-claviculaire est délimitée par les surfaces articulaires de l'acromion (Acr) et de la clavicule (Cl) recouvertes de cartilage articulaire (losanges). La capsule articulaire supérieure est renforcée par le ligament acromio-claviculaire supérieur (flèches) et se confond avec l'attache musculo-aponévrotique des muscles trapèze et deltoïde. Le tissu fibrocartilagineux formant un disque méniscoïde en forme de coin (m) fait saillie dans l'espace articulaire (astérisque). Les pointes de flèches indiquent la capsule articulaire inférieure. b L'image coronale 15–7 MHz correspondante sur la face supérieure de l'articulation acromio-claviculaire montre les extrémités hyperéchogènes de l'acromion (Acr) et de la clavicule distale (Cl) séparées par un espace hypoéchogène reflétant la cavité articulaire (astérisques). Le ligament supérieur peut être apprécié comme une structure fibrillaire hyperéchogène (têtes de flèches) joignant les surfaces osseuses de l'articulation. En profondeur, le sus-épineux (SupraS) peut être apprécié grâce à la transmission directe du faisceau US. c,d Différents aspects échographiques de l'articulation acromio-claviculaire chez un sujet sain c en gardant le bras en position neutre et d en abduction. Un élargissement alterné c et un rétrécissement d (flèches) de l'espace articulaire sont observés en raison de la flexibilité de l'articulation normale. Notez le disque méniscoïde mobile en forme de coin (m) lorsqu'il s'extrude vers le haut tandis que l'espace articulaire se rétrécit. Pointes de flèches, ligament supérieur. L'insert en haut à droite de la figure indique le positionnement du transducteur.
Un os acromiale peut parfois être reconnu comme une découverte fortuite lors de la numérisation de l'articulation acromio-claviculaire avec US (Fig. 51). Cet os accessoire dérive de l'épiphyse non fusionnée de la partie antérieure de l'acromion, a une fréquence globale d'environ 8 % de la population générale et est bilatéral dans un tiers des cas (Sammarco 2000). L'os acromial est de forme triangulaire et de taille variable (moyenne 22 mm). Il peut s'articuler avec l'acromion et la clavicule avec une articulation distincte, une union fibrocartilagineuse ou une union presque complète (Sammarco 2000). Le muscle deltoïde s'insère sur son bord antérolatéral. L'os acromial est une source potentielle de conflit antéro-supérieur, soit sous la forme d'un fragment mobilisé par des tractions deltoïdiennes, soit à partir d'un lèvrement ostéophytique. L'échographie est un moyen sensible d'identifier ou de confirmer cet os anormal (Boehmet al. 2003). Le diagnostic repose sur la détection d'une discontinuité corticale bien définie sur la face supérieure de l'acromion, mimant souvent une double articulation acromio-claviculaire. (Fig. 51, 52). Aux États-Unis, un os acromial peut présenter des marges osseuses plates (type I), des ostéophytes marginaux (type II) ou des marges osseuses inversées (type III) (Boehm et al. 2003). Une identification sûre de l'os acrominal à partir de l'articulation acromio-claviculaire adjacente peut facilement être réalisée en déplaçant et en faisant pivoter la sonde sur l'acromion afin d'identifier deux articulations au lieu d'une. En cas de rupture associée de la coiffe des rotateurs, le traitement est varié. Chez les patients présentant des symptômes de conflit, un petit os acromial mobile peut être réséqué, un gros os acromiale stable traité par acromioplastie et un gros os acromiale instable par fusion à l'acromion. Le résultat postopératoire est bon.
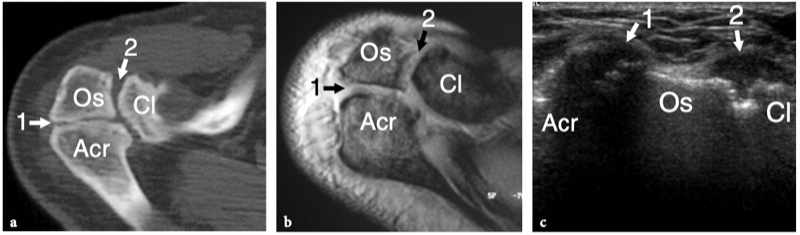
Figures 51a–c. Os acromial. Une tomodensitométrie transversale a et une IRM pondérée en T2* en écho de gradient b sur l'articulation acromio-claviculaire montrent un os acromiale (Os) séparé de la partie restante de l'acromion (Acr) par un espace fibreux (1) et relié à l'extrémité distale de la clavicule (Cl) par une articulation distincte (2). c L'image US 12–5 MHz correspondante révèle un « aspect de double articulation » représentant la jonction de l'os acromial (Os) avec l'acromion (Acr) en arrière (1) et avec la clavicule (Cl) en avant (2).
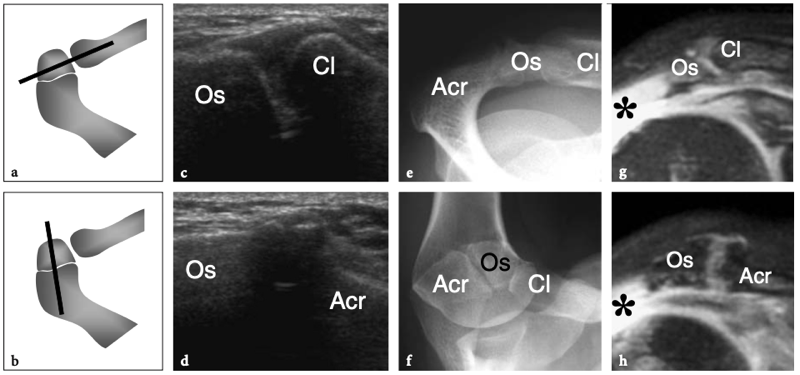
Figures 52a–h. Os acromial. a,b Dessins schématiques d'une vue transversale à travers l'articulation acromio-claviculaire montrant le positionnement adéquat du transducteur pour la représentation échographique d'un os acromial avec c,d correspondant aux images américaines 12–5 MHz. Deux articulations individuelles sont mises en évidence au lieu d'une, la pseudo-articulation de l'osselet accessoire (Os) avec l'acromion (Acr) étant située dans un site plus postérieur que prévu pour une véritable articulation acromio-claviculaire. Cl, extrémité distale de la clavicule. e,f Aspect radiographique d'un os acromial imagé au moyen des vues e acromio-claviculaire et f Bernageau. g,h Images IRM coronales obliques pondérées en T2 g sur la pseudo-articulation de l'os acromial avec la clavicule et h l'acromion chez un patient présentant une déchirure de la coiffe des rotateurs et une collection liquidienne abondante (astérisque) dans la bourse sous-deltoïdienne sous-acromiale.
31. LABRUM GLÉNOÏDIEN
Le labrum fibrocartilagineux peut être démontré à l'US comme une structure triangulaire hyperéchogène homogène coiffant le bord osseux de la glène (Schydlowsky et al. 1998a). Les différentes parties du labrum se situent à différentes profondeurs, l'inférieur étant le plus superficiel et l'antérieur le plus profond. Par conséquent, une technique de balayage US adéquate doit d'abord inclure un ajustement dynamique de la zone focale, basé sur les caractéristiques de chaque quadrant individuel à examiner. Le labrum antérieur est mieux scanné avec des transducteurs à réseau incurvé et des basses fréquences (jusqu'à 5 MHz) en utilisant une approche transversale antérieure (Illustration 53a). Le bras du patient est maintenu en adduction ou en abduction à 90° avec le coude fléchi ou avec un abord transversal axillaire plaçant le bras dans la même position qu'auparavant (Hammar et al. 2001). Lors de l'évaluation du quadrant antéro-inférieur de la glène, des difficultés peuvent survenir chez les patients obèses ou incapables de mettre leur bras dans la bonne position à cause de la douleur ou de l'appréhension. Contrairement au labrum antérieur, le labrum postérieur est plus superficiel en position et peut être facilement imagé à l'US en utilisant des plans transversaux tout en plaçant la main du patient sur l'épaule opposée (Fig.53b). Il apparaît comme une structure triangulaire avec la base dirigée médialement et l'apex pointant latéralement. Des changements dans la forme du labrum peuvent être observés dans différentes rotations du bras. On note un aspect plus pointu lorsqu'une traction est appliquée sur celle-ci par la capsule (lors de la rotation interne pour le labrum postérieur). Le labrum supérieur est très difficile à visualiser en raison de problèmes d'accès liés à l'occultation acoustique de l'acromion. Une approche provisoire peut être faite chez les sujets minces en plaçant la sonde juste derrière la tête de la clavicule lors de l'abduction du bras pour mieux différencier la glène statique de la tête humérale mobile (Fig.53c). Même avec une technique appropriée, un équipement haut de gamme et des mains expertes, l'échographie est incapable de démontrer des anomalies du labrum supérieur, telles que des lésions antéro-postérieures (SLAP). L'arthro-IRM ou la tomodensitométrie sont les techniques de choix pour décrire cette condition. Quelle que soit sa localisation, le labrum se manifeste plus facilement lorsqu'il est entouré d'épanchement articulaire. Une zone hypoéchogène mince (<2 mm) à la base du labrum - une image quelque peu équivalente à la bande de transition sous-labrale d'intensité de signal intermédiaire visible à l'IRM (Loredo et al. 1995) - est une constatation normale liée à une bande de cartilage et ne doit pas être confondu avec une déchirure.
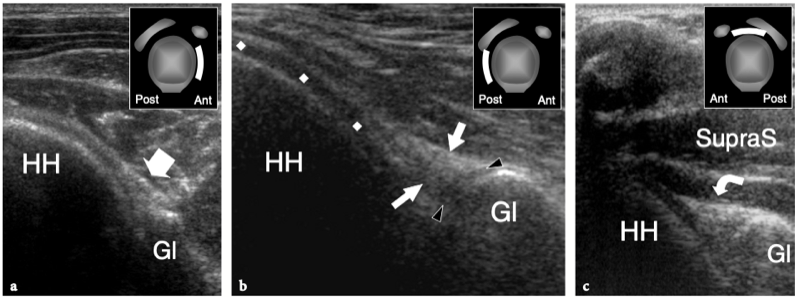
Figures 53a–c. Labrum glénoïdien fibrocartilagineux. une image US transversale 12–5 MHz au-dessus de l'épaule antérieure tandis que le bras du patient est maintenu en abduction et rotation externe et que le transducteur est fermement pressé contre l'espace articulaire antérieur montre le labrum glénoïdien antérieur (flèche) comme une structure échogène homogène triangulaire avec son base attachée à la glène osseuse (Gl). HH, tête humérale. b Image échographique transversale 12–5 MHz au-dessus de l'épaule postérieure, tandis que le bras du patient est maintenu en rotation interne, révèle le labrum glénoïdien postérieur (flèches) situé entre la couche hypoéchogène du cartilage articulaire (losanges) recouvrant la tête humérale convexe (HH) et le profil émoussé de la glène osseuse (Gl). Notez la fine bande hypoéchogène de cartilage (têtes de flèches) ancrant le labrum à l'os. c L'image coronale 12–5 MHz US obtenue chez un enfant juste derrière la tête de la clavicule représente le labrum supérieur (flèche courbe) juste en profondeur du muscle sus-épineux (SupraS). HH, tête humérale. Les inserts en haut à droite des images américaines font référence aux parties respectives (en blanc) du labrum examiné.
32. NERFS AUTOUR DE L'ÉPAULE
À l'aide de transducteurs à haute résolution, le nerf suprascapulaire peut parfois être visualisé par échographie chez des sujets jeunes et élancés. Les plans à petit axe sont les plus utiles pour le révéler. Dans la fosse supra-épineuse, le nerf peut être visualisé comme une petite structure hypoéchogène arrondie située entre l'omoplate et le muscle sus-épineux. (Illustration 54a). Dans la fosse spinoglénoïde, le nerf est identifié dans une dépression peu profonde de l'omoplate, l'encoche splinoglénoïde, remplie de graisse hyperéchogène (Fig.54b). Aux deux sites, le nerf suprascapulaire apparaît comme une fine structure hypoéchogène reposant sur le plancher osseux (Bouffard et al. 2000 ; Martinoli et al. 2003 ; Martinoli et al. 2004). L'imagerie Doppler peut aider à identifier le nerf en montrant les signaux de flux de couleur de l'artère suprascapulaire adjacente (Fig.54c) (Bouffard et al. 2000).
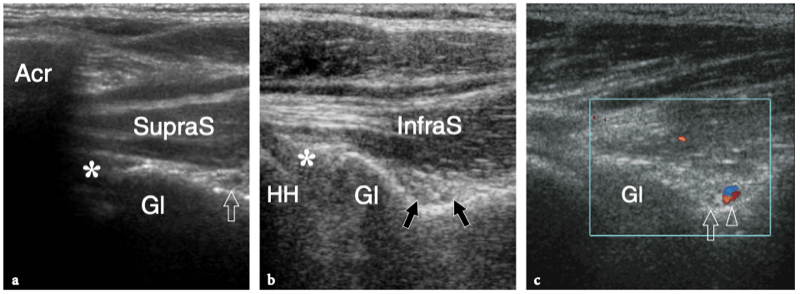
Figure 54a,b. Encoches supraépineuses et spinoglénoïdes. une image US coronale oblique 12–5 MHz obtenue en dedans de l'acromion (Acr) révèle l'encoche supra-épineuse comme une rainure peu profonde située dans la partie crânienne de l'omoplate juste en dedans de la glène osseuse (Gl) et du labrum supérieur (astérisque). Quelques minuscules points hypoéchogènes (flèche) sont appréciés dans l'encoche supra-épineuse, en profondeur du muscle supra-épineux (SupraS), reflétant l'artère suprascapulaire et le nerf suprascapulaire. b L'image échographique transversale 10–5 MHz obtenue au-dessus de l'épaule postérieure montre l'encoche spinoglénoïde (flèches) comme une concavité remplie de graisse de l'omoplate située à la base de la glène (Gl) et en profondeur du muscle sous-épineux (InfraS). Notez le labrum postérieur (astérisque) et la tête humérale (HH). c L'image Doppler couleur 12–5 MHz transversale permet de distinguer l'artère suprascapulaire (tête de flèche) du nerf suprascapulaire adjacent (flèche) en fonction de la détection des signaux de flux sanguin dans l'artère.
La détection échographique du nerf axillaire est une tâche difficile en raison de sa petite taille et de son parcours profond. L'imagerie Doppler est une étape essentielle de l'examen car elle facilite l'identification de la position du nerf en démontrant les signaux de flux de l'artère circonflexe postérieure adjacente (Martinoli et al. 2004). Avec le bras surélevé, le faisceau neurovasculaire axillaire est d'abord imagé dans le pli axillaire postérieur lorsqu'il passe entre le grand rond et le muscle triceps (Fig. 55a, b). Ensuite, l'artère et le nerf peuvent être suivis à travers l'épaule postérieure avec le patient assis et en gardant le bras en position neutre (Fig.55c,d). Dans certains cas, certains chirurgiens orthopédistes peuvent demander à l'examinateur de marquer la peau latérale au niveau du nerf axillaire pour éviter une lésion nerveuse par inadvertance lors de l'incision cutanée pour la réparation des déchirures de la coiffe des rotateurs. Si le nerf n'est pas clairement détectable, la peau peut être marquée au niveau de l'artère circonflexe.
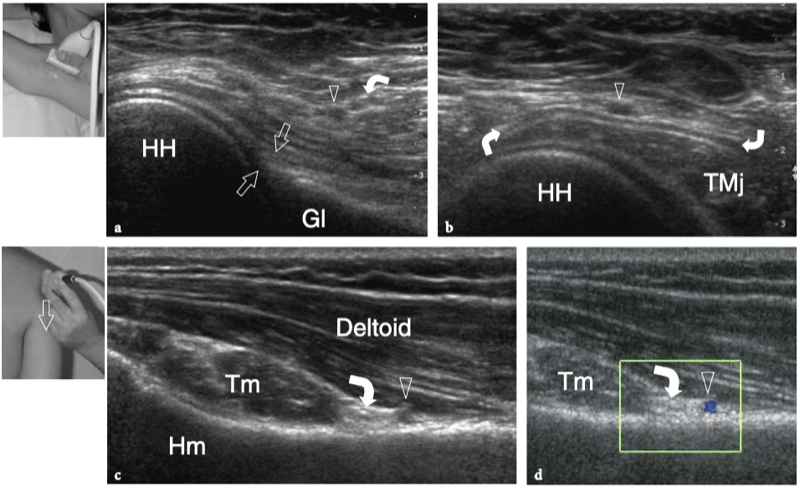
Figures 55a–d. Nerf axillaire et artère circonflexe postérieure. une image échographique oblique sagittale 12–5 MHz obtenue au-dessus de l'évidement axillaire de l'articulation gléno-humérale montre le labrum fibrocartilagineux inférieur (flèches blanches) entre la tête humérale (HH) et la glène osseuse (Gl). A proximité de ces structures, l'artère circonflexe postérieure (tête de flèche) et le nerf axillaire (flèche courbe) sont visualisés. b Image US 12–5 MHz grand axe du nerf axillaire (flèches courbes) le long de son trajet à travers l'aisselle. Notez la relation du nerf avec l'artère circonflexe postérieure (tête de flèche) et le muscle grand rond profond (TMj). Les images échographiques sagittales c en niveaux de gris et d Doppler couleur 12–5 MHz obtenues au-dessus de la métaphyse humérale postérieure (Hm) montrent le nerf axillaire (flèche courbe) et l'artère circonflexe postérieure adjacente (tête de flèche) alors qu'ils cheminent à la surface de l'os, en dessous le muscle petit rond (Tm) et en profondeur jusqu'au deltoïde. Les inserts en haut à gauche de la figure indiquent le positionnement respectif du transducteur.
33. PLEXUS BRACHIAL ET AUTRES NERFS DU COU
L'échographie s'est récemment révélée être un moyen efficace de représenter l'anatomie normale du plexus brachial à plusieurs niveaux, y compris les régions paravertébrale, interscalénique, supraclaviculaire, infraclaviculaire et axillaire (Yang et al. 1998 ; Sheppard et al. 1998 ; Apan et al. 2001 ; Retzl et al. 2001 ; Martinoli et al. 2002 ; Demondion et al. 2003). L'examen échographique des nerfs du plexus brachial est basé sur la détection de certains repères anatomiques dans le cou, notamment les os (racines), les muscles (troncs) et les vaisseaux (divisions et cordons). Après avoir quitté le foramen neural, les racines passent entre deux apophyses proéminentes des processus transverses des vertèbres cervicales - les tubercules antérieur et postérieur - en relation étroite avec l'artère et la veine vertébrales (Fig. 56). Chaque racine émerge comme une structure hypoéchogène individuelle (monofasciculaire), une apparence tout à fait différente de celle des nerfs des extrémités, qui sont composés de grappes de faisceaux hypoéchogènes. Les plans coronaux sont capables de représenter les racines nerveuses dans la zone paravertébrale en utilisant le même balayage longitudinal pour l'étude de l'artère et de la veine vertébrale comme point de repère (Fig. 57a, b). Dans ces plans, l'image des vaisseaux vertébraux est obscurcie à intervalles réguliers par l'ombrage acoustique des tubercules antérieurs des apophyses transverses. En déplaçant le transducteur légèrement vers l'arrière, les vaisseaux disparaissent et les racines apparaissent comme des images hypoéchogènes allongées sortant des foramens neuraux, chacun étant situé au-dessus de la barre costotransversale de la vertèbre. (Fig.57c,d). Néanmoins, les plans transversaux sont idéaux pour décrire la relation des racines avec les processus transverses à un niveau donné. Sur la base de l'aspect particulier du processus transverse de C7, dans lequel le tubercule postérieur est absent, l'échographie est en mesure d'évaluer le niveau des racines nerveuses (Martinoli et al. 2002).
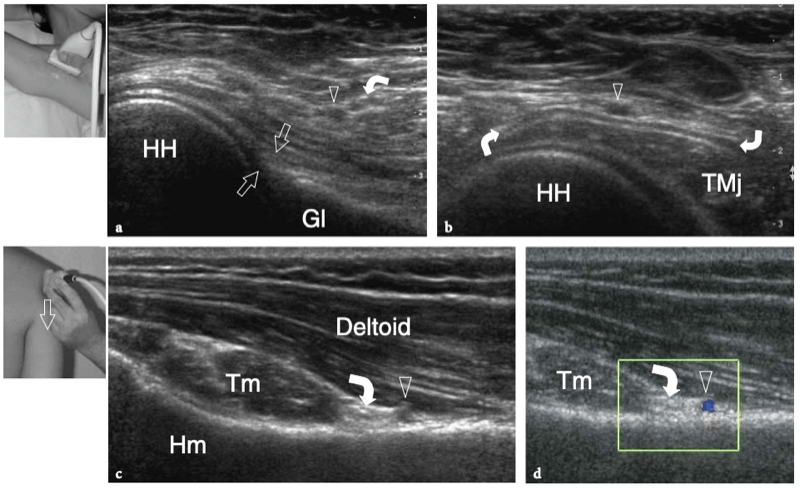
Figures 55a–d. Nerf axillaire et artère circonflexe postérieure. une image échographique oblique sagittale 12–5 MHz obtenue au-dessus de l'évidement axillaire de l'articulation gléno-humérale montre le labrum fibrocartilagineux inférieur (flèches blanches) entre la tête humérale (HH) et la glène osseuse (Gl). A proximité de ces structures, l'artère circonflexe postérieure (tête de flèche) et le nerf axillaire (flèche courbe) sont visualisés. b Image US 12–5 MHz grand axe du nerf axillaire (flèches courbes) le long de son trajet à travers l'aisselle. Notez la relation du nerf avec l'artère circonflexe postérieure (tête de flèche) et le muscle grand rond profond (TMj). Les images échographiques sagittales c en niveaux de gris et d Doppler couleur 12–5 MHz obtenues au-dessus de la métaphyse humérale postérieure (Hm) montrent le nerf axillaire (flèche courbe) et l'artère circonflexe postérieure adjacente (tête de flèche) alors qu'ils cheminent à la surface de l'os, en dessous le muscle petit rond (Tm) et en profondeur jusqu'au deltoïde. Les inserts en haut à gauche de la figure indiquent le positionnement respectif du transducteur.
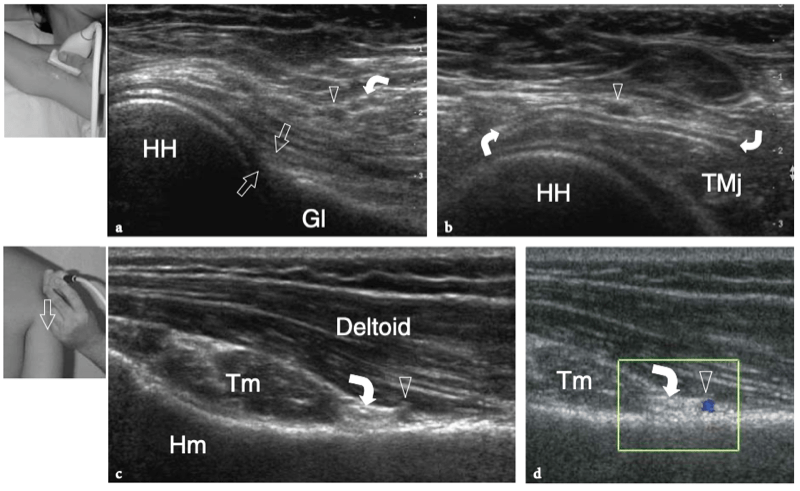
Fig. 56. Plexus brachial normal : aire paravertébrale. L'image US transversale 12–5 MHz sur le col antérolatéral gauche montre les principaux repères pour l'identification des racines nerveuses. Notez la position du lobe gauche de la thyroïde (Thy), de l'œsophage (Esoph), de l'artère carotide commune (CA), de la veine jugulaire interne (IJV) située entre le sternocleidomastoideus superficiel (SternoCl) et le longus colli profond (LC ) muscles. Au plus profond de ces structures, la face latérale de la vertèbre C6 présente un contour hyperéchogène ondulé, qui délimite le corps vertébral (1), le pédicule (2) et l'apophyse transverse (3), qui présente tour à tour deux protubérances antérieures (astérisque) et tubercules postérieurs (étoiles). La racine C6 (flèche) apparaît comme une image hypoéchogène contenue entre ces tubercules. L'insert en haut à gauche de la figure indique le positionnement du transducteur.
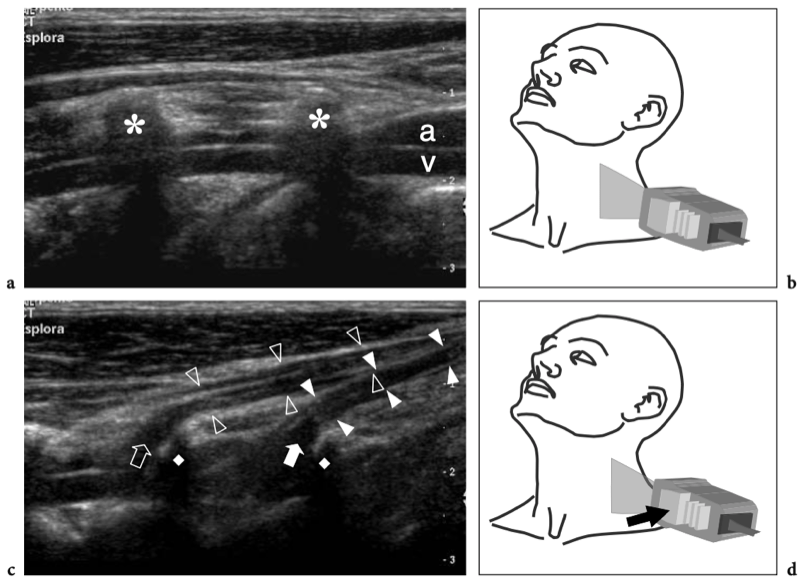
Figures 57a–d. Plexus brachial normal : région paravertébrale. a,c Images échographiques coronales obliques 12–5 MHz sur le col latéral avec schémas correspondants b,d montrant la position du transducteur échographique. a,b L'artère vertébrale (a) et la veine (v) sont mises en évidence le long de leur grand axe. Notez que ces vaisseaux sont obscurcis à intervalles réguliers par l'ombrage acoustique intermédiaire des tubercules antérieurs (astérisques) des processus transverses. c,d En déplaçant le transducteur légèrement vers l'arrière (flèche noire en d), les vaisseaux disparaissent et deux racines nerveuses (têtes de flèches ouvertes et blanches) sont appréciées comme des images hypoéchogènes allongées sortant des foramens neuraux (flèches ouvertes et blanches), chacune d'entre elles parcourant une barre costotransverse (losanges).
À cette fin, le balayage révèle d'abord le niveau C7, puis se déplace vers le haut ou vers le bas sur des plans axiaux. La racine C7 est détectée dans le même plan car la vertèbre C7 est bordée par le tubercule postérieur uniquement (Fig. 58a à d). En déplaçant le transducteur vers le haut, la vertèbre C6 est reconnue en raison de la présence de tubercules antérieurs et postérieurs proéminents : la racine C6 apparaît comme une structure hypoéchogène maintenue entre eux (Fig. 58e – h). Les apophyses transverses de C5 ont fondamentalement la même forme que celles de C6 et peuvent être identifiées comme des étapes crâniennes successives au niveau de C6 en tenant compte du nombre d'apophyses transverses rencontrées lors du balayage crânien du transducteur à partir de C7. Du point de vue anatomique, plus le niveau est élevé, plus l'espace entre les tubercules est petit. Ensuite, en déplaçant le transducteur vers le bas à partir de C7, la face latérale de la vertèbre T1 est plate sans aucun tubercule ; à ce niveau, la racine C8 peut être appréciée près du débouché foraminal. Plus caudalement, l'identification de la racine T1 n'est pas toujours réalisable en raison de problèmes d'accès liés à la localisation trop profonde du foramen intervertébral entre les vertèbres T1 et T2. La racine T1 montre une courbe en dessous de la première côte et peut être examinée en utilisant un plan axial oblique d'environ 45°. En plus de déterminer si une lésion est préganglionnaire plutôt que postganglionnaire, ou infraclaviculaire plutôt que supraclaviculaire, l'attribution d'un niveau donné d'atteinte nerveuse est un élément important du rapport d'imagerie puisque la liste des syndromes cliniques possibles chez un patient atteint de plexopathie brachiale est différente selon au motif des racines et des troncs blessés (p. ex., partie supérieure : C5, C6 [C7] ; partie inférieure : C8, T1 ; complète : C5–T1) (Narakas, 1993). En balayant le transducteur jusqu'à la région interscalène sur des plans à axe court, les troncs nerveux sont visualisés lorsqu'ils passent entre les muscles scalène antérieur et scalène moyen (Yang et al. 1998).
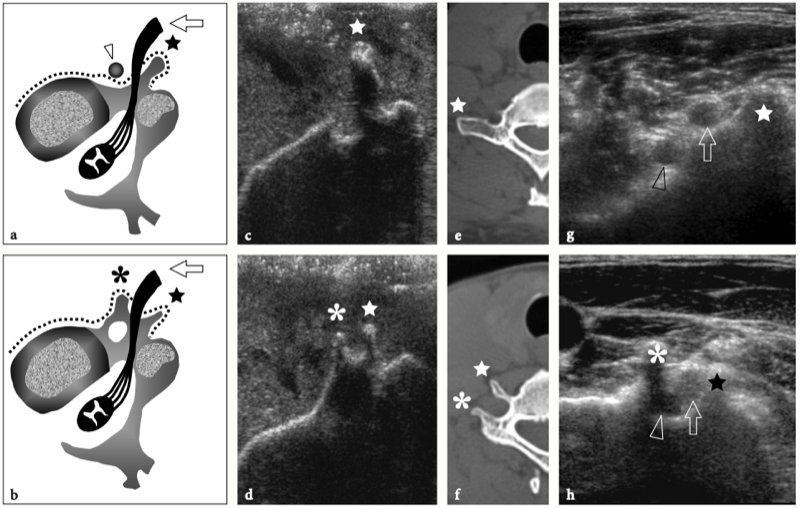
Figures 58a–h. Plexus brachial normal : région paravertébrale. a,b Dessins schématiques d'une vue transversale à travers les vertèbres cervicales avec des images américaines c,d transversales in vitro 12–5 MHz correspondantes d'un fantôme contenant une colonne cervicale, des tomodensitogrammes e,f et transverses g,h in vivo 12–5 MHz Images échographiques obtenues au niveau des apophyses transverses. a–d La première série d'images concerne la vertèbre C7. L'apophyse transverse de cette vertèbre est caractérisée uniquement par un tubercule postérieur (étoile). La racine C7 (flèche) et l'artère vertébrale (tête de flèche) lui sont antérieures (étoile). e–h La deuxième série d'images fait référence à la vertèbre C6, caractérisée par deux tubercules discrets : antérieur (astérisque) et postérieur. La racine C6 (flèche) et l'artère vertébrale (tête de flèche) cheminent entre ces tubercules.
La visualisation des troncs dans l'espace interscalène dépend de la quantité de graisse entre ces muscles, et une technique de balayage minutieuse est nécessaire car les faisceaux nerveux peuvent facilement être confondus avec les faisceaux musculaires. Les troncs supérieurs et moyens sont plus facilement identifiés avec les États-Unis (Fig. 59). Ils sont disposés en série du superficiel au profond et reçoivent des apports des niveaux C5 et C6 (tronc supérieur) et du niveau C7 (tronc moyen). Il faut considérer que la progression des racines est anatomiquement constante jusqu'à la région interscalène, où elles s'unissent pour former les trois troncs : supérieur (C5 et C6), moyen (C7) et inférieur (C8 et T1). Par conséquent, la capacité de l'échographie à reconnaître les niveaux racinaires dans la zone paravertébrale se reflète également sur une identification sûre des troncs en suivant simplement les nerfs d'où ces derniers émergent. Dans la région supraclaviculaire, les nerfs sont visualisés comme un groupe d'images arrondies hypoéchogènes qui représentent les divisions (Yang et al. 1998). Les divisions suivent, pour la plupart, la face postérieure de l'artère sous-clavière, juste au-dessus de l'aspect hyperéchogène droit de la première côte et de la plèvre apicale. (Fig. 60) (Sheppard et al. 1998; Yang et al. 1998).
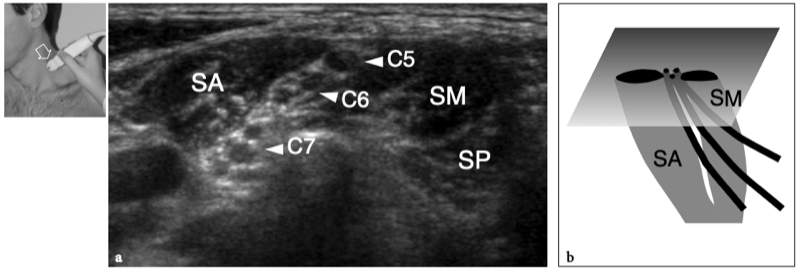
Figure 59a,b. Plexus brachial normal : région interscalène. une image US transversale oblique de 12 à 5 MHz sur la région interscalène avec une corrélation de dessin schématique b montre les contributions des niveaux C5 et C6 (formant le tronc supérieur du plexus) et la contribution de C7 (formant le tronc moyen) lorsqu'ils passent entre les muscles scalène antérieur (SA) et scalène moyen (SM). Le muscle scalène postérieur (SP) est également démontré à proximité du scalène moyen. Dans cette région, les nerfs (têtes de flèches) apparaissent comme des points hypoéchogènes intégrés dans l'espace graisseux hyperéchogène situé entre ces muscles en raison de leur parcours hors du plan. L'examinateur doit être conscient que les points les plus externes appartiennent au tronc supérieur du plexus brachial. L'insert en haut à gauche de la figure indique le positionnement du transducteur.
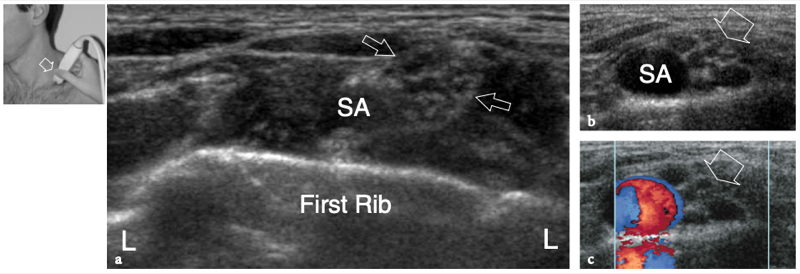
Figures 60a–c. Plexus brachial normal : région sus-claviculaire. une image US transversale oblique de 12 à 5 MHz sur la région supraclaviculaire montre les divisions du plexus brachial et les parties initiales des cordons sous forme de groupes de faisceaux hypoéchogènes ronds (flèches) situés au-dessus et, pour la plupart, en arrière de l'artère sous-clavière (AS). Au plus profond de ces structures, le profil rectiligne de la première côte et du poumon (L), qui apparaît comme une interface hyperéchogène brillante en raison de sa teneur en air, est également démontré. b,c Images échographiques transversales obliques b en échelle de gris et c Doppler couleur 12–5 MHz sur la région supraclaviculaire. L'imagerie Doppler peut aider à identifier les nerfs (flèche) dans cette région sur la base de la détection des signaux de flux sanguin de l'artère adjacente. L'insert en haut à gauche de la figure indique le positionnement du transducteur.
Traversant la clavicule, dans la région sous-claviculaire, les cordons nerveux continuent leur parcours le long de l'artère axillaire et derrière le muscle petit pectoral (Fig. 61). Une identification individuelle des divisions et des cordons du plexus brachial distal par rapport à la région interscalène est moins faisable à l'échographie car ces branches s'anastomosent les unes avec les autres dans diverses combinaisons. Dans l'ensemble, nous pensons que le principal avantage de l'échographie dans l'imagerie du plexus brachial est sa capacité à suivre en continu chaque composant individuel du plexus à travers le col latéral en déplaçant la sonde d'avant en arrière dans le plan à axe court. Semblable à d'autres sites du corps, des variantes anatomiques des nerfs du plexus brachial et des tissus environnants pouvant prédisposer à la neuropathie compressive peuvent être démontrées par échographie, y compris la côte cervicale, le processus transverse hypertrophié de C7 et les variations des muscles scalènes (Fig. 62). La détection d'une branche artérielle discrète provenant de l'artère sous-clavière et empiétant sur les nerfs du plexus brachial dans la région supraclaviculaire est une découverte normale. Ce vaisseau sanguin est l'artère scapulaire dorsale (Fig. 63).
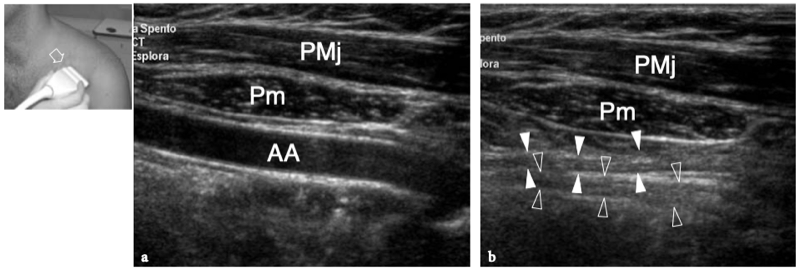
Figures 61a,b. Plexus brachial normal : région sous-claviculaire. Images échographiques transversales obliques 12–5 MHz obtenues sous la clavicule a sur le grand axe de l'artère axillaire (AA) et b immédiatement en arrière. Les cordons du plexus brachial (têtes de flèches ouvertes et blanches) sont visualisés sous forme de structures fasciculaires allongées courant autour de l'artère axillaire et profondes jusqu'au muscle petit pectoral (Pm). PMj, muscle grand pectoral. L'insert en haut à gauche de la figure indique le positionnement du transducteur.
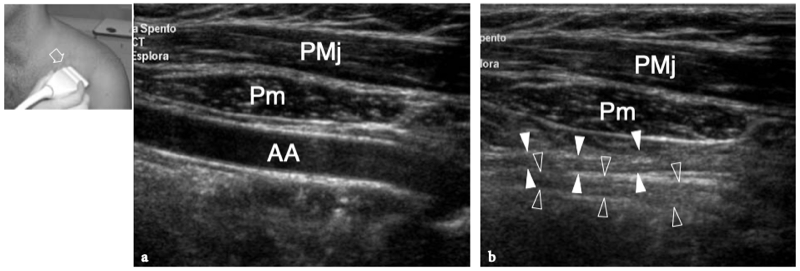
Figures 62a–c. Côte cervicale accessoire. une radiographie de face chez un sujet asymptomatique montre une côte cervicale (flèche droite) à droite et une apophyse transverse hypertrophiée (flèche courbe) de la vertèbre C7 à gauche. La côte cervicale s'articule avec un tubercule postérieur proéminent de C7 et la première côte. b L'image US transversale 12–5 MHz obtenue dans la zone paravertébrale droite montre la relation étroite entre la racine C7 (grande flèche) et un tubercule postérieur anormalement proéminent (flèche étroite). c Une image US transversale oblique de 12 à 5 MHz obtenue dans la région supraclaviculaire droite révèle l'articulation distale (têtes de flèche) de la côte cervicale lorsqu'elle se gonfle le long de l'artère sous-clavière (AS) et des divisions nerveuses (grande flèche) du plexus brachial pour se connecter avec la première côte.
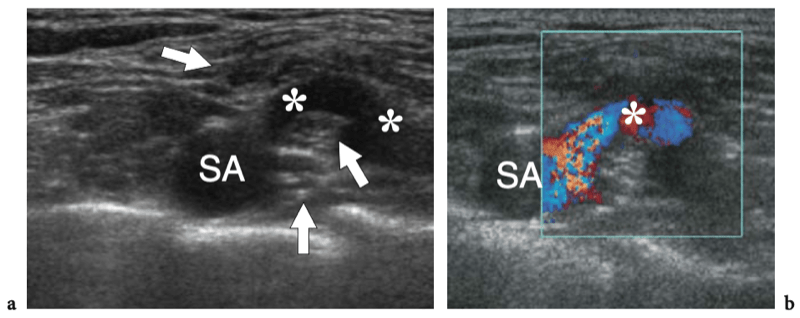
Figure 63a,b. Artère scapulaire dorsale. a,b Oblique transverse a échelle de gris et b couleur Doppler 12–5 MHz US images obtenues dans la région supraclaviculaire droite d'un sujet asymptomatique démontre une origine anormale de l'artère scapulaire dorsale (astérisques) à partir de l'artère sous-clavière (AS). Peu après son origine, l'artère passe parmi les nerfs du plexus brachial (flèches) formant un plan de clivage entre des amas superficiels (troncs supérieur et moyen) et profonds (troncs inférieurs) de faisceaux nerveux.
En plus des nerfs du plexus brachial, l'échographie est également capable d'imager d'autres nerfs fonctionnant dans la région cervicale latérale, y compris le nerf vague (Giovagnorio et Martinoli 2001), le nerf laryngé récurrent (Solbiati et al. 1985) et le nerf spinal accessoire ( Bodner et al. 2002). Le nerf vague (CN X), le principal nerf parasympathique des organes du corps, quitte le crâne par le foramen jugulaire et passe en bas dans la partie postérieure de la gaine carotide, dans l'angle entre et en arrière de la veine jugulaire interne et l'artère carotide (Illustration 64a). À cet endroit, il peut être apprécié avec les États-Unis comme une structure en forme de corde fine (<2 mm de diamètre de section transversale) orientée verticalement contenant trois ou quatre très petits fascicules (Fig.64b) (Giovagnorio et al. 2001). Sa branche secondaire, le nerf laryngé récurrent, atteint la face postéro-médiale du pôle inférieur de la thyroïde après avoir bouclé l'artère sous-clavière (à droite) et la crosse aortique (à gauche). Ensuite, il procède crânialement dans le sillon trachéo-oesophagien pour alimenter le muscle intrinsèque du larynx (Illustration 64a). À l'aide de transducteurs à haute résolution, de petits segments de ce nerf peuvent être reconnus chez quelques patients au cou maigre, au plus profond de la thyroïde (Fig.64c) (Solbiati et al. 1985). Le nerf spinal accessoire (CN XI) est un nerf moteur constitué de racines rachidiennes et crâniennes qui quitte la base du crâne par le foramen jugulaire et traverse le triangle cervical latéral, un espace bordé par le muscle sternocléidomastoïdien en avant, le trapèze en arrière et la clavicule en bas. , pour alimenter le muscle trapèze. Sa paralysie provoque une élévation et une rétraction limitées de l'épaule, appelée épaule tombante. Le nerf spinal accessoire passe sous le muscle sternocléidomastoïdien et, dans le triangle cervical latéral, il devient superficiel, descendant immédiatement en profondeur jusqu'au fascia et adjacent aux ganglions lymphatiques superficiels. Au niveau de ce site, il peut être lésé lors d'une biopsie ganglionnaire ou d'interventions de chirurgie carotidienne. L'échographie est capable de représenter le nerf normal comme une petite structure linéaire (taille de 1 mm) traversant le triangle cervical latéral et peut révéler ses lésions traumatiques dans le cadre clinique approprié (Bodner et al. 2002).
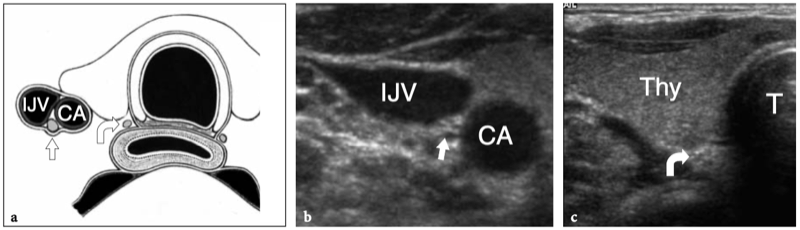
Figures 64a–c. Nerfs vague et laryngé récurrent. a Le dessin schématique montre le nerf vague (flèche) à l'intérieur du faisceau neurovasculaire majeur et derrière l'artère carotide commune (CA) et la veine jugulaire interne (IJV). Le nerf laryngé récurrent (flèche courbe) chemine plus médialement, le long du sillon trachéo-œsophagien et immédiatement en arrière des lobes thyroïdiens. b Une image US transversale 12–5 MHz du faisceau neurovasculaire droit montre le nerf vague (flèche) comme une très petite structure caractérisée par quelques fascicules hypoéchogènes entourés d'épinèvre hyperéchogène, entre l'artère carotide commune (AC) et la veine jugulaire interne ( IJV). c L'image US transversale 12–5 MHz sur le lobe droit (Thy) de la glande thyroïde montre le petit nerf laryngé récurrent (flèche courbe) lorsqu'il remonte le cou le long de la trachée (T).
34. PATHOLOGIE DE L'ÉPAULE
La connaissance de la pathophysiologie et de la biomécanique complexes sous-jacentes au conflit de la coiffe des rotateurs et à l'instabilité de l'épaule est une condition préalable essentielle à un examen échographique correctement exécuté et à l'interprétation des résultats d'imagerie.
35. APERÇU PHYSIOPATHOLOGIQUE – IMPINGEMENT ET MALADIE DE LA COIFFE DES ROTATIFS
La maladie de la coiffe des rotateurs est la cause la plus fréquente de douleur et de dysfonctionnement de l'épaule chez l'adulte. Elle découle d'un large éventail de conditions pathologiques, y compris les traumatismes aigus et chroniques, l'arthrite et l'instabilité de l'épaule (Laredo et Bard 1996). Cependant, la plupart des déchirures surviennent chez des patients qui n'ont pas d'antécédents cliniques précis de traumatisme ou de maladie systémique. Dans ces cas, on pense que la maladie de la coiffe des rotateurs est secondaire à des causes locales. Du point de vue physiopathologique, l'ischémie tendineuse a été le premier facteur supposé jouer un rôle causal dans la pathogenèse de la maladie de la coiffe des rotateurs (Codman, 1934). Cette théorie a été étayée par la preuve histologique d'une zone relativement hypovasculaire dans le tendon sus-épineux, la soi-disant «zone critique», qui est située à environ 1 cm en dedans de l'attache du tendon sur la grosse tubérosité. (Illustration 65a). Des études microangiographiques ont montré que cette zone se situe à la limite entre la vascularisation tendineuse issue de la jonction myotendineuse et celle issue de la jonction téno-osseuse du sus-épineux (Chansky et Iannotti 1991). La zone critique est donc sujette à l'ischémie et plus susceptible de développer des changements dégénératifs. Plus récemment, les lésions tendineuses secondaires au contact chronique du tendon sus-épineux avec la face inférieure de l'arc coraco-acromial, le soi-disant «syndrome de conflit», ont été proposées comme le principal facteur causal conduisant aux déchirures de la coiffe des rotateurs (Neer, 1972). Le succès clinique des procédures combinées de réparation de la coiffe des rotateurs et d'acromioplastie antérieure a conduit à l'acceptation généralisée de cette hypothèse. Un consensus émerge maintenant sur le fait que les causes de la maladie de la coiffe des rotateurs sont multiples, y compris diverses combinaisons de facteurs extrinsèques, tels que la morphologie de l'arc coracoacromial, la surcharge de traction, la surutilisation répétitive et les anomalies cinématiques, et des facteurs intrinsèques, tels que l'alimentation vasculaire tendineuse altérée ( Soslowsky et al. 1997).
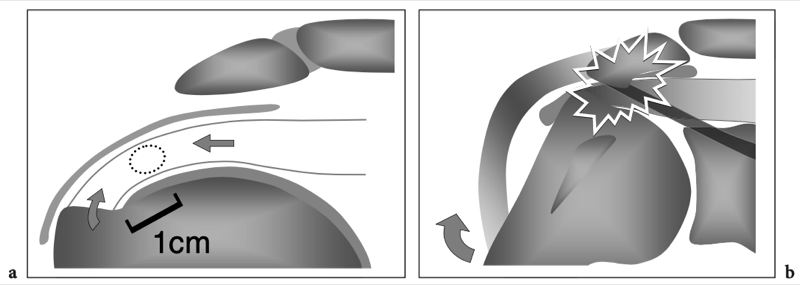
Figure 65a,b. Syndrome de conflit et maladie de la coiffe des rotateurs. a Le dessin schématique d'une vue coronale à travers l'épaule montre la position de la « zone critique » (cercle en pointillés), qui est située à environ 1 cm de l'insertion du tendon du sus-épineux (flèches) dans la grosse tubérosité. b Le dessin schématique d'une vue coronale à travers l'épaule illustre le mécanisme du syndrome de conflit antéro-supérieur. Le contact du côté bourse du tendon sus-épineux contre le tiers antérieur de l'acromion et la face inférieure de l'articulation acromio-claviculaire se produit lors de l'abduction (flèche) et de l'élévation antérieure du bras.
Le processus dégénératif de la substance tendineuse peut évoluer vers des déchirures partielles et complètes du tendon. Comme l'ont démontré les études d'autopsie, la pathologie de la coiffe des rotateurs devient plus fréquente avec l'âge. Une prévalence de la maladie d'environ 10 % à 30 ans, 50 % à 60-70 ans et 80 % à 80 ans a été rapportée et il est bien connu que les lésions asymptomatiques de la coiffe des rotateurs ne sont pas si rares, en particulier chez les sujets âgés qui ne réalisent pas l'échec de l'épaule compte tenu de leurs exigences réduites (Leach et Schepsis 1983; Yamaguchi et al. 2001). Selon la localisation du contact, trois principaux types de conflit d'épaule ont été décrits : antéro-supérieur (le plus fréquent), antéro-médial et postéro-supérieur. Comme décrit ci-dessus, le tendon sus-épineux se situe dans l'espace sous-acromial entre la tête humérale et la couverture de l'arc coraco-acromial, qui est formé (de l'arrière vers l'avant) par la partie antérieure de l'acromion et l'articulation acromio-claviculaire, le ligament et la pointe coraco-acromial. de la coracoïde. Dans les états normaux, le tendon glisse doucement dans l'espace sous-acromial lors de l'abduction et de l'élévation antérieure du bras. La bourse sous-acromiale sous-deltoïdienne, qui s'interpose entre elle et les structures de l'arc coraco-acromial, réduit l'attrition locale lors des mouvements d'épaule. Dans le conflit antéro-supérieur, le conflit entre le côté bourse du tendon et la face inférieure de l'arc se produit lors de l'abduction de l'épaule et de l'élévation du bras (Fig.65b).
Du point de vue physiopathologique, le syndrome de conflit antéro-supérieur peut être secondaire à plusieurs facteurs anatomiques et dynamiques. Les facteurs anatomiques se réfèrent principalement à l'incongruité entre la taille et la forme de l'espace sous-acromial et les structures qu'il contient. Toute lésion entraînant une diminution de la section transversale de l'espace sous-acromial ou une augmentation du volume des structures qui y sont logées rend plus probable un conflit tendineux. Des variantes congénitales de la pente et de la forme acromiale ou la survenue d'un os acromial peuvent être des facteurs prédisposant à l'apparition d'un syndrome de conflit antéro-supérieur (Mudge et al. 1984 ; Bigliani et al. 1991). Selon le système de classification de Bigliani et ses collaborateurs (Bigliani et al. 1986), la forme de l'acromion peut être classée en trois types principaux tels qu'ils apparaissent sur la base des radiographies « en vue de sortie » : l'acromion de type I (18.6 %) a une surface inférieure plate (Fig.66a,d); le type II (42%) a une sous-surface incurvée parallèle à la convexité de la tête humérale (Fig.66b,e); et le type III (38.6%) a un crochet en saillie vers l'avant, résultant soit d'un éperon au niveau du site d'attache du ligament coracoacromial, soit d'une configuration anormale congénitale (Fig.66c,f).
Figures 66a–f. Types de morphologie acromiale. a–c Les dessins schématiques d'une vue sagittale à travers l'épaule avec les radiographies de la vue de sortie d–f correspondantes montrent a,d type I ou acromion plat, b,e type II ou acromion incurvé et c,f type III ou acromion crochu. Les flèches indiquent les différentes formes acromiale.
Bien qu'une certaine variabilité interobservateur dans une telle évaluation ait été décrite, les clichés simples (vue de Lamy, vue de sortie) et l'IRM (plans obliques sagittaux) sont capables d'évaluer le type acromial (Mayerhoefer et al. 2005). L'acromion de type III provoque un rétrécissement de l'espace sous-acromial et semble être lié à une fréquence plus élevée de conflit tendineux (Bigliani et al. 1986). Un quatrième type de forme d'acromion (type IV) avec une surface inférieure convexe a également été décrit (Vanarthos et Monu 1995). L'importance de la pente de l'acromion dans la pathogenèse du syndrome de conflit d'épaule a été rapportée (Edelson et Taitz, 1992). En particulier, on pense que la descente latérale ou antérieure de l'acromion par rapport à la clavicule peut contribuer au rétrécissement de la sortie du sus-épineux. L'os acromial dérive d'un échec de fusion du centre d'ossification antérieur de l'acromion avec le corps acromial. Dans la plupart des cas, un pont fibreux solide relie fermement l'osselet à l'acromion, empêchant son mouvement. Dans certains cas, cependant, la pointe de l'os acromial peut être tirée vers le bas lors de la contraction du deltoïde, qui s'y fixe, provoquant un impact sur le tendon sous-épineux sous-jacent (Mudge et al. 1984). En plus des causes congénitales, une variété de troubles acquis peuvent entraîner un espace sous-acromial restreint. Parmi eux, l'arthrose de l'articulation acromio-claviculaire avec des ostéophytes s'étendant vers le bas peut provoquer un grattage et une lésion du côté de la bourse du tendon sus-épineux. Ces ostéophytes sont retrouvés chez environ la moitié des patients présentant des déchirures du tendon sus-épineux contre 14 % des patients sans déchirure (Peterson et Genz 1983).
Les éperons sur l'attache acromiale du ligament coracoacromial sont également considérés comme des signes de conflit d'épaule. Une fracture mal consolidée du tubercule majeur peut entraîner un déplacement anormal vers le haut du fragment osseux et un rétrécissement ultérieur de l'espace sous-acromial. Un conflit antéro-supérieur peut survenir en l'absence de tout signe d'anomalies anatomiques pouvant l'expliquer. Contrairement au syndrome de conflit lié à des altérations de l'arc coracoacromial, ces cas surviennent chez des athlètes impliqués dans des activités sportives qui nécessitent un mouvement du bras au-dessus de la tête (p. ex. volley-ball, lancer) et sont quelque peu liés à une instabilité de l'articulation gléno-humérale (Jobe et al. 1989). Au cours de l'instabilité antérieure, la surcharge répétitive entraîne un certain degré de translation antérieure et supérieure de la tête humérale avec restriction secondaire de l'espace sous-acromial et attrition locale du tendon sus-épineux contre l'acromion antérieur et le ligament coracoacromial lorsque le bras est en abduction et en rotation externe. En général, ces patients ont une maladie de la coiffe des rotateurs moins avancée (c'est-à-dire une tendinose, des déchirures partielles) et bénéficient d'un traitement dirigé contre l'instabilité sous-jacente, y compris le renforcement de la coiffe des rotateurs. La même chose se produit souvent chez les jeunes femmes minces qui ont de faibles rotateurs scapulaires. Une fois le syndrome de conflit établi, les microtraumatismes mécaniques chroniques induisent une dégénérescence et une déchirure tendineuses progressives ainsi que des modifications de la bourse sous-deltoïdienne sous-acromiale. Dans le syndrome de conflit antérieur, trois stades d'atteinte tendineuse croissante ont été décrits (Neer, 1972). Le stade I est surtout apprécié chez l'adulte jeune chez qui le conflit entraîne une bursite sous-acromiale et des modifications tendineuses absentes ou minimes : ce stade est généralement réversible. Le stade II est caractérisé par un épaississement progressif et un aspect irrégulier du tendon sus-épineux et de la bourse sous-deltoïdienne sous-acromiale à la suite du processus dégénératif : la chirurgie est généralement envisagée (c'est-à-dire l'ablation de la bourse épaissie et la libération du ligament coraco-acromial) si une prise en charge conservatrice échoue. Le stade III indique une progression des lésions tendineuses vers des déchirures partielles et totales : une acromioplastie et une réparation de la coiffe sont souvent nécessaires.
Beaucoup moins fréquent que le conflit antéro-supérieur, le conflit antéro-médian (conflit sous-coracoïdien) dérive de l'empiétement de la partie supérieure du tendon sous-scapulaire et de la longue portion du tendon du biceps contre la pointe de la coracoïde lors de la rotation interne maximale et de la flexion avant du bras (Gerber et al. 1985). Une laxité de la capsule antérieure et des ligaments et des anomalies congénitales de l'apophyse coracoïde et de la petite tubérosité semblent être impliquées comme facteurs prédisposants. Enfin, un troisième type de conflit d'épaule, le conflit postéro-supérieur (conflit postéro-sous-glénoïdien) résulte d'un pincement de la coiffe des rotateurs à la jonction des tendons supra-épineux et infra-épineux, entre le trochiter et la face postéro-supérieure du bord glénoïdien, lors de abduction maximale et rotation externe du bras (Walch et al. 1991). Ce type de conflit provoque des modifications dégénératives et des déchirures partielles du tendon postérieur du sus-épineux, impliquant généralement sa face inférieure.
36. INSTABILITÉ
En raison de son anatomie particulière, l'articulation de l'épaule est intrinsèquement instable. Plusieurs structures de l'épaule peuvent être impliquées dans la pathogenèse de l'instabilité, notamment les surfaces osseuses, la capsule articulaire, les ligaments et le labrum fibrocartilagineux (contraintes statiques) et les tendons de la coiffe des rotateurs (contraintes dynamiques). En plus des facteurs anatomiques, une combinaison d'autres facteurs prédisposants liés à la fois aux maladies développementales et acquises, souvent combinés entre eux, peuvent être responsables de l'instabilité articulaire gléno-humérale. Le degré d'instabilité de l'articulation gléno-humérale va de la subluxation à la luxation et indique que la tête humérale glisse hors de son alvéole lors des mouvements. Dans ce contexte, le clinicien doit se rendre compte si une subluxation ou une luxation s'est produite et doit évaluer l'état des structures anatomiques responsables de la stabilité articulaire pour établir un traitement approprié. Selon sa direction, l'instabilité de l'épaule peut être définie comme antérieure, postérieure ou inférieure à la glène, ou multidirectionnelle (Zarins et Rowe, 1984). L'instabilité antérieure représente environ 96 à 98 % de toutes les luxations de l'épaule. Bien que souvent rencontrée chez les sujets présentant une capsule antérieure et des ligaments lâches, l'instabilité antérieure fait généralement suite à une lésion aiguë qui fragilise les structures para-articulaires responsables de la stabilité articulaire. Le mécanisme associé à l'instabilité antérieure est l'abduction, l'extension et la rotation externe. Des subluxations ou luxations récurrentes peuvent survenir même après un traumatisme bénin. Le diagnostic d'instabilité antérieure repose sur l'examen physique et les clichés simples (Fig. 67).
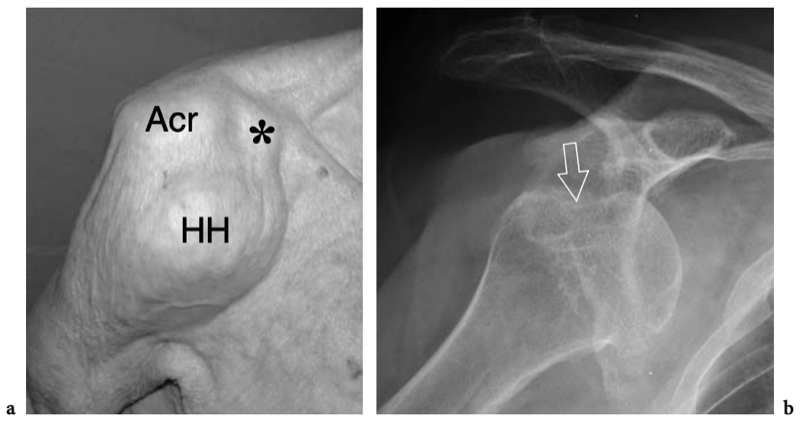
Figure 67a,b. Instabilité antérieure de l'épaule. a Instabilité antérieure chronique chez un patient âgé. Notez la luxation antérieure de la tête humérale (HH) par rapport à l'acromion (Acr) et à la coracoïde (astérisque). b Luxation gléno-humérale antérieure type sous-coracoïdienne. La radiographie de face montre un déplacement antérieur de la tête humérale qui semble située en dessous de l'apophyse coracoïde. Une déformation de Hill-Sachs est présente (flèche).
Dans la plupart des cas, les vues antéropostérieures sont suffisantes pour détecter la luxation antérieure de la tête humérale et aucune projection supplémentaire n'est nécessaire. Contrairement à la luxation, une subluxation de la tête humérale peut être un événement transitoire subtil qui peut être difficile à reconnaître. L'instabilité postérieure peut être secondaire à un traumatisme de l'épaule et, lorsqu'elle est bilatérale, elle est fréquemment observée dans les convulsions en raison de la contraction convulsive plus forte des muscles postérieurs (sous-épineux et petit rond) par rapport à celle du sous-scapulaire. Le diagnostic est souvent manqué car cette affection est peu fréquente (4 % de toutes les luxations de l'épaule) et peut présenter des signes cliniques et radiographiques subtils. Les radiographies standard, y compris les vues antéropostérieures et latérales, peuvent souvent être inadéquates pour la détection de la luxation postérieure et des projections supplémentaires, telles que la vue axillaire, peuvent être nécessaires à cette fin. Cependant, ces projections ne sont pas facilement obtenues chez le patient gravement blessé. Environ 50 % des luxations postérieures de l'épaule passent inaperçues et certains auteurs ont rapporté un intervalle moyen entre la lésion et le diagnostic de 1 an, en particulier dans le cas d'une luxation postérieure « verrouillée » qui survient lorsque la glène postérieure provoque une fracture par impaction sur le tête humérale empêchant son repositionnement (Hawkins et al. 1987). Si elle n'est pas reconnue tôt, la luxation postérieure peut entraîner une raideur articulaire chronique, des douleurs et une amplitude de mouvement réduite. Les luxations chroniques de longue date sont le plus souvent retrouvées chez les personnes âgées. Dans ces cas, le pronostic n'est pas bon et la décision peut souvent être de laisser l'épaule luxée et d'essayer de retrouver le plus de mouvement possible avec une thérapie physique ou l'insertion d'une prothèse d'épaule.
37. PATHOLOGIE DE LA COIFFE DES ROTATEURS
Initialement et pendant de nombreuses années, les chercheurs ont rapporté des résultats contradictoires, enthousiastes ou médiocres, sur la capacité de l'échographie à diagnostiquer une pathologie de la coiffe des rotateurs (Mayer 1985 ; Mack et al. 1985 ; Middleton et al. 1985, 1986b ; Hodler et al. 1988, 1991 ; Burk et al. 1989 ; Brandt et al. 1989 ; Soble et al. 1989 ; Hall 1989 ; Ahovuo et al. 1989a,b ; Miller et al. 1989 ; Drakeford et al. 1990 ; Vick et Bell 1990 ; Misamore et Woodward, 1991 ; Nelson et al. 1991 ; Wulker et al. 1991 ; Wiener et Seitz, 1993 ; Guckel et Nidecker 1997). Dans de nombreux cas, les premières études utilisaient des critères américains aujourd'hui affinés ou ne sont plus acceptés, les examens étaient réalisés avec une technique de balayage modifiée depuis pour améliorer la visualisation du brassard, et d'anciens équipements à basse résolution étaient employé. Dans le contexte des améliorations technologiques, des capacités de résolution plus élevées et de nouveaux critères pour diagnostiquer les déchirures de la coiffe des rotateurs, la technologie américaine actuelle est maintenant de plus en plus en mesure de fournir de manière fiable une bonne précision dans l'évaluation des déchirures de la coiffe des rotateurs (Teefey et al. 1999, 2004 ; Bouffard et al. 2000 ; Leotta et al. 2000 ; Roberts et al. 2001 ; Moosikasuwan et al. 2005). De plus, cette technique permet l'évaluation de la plupart des stades de la maladie de la coiffe des rotateurs et la classification des déchirures de la coiffe des rotateurs en fonction de l'étendue de l'atteinte du tendon, de la taille et de l'emplacement de la déchirure. Comme déjà décrit, le sus-épineux est le tendon de la coiffe des rotateurs le plus souvent impliqué dans des déchirures partielles ou totales à la suite d'un conflit sous-acromial. Dans une large série de ruptures de la coiffe des rotateurs prouvées chirurgicalement, des ruptures isolées du tendon sus-épineux ont été retrouvées dans 62 % des cas, représentant 18 % des ruptures partielles et 44 % des ruptures totales (Walch et al. 1999). Des changements dégénératifs précoces et des déchirures du sus-épineux sont généralement observés dans la moitié antérieure du tendon, juste derrière la longue tête du tendon du biceps (Illustration 68a). Les plus petites formes de déchirures de la coiffe des rotateurs sont des déchirures d'épaisseur partielle, qui peuvent à leur tour être situées à la surface articulaire (12 %) ou à la surface de la bourse (5 %) du tendon impliqué. Les déchirures intrasubstance surviennent plus rarement (1 %). Si elles ne sont pas traitées, les déchirures d'épaisseur partielle peuvent s'agrandir pour devenir des déchirures de pleine épaisseur (Fig.68b). Dans l'ensemble, il faut considérer que les déchirures de demi-épaisseur sont plus fréquentes que les déchirures de pleine épaisseur et celles impliquant le côté articulaire de la coiffe des rotateurs sont légèrement plus fréquentes que celles du côté de la bourse. Commençant dans le tiers antérieur du sus-épineux, la plupart des déchirures se propagent ensuite dans une direction postérieure pour impliquer le tendon moyen et postérieur, provoquant éventuellement dans certains cas une rupture complète du sus-épineux. (Fig.68c). Dans une maladie plus avancée, d'autres tendons de la coiffe des rotateurs peuvent également se rompre en raison de forces de traction excessives dues à la biomécanique altérée de l'épaule liée à la déchirure du sus-épineux. (Fig.68d). L'implication d'autres tendons avec le sus-épineux a été rapportée chez 30 % de patients supplémentaires (Walch et al. 1999). Dans ces déchirures combinées, l'extension postérieure d'une déchirure du sus-épineux à l'infra-épineux survient dans environ 20 % des cas, alors que l'atteinte antérieure du sous-scapulaire à partir d'une déchirure du tendon du supra-épineux est moins fréquente et représente environ 10 % des cas (Walch et al 1999). Au fur et à mesure que la lésion s'étend vers l'avant dans le sous-scapulaire, une rupture des stabilisateurs du tendon du biceps (c'est-à-dire des structures d'intervalle de la coiffe des rotateurs) se produit. Une rupture isolée du tendon sous-scapulaire survient dans 8 % des cas supplémentaires : ces ruptures sont plus fréquentes dans les traumatismes sportifs en raison d'un étirement forcé sur un bras en abduction et en rotation externe. En revanche, la rupture isolée de l'infraspinatus est rare et survient dans le spectre du conflit sous-glénoïdien postéro-supérieur.
Figures 68a–d. Les dessins schématiques d'une vue sagittale à travers l'épaule illustrent la progression typique d'une déchirure de la coiffe des rotateurs. a Initialement, une déchirure d'épaisseur partielle (gris foncé) du tendon antérieur du sus-épineux (gris clair) se produit. Cette déchirure a tendance à grossir (flèches) dans le plan vertical jusqu'à devenir une déchirure de pleine épaisseur. Une fois établie, une déchirure de pleine épaisseur se dilate dans une direction antérieure et postérieure (flèches) jusqu'à provoquer une rupture complète du tendon sus-épineux. d Dans une maladie avancée, la déchirure du tendon supraspinatus peut s'étendre davantage soit dans une direction postérieure (flèche blanche), impliquant le tendon infraspinatus, soit dans une direction antérieure (flèches noires), impliquant le biceps et le tendon sous-scapulaire, pour créer une déchirure massive .
La classification des déchirures de la coiffe des rotateurs est quelque peu déroutante car différents termes ont été utilisés de manière inappropriée avec le même sens. Afin de mieux comprendre le type de rupture tendineuse et d'uniformiser les observations des différents examinateurs, la coiffe des rotateurs doit être pensée en trois dimensions. Une déchirure doit être considérée comme incomplète lorsqu'elle ne concerne qu'une partie de la largeur du tendon sur des plans de petit axe (Fig. 68a, b). Les déchirures incomplètes peuvent être à leur tour subdivisées en épaisseur partielle (Illustration 68a) ou pleine épaisseur (Fig.68b) types selon qu'ils entraînent ou non une communication anormale de l'articulation gléno-humérale et de la bourse sous-deltoïdienne sous-acromiale. Selon leur profondeur, les déchirures de demi-épaisseur peuvent concerner le côté bourse, le côté articulaire ou le milieu (intrasubstance) du tendon (Ellman 1990). Lorsqu'une déchirure de pleine épaisseur implique toute la largeur d'un tendon, elle devient une déchirure complète (Fig.68c). Ensuite, il peut devenir une déchirure massive en se propageant pour impliquer plus d'un tendon avec une largeur totale de la coiffe affectée supérieure à 3 cm (Fig.68d).
38. TENDINOPATHIE DE LA COIFFE
On pense que la tendinopathie de la coiffe des rotateurs est un résultat précoce d'un conflit antéro-supérieur (Neer stade II) et, dans un premier temps, affecte le tendon sus-épineux avec la bourse sous-acromiale. L'aspect américain de la tendinopathie comprend un gonflement du tendon affecté et une échotexture tendineuse anormale avec un aspect hypoéchogène hétérogène (Fig. 69).
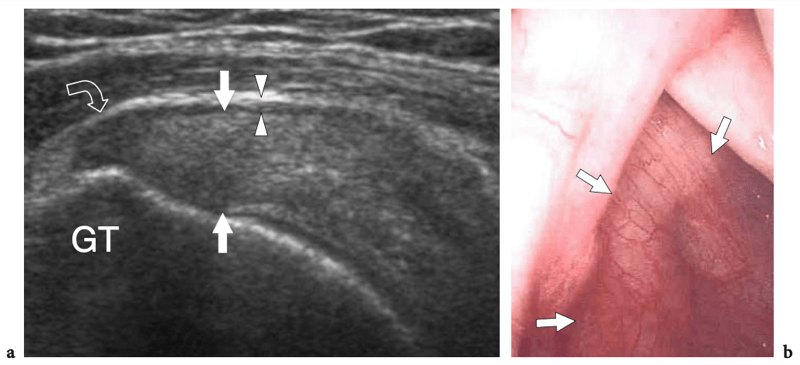
Figure 69a,b. Syndrome de conflit avec anomalies du tendon sus-épineux traduisant une tendinose. une image US à axe long 12–5 MHz sur le sus-épineux montre un tendon hypoéchogène et gonflé (flèches droites). L'insertion tendineuse (flèche courbe) est plus arrondie et renflée au-dessus de la grosse tubérosité (GT). La bourse sous-acromiale sous-deltoïdienne (têtes de flèches) se distingue du tendon sous-jacent par son aspect plus hypoéchogène. b La photographie arthroscopique révèle un réseau microvasculaire rougeâtre (flèches) sur la surface du tendon sus-épineux reflétant une hyperémie intratendineuse.
Le gonflement du tendon peut être apprécié avec l'échographie comme une augmentation focale ou - le plus souvent - diffuse de l'épaisseur du tendon (Farin et al. 1990). Parce que les plans à grand axe donnent une représentation panoramique du tendon dans son ensemble, ils sont les plus adéquats pour reconnaître son épaississement. L'examen bilatéral peut parfois être utilisé pour améliorer la confiance du diagnostic lorsque seuls de petits changements dans la taille du tendon se produisent. Dans ces cas, il faut veiller à évaluer le même niveau des deux côtés car le sus-épineux se rétrécit vers le tubercule majeur et d'avant en arrière. Le balayage dynamique obtenu en plaçant la sonde dans le plan coronal sur le bord latéral de l'acromion pendant que le patient fait une abduction du bras en rotation interne peut démontrer un glissement difficile du tendon épaissi et de la bourse sous-acromiale sous l'acromion (Read et Perko 1998). Certains seuils de taille tendineuse entre le côté sain et le sus-épineux atteint (différence d'épaisseur allant de 1.5 à 2.5 mm) ou une épaisseur tendineuse supérieure à 8 mm ont été proposés comme indicateurs de tendinopathie (Crass et al. 1988a). À l'instar d'autres applications de l'imagerie musculo-squelettique, nous pensons que les résultats de l'échographie dans la pathologie de la coiffe des rotateurs doivent être interprétés à la lumière des données cliniques plutôt que sur la base de différences de mesures. En effet, les mesures sont moins fiables et leur valeur est médiocre en l'absence de corrélation clinique. De plus, la tendinopathie sus-épineuse est souvent associée à un épaississement diffus de la paroi de la bourse sous-deltoïdienne sous-acromiale et à un petit épanchement réactif de la bourse. Dans de nombreux cas, un plan de clivage fait défaut entre ces deux structures et, par conséquent, il peut être difficile d'exclure la contribution de la bourse lors de la mesure de l'épaisseur du tendon. En ce qui concerne l'échotexture anormale dans la tendinopathie, les découvertes échographiques semblent être liées à de subtiles déchirures fibrillaires et à des zones de dégénérescence mucoïde mêlées au processus de réparation se produisant dans la substance tendineuse. Néanmoins, une corrélation pathologique précise de ces anomalies fait défaut dans la littérature d'imagerie car ces patients sont traités de manière conservatrice. De légères modifications corticales du tubercule majeur peuvent également être observées.
39. LARMES D'ÉPAISSEUR PARTIELLE
Les déchirures d'épaisseur partielle représentent environ 13 à 18 % de toutes les déchirures de la coiffe des rotateurs et surviennent dans un groupe d'âge plus jeune que les déchirures d'épaisseur totale (Walch et al. 1999). La détection par échographie de ces déchirures et leur différenciation de la tendinopathie focale est souvent difficile car l'apparence des deux affections peut être similaire. Il faut cependant noter que l'approche thérapeutique est conservatrice pour les deux, de sorte que leur différenciation n'a aucune valeur clinique. Sur la base des résultats américains, nous pensons qu'un diagnostic précis d'une déchirure d'épaisseur partielle doit être posé lorsqu'un véritable défaut ou une fente dans la substance tendineuse est clairement délimité sur les plans à axe long et court. Comme indiqué précédemment, les ruptures partielles touchent le plus souvent le tiers antérieur du tendon sus-épineux. La principale constatation échographique est une zone hypoéchogène localisée n'affectant qu'une partie de l'épaisseur du tendon. Étant donné que l'échogénicité des différentes portions de tendon peut varier en fonction de l'incidence du faisceau échographique, un diagnostic fiable de déchirures d'épaisseur partielle ne doit être posé que lorsque la zone ne change pas d'aspect hypoéchogène sur les scanners à petit et grand axes et pendant que inclinaison du transducteur sur le tendon (van Holsbeeck et al. 1995). La taille de la déchirure doit être mesurée sur des plans long et petit axe et doit être indiquée dans le rapport sous la forme d'une mesure (en mm) ou d'un pourcentage du diamètre du tendon (tiers de l'épaisseur du tendon). À notre avis, la deuxième option est plus pratique car elle donne une estimation de la lésion par rapport à la taille du tendon. En référence aux déchirures de demi-épaisseur, elles peuvent avoir soit une bourse, soit une extension articulaire ou intra-tendineuse. Les déchirures de la surface de la bourse sont mieux visibles à l'échographie et apparaissent généralement comme des défauts concaves hypoéchogènes situés à la surface de la bourse du sus-épineux, dans la plupart des cas près de la grosse tubérosité (Fig. 70, 71). Une hernie focale de liquide de bourse hypoéchogène ou de graisse péribursale hyperéchogène dans le défaut est souvent observée et représente un signe utile pour détecter de telles déchirures (Fig. 72).
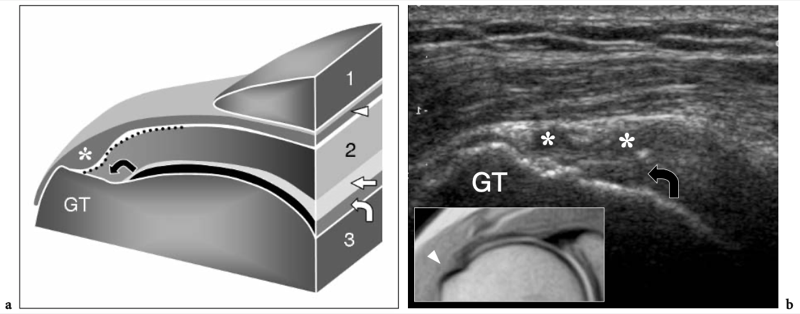
Figure 70a,b. Déchirure de l'épaisseur partielle côté bourse du tendon sus-épineux. a Dessin schématique d'une vue grand axe à travers le tendon sus-épineux et b l'image US correspondante à 12–5 MHz révèle un défaut concave (ligne pointillée) à la surface de la bourse du tendon sus-épineux à proximité immédiate de la grosse tubérosité (GT). Le défect est rempli de liquide de bourse hypoéchogène (astérisques). Notez les fibres articulaires profondes intactes (flèche courbe noire) du tendon. 1, acromion ; pointe de flèche, bourse sous-deltoïdienne sous-acromiale ; 2, tendon sus-épineux ; flèche droite, cavité articulaire gléno-humérale ; flèche courbe blanche, cartilage articulaire ; 3, tête humérale. L'imagerie RM corrélative du même cas est fournie dans l'insert en bas à gauche de l'image US.
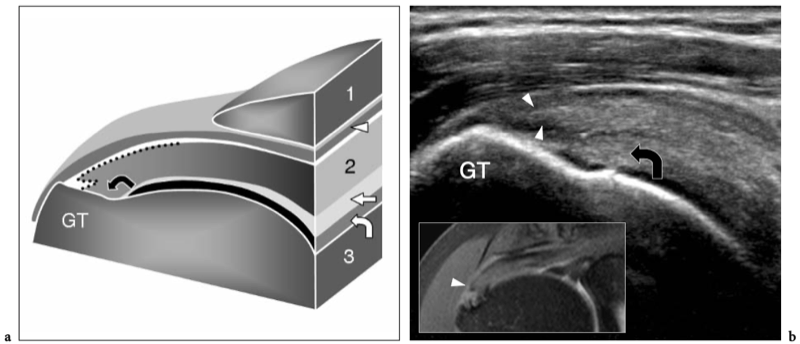
Figure 71a,b. Déchirure de l'épaisseur partielle côté bourse du tendon sus-épineux. a Dessin schématique d'une vue grand axe à travers le tendon sus-épineux et b l'image US 12–5 MHz correspondante révèle le détachement des fibres tendineuses superficielles (ligne pointillée an a; pointes de flèches en b) à partir de leur insertion dans la grande tubérosité (GT). A noter une subtile fente hypoéchogène séparant les fibres bursales rompues des fibres articulaires profondes intactes (flèche courbe noire) du tendon. 1, acromion ; pointe de flèche, bourse sous-deltoïdienne sous-acromiale ; 2, tendon sus-épineux ; flèche droite, cavité articulaire gléno-humérale ; flèche courbe blanche, cartilage articulaire ; 3, tête humérale. L'imagerie RM corrélative du même cas est fournie dans l'insert en bas à gauche de l'image US.
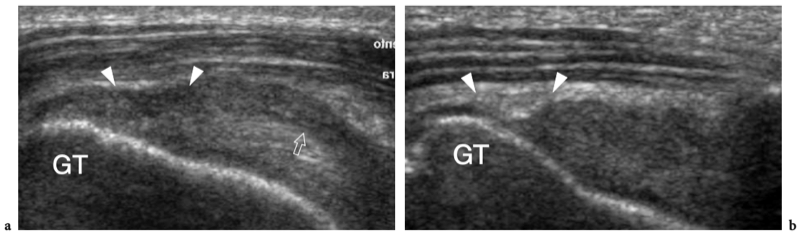
Figure 72a,b. Déchirures d'épaisseur partielle côté bourse du tendon sus-épineux. Deux cas différents. une image US à axe long 12–5 MHz sur le tendon sus-épineux montre une hernie focale du tissu hypoéchogène de la bourse dans le défaut (têtes de flèches). Notez l'épaississement des parois de la bourse (flèche) et la perte de la convexité normale de la graisse péribursale au site de la déchirure. GT, grosse tubérosité. b Image échographique grand axe 12–5 MHz sur le tendon sus-épineux révélant une graisse péribursale hyperéchogène remplissant un petit défaut superficiel (têtes de flèches) en l'absence d'épanchement local.
L'épanchement de la bourse est généralement modéré et nécessite une technique de balayage précise pour sa détection : une pression graduée avec la sonde peut rendre plus évidente la hernie liquidienne dans la déchirure. Dans les déchirures de la bourse, la visualisation de l'intégrité des fibres articulaires profondes est toujours nécessaire pour ne pas confondre ces déchirures avec des déchirures de pleine épaisseur. Les déchirures de la surface articulaire sont plus fréquentes que celles de la bourse, mais sont également plus difficiles à détecter par échographie. Elles se présentent comme une discontinuité de la ligne articulaire du tendon remplie d'épanchement articulaire et sont associées à une insertion normale des fibres superficielles de la bourse (Fig. 73). Souvent, ils apparaissent comme un foyer hyperéchogène et hypoéchogène profond mixte au niveau du col huméral, en raison de la séparation du segment distal rétracté du tendon du tissu intact environnant, ce qui entraîne une nouvelle interface acoustique dans la substance tendineuse. (Fig. 74) (van Holsbeeck et al. 1995 ; Teefey et al. 1999 ; Bouffard et al. 2000 ; Yao et al. 2004). Les déchirures latérales articulaires s'accompagnent souvent d'irrégularités osseuses au niveau du tubercule majeur. Les déchirures intra-substance peuvent être appréciées comme de subtiles fentes longitudinales intratendineuses orientées à partir de l'insertion osseuse de manière proximale sans sortir ni sur la bourse ni sur le côté articulaire du tendon. Elles se présentent sous la forme de fines lignes intratendineuses remplies de liquide et doivent être évaluées dans leur axe long et court pour éviter les pièges liés à l'anisotropie et à la confusion avec une tendinopathie focale. (Fig. 75). Dans d'autres cas, ces déchirures peuvent être caractérisées par un écho linéaire de haut niveau entouré d'un halo hypoéchogène de tendon liquidien ou oedémateux, les déchirures dites "rim rent". (Fig. 76) (Bouffard et al. 2000).
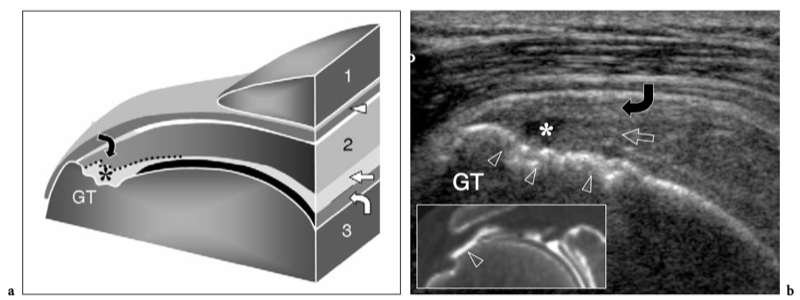
Figure 73a,b. Déchirure d'épaisseur partielle du côté articulaire du tendon sus-épineux. a Dessin schématique d'une vue grand axe à travers le tendon sus-épineux et b image US 12–5 MHz correspondante démontrant le détachement des fibres articulaires profondes (flèche ouverte) du tendon de leur insertion osseuse. Un petit épanchement hypoéchogène (astérisque) remplit la déchirure. Notez les fibres bursales intactes (flèche courbe noire) du tendon et le contour cortical irrégulier (têtes de flèches) de la grosse tubérosité (GT). 1, acromion ; pointe de flèche, bourse sous-deltoïdienne sous-acromiale ; 2, tendon sus-épineux ; flèche blanche droite, cavité articulaire gléno-humérale ; flèche courbe blanche, cartilage articulaire ; 3, tête humérale. La corrélation d'imagerie arthro-CT du même cas est fournie dans l'insert en bas à gauche de l'image US.
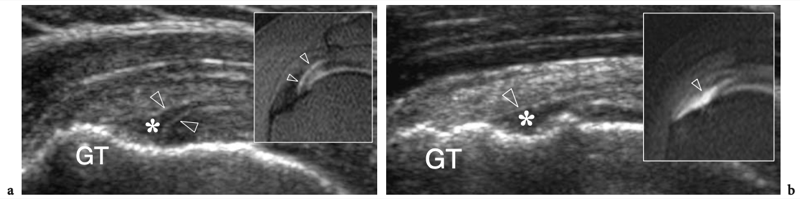
Figure 74a,b. Déchirures d'épaisseur partielle du côté articulaire du tendon sus-épineux. Spectre des apparitions américaines. a,b Les images échographiques 12–5 MHz à axe long sur le tendon du sus-épineux montrent un défaut triangulaire intra-tendineux rempli de liquide (astérisque) avec sa base faisant face à la surface corticale. La séparation du segment distal rétracté du tendon du tissu intact sus-jacent se traduit par de nouvelles interfaces acoustiques (têtes de flèches) au sein de la substance tendineuse. GT, grosse tubérosité. La corrélation d'imagerie arthro-IRM des mêmes cas est fournie dans les inserts en haut à droite des images américaines.
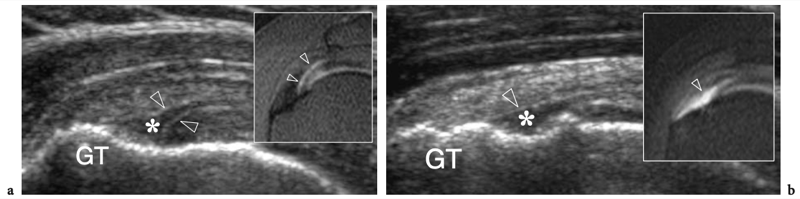
Figure 75a,b. Déchirure intrasubstance d'épaisseur partielle du tendon sus-épineux. a Dessin schématique d'une vue grand axe à travers le tendon sus-épineux et b L'image US 12–5 MHz correspondante affiche une scission longitudinale hypoéchogène (flèche vide) orientée de l'insertion du tendon dans la grande tubérosité (GT) de manière proximale avec l'intégrité de la plus externe fibres bursales (b) et articulaires (a). 1, acromion ; pointe de flèche, bourse sous-deltoïdienne sous-acromiale ; 2, tendon sus-épineux ; flèche blanche, cavité articulaire gléno-humérale ; flèche courbe blanche, cartilage articulaire ; 3, tête humérale.
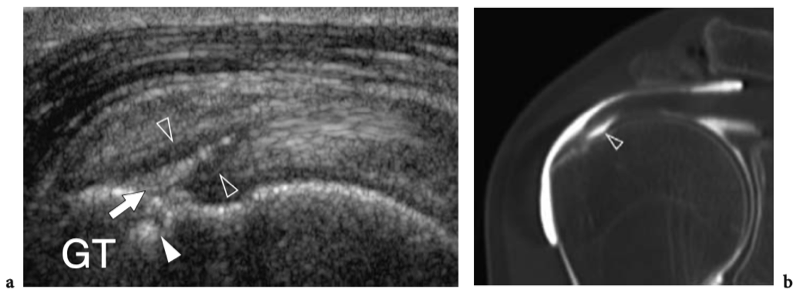
Figure 76a,b. Déchirure de la jante. a Les images américaines à axe long 12–5 MHz du tendon sus-épineux avec corrélation b arthro-CT démontrent un petit défaut triangulaire hypoéchogène (têtes de flèche ouvertes) avec une ligne hyperéchogène centrale (flèche) s'étendant de l'insertion du tendon de manière proximale. Ces déchirures correspondent à un décollement minime des fibres du trochiter (GT) et ne doivent pas être confondues avec des dépôts intratendineux linéaires dans les tendinites calcifiantes. Dans la plupart des cas, elles touchent les fibres articulaires du tendon sus-épineux antérieur et sont associées à des irrégularités (tête de flèche blanche) de l'os sous-jacent.
Dans une série de 52 épaules avec corrélation arthroscopique, l'échographie avait une sensibilité de 93 %, une spécificité de 94 %, une valeur prédictive positive de 82 % et une valeur prédictive négative de 98 % pour la détection des ruptures d'épaisseur partielle de la coiffe des rotateurs (van Holsbeeck et al. 1995). Une autre étude plus récente, réalisée avec un équipement haut de gamme dans laquelle les résultats américains ont été contrôlés par des résultats arthroscopiques, a rapporté une sensibilité de 67 %, une spécificité de 85 %, une valeur prédictive positive de 77 %, une valeur prédictive négative de 77 % et une précision de 77 % dans le diagnostic en tenant compte déchirures d'épaisseur partielle comme vrais positifs et aucune déchirure comme vrais négatifs (Teefey et al. 2000a). Par rapport à l'échographie, l'arthro-IRM a une sensibilité plus élevée pour représenter les petites déchirures d'épaisseur partielle, en particulier celles qui se produisent du côté articulaire de la coiffe (Ferrari et al. 2002).
40. LARMES DE PLEINE ÉPAISSEUR
Les déchirures de pleine épaisseur s'étendent de la bourse à la surface articulaire du tendon. Comme indiqué précédemment, le terme "pleine épaisseur" peut faire référence à une rupture complète (pleine largeur) ou incomplète (largeur partielle) du tendon (c'est-à-dire une déchirure située dans le tiers antérieur du sus-épineux qui permet la communication entre le l'espace articulaire gléno-huméral et la bourse est une déchirure de pleine épaisseur mais pas une déchirure complète car le tiers médian et postérieur du tendon n'est pas affecté). En général, les déchirures de pleine épaisseur ont une plus grande extension que les déchirures partielles et sont donc plus faciles à détecter par échographie. Une classification des déchirures de pleine épaisseur a été proposée dans la littérature radiographique et clinique (Lyons et Tomlinson 1992). Dans les petites déchirures de pleine épaisseur (<5 mm de large) du tendon du sus-épineux, on peut voir une fine fente hypoéchogène reliant la cavité articulaire et la bourse (Fig. 77). L'identification de ces déchirures peut ne pas être facile en raison du manque de rétraction tendineuse (le sus-épineux est maintenu dans la bonne position par ses parties intactes) et de l'absence de modifications des limites inférieures de la graisse deltoïde et sous-deltoïde. Un épaississement focal de la bourse ou une petite quantité de liquide collecté juste au-dessus de la lésion peut augmenter la confiance de l'examinateur dans la présence d'une lésion. À cet égard, certains auteurs ont même proposé de réaliser l'examen échographique après arthrographie pour mieux évaluer les ruptures de la coiffe des rotateurs consécutives à la distension induite de la bourse séreuse (Fermand et al. 2000 ; Lee et al. 2002). Dans le cas contraire, les petites déchirures doivent toujours être confirmées sur les plans grand et petit axe pour éviter toute confusion avec le prolongement distal du tissu musculaire sus-épineux. Dans certains cas, un diagnostic différentiel entre une déchirure d'épaisseur partielle et une petite déchirure d'épaisseur totale ne peut pas être réalisé même avec des transducteurs à haute résolution. Les déchirures de pleine épaisseur plus importantes affectent généralement la partie antérieure du tendon du sus-épineux au niveau de la zone critique (Fig. 78). Lorsque la déchirure est localisée dans cette zone, le sus-épineux postérieur peut apparaître tout à fait normal. Dans ces cas, l'échographie s'est avérée exacte pour prédire la taille de la déchirure. Les scans à axe long peuvent être utilisés pour mesurer la quantité de rétraction de l'extrémité du tendon déchiré à partir du tubercule majeur, tandis qu'une estimation de la largeur de la déchirure peut être obtenue sur les scans à axe court à partir de la distance entre les extrémités du tendon déchiré. (Fig. 79) (Farin et al. 1996b). La précision de ces mesures est moins bonne dans les déchirures de grande taille (Teefey et al. 2005) et peut être quelque peu liée au positionnement de l'épaule (Ferri et al. 2005). Lorsque les scans utilisant les positions de Crass et Middleton ont été comparés aux résultats opératoires, les premiers semblaient refléter plus précisément la taille réelle des déchirures de pleine épaisseur dans le plan de l'axe long, alors que les deux étaient tout aussi précis dans l'évaluation de la taille de la déchirure dans le court -plan de l'axe (Ferri et al. 2005). À l'inverse, la position de Middleton avait tendance à surestimer, dans une certaine mesure, la taille de la déchirure. Il est concevable que les deux positions puissent créer une tension différente à travers une déchirure de la manchette, affectant ainsi sa taille mesurée. En particulier, la composante de rotation interne dans la position de Middleton pourrait contribuer à une tension accrue le long de la longueur du tendon et à la surestimation subséquente de la taille de la déchirure (Ferri et al. 2005).
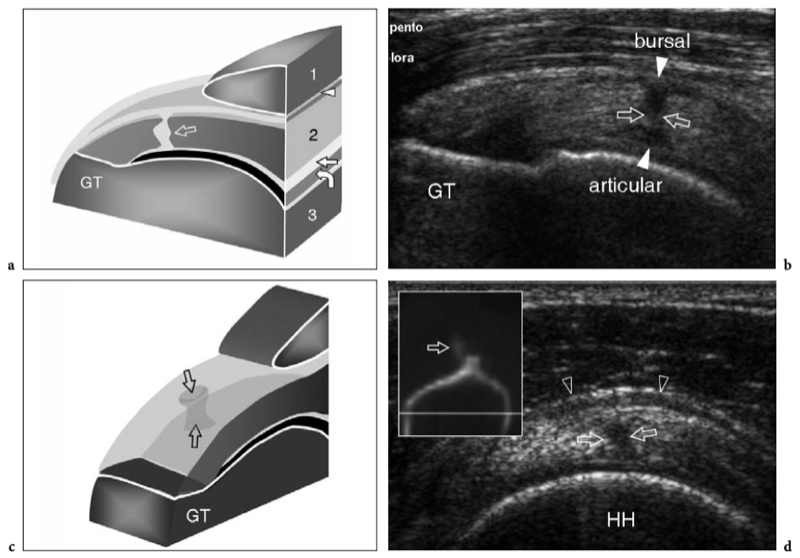
Figures 77a–d. Petite déchirure de pleine épaisseur du tendon sus-épineux (perforation). a,c Les dessins schématiques du tendon du sus-épineux représentés dans ses vues a grand axe et c petit axe avec b,d images échographiques 12–5 MHz correspondantes montrent une fine fente hypoéchogène en forme d'entonnoir (flèches vides) reliant l'articulation glénohumérale profonde cavité avec la bourse superficielle. En d, noter un léger épaississement focal (têtes de flèches ouvertes) des parois de la bourse par rapport à la déchirure. Dans les cas douteux, ce signe peut renforcer la confiance diagnostique de l'examinateur qu'une déchirure est présente dans le tendon sus-épineux. La corrélation d'imagerie arthro-CT du même cas est fournie dans l'insert en d. 1, acromion ; pointe de flèche, bourse sous-deltoïdienne sous-acromiale ; 2, tendon sus-épineux ; GT, grosse tubérosité ; flèche droite, cavité articulaire gléno-humérale ; flèche courbe blanche, cartilage articulaire ; 3 et HH, tête humérale.
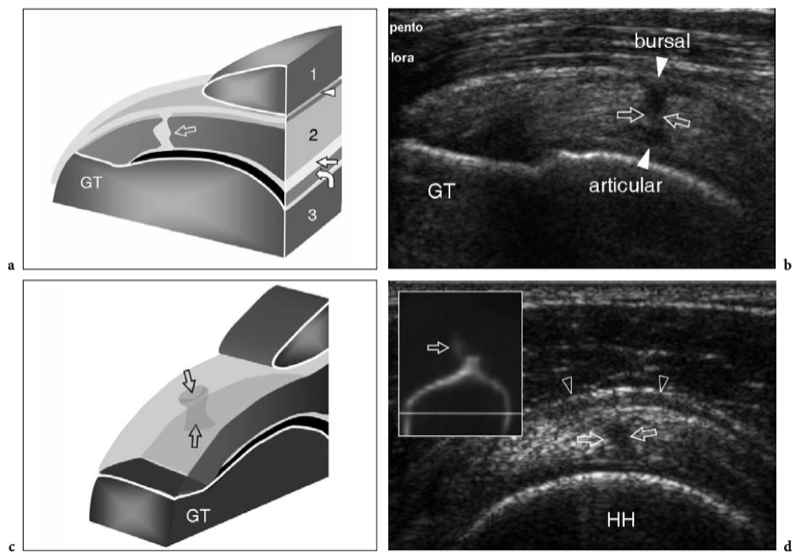
Figure 78a,b. Rupture de pleine épaisseur non rétractée du tendon sus-épineux. a Image échographique 12–5 MHz grand axe sur le tendon postérieur du sus-épineux avec b corrélation d'imagerie IRM pondérée en T2 montrant un défaut linéaire rempli de liquide (tête de flèche) avec une rétraction minimale du tendon proximal (flèche), laissant un petit reste de tendon (astérisque) attaché à l'extrémité distale de la grande tubérosité (GT).
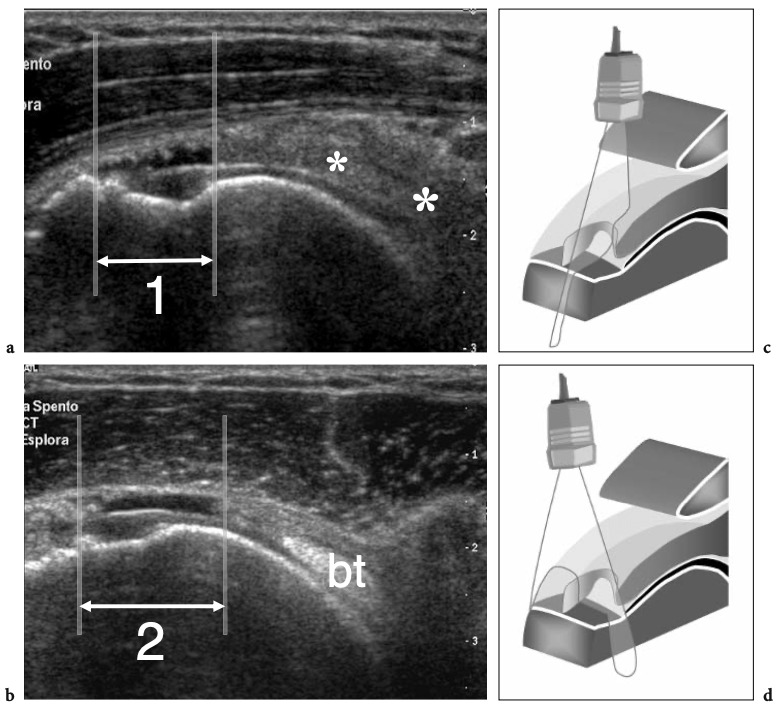
Figures 79a–d. Évaluation de la taille d'une déchirure du tendon sus-épineux. a Des images US grand axe et b petit axe 12–5 MHz d'une déchirure de pleine épaisseur du tendon sus-épineux antérieur (astérisques) avec des corrélations schématiques c,d montrant le positionnement du transducteur démontrent la quantité de rétraction du tendon (1) et la largeur de la déchirure (2) indiquée par la distance (lignes blanches) entre les barres verticales grises. La partie intra-articulaire ovoïde du tendon du biceps (bt) peut aider l'examinateur à établir que la partie affectée du tendon est la partie médio-antérieure.
L'aspect américain des déchirures de pleine épaisseur dépend de la quantité d'épanchement articulaire. Lorsqu'un épanchement important est présent, la déchirure apparaît comme une zone hypoéchogène focale en raison du liquide qui remplit la discontinuité du tendon (Fig. 80, 81). Dans ces cas, une pression graduée avec la sonde peut être utile pour distinguer le liquide hypoéchogène du tendon. Lorsque l'épanchement est petit, il a tendance à s'accumuler dans les parties les plus dépendantes de la bourse et de la cavité articulaire, ne remplissant ainsi pas la déchirure. Dans ces cas, le diagnostic repose sur la non-visualisation focale des fibres tendineuses. En l'absence d'épanchement ou de rétraction tendineuse, l'inclinaison de la sonde et son appui sur le tendon peuvent mettre en évidence le détachement des fibres de leur insertion humérale. Déchirure de pleine épaisseur conduisant à un aspect dénudé du tubercule majeur car l'os n'est plus recouvert par le tendon rétracté (Fig. 80). Chez ces patients, il faut veiller à ne pas confondre le muscle deltoïde avec le sus-épineux. Parmi les signes indirects des déchirures du tendon du sus-épineux, les plus importants sont une hernie focale du muscle deltoïde et de la graisse péribursale dans l'espace créé par la déchirure. (Fig. 82a, b). Ce signe est plus prononcé en pleine épaisseur qu'en demi-épaisseur et s'apprécie encore mieux lorsqu'une pression est exercée avec la sonde. De plus, il peut y avoir une réflexion importante du faisceau US à l'interface du fluide et du cartilage articulaire, un signe communément appelé « signe du cartilage découvert » ou « signe de l'interface du cartilage ». (Fig.82c,d). Bien que ce dernier signe puisse être observé dans les grandes déchirures partielles affectant la surface articulaire du sus-épineux, il est le plus fréquemment rencontré dans les déchirures de pleine épaisseur lorsqu'il y a un liquide anéchoïque recouvrant le cartilage articulaire. Il faut cependant être conscient que ce dernier signe est subjectif et peut également être apprécié dans des états normaux (Jacobson et al. 2004). La survenue d'irrégularités osseuses dans le profil du trochiter majeur est une donnée importante à rechercher en routine car elle n'est pas simplement liée au vieillissement mais aussi significativement associée aux ruptures de la coiffe des rotateurs, en particulier aux ruptures du supra-épineux de pleine épaisseur (Wohlwend et al. 1998 ; Huang et al. 1999 ; Jiang et al. 2002 ; Jacobson et al. 2004). Ce signe s'est avéré très important, car il a la sensibilité la plus élevée et la valeur prédictive négative dans le diagnostic de rupture du tendon sus-épineux (Jacobson et al. 2004). D'autre part, des résultats contradictoires sont rapportés dans la littérature quant à savoir si la découverte aux États-Unis d'un liquide de bourse combiné à un épanchement articulaire peut être considérée comme un signe prédictif spécifique d'une déchirure de la coiffe des rotateurs (Hollister et al. 1995 ; Arslan et al. 1999) . Cela pourrait s'expliquer par le fait que la bourse ou le liquide articulaire est fréquent chez les patients présentant un conflit d'épaule même en l'absence de déchirure de la coiffe des rotateurs (Jacobson et al. 2004).
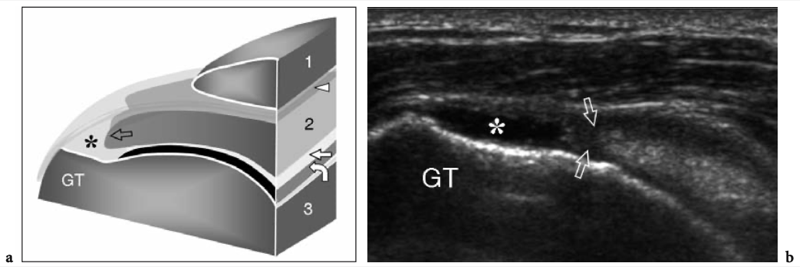
Figure 80a,b. Large déchirure de pleine épaisseur du tendon sus-épineux. a Dessin schématique d'une vue grand axe à travers le tendon sus-épineux et b l'image US 12–5 MHz correspondante montre un grand défaut rempli de liquide (astérisque) dans la région de la déchirure, où le tendon une fois inséré sur la grande tubérosité (GT ). Notez l'aspect nu de la grosse tubérosité et le tissu de la coiffe des rotateurs rétracté (flèche ouverte) qui recouvre la tête humérale. 1, acromion ; pointe de flèche, bourse sous-deltoïdienne sous-acromiale ; 2, tendon sus-épineux ; flèche droite blanche, cavité articulaire gléno-humérale ; flèche courbe blanche, cartilage articulaire ; 3, tête humérale.
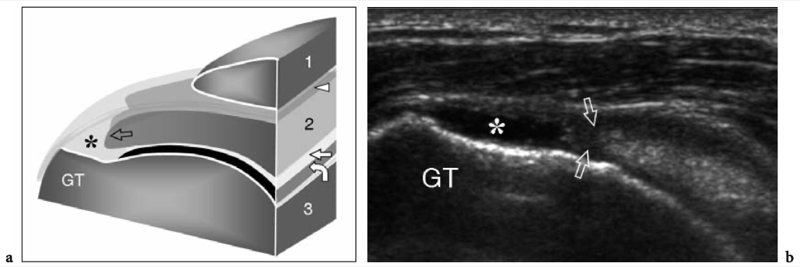
Figure 81a,b. Déchirure de pleine épaisseur du tendon sus-épineux. a Image échographique 12–5 MHz à petit axe sur le tiers médian du tendon sus-épineux avec b corrélation d'imagerie IRM pondérée en T2 montrant une grande déchirure de pleine épaisseur remplie de liquide (flèche). Une légère pression appliquée avec le transducteur sur la déchirure provoque une hernie (têtes de flèches) du tissu hypertrophié de la bourse dans le défaut avec perte de la convexité normale de la coiffe et de la graisse péribursale.
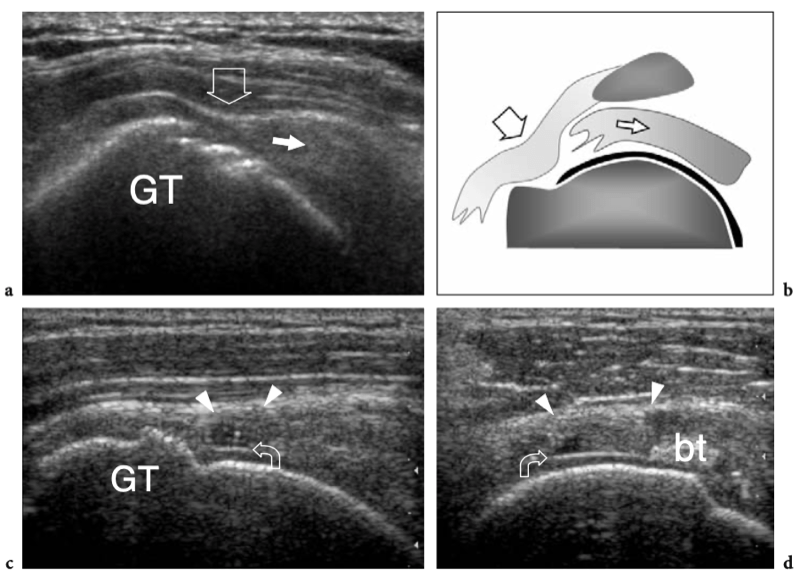
Figures 82a–d. Hernie deltoïde et signe de cartilage découvert. Une image US à axe long 12–5 MHz sur le tendon sus-épineux avec une corrélation de dessin schématique b montre une hernie (grande flèche) du muscle deltoïde et du tissu hypertrophié de la bourse dans l'espace créé par une déchirure de pleine épaisseur. La petite flèche indique la rétraction du tendon. Notez le contour cortical irrégulier de la grosse tubérosité (GT). c Les images échographiques grand axe et d petit axe 12–5 MHz révèlent une petite déchirure de pleine épaisseur du tendon antérieur du sus-épineux. L'interface acoustique entre le fluide dans la déchirure (têtes de flèches) et la surface du cartilage articulaire produit un écho linéaire brillant (flèche courbe) qui peut être considéré comme un signe indirect d'une déchirure de la coiffe des rotateurs. bt, tendon du biceps.
Considérant les déchirures de pleine épaisseur comme de vrais positifs et l'absence de déchirure comme de vrais négatifs, une étude récente réalisée avec un équipement haut de gamme dans laquelle les résultats américains ont été contrôlés par des résultats arthroscopiques a rapporté une sensibilité de 100 %, une spécificité de 85 %, une valeur prédictive positive de 96 %. valeur prédictive négative de 100 % et précision de 96 % dans le diagnostic (Teefey et al. 2000a). En termes de reproductibilité des études, un faible niveau de variabilité inter-observateur a été démontré dans la détection, la caractérisation et la localisation des ruptures de la coiffe des rotateurs aux États-Unis en comparant les résultats de deux observateurs experts en aveugle dans un groupe de 61 patients (Middleton et al. 2004). Dans les quelques cas discordants, le désaccord portait sur la question de savoir s'il s'agissait d'une déchirure pleine ou partielle ou si une déchirure concernait à la fois les tendons sus-épineux et sous-épineux ou l'un ou l'autre de ces tendons (Middleton et al. 2004b). D'autres erreurs de diagnostic se produisent également pour distinguer la tendinopathie des déchirures d'épaisseur partielle (Teefey et al. 2005). Ces données semblent particulièrement importantes étant donné que l'échographie est généralement considérée comme l'une des techniques d'imagerie les plus dépendantes de l'opérateur. En revanche, un mauvais accord est attendu lorsqu'il existe une disparité marquée entre les niveaux d'expérience des opérateurs (O'Connor et al. 2005).
Par rapport à l'IRM, il a été démontré que l'échographie a une précision comparable pour identifier et mesurer la taille des déchirures de la coiffe des rotateurs de pleine épaisseur et d'épaisseur partielle si elle est réalisée par un examinateur expérimenté utilisant un équipement haut de gamme (Jacobson 1999 ; Martin-Hervas et al. 2001 ; Teefey et al. 2004). Lorsque l'examinateur a une expérience comparable avec les deux tests d'imagerie, la décision concernant le test à effectuer pour l'évaluation de la coiffe des rotateurs n'a pas besoin d'être basée sur des préoccupations concernant la précision (Chang et al. 2002 ; Teefey et al. 2004). Au lieu de cela, il peut être basé sur d'autres facteurs, tels que l'importance des informations cliniques auxiliaires (concernant les lésions du bourrelet glénoïdien, de la capsule articulaire ou du muscle ou de l'os environnant), la présence d'un dispositif implanté, la tolérance du patient et le coût (Teefey et al. 2004).
41. LARMES COMPLÈTES ET MASSIVES
Lorsqu'une déchirure de pleine épaisseur s'étend sur toute la largeur du sus-épineux, le tendon se rétracte médialement. La quantité de rétraction du tendon dépend principalement de l'âge de la déchirure. Dans les lésions aiguës, le tendon est moins rétracté et sa pointe peut encore être détectée à l'échographie (Fig. 83a – c). Dans les ruptures chroniques les plus courantes, l'extrémité du tendon disparaît sous l'arc coracoacromial à la suite de processus d'involution de la substance tendineuse et du déplacement vers le haut de la tête humérale. (Fig. 83d, e). Cette condition peut être rapidement reconnue avec les États-Unis. Les principaux résultats échographiques incluent la non visualisation du tendon et une hernie du deltoïde, qui montre une marge inférieure rectiligne ou convexe faisant face à la convexité humérale. Une large zone de la convexité supérieure de la tête humérale apparaît découverte par le sus-épineux, signe dit de la « tête nue ». Le liquide articulaire et bursal est souvent absent (Teefey et al. 2000b). En particulier dans les cas de rétraction légère de l'extrémité déchirée du tendon, les plans à axe court sont essentiels pour distinguer les déchirures complètes (pleine épaisseur, pleine largeur) des déchirures incomplètes (pleine épaisseur, largeur partielle) du tendon sus-épineux. (Fig. 84). Plusieurs écueils possibles peuvent masquer ou simuler une déchirure complète du tendon sus-épineux. Bien que la plupart de ces pièges soient faciles à reconnaître et, par conséquent, peu susceptibles de présenter un problème de diagnostic, d'autres sont potentiellement déroutants. Parmi eux, la couche continue de cartilage huméral hypoéchogène reposant sur une tête humérale nue peut créer une confusion avec un tendon intact (Illustration 85a). De même, des dépôts calcifiants massifs dans le tendon sus-épineux liés à une tendinite calcifiante ne doivent pas être confondus avec une tête humérale nue. (Fig.85b) (Middleton et al. 1986a). La familiarité avec ces résultats d'imagerie, associée à la connaissance de l'anatomie américaine normale de la coiffe des rotateurs, peut faciliter la reconnaissance de la véritable maladie et aider à éviter les erreurs de diagnostic.
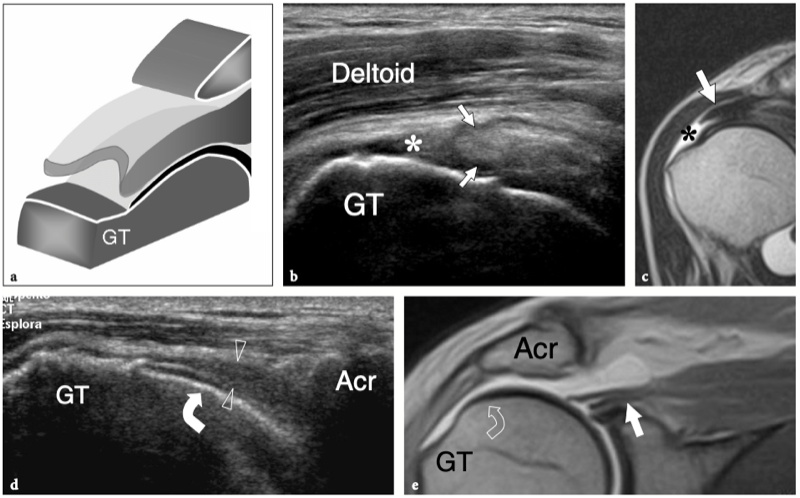
Figures 83a–e. Déchirures complètes (pleine épaisseur, pleine largeur) du tendon sus-épineux chez deux patients différents avec une rupture a–c aiguë récente et d,e chronique de longue date. a Dessin schématique d'une vue grand axe à travers le tendon du sus-épineux avec une image échographique b 12–5 MHz correspondante et une corrélation d'imagerie IRM coronale oblique pondérée en T2 ne montre qu'une légère rétraction de l'extrémité déchirée du tendon (flèches) à partir de la grosse tubérosité ( GT). Comme indiqué précédemment, la déchirure est considérée comme un défaut rempli de liquide (astérisque) recouvrant la grosse tubérosité. d L'image échographique 12–5 MHz à axe long avec e corrélation d'imagerie IRM pondérée en T2 ne montre aucune coiffe des rotateurs recouvrant la grande tubérosité (GT) et la tête humérale (flèche courbée) lorsque l'extrémité du tendon du sus-épineux (flèche droite) est rétractée sous le acromion (Acr). Un peu de tissu hypoéchogène (têtes de flèches) reste dans l'espace entre la graisse péribursale et le cartilage de la tête humérale, reflétant le tissu synovial enflammé épaissi de la bourse sous-deltoïdienne sous-acromiale.
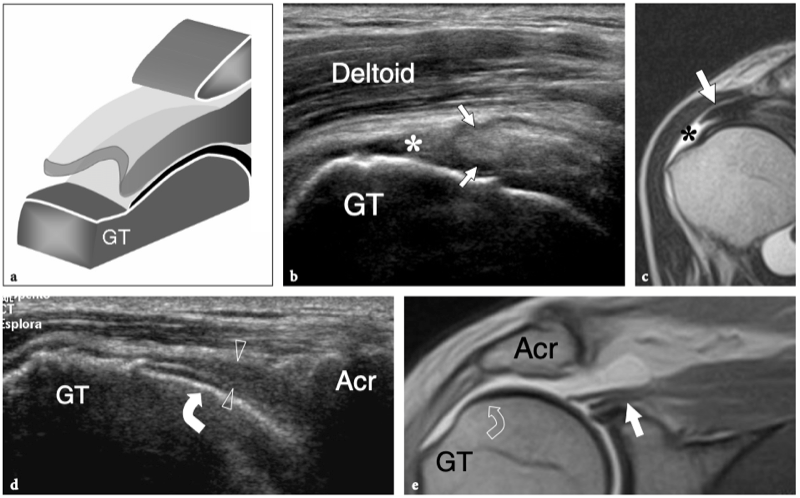
Figure 84a,b. Déchirure complète (pleine épaisseur, pleine largeur) du tendon sus-épineux. a Image échographique transversale 12–5 MHz sur la face crânienne de la tête humérale (HH) avec b corrélation d'imagerie IRM pondérée en T2 montrant un large défaut (flèches) du tissu de la coiffe immédiatement postérieur à la partie intra-articulaire du tendon du biceps (bt) à la limite supérieure du tendon infraspinatus (IS), reflétant une déchirure rétractée complète du tendon sus-épineux.
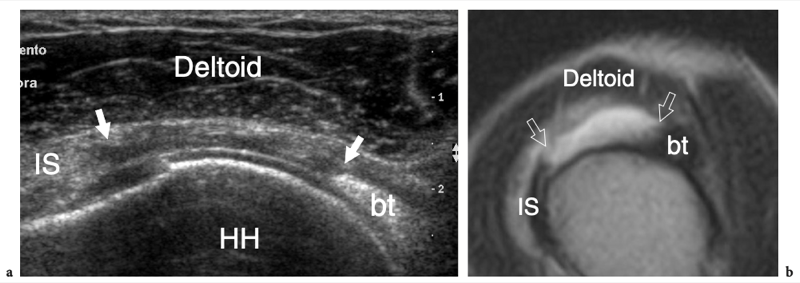
Figure 84a,b. Déchirure complète (pleine épaisseur, pleine largeur) du tendon sus-épineux. a Image échographique transversale 12–5 MHz sur la face crânienne de la tête humérale (HH) avec b corrélation d'imagerie IRM pondérée en T2 montrant un large défaut (flèches) du tissu de la coiffe immédiatement postérieur à la partie intra-articulaire du tendon du biceps (bt) à la limite supérieure du tendon infraspinatus (IS), reflétant une déchirure rétractée complète du tendon sus-épineux.
Après avoir évalué une rupture complète du tendon sus-épineux, l'attention doit toujours être portée sur les tendons infraspinatus et sous-scapulaire pour détecter une éventuelle extension postérieure ou antérieure de la lésion conduisant à une rupture massive de la coiffe des rotateurs. Il n'est pas rare de voir une déchirure complète du sus-épineux s'étendre dans la direction postérieure pour impliquer le tendon sous-épineux. Les découvertes américaines de déchirures de pleine épaisseur de l'infraspinatus sont souvent similaires à celles déjà décrites pour le supraspinatus (Fig. 86). Le balayage dynamique pendant la rotation interne et externe du bras peut être utile pour montrer le tendon de l'infraspinatus déchiré détaché de son insertion sur la tête humérale. Dans ces cas, des modifications atrophiques du muscle sous-épineux et une légère hypertrophie du muscle petit rond peuvent être appréciées sur les coupes sagittales postérieures. (Fig. 87). L'examinateur doit cependant être conscient que l'atrophie du muscle sous-épineux peut également survenir avec un tendon intact à la suite d'une inutilisation chez les patients présentant des déchirures du tendon de la coiffe antérieure de pleine épaisseur ou une neuropathie suprascapulaire (Yao et Mehta 2002). Par conséquent, cette constatation n'implique pas que le tendon sous-épineux est rompu.
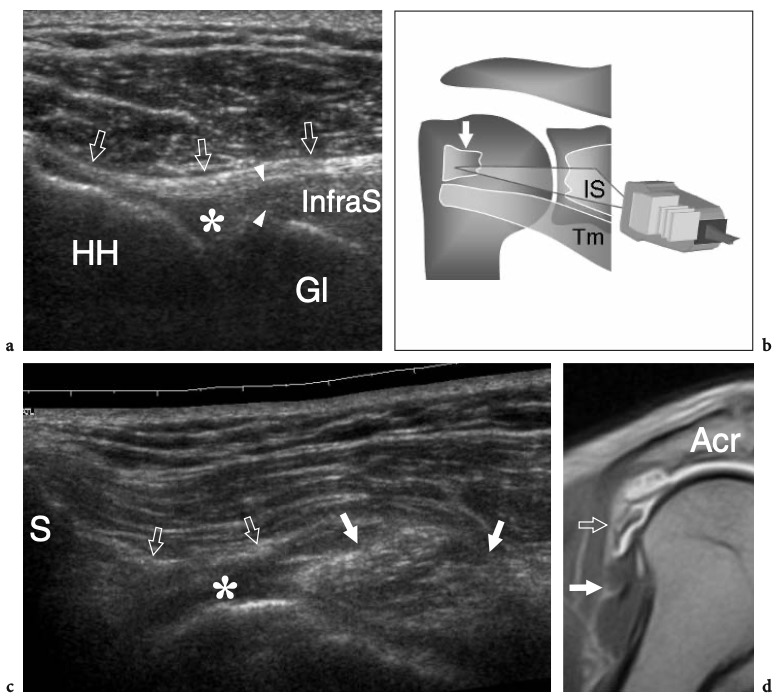
Figures 86a–d. Déchirure complète (pleine épaisseur, pleine largeur) du tendon sous-épineux. une image US transversale 12–5 MHz sur la face postérieure de l'articulation gléno-humérale montre une déchirure de la coiffe des rotateurs remplie de liquide (astérisque) produisant une hernie (flèches vides) du muscle deltoïde et de la graisse péribursale au site de la déchirure. Notez l'aspect nu de la tête humérale (HH) et l'extrémité rétractée (têtes de flèches) du tendon infraspinatus (InfraS) sur la glène osseuse (Gl). b Le dessin schématique correspondant montre le positionnement du transducteur sur l'axe longitudinal du tendon rompu de l'infraspinatus (IS). Tm, teres minor. c Image échographique sagittale à champ de vision étendu de 12 à 5 MHz sur la face postérieure de l'articulation gléno-humérale avec une corrélation d'imagerie IRM pondérée en T2 révélant un fluide (astérisque) remplissant la déchirure du tendon sous-épineux et le muscle deltoïde au-dessus (flèches ouvertes) tombant dans le défaut tendineux. A un niveau plus caudal, notez l'aspect ovoïde du muscle petit rond intact (flèches blanches). S, épine scapulaire ; Acr, acromion.
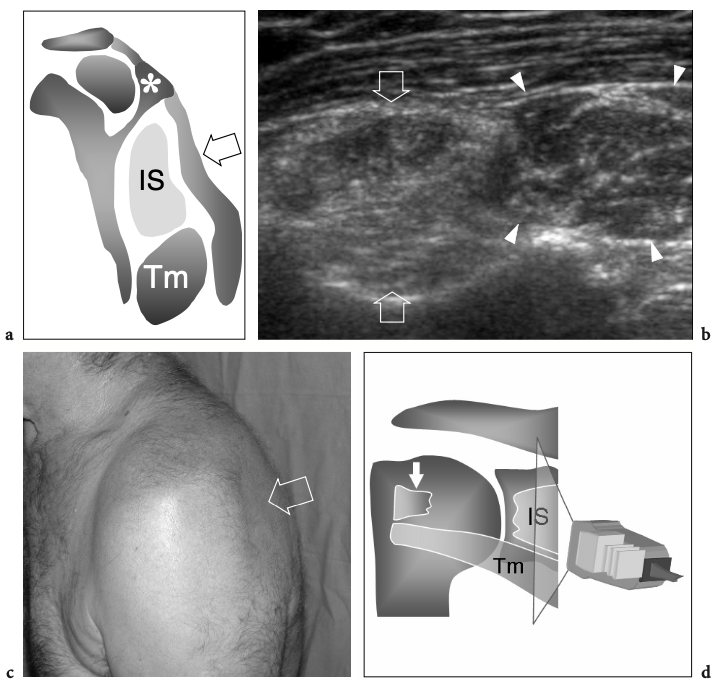
Figures 87a–d. Déchirure complète (pleine épaisseur, pleine largeur) du tendon sous-épineux. a Le dessin schématique d'une vue sagittale à travers la face postérieure de l'épaule illustre les relations entre l'épine scapulaire (astérisque), l'infraspinatus (IS), le petit rond (Tm) et les muscles deltoïdes (flèche). Après rupture tendineuse, le muscle sous-épineux présente une perte de volume et une échotexture hyperéchogène traduisant des modifications atrophiques graisseuses. Dans les cas avancés, le muscle deltoïde peut hernier dans le défaut. b Une image échographique sagittale 12–5 MHz sur la base postérieure de la glène montre l'aspect en coupe des muscles infraspinatus (flèches) et teres minor (têtes de flèches) chez un patient présentant une déchirure de l'infraspinatus. Le ventre musculaire de l'infraspinatus déchiré apparaît légèrement réduit en volume et hyperéchogène par rapport au teres minor normal adjacent. Suite à la rupture de l'infraspinatus, le teres minor adjacent tend à subir une légère hypertrophie. c La photographie montre une fonte musculaire dans la fosse postérieure (flèche) résultant d'une déchirure du tendon sous-épineux. d Le dessin schématique correspondant montre le positionnement du transducteur sur l'axe court du tendon rompu (flèche blanche) de l'infraépineux (IS) et du petit rond intact (Tm).
En raison de la structure intrinsèque entrelacée des tendons supraspinatus et infraspinatus, certaines déchirures de pleine épaisseur du supraspinatus peuvent progresser au bord postérieur du défaut le long d'un plan de clivage horizontal provoquant un schéma complexe de délaminage (Illustration 88a). Ces déchirures horizontales sont probablement liées aux forces de cisaillement générées par le défaut du tendon sus-épineux. Ils consistent en une fissuration parallèle au plan de la face articulaire du tendon et se présentent comme des défauts hypoéchogènes linéaires dans l'épaisseur moyenne du tendon. La détection des déchirures horizontales a une pertinence clinique car elle modifie l'approche chirurgicale. Contrairement à l'arthro-CT ou à l'arthro-IRM, l'échographie ne révèle pas facilement ces déchirures. Les changements sont généralement subtils et l'expérience est nécessaire pour reconnaître correctement cette entité. Lorsqu'elles sont visibles, les déchirures horizontales apparaissent sous forme de défauts hypoéchogènes linéaires focaux au milieu du tendon (Fig. 89). Dans de rares cas, l'insinuation de liquide dans la déchirure peut générer des kystes intramusculaires qui apparaissent comme des masses hypoanéchogènes bien définies à l'intérieur du ventre du muscle sus-épineux ou sous-épineux. (Fig.88b). Les déchirures du tendon du petit rond sont extrêmement rares et résultent généralement d'un traumatisme aigu de l'épaule plutôt que de la progression caudale d'une déchirure de l'infraspinatus.
Figure 88a,b. Décollement des déchirures de la coiffe des rotateurs. un dessin schématique illustre une déchirure de pleine épaisseur du tendon sus-épineux s'étendant vers l'arrière dans un plan de clivage longitudinal rempli de liquide (flèches). b Le dessin schématique montre le mécanisme selon lequel un défaut dans un tendon de la coiffe des rotateurs peut permettre au liquide de l'articulation gléno-humérale et de la bourse associée de pénétrer dans la substance du tendon, puis de disséquer le long des fibres tendineuses et des plans intramusculaires pour former un kyste (astérisque) au sein du muscle. GT, grosse tubérosité ; Gl, glène.
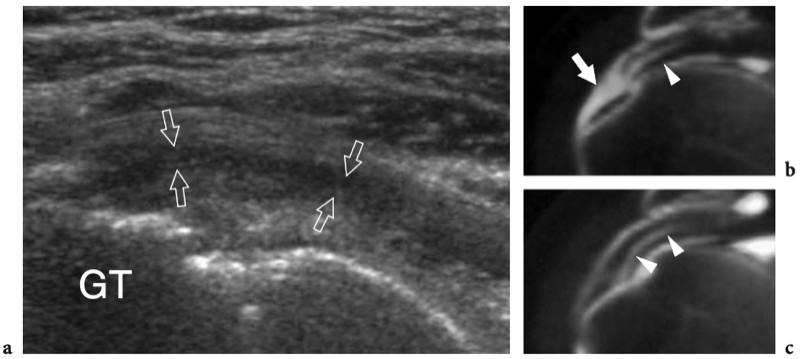
Figures 89a–c. Décollement des déchirures de la coiffe des rotateurs. a Image échographique grand axe 12–5 MHz sur le tendon sous-épineux chez un patient présentant une déchirure de pleine épaisseur du sus-épineux postérieur. Une fente hypoéchogène longitudinale (flèches) dans l'épaisseur moyenne du tendon infraspinatus est observée reflétant la délamination des fibres s'étendant en arrière jusqu'à une déchirure du tendon supraspinatus. GT, grosse tubérosité. b,c Les images arthro-scanner coronales obliques obtenues sur b le milieu et c le tiers postérieur du tendon sus-épineux montrent un plan de clivage horizontal intra-tendineux (têtes de flèches) en continuité avec la déchirure de pleine épaisseur (flèche) du sus-épineux.
Alors que les déchirures du tendon infraspinatus sont presque invariablement associées à la rupture du supraspinatus, les ruptures du subscapularis peuvent également être rencontrées comme un problème isolé. Les déchirures du tendon sous-scapulaire sont principalement liées à des lésions traumatiques aiguës produites avec le bras en abduction et en rotation externe. Comme pour les autres tendons de la coiffe des rotateurs, les déchirures complètes du sous-scapulaire se révèlent par l'absence de fibres tendineuses et la concavité du deltoïde sur la face antérieure nue de la tête humérale. Les déchirures incomplètes du tendon sous-scapulaire impliquent souvent le crâne et préservent la partie caudale du tendon (Fig. 90). Ce motif ne doit pas être confondu avec des déchirures complètes. A cet effet, la morphologie du trochiter vu sur les plans sagittaux peut aider à établir la limite caudale du tendon et éviter toute confusion entre ruptures tendineuses incomplètes et complètes. (Fig. 91). De plus, en raison de l'insertion particulière du sous-scapulaire sur le trochiter et des relations de ce tendon avec le long chef du tendon du biceps, les déchirures du sous-scapulaire provoquent généralement une instabilité secondaire du tendon du biceps. Une explication plus détaillée du mécanisme d'atteinte du tendon du biceps sera donnée ultérieurement.
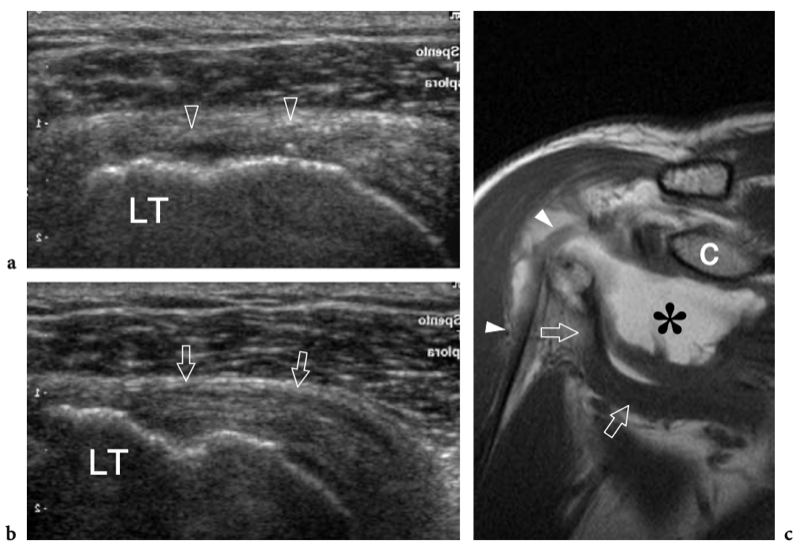
Figures 90a–c. Déchirure incomplète (pleine épaisseur, largeur partielle) du tendon du sous-scapulaire. a,b Images échographiques transversales 12–5 MHz obtenues sur la face antérieure de la tête humérale (a niveau supérieur ; b niveau inférieur) avec une corrélation d'imagerie IRM coronale pondérée en T2 c révélant une déchirure de pleine épaisseur de la partie supérieure du sous-scapulaire tendon. Au niveau crânien, aucun tissu appréciable de la coiffe n'est visible. Notez l'aspect nu de la petite tubérosité (LT). Une fine couche de tissus mous (pointes de flèche vides) se trouve entre la tête humérale et le deltoïde : cela représente un tissu bursal épaissi et ne doit pas être confondu avec des restes de manchette. En déplaçant légèrement le transducteur vers le bas, certaines fibres intactes (flèches) de la partie inférieure du sous-scapulaire sont démontrées. Le tendon résiduel a une épaisseur normale et une insertion dans le tubercule mineur. Cette constatation indique une déchirure de pleine épaisseur du sous-scapulaire impliquant la moitié crânienne du tendon. Sur l'image IRM, notez le liquide hyperintense (astérisque) remplissant le large espace laissé par les fibres tendineuses déchirées et le tiers inférieur intact du tendon (flèches). C, coracoïde. Pointes de flèches blanches, long chef du tendon du biceps.
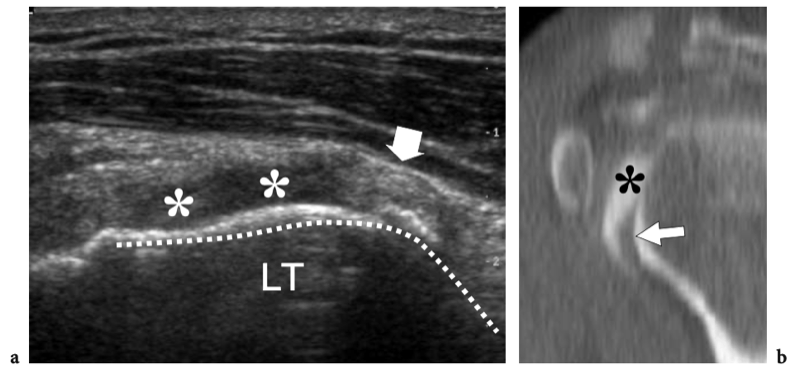
Figures 91a,b. Déchirure incomplète (pleine épaisseur, largeur partielle) du tendon du sous-scapulaire. a Image échographique sagittale 12–5 MHz obtenue sur le petit axe du tendon sous-scapulaire avec b corrélation sagittale arthro-scanner montre une déchirure de pleine épaisseur des deux tiers supérieurs du tendon sous-scapulaire. Notez l'aspect plat (ligne pointillée) de la petite tubérosité (LT), qui se courbe vers la profondeur juste caudale à l'insertion du tendon. Cela peut être un repère utile pour établir la limite caudale du tendon. Dans ce cas particulier, une large fente remplie de liquide (astérisques) occupe les deux tiers supérieurs de l'insertion sous-scapulaire. A noter quelques fibres échogènes (flèche) du tendon sous-scapulaire qui restent insérées sur la face la plus basse du tubercule mineur.
Une fois qu'une évaluation complète des tendons de la coiffe des rotateurs a été effectuée, que la taille et l'emplacement de la déchirure ont été déterminés et que le degré de rétraction du tendon déchiré a été évalué, l'état des muscles de la coiffe des rotateurs doit également être évalué pour exclure une possibilité hypotrophie et dégénérescence graisseuse (Sofka et al. 2004a). En fait, la littérature orthopédique a confirmé que la reconnaissance de l'atrophie musculaire peut contribuer à un choix plus précis du traitement chirurgical ou conservateur pour les patients présentant une rupture de la coiffe des rotateurs, et peut être utile pour prouver qu'une lésion post-traumatique n'est pas vraie mais liée à un état dégénératif préexistant. De plus, la présence d'une atrophie musculaire suite à une réparation chirurgicale d'une coiffe déchirée peut indiquer que l'absence de récupération fonctionnelle est due à l'état des muscles et n'est pas liée à une intervention chirurgicale infructueuse.
42. ARTHROPATHIE PAR DÉCHIRURE DE LA COIFFE
Dans les ruptures massives de la coiffe des rotateurs, la rétraction médiale des tendons amincis déchirés et la contraction du muscle deltoïde provoquent un déplacement vers le haut de la tête humérale entraînant un conflit accru entre la face supérieure de la grosse tubérosité et la face inférieure de l'acromion. (Illustration 93a). Les traumatismes locaux chroniques entraînent des modifications osseuses dégénératives telles que la sclérose, les kystes sous-chondraux, l'éperon et l'amincissement de l'acromion et les irrégularités corticales. Dans la maladie ancienne, les modifications sous-acromiales sont suivies d'une atteinte directe de l'espace gléno-huméral liée à l'incongruité entre les surfaces articulaires. La condition qui en résulte est appelée arthrose excentrique (en raison du déplacement vers le haut de la tête humérale) ou « arthropathie à déchirure de la coiffe » (Neer et al. 1983b). Cet état peut être considéré comme une arthropathie destructrice irréversible terminale consistant en un espace sous-acromial réduit ou absent, un amincissement et une perte du cartilage articulaire du tiers inférieur de la tête humérale et de la face supérieure de la cavité glénoïdienne, des ostéophytes inférieurs de l'humérus tête, un tubercule majeur arrondi et irrégulier dû à l'abrasion lors de l'abduction du bras avec aplatissement du sillon bicipital et une épaisseur réduite de l'acromion. Dans les maladies chroniques de longue date, la survenue d'une fracture de fatigue de l'acromion peut survenir à la suite d'un traumatisme local induit par la tête humérale (Hall et Calvert 1995). Il a été suggéré que l'arthropathie de la coiffe des rotateurs peut provenir à la fois de facteurs mécaniques et d'une nutrition réduite du cartilage en raison de l'augmentation du volume de la cavité articulaire et de la diminution subséquente de la pression intra-articulaire (Neer et al. 1983b).
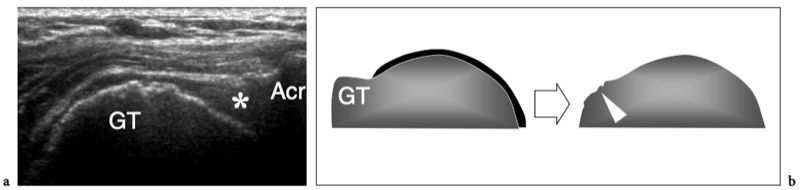
Figure 93a,b. Arthropathie de la coiffe des rotateurs. une image échographique coronale oblique 12–5 MHz sur la grande tubérosité (GT) chez un patient présentant une large déchirure rétractée de la coiffe des rotateurs démontre l'absence du tendon du sus-épineux. Du tissu de bourse hypoéchogène (astérisque) est visible dans l'espace de la déchirure. Notez les changements atrophiques dans le tubercule majeur, qui a un contour cortical irrégulier et un contour plus arrondi. Acr, acromion. b Dessin schématique montrant les changements survenant dans le trochiter (GT) dans le cadre d'une rupture avancée de la coiffe. Il existe une abrasion du cartilage articulaire recouvrant la tête humérale contre l'arc coraco-acromial et une érosion de la face supérieure du tubercule majeur (tête de flèche) conduisant à un contour osseux plus convexe.
Le diagnostic d'arthropathie de la coiffe des rotateurs repose essentiellement sur son aspect radiographique. Nous pensons que les radiographies standard sont obligatoires avant une étude américaine car l'examen d'un patient atteint d'arthropathie de la coiffe des rotateurs avec US comme premier examen peut être un défi, en particulier pour les débutants. Les principales constatations échographiques incluent une déchirure massive de deux ou plusieurs tendons de la coiffe des rotateurs associée à un espace sous-acromial nettement réduit ou absent, une perte du cartilage articulaire, une grosse tubérosité arrondie et irrégulière due à l'abrasion lors de l'abduction du bras avec aplatissement du muscle bicipital. sulcus, une épaisseur réduite de l'acromion et des ostéophytes marginaux sur la tête humérale inférieure (Fig. 93, 94). Les épanchements articulaires et bursaux peuvent contenir des débris échogènes. Le contact étroit de la tête humérale avec la face inférieure de l'acromion peut rendre la différenciation entre ces structures moins immédiate avec l'échographie. La meilleure façon de séparer ces structures est d'effectuer un balayage dynamique sur des plans coronaux (un peu orientés le long de l'axe longitudinal du sus-épineux) au-dessus de la pointe de l'acromion tout en abductant le bras du patient en rotation interne. Cette manœuvre peut aider à distinguer la tête humérale mobile de l'acromion stationnaire et à apprécier la distance réduite qui les sépare. Un problème supplémentaire peut être lié à la localisation du sillon bicipital qui est, au moins en partie, effacé par les abrasions de la grosse tubérosité. Cela peut entraîner des problèmes techniques, même pour l'examinateur expérimenté, car le sulcus est un repère principal pour l'évaluation de la coiffe des rotateurs. Dans le cas d'un tendon sous-scapulaire intact, son identification peut être utile pour localiser la position du sillon aplati. Une épaisseur réduite de l'acromion peut également être observée. Ces patients ont une migration proximale de la tête humérale telle qu'elle entre en contact avec la face inférieure de l'acromion. Ce point de contact fonctionne comme un point d'appui, permettant une élévation quasi normale de l'épaule avec contraction du deltoïde, malgré l'absence de la coiffe des rotateurs.
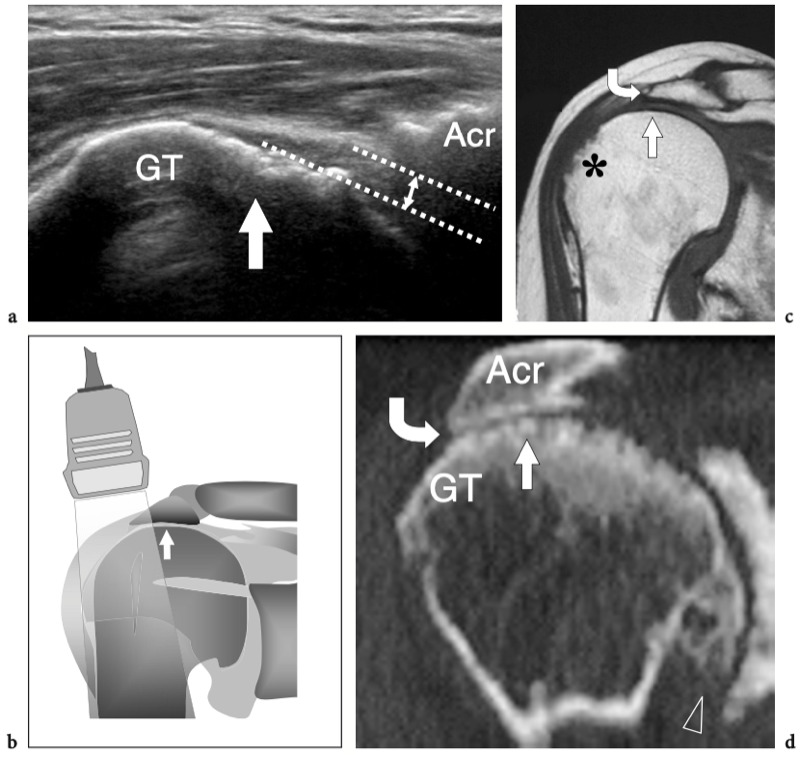
Figures 94a–d. Arthropathie de la coiffe des rotateurs. a Une image échographique coronale oblique à 12–5 MHz sur la grande tubérosité (GT) et la tête humérale avec une corrélation schématique b chez un patient présentant une déchirure rétractée de la coiffe des rotateurs de longue date démontre une diminution de la distance (lignes pointillées) entre l'acromion (Acr) et l'humérus tête résultant du déplacement vers le haut (flèche) de l'humérus. c L'IRM coronale oblique pondérée en T1 et la corrélation d CT révèlent des abrasions (astérisque) dans le tubercule majeur, un éperon et un amincissement de la face inférieure de l'acromion antérieur et un espace sous-acromial presque absent (flèche courbe) secondaire à la subluxation supérieure (flèche droite ) de la tête humérale. En d, des signes d'arthrite dégénérative de l'articulation gléno-humérale sont également visibles avec des ostéophytes (tête de flèche) à la jonction de la tête et du cou huméraux.
43. KYSTES ACROMIOCLAVICULAIRES
Les kystes acromioclaviculaires apparaissent comme des masses indolores bien délimitées recouvrant l'articulation acromioclaviculaire (Cvitanic et al. 1999). L'examen physique révèle généralement une masse élastique indolore légèrement sensible. Les kystes acromio-claviculaires peuvent être associés à plusieurs arthropathies affectant l'articulation acromio-claviculaire (Cooper et al. 1993 ; De Sanctis et al. 2001 ; O'Connor et al. 2003) ou, plus fréquemment, peuvent se développer chez des patients présentant un rotateur massif de longue date. déchirures de la coiffe (Cvitanic et al. 1999; Mellado et al. 2002; Steiner et al. 1996). La pathogenèse des kystes acromio-claviculaires est encore débattue. Le frottement chronique de la tête humérale contre la surface inférieure de l'articulation acromio-claviculaire en raison d'une déchirure de pleine épaisseur du tendon sus-épineux a été suggéré comme cause de dommages progressifs à la capsule inférieure et de communication entre l'articulation gléno-humérale et acromio-claviculaire dégénérée (Craig 1986) . Ensuite, le kyste dans les tissus mous à la face supérieure de l'épaule se développe à partir du passage progressif du liquide articulaire gléno-huméral à travers l'articulation acromio-claviculaire. (Fig. 95).
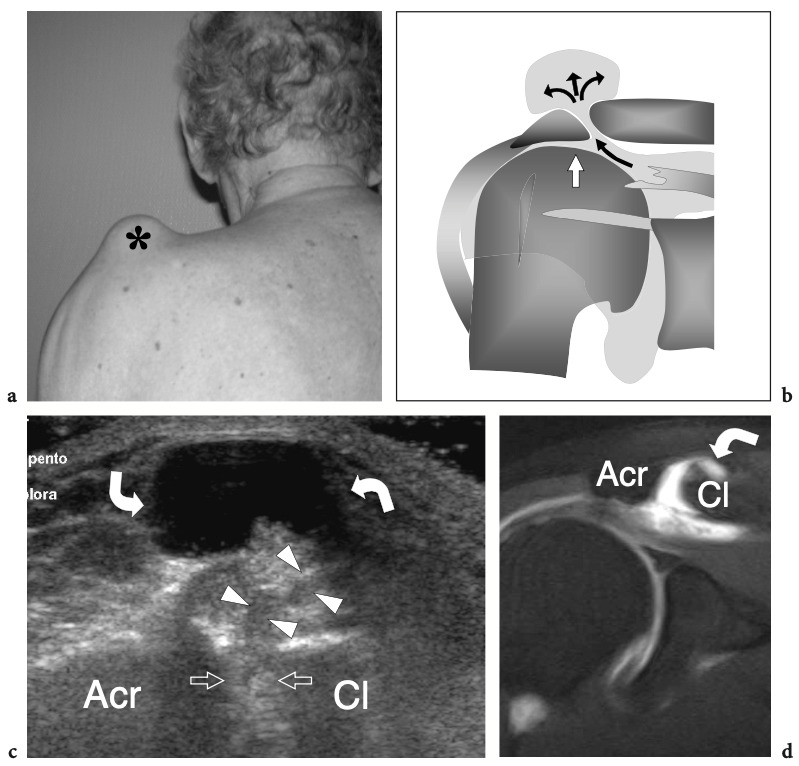
Fig. 95a–d. Kyste acromio-claviculaire. une photographie de l'épaule gauche montre une grosseur proéminente des tissus mous (astérisque) sur la face crânienne de l'articulation acromio-claviculaire reflétant un kyste. b Le dessin schématique montre le mécanisme de formation du kyste acromioclaviculaire. Par une déchirure pleine épaisseur du tendon sus-épineux, le fluide (flèches noires) s'échappe de l'articulation gléno-humérale dans la bourse sous-deltoïdienne sous-acromiale puis dans la capsule inférieure rompue de l'articulation acromio-claviculaire, acquise à la suite d'une attrition de la tête humérale subluxée (flèche blanche) contre sa face inférieure. Ensuite, le kyste se dilate progressivement dans les tissus mous recouvrant l'articulation acromio-claviculaire. c Image échographique coronale 12–5 MHz sur l'articulation acromio-claviculaire avec d la corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse révèle une masse remplie de liquide (flèches courbes) située à la surface de l'articulation acromio-claviculaire (flèches droites), une apparence ressemblant étroitement à celle de kystes méniscals. Notez la communication tortueuse (têtes de flèches) reliant le kyste à l'articulation sous-jacente. Sur l'IRM, une colonne continue de liquide hyperintense s'étend de l'articulation gléno-humérale, à travers la capsule articulaire acromio-claviculaire inférieure déchirée et le ligament dans l'articulation acromio-claviculaire. Acr, acromion ; Cl, clavicule.
Cette théorie mécanique n'explique cependant pas certaines découvertes pathologiques souvent associées à ces kystes, comme leur contenu mucoïde et leur paroi fibreuse. De plus, à l'instar des ganglions, l'extension intramusculaire de ces kystes à l'intérieur du trapèze a également été rapportée (Montet et al. 2004). Sur la base de ces résultats, l'instabilité chronique de l'articulation acromio-claviculaire pourrait également être supposée jouer un rôle causal dans le développement du kyste. Cette observation est étayée par le fait que les patients présentant des ruptures massives de la coiffe des rotateurs présentent souvent un élargissement de l'espace articulaire acromio-claviculaire à l'arthrographie et une échographie dynamique lors des mouvements du bras. Bien que nous ne puissions que spéculer à ce sujet, des ruptures massives de la coiffe des rotateurs pourraient générer des kystes acromio-claviculaires par la séquence d'événements suivante : déplacement vers le haut de la tête humérale, déchirure de la capsule inférieure de l'articulation acromio-claviculaire due à un microtraumatisme chronique contre la grosse tubérosité, acromio-clavicule instabilité, déchirure du disque articulaire ou de la capsule supérieure liée aux efforts chroniques de compression et de traction exercés sur les structures articulaires et, enfin, formation du kyste (Montet et al. 2004). Selon cette théorie, les kystes acromio-claviculaires seraient quelque peu similaires aux kystes méniscals. Aux États-Unis, les kystes acromio-claviculaires peuvent présenter des parois épaissies et des cloisons internes qui peuvent partiellement remplir la lésion. Dans certains cas, les kystes acromio-claviculaires sont associés à une maladie des dépôts de pyrophosphate de calcium déshydraté ou à une hypertrophie synoviale conduisant à un aspect échogène de la masse (Tshering Vogel et al. 2005). Ces constatations peuvent évoquer une tumeur solide plutôt qu'une lésion kystique et il faut se garder de proposer une biopsie pour une lésion aussi bénigne. (Fig. 96).
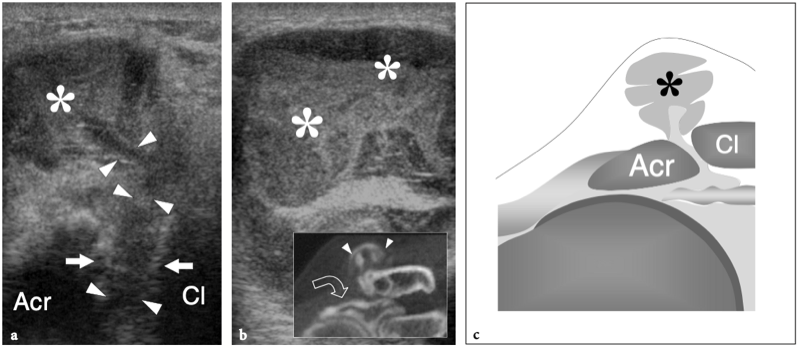
Figures 96a–c. Kyste acromio-claviculaire. a Images échographiques coronales et b sagittales 10-5 MHz sur l'articulation acromio-claviculaire avec corrélation schématique c obtenue chez un patient âgé atteint de chondrocalcinose présentant une masse indolore des tissus mous sur la face crânienne de l'épaule. Une grande masse pseudotumorale (astérisques) caractérisée par une échotexture solide prédominante et une communication en entonnoir (têtes de flèches) avec l'articulation acromioclaviculaire sous-jacente (flèches droites) est observée. Dans l'insert en b, l'image arthro-scanner corrélative montre un passage direct du produit de contraste de l'articulation gléno-humérale (flèche courbe) vers le kyste (têtes de flèches). L'aspiration guidée par échographie a révélé une synoviale enflammée, un dépôt de fibrine et des cristaux de CPPD. Acr, acromion ; Cl, clavicule.
Dans de rares cas, l'échographie peut démontrer la communication de l'espace articulaire acromio-claviculaire avec le kyste et, en exerçant une pression avec la sonde sur le kyste, des débris peuvent être vus se déplaçant d'avant en arrière à travers l'articulation acromio-claviculaire (Craig 1984), le soi-disant "Geyser pancarte". Le traitement des kystes acromio-claviculaires dépend de l'âge et des exigences fonctionnelles du patient. Chez la personne âgée ou lorsque le handicap est négligeable, le traitement conservateur est le plus approprié. Un traitement chirurgical peut être proposé chez des patients actifs plus jeunes et doit également être orienté vers le trouble sous-jacent. L'excision combinée du kyste et de la réparation de la coiffe des rotateurs est le traitement de choix pour les patients présentant une déficience fonctionnelle, car une simple aspiration ou résection du kyste est presque invariablement suivie d'une récidive si la coiffe des rotateurs elle-même n'est pas traitée (Groh et al. 1993). Dans les cas compliqués d'arthrose dégénérative de l'articulation gléno-humérale, une arthroplastie d'épaule peut prévenir les récidives (Groh et al. 1993).
44. BRASSARD POSTOPÉRATOIRE
Dans les premiers stades, le syndrome de conflit est traité de manière conservatrice avec une restriction des activités, une thérapie physique, des médicaments anti-inflammatoires et, éventuellement, des injections de stéroïdes dans la bourse sous-acromiale sous-deltoïdienne (Bokor et al. 1993). En cas d'échec du traitement conservateur, la chirurgie est indiquée. Une connaissance de base du type d'intervention chirurgicale effectuée et de son étendue est essentielle pour que l'examinateur parvienne à une interprétation correcte des images américaines. Avant l'examen, les détails de l'intervention chirurgicale doivent toujours être recueillis à partir des rapports chirurgicaux ou des dossiers du patient. D'une manière générale, les principales techniques chirurgicales pour le syndrome de conflit et la maladie de la coiffe des rotateurs impliquent la décompression sous-acromiale et la réparation ou le débridement de la coiffe des rotateurs. Chez les patients présentant un conflit sous-acromial mais sans déchirure de la coiffe des rotateurs, la décompression sous-acromiale peut être réalisée soit par une procédure ouverte par une incision de séparation antérolatérale du deltoïde, soit par arthroscopie (Fig. 97a, b). L'approche ouverte consiste en l'excision de la face antéro-inférieure de l'acromion, y compris l'extrémité distale de la clavicule, et la résection ou le débridement d'une partie du ligament coracoacromial (Fig.97c,d).
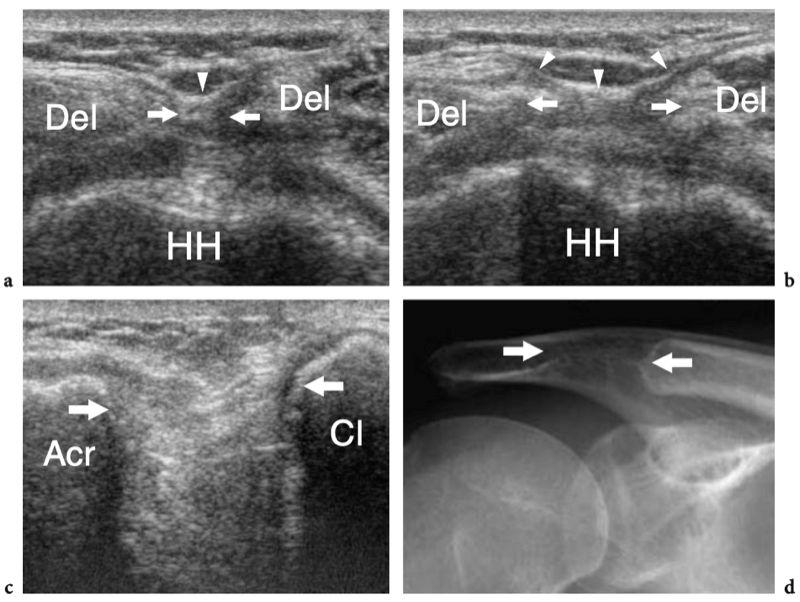
Fig. 97a–d. Coiffe postopératoire : résultats US normaux. a,b Scission antérolatérale du deltoïde après acromioplastie ouverte. Images échographiques post-chirurgicales coronales 10–5 MHz obtenues latéralement à l'acromion tout en gardant le bras a en abduction et b en position neutre. La déchirure deltoïde (Del) produit un défaut focal (flèches) dans le muscle convexe normal et provoque une hernie (têtes de flèches) de la graisse sous-cutanée à l'intérieur de la déchirure. Notez que l'espace dans le muscle s'agrandit avec le bras en position neutre. HH, tête humérale. c,d Décompression sous-acromiale incluant résection distale de la clavicule (procédure de Mumford). c L'image coronale 10-5 MHz post-chirurgicale sur l'articulation acromio-claviculaire avec corrélation radiographique d démontre une distance accrue (flèches) entre l'acromion (Acr) et la clavicule (Cl).
Si des ostéophytes proéminents sont présents, l'articulation acromio-claviculaire et les 2.5 cm distaux de la clavicule peuvent être retirés. D'autre part, la décompression sous-acromiale arthroscopique est réalisée en réséquant le bord antérieur et la face inférieure de l'acromion ainsi que la bourse sous-acromiale sous-deltoïdienne et la graisse sous-deltoïdienne. Le ligament coracoacromial est libéré et la clavicule distale est également réséquée. Des approches combinées ouvertes et arthroscopiques peuvent être utilisées en cas de ruptures profondes de la coiffe des rotateurs. Bien que l'arthroscopie ne nécessite pas d'incision du deltoïde (conduisant à une faiblesse secondaire du muscle), cette technique est plus souvent associée à une persistance ou à une récidive de la douleur (échec de la procédure rapporté jusqu'à 3 à 11 % des cas), en raison d'une excision insuffisante. de l'acromion. D'autres complications comprennent la progression de la tendinose de la coiffe des rotateurs, des déchirures résiduelles ou récurrentes de la coiffe des rotateurs et des adhérences postopératoires. Chez les patients présentant une rupture de la coiffe des rotateurs, le type d'intervention dépend principalement de la localisation, de l'épaisseur et de la gravité de la rupture. Dans les petites déchirures d'épaisseur partielle, le traitement va du débridement du tissu tendineux effiloché à une excision combinée du défaut et à la réparation des marges saines adjacentes de la coiffe. Dans les déchirures de pleine épaisseur, la réparation peut être effectuée soit par une suture côte à côte (petites déchirures) soit par un rattachement tendon-os (grosses déchirures), tous deux associés à une acromioplastie. Habituellement, ces interventions sont réalisées sous arthroscopie à l'aide de trois portes bursales (antérieure, latérale et postérieure) ou avec une mini réparation à ciel ouvert (le moins possible de scission dans le deltoïde, préservant l'origine acromiale du muscle). Dans les grandes déchirures de pleine épaisseur, une réparation tendon-os est généralement effectuée, refixant le tendon à un site plus proximal (col huméral) par rapport à la grande tubérosité (supraspinatus) ou à la petite tubérosité (sous-scapulaire). (Fig. 98, 99). Des sutures non résorbables ou des ancres métalliques (réparations arthroscopiques) sont utilisées pour cette procédure. Les déchirures massives sont, pour la plupart, traitées par débridement seul.
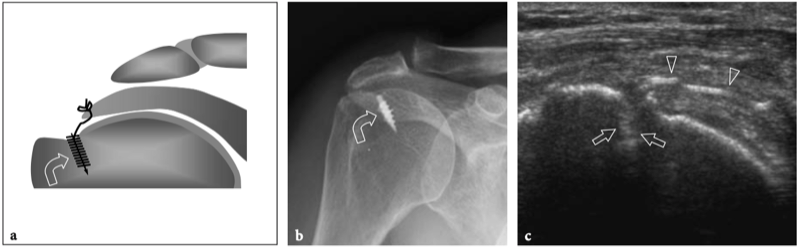
Figures 98a–c. Coiffe postopératoire : résultats US normaux. un dessin schématique illustre la modalité de rattachement du tendon sus-épineux au trochiter à l'aide d'un ancrage de suture (flèche courbe) après une déchirure de la coiffe de pleine épaisseur. b La radiographie de face de l'épaule montre l'ancre métallique (flèche courbe) fixée au niveau du col huméral. c L'image échographique 12–5 MHz grand axe sur le tendon sus-épineux révèle des sutures intra-tendineuses (têtes de flèches) et le trou percé (flèches) dans l'os contenant l'ancre à laquelle elles sont connectées. L'échographie montre une réparation tendineuse intacte.
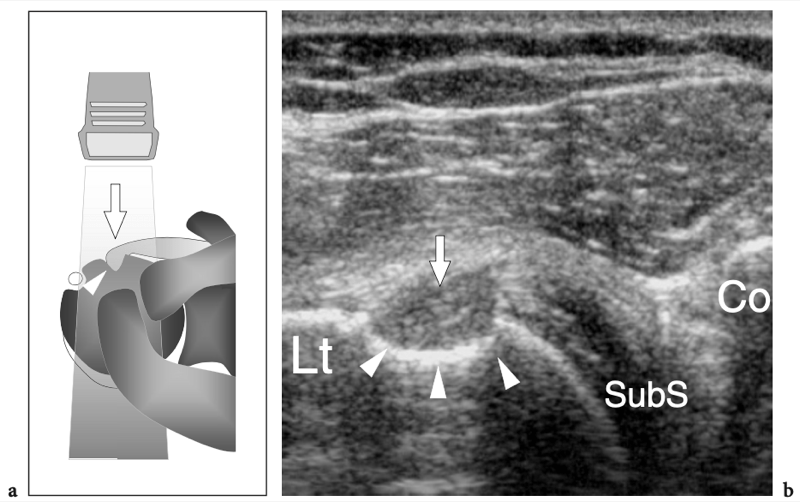
Figure 99a,b. Coiffe postopératoire : résultats US normaux. a Dessin schématique d'une vue crânienne à travers l'épaule avec b image US transversale post-chirurgicale correspondante de 12 à 5 MHz sur la face antérieure de la tête humérale chez un patient présentant une déchirure de pleine épaisseur du tendon sous-scapulaire (SubS). Observez l'encoche peu profonde (pointes de flèche) percée sur la face antéro-médiale de la tête humérale pour le rattachement du tendon à l'os. Il se situe à un site plus proximal par rapport à la petite tubérosité (Lt). Un tendon intact est inséré dans l'encoche. Co, coracoïde.
Le rôle diagnostique de l'IRM d'une épaule ayant subi un traitement chirurgical est controversé en raison des sutures, des ancres de suture et des changements osseux qui peuvent modifier les intensités des signaux dans l'acromion, la tête humérale et le tissu de la coiffe des rotateurs (Magee et al. 1997). L'échographie a l'avantage de ne pas être affectée par la présence de matériel intra-osseux. Néanmoins, l'échographie postopératoire de l'épaule peut être un défi, surtout si les détails opératoires ne sont pas disponibles. À l'examen échographique, un sus-épineux réparé apparaît généralement beaucoup plus hétérogène que la normale. Les limites superficielles du tendon peuvent prendre un profil légèrement concave lorsque le sus-épineux est cicatrisé et réduit en volume. De plus, la surface de la bourse du tendon est souvent indéfinie à la suite de l'ablation de la bourse. Le matériau de suture intratendineux non résorbable et les ancres de suture peuvent être perçus comme des échos linéaires brillants avec un léger artefact de réverbération (Fig. 98c, 100a). L'examinateur doit être conscient que le tendon déchiré rétracté est souvent implanté dans le col huméral plutôt que dans la grosse tubérosité. Par conséquent, certains os nus dans la région du trochiter ne doivent pas nécessairement être considérés comme une déchirure récurrente. Les signes échographiques les plus fiables d'un sus-épineux re-déchiré sont : la non-visualisation de la coiffe en raison d'une avulsion et d'une rétraction complètes du tendon sous l'acromion, la présence d'un défaut focal dans la coiffe des rotateurs, un degré variable de rétraction du tendon de la cuvette chirurgicale et la détection de sutures flottant librement dans le fluide (Fig.100b) (Crass et al. 1986 ; Hall 1986 ; Mack et al. 1988b ; Prickett et al. 2003). Dans les cas difficiles, le balayage dynamique peut être utile pour distinguer l'atteinte liée à une déchirure récidivante de la capsulite rétractile ainsi que pour apprécier le résultat fonctionnel de l'acromioplastie. Dans l'ensemble, la précision diagnostique de l'échographie pour la détection des déchirures postopératoires de la coiffe des rotateurs est similaire à celle de l'imagerie des épaules non opérées (Mack et al. 1988 ; Furtschegger et Resch, 1988 ; Prickett et al. 2003). La série la plus récente basée sur un équipement plus récent, les critères américains actuels pour les déchirures et la validation chirurgicale complète des résultats a rapporté une sensibilité de 91 %, une spécificité de 86 % et une précision de 89 % pour l'identification par échographie de l'intégrité de la coiffe des rotateurs après l'opération (Prickett et al. 2003).
Figure 100a,b. Coiffe postopératoire : rupture du tendon sus-épineux. a,b Image échographique grand axe 12–5 MHz du tendon sus-épineux obtenue a 1 mois et b 6 mois après la chirurgie, après récidive de douleur à l'épaule. En a, un sus-épineux recollé intact avec du matériel de suture intra-tendineux (têtes de flèches) est visible. A noter un peu d'os nu (flèche courbe) dans la région du trochiter : cela n'indique pas une déchirure car le tendon a été recollé à un niveau plus proximal. Il y a une mauvaise délimitation (flèches) entre le tendon sus-épineux et le muscle deltoïde sus-jacent en raison de la perte de graisse sous-deltoïdienne. HH, tête humérale. En b, une déchirure récurrente de pleine épaisseur du sus-épineux est appréciée comme un défaut de la coiffe avec une suture (tête de flèche) reposant librement sur la tête humérale. Le bord rétracté (flèches) du tendon de retour est visible en proximal.
45. TENDINITE CALCIFIANTE
Les calcifications de la coiffe des rotateurs sont une constatation courante (survenant chez jusqu'à 3 % des adultes avec une prévalence chez les femmes de la quatrième à la sixième décennie de la vie) lors de l'examen de l'épaule par échographie. D'une manière générale, la tendinite calcifiante correspond à un dépôt de calcium, principalement d'hydroxyapatite, dans les tendons de la coiffe des rotateurs : le tendon le plus fréquemment atteint est le sus-épineux (80 %), suivi de l'infraspinatus (15 %) et du subscapularis (5 %). Cependant, des dépôts peuvent également être trouvés à des endroits inattendus autour de l'épaule, tels que le petit rond, le grand pectoral et la jonction myotendineuse du long chef du tendon du biceps (Goldman, 1989 ; Cahir et Saiffuddin, 2005). Au niveau de la coiffe, le tiers inférieur du tendon sous-épineux, la zone critique du sus-épineux et les fibres préinsertionnelles du sous-scapulaire sont les sites les plus fréquemment atteints. Bien que la pathogenèse de la tendinite calcifiante ne soit pas complètement comprise, cette condition semble être liée à des zones hypoxiques ou à des facteurs métaboliques dans les tendons et est généralement associée à une coiffe des rotateurs intacte. On pense que l'hypoxie locale conduit à une métaplasie fibrocartilagineuse qui produit à son tour des calcifications (Flemming et al. 2003). Quatre stades de la maladie peuvent être reconnus : précalcifiant, calcifiant, résorbant et postcalcifiant (Uhthoff et Sarkar 1989). Dans la phase de résorption, le tendon développe une vascularisation accrue et les dépôts de calcium sont éliminés par les phagocytes. Il existe une corrélation significative entre les crises de douleur aiguë et les signes histologiques de résorption du calcium. Au moment du diagnostic, les patients peuvent être asymptomatiques ou présenter des douleurs aiguës ou chroniques. Les symptômes typiques incluent soit une douleur subaiguë de bas grade à l'épaule augmentant la nuit (phase formative), soit une douleur aiguë aiguë limitant les mouvements de l'épaule et rarement accompagnée de fièvre due à la rupture de la calcification dans les structures adjacentes (phase de résorption). Le diagnostic de tendinite calcifiante repose sur des radiographies simples (vues de face en rotation interne, neutre et externe, vue exutoire) qui permettent d'apprécier avec précision la taille et la localisation des calcifications. Les radiographies peuvent également détecter des dépôts calcifiants à l'intérieur de la bourse et l'apparition d'érosions focales sur la tête humérale. Les calcifications asymptomatiques de la coiffe des rotateurs ne nécessitent pas de traitement. Dans les cas symptomatiques, la tendinite calcifiante peut être gérée de manière conservatrice avec une thérapie physique et une courte cure d'anti-inflammatoires non stéroïdiens. Les complications sont mieux traitées avec une thérapie plus agressive comprenant des stéroïdes systémiques.
À l'échographie, les calcifications de la coiffe des rotateurs apparaissent comme des foyers hyperéchogènes intratendineux. Trois principaux types de dépôts de calcium peuvent être identifiés avec les États-Unis en fonction de la quantité de calcium contenue dans le dépôt. Les calcifications de type I apparaissent comme des foyers hyperéchogènes avec une ombre acoustique bien définie, semblable aux calculs biliaires (Illustration 101a). Ces calcifications correspondent à la phase formative du dépôt de calcium et représentent environ 80 % des cas. Les calcifications de type II et de type III (calcifications « slurry ») ressemblent à des foyers hyperéchogènes avec une ombre faible (type II) ou absente (type III) et peuvent être référées à la phase de résorption, dans laquelle les dépôts sont presque liquides et peuvent être traités avec succès. aspiré (Fig.101b,c). Chez les patients symptomatiques, ces dépôts sont plus souvent associés à une hyperémie locale au Doppler couleur (Chiou et al. 2002). Souvent, les dépôts semi-liquides sont difficiles à diagnostiquer car ils apparaissent presque isoéchogènes avec le tendon (Fig.101d). Une zone ovale de perte fibrillaire et de petits points hyperéchogènes dans le tendon atteint est le principal critère de détection. La forme de la calcification est assez variable, allant de morceaux de calcium bien définis à de minces brins hyperéchogènes dans le brassard (Fig. 102).
Fig. 101a–d. Tendinite calcifiante : types de calcifications. a La calcification de type I apparaît comme un foyer hyperéchogène intratendineux (flèches) avec un ombrage acoustique postérieur bien défini (têtes de flèches). Cette apparence est en corrélation avec la phase formative du dépôt de calcium. b La calcification de type II se présente sous la forme d'un foyer hyperéchogène (flèches) avec de faibles ombres (têtes de flèches). c,d Les calcifications de type III peuvent apparaître soit comme un foyer hyperéchogène ca (flèches) sans ombre, soit comme une structure isoéchogène indéfinie ou légèrement hyperéchogène (flèches) avec des échos internes mobiles, reflétant un contenu semi-liquide. Les calcifications de type II et de type III correspondent plus probablement à la phase de résorption de la tendinite calcifiante.
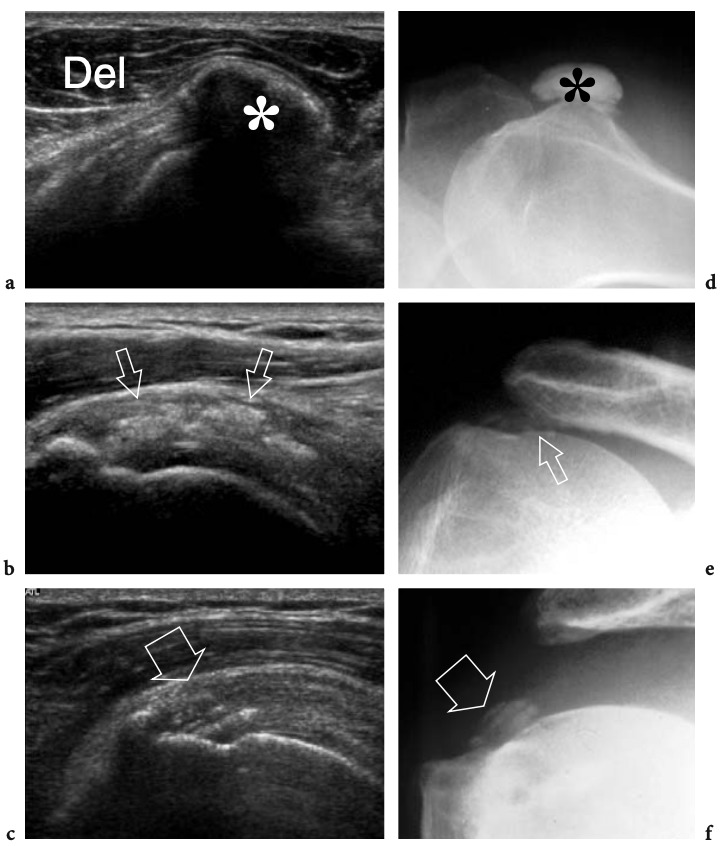
Fig. 102a–f. Tendinite calcifiante : formes de calcification. a–c Des séries d'images échographiques 12–5 MHz avec des radiographies correspondantes d–f démontrent la gamme d'apparences des calcifications intratendineuses chez les patients atteints de tendinite calcifiante. a,d Calcification ovoïde volumineuse (astérisque) dans le tendon sous-scapulaire. En raison de sa grande taille, ce dépôt empiète sur la surface profonde du muscle deltoïde. b,e Calcifications diffuses du lisier (flèches) dans le tendon sus-épineux. c–f Dépôts en forme de bandes préinsertionnelles (grande flèche) dans le tendon sus-épineux.
Ces dépôts en forme de bandes sont généralement situés au niveau préinsertionnel (enthésopathie calcifiante) et ne doivent pas être confondus avec des déchirures d'épaisseur partielle intratendineuses, telles que des déchirures du bord. Bien que les radiographies standard permettent d'établir le tendon dans lequel se trouve le dépôt calcifiant, l'examen échographique est précieux pour déterminer quelle partie du tendon est affectée, la distance de la calcification par rapport à un repère arthroscopique tel que le tendon du biceps (particulièrement utile lorsque le dépôt ne pas renflé sur la surface du tendon) et, surtout, si la calcification provoque un conflit (Fig. 102a,d, 103). L'examen dynamique peut révéler le coincement de la calcification contre l'acromion lors de l'abduction du bras en rotation interne. Dans le cas de dépôts semi-liquides, la compression locale et l'inclinaison de la sonde sur le foyer calcifiant peuvent induire des mouvements du calcium liquide.
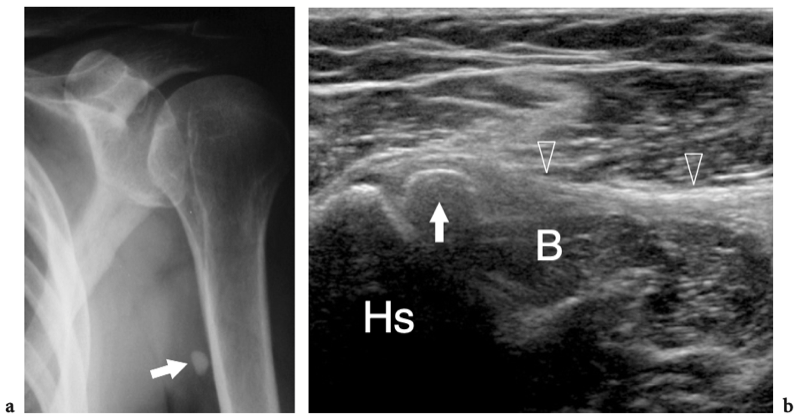
Figure 103a,b. Tendinite calcifiante du tendon du grand pectoral. une radiographie antéropostérieure montre une calcification juxtacorticale (flèche) adjacente à la corticale de la diaphyse humérale proximale antérieure. b L'image US transversale 12–5 MHz correspondante au-dessus de la jonction myotendineuse de la longue portion du biceps (B) montre un dépôt de type I bien défini (flèche) dans le tendon distal du grand pectoral (têtes de flèche). Hs, diaphyse humérale.
Les calcifications de types II et III peuvent apparaître initialement sur un site et migrer ensuite vers un autre site. Dans de tels cas, l'échographie peut identifier l'extrusion sous-bursale et intrabursale de la calcification, lorsque le dépôt sort du tendon et glisse entre celui-ci et la bourse ou pénètre dans la bourse sous-acromiale sous-deltoïde elle-même, provoquant une bursite microcristalline aiguë. Ces conditions douloureuses peuvent être diagnostiquées de manière fiable avec les États-Unis. Lors de la migration sous-boursière, le dépôt calcifiant se déplace entre la bourse sous-deltoïdienne sous-acromiale et le tendon dont il dérive. Ces dépôts sont généralement isoéchogènes ou légèrement échogènes par rapport au tendon, déplacent une bourse affaissée et sont associés à des modifications oedémateuses des espaces graisseux environnants. (Fig. 104). En cas de pénétration intrabursale de la calcification, la bourse sous-acromiale sous-deltoïdienne présente des parois épaissies et apparaît complètement remplie de liquide hyperéchogène contenant du calcium et des débris. Dans certains cas, un niveau liquide-calcique dans la poche dépendante de la bourse peut être observé : la couche supérieure hypoéchogène du niveau est liée au liquide synovial réactif tandis que le niveau inférieur est dû à la sédimentation de la matière calcique. (Fig. 105a – c). Bien que subtils, ces résultats peuvent expliquer l'exacerbation sévère de la douleur qui accompagne généralement l'extrusion de calcium. Une déchirure du tendon d'épaisseur partielle côté bourse a été rapportée après extrusion de calcium dans la bourse sous-acromiale (Fig.105d) (Gotoh et al.2003).
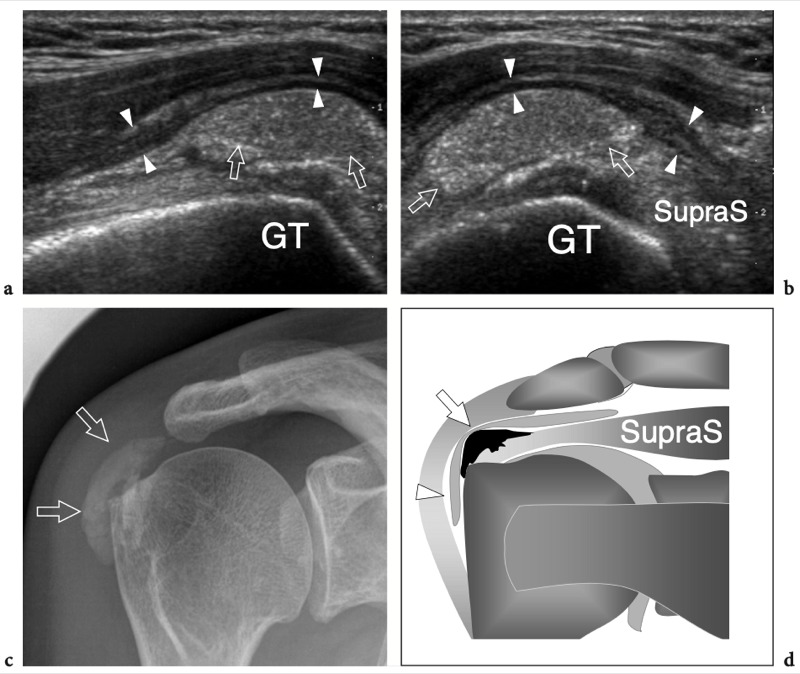
Figures 104a–d. Migration sous-boursière des tendinites calcifiantes. a Les images américaines longitudinales et b transversales 12–5 MHz sur la pente latérale de la grosse tubérosité (GT) révèlent un important dépôt semi-liquide de type III (flèches) caractérisé par un motif homogène d'échos de niveau moyen. On voit le dépôt calcifiant déplacer une bourse effondrée (têtes de flèches) contre le deltoïde. c La radiographie de face montre la calcification (flèches) dans toute son étendue mais ne permet pas d'apprécier sa localisation, qu'elle soit intratendineuse ou sous-boursière ou intrabursale. d La corrélation schématique illustre les relations de la calcification sous-bursale (flèche) avec le tendon sus-épineux (SupraS) et la bourse sous-deltoïdienne sous-acromiale (tête de flèche).
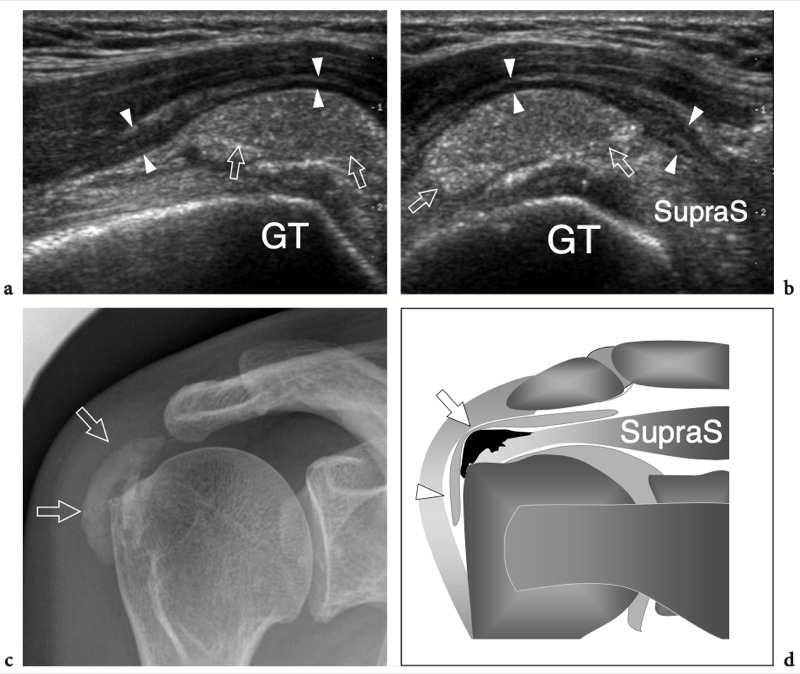
Fig. 105a–d. Migration intrabursale des tendinites calcifiantes. une image coronale 12–5 MHz US sur la face latérale de la diaphyse humérale proximale avec une corrélation de dessin schématique b révèle une poche distale distendue de la bourse sous-deltoïdienne sous-acromiale (flèches) contenant des niveaux de liquide (têtes de flèches) d'échogénicité différente en raison de la superposition de la calcification Matériel. c La radiographie de face obtenue en rotation interne du bras confirme la présence de matériel calcifiant intrabursal sous la forme d'une zone radiodense en forme de larme (têtes de flèches) sous le tubercule majeur. d L'image américaine 12–5 MHz à axe long sur le tendon sus-épineux identifie une déchirure d'épaisseur partielle côté bourse (flèches) s'étendant jusqu'à la bourse sous-deltoïdienne sous-acromiale (têtes de flèches) reflétant le site à partir duquel le calcium a germé dans la bourse. D'autres calcifications (astérisques) subsistent dans le tendon sus-épineux. GT, grosse tubérosité ; Acr, acromion.
La localisation intra-osseuse de la calcification peut se produire dans les tubérosités suite à la migration du dépôt intra-tendineux dans l'os (Chan et al. 2004). Le mécanisme pathogénique n'est pas complètement élucidé : il semble être quelque peu médié par une inflammation aiguë et une vascularisation locale à l'insertion du tendon ou par des effets mécaniques de traction musculaire provoquant une destruction osseuse (Durr et al. 1997). De la fièvre, une augmentation du nombre de globules blancs et une sensibilité locale sont souvent associées. Le diagnostic échographique de la localisation intra-osseuse des tendinites calcifiantes est difficile. Une érosion osseuse focale en continuité avec une calcification tendineuse et partiellement comblée par des points hyperéchogènes doit faire suspecter la lésion si le patient se plaint de douleurs intenses sans lésion particulière (Fig. 106). Ce résultat doit être confirmé par d'autres modalités d'imagerie, notamment la radiographie, la scintigraphie, la tomodensitométrie ou l'imagerie par résonance magnétique : la détection d'une zone lytique intraosseuse avec un foyer ou une faible calcification, une calcification mal définie dans le tendon sus-jacent et une réaction périostée est diagnostique (Fig. 106, 107).
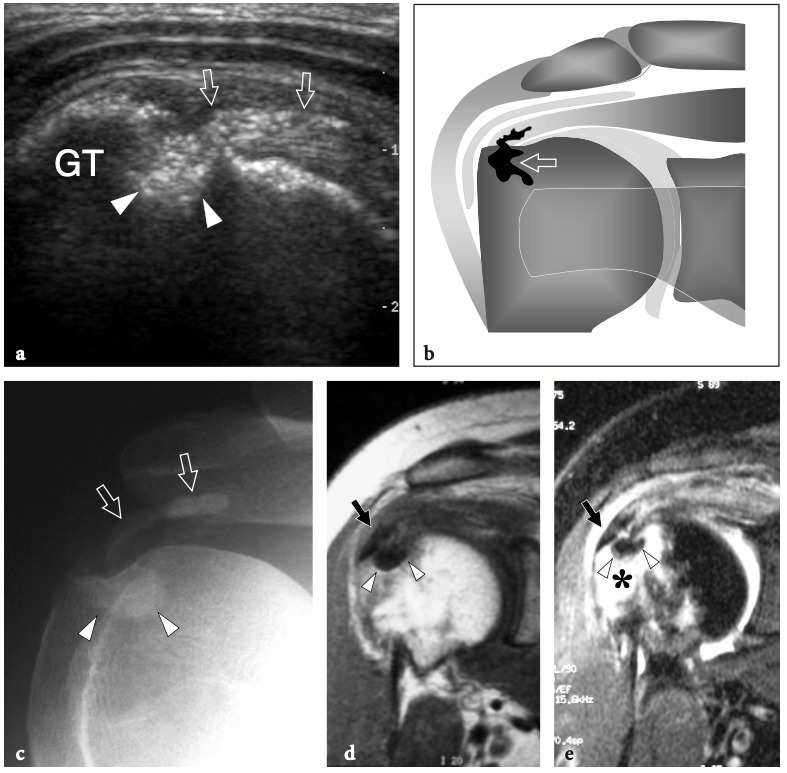
Fig. 106a–e. Pénétration intra-osseuse des tendinites calcifiantes. a Image échographique 12–5 MHz à axe long sur le tendon sus-épineux avec corrélation de dessin schématique b chez un patient souffrant de douleur à l'épaule ennuyeuse montre des calcifications de boue (flèches) dans le tendon. Le matériel calcifiant se prolonge dans une cavité profonde (têtes de flèches) au sein de la grosse tubérosité (GT). c La radiographie de face de l'épaule montre une faible opacité intra-osseuse (têtes de flèches) en continuité avec des calcifications mal définies (flèches) dans la région du tendon sus-épineux. d,e Coronal oblique d Les images IRM pondérées en T1 et e en pondération T2 avec suppression de la graisse montrent une structure arrondie de faible intensité de signal (têtes de flèches) dans la tête humérale supérolatérale avec un œdème de la moelle osseuse environnant (astérisque). Des calcifications intratendineuses (flèche noire) et du liquide bursal sont également associés.
Fig. 107a–e. Pénétration intra-osseuse d'une tendinite calcifiante du grand pectoral. une image US transversale 12–5 MHz sur la jonction myotendineuse de la longue tête du biceps (B) montre un tendon du grand pectoral gonflé et hypoéchogène (têtes de flèches) et une érosion corticale (flèches) au niveau de l'enthèse. Hs, diaphyse humérale. b L'image frontale d'une scintigraphie osseuse retardée montre un foyer arrondi (flèche) d'augmentation marquée de l'absorption des radionucléides au niveau de la diaphyse humérale droite proximale. c La radiographie de face obtenue avec rotation interne du bras montre une légère calcification (flèche) adjacente à la corticale humérale. d La tomodensitométrie montre la calcification typique en « queue de comète » (têtes de flèche) dans le tendon distal du grand pectoral et une érosion corticale bien définie de l'enthèse (flèche incurvée), reflétant la localisation intra-osseuse du calcium du tendon du pectoral. B, chef long du biceps brachial. La séquence STIR sagittale oblique montre un signal hyperintense marqué dans les tissus mous (tête de flèche) et la moelle (astérisque) autour du foyer calcifiant (flèche). (Avec l'aimable autorisation du Dr Nicolò Prato, Italie).
Il existe un consensus général sur le fait que la tomodensitométrie est la modalité d'imagerie optimale pour représenter la continuité des processus tendineux, corticaux et médullaires (l'IRM est supérieure pour évaluer l'atteinte médullaire, mais la calcification intratendineuse peut ne pas être appréciée) (Flemming et al. 2003). Parmi les complications rares de la tendinite calcifiante, une subluxation de l'articulation gléno-humérale inférieure (épaule tombante) a été décrite à la suite d'un dépôt calcifiant de grande taille dans le tendon du sus-épineux (Prato et al. 2003). Dans le cas rapporté, le dépôt a poussé vers le bas contre la tête humérale, surmontant la résistance des muscles et des structures capsuloligamenteuses compte tenu du toit rigide formé au-dessus par l'arc coraco-acromial. L'ablation directe d'une partie de la calcification par aspiration à l'aiguille, associée au passage de la partie résiduelle dans la bourse sous-deltoïdienne sous-acromiale, a diminué la compression sur la tête humérale, permettant sa relocalisation par rapport à la fosse glénoïdienne (Prato et al. 2003).
46. PATHOLOGIE DU TENDON DU BICEPS – TENDINOPATHIE DU BICEPS
La tendinopathie du tendon du chef long du biceps, incluant la ténosynovite et la tendinose, dérive de deux mécanismes principaux : le conflit et l'attrition. Dans la première, la portion intracapsulaire du biceps est pincée entre la tête humérale et l'arc coracoacromial lors de l'abduction et de la rotation du bras. Le mécanisme est similaire à celui conduisant au conflit sus-épineux. De plus, si le sus-épineux est déchiré, la tête humérale est déplacée vers le haut sous l'action du deltoïde de sorte que le tendon du biceps est tiré par la tête humérale et devient sa principale structure dépressive. (Illustration 108a). La tension chronique liée à cette surcharge peut contribuer à la dégénérescence des tendons (Wallny et al. 1999). Le deuxième mécanisme découle d'un conflit chronique entre la partie intertuberculaire du biceps et un sillon bicipital rétréci causé par une périostite locale, des ostéophytes et des irrégularités osseuses dans la petite tubérosité (Pfahler et al. 1999).
Figures 108a–c. Tendinopathie du biceps. un dessin schématique d'une vue coronale à travers l'épaule montre le pathomécanisme lié à l'impact conduisant à des changements dégénératifs dans le tendon du biceps. Suite à la rupture du tendon sus-épineux, le tendon du biceps (têtes de flèches) devient la structure principale contrecarrant le déplacement vers le haut (flèche) de la tête humérale lors de l'élévation du bras et de la contraction du deltoïde. Cela provoque une surcharge et des contraintes chroniques appliquées au tendon conduisant à sa dégénérescence et à sa déchirure. b L'image échographique 12–5 MHz à petit axe sur l'intervalle de la coiffe des rotateurs révèle un tendon du biceps intra-articulaire enflé et grossièrement œdémateux (flèche blanche) avec de subtiles fentes hypoéchogènes intrasubstance compatibles avec une tendinose et des fissures de haut grade (têtes de flèches). Notez la déchirure du tendon supraspinatus antérieur coexistant (flèches vides) et le subscapularis intact (SubS). c La vue arthroscopique correspondante montre des abrasions rougeâtres (têtes de flèches) sur la surface du tendon du biceps (Bt) compatibles avec des microfissurations. HH, tête humérale.
Les principaux signes de tendinopathie sont une hypertrophie du tendon du biceps liée à un œdème et une échotexture hétérogène avec des fissures (Fig.108b,c). Ces anomalies sont maximales au niveau de la réflexion tendineuse sur la tête humérale et à la partie proximale du sillon bicipital. Les signaux de flux de couleur peuvent également être reconnus autour du tendon enflé. Dans certains cas, la partie extra-articulaire du biceps peut apparaître normale et ce constat peut être trompeur si le scanner n'inclut pas systématiquement sa partie intra-articulaire. Dans la tendinopathie du biceps, l'épanchement dans la gaine tendineuse est une constatation accessoire. Il faut veiller à ne pas diagnostiquer une tendinopathie du biceps lorsqu'un épanchement de la gaine entoure un tendon par ailleurs normal, car le liquide reflète simplement un épanchement intra-articulaire qui peut s'étendre dans la gaine du tendon. Lorsque le liquide contenu dans la gaine tendineuse est disproportionné par rapport à celui visible dans la cavité articulaire postérieure, il peut être considéré comme l'expression d'une tendinopathie du biceps. Dans la tendinose par attrition, le tendon du biceps peut apparaître aminci et effiloché à travers le sillon intertuberculaire. En raison de frottements répétés contre l'os irrégulier, la tendinose du biceps peut éventuellement évoluer vers des spits longitudinaux. Ceux-ci peuvent soit créer une cavité centrale dans la substance tendineuse, soit diviser le biceps en deux cordons, donnant l'apparence de deux tendons adjacents sur une longueur variable. (Fig. 109a à f). Dans ce dernier cas, il faut être sûr que le deuxième tendon est en fait une structure allongée car les plis synoviaux et les corps lâches dans la gaine pourraient imiter l'apparence de deux tendons en coupe transversale. Il faut veiller à ne pas confondre une déchirure longitudinale partielle du biceps avec un tendon bifide, qui représente une variante anatomique. La distinction d'une déchirure d'une telle variante peut être potentiellement difficile car l'échographie est incapable de suivre le tendon jusqu'à son insertion dans le tubercule supraglénoïdien. En cas d'épanchement de la gaine, la détection de deux mésotendons individuels dans le sillon bicipital peut être considérée comme un indicateur d'un tendon bifide (Fig. 109g–i). L'évaluation de l'attache labrale doit également être importante pour différencier une déchirure longitudinale isolée du tendon du biceps d'une déchirure du biceps associée à une lésion SLAP. À cet égard, l'IRM est supérieure à l'échographie pour établir un diagnostic correct.
Figures 109a–i. Grands écarts longitudinaux et tendon bifide du biceps : spectre des apparitions américaines. ac Tendon du biceps coupé en deux. a Les images américaines à petit axe et b à axe long 12–5 MHz sur le sillon intertuberculaire avec corrélation de dessin schématique c révèlent deux tendons appariés (flèches) au lieu d'un, chacun étant caractérisé par une échotexture fibrillaire bien définie. Une petite quantité de liquide (astérisque) dans la gaine du tendon facilite la représentation de la déchirure (têtes de flèches). GT, grosse tubérosité ; LT, tubérosité inférieure. df Fissuration intrasubstance du tendon du biceps. d Les images US à axe court et e à axe long 12–5 MHz distales du sillon intertuberculaire avec une corrélation de dessin schématique f démontrent un défaut central rempli de liquide (astérisques) dans le tendon du biceps (têtes de flèches) - quelque peu similaire à un syrinx cavité - représentant une division intrasubstance. gi Tendon bifide du biceps. g, h Les images échographiques à axe court 12–5 MHz obtenues sur g la partie intra-articulaire du tendon du biceps et h au niveau du sillon intertuberculaire avec i corrélation schématique montrent deux tendons du biceps séparés (1, 2) au lieu de un, chacun caractérisé par un mésotendon individuel. Un léger épanchement hypoéchogène de la gaine facilite la détection de cette variante par échographie. Noter les relations des deux tendons avec le ligament coraco-huméral (CHL), la grande (GT) et la petite (LT) tubérosité. SubS, tendon sous-scapulaire.
47. RUPTURE DU TENDON DU BICEPS
La rupture du tendon du chef long du biceps n'est pas un diagnostic clinique difficile. Il génère généralement une masse de tissus mous dans la face antérieure du bras moyen, le soi-disant signe "Popeye", accompagné d'une diminution de la force lors de la flexion et de la supination de l'avant-bras. (Illustration 110a). Souvent, la douleur à l'épaule cesse lorsque le tendon se déchire et le patient est étonné de voir un tel muscle hypertrophié dans le bras qui conduit paradoxalement à une diminution de la force. Des difficultés diagnostiques peuvent être rencontrées dans quelques cas, notamment chez les patients obèses aux bras épais. L'échographie peut identifier la rupture du tendon, qui se produit généralement au niveau intra-articulaire et se rétracte distalement en laissant un sillon vide (Fig. 110b – e). Sur les scanners à petit axe obtenus au niveau intra-articulaire, le ligament coraco-huméral peut prendre un profil concave au-dessus de la tête humérale en raison de l'absence du biceps sous-jacent (Fig. 111).
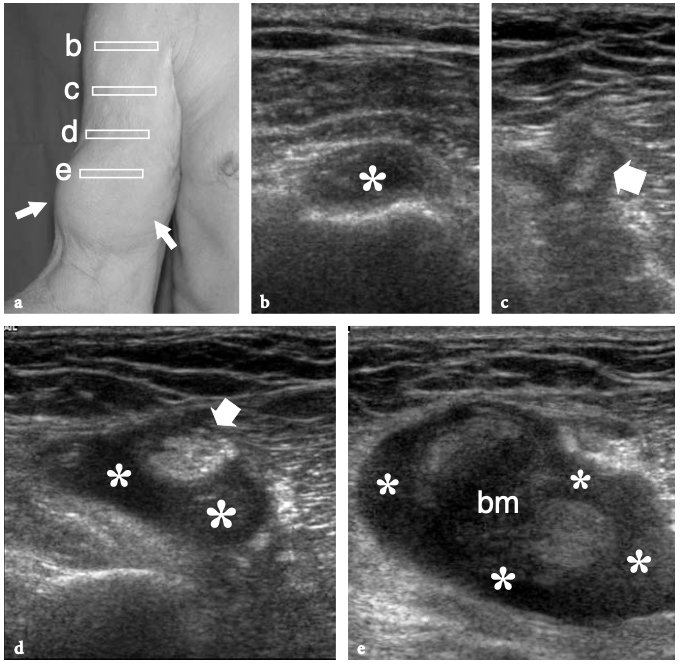
Fig. 110a–e. Rupture récente du tendon du biceps. a La photographie montre la rétraction distale du ventre musculaire (flèches) de la longue tête du biceps suite à une rupture du tendon, entraînant l'aspect Popeye caractéristique. b–e Série d'images échographiques transversales 12–5 MHz obtenues de proximal à distal aux niveaux (barres blanches horizontales) indiqués dans un montre une gaine vide (astérisque) juste en aval du sillon intertuberculaire. Au fur et à mesure que le plan de balayage avance distalement, l'extrémité rétractée du tendon (flèche) est appréciée et entourée par des quantités croissantes d'épanchement de la gaine (astérisques). En e, notez le ventre musculaire rétracté (bm) entouré d'un important hématome intrafascial (astérisques).
Figure 111a,b. Signes échographiques indirects de rupture du tendon du biceps. a,b Images échographiques transversales 12–5 MHz obtenues sur a l'intervalle de la coiffe des rotateurs et b le sillon intertuberculaire. En a, le ligament coraco-huméral (flèches) prend un aspect concave suite à la rupture de la portion intra-articulaire du tendon du biceps. Notez le sous-scapulaire intact (SubS) et la petite quantité de liquide (astérisque) collectée sous le ligament au lieu du tendon du biceps. En b, le ligament huméral transverse (flèche) se replie vers l'intérieur du sillon intertuberculaire, dans l'espace laissé libre par le biceps rétracté. GT, grosse tubérosité ; LT, tubérosité inférieure.
Dans les ruptures aiguës, le moignon du tendon est rétracté dans le bras et apparaît entouré de liquide (Middleton et al. 1985 ; Ahovuo et al. 1986). Au site de rupture, la gaine du tendon du biceps peut se remplir de débris, rendant difficile la distinction entre un tendon déchiré et un tendon irrégulier mais intact. Dans de telles circonstances, nous pensons qu'il n'y a pas vraiment besoin d'explorer le sulcus du biceps pour poser un diagnostic correct. Au lieu de cela, l'examinateur doit considérer le niveau d'insertion du tendon du grand pectoral par rapport à la jonction myotendineuse du biceps. En effet, lorsque le biceps se déchire, sa jonction myotendineuse retombe à un endroit plus distal que le niveau du pectoral. (Fig. 112). Dans un contexte aigu, le muscle rétracté est généralement entouré de liquide et conserve son échotexture normale. Crânienne à celle-ci, une image hyperéchogène entourée d'un halo hypoéchogène correspond au tendon rétracté entouré d'un épanchement. Dans les ruptures chroniques, le ventre musculaire montre un volume diminué et devient hyperéchogène par rapport au ventre court adjacent à la suite de modifications atrophiques.
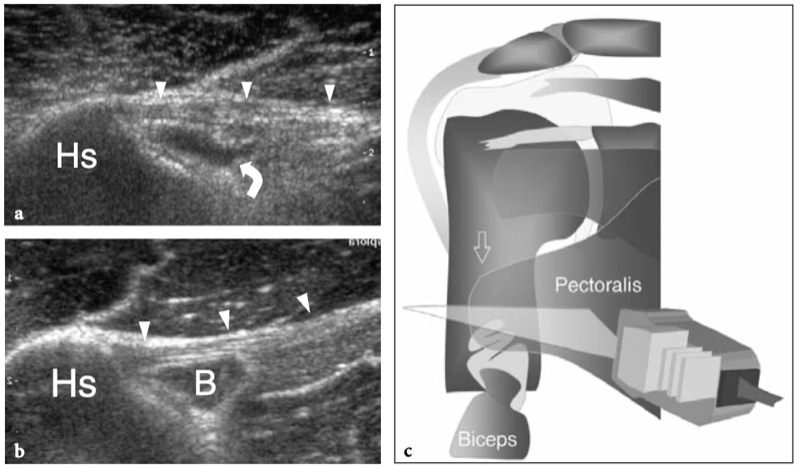
Fig. 112a–c. Rupture du tendon du biceps et du tendon du grand pectoral. une image US transversale 12–5 MHz obtenue sur le grand axe du tendon du grand pectoral (têtes de flèches) chez un patient présentant une déchirure du tendon du biceps montre un épanchement hypoéchogène (flèche courbe) au lieu de la jonction myotendineuse du long chef du biceps. b Côté controlatéral normal montrant la jonction myotendineuse du biceps (B) située juste en profondeur de l'insertion pectorale (têtes de flèches) Hs, diaphyse humérale. c Le dessin schématique d'une vue coronale à travers l'épaule antérieure et le haut du bras montre une position inférieure de la jonction myotendineuse rétractée du biceps par rapport au tendon du grand pectoral. Dans les cas douteux, placer la sonde sur le grand axe du tendon pectoral comme repère peut aider au diagnostic de rupture du tendon du biceps.
La différence entre les deux têtes de biceps peut être si frappante qu'un aspect "noir et blanc" est souvent noté sur les scans transversaux (Fig. 113). Parfois, il peut y avoir auto-attachement du moignon de tendon rompu dans la rainure sans rétraction et il faut veiller à ne pas le confondre avec un tendon normal. Dans ces cas, le rattachement du tendon déchiré à un endroit plus distal peut empêcher la dégénérescence musculaire. Le muscle peut présenter un aspect globuleux à la suite d'une rétraction mais conserve généralement une échotexture interne normale (Fig. 114a, b). Enfin, dans de rares cas, des déchirures du tendon du biceps peuvent survenir à la jonction myotendineuse avec un tendon d'apparence normale à l'intérieur de la rainure. (Fig. 114c – e). Si le tendon du biceps est examiné sans évaluer le muscle, de telles déchirures peuvent être complètement manquées. Bien que les constatations américaines des ruptures du tendon du biceps soient multiformes, le point essentiel est de déterminer si le tendon est intact ou déchiré : des informations complémentaires sur la position et l'écho-texture des extrémités tendineuses et du muscle n'influencent pas la décision thérapeutique (chirurgicale vs. conservateur), qui repose essentiellement sur des données cliniques telles que l'âge et l'activité du patient. En général, les ruptures du tendon du biceps sont significativement associées aux déchirures du tendon du sus-épineux (96.2 % des cas) ou du sous-scapulaire (47.1 % des cas) en raison des mêmes forces d'impact et des blessures de traction (Beall et al. 2003).
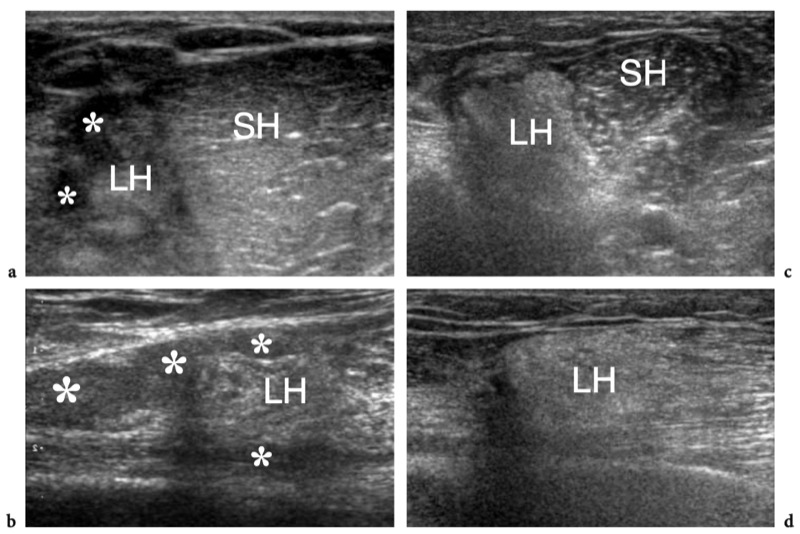
Fig. 113a–d. Déchirure du tendon du biceps : spectre des aspects échographiques du ventre musculaire rétracté en fonction de l'ancienneté de la déchirure. a Les images US petit axe et b grand axe 12–5 MHz sur les chefs long (LH) et court (SH) du muscle biceps chez un patient présentant une déchirure récente du chef long du tendon du biceps montrent un liquide hypoéchogène ( astérisques) entourant le ventre de la longue tête. Le muscle semble rétracté mais présente une échotexture similaire à la tête courte adjacente. Les images échographiques c petit axe et d grand axe 12–5 MHz sur les chefs long (LH) et court (SH) du muscle biceps chez un patient présentant une déchirure chronique de longue date du chef long du tendon du biceps révèlent des différences échotexturales marquées entre les deux chefs du biceps, le chef long étant beaucoup plus échogène. Cette modification traduit une atrophie des fibres musculaires et une infiltration graisseuse des muscles.
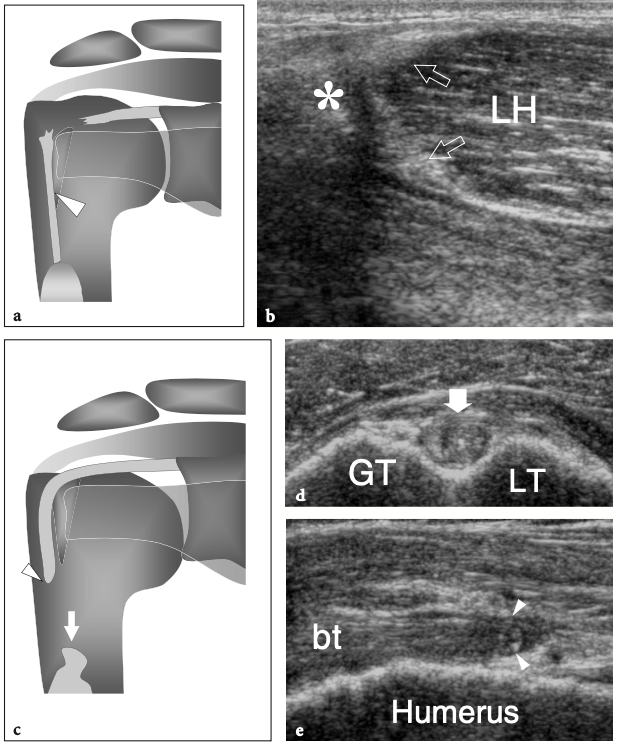
Figures 114a–e. Découvertes rares aux États-Unis de déchirures du tendon du biceps. a,b Tendon du biceps auto-attaché à l'intérieur de la gouttière sans rétraction. un dessin schématique d'une vue coronale à travers l'épaule antérieure et le haut du bras illustre une extrémité distale pendante du tendon du biceps (tête de flèche) qui s'est coincée spontanément dans la rainure distale après rupture. b L'image échographique 12–5 MHz à axe long correspondante sur la longue tête (LH) du muscle biceps montre un muscle de forme globulaire (flèches) mais d'apparence presque normale. Le coincement accidentel du tendon à l'intérieur de la rainure a empêché des changements échotexturaux majeurs dans le muscle. Seul un léger aspect hyperéchogène (astérisque) est observé à la jonction myotendineuse. c–e Déchirure de la jonction myotendineuse du biceps. c Le dessin schématique d'une vue coronale à travers l'épaule antérieure et le haut du bras montre une rupture du tendon du biceps au niveau de sa jonction myotendineuse. Un examen minutieux est nécessaire dans ces cas pour ne pas manquer la déchirure, car le tendon du biceps conserve un aspect normal dans le sillon intertuberculaire. d L'échographie 12–5 MHz petit axe au-dessus du sillon intertuberculaire révèle un tendon du biceps apparemment normal situé entre la grande (GT) et la petite (LT) tubérosités. e L'image échographique 12–5 MHz grand axe sur le tendon du biceps (bt) montre une extrémité abrupte du tendon (têtes de flèches) reflétant la déchirure distale.
48. INSTABILITÉ DU TENDON DU BICEPS
De par sa trajectoire curviligne et sa réflexion sur la tête humérale, le biceps est intrinsèquement prédisposé à l'instabilité. En règle générale, le biceps ne subit pas de subluxation ou de luxation médiale hors de la gouttière bicipitale lorsque le ligament coracohuméral est intact. Si le ligament coracohuméral est déchiré, comme cela peut se produire en association avec des déchirures du sus-épineux antérieur, le biceps peut se disloquer sur le sous-scapulaire intact. Dans de tels cas, la partie latérale rompue du ligament coracohuméral peut être vue (Fig. 115a, b). L'examen dynamique lors des mouvements de rotation de l'épaule peut révéler un mouvement anormalement augmenté de la partie intra-articulaire du tendon du biceps, qui n'est plus stabilisée par la poulie formée par les ligaments coraco-huméral et gléno-huméral supérieur. Dans ces cas, des forces de stress anormales peuvent produire une dégénérescence locale précoce avec un épaississement et des fissures du tendon du biceps. Plus caudalement, le biceps peut apparaître perché sur la petite tubérosité (Fig.115c). Une technique de numérisation minutieuse est nécessaire pour imager la longue portion subluxée du tendon du biceps car l'instabilité se produit d'abord crânialement, au niveau intra-articulaire.
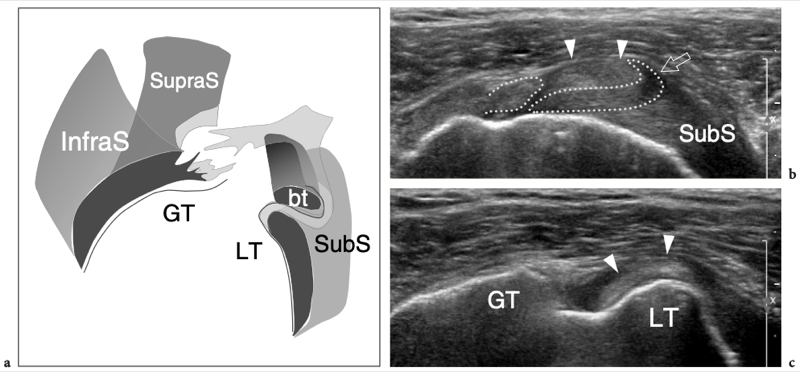
Figures 115a–c. Déchirure du ligament coracohuméral et subluxation du tendon du biceps. un dessin schématique d'une vue à petit axe à travers l'intervalle de la coiffe des rotateurs montre une lésion de la corde latérale du ligament coracohuméral associée à une déchirure antérieure du tendon sus-épineux (SupraS). Avec ces déchirures, le tendon du biceps (bt) a tendance à subluxer sur le cordon médial du ligament et le tendon sous-scapulaire intact (SubS). InfraS, tendon sous-épineux ; GT, grosse tubérosité ; LT, tubérosité inférieure. b,c Les images échographiques 17-5 MHz à petit axe b sur l'intervalle de la coiffe des rotateurs et c le sillon intertuberculaire montrent une rupture du ligament coracohuméral (lignes pointillées) et du tendon du biceps (pointes de flèche) qui apparaît subluxé sur la moelle médiale (flèche) de le ligament et les fibres les plus crâniennes du sous-scapulaire (SubS) et, plus distalement, perché sur la petite tubérosité (LT).
De plus, la légère position médiale que le tendon adopte normalement lorsqu'il pénètre dans le sillon bicipital ne doit pas être confondue avec une découverte pathologique. Nous pensons qu'un diagnostic correct de subluxation du tendon du biceps ne peut être posé par échographie que lorsque le tendon est vu recouvrant la petite tubérosité sur des coupes transversales dans lesquelles le sillon bicipital est clairement représenté. Lorsque le sulcus n'est pas clairement visible, la subluxation apparente du tendon du biceps peut être le résultat soit d'une technique de balayage incorrecte, soit de variations anatomiques. Dans les rares cas d'instabilité intermittente, on observe un déplacement en « va-et-vient » du tendon hors de la gouttière. Un scanner dynamique avec l'épaule en rotation externe et interne maximale peut aider au diagnostic (Farin et al. 1995). Chez ces patients, la rainure du biceps doit être imagée avec précision sur des plans transversaux pour évaluer sa forme (Farin et Jaroma 1996). Un sillon intertuberculaire congénital peu profond (<3 mm de profondeur) avec une paroi médiale plate prédispose le long chef du tendon du biceps à l'instabilité (Levinshon et Santelli 1991). Dans de rares cas, la luxation du tendon du biceps peut être secondaire à une déchirure combinée de la partie latérale de la poulie de réflexion et du ligament transverse même si le sous-scapulaire est normal. Chez ces patients, le biceps peut se disloquer superficiellement au sous-scapulaire (Fig. 116) (Patton et al. 2001; Bennett 2001). Lorsque le biceps est subluxé, l'éperon du trochiter peut contribuer à aggraver la tendinopathie par attrition. Dans ces cas, le biceps peut être nettement gonflé et prédisposé aux fentes longitudinales, comme déjà décrit. Le mécanisme pathogénique de cette anomalie est similaire à celui qui se produit dans le court péronier de la cheville à la suite d'une subluxation antérieure intermittente sur la malléole latérale.
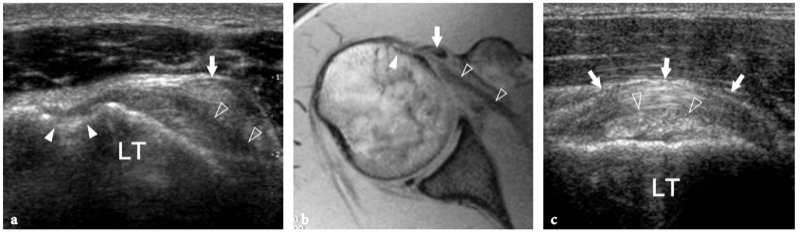
Figures 116a–c. Luxation du tendon du biceps sur un tendon sous-scapulaire intact. a Image échographique transversale 12–5 MHz de l'épaule antérieure au niveau du sillon intertuberculaire avec corrélation d'imagerie IRM pondérée en T2* en écho de gradient b montrant le tendon du biceps (flèche) déplacé superficiellement par rapport au sous-scapulaire intact (têtes de flèche ouvertes) à la suite de un ligament coracohuméral lésé. Notez que le sillon intertuberculaire vide (têtes de flèches blanches) est obtus. c Image échographique sagittale 12–5 MHz au-dessus du petit tubercule (LT) révèle le déplacement du tendon du biceps (flèches) lors de son passage superficiel aux fibres intactes du sous-scapulaire (têtes de flèches).
La rupture du tiers crânien du tendon sous-scapulaire, isolée ou associée à une déchirure du tendon sus-épineux, est souvent associée à une instabilité du biceps (Bennett 2001). Lorsque le tiers crânien du sous-scapulaire est déchiré, le tendon du biceps a tendance à subluxer superficiellement sur les coupes transversales crâniennes et à se reposer dans une position normale sur les coupes transversales caudales. (Fig. 117). Lorsque la déchirure du sous-scapulaire est complète, le biceps glisse médialement dans l'articulation gléno-humérale (Ptasznik et Hennesy 1995 ; Farin et al. 1995 ; Farin 1996 ; Prato et al. 1996). Le diagnostic américain de luxation du tendon du biceps repose sur la démonstration d'un sillon vide et d'un tendon déplacé médialement. Dans de nombreux cas, l'échographie est capable d'identifier le tendon du biceps sur la pente extérieure de la rainure bicipitale (Fig. 118).
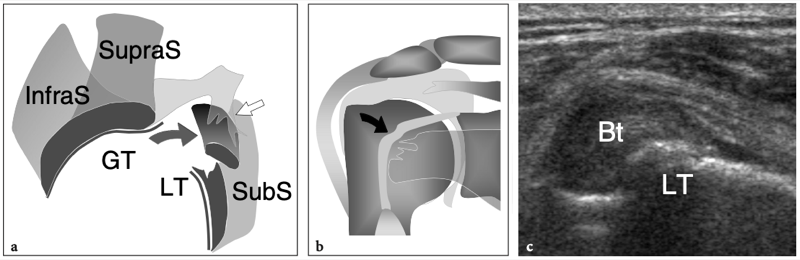
Figures 117a–c. Luxation du tendon du biceps associée à une rupture incomplète du tendon sous-scapulaire. Les dessins schématiques d'une vue à petit axe à travers l'intervalle de la coiffe des rotateurs et d'une vue coronale à travers l'épaule antérieure et le haut du bras montrent une lésion sélective de la corde médiale de la poulie de réflexion (flèche droite) associée à une déchirure des fibres les plus crâniennes de le tendon sous-scapulaire (SubS). Avec ces déchirures, le tendon du biceps (bt) a tendance à subluxer (flèche courbe) sur la petite tubérosité (LT). GT, grosse tubérosité ; InfraS, tendon sous-épineux ; SupraS, tendon sus-épineux. c Image échographique transversale 12–5 MHz obtenue sur le tubercule mineur avec le bras en position neutre montrant un tendon du biceps (Bt) gonflé et œdémateux subluxé sur le tubercule mineur (LT).
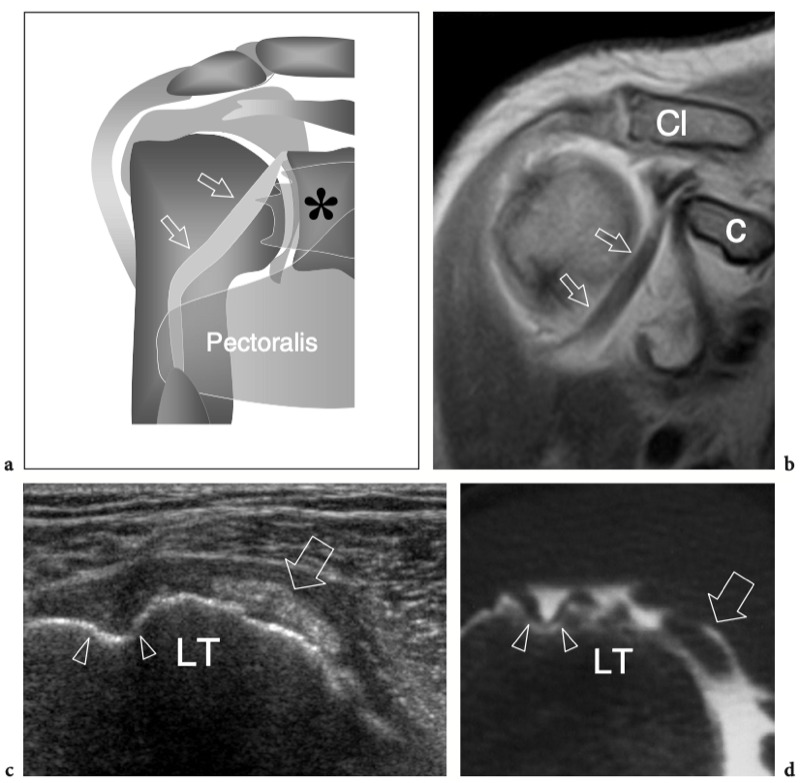
Fig. 118a–d. Luxation du tendon du biceps associée à une rupture complète rétractée du tendon sous-scapulaire. a Dessin schématique d'une vue coronale à travers l'épaule antérieure et le haut du bras avec une corrélation d'imagerie IRM pondérée en T2 coronale b montrant le sous-scapulaire déchiré (astérisque) rétracté du point d'attache normal sur la petite tubérosité et le tendon du biceps (flèches) disloqué médialement dans l'espace articulaire gléno-huméral. cl, clavicule ; c, coracoïde. c Image échographique transversale 12–5 MHz sur la face antérieure de la tête humérale avec corrélation d arthroscanner montrant une gouttière vide (têtes de flèches) et le tendon du biceps (flèche) disloqué à l'extérieur de la gouttière humérale et positionné en dedans de la petite tubérosité (LT ).
Cependant, le déplacement de ce tendon peut être si médial et profond qu'il rend sa mise en évidence difficile en raison de l'occultation acoustique de la coracoïde. Dans ces cas, une technique de balayage minutieuse peut être nécessaire pour reconnaître le tendon disloqué à proximité du bourrelet glénoïdien antérieur afin d'éviter un faux diagnostic de rupture du tendon. Dans les cas douteux, l'inclinaison de la sonde de haut en bas peut aider à détecter le biceps disloqué sur la base de l'anisotropie. Une astuce consiste à se référer au tendon du grand pectoral comme point de repère pour identifier la jonction myotendineuse du biceps. Contrairement aux déchirures du tendon du biceps, la luxation de ce tendon n'entraîne pas de changement de position de la jonction myotendineuse. La sonde doit être balayée de caudale à crânienne en suivant le trajet du tendon : si le biceps est vu dévié de son trajet normal, une luxation du tendon doit être envisagée. Sur les images à petit axe, un tendon du biceps disloqué apparaît généralement comme une image arrondie hyperéchogène entourée d'un rebord hypoéchogène dû à un épanchement péritendineux. Aussi, il faut veiller à ne pas confondre le chef long déplacé du tendon du biceps avec le chef court : on peut les différencier en balayant la sonde vers le haut pour atteindre l'insertion du chef court dans la coracoïde. Enfin, il ne faut pas confondre les débris échogènes et les cicatrices fibreuses que l'on retrouve souvent dans la gouttière vide pour un tendon normalement positionné (tendon du pseudobiceps) (Farin 1996). Dans ces cas, la confiance diagnostique peut être renforcée par l'absence d'échos fibrillaires détectables sur les balayages longitudinaux au-dessus du sillon bicipital (Teefey et al. 1999). Globalement, la distinction entre rupture du tendon du biceps et instabilité est cliniquement pertinente car une rupture est généralement traitée par des mesures conservatrices, alors que la luxation du biceps est fréquemment associée à une rupture du sous-scapulaire, affection nécessitant un traitement chirurgical : débridement en cas de rupture incomplète du le sous-scapulaire, réparation des déchirures complètes et ténodèse du tendon du biceps jusqu'au sillon intertuberculaire (Fig. 119).
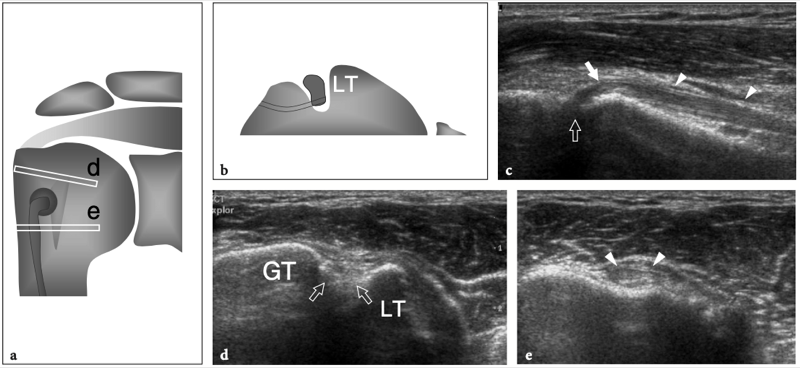
Figures 119a–e. Ténodèse du tendon du biceps jusqu'au sillon intertuberculaire chez un patient avec antécédent de déchirure du tendon du sous-scapulaire et de luxation du tendon du biceps. a,b Des dessins schématiques montrant aa une vue coronale à travers l'épaule antérieure et b une vue transversale à travers le sillon intertuberculaire illustrent la méthode de réalisation de la ténodèse du biceps. Le moignon distal du biceps est tiré vers le haut dans sa gaine et est ancré avec des sutures non résorbables à une fenêtre dans l'os qui peut être obtenue en approfondissant la rainure existante ou en créant une nouvelle rainure immédiatement postérieure à la rainure du biceps. Le moignon de tendon proximal peut être excisé ou utilisé pour réparer les défauts de la coiffe. c L'image US 12–5 MHz à axe long montre le tendon du biceps rattaché (pointes de flèches) alors qu'il se courbe (flèche blanche) pour s'insérer dans une nouvelle rainure (flèche ouverte) percée dans l'os. d,e Les images US transversales 12–5 MHz obtenues aux niveaux (barres blanches) indiqués en a montrent un sillon vide (flèches) entre les grandes (GT) et petites (LT) tubérosités. Au fur et à mesure que le plan de balayage avance distalement, le tendon du biceps réinséré (têtes de flèches) est visible.
49. PATHOLOGIE DE L'ÉPAULE AU-DELÀ DE LA CUF DES ROTATEURS
Bien que la plupart des examens de l'épaule soient effectués pour évaluer la coiffe des rotateurs, l'échographie peut évaluer d'autres structures autour de la ceinture scapulaire (Peetrons et al. 2001 ; Martinoli et al. 2003). En général, les gens sont mal informés sur les contributions de l'échographie dans les instabilités de l'épaule, les troubles articulaires et les syndromes de compression des nerfs, et l'échographie reste probablement sous-utilisée dans ce domaine. Quant aux maladies intra-articulaires, il ne fait aucun doute qu'elles sont mieux diagnostiquées par l'IRM et l'arthroscanner et IRM, du fait d'une meilleure évaluation des structures anatomiques telles que la capsule, les ligaments, le labrum glénoïdien et l'os. Cependant, l'échographie est rapide à réaliser et présente des avantages spécifiques par rapport à l'imagerie par résonance magnétique qui justifient son utilisation plus large, notamment sa résolution plus élevée et sa capacité à examiner différentes structures dans des états statiques et dynamiques et dans différentes positions du patient.
50. LÉSIONS PECTORALES ET DELTOÏDES
La rupture traumatique complète du grand pectoral est une blessure sportive très rare qui survient principalement chez les jeunes athlètes masculins. En règle générale, la blessure survient lors de l'exécution de développé couché avec le bras en rotation externe forcée, extension et abduction de l'humérus. Parce que les fibres les plus basses du muscle s'insèrent au point le plus haut de l'humérus, ce mécanisme provoque un étirement excentrique et un allongement de la partie inférieure (abdominale) du muscle, le prédisposant à la rupture (Wolfe et al. 1992). La rotation externe forcée et l'abduction (position ABER) appliquées sur le muscle contracté d'un bras tendu lors d'une chute, ou des accidents de lutte, de rugby et de ski nautique, ont également été signalés comme mécanismes possibles de blessure (Äärimaa et al. 2004). Les patients signalent une douleur soudaine au bras et à l'épaule avec ou sans sensation de « pop ». La classification des déchirures dépend du degré (complète ou partielle) et de la localisation (jonction tendon-os, jonction myotendineuse, intramusculaire) de la lésion. Dans la phase aiguë, il est important de faire la distinction entre ces types de déchirures car les blessures partielles sont traitées de manière conservatrice alors que les déchirures complètes nécessitent une réparation chirurgicale pour restaurer la force et avoir un meilleur résultat pour le patient. Cette différenciation, cependant, est souvent difficile à faire sans études d'imagerie, en raison de l'œdème local et du gonflement et de la sensibilité des tissus mous. Dans les phases chroniques, la perte du pli axillaire antérieur peut être retrouvée avec une asymétrie du muscle par rapport au côté sain (Illustration 120a). L'échographie s'est avérée capable de diagnostiquer les lésions traumatiques du muscle grand pectoral, ainsi que d'obtenir un classement précis de la déchirure (Rehman et Robinson, 2005). Si le tendon est avulsé de l'os huméral, le cas le plus courant (Connell et al. 1999), les résultats des échographies incluent soit une apparence ondulée, soit une non-visualisation du tendon (Martinoli et al. 2003 ; Rehman et Robinson, 2005). Un liquide hypoéchogène adjacent au cortex huméral et le long du lit tendineux lié à l'hématome peut aider au diagnostic (Fig.120b,c). Le long chef du tendon du biceps et sa jonction myotendineuse sont entourés de liquide. Comme le tendon du grand pectoral est un stabilisateur du long tendon du chef du biceps en aval des tubérosités humérales, sa rupture entraîne une élévation du biceps de l'humérus (Fig.120d) (Martinoli et al. 2003). Si la lésion survient à la jonction myotendineuse distale, l'échographie montre une insertion tendineuse normale sur l'humérus et un gonflement et une échotexture hétérogène à la jonction tendon-muscle liée à des fibres musculaires perturbées et à un hématome hypoéchogène intermédiaire, juste en profondeur du muscle deltoïde. Dans les ruptures complètes, le ventre musculaire est rétracté médialement et peut présenter des modifications atrophiques. Avec le temps, les adhérences peuvent former un pseudo-tendon entre le muscle rétracté et le moignon tendineux réel (Rehman et Robinson, 2005). Lorsque la différenciation entre déchirures partielles et complètes est douteuse avec l'échographie, l'IRM est un moyen précis de confirmer le diagnostic (Connell et al. 1999 ; Lee et al. 2000 ; Carrino et al. 2000).
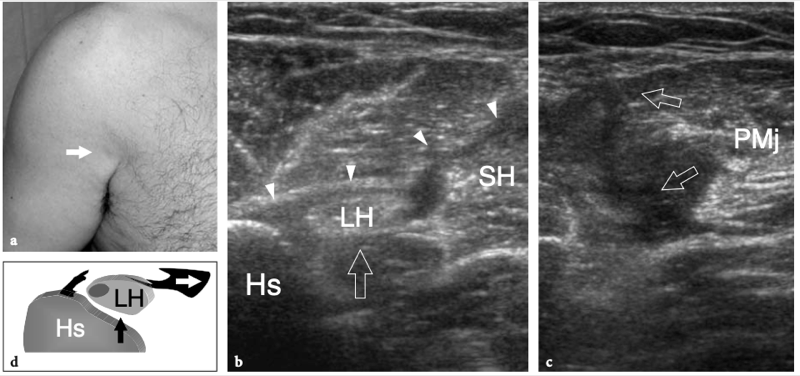
Fig. 120a–d. Déchirure du tendon du grand pectoral. a Photographie d'un patient se plaignant de douleur et d'un défaut palpable (flèche) de la paroi antérieure de l'aisselle suite à une tentative d'attraper un objet lourd. b Une image US transversale de 12 à 5 MHz au-dessus du défaut révèle un liquide hypoéchogène remplissant le lit (têtes de flèches) du tendon du grand pectoral rompu. La lésion est survenue au niveau de l'enthèse avec décollement de l'insertion du tendon dans l'os. Notez le déplacement antérieur (flèche) de la jonction myotendineuse du biceps (LH) qui apparaît entourée de liquide. SH, chef court du biceps. Hs, diaphyse humérale. c Plus médialement, une image US transversale 12–5 MHz montre un muscle rétracté hétérogène (PMj), en particulier à son origine myotendineuse (flèches).
Hormis les lésions traumatiques, les muscles pectoraux majeurs et mineurs sont les muscles congénitalement absents les plus courants. (Fig. 121). Les patients ont généralement une paroi thoracique aplatie avec des côtes hypoplasiques et un mamelon surélevé. L'agénésie de ces muscles est souvent partielle et peut faire partie d'un syndrome associé à d'autres anomalies : le syndrome de Poland (Demos et al. 1985). Ce syndrome est une maladie autosomique récessive avec une incidence de 1/30,000 XNUMX naissances vivantes, dans laquelle l'absence du pectoral est unilatérale et associée à une syndactylie et une hypoplasie du membre supérieur homolatéral. Le diagnostic américain d'agénésie pectorale repose principalement sur l'absence de ventre musculaire et de tendon. Des plans transversaux sur la paroi thoracique antérieure et la jonction myotendineuse du biceps sont obtenus des deux côtés à des fins de comparaison. Dans l'agénésie pectorale, un reste fibreux du tendon et du muscle peut parfois être observé; cette découverte ne doit pas induire l'examinateur en erreur en lui faisant croire qu'une absence congénitale du muscle n'existe pas.
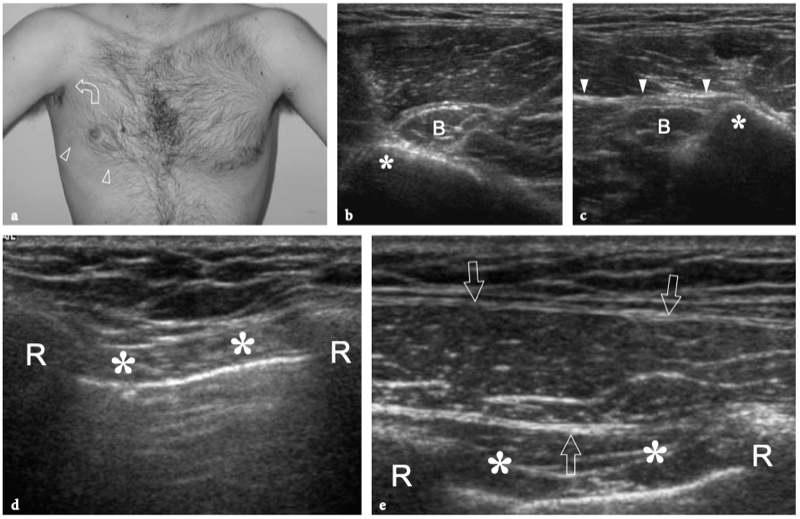
Fig. 121a–e. Agénésie du muscle pectoral. une photographie du thorax d'un patient présentant une absence congénitale du grand pectoral droit montre une paroi thoracique aplatie (têtes de flèches), ce qui provoque l'élévation du mamelon, et l'absence du pli axillaire antérieur (flèche courbe). b,c Images échographiques transversales 12–5 MHz sur la jonction myotendineuse b droite et c gauche du biceps (B). Du côté atteint, il y a absence du tendon pectoral (têtes de flèches) et le biceps est décalé vers l'avant par rapport à la diaphyse humérale (astérisque). d,e Les images échographiques sagittales 12–5 MHz sur les parois thoraciques d droite et e gauche démontrent l'absence complète du muscle pectoral droit (flèches). En d, notez la graisse sous-cutanée qui atteint le plan costal, constituée d'une combinaison de côtes (R) et de muscles intercostaux (astérisques).
Il existe peu de rapports dans la littérature traitant de la rupture spontanée du muscle deltoïde. Dans les cas rapportés, la blessure s'est produite chez des patients souffrant de déchirures chroniques et massives de la coiffe des rotateurs et a été, dans certains cas, responsable d'un début aigu de faiblesse de l'épaule. L'un des facteurs causals possibles prétendus pour expliquer la rupture ou le détachement du muscle deltoïde est une histoire d'injections répétées de stéroïdes pour l'épaule gelée et les déchirures de longue date de la coiffe des rotateurs (Allen et Drakos 2002). Parce que, chez les patients présentant une rupture du deltoïde et une déchirure massive de la coiffe des rotateurs, la contraction du deltoïde intact peut entraîner une saillie de la tête humérale à travers le défaut (un type de boutonnière) - le plus souvent dans le tiers antérieur ou moyen - un conflit huméral sur la face inférieure de le deltoïde pourrait être considéré comme un autre facteur causal possible (Blazar et al. 1998 ; Bianchi et al. 2006). Le déplacement vers le haut de la tête humérale peut entraîner une attrition à différents sites. Si le conflit agit sur la partie antéro-médiale de l'arc acromio-claviculaire, il génère plus probablement des kystes acromio-claviculaires (Tshering Vogel et al. 2005) ; si elle touche la partie postérieure de l'arc acromio-claviculaire, elle peut entraîner des fractures de fatigue de l'acromion (Dennis et al. 1986). Il est concevable qu'une localisation plus latérale des forces d'impact (éventuellement secondaire à une petite taille d'acromion ou à une grosse tête humérale) puisse provoquer un affaiblissement voire des déchirures de l'attache deltoïdienne (Fig. 122, 123) (Bianchi et al. 2006). Le décollement de l'insertion deltoïdienne de l'acromion antérolatéral est une pratique chirurgicale fréquente qui améliore l'exposition lors de l'acromioplastie. Le décollement postopératoire du deltoïde est une complication potentielle après cette intervention. L'échographie peut identifier cette condition, qui peut être réparée chirurgicalement si elle est reconnue tôt.
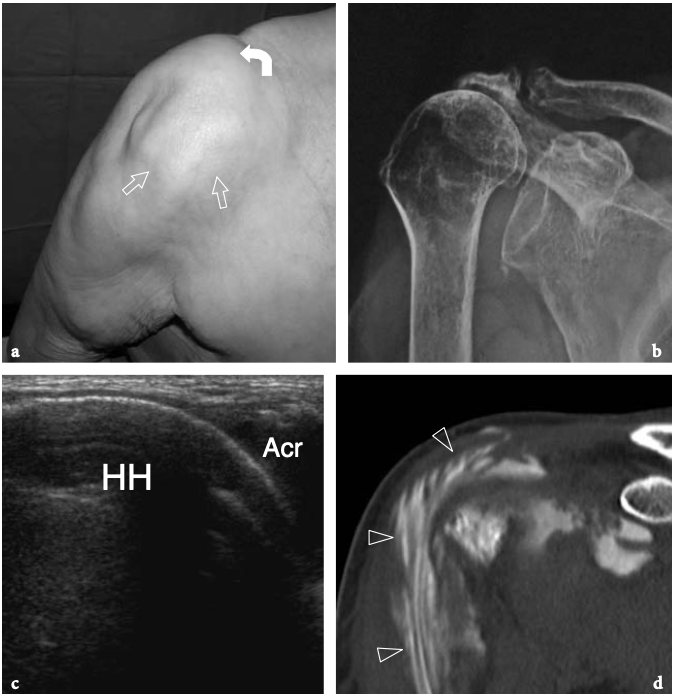
Fig. 122a-d. Atteinte des deux tiers antérieurs du muscle deltoïde secondaire à un conflit huméral chronique chez un patient âgé présentant une rupture massive de la coiffe des rotateurs. a La photographie montre la proéminence de la tête humérale (flèches droites) sur la peau, qui devient de plus en plus visible lors des mouvements de rotation du bras. La flèche courbe indique l'acromion. b La radiographie de face montre une translation supérieure marquée de la tête humérale avec des signes avancés d'arthrose glénohumérale et d'arthrose acromiohumérale. c L'image coronale oblique 12–5 MHz US montre un espace sous-acromial presque absent et un renflement considérable de la tête humérale (HH) à l'extérieur du bord latéral de l'acromion (Acr). Il y a absence du tiers médian du muscle deltoïde avec l'humérus approchant les plans tissulaires superficiels de la face supérolatérale de l'épaule. d La corrélation arthro-scanner révèle un muscle deltoïde perturbé (têtes de flèches).
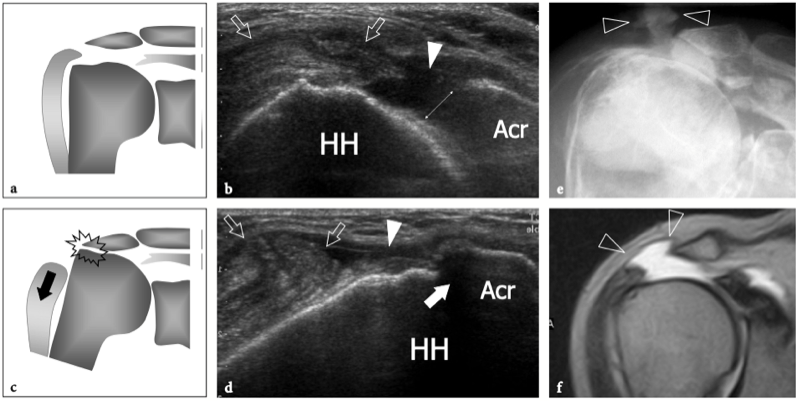
Figures 123a–f. Décollement spontané du muscle deltoïde. a,c Dessin schématique d'une vue antérieure à travers l'épaule et b,d images échographiques 12–5 MHz correspondantes sur le tiers médian du muscle deltoïde obtenues a,b au repos et c,d pendant l'abduction active du bras . Au repos, l'espace (double flèche) intervenant entre la tête humérale (HH) et l'acromion (Acr) est dû à la traction due au poids du bras (flèche). Au cours de l'abduction active, la tête humérale est déplacée vers le haut (flèche blanche) par les parties intactes antérieure et postérieure du muscle deltoïde et empiète sur la face inférieure de l'acromion. Le tiers moyen détaché (flèches vides) du muscle deltoïde apparaît plus globuleux en raison de la contraction (flèche noire). e Arthrographie antéropostérieure montrant un produit de contraste remplissant la déchirure du deltoïde (têtes de flèches). f L'arthro-IRM coronale oblique confirme le décollement de pleine épaisseur (têtes de flèches) du tiers médian du muscle deltoïde.
L'injection intramusculaire à travers le muscle deltoïde est une pratique courante pour traiter la douleur et l'infection de l'épaule. L'injection répétée de médicaments peut cependant entraîner une fibrose du site d'injection, évoluant même vers un état de contracture des muscles (myopathie d'injection). La contraction du muscle deltoïde est une entité clinique rare, souvent méconnue, qui implique généralement la partie intermédiaire du muscle, site de prédilection pour l'injection intramusculaire (Chen et al. 1998). Les signes cliniques comprennent un cordon fibreux palpable dans le muscle deltoïde, des capitons cutanés recouvrant le cordon, une oscillation de l'omoplate et une amplitude restreinte des mouvements de l'épaule, en particulier une adduction limitée de l'articulation gléno-humérale. L'échographie est capable de révéler plusieurs cordons fibreux hypoéchogènes de petit calibre (diamètre <1 cm) orientés le long de l'axe longitudinal du muscle (schéma I), reflétant le stade initial de petits foyers fibreux focaux (Fig. 124) (Huang et al. 2005). Au fur et à mesure que les injections se poursuivent ou que l'anomalie évolue avec le temps, les cordes de petit calibre peuvent fusionner en zones hypoéchogènes plus larges (schéma II) ou même se développer en masses calcifiées (schéma III) (Huang et al. 2005). Dans la maladie avancée, le traitement repose sur la libération distale des cordons fibreux du deltoïde.
Figure 124a,b. Contracture du muscle deltoïde. a Les images américaines longitudinales et b transversales à 12–5 MHz sur l'épaule latérale montrent une zone hypoéchogène irrégulière allongée (astérisques) entourée d'un halo hyperéchogène mal défini (têtes de flèches) dans le tiers médian du muscle deltoïde (flèches) reflétant une fibre sclérotique dense tissu dans la lésion de contracture.
51. CAPSULITE ADHÉSIVE (ÉPAULE GELÉE)
La capsulite adhésive, également appelée «épaule gelée», fait référence à un syndrome insidieux de douleur à l'épaule et de restriction des mouvements en l'absence de conflit avec l'épaule et de blessure à la coiffe des rotateurs. Le patient se plaint généralement de la perte de l'amplitude normale des mouvements de l'épaule, en particulier l'élévation du bras et la rotation externe. Cette condition a tendance à survenir chez les femmes en périménopause et est associée au diabète sucré, à certains traitements médicamenteux (c'est-à-dire l'isoniazide et les barbituriques), à un traumatisme et à une immobilisation prolongée après réduction pour luxation de l'épaule. Bien que la physiopathologie de la capsulite adhésive soit inconnue, une prolifération synoviale hypervasculaire suivie d'un dépôt de collagène et de la formation d'adhérences capsulaires est généralement observée chez ces patients, entraînant une réduction du volume articulaire et, par conséquent, des douleurs et des mouvements articulaires sévèrement restreints. Le traitement comprend la physiothérapie, les injections de stéroïdes et la manipulation fermée en salle d'opération. Dans les cas réfractaires, une hydrodilatation et une capsulotomie antérieure sont indiquées (Gam et al. 1998).
Le diagnostic clinique n'est pas aisé dans les phases précoces. Elle repose sur des constatations physiques et la mise en évidence d'une capacité articulaire réduite à l'arthrographie (capacité articulaire gléno-humérale < 7 ml). Dans les premiers stades, cependant, cette condition peut être difficile à diagnostiquer car elle imite la pathologie de la coiffe des rotateurs et le syndrome de conflit. Bien que l'échographie ne soit pas en mesure de décrire les adhérences ou de mesurer le degré de restriction de la cavité articulaire, l'épaule gelée doit être considérée dans les diagnostics différentiels lorsque la limitation des mouvements de glissement du tendon du sus-épineux sous l'acromion lors de l'abduction du bras ou sa visualisation persistante lors de l'élévation latérale du bras est observée (Ryu et al. 1993). En fait, lors de l'abduction du bras, ces patients ont tendance à élever l'épaule car la rotation de l'humérus est gênée par des adhérences capsulaires. (Fig. 125). D'autres résultats incluent un épaississement des structures des tissus mous dans l'intervalle de la coiffe des rotateurs et une vascularisation accrue illustrée par l'imagerie Doppler couleur autour de la partie intra-articulaire du tendon du biceps et du ligament coracohuméral. (Fig. 126) (Lee et al. 2005). Une légère distension liquidienne de la gaine du tendon du biceps et de la cavité sous-scapulaire est également observée. Néanmoins, ces signes dépendent de l'opérateur et de l'équipement et, pour la plupart, sont difficiles à quantifier. Dans les cas douteux, l'IRM et l'arthrographie IRM sont utiles pour diagnostiquer cette affection (Mengiardi et al. 2004).
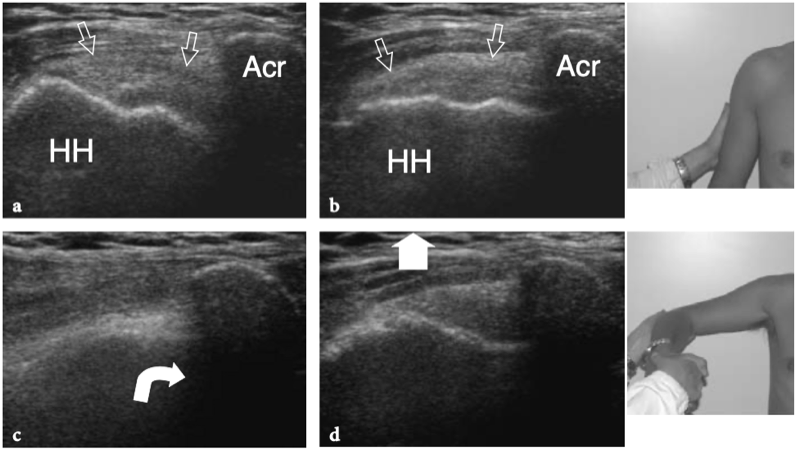
Fig. 125a–d. Capsulite adhésive. Échographie dynamique 12–5 MHz US sur le grand axe des tendons sus-épineux chez un patient atteint de capsulite rétractile gauche. Les images US sont obtenues avec le bras a,b en position neutre et c,d en abduction passive en rotation interne. a,c côté droit ; b,d côté gauche. Avec cette manœuvre, l'échographie permet une visualisation directe des relations entre l'acromion (Acr), la tête humérale (HH) et le tendon sus-épineux intermédiaire (flèches ouvertes) pendant le mouvement actif de l'épaule. Du côté droit sain, le passage (flèche blanche incurvée) du sus-épineux sous l'acromion n'était pas obstrué lors de l'abduction complète de l'épaule. A l'inverse, du côté gauche atteint, le glissement du sus-épineux montrait un blocage brutal lors du mouvement d'abduction. Différent de celui observé dans le syndrome de conflit, le sus-épineux gauche apparaissait normal et le passage tendineux était obstrué brusquement et non progressivement, avec absence d'anomalies des tissus mous sous-acromiaux. Après blocage tendineux, le patient avait tendance à surélever (flèche blanche droite) l'épaule plutôt qu'à enlever le bras. Les inserts sur le côté droit de la figure indiquent le positionnement du transducteur.
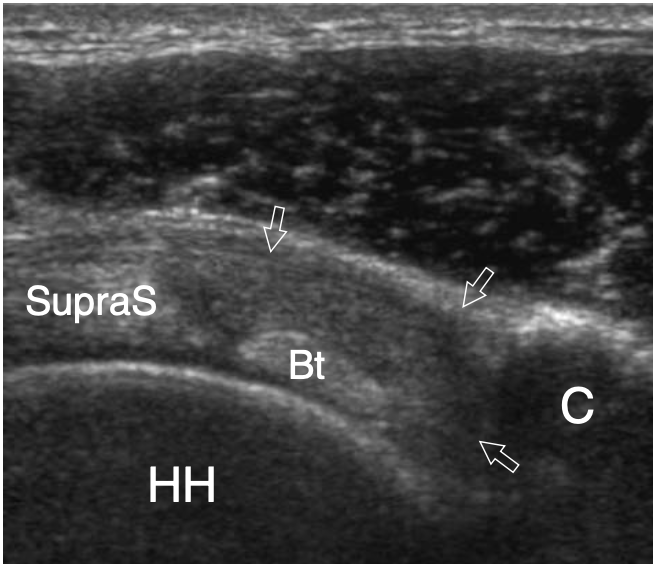
Fig. 126. Capsulite adhésive. Image échographique 12–5 MHz à petit axe sur la partie intra-articulaire du tendon du biceps (Bt) chez un patient diabétique atteint de capsulite rétractile montrant des tissus mous hypoéchogènes homogènes (flèches) remplissant l'espace de l'intervalle de la coiffe des rotateurs et créant les structures ligamentaires de la poulie bicipitale indéfinie. Notez le tendon sus-épineux (SupraS). HH, tête humérale ; C, coracoïde.
52. INSTABILITÉ DE L'ARTICULATION GLÉNO-HUMÉRALE
Bien que la valeur de l'échographie dans l'évaluation de l'instabilité de l'articulation gléno-humérale soit faible, cette technique peut détecter de manière incidente une variété de lésions d'instabilité affectant le bourrelet glénoïdien et l'os (Rasmussen 2004). Dans l'instabilité antérieure de l'épaule, les principaux critères de déchirure antérieure du labrum sont une zone hypoéchogène élargie (> 2 mm) à la base du labrum, une fente hypoéchogène dans un labrum par ailleurs homogène, une forme irrégulière tronquée, érodée, effilochée ou l'absence de le labrum et une motilité anormale du labrum lors de la réalisation d'un balayage dynamique ; l'échogénicité labrale altérée semble être une découverte inexacte (Fig. 127) (Loredo et al. 1995 ; Hammar et al. 2001 ; Schydlowsky et al. 1998b ; Rasmussen 2004). D'autre part, un petit labrum altéré semble indiquer des changements dégénératifs (Schydlowsky et al. 1998c ; Hammar et al. 2001 ; Taljanovic et al. 2000). Chez les patients présentant des luxations antérieures traumatiques aiguës ou récurrentes de l'épaule, l'échographie a une sensibilité rapportée de 88 à 95 % et une spécificité de 67 à 70 % pour le diagnostic des déchirures labrales (Schydlowsky et al. 1998b ; Hammar et al. 2001 ; Rasmussen 2004). Néanmoins, même avec des sondes haut de gamme, le complexe capsulaire antérieur (capsule et ligament gléno-huméral inférieur) ne se distingue pas clairement du labrum antérieur. Bien que certaines tentatives aient été faites pour évaluer l'étanchéité capsulaire lors d'un balayage dynamique, l'échographie semble incapable d'identifier de manière fiable la discontinuité du complexe capsuloligamenteux antérieur en cas d'avulsion traumatique de la capsule à partir de son insertion glénoïdienne, appelée décapage ou cisaillement capsulaire. En revanche, la fragmentation du rebord antéro-inférieur de la glène, représentant une lésion de Bankart, peut parfois être identifiée à l'échographie comme un défaut osseux en forme de V sur la face antérieure de la glène (Hammar et al. 2001). Dans l'ensemble, nous pensons que l'échographie a des limites intrinsèques dans l'évaluation du labrum glénoïdien fibrocartilagineux. Il peut exclure les déchirures du labrum lorsque le labrum semble normal. En cas d'anomalies suspectées, l'arthro-IRM et la tomodensitométrie sont la technique la plus fiable et la plus spécifique pour confirmer une déchirure du labrum en représentant un produit de contraste s'étendant dans le défaut labral.
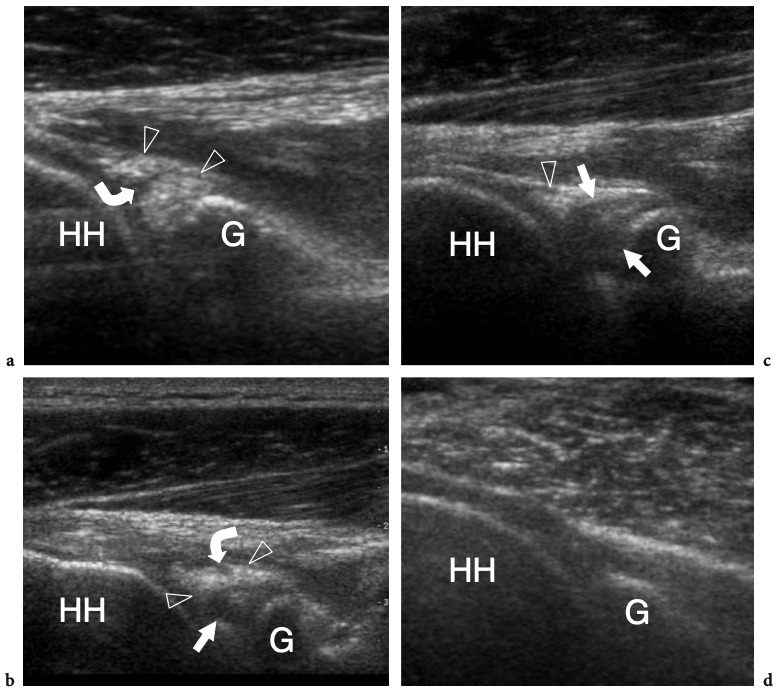
Fig. 127a–d. Déchirures fibrocartilagineuses du labrum : spectre des apparitions américaines. Des images échographiques transversales 12–5 MHz sur la face postérieure de l'articulation gléno-humérale montrent différentes apparences de déchirures postérieures du labrum : a, b fentes hypoéchogènes (flèches) dans un labrum homogène (têtes de flèches) ; c zone hypoéchogène élargie (flèches droites) à la base du labrum (tête de flèche) ; d absence complète du labrum. HH, tête humérale ; G, glène osseuse.
Une technique de numérisation pour documenter la présence, la direction et l'étendue de la translation gléno-humérale a été décrite chez des patients présentant une subluxation ou une luxation postérieure volontaire de l'épaule (Bianchi et al. 1994). Bien que rare, cette affection est souvent méconnue cliniquement et peut être diagnostiquée à tort comme une épaule gelée. Dans cette technique, l'examinateur se tient derrière le patient et acquiert des images transversales sur l'articulation gléno-humérale postérieure. La distance entre la glène osseuse dorsale et la pointe de la tête humérale est mesurée au repos et lors de la subluxation. Le patient est examiné dans différentes positions (neutre, flexion à 90°, abduction et rotation externe), dont celle dans laquelle il perçoit que l'épaule est devenue subluxée. Les distances mesurées sont comparées entre l'épaule atteinte et l'épaule saine : des distances entre 12 et 18 mm sont révélatrices d'une subluxation (Fig. 128). Il est cependant important de souligner que l'évaluation des lésions intra-articulaires associées dépend essentiellement de l'utilisation des modalités d'imagerie à base de contraste (arthro-scanner et arthro-IRM). Dans la luxation postérieure de l'épaule, la relation de la coracoïde (approche antérieure) ou de la surface glénoïdienne postérieure (approche postérieure) avec la tête humérale luxée peut être évaluée et les distances entre ces structures sont mesurées sans nécessiter de rotation ou d'abduction douloureuse du bras. en utilisant les approches antérieure et postérieure (Fig. 129) (Hunter et al. 1998 ; Bize et al. 2003).
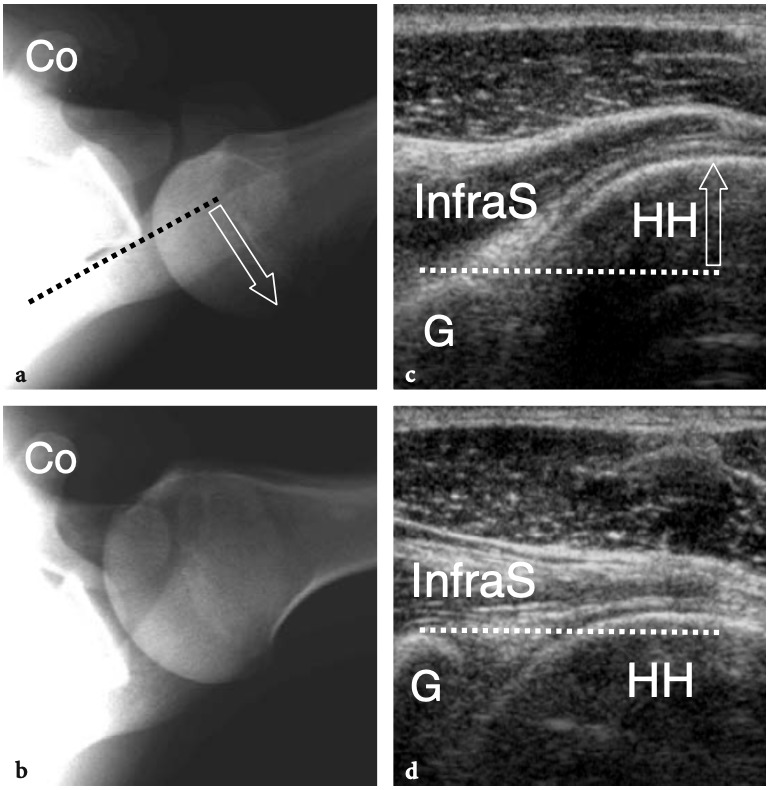
Fig. 128a–d. Subluxation postérieure de la tête humérale. a,b Vues axillaires et c,d images US 12–5 MHz correspondantes sur l'articulation gléno-humérale postérieure chez un patient présentant une instabilité volontaire de l'épaule. a,c Lors de la subluxation, la tête humérale (HH) est plus exposée et positionnée en arrière (flèche) par rapport au niveau de la glène osseuse (G) indiqué par la ligne pointillée. b,d Les mêmes images obtenues après relocalisation volontaire de l'épaule montrent l'apposition exacte de la tête humérale (HH) par rapport à la glène (G). InfraS, tendon sous-épineux ; Co, coracoïde. L'échographie peut aider à confirmer que la subluxation est dans une direction postérieure.
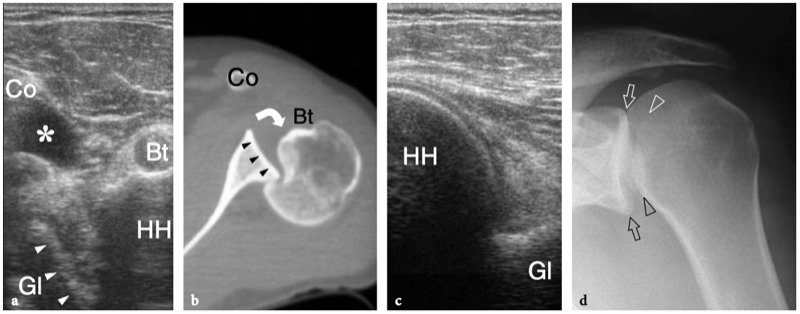
Figures 129a–d. Luxation postérieure de l'épaule. a Image échographique transversale 10–5 MHz sur la face antérieure de l'articulation gléno-humérale avec b scanner correspondant chez un patient présentant des antécédents cliniques de convulsions et une incapacité à bouger le bras montrant un déplacement postérieur (flèche courbe) de la tête humérale (HH ), laissant la surface de la moitié antérieure (têtes de flèches) de la glène (Gl) découverte. Il y a un petit épanchement (astérisque) à l'intérieur de la cavité sous-scapulaire. Notez la distance accrue entre la tête humérale et la coracoïde (Co). Le tendon du biceps (Bt) est normal. c Une image échographique transversale 10–5 MHz sur la face postérieure de l'articulation gléno-humérale révèle une proéminence anormale vers l'arrière de la tête humérale convexe (HH) par rapport à la glène (Gl). d La radiographie corrélative de face montre une luxation postérieure fixe de l'épaule caractérisée par une élévation de la tête humérale, une absence de visibilité de l'interligne glénohuméral et la détection de deux lignes parallèles d'os cortical visibles sur la face médiale de la tête humérale : la médiale (flèches ) correspondant au contour glénoïdien, le latéral (têtes de flèches) à une fracture impactée antérieure.
Les distances mesurées dans l'épaule affectée sont comparées à celles de l'épaule controlatérale (il faut veiller à ne pas mal diagnostiquer une luxation bilatérale) et une différence supérieure à 20 mm indique une luxation (Bianchi et al. 1994). Des mesures quantitatives effectuées au cours d'une échographie dynamique ont également été suggérées pour mesurer la laxité accrue chez les patients présentant une instabilité antérieure et multidirectionnelle de l'épaule (Jerosch et al. 1989 ; Krarup et al. 1999) ainsi que pour évaluer la translation gléno-humérale antérieure et postérieure dans une série sélectionnée. des nageurs (Borsa et al. 2005b) et des lanceurs de baseball professionnels (Borsa et al. 2005c). Sur la base de ces études, l'échographie dynamique semble être un moyen prometteur pour mesurer la laxité articulaire gléno-humérale, remplaçant à cet effet la radiographie de stress (Borsa et al. 2005a).
Une variété de procédures chirurgicales, à la fois ouvertes et arthroscopiques, peuvent être utilisées pour réparer le complexe capsulolabral et pour épaissir et resserrer les ligaments glénohuméraux chez les patients présentant une instabilité glénohumérale post-traumatique (Mohana-Borges et al. 2004). La description détaillée de ces procédures dépasse le cadre de ce chapitre. Dans le cadre postopératoire de l'instabilité gléno-humérale, cependant, les matériaux de suture et les ancres utilisés pour la fixation le long du complexe capsuloligamenteux peuvent être visualisés avec US (Fig. 130).
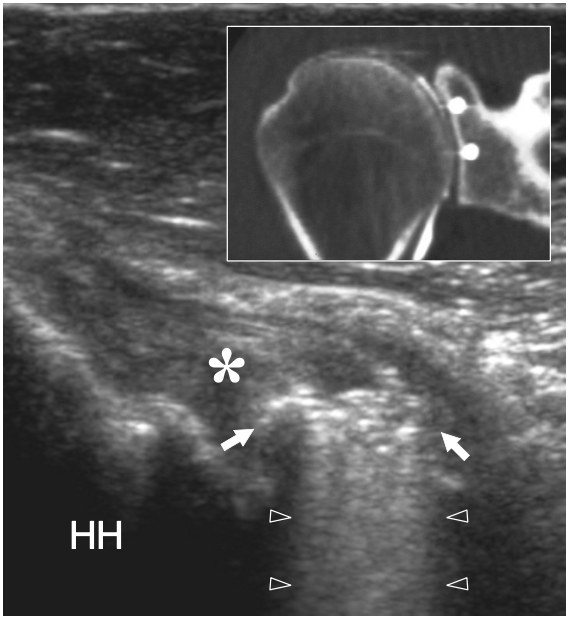
Fig. 130. Réparation des lésions de Bankart. L'image post-chirurgicale 12–5 MHz US sur la face antéro-médiale de l'épaule montre un épaississement des structures capsuloligamenteuses antérieures (astérisque) et des artefacts métalliques (flèches) avec des réverbérations postérieures (têtes de flèches) des ancres de suture dans le quadrant glénoïdien antérieur. HH, tête humérale. Dans l'insert, l'image CT corrélative montre des pistes d'ancrage dans l'os glénoïdien antérieur utilisées pour le rattachement du complexe capsulolabral à la marge glénoïdienne.
53. FRACTURES DE LA TÊTE HUMÉRALE
Malgré ses limites dans l'évaluation des os, l'échographie peut détecter avec précision les traumatismes crâniens huméraux qui accompagnent l'instabilité de l'articulation gléno-humérale, y compris les fractures de Hill-Sachs et McLaughlin et les avulsions des tubérosités. La lésion de Hill-Sachs est une fracture par tassement intra-articulaire déprimée située sur la face postérolatérale de la tête humérale typiquement observée après des épisodes de luxations glénohumérales antérieures. Elle peut être considérée comme une caractéristique de la luxation de l'articulation gléno-humérale antérieure car elle survient chez jusqu'à 47 % des patients après le premier épisode de luxation et jusqu'à 100 % chez les patients atteints d'une maladie récurrente (Resnick et al. 1997). Le mécanisme pathologique de la fracture de Hill-Sachs consiste en une puissante contraction des muscles para-articulaires qui tirent la tête humérale contre le rebord antéro-inférieur de la glène (Calandra et al. 1989 ; Resnick et al. 1997). La taille et la localisation de la fracture doivent être évaluées car un défect important peut favoriser de nouveaux épisodes de luxation. L'échographie a une sensibilité rapportée de 91 à 100 %, une spécificité de 89 à 100 % et une précision globale de 84 à 94 % dans la détection de cette lésion (Farin et al. 1996a ; Pancione et al. 1997 ; Cicak et al. 1998). Pour cela, l'aspect postéro-latéral de l'épaule est examiné avec le transducteur dans des plans transversaux. Profondément au tendon sous-épineux, la tête humérale à ce niveau doit avoir une surface lisse et curviligne. La lésion de Hill-Sachs apparaît généralement comme un défaut peu profond en forme de coin du contour osseux hyperéchogène de la tête humérale au point où la partie antérieure de l'infraspinatus s'insère dans la grosse tubérosité (Jerosch et al. 1990) (Fig. 131).
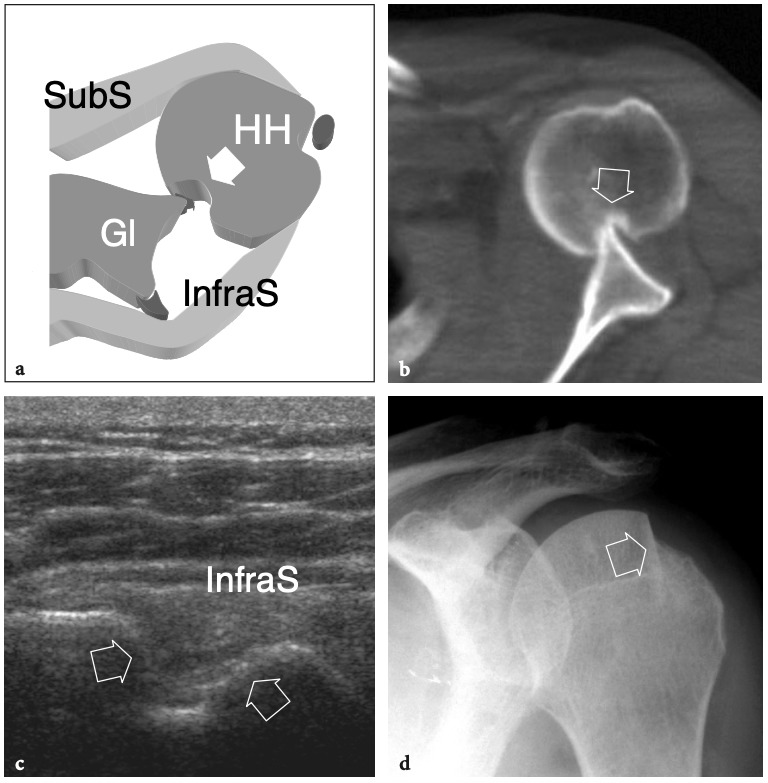
Fig. 131a–d. Fracture de Hill-Sachs. a Le dessin schématique d'une vue transversale à travers l'épaule avec b corrélation CT illustre le mécanisme pathogénique conduisant à la formation d'une fracture de Hill-Sachs (flèche). Cette fracture par tassement est typiquement localisée sur la face postérolatérale de la tête humérale (HH) résultant d'épisodes d'instabilité glénohumérale antérieure. Gl, glène ; InfraS, sous-épineux ; SubS, sous-scapulaire. c L'image échographique transversale 12–5 MHz obtenue sur la face postérieure de l'épaule chez un patient présentant une instabilité antérieure récurrente de l'épaule révèle un défaut rainuré large, profond et irrégulier (flèches) de la tête humérale reflétant la fracture. InfraS, tendon sous-épineux. d La radiographie standard en rotation interne montre un large défect postérolatéral de la tête humérale (flèche).
Sa taille et sa forme peuvent être évaluées avec précision par US. L'examen dynamique avec rotation de va-et-vient permet de juger si la lésion atteint la cavité glénoïdienne lors du mouvement et dans quelle mesure le mouvement du membre est gêné. Il est important d'éviter la confusion entre les érosions plus petites et superficielles qui se produisent couramment dans la tendinopathie de la coiffe des rotateurs et une véritable lésion de Hill-Sachs. Habituellement, ce dernier entre en contact avec le bord dorsal de la glène à 10–20° de rotation externe. Aussi, il faut veiller, du moins par le débutant, à ne pas méconnaître l'enfoncement normal du col huméral (zone dénudée) situé sur un plan plus caudal pour une fracture de Hill-Sachs (Bouffard et al. 2000). De même, dans le cadre d'une luxation postérieure de l'épaule, une fracture de la partie antérieure de la tête humérale peut survenir suite à son impact contre la face postérieure du rebord glénoïdien. Cette lésion est communément appelée « lésion inversée de Hill-Sachs » ou fracture de McLaughlin. Chez ces patients, les radiographies standard de face montrent deux lignes parallèles d'os cortical la face médiale de la tête humérale, la latérale correspondant au bord de la fracture impactée antérieure. Cette ligne, appelée « ligne de creux », est créée lorsque la face antérieure de la tête humérale heurte le rebord postérieur de la glène lors de la luxation. Le diagnostic de luxation postérieure de l'articulation gléno-humérale est souvent retardé et cette fracture peut être radiographiquement insoupçonnée à moins que des projections supplémentaires (c'est-à-dire une vue axillaire) ne soient réalisées. L'échographie peut démontrer la lésion de Hill-Sachs inversée comme un défaut osseux sur la face antérieure de la tête humérale située en dedans de la petite tubérosité et en profondeur du tendon du sous-scapulaire (Fig. 132). Cette lésion doit être recherchée avec le bras du patient en rotation externe car en position neutre la fracture peut être masquée par la coracoïde.
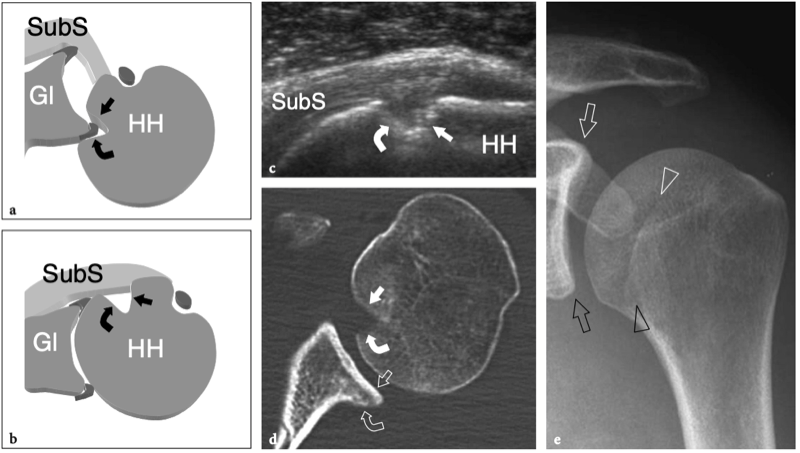
Figures 132a–e. Fracture McLaughlin. a,b Les dessins schématiques d'une vue transversale à travers l'épaule illustrent le pathomécanisme conduisant à la formation d'une fracture de McLaughlin (flèches). a Position verrouillée et b déverrouillée de la tête humérale (HH). SubS, tendon du sous-scapulaire ; Gl, glène. Opposée en site à la fracture de Hill-Sachs, la fracture de McLaughlin est située sur la face antéro-médiale de la tête humérale à la suite de l'impaction de l'humérus contre le bord antérieur de la fosse glénoïdienne dans le cadre d'une instabilité gléno-humérale antérieure. c Une image échographique transversale 12–5 MHz obtenue sur le tendon sous-scapulaire (SubS) avec une tomodensitométrie d corrélative montre la fracture comme un défaut en forme de coin (flèches blanches) dans la face antéro-médiale de la tête humérale (HH). Comme on le voit au scanner, il existe une correspondance biunivoque entre la forme du défect huméral (flèches blanches) et le bord postérieur de la glène (flèches vides). La radiographie antéropostérieure montre une tête humérale déverrouillée chez un patient avec une fracture de McLaughlin. Notez la ligne de creux (pointes de flèche) sur la face médiale de la tête humérale. Elle est légèrement incurvée et rappelle étroitement la forme du bord glénoïdien (flèches).
Des lésions d'avulsion des tubérosités peuvent également se rencontrer dans l'instabilité de l'épaule. Les fractures du tubercule majeur sont les plus fréquentes et résultent d'une force de traction excessive exercée par le sus-épineux sur son insertion osseuse. L'examinateur doit être conscient que ces fractures peuvent également être secondaires à un coup direct sur l'épaule et qu'elles sont souvent manquées sur les radiographies standard. Ainsi, dans un contexte post-traumatique, l'examen échographique de l'épaule doit inclure une recherche minutieuse des irrégularités osseuses du trochiter, même en présence de radiographies antérieures normales. Lorsqu'elles ne sont pas déplacées, ces fractures se présentent comme une double discontinuité de l'os cortical située au niveau de l'échancrure entre la tête humérale et le trochiter (col huméral) et sur le versant externe du trochiter, souvent à la jonction de la diaphyse humérale et du trochiter. col anatomique de l'humérus, suggérant un fragment surélevé (Fig. 133) (Patten 1992). Dans les fractures déplacées, le fragment soulevé peut être incliné ou se chevaucher, et le tendon du sus-épineux en continuité avec lui apparaît anormalement épaissi et hétérogène en raison de l'œdème et de la contusion. (Fig. 134). Dans ces cas, la visualisation d'un défect bien délimité à la surface du trochiter peut éviter les erreurs de diagnostic avec une tendinite calcifiante. Les fractures-avulsion du petit tubercule peuvent également être trouvées dans les luxations postérieures de l'épaule à la suite d'une traction sous-scapulaire. (Fig. 135) (Ross et al. 1989; Martinoli et al. 2003). Dès qu'une éventuelle fracture des tubérosités est découverte, des clichés radiographiques complémentaires, notamment sous contrôle fluoroscopique, doivent être obtenus pour confirmer les résultats échographiques.
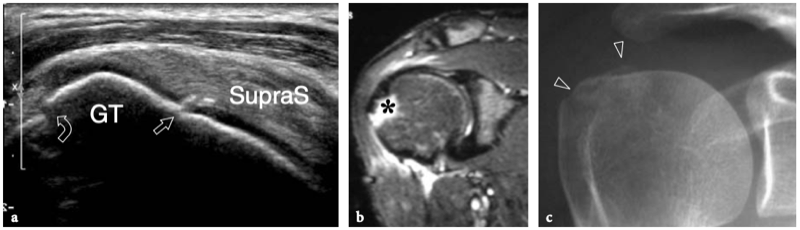
Figures 133a–c. Fracture du tubercule majeur peu déplacée. une image échographique grand axe 17–5 MHz sur le tendon sus-épineux (SupraS) chez un patient présentant une instabilité antérieure montre une double discontinuité de la surface humérale hyperéchogène au niveau de l'encoche entre la tête humérale et le tubercule majeur (flèche droite) et sur le pente externe (flèche courbe) du tubercule majeur (GT), évoquant une fracture non déplacée du tubercule majeur. Le film ordinaire initial était négatif. b La corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse coronale oblique montre un signal hyperintense (astérisque) au niveau de la grosse tubérosité reflétant un œdème médullaire post-traumatique. c Une radiographie de suivi réalisée 3 mois plus tard révèle de subtiles modifications osseuses (têtes de flèches) autour du tubercule majeur reflétant la guérison de la fracture.
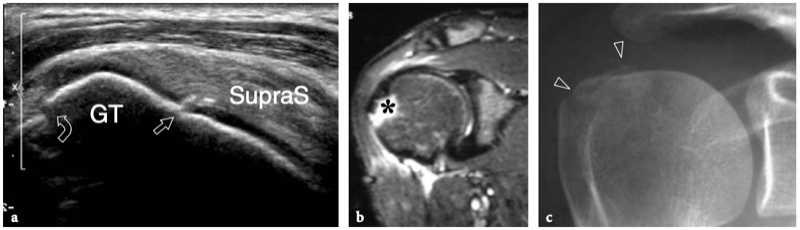
Figure 134a,b. Fracture du tubercule majeur : spectre des apparitions américaines. a,b Images échographiques grand axe 12–5 MHz sur le tendon sus-épineux chez deux patients présentant respectivement a une fracture non déplacée et b une fracture angulée du tubercule majeur. En a, une élévation subtile et une fragmentation de la couche la plus superficielle (têtes de flèches ouvertes) du cortex osseux (têtes de flèches blanches) du trochiter créent deux lignes parallèles hyperéchogènes (têtes de flèches blanches et ouvertes) résultant d'un traumatisme aigu récent de traction par le tendon supraspinatus (SupraS). En b, une fracture-avulsion résultant de l'insertion du tendon sus-épineux est observée, juste en aval de la surface articulaire humérale. Comparer la discontinuité de la surface humérale hyperéchogène au niveau du col huméral (flèche droite) et sur la pente externe (flèche courbe) du trochiter avec la fracture non déplacée illustrée à la figure 6.133a. Le fragment de fracture est incliné et tourné après traction par le tendon intact du sus-épineux (SupraS).
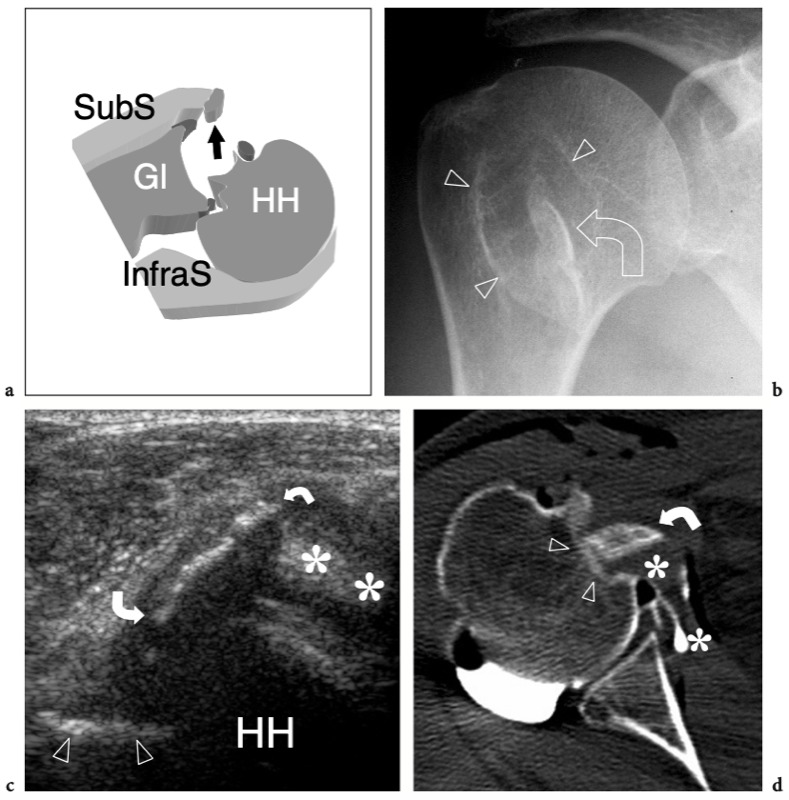
Fig. 135a–d. Fracture du petit tubercule. un dessin schématique d'une vue transversale à travers l'épaule illustre le mécanisme pathologique lié à la fracture par avulsion (flèche) de la petite tubérosité. Dans sa forme isolée, cette fracture résulte de la combinaison d'une luxation postérieure de l'épaule et d'une traction du tendon sous-scapulaire (SubS). Gl, glène ; HH, tête humérale ; InfraS, tendon sous-épineux. b La radiographie antéropostérieure montre un fragment bordé lisse orienté verticalement (flèche incurvée) surélevé au-dessus de la face antérieure de la tête humérale, reflétant la petite tubérosité avulsée. Le nidus d'avulsion est large et apparaît comme un halo radiotransparent (têtes de flèches) entourant le fragment de fracture. c Image échographique transversale 12–5 MHz au-dessus de l'épaule antéro-médiale chez un patient présentant une instabilité postérieure avec corrélation d arthro-TDM montrant une large tache osseuse (flèche courbe) avulsée de la tête humérale (HH). Notez le défect profond (têtes de flèches) sur la face antérieure de l'humérus et la continuité de l'os avulsé avec le tendon sous-scapulaire (astérisques).
54. ARTHROPATHIES DÉGÉNÉRATIVES ET CORPS MOBILES
L'arthrose dégénérative de l'articulation gléno-humérale peut être idiopathique ou secondaire à une rupture massive ancienne de la coiffe des rotateurs. Bien que les radiographies simples soient la base du diagnostic, l'examinateur doit se familiariser avec l'aspect américain de l'arthrose de l'épaule afin de reconnaître cette affection même en l'absence d'une étude radiographique préalable. Les principaux résultats de l'échographie comprennent le rétrécissement de l'espace articulaire, les ostéophytes et les corps lâches intra-articulaires. Les ostéophytes huméraux sont plus proéminents sous forme d'une sorte de « couronne » autour de la jonction cartilage-os (col huméral), tandis que les ostéophytes glénoïdiens sont moins visibles et plus difficiles à identifier. Aux États-Unis, ils apparaissent comme des éperons osseux hyperéchogènes provenant de la surface de l'articulation qui sont généralement recouverts d'un mince rebord hypoéchogène de cartilage. (Fig. 136). Un épanchement intra-articulaire et, dans les cas plus graves, une hypertrophie synoviale réactive peuvent être détectés.
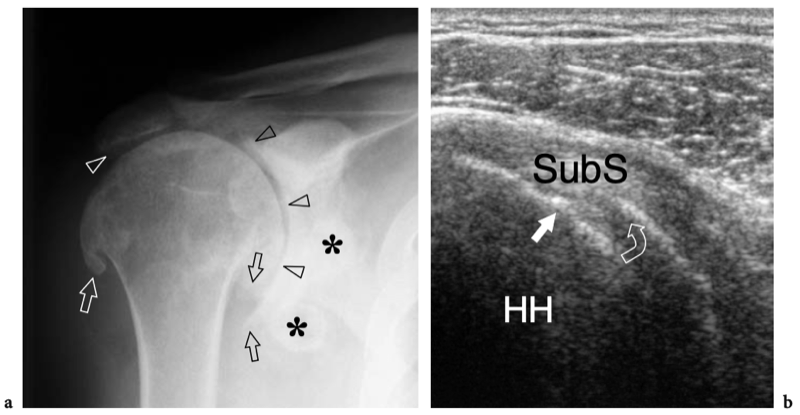
Figure 136a,b. Arthrose articulaire gléno-humérale. une vue antéropostérieure montre des signes radiographiques typiques d'une maladie avancée, y compris un rétrécissement de l'espace articulaire, des ostéophytes (flèches) le long des marges articulaires de la tête humérale et de la marge inférieure de la glène, une translation vers le haut de la tête humérale avec un espace sous-acromial réduit (tête de flèche blanche) , sclérose sous-chondrale diffuse (têtes de flèches noires) et multiples corps ostéochondraux intra-articulaires (astérisques). b Une image US transversale 12–5 MHz au-dessus de l'épaule antéro-médiale montre un ostéophyte (flèche incurvée) se projetant juste en profondeur sur le tendon sous-scapulaire (SubS). Notez les irrégularités (flèche droite) dans le profil cortical du cortex huméral. HH, tête humérale.
Les corps lâches intra-articulaires sont le résultat final de la désintégration progressive du cartilage articulaire et de l'os sous-chondral qui conduit à la libération de fragments dans la cavité articulaire. Alors que les fragments osseux sont avasculaires et se nécrose, les fragments cartilagineux peuvent grossir car ils sont nourris par le liquide synovial. Les corps lâches restent généralement piégés dans les parties les plus dépendantes de l'articulation gléno-humérale, y compris la poche axillaire, la gaine du tendon du biceps, l'évidement gléno-huméral postérieur et certains évidements de la bourse (c'est-à-dire la bourse latérale sous-coracoïdienne) qui communiquent avec la cavité articulaire en conséquence d'une déchirure de la coiffe des rotateurs (Fig. 137). La plupart des corps lâches intra-articulaires apparaissent comme des images hyperéchogènes avec ombrage acoustique postérieur (Fig. 138).
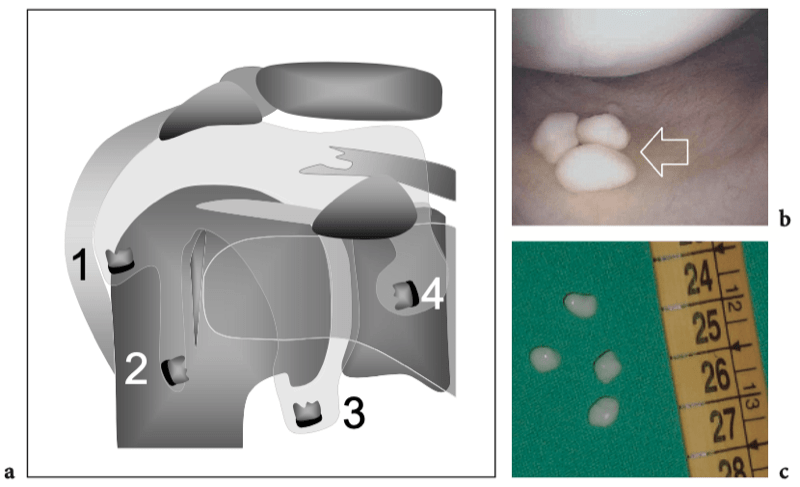
Figures 137a–c. Corps lâches intra-articulaires. un dessin ic d'une vue coronale à travers l'épaule illustre les poches dépendantes d'une cavité glénohumérale-bursale communicante où les corps lâches sont plus fréquemment trouvés. Ce sont : le récessus latéral de la bourse (1), la gaine tendineuse du biceps (2), le récessus axillaire (3) et la bourse sous-coracoïdienne (4). b,c Aspect brut de certains petits corps étrangers intra-articulaires b en vue arthroscopique et c photographiés après ablation arthroscopique.
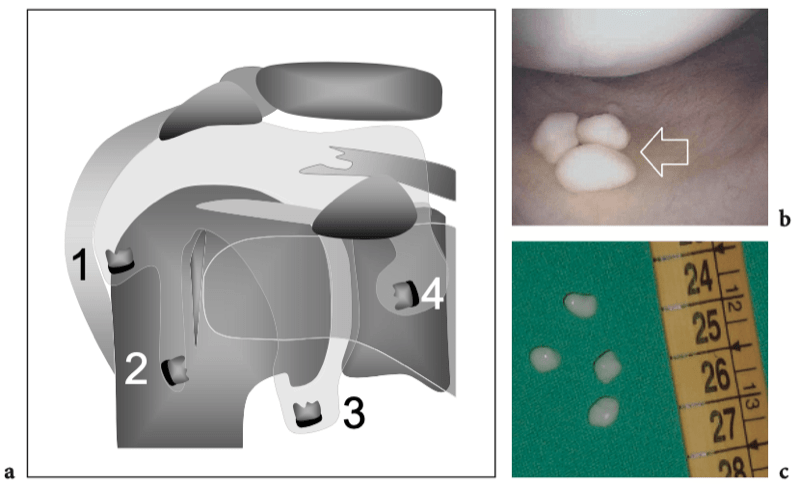
Figures 138a–e. Corps lâches intra-articulaires. a Vue antéropostérieure de l'épaule chez un patient atteint d'arthrose gléno-humérale avancée montrant de multiples corps libres situés dans la gaine du tendon du biceps dépendant (1), le récessus axillaire (2) et la bourse sous-coracoïdienne (3). b Image échographique transversale 12–5 MHz sur la face antéro-médiale de l'épaule montrant de multiples corps étrangers calcifiés (flèches) dans le récessus sous-coracoïdien. La présence de liquide hypoanéchoïque montre la localisation intraboursière des corps étrangers. c Image échographique longitudinale 12–5 MHz sur la longue portion du tendon du biceps (têtes de flèches) révèle un corps lâche (flèche) logé à l'intérieur de la gaine synoviale (astérisque). d L'IRM transversale pondérée en T1 et la corrélation de la tomodensitométrie e sur la gaine du tendon du biceps montrent les relations de deux fragments ostéochondraux calcifiés (flèches droites) avec le tendon du biceps (flèche courbe).
Dans certains cas, cependant, une couche de cartilage hypoéchogène peut être identifiée sur l'interface échogène correspondant à l'os sous-chondral (Bianchi et Martinoli 1999). La taille et la position des fragments peuvent être déterminées de manière fiable par US. Leur nombre exact, en revanche, ne peut être établi avec certitude. L'estimation de la taille des corps étrangers est importante avant de planifier une chirurgie arthroscopique car les fragments trop volumineux ne peuvent pas être retirés sous arthroscopie et peuvent rendre la procédure difficile et longue. Cependant, une telle évaluation peut également être problématique en utilisant des radiographies standard, car la partie non ossifiée du fragment conduit à une sous-estimation de sa taille réelle. La différenciation entre les corps étrangers secondaires à l'arthrose, aux traumatismes et à l'ostéochondromatose repose principalement sur les résultats cliniques et radiographiques. En général, la détection par échographie d'innombrables corps lâches de taille presque égale sans rétrécissement de l'espace articulaire reflète plus probablement une ostéochondromatose, alors que l'identification d'un seul fragment ou de quelques fragments de taille et d'apparence différentes est plus probablement associée à un processus lié à l'arthrose ou à un traumatisme post-traumatique. nature (Campeau et Lewis 1998). Dans l'ostéochondromatose synoviale idiopathique, la tranche d'âge des patients atteints est large mais, dans la plupart des cas, l'apparition de la maladie survient dans la quatrième ou la cinquième décennie. Les hommes sont plus fréquemment touchés que les femmes. Aux États-Unis, différents schémas peuvent être notés selon que les corps étrangers contiennent du cartilage seul, du cartilage et de l'os ou de l'os mature. (Fig. 139a, b). Lorsqu'ils sont entièrement cartilagineux (chondromatose synoviale), les nodules intra-articulaires sont hypoanéchogènes et difficiles à distinguer des épanchements environnants. De plus, les masses cartilagineuses de la chondromatose synoviale peuvent être difficiles à différencier des « corps de riz », qui sont observés chez les patients atteints de polyarthrite rhumatoïde chronique ou de tuberculose (Mutlu et al. 2004). Aux États-Unis, les corps de riz peuvent apparaître sous forme de sphérules hypoanéchoïques de quelques millimètres de taille (Fig.139c,d).
Figures 139a–d. Corps intra-articulaires : spectre des apparitions américaines. a,b Ostéochondromatose synoviale primaire. Une image US transversale 12–5 MHz sur la bourse sous-acromiale sous-deltoïdienne avec une corrélation d'imagerie IRM pondérée en T2 montre de multiples petits nodules hyperéchogènes à faible intensité de signal (têtes de flèches) remplissant une bourse distendue (flèches), compatibles avec une ostéochondromatose synoviale. c,d Corps de riz chez un patient atteint de polyarthrite rhumatoïde. c Les images coronales et d transversales 12–5 MHz obtenues respectivement sur la poche latérale et la partie dépendante antérieure de la bourse sous-acromiale sous-deltoïdienne montrent de multiples défauts de remplissage arrondis hypoéchogènes (têtes de flèches) dans une bourse enflammée et élargie (flèches blanches) reflétant les corps de riz. Un léger épanchement est observé dans la gaine du tendon du biceps (flèche ouverte).
Ils peuvent remplir la bourse sous-deltoïdienne et, dans la plupart des cas, se distinguent difficilement du pannus synovial hypoéchogène adjacent en raison d'une échogénicité similaire. La pathogenèse des corps de riz est différente de celle des corps lâches. Aux derniers stades de la polyarthrite rhumatoïde, les corps de riz semblent provenir d'une inflammation articulaire chronique entraînant la formation de villosités synoviales allongées qui se recouvrent ensuite de fibrine et peuvent se détacher, produisant des grains de fibrine similaires au riz poli (Law et al. 1998 ; Reid et al. 1998). Avec l'âge, les corps du riz subissent un certain degré d'organisation et peuvent contenir un noyau de collagène mature. L'identification des corps de riz est cliniquement pertinente car ils sont une raison persistante de l'inflammation synoviale continue. Leur retrait est généralement associé à une amélioration clinique (Propert et al. 1982).
Parmi les arthropathies dégénératives qui impliquent généralement l'épaule, il existe une variété d'affections liées aux maladies de dépôt de cristaux, notamment l'ostéodystrophie rénale, le syndrome lait-alcali, l'hypervitaminose D et le soi-disant « syndrome de l'épaule de Milwaukee ». Cette dernière affection, également connue sous le nom d'arthrite destructrice associée à l'apatite, d'épaule hémorragique ou d'arthrite destructrice rapide de l'épaule, consiste en une déchirure massive de la coiffe des rotateurs, des modifications arthrosiques, un épanchement articulaire non inflammatoire taché de sang contenant des cristaux d'hydroxyapatite de calcium et de pyrophosphate de calcium dihydraté, hyperplasie synoviale et destruction extensive du cartilage et de l'os sous-chondral (Llauger et al. 2000). Les ostéophytes ne sont pas caractéristiques du syndrome de Milwaukee. Cette arthropathie destructrice touche le plus souvent les patients âgés, majoritairement des femmes, et se manifeste cliniquement par une arthrite destructrice et progressive rapide de l'épaule avec douleur localisée, gonflement, limitation variable des mouvements articulaires et instabilité articulaire. Occasionnellement, il y a rupture de la capsule de l'épaule avec écoulement de liquide taché de sang dans les tissus mous para-articulaires pendant des semaines ou des mois (Fig. 140).
Figure 140a-c. Épaule de Milwaukee. une radiographie antéropostérieure de l'épaule montre des modifications dégénératives avancées de l'articulation gléno-humérale associées à une migration vers le haut de la tête humérale (flèche) liée à une déchirure de la coiffe des rotateurs et à une pseudoarthrose (tête de flèche) entre l'humérus, la coracoïde et l'acromion avec une sclérose osseuse sous-chondrale légère et peu d'ostéophytose. Notez les dépôts calcifiants dans la partie latérale dépendante de la bourse (flèche courbe). b L'image coronale 12–5 MHz US obtenue latéralement à l'acromion révèle une bursite sous-deltoïdienne étendue avec des frondes synoviales proéminentes et des signes de rupture de la bourse dans le tissu sous-cutané (flèches). c La photographie de l'épaule gauche montre un gonflement diffus et des ecchymoses liés au drainage de liquide sanguinolent dans les tissus mous para-articulaires.
Radiographiquement, cette affection ressemble à une arthropathie de type neuropathie avec tête humérale haute. Une pseudoarthrose entre la tête humérale, la coracoïde et l'acromion est fréquente (Nguyen 1996). Bien que l'échographie soit en mesure de mettre en évidence une distension marquée de l'espace articulaire par épanchement et débris échogènes reflétant une prolifération synoviale et des caillots sanguins, des dépôts calcifiés, une destruction du cartilage et une ostéolyse de l'os sous-chondral, elle n'est pas fiable pour différencier ce trouble du plus arthrose courante liée à la maladie de la coiffe des rotateurs. Le traitement comprend des médicaments analgésiques et des arthrocentèses répétées suivies d'une administration intra-articulaire de stéroïdes. En cas de maladie avancée, une arthroplastie de l'épaule peut être envisagée. Chez les patients atteints de chondrocalcinose, l'échographie peut mettre en évidence un dépôt de cristaux de pyrophosphate dans le cartilage de la tête humérale (Peetrons et al. 2001). Ces dépôts apparaissent sous la forme d'une ligne hyperéchogène floue sur le bord externe de la surface du cartilage (Fig. 141).
Figure 141a,b. Chondrocalcinose. a Image coronale oblique 12–5 MHz US sur le tendon sus-épineux avec corrélation radiographique b montre un continuum de fines taches hyperéchogènes (flèches) situées en série dans le cartilage articulaire hypoéchogène de la tête humérale (HH), reflétant la maladie de dépôt de cristaux de pyrophosphate de calcium dihydraté .
Un épaississement grossièrement échogène de la synoviale, particulièrement important dans la bourse sous-acromiale sous-deltoïdienne, des nodules para-articulaires dans les tissus mous entourant la coiffe et des érosions osseuses profondes peuvent être observés dans l'arthropathie de l'épaule liée à la dialyse reflétant le dépôt amyloïde de ß2-microglobuline, qui est un protéine amyloïde qui n'est pas filtrée par les membranes de dialyse standard (Kay et al. 1992; Sommer et al. 2002; Cardinal et al. 1996; Llauger et al. 2000; Slavotinek et al. 2000). Les caractéristiques américaines de l'amylose de l'épaule sont variées et peuvent inclure une coiffe des rotateurs hétérogène et épaissie, impliquant en particulier les tendons sus-épineux et sous-scapulaire (McMahon et al. 1991 ; Malghem et al. 1996). Sur la base de ces résultats, l'échographie offre un diagnostic précoce et devrait être un outil utile pour suivre la maladie. Chez ces patients, des calcifications para-articulaires sont souvent observées à la suite d'un déséquilibre calcium-phosphore.
55. ARTHROPATHIES INFLAMMATOIRES
En raison d'une atteinte généralisée des tissus synoviaux, la polyarthrite rhumatoïde affecte généralement l'articulation gléno-humérale en association avec l'articulation acromio-claviculaire et les bourses synoviales autour de l'épaule. Radiographiquement, la polyarthrite rhumatoïde peut provoquer un rétrécissement uniforme de l'espace articulaire, des érosions marginales, des érosions du trochiter, des ostéophytes, un aplatissement de la cavité glénoïdienne et une sclérose des surfaces d'appui de la glène et de l'humérus et un pseudo-élargissement de l'articulation acromio-claviculaire lié à la réabsorption de la extrémité distale de la clavicule (Illustration 142a). L'échographie s'est avérée capable de révéler une synovite à la fois aux stades précoces de la maladie, lorsqu'aucun changement radiographique n'est encore évident (Alasaarela et Alasaarela 1994 ; Chhem 1994 ; Alasaarela et al. 1997 ; Gibbon et Wakefield 1999), et dans une population asymptomatique atteinte d'arthrite. épaule (Naranjo et al. 2002). Cette technique est utilisée pour l'évaluation de l'arthrite de la ceinture scapulaire dans le but d'évaluer quelle cavité synoviale est impliquée dans le processus inflammatoire, de différencier l'épanchement du pannus synovial et d'évaluer l'étendue de cette implication, ainsi que de détecter les érosions osseuses subtiles qui ne peut pas être visualisé sur des radiographies standard (Fig.142b) (Vitesse et Hazleman 1999). Dans un groupe sélectionné de patients présentant une maladie symptomatique, l'évaluation américaine de la synovite a démontré que la bursite sous-deltoïdienne sous-acromiale était la constatation la plus fréquente, survenant dans jusqu'à 69 % des cas, suivie d'une atteinte de l'articulation gléno-humérale dans 58 % des cas et d'une tendinite du biceps dans 57 % (Alasaarela et al. 1998a).
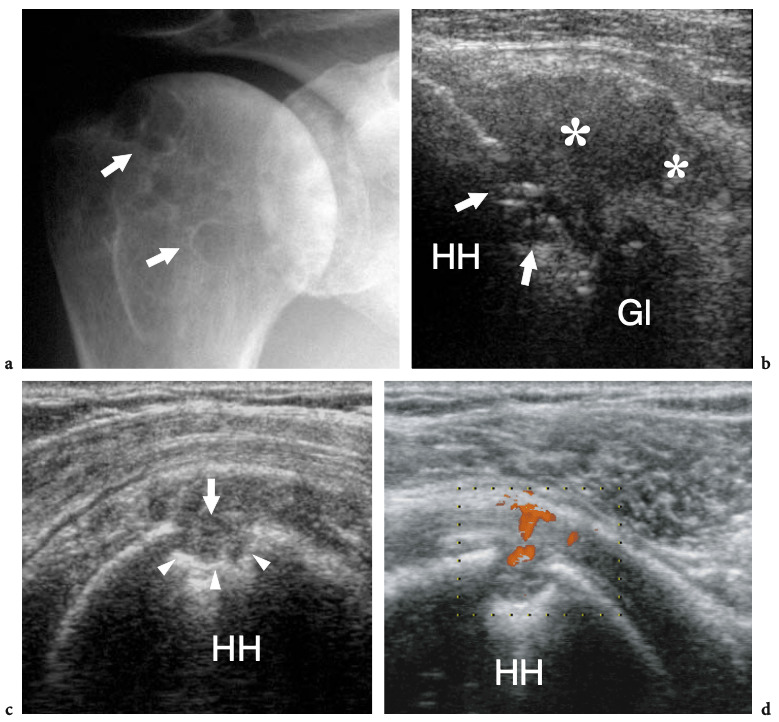
Fig. 142a–d. La polyarthrite rhumatoïde. a Radiographie antéropostérieure chez un patient atteint d'une maladie ancienne montrant des érosions marginales confluentes et des kystes sous-chondraux (flèches) dans la tête humérale. b Une image US transversale 12–5 MHz sur l'épaule postérieure révèle une masse hypoéchogène des tissus mous (astérisques) représentant le pannus synovial dans le récessus postérieur. A cette constatation s'ajoutent des irrégularités de la face postérieure de la tête humérale (HH), compatibles avec des érosions osseuses (flèches). Gl, glène. c,d Transverse c niveaux de gris et d images Doppler couleur 12–5 MHz US sur la face antérieure de la tête humérale (HH) montrent une érosion corticale arrondie bien définie (têtes de flèches) remplie de pannus synovial hypervasculaire (flèche).
Dans l'ensemble, aucune corrélation n'existe entre ces résultats et la durée ou le stade de la maladie. Une évaluation quantitative de la synovite peut être tentée en mesurant la plus grande distance entre la tête humérale et la capsule articulaire dans la poche axillaire et les cavités postérieures (Alasaarela et Alasaarela 1994 ; Alasaarela et al. 1998a ; Koski 1989, 1991). Des difficultés peuvent survenir avec l'échographie lorsqu'on essaie de distinguer l'épanchement du pannus dans la cavité postérieure, car la compression graduée avec la sonde n'est pas toujours en mesure d'extraire le liquide de ce site. De plus, lorsqu'une pression est appliquée sur le pannus, celui-ci peut être mobilisé de la même manière que le liquide articulaire. Les systèmes Doppler peuvent être utiles pour évaluer l'activité du processus inflammatoire en montrant le flux sanguin hyperémique dans le tissu synovial (Alasaarela et Alasaarela 1994). Dans la gaine du tendon du biceps, le flux hyperémique est davantage détecté dans la polyarthrite rhumatoïde que chez les patients atteints d'une maladie dégénérative (Strunk et al. 2003). La fiabilité de ces résultats semble cependant trop limitée pour une évaluation objective, en particulier lorsque l'imagerie Doppler est utilisée comme indicateur de la réponse au traitement. Il est possible que l'agent de contraste US joue un rôle dans ce domaine (Wamser et al. 2003). La perte de définition et l'amincissement du cartilage articulaire peuvent également être démontrés dans une maladie avancée. En ce qui concerne les surfaces osseuses, l'échographie est capable de révéler des érosions comme des défauts corticaux bien définis comblés par des pannus hypoéchogènes : ils peuvent être isolés, confluents ou généralisés. (Fig.142c,d) (Alasaarela et al. 1998b ; Gibbon et Wakefield 1999 ; Hermann et al. 2003). Comme mentionné précédemment, l'échographie est utile lors de l'obtention d'un échantillon de liquide ou de synoviale car elle peut identifier le site de ponction idéal (où le liquide s'accumule davantage ou le pannus est plus épais) et peut fournir des conseils faciles pour diriger l'aiguille. L'injection intra-articulaire de corticoïdes ou le test de lidocaïne peuvent être réalisés sous contrôle échographique, évitant ainsi les risques d'injection intra-tendineuse intempestive de stéroïdes ou d'injections para-articulaires d'anesthésique. Dans ces circonstances, la procédure de placement de l'aiguille est plus précise et moins douloureuse sous contrôle américain que lorsqu'elle est effectuée à l'aveugle. Les structures impliquées dans le processus inflammatoire de la polymyalgie rhumatismale ont également été étudiées par échographie (Lange et al. 1998 ; Koski 1992 ; Cantini et al. 2001). La plupart des études rapportent une fréquence de bursite (14–16 %) inférieure à celle de la synovite gléno-humérale (57–66 %) dans cette pathologie (Lange et al. 1998 ; Koski 1992).
56. ARTHROPLASTIE DE L'ÉPAULE
L'arthroplastie gléno-humérale est devenue la procédure de choix pour traiter les patients souffrant de douleurs et de lésions articulaires qui ne répondent pas au traitement conservateur. Quelle que soit la maladie sous-jacente (par exemple, arthrose, polyarthrite rhumatoïde, arthropathie de la coiffe des rotateurs, nécrose avasculaire, fractures humérales proximales), la procédure est réalisée pour soulager la douleur et améliorer l'amplitude des mouvements de l'épaule. La prothèse est composée d'une tige métallique à tête humérale modulaire qui s'articule soit avec la glène native (hémiarthroplastie d'épaule), soit avec une pièce glénoïdienne en polyéthylène ou en métal (arthroplastie totale d'épaule) (Taljanovic et al. 2003). Les prothèses d'épaule inversées sont également obtenues en inversant la position de la boule (implantée sur la glène) et de l'emboîture (implantée sur la tête humérale). De nombreux types d'appareils sont disponibles. Les critères de sélection d'un type donné dépendent de l'état du patient, de la préférence du chirurgien et de l'expérience du chirurgien, et sortent du cadre de ce chapitre. Les principales complications de l'arthroplastie de l'épaule sont le descellement, la migration supérieure, la subluxation ou la luxation de la tête humérale et la rupture postopératoire de la coiffe des rotateurs. Après arthroplastie de l'épaule, l'IRM a un intérêt limité en raison de l'artefact créé par l'implant métallique. L'échographie s'est avérée capable de fournir des informations sur les tissus mous para-articulaires et la coiffe des rotateurs après arthroplastie de l'épaule, en particulier en cas de mauvais résultat postopératoire et d'absence de signes radiographiques de descellement et de migration (Westhoff et al. 2002 ; Sofka et Adler 2003) . Dans ce cadre, la quincaillerie métallique du composant huméral de la prothèse est facilement mise en évidence, permettant de reconnaître les repères suivants disposés en série : acromion, composant huméral, tubérosité majeure (Sofka et Adler 2003). La prothèse elle-même ne gêne pas l'examen de la coiffe des rotateurs. Sa composante métallique apparaît comme une interface échogène linéaire avec un artefact de réverbération postérieur modéré. L'examinateur doit se rappeler qu'une atrophie musculaire régionale modérée à sévère - impliquant souvent le deltoïde et le petit rond - est fréquemment rencontrée chez les patients qui ont subi une arthroplastie de l'épaule et que le tendon du sous-scapulaire (mais pas le sus-épineux) a souvent été retiré de la petite tubérosité. pour permettre un accès chirurgical (voie delto-pectorale). Après mise en place de la prothèse, le tendon du sous-scapulaire est généralement réinséré plus médialement, au niveau du site de résection de la tête humérale plutôt qu'au niveau du site d'insertion anatomique : cependant, ce tendon peut se rétracter conduisant à une épaule antérieurement instable. En général, la préservation des tendons de la coiffe des rotateurs chez ces patients est corrélée à un bon résultat clinique. Chez les patients présentant un descellement de la cupule, l'examen dynamique peut mettre en évidence une certaine instabilité de la quincaillerie métallique par rapport à l'humérus osseux (Fig. 143).
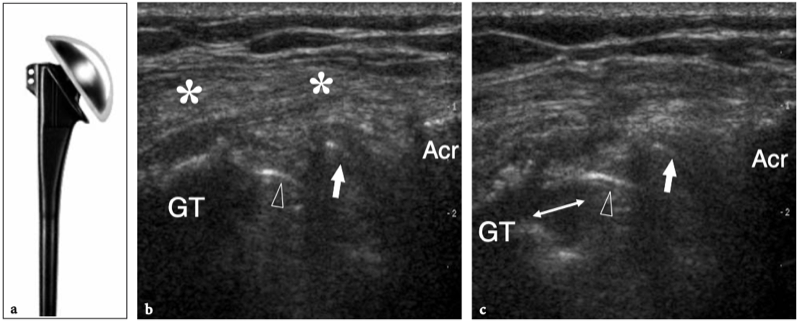
Figures 143a–c. Prothèse d'épaule. un dessin schématique illustre une tige humérale conventionnelle pour l'arthroplastie de l'épaule. b,c Images échographiques coronales obliques 12–5 MHz obtenues immédiatement latéralement à l'acromion (Acr) tout en gardant le bras b en abduction et c en position neutre. Une série de surfaces échogènes brillantes reflétant des os natifs et des marchandises métalliques sont observées. De médial en latéral, ce sont : la pièce glénoïdienne en polyéthylène (flèche) de la prothèse, la cupule de la pièce humérale (tête de flèche) et la grosse tubérosité (GT). Il y a un léger artefact de réverbération sous les matériaux de prothèse, l'absence du tendon sus-épineux et une atrophie du muscle deltoïde (astérisques). L'examen dynamique révèle une certaine instabilité de la quincaillerie métallique par rapport à l'humérus osseux avec une distance accrue (double flèche) entre la vaisselle humérale et la grosse tubérosité en position neutre.
57. ARTHRITE SEPTIQUE ET BURSITE
L'arthrite septique de l'articulation gléno-humérale a une prédilection pour les très jeunes nourrissons ou les patients âgés souffrant de troubles chroniques débilitants, tels que le diabète, la cirrhose et l'alcoolisme. L'injection intra-articulaire de corticostéroïdes augmente considérablement le risque de maladie infectieuse en raison de la réduction induite par les stéroïdes des défenses de l'hôte. De plus, l'arthrite septique peut provenir de l'introduction accidentelle de bactéries lors de procédures d'arthrocentèse non stériles. Bien que l'échographie soit un moyen sensible de détection des épanchements articulaires glénohuméraux, même de petite taille, les résultats de l'imagerie échographique ne permettent généralement pas de différencier définitivement un épanchement articulaire non infecté de l'arthrite septique (Cardinal et al. 2001). Le diagnostic définitif nécessite une analyse du liquide, éventuellement aspiré sous contrôle américain, et doit être effectué chez tous les patients chez lesquels une probabilité d'infection est présente. Comme décrit au chapitre 18, les aiguilles de gros calibre (calibre 16-18) sont idéales à cette fin, car le matériau purulent peut être trop épais et visqueux pour être aspiré avec une petite aiguille. Bien que le site de ponction le plus adéquat puisse varier selon les patients, l'approche postérieure est généralement préférée. En utilisant cet accès, l'aiguille doit être insérée au niveau mi-gléno-huméral et dirigée dans la cavité postérieure à travers l'infraspinatus. L'arthrite septique n'est généralement pas associée à une infection de la bourse sauf si une déchirure de pleine épaisseur de la coiffe des rotateurs est présente et permet une libre communication entre ces deux espaces. Néanmoins, les deux entités peuvent se chevaucher et la différenciation clinique peut être difficile. À l'examen échographique, une bourse sous-deltoïdienne sous-acromiale infectée peut apparaître distendue par un épanchement complexe contenant des débris et des cloisons (Illustration 144a) (Cardinal et al. 2001 ; Lombardi et al. 1992 ; Rutten et al. 1998). Les parois de la bourse peuvent être épaissies et des brins hypoéchogènes péribursaux reflétant un œdème dans les tissus mous environnants peuvent être associés. (Fig.144b).
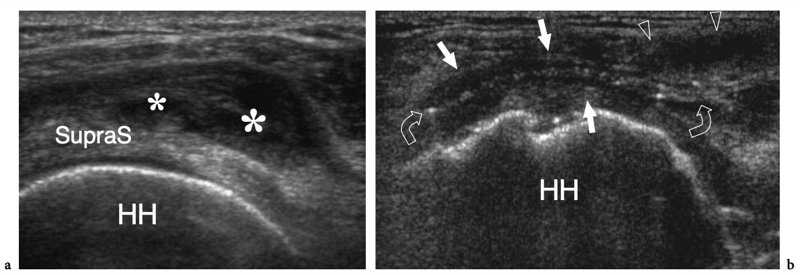
Figure 144a,b. Bursite septique. Deux cas différents. une image US transversale 12–5 MHz sur le petit axe du tendon sus-épineux (SupraS) montre un revêtement irrégulier de la bourse avec un épaississement hypoéchogène focal de la synoviale (astérisques). L'aspiration a révélé une infection à Staphylococcus aureus de la bourse sous-deltoïdienne sous-acromiale. b Image échographique oblique sagittale 12-5 MHz obtenue immédiatement latéralement à l'acromion chez un patient diabétique présentant une déchirure massive de la coiffe des rotateurs et l'apparition récente d'un gonflement de l'épaule, de douleur et de fièvre montrant un épanchement hétérogène de la bourse contenant un matériau d'échogénicité mixte (flèches droites). De petits foyers hyperéchogènes (flèches courbes) dans la cavité synoviale suggèrent un matériau purulent. Notez les changements hypoéchogènes (têtes de flèches) dans les couches de tissus mous entourant la bourse reflétant l'inflammation réactive péribursale et l'œdème. L'aspiration a révélé une infection à Streptococcus. HH, tête humérale.
Bien que l'imagerie Doppler couleur et puissance puisse montrer un flux hyperémique dans les parois synoviales et autour de la bourse, cela n'est pas considéré comme un signe spécifique de maladie infectieuse. Lorsque les récessus articulaires sont exempts de liquide, l'échographie est un moyen fiable pour obtenir un diagnostic correct d'atteinte isolée de la bourse, évitant ainsi les procédures d'arthrocentèse avec leurs complications potentielles (Lombardi et al. 1992). Lors de l'aspiration de la bourse infectée, le guidage par échographie peut éviter une contamination accidentelle de l'articulation stérile sous-jacente en traversant la bourse infectée avec l'aiguille. Dans la septicémie de l'articulation acromio-claviculaire (Blankstein et al. 1985), l'échographie est une modalité utile pour exclure l'implication de la bourse sous-acromiale sous-deltoïdienne adjacente et de l'articulation gléno-humérale. Les principaux résultats de l'échographie comprennent un renflement supérieur de la capsule articulaire, un élargissement de l'espace articulaire avec des érosions des bords osseux et des débris se déplaçant librement dans l'espace articulaire (Widman et al. 2001). Bien que l'aspiration de l'articulation infectée puisse être réalisée à l'aveugle, l'échographie permet de réaliser cette procédure avec plus de confiance.
58. TRAUMATISME ET INSTABILITÉ DE L'ARTICULATION ACROMIOCLAVICULAIRE
La subluxation ou la luxation de l'articulation acromio-claviculaire peut être source de douleur à l'épaule souvent confondue avec une lésion post-traumatique de la coiffe des rotateurs en raison de la proximité de cette articulation avec les tendons de la coiffe des rotateurs. L'échographie est plus sensible que les radiographies standard pour détecter les entorses de bas grade de l'articulation acromio-claviculaire. Ces lésions se manifestent par un élargissement de la cavité articulaire, distendu par un hématome ou un épanchement, et un renflement de la capsule supérieure et du ligament (Fig. 145). Lorsque l'articulation acromio-claviculaire est plus sévèrement lésée avec rupture des ligaments coraco-claviculaires, un déplacement vers le haut de l'extrémité distale de la clavicule peut être apprécié (Fig. 146). Bien que l'imagerie directe des ligaments coracoclaviculaires ne soit pas possible avec l'échographie en raison de la clavicule sus-jacente, un hématome dans les tissus mous entre la clavicule et la coracoïde peut être considéré comme un signe indirect de ligaments lésés.
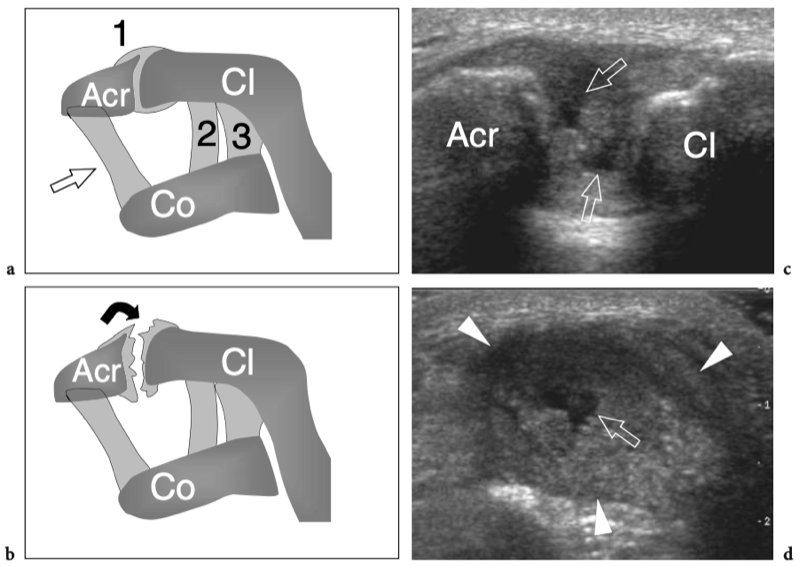
Fig. 145a–d. Entorse acromio-claviculaire légère (lésion de type II). a Le dessin schématique sur l'arc coracoacromial illustre les relations normales de l'articulation acromioclaviculaire (1) avec le ligament coracoacromial (flèche) et les composants trapézoïdaux (2) et conoïdes (3) du ligament coracoclaviculaire. Acr, acromion ; Co, coracoïde ; Cl, clavicule. b Le dessin schématique montre les altérations observées dans une entorse bénigne de l'articulation acromio-claviculaire. L'interligne articulaire est élargi (flèche courbe) sans lésion du ligament coraco-claviculaire. c Les images échographiques coronales et sagittales 12–5 MHz sur l'articulation acromio-claviculaire chez un patient souffrant de douleurs post-traumatiques à l'épaule révèlent un espace articulaire élargi (têtes de flèches) et un liquide hypoéchogène (flèches) distendant la cavité articulaire. Acr, acromion ; Cl, clavicule.
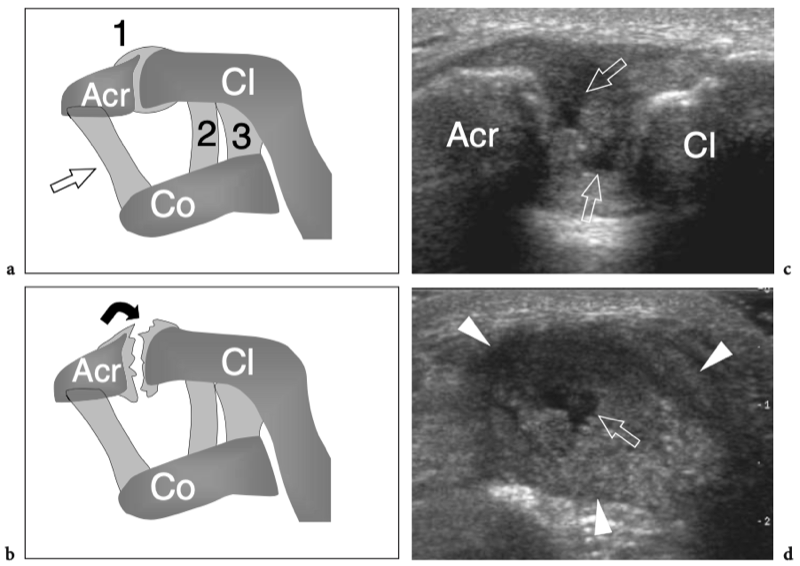
Figures 146a–f. Séparation de l'articulation acromio-claviculaire (lésion de type III). a Dessin schématique sur l'arc coraco-acromial avec corrélation radiographique b montrant une élévation (flèche droite) de la clavicule (Cl) par rapport à l'acromion (Acr) avec une augmentation des distances articulaires acromio-claviculaires et coraco-claviculaires (flèches courbes) indiquant une rupture des ligaments. Co, coracoïde. c,d Images échographiques coronales 12–5 MHz sur l'articulation acromio-claviculaire droite chez un patient présentant une luxation articulaire post-traumatique. Notez le déplacement vers le haut (flèche) de l'extrémité distale de la clavicule (Cl) par rapport à l'acromion (Acr). La double flèche entre les lignes pointillées indique la mesure de la largeur de l'articulation acromio-claviculaire (c,e) et le déplacement supérieur de la clavicule (d,f). e,f Images échographiques coronales 12–5 MHz de l'articulation acromio-claviculaire gauche normale à des fins de comparaison.
De plus, la mesure de la distance coraco-claviculaire à l'aide de scanners sagittaux antérieurs peut augmenter la confiance dans le diagnostic (Sluming, 1995). Dans les luxations sévères avec déplacement grossier de la clavicule, une perturbation de l'insertion musculaire du deltoïde et/ou du trapèze avec un hématome se développant en avant (lésion du deltoïde) ou en arrière (lésion du trapèze) du bord crânien de la clavicule peut également être mise en évidence ( Heers et Hedtmann 2005). Les plans à axe court sur la clavicule distale sont utiles pour évaluer le fascia commun des deux muscles afin d'éviter que des blessures ne soient manquées (Heers et Hedtmann 2005). Ces structures sont d'importants stabilisateurs de l'articulation acromio-claviculaire. Bien que l'échographie ne soit pas couramment utilisée comme modalité de dépistage de la séparation de l'articulation acromio-claviculaire, certaines tentatives ont été faites pour corréler les résultats de l'échographie dans les articulations acromio-claviculaires aiguës et chroniques instables de gravité variable avec l'échelle radiographique décrite par Tossy (Tossy et al. 1963) et le Classement Rockwood (Rockwood 1984). À l'échographie, la largeur de l'articulation est mesurée par voie coronale et comparée au côté controlatéral. Théoriquement, les mesures sont mieux obtenues avec les bras du patient pendants et tenant un poids de 10 kg dans chaque main pour augmenter le stress sur les structures capsuloligamenteuses et permettre l'identification de changements subtils. Étant donné que des variantes peuvent exister dans la largeur des articulations chez les sujets normaux, la mesure doit être liée au côté normal non blessé. Un indice est alors calculé en divisant la largeur de l'articulation acromio-claviculaire du côté atteint par celle du côté normal. Chez les sujets normaux, la largeur de l'articulation acromio-claviculaire ne doit pas dépasser 6 mm et l'indice acromio-claviculaire 1.0 ; les patients présentant une instabilité de Tossy II ont une largeur articulaire acromio-claviculaire moyenne de 10.2 mm du côté lésé et un index acromio-claviculaire de 0.5 ; les patients présentant une instabilité de Tossy III et une indication chirurgicale ont une largeur articulaire acromio-claviculaire moyenne de 22.3 mm du côté lésé et un index acromio-claviculaire inférieur à 0.25 (Kock et al. 1996). Selon la définition de Rockwood (Rockwood 1984), les lésions de type Tossy III peuvent être subdivisées en fonction du déplacement postérieur de la clavicule (type IV), de l'augmentation marquée de la distance coracoclaviculaire de 2 ou 3 fois et de l'omoplate déplacée vers le bas (type V) et luxation de la clavicule inférieure à l'acromion ou à la coracoïde (type VI). Bien que les fractures de l'apophyse coracoïde puissent être secondaires à une luxation antérieure de l'épaule, elles surviennent le plus souvent en association avec des luxations acromio-claviculaires de type III (Ogawa et al. 1997). Le mécanisme de ces rares fractures semble lié à la survenue d'un traumatisme direct de la ceinture scapulaire et d'une forte traction soudaine du chef court du biceps et du coracobrachial s'insérant au niveau de l'apophyse coracoïde, conduisant à une avulsion (Fig. 147). Dans la plupart des cas, un traitement conservateur est approprié. En cas de gros fragments avulsés ou de douleurs persistantes, une réduction à ciel ouvert est conseillée avec vis coracoïde et fixation acromio-claviculaire.
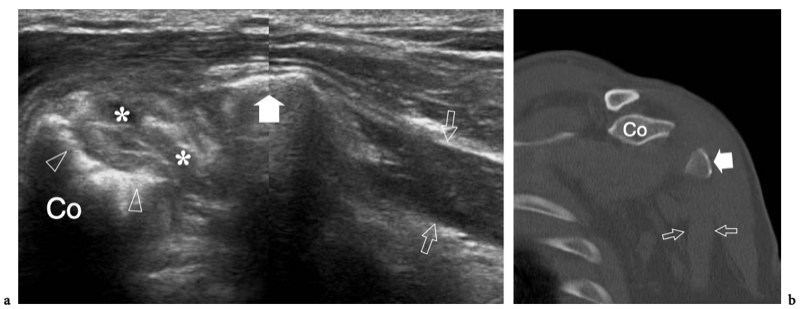
Figure 147a,b. Fracture coracoïde. a Image sagittale en écran partagé 12–5 MHz sur la coracoïde (co) avec b corrélation d'imagerie reconstruite par scanner sagittal oblique chez un patient présentant un traumatisme direct à la ceinture scapulaire et une séparation de l'articulation acromio-claviculaire (lésion de type III) révèle un décollement et un déplacement caudal de la pointe coracoïde (flèches blanches) résultant de la traction par le chef court du biceps et le coracobrachial (flèches pleines). Observer le nidus (têtes de flèches) d'avulsion dans la coracoïde et l'hématome associé (astérisque).
L'ostéolyse post-traumatique de la clavicule est un trouble spontanément résolutif avec des modifications réparatrices progressives sur une période de 4 à 6 mois pouvant survenir plusieurs semaines à plusieurs années après un traumatisme acromioclaviculaire (Dardani et al. 2000). La clé du diagnostic est le fait que les changements ne se produisent qu'à l'extrémité claviculaire alors que l'acromion reste normal. Bien que le diagnostic soit généralement basé sur les antécédents du patient et les résultats radiographiques, l'échographie est capable de détecter les mêmes anomalies que celles observées sur les films simples. Aux États-Unis, la pointe claviculaire présente des érosions corticales irrégulières associées à un élargissement de l'espace articulaire, un épanchement articulaire et un gonflement des tissus mous, tandis que l'acromion reste intact (Fig. 148). L'ostéolyse post-traumatique de la clavicule doit être envisagée dans le diagnostic différentiel lorsqu'un patient ressent une douleur chronique ou un gonflement des tissus mous au-delà de la phase aiguë de la lésion. Il faut veiller à ne pas confondre cette affection avec le raccourcissement de la clavicule secondaire à la résection de l'extrémité distale de la clavicule, qui peut être réalisée pour traiter l'arthrose acromio-claviculaire avec conflit secondaire, la polyarthrite rhumatoïde, la spondylarthrite ankylosante et l'infection. L'histoire du patient et l'inspection locale permettent une différenciation fiable entre ces conditions.
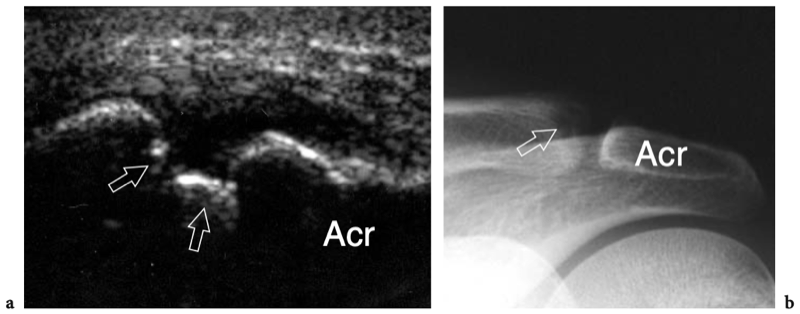
Figure 148a,b. Ostéolyse post-traumatique de la clavicule. a Image coronale 10–5 MHz US avec corrélation radiographique b chez un patient présentant une sensibilité douloureuse au niveau de l'articulation acromio-claviculaire 6 mois après un traumatisme montrant une érosion irrégulière (flèches) de l'extrémité distale de la clavicule. Acr, acromion. (Avec l'aimable autorisation du Dr Nicolò Prato, Italie)
59. PATHOLOGIE DE L'ARTICULATION STERNOCLAVICULAIRE ET COSTOSTERNALE
Les lésions de l'articulation sterno-claviculaire sont rares compte tenu du fort soutien ligamentaire de cette articulation. L'instabilité sternoclaviculaire traumatique, y compris la subluxation et la luxation, est toujours secondaire à un événement traumatique bien défini. Chez ces patients, l'invalidité dure plus longtemps en cas de luxation postérieure qu'en cas de luxation antérieure, probablement en raison d'une lésion concomitante des tissus mous médiastinaux postérieurs au sternum. L'échographie s'est avérée capable d'identifier la luxation sterno-claviculaire postérieure ainsi que d'évaluer sa réduction au bloc opératoire (Benson et al. 1991 ; Pollock et al. 1996). En plus des blessures traumatiques, d'autres affections atraumatiques affectant l'articulation sternoclaviculaire se prêtent à un examen échographique, y compris l'arthrose dégénérative (Hiramuro-Shoji et al. 2003). Semblable à celle observée au niveau de l'articulation acromio-claviculaire, l'arthrose dégénérative de l'articulation sterno-claviculaire se caractérise par un rétrécissement de l'interligne articulaire, des ostéophytes et des kystes para-articulaires (Fig. 149a, b). Cette condition affecte généralement le bras dominant des femmes âgées de 40 à 60 ans. Une chirurgie antérieure du cou avec lésion du nerf spinal accessoire est également revendiquée comme un facteur prédisposant, car elle provoque une chute de l'épaule vers le bas et vers l'avant, entraînant une contrainte supplémentaire sur l'articulation sternoclaviculaire (Hiramuro-Shoji et al. 2003). Dans la polyarthrite rhumatoïde, l'atteinte de l'articulation sterno-claviculaire montre des irrégularités des surfaces osseuses avec ostéolyse de l'extrémité médiale de la clavicule et inflammation synoviale (Fig.149c,d). Le syndrome de Tietze, également appelé syndrome costosternal ou syndrome de la paroi thoracique antérieure, est une affection bénigne autolimitative caractérisée par un gonflement des cartilages costaux et une apparition progressive de douleurs dans la paroi thoracique antérieure exacerbées par la toux et les éternuements. L'échographie est capable de révéler un volume accru des cartilages costaux avec des calcifications irrégulières et un gonflement des tissus mous périchondraux dans des articulations costochondrales cliniquement et radiographiquement apparemment normales de patients souffrant de douleurs thoraciques antérieures (Choi et al. 1995 ; Kamel et Kotob 1997). Chez ces patients, l'échographie a été proposée comme moyen de guider l'injection locale de stéroïdes pour le traitement (Kamel et Kotob 1997).
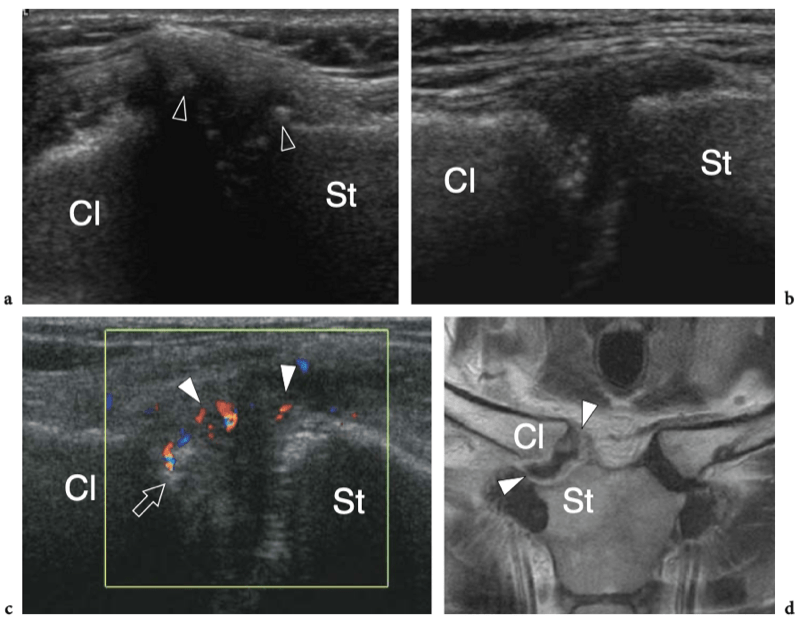
Figures 149a–d. Anomalies de l'articulation sternoclaviculaire. a,b Arthrose dégénérative. une image US transversale 12–5 MHz sur l'articulation sterno-claviculaire droite montre des irrégularités et des ostéophytes (têtes de flèches) de la surface articulaire de la clavicule (Cl) et du sternum (St). b Articulation controlatérale normale pour comparaison. c,d Polyarthrite rhumatoïde. c Image échographique Doppler couleur transversale 12–5 MHz sur l'articulation sterno-claviculaire droite avec d La corrélation d'imagerie IRM pondérée en T1 avec contraste coronal montre un élargissement de l'espace articulaire, des irrégularités à l'extrémité médiale de la clavicule (flèche) reflétant des érosions osseuses et une hyperémie synoviale ( pointes de flèches) comme on le voit à l'imagerie Doppler et après absorption de gadolinium.
60. SYNDROME DE L'ESPACE QUADRILATERAL
Dans les neuropathies autour de l'épaule, la petite taille des nerfs, l'anatomie régionale complexe et les problèmes d'accès dus à l'occultation acoustique des structures osseuses superficielles rendent difficile l'évaluation directe des nerfs par échographie. La neuropathie axillaire peut être causée par des lésions d'étirement (luxation antérieure) ou une compression extrinsèque dans l'espace quadrilatéral causée par des fractures de l'humérus supérieur, une mauvaise utilisation de béquilles, des plâtres, des bandes fibreuses et des kystes paraglénoïdes inférieurs (de 9 à 7 heures). (Linker et al. 1993 ; Chautems et al. 2000 ; Tung et al. 2000). La traction et la compression statiques (bandes fibreuses, occlusion de l'artère circonflexe postérieure, hypertrophie musculaire) et dynamiques (nerf s'étendant dans certaines positions des bras, comme cela se produit chez les athlètes de lancer aux extrêmes du mouvement articulaire) sur le nerf axillaire semblent jouer un rôle dans ce syndrome (Perlmutter 1999). Des dommages iatrogènes lors d'interventions arthroscopiques autour de la coracoïde ou par des portails arthroscopiques chirurgicaux postérieurs ont également été rapportés en dehors de l'espace quadrilatère (Lo et al. 2004). Lorsque la compression du nerf axillaire se produit dans l'espace quadrilatéral, il y a dénervation sélective du muscle petit rond car la branche antérieure du nerf (alimentant le deltoïde) est épargnée. Cliniquement, la neuropathie axillaire est souvent retrouvée occasionnellement lors d'un examen de l'épaule à la recherche d'autres anomalies symptomatiques. Cela suggérerait que la maladie peut exister dans une entité asymptomatique ou sous-clinique (Sofka et al. 2004b; Cothran et Helms 2005). Lorsqu'elle est symptomatique, elle est associée à des douleurs postérieures de l'épaule vagues, souvent non spécifiques, des paresthésies sur la face externe de l'épaule et une faiblesse exacerbée par l'abduction et la rotation externe du bras. Parce que le petit rond est le seul muscle impliqué, cette condition peut être difficile à reconnaître sur la base des seuls motifs cliniques, car l'action du petit rond ne peut pas être clairement séparée de la contribution de l'infraspinatus. Même sans aucune anomalie détectable des tissus mous le long du trajet du nerf, le diagnostic de neuropathie axillaire est basé sur la preuve d'une perte de volume et de changements hyperéchogènes des muscles impliqués en l'absence de déchirure du tendon (Martinoli et al. 2003). Ces signes sont d'autant plus évocateurs que les ruptures tendineuses mineures du rond rond sont extrêmement rares, même en cas de rupture massive de la coiffe des rotateurs. Aux États-Unis, l'atrophie du petit rond est mieux évaluée en comparant l'apparence de ce muscle avec celle de l'infraspinatus adjacent sur les coupes sagittales (Fig. 150). En revanche, l'atrophie du deltoïde peut être révélée par une épaisseur réduite de ce muscle par rapport au muscle controlatéral sur les coupes coronales. (Fig. 151). De plus, l'échographie est en mesure de mettre en évidence toute lésion occupant de l'espace dans l'espace quadrilatéral, comme des kystes paralabraux s'étendant de la face inférieure de la glène en association avec une déchirure du labrum inférieur (Sanders et Tirman 1999 ; Robinson et al. 2000). Le principal diagnostic différentiel du syndrome de l'espace quadrilatéral est le syndrome de Parsonage-Turner, dans lequel l'implication des muscles concerne généralement plus d'une distribution nerveuse.
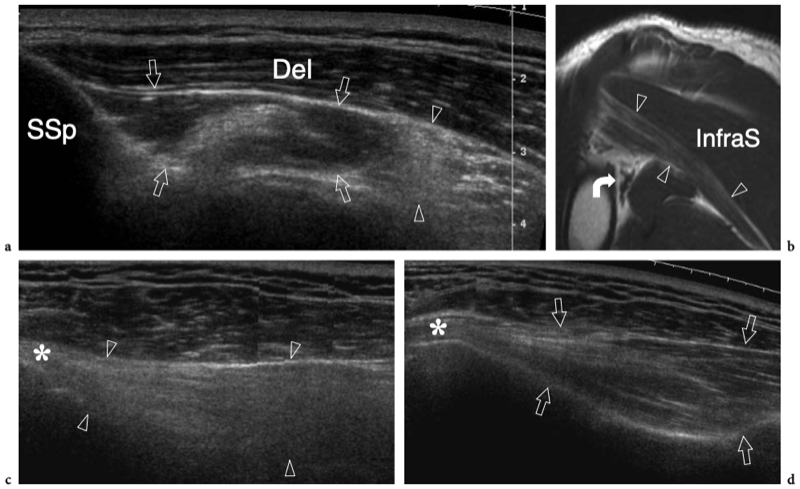
Figures 150a–d. Neuropathie axillaire avec dénervation sélective du muscle petit rond. une image échographique sagittale à champ de vision étendu de 12 à 5 MHz obtenue au-dessus de la fosse postérieure droite montre une perte de volume et une augmentation de l'échogénicité du muscle petit rond (têtes de flèches), un résultat compatible avec une atrophie graisseuse, alors que le muscle sous-épineux ( flèches) est conservé. SSp, colonne vertébrale de l'omoplate ; Del, muscle deltoïde. b La corrélation en IRM coronale oblique pondérée en T1 confirme la dénervation chronique sous forme d'infiltration graisseuse du petit rond (têtes de flèches) liée à une neuropathie axillaire. Notez le muscle sous-épineux normal (InfraS) et certaines structures hypointenses (flèche courbe) traversant l'espace quadrilatère, compatibles avec le nerf axillaire et l'artère circonflexe postérieure. c, d Les images américaines 12–5 MHz à axe long sur c la droite (têtes de flèches) et d la gauche (flèches) muscles mineurs ronds montrent des différences échotexturales frappantes, le ventre droit étant réduit en volume et beaucoup plus échogène que le gauche. Des deux côtés, les tendons sont intacts (astérisque).
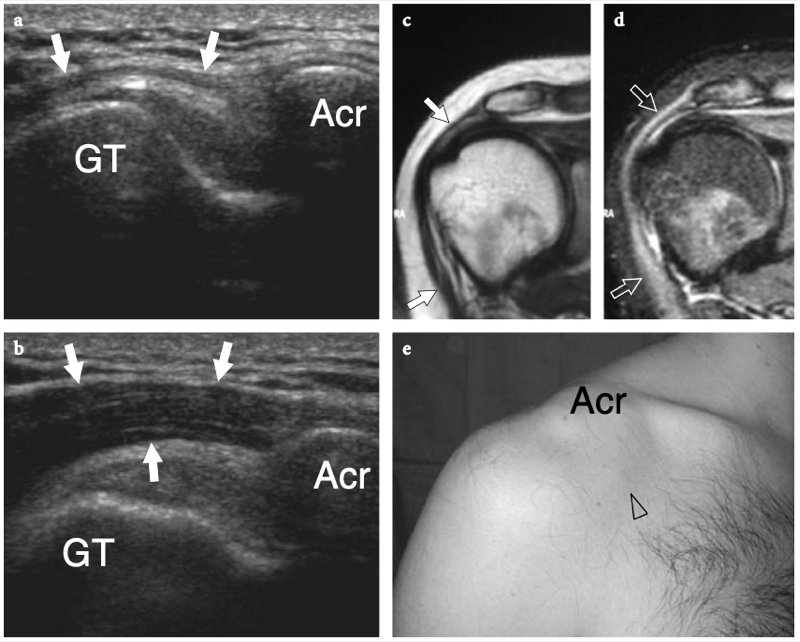
Fig. 151a–e. Lésion du nerf axillaire avec dénervation du deltoïde par atteinte de la branche antérieure du nerf axillaire chez un patient ayant déjà subi une luxation de l'épaule et une fracture de l'humérus lors d'un accident de la circulation. une image échographique grand axe 12–5 MHz sur le tendon intact du sus-épineux montre une atrophie marquée du muscle deltoïde (flèches). b Côté normal controlatéral correspondant montrant le deltoïde normal (flèches). Acr, acromion ; GT, grosse tubérosité. c Les images IRM obliques-coronales pondérées en T1 et d pondérées en T2 avec suppression de la graisse confirment un amincissement marqué du muscle deltoïde (flèches), qui présente un signal T2 légèrement augmenté lié au processus de dénervation. e La photographie de l'épaule droite montre la proéminence de l'acromion (Acr) et de la coracoïde (tête de flèche) sur la peau en raison de l'atrophie du muscle deltoïde.
61. SYNDROME DU NERF SUPRASCAPULAIRE
La neuropathie suprascapulaire est un syndrome inhabituel entraînant une douleur et une faiblesse chroniques de l'épaule (Fehrman et al. 1995). Cette condition peut être secondaire à une constriction du nerf suprascapulaire au niveau de l'encoche suprascapulaire ou de l'encoche spinoglénoïde à la suite d'une variété d'affections, notamment des blessures par étirement, des anomalies ligamentaires, une surutilisation ou des lésions occupant de l'espace. Du point de vue physiopathologique, si le nerf suprascapulaire est piégé au niveau de l'encoche supra-épineuse, les muscles supra-épineux et infra-épineux subissent des modifications de dénervation ; s'il est comprimé au niveau de l'échancrure spino-glénoïdienne, la dénervation est limitée au muscle sous-épineux alors que le supra-épineux est épargné. Comme le nerf suprascapulaire est un nerf purement moteur, il n'y a pas de perte sensorielle. Les kystes paralabraux sont la principale cause de neuropathie suprascapulaire (Takagishi et al. 1991; Bousquet et al. 1996; Bredella et al. 1999; Tung et al. 2000; Weiss et Imhoff 2000; Ludig et al. 2001; O'Connor et al. . 2003). Deux théories possibles ont été avancées pour expliquer l'origine de ces kystes. La première suppose qu'elles sont secondaires à des déchirures du bourrelet glénoïdien permettant l'extrusion du liquide articulaire dans les tissus périarticulaires ; la seconde suggère qu'ils proviendraient de zones de dégénérescence myxoïde des structures para-articulaires consécutives à des déchirures labrales, une pathogenèse quelque peu similaire à celle des autres kystes ganglionnaires. Dans l'épaule, les kystes paralabraux sont généralement associés à des déchirures du labrum glénoïdien supérieur et postérieur (de 8 à 11 heures), à la suite d'une lésion SLAP ou d'une instabilité postérieure, respectivement. Rarement ils s'étendent de la face antérieure et inférieure de la glène. Une fois développés, les kystes paralabraux peuvent montrer un élargissement progressif dû à un mécanisme de valve unidirectionnelle conduisant au passage du liquide articulaire dans le kyste à travers un pédicule fin. (Fig. 152a, b). Au cours de leur expansion, ils se propagent dans l'encoche spinoglénoïde, l'encoche suprascapulaire ou les deux encoches de l'omoplate situées profondément à la jonction myotendineuse du supraspinatus ou de l'infraspinatus, et peuvent ou non provoquer un piégeage nerveux et une dénervation musculaire. (Fig.152c) (Tung et al. 2000). L'échographie peut facilement reconnaître les modifications secondaires des lésions nerveuses, y compris la perte de volume et l'augmentation de la réflectivité des muscles innervés en raison de l'œdème et du remplacement graisseux (Fig. 153, 154).
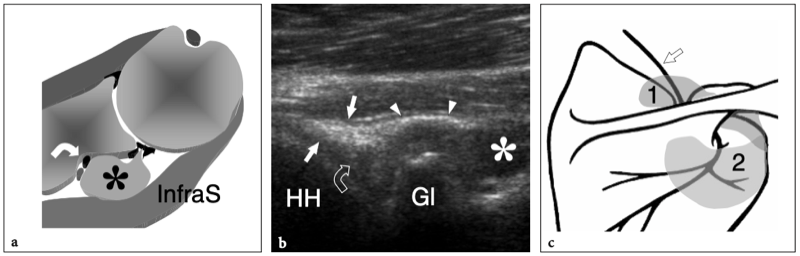
Figures 152a–c. Kystes ganglionnaires paralabraux. un dessin schématique montre le mécanisme de la compression du nerf suprascapulaire (flèche incurvée) par un kyste ganglionnaire (astérisque) développé à partir d'une déchirure dans le labrum postérieur. InfraS, tendon sous-épineux. b Une image échographique transversale de 12 à 5 MHZ obtenue au-dessus de l'épaule postérieure révèle un kyste (astérisque) faisant saillie dans l'encoche spinoglénoïde de l'omoplate, profondément jusqu'au muscle sous-épineux. Le kyste communique par un pédicule fin (têtes de flèches) avec une fente hypoéchogène (flèche courbe) dans le labrum glénoïdien postérieur (flèches droites) reflétant une déchirure labrale. Notez la face postérieure de la glène osseuse (Gl) et de la tête humérale (HH). c Le dessin schématique sur la face postérieure de l'omoplate illustre les sites typiques des kystes ganglionnaires paralabraux se développant dans les encoches suprascapulaires (1) et spinoglénoïdes (2) et leurs relations avec le nerf suprascapulaire (flèche).
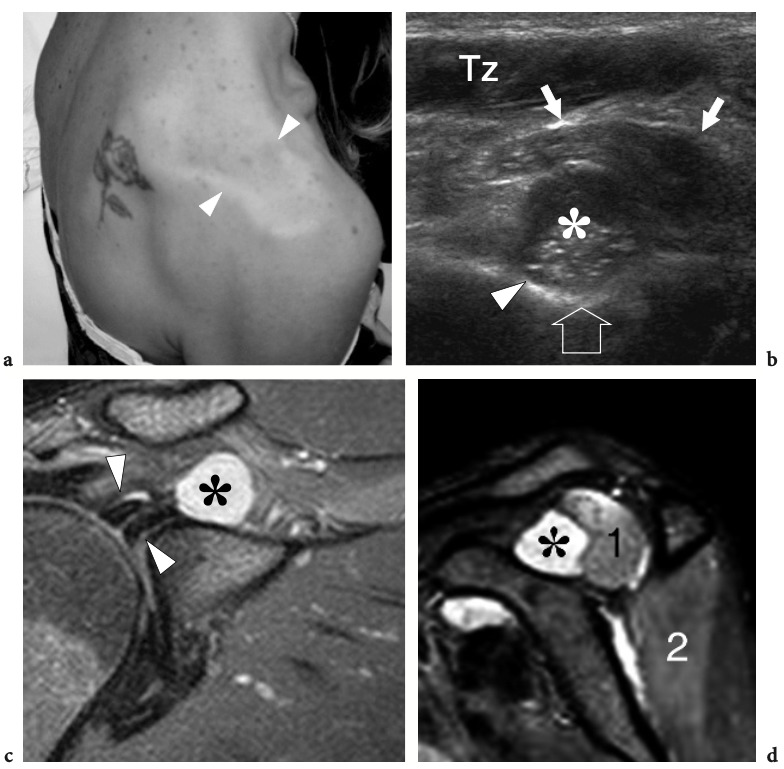
Figures 153a–d. Neuropathie suprascapulaire : piégeage de l'échancrure supra-épineuse. a Photographie d'un patient présentant des symptômes d'instabilité et une aggravation progressive de la force musculaire de l'épaule droite suite à une chute. Notez l'aspect concave de la fosse supra-épineuse (têtes de flèches) résultant de l'atrophie supra-épineuse. b Une image échographique 12–5 MHz à petit axe obtenue sur le muscle trapèze (Tz) immédiatement en arrière de l'articulation acromio-claviculaire montre un kyste (astérisque) partiellement rempli de débris échogènes internes. Le kyste se situe dans l'échancrure sus-épineuse (flèche ouverte) poussant le faisceau neurovasculaire suprascapulaire (tête de flèche) contre l'os. Il provoque également un déplacement vers le haut du muscle sus-épineux atrophique (flèches blanches). c Les images IRM pondérées en T2 avec suppression de la graisse oblique coronale et oblique sagittale montrent une lésion SLAP (têtes de flèches) associée à un kyste paralabral (astérisque) s'étendant vers l'échancrure spinoglénoïde. Une intensité de signal pondérée en T2 légèrement augmentée est observée dans les muscles sus-épineux (1) et sous-épineux (2), compatible avec un œdème de dénervation.
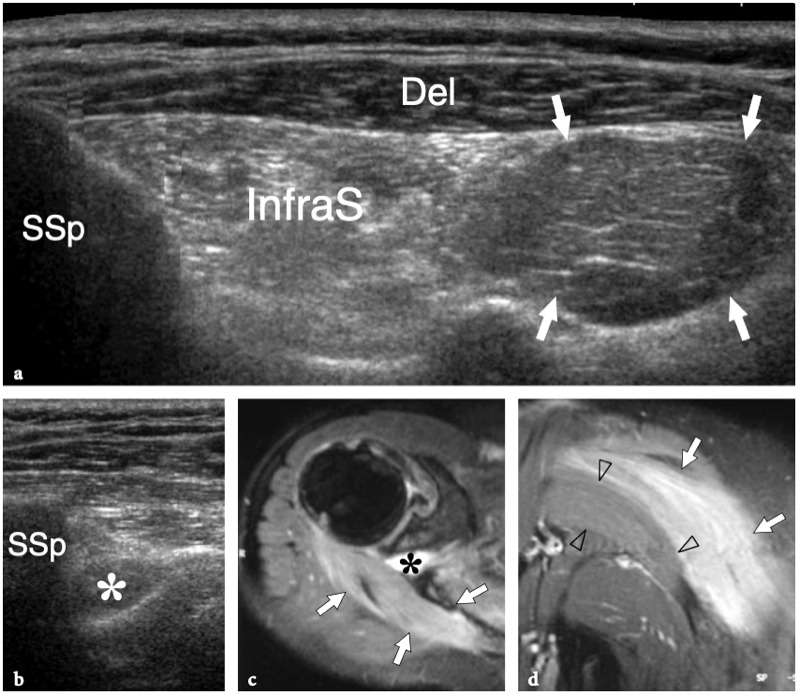
Figures 154a–d. Neuropathie suprascapulaire : piégeage de l'échancrure spinoglénoïdienne. une image US sagittale à champ de vision étendu 12–5 MHz obtenue au-dessus de la fosse postérieure droite montre une perte de volume et une augmentation de l'échogénicité du muscle sous-épineux (InfraS), tandis que le petit rond (flèches) conserve une échotexture normale. SSp, épine de l'omoplate. Del, muscle deltoïde. b Image échographique sagittale 12–5 MHz obtenue au-dessus de l'échancrure spino-glénoïdienne avec une corrélation d'imagerie IRM coronale c transversale et oblique à l'aide de séquences STIR révèle une lésion kystique (astérisque) située en dessous de la colonne vertébrale de l'omoplate (SSp) et profonde au muscle sous-épineux (flèches), compatible avec un kyste ganglionnaire. Notez l'intensité diffuse du signal élevé du muscle sous-épineux liée à l'œdème de dénervation et au petit rond préservé (têtes de flèches).
Une corrélation a été trouvée entre la taille des kystes paralabraux et l'apparition des symptômes de dénervation, significativement plus de dénervation musculaire survenant avec des kystes plus gros (volume 6.0 cm3 ; diamètre 3.1 cm) par rapport à tous les autres kystes paralabraux (volume 2.2 cm3) (Tung et al. 2000). Une technique de numérisation minutieuse est recommandée pour l'imagerie de l'épaule postérieure, en commençant par des paramètres de champ proche pour examiner les tendons de la coiffe des rotateurs, puis en ajustant à la fois la zone focale et le grossissement de l'image au champ lointain afin d'explorer les encoches scapulaires (Martinoli et al . 2003). En fait, même les gros kystes pourraient facilement passer inaperçus lors d'un examen américain standard de l'épaule en raison de leur localisation profonde, loin des tendons de la coiffe des rotateurs. Dans de nombreux cas, les kystes spinoglénoïdes se développent dans la partie la plus crânienne de l'encoche, à proximité immédiate de l'épine scapulaire. Placer la main sur l'épaule opposée pendant le balayage peut être utile pour diminuer la profondeur de la fosse postérieure et pour faciliter l'examen de cette zone par échographie. L'échographie montre que les kystes paralabraux sont des lésions hypoéchogènes arrondies ou ovales avec des marges bien définies, relativement fixes en termes d'emplacement et de forme lors des mouvements actifs et passifs de l'épaule (Hashimoto et al. 1994 ; Bouffard et al. 2000 ; Martinoli et al. 2003). La continuité du kyste avec un défect du labrum postérieur peut être révélée par échographie. Un effet de masse sur le tendon et le muscle adjacent est également souvent mis en évidence. Ensuite, une évaluation minutieuse des tendons de la coiffe des rotateurs doit être effectuée pour exclure une éventuelle rupture du tendon comme cause de l'atrophie musculaire. Le principal diagnostic différentiel des kystes paralabraux comprend les varicosités dans l'encoche spinoglénoïde (Carroll et al. 2003). Bien que les veines à encoche spinoglénoïde agrandies apparaissent comme des images rondes ou ovales hypoéchogènes imitant un kyste, elles ne sont pas stationnaires et changent de forme et de taille lors des mouvements de l'épaule (une taille veineuse accrue est généralement appréciée lorsque le bras est en rotation externe, alors que ces vaisseaux ont tendance à s'effondrer en rotation interne) (Fig. 155).
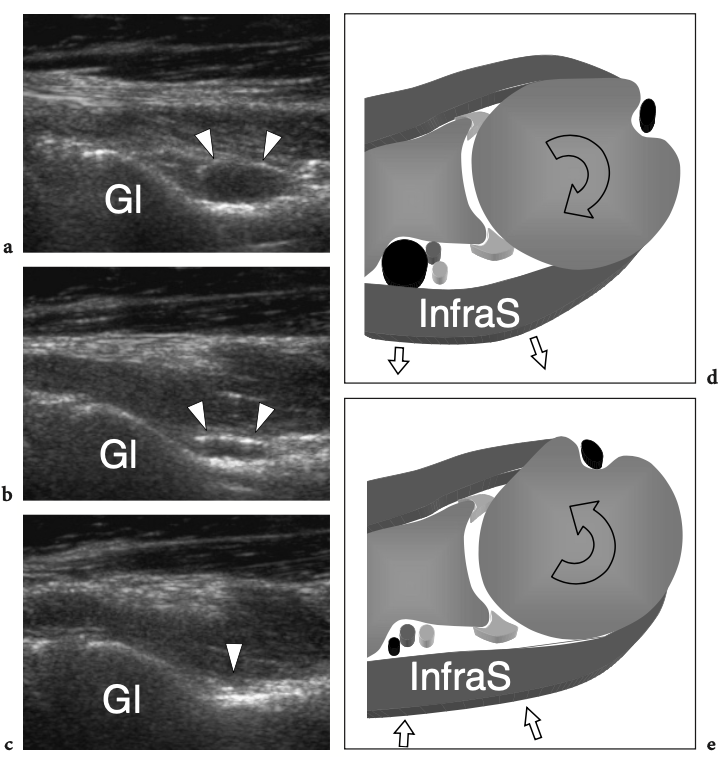
Figures 155a–e. Varicosités de l'encoche spinoglénoïdienne. a–c Série d'images échographiques transversales 12–5 MHz obtenues au-dessus de l'échancrure spino-glénoïdienne en maintenant le bras en a rotation externe, b position neutre et c rotation interne. Il y a remplissage transitoire d'une veine suprascapulaire (têtes de flèches) lorsque le bras tourne vers l'extérieur. Cette constatation ne doit pas être confondue avec un kyste ganglionnaire Gl, glénoïde. d,e Des dessins schématiques illustrent le mécanisme : la taille de la veine spinoglénoïde (en noir) augmente en rotation externe (flèche courbe) en raison de la relaxation (flèches droites) du muscle sous-épineux sus-jacent (InfraS) et diminue en rotation interne ( flèche courbe) suivant sa contraction (flèches droites).
D'autre part, l'imagerie Doppler ne met pas en évidence les signaux d'écoulement dans ces veines car les vitesses d'écoulement sont trop faibles. Dans des articles récents, l'association d'anomalies vasculaires dans la région de l'encoche spinoglénoïde avec une neuropathie suprascapulaire a été décrite (Bredella et al. 1999 ; Ludig et al. 2001 ; Carroll et al. 2003). Dans ces cas, il n'est pas encore clair si le plexus veineux dilaté et le nerf comprimé sont une expression distincte d'un tunnel suprascapulaire étroit ou si les varicosités elles-mêmes peuvent entraîner un conflit nerveux. En cas de neuropathie suprascapulaire causée par des kystes paralabraux, une aspiration percutanée à l'aiguille du kyste peut être tentée sous la direction des États-Unis (Hashimoto et al. 1994 ; Chiou et al. 1999). La procédure a trois objectifs principaux : confirmer le diagnostic en montrant un contenu mucoïde visqueux ; drainer le liquide autant que possible pour réduire la pression interne du kyste; et de rompre la paroi kystique avec des mouvements de va-et-vient répétés de la pointe de l'aiguille pour éviter les récidives. Bien que cette procédure ne soit pas définitive, une amélioration ou un soulagement marqué des symptômes des patients a été rapporté dans jusqu'à 86 % des cas (Chiou et al. 1999). L'efficacité réelle d'un ajout de stéroïdes au sein du kyste après aspiration est inconnue et peut augmenter le risque d'infection locale.
62. DÉPART THORACIQUE ET PATHOLOGIE DU PLEXUS BRACHIAL
D'une manière générale, les structures cliniquement pertinentes de la région du défilé thoracique sont les nerfs du plexus brachial, l'artère sous-clavière et la veine sous-clavière. Les causes de la plexopathie brachiale comprennent les traumatismes, les tumeurs intrinsèques et extrinsèques, la plexopathie radique et le syndrome de Parsonage-Turner. Les structures neurovasculaires du défilé thoracique peuvent également être atteintes par des lésions compressives dues à des modifications congénitales ou acquises des structures fibro-osseuses et fibromusculaires environnantes, conduisant au syndrome de compression du défilé thoracique.
63. TRAUMATISME DU PLEXUS BRACHIAL
Les traumatismes du plexus brachial représentent plus de la moitié des cas de plexopathies brachiales. Les lésions nerveuses sont généralement causées par des mécanismes traumatiques qui provoquent simultanément une traction du bras et un rejet de la tête vers l'épaule opposée, comme cela se produit le plus souvent dans la population adulte lors d'un accident de moto. Différents types de lésions histopathologiques peuvent survenir selon l'endroit où la blessure d'étirement a lieu. Les lésions préganglionnaires dérivent de l'avulsion des radicelles nerveuses de la moelle épinière ou de l'avulsion des racines nerveuses au niveau des foramens neuraux (Fig. 156a, b). Dans le cas d'avulsions de racines nerveuses, des pseudoméningocèles peuvent survenir à la suite d'une rupture de la dure-mère et des membranes arachnoïdiennes et d'une extravasation de liquide céphalo-rachidien en dehors du foramen neural. (Fig.156b). Ces lésions sont caractérisées par le plus mauvais pronostic car la reconnexion chirurgicale des radicelles nerveuses avec la moelle épinière n'est pas réalisable. Étant donné que les lésions préganglionnaires sont situées à l'intérieur du canal rachidien, elles ne sont pas visibles aux États-Unis et nécessitent une imagerie IRM pour leur représentation. D'autre part, les lésions postganglionnaires sont presque invariablement associées à des nerfs perturbés et à des névromes traumatiques dans le triangle interscalénique ou dans la zone située entre le triangle interscalénique et l'espace costoclaviculaire. (Fig.156c). Les névromes peuvent provenir soit d'une lésion d'un tronc, le tronc supérieur (niveau C5-C6) étant le plus souvent touché, soit d'une avulsion et d'une rétraction des racines nerveuses à l'extérieur de la colonne vertébrale (Fig.156d). Dans les deux cas, la localisation des névromes se situe presque invariablement au niveau des muscles scalènes.
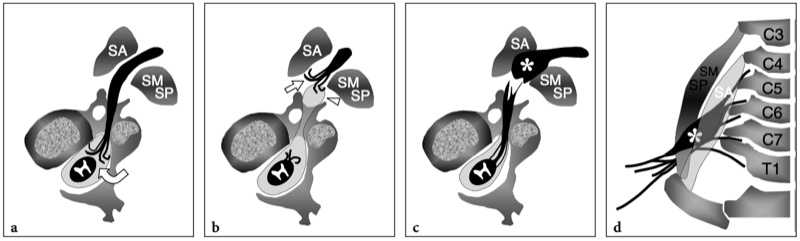
Figures 156a–d. Blessures du plexus brachial. a–c Des dessins schématiques illustrent les origines des nerfs du plexus brachial (en noir) et leurs relations avec la moelle épinière, la zone foraminale, l'apophyse transverse et, plus extérieurement, les muscles scalènes, y compris le scalène antérieur (SA), moyen ( SM) et postérieur (SP). La plupart des lésions du plexus brachial fermé résultent d'un mécanisme de traction qui se produit à différents niveaux le long du trajet nerveux. De proximal en distal, une lésion du plexus brachial peut déterminer : un décollement des radicelles de la moelle à l'intérieur du canal rachidien ; b avulsion et rétraction des racines nerveuses (flèche) dans la zone foraminale avec possible extravasation de liquide céphalo-rachidien et formation de pseudoméningocèles (tête de flèche) ; c rupture des racines nerveuses et/ou des troncs primaires en dehors des foramens neuraux avec formation de névromes traumatiques (astérisque). d Chez le patient traumatisé, l'atteinte la plus fréquente est celle du tronc supérieur (niveau C5–C6). En règle générale, les névromes (astérisque) résultant de lésions du tronc supérieur sont situés dans l'espace interscalénique.
Dans les lésions préganglionnaires, les pseudoméningocèles peuvent être appréciées comme des collections hypoanéchogènes situées à proximité des foramens intervertébraux au lieu des racines nerveuses. Dans notre expérience, cependant, l'échographie semble moins sensible que l'IRM pour les détecter. Au moins en partie, cela pourrait s'expliquer par le fait que ces collections ne sont pas extrudées si loin à l'extérieur des foramens neuraux. De plus, les racines effilochées avulsées sans pseudoméningocèles peuvent avoir un aspect américain très similaire. L'examinateur doit également être conscient que des avulsions de racines nerveuses peuvent survenir sans pseudoméningocèles traumatiques et que des pseudoméningocèles traumatiques peuvent exister en l'absence d'avulsions de racines nerveuses (Ochi et al. 1994). Dans les lésions post-ganglionnaires, trois principaux types d'échographie peuvent être détectés : une rupture de la continuité nerveuse d'une ou plusieurs racines et troncs, éventuellement associée à une tuméfaction des moignons proximaux et distaux et à une trajectoire « ondulée » du segment distal rétracté ; tissu cicatriciel irrégulier enveloppant un ou plusieurs nerfs ; épaississement segmentaire fusiforme des racines et des troncs du plexus représentant des névromes traumatiques (Fig. 157) (Shafighi et al. 2003; Graif et al. 2004). Ces dernières lésions consistent en une masse de tissu cicatriciel et de tissu nerveux rétracté en continuité avec les nerfs et peuvent être considérées comme un véritable marqueur de la maladie. Ils peuvent provenir d'une lésion partielle ou complète d'une racine ou d'un tronc en dehors de la colonne vertébrale et se produisent généralement en relation avec le triangle interscalène. Souvent, ils dépassent les marges latérales des muscles scalènes. En ce qui concerne la meilleure technique de balayage pour les imager, les plans à grand axe sur les nerfs affectés ne sont pas si faciles à réaliser en raison du trajet oblique des nerfs. Nous recommandons donc l'utilisation de plans à petit axe (Fig. 158). Sur ces plans, l'échographie met en évidence les névromes sous forme de masses hypoéchogènes remplissant le plan graisseux entre les muscles scalènes. Ils apparaissent isoéchogènes ou légèrement hyperéchogènes par rapport aux muscles adjacents selon leur contenu différent en tissu fibreux. Rappelons que des difficultés peuvent survenir lors de l'examen du plexus brachial en situation aiguë en raison de la survenue possible d'un emphysème sous-cutané diffus lié à un traumatisme thoracique.
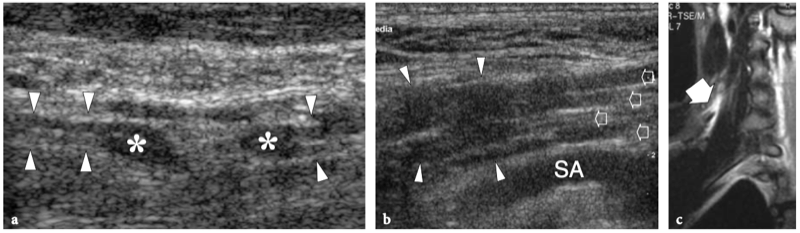
Figures 157a–c. Traumatisme du plexus brachial chez un jeune patient suite à un accident de moto. une image US à axe long 12–5 MHz obtenue sur les nerfs du tronc supérieur dans la zone interscalène montre un nerf sectionné (C7). Notez l'aspect gonflé hypoéchogène des moignons proximaux et distaux (têtes de flèches), chacun se terminant par un névrome terminal (astérisque). b L'image américaine 12–5 MHz à axe long sur les divisions et les cordons (flèches ouvertes) du plexus au niveau de la zone supraclaviculaire montre un gonflement hypoéchogène fusiforme mal défini (têtes de flèches) de trois faisceaux nerveux, superficiels par rapport à l'artère sous-clavière (AS). c La corrélation d'imagerie IRM coronale pondérée en T2 démontre un signal accru (flèche) dans les tissus mous de la zone interscalénique.
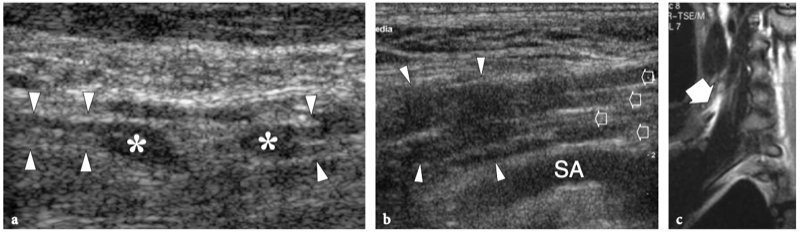
Figures 158a–e. Traumatisme récent du plexus brachial chez un patient ayant subi un accident de vélo 15 jours auparavant. a–c Une série d'images échographiques à axe court 12–5 MHz obtenues à partir d'un proximal à c distal sur les nerfs du plexus brachial (flèches ouvertes) montre un gonflement progressif de certains fascicules (têtes de flèches) au fur et à mesure qu'ils cheminent à la surface de l'artère sous-clavière (AS). En c, les faisceaux anormaux sont enchâssés dans une masse hypoéchogène et irrégulière (têtes de flèches) reflétant un névrome traumatique. Astérisques, muscles scalènes. d Les images IRM sagittales obliques pondérées en T1 et e en pondération T2 avec suppression de la graisse montrent le névrome sous la forme d'une masse bien définie (têtes de flèches) enveloppant les cordons du plexus. Du fait de sa formation récente, le névrome est hyperintense sur les séquences pondérées en T2.
Dans l'ensemble, nous pensons que l'échographie est plus précise que l'IRM pour établir le niveau d'implication, à savoir si le plexus supérieur ou inférieur est blessé, chez les patients présentant des lésions postganglionnaires. En revanche, l'IRM est plus sensible pour détecter les pseudo-méningocèles et les lésions survenant à l'intérieur du rachis. En pratique clinique, nous proposons une approche combinée avec l'IRM et l'échographie pour évaluer le patient traumatisé, la première technique pour évaluer le rachis et les foramens, la seconde pour évaluer les nerfs extra-rachidiens. La détection d'anomalies nerveuses par échographie peut avoir des implications cliniques. Il peut fournir une évaluation précoce de l'état du plexus dans les phases immédiates après le traumatisme, lorsque les résultats cliniques ne sont pas encore concluants quant à savoir si les lésions du plexus brachial nécessitent ou non une intervention. En général, les patients atteints de plexopathie totale ont les plus gros névromes, car ceux-ci reflètent probablement la somme de plus d'une lésion. D'autre part, les patients atteints de petits névromes sont généralement gérés de manière conservatrice et présentent la meilleure récupération fonctionnelle sans chirurgie.
64. ATTEINTE NÉOPLASIQUE DU PLEXUS BRACHIAL
L'imagerie des tumeurs du plexus brachial doit prendre en compte deux classes principales de troubles : la maladie métastatique et la plexopathie radique, et les tumeurs primaires neurogènes. Bien qu'il ait été rapporté que de nombreux histotypes métastasent dans le plexus brachial, y compris le cancer du sein, le carcinome bronchique, le lymphome et le carcinome épidermoïde de la tête et du cou, l'atteinte nerveuse chez les patientes atteintes d'un cancer du sein est beaucoup plus fréquente - représentant environ 24 % des toutes les plexopathies brachiales non traumatiques - parce que l'une des principales voies de drainage lymphatique du sein passe par l'apex de l'aisselle (Wittenberg et Adkins 2000). Chez certains patients, la tumeur métastatique apparaît comme une masse solide bien définie généralement située dans les tissus mous de la région suprascapulaire ou sous-claviculaire (schéma I). Il peut présenter des marges irrégulières et une échotexture hypoéchogène et peut être vu enveloppant les nerfs avec une interface abrupte nerf-tumeur (Fig. 6.159a,b) (Graif et al. 2004). Le plus souvent, le néoplasme envahit le plexus brachial entraînant un épaississement segmentaire et un aspect hypoéchogène des nerfs concernés sans provoquer d'effet de masse net (schéma II). La propagation infiltrante de la tumeur provoque un épaississement fusiforme anormal du nerf (Fig. 159c – e).
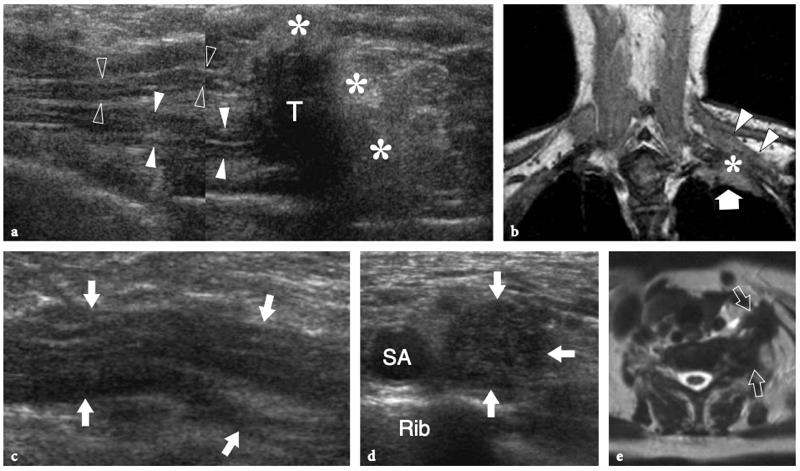
Figures 159a–e. Métastase d'un carcinome du sein avec atteinte du plexus brachial. Deux cas différents. a Image échographique 12–5 MHz grand axe sur les divisions et les cordons du plexus dans la région supraclaviculaire avec une corrélation d'imagerie IRM coronale pondérée en T1 montrant deux branches nerveuses individuelles (têtes de flèches ouvertes et blanches) entourées brusquement par une grande masse solide hypoéchogène (T) avec marges spiculées et propagation infiltrante (astérisques) dans les tissus mous environnants. L'image IRM montre que la masse (astérisque) provient de la première côte et est associée à une atteinte sous-pleurale apicale. c Les images échographiques grand axe et d petit axe 12–5 MHz sur les divisions et les cordons du plexus avec e image IRM transversale pondérée en T2 montrent un épaississement hypoéchogène anormal des nerfs impliqués (flèches) sur la zone interscalène et supraclaviculaire , traduisant une dissémination infiltrante de la tumeur. Les nerfs individuels ont des marges indéfinies et ont tendance à fusionner dans une structure épaisse en forme de cordon longeant l'artère sous-clavière (SA). L'IRM montre l'extension crânienne (flèches) de la tumeur métastatique dans la région paravertébrale.
Des ganglions lymphatiques satellites sont souvent associés. L'imagerie Doppler couleur peut représenter les vaisseaux intratumoraux et peut aider à représenter le déplacement et l'infiltration des vaisseaux sous-claviers et à distinguer les cordons infiltrés des vaisseaux sanguins adjacents. Par rapport à l'IRM, l'échographie semble mieux à même de délimiter le tissu tumoral et l'atteinte nerveuse dans la zone interscalénique et supraclaviculaire grâce à ses capacités de résolution spatiale plus élevées. D'autre part, l'IRM a l'avantage d'une vue panoramique avec la possibilité de délimiter à la fois l'atteinte vertébrale et pleurale. Chez les patients ayant reçu une radiothérapie dans la région axillaire, les lésions radio-induites des nerfs du plexus brachial sont une cause fréquente de plexopathie brachiale, représentant environ 30 % des cas de plexopathies non traumatiques (Wittenberg et Adkins 2000). La distinction entre une maladie récurrente ou résiduelle et une neuropathie radio-induite peut être difficile à la fois sur le plan clinique et sur les études d'imagerie. Des dommages neurologiques après radiothérapie peuvent être observés plusieurs mois à plusieurs années après le traitement. Les symptômes courants de la neuropathie radique comprennent une atteinte du plexus brachial supérieur, des doses supérieures à 60 Gy, une période de latence inférieure à 1 an (pic à 10-20 mois), une absence de douleur et un lymphœdème du membre supérieur. En revanche, la plexopathie néoplasique semble plus typiquement associée à des symptômes liés aux nerfs du plexus inférieur, à des douleurs précoces et intenses, à une faiblesse des mains, à une dose inférieure à 60 Gy et à une période de latence après la fin de la radiothérapie de plus de 1 an (Wittenberg et Adkins 2000). Dans la radiofibrose, l'échographie met en évidence un épaississement diffus des faisceaux nerveux en l'absence de masse focale. Contrairement à l'infiltration tumorale (voir pour comparaison Fig. 159c,d), l'épaississement nerveux est plus uniforme et un léger motif fasciculaire est préservé (Fig. 160). Cependant, cette découverte est loin d'être spécifique à la fibrose radique et la différenciation entre les dommages radiologiques et la tumeur résiduelle ou la récidive peut être problématique car les deux conditions peuvent coexister (Graif et al. 2004). Les lésions du plexus post-irradiation doivent être opérées le plus tôt possible pour stabiliser l'évolution clinique (dès l'apparition des paresthésies et avant le début des douleurs). L'échographie peut fournir un moyen utile pour surveiller les changements dans le volume transversal des faisceaux nerveux affectés au fil du temps.
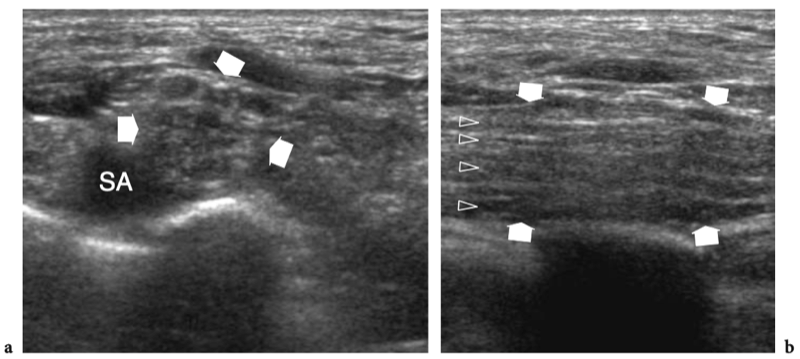
Figure 160a,b. Radiofibrose. a Images échographiques petit axe et b grand axe 12–5 MHz des nerfs du plexus brachial (flèches blanches) dans la région supraclaviculaire obtenues 1 an après la radiothérapie d'un cancer du sein chez une patiente atteinte de plexopathie brachiale réversible. Il existe un léger gonflement homogène des faisceaux nerveux (têtes de flèches) qui semblent moins définis. Aucune masse focale n'est observée. SA, artère sous-clavière.
Les tumeurs primaires neurogènes du plexus brachial, y compris pour la plupart des neurofibromes et des schwannomes, sont beaucoup moins fréquentes que les affections métastatiques (Graif et al. 2004). Les caractéristiques américaines de ces tumeurs sont les mêmes que celles déjà décrites dans d'autres endroits du corps. La caractéristique de valeur pour les distinguer des autres masses des tissus mous - et en particulier des ganglions lymphatiques sus-claviculaires hypertrophiés - est la démonstration de la continuité entre la tumeur et le nerf d'origine (Fig. 161) (Shafighi et al.2003).
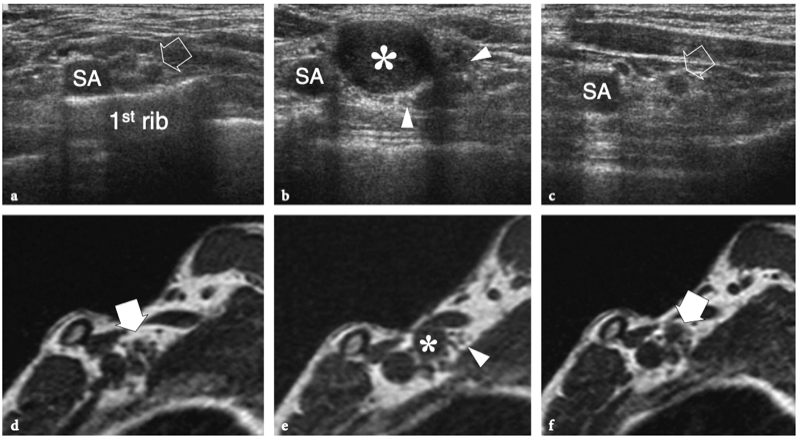
Fig. 161a–f. Schwannome du plexus brachial. une série d'images échographiques à axe court de 12 à 5 MHz obtenues à partir d'un nerf proximal à c distal sur les nerfs du plexus brachial avec des images IRM sagittales obliques correspondantes d - f pondérées en T1 démontrent une masse arrondie (astérisque) avec un contour lisse et une échotexture hypoéchogène solide dans la partie médiane de la région sus-claviculaire. La masse est adjacente à l'artère sous-clavière (AS) et est en continuité proximale et distale avec l'un des cordons nerveux (flèche). Notez les fascicules épargnés (têtes de flèches) lorsqu'ils passent le long de la tumeur. La continuité entre la masse et le nerf d'origine permet d'écarter un ganglion sus-claviculaire.
65. SYNDROME DE PARSONAGE-TURNER
Le syndrome de Parsonage-Turner, également connu sous le nom de « névrite aiguë du plexus brachial », est une entité clinique rare de cause inconnue consistant en une douleur soudaine et intense à l'épaule suivie de l'apparition d'une faiblesse musculaire profonde et d'une paralysie flasque de la ceinture scapulaire et du haut du bras. Ce trouble a un taux d'incidence maximal entre la troisième et la cinquième décennie et une légère prédominance masculine. Bien que différents facteurs, notamment l'infection virale, les traumatismes, la chirurgie et l'auto-immunité, aient été suspectés de jouer un rôle causal, l'étiologie de la maladie reste inconnue. Il n'y a généralement pas de perte de
sensation associée à la faiblesse. Plusieurs schémas de faiblesse sont rapportés, l'atteinte du nerf suprascapulaire étant la plus fréquente. Le tableau le plus fréquent concerne l'atteinte multiple des nerfs axillaire (deltoïde et petit rond), suprascapulaire (supraspinatus et infraspinatus), long thoracique (serratus anterior) et musculocutané (coracobrachialis, biceps brachii, brachialis). En ce qui concerne le schéma d'atteinte des racines nerveuses, C5 et C6 sont les plus fréquemment touchés. Le pronostic est généralement bénin, avec environ 75 % de guérison en 2 ans, et le traitement est symptomatique (antalgiques et kinésithérapie). Les études électrodiagnostiques peuvent indiquer le schéma complexe de l'atteinte musculaire. Les études d'imagerie peuvent être utiles pour exclure toute autre anomalie locale, comme les déchirures de la coiffe des rotateurs, le syndrome de conflit de l'épaule et la tendinite calcifiante, évitant ainsi une intervention chirurgicale inutile chez certains patients en raison d'un échec du diagnostic (Helms et al. 1998 ; Helms 2002). À l'examen échographique, les muscles atteints apparaissent plus petits en volume en raison de l'atrophie et hyperéchogènes diffus en relation avec l'œdème de dénervation et l'infiltration graisseuse (Fig. 162). Bien que l'échographie soit en mesure de confirmer le diagnostic clinique, l'IRM semble plus fiable pour décrire l'étendue globale de l'atrophie musculaire autour de l'épaule (Bredella et al. 1999 ; Helms, 2002).
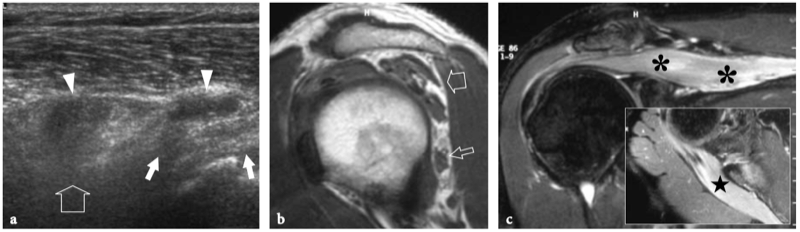
Figures 162a–c. Syndrome de Parsonage-Turner chez un patient avec apparition récente d'une faiblesse intense des muscles de l'épaule. a Image échographique sagittale 12–5 MHz sur la fosse postérieure avec une corrélation d'imagerie IRM pondérée en T1 sagittale oblique montrant une échotexture hyperéchogène marquée des muscles infraspinatus (flèche ouverte) et teres minor (flèches blanches). Notez que les tendons intramusculaires (têtes de flèches) apparaissent hypoéchogènes en raison de l'anisotropie. c Les images IRM pondérées en T2 avec suppression de la graisse, coronales et transversales obliques (dans l'insert) révèlent une intensité de signal élevée marquée dans les muscles sus-épineux (astérisques) et sous-épineux (étoile). En raison d'une atteinte coexistante du petit rond, le schéma global de dénervation est caractéristique d'un déficit neurogène des nerfs suprascapulaire et axillaire.
66. SYNDROME DU DÉCHET THORACIQUE
Le syndrome du défilé thoracique est une gamme de troubles résultant du passage de l'artère et de la veine sous-clavières et des nerfs du plexus brachial à travers les trois espaces anatomiques du défilé thoracique - le triangle interscalénique, l'espace costoclaviculaire et l'espace rétropectoral mineur (tunnel sous-coracoïdien) - le dont le rétrécissement peut entraîner une compression artérielle, veineuse ou nerveuse (Demondion et al. 2000). La compression de ces structures neurovasculaires avec l'apparition de symptômes associés peut survenir au repos ou lors de manœuvres dynamiques, comme lors du maintien du bras au-dessus de la tête et vers l'arrière (hyperabduction). Les symptômes typiques comprennent l'ischémie des membres supérieurs, la pâleur, la fraîcheur, la fatigabilité, la douleur, les crampes musculaires et l'absence de pouls. Dans le syndrome du défilé artériel thoracique, l'imagerie Doppler couleur et l'analyse de la forme d'onde doivent être obtenues à la fois des artères sous-clavières et axillaires. Ces techniques peuvent démontrer des vitesses systoliques maximales élevées dans l'artère sous-clavière au site de compression et un flux sanguin diminué ou absent dans l'artère axillaire (ou les artères distales du bras) avec des manœuvres d'hyperabduction (Fig. 163) (Longley et al. 1992). Ce dernier signe semble en effet plus fiable car la sténose vasculaire survient le plus souvent au niveau de l'espace costo-claviculaire à la suite d'anomalies fibro-osseuses ou fibromusculaires et donc non directement figurable à l'échographie du fait de problèmes d'accès. Une augmentation de rebond des vitesses lors de la libération de l'abduction peut également être notée (Wadhwani et al. 2001). En revanche, dans le syndrome du défilé veineux thoracique, le patient se plaint d'œdème, de cyanose, de fatigabilité et de lourdeur. Dans ces cas, les plans à grand axe au-dessus de la veine axillaire peuvent révéler une diminution progressive de la lumière du vaisseau à proximité de la clavicule et une dilatation veineuse distale (Fig. 164).
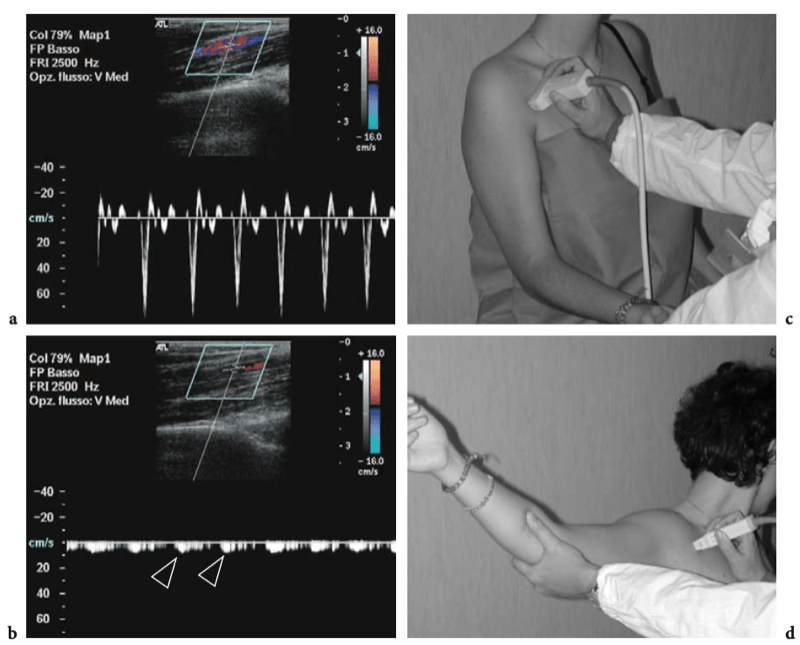
Fig. 163a–d. Syndrome du défilé artériel thoracique. a,b Analyse de la forme d'onde spectrale Doppler obtenue à partir de l'artère axillaire tout en gardant le bras a dans une position neutre et b pendant le test d'hyperabduction. En position neutre, l'artère axillaire présente un flux pulsatile normal à haute résistance. Au cours de la manœuvre d'effort, le flux sanguin artériel normal se transforme brusquement en un schéma post-sténotique «tardus-parvus», caractérisé par des pics systoliques à faible vitesse (têtes de flèches). Ce schéma anormal était transitoire et revenait à la normale dès que le patient reprenait une position neutre. c,d Photographies montrant le positionnement du patient et du transducteur, respectivement.
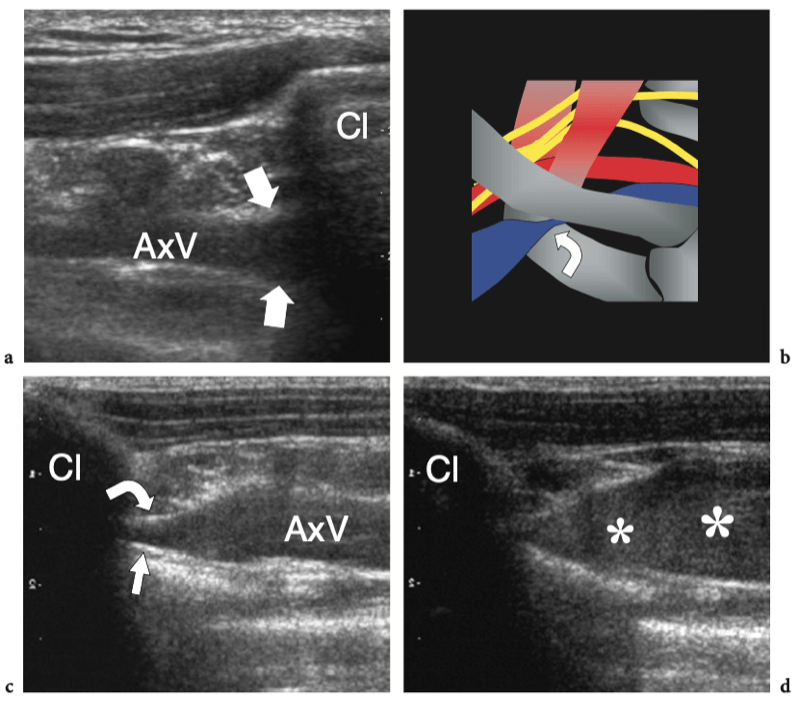
Figures 164a–d. Syndrome du défilé veineux thoracique. a Image échographique grand axe 12–5 MHz de la veine axillaire droite (AxV), obtenue immédiatement latéralement à la clavicule (Cl) chez un patient présentant une compression de la veine axillaire gauche. La veine a une taille normale (flèches) lorsqu'elle passe sous la clavicule. b Le dessin schématique de la région du défilé thoracique illustre l'emplacement typique de la compression veineuse (flèche courbe) au niveau de l'espace costoclaviculaire. c,d Images échographiques grand axe 12–5 MHz de la veine axillaire droite (AxV) obtenues avec le bras c en position neutre et d lors du test d'hyperabduction de Wright. Par rapport au côté droit, la veine axillaire gauche se rétrécit progressivement (flèches) au point où elle passe profondément dans la clavicule à la fois au départ et pendant la manœuvre d'effort. Au cours du test de Wright, la veine se dilate progressivement et le flux sanguin (astérisque) devient stationnaire et échogène, imitant un thrombus. Dans le même temps, il y avait apparition de paresthésies dans le membre supérieur.
Ce signe peut être observé soit au repos et avec une manœuvre d'hyperabduction, soit lors d'une hyperabduction seule. Lorsque la compression se produit lors des tests de provocation, la lumière devient plus échogène en raison de la stase du flux sanguin. Pour la plupart, les causes de la compression veineuse sont liées à des bandes fibreuses ou à des anomalies autour de l'espace costoclaviculaire et, par conséquent, ne peuvent pas être délimitées par l'échographie (Longley et al. 1992). La compression veineuse doit cependant être interprétée avec beaucoup de prudence car elle est souvent observée dans la population asymptomatique (Demondion et al. 2003a). De plus, il faut veiller à exclure une côte cervicale ou un processus transverse allongé de la vertèbre C7, qui sont souvent associés à des bandes fibreuses. Chez ces patients, un contact serré et un impact de l'artère sous-clavière contre la pointe de la côte cervicale peuvent être révélés lors de l'exécution de la manœuvre posturale. Une compression des structures neurales avec paresthésie, engourdissement, picotements, faiblesse progressive et douleur peuvent être associés (syndrome neuro-artériel mixte). Cependant, la détection de la compression nerveuse dynamique dans cette zone est difficile avec l'échographie, soit sous sa forme isolée, soit associée à une maladie vasculaire. Dans l'ensemble, nous pensons que l'IRM présente des avantages importants par rapport à l'échographie pour représenter clairement les différents compartiments du défilé thoracique en mesurant directement la taille du triangle interscalénique, l'espace costoclaviculaire et l'espace mineur pectoral avec le bras le long du corps ou après un examen postural. manœuvre, ainsi que pour démontrer l'emplacement et la cause de la compression (Demondion et al. 2000, 2003).
67. MASSES DES ÉPAULES
Selon l'âge de présentation, jusqu'à 60 % des tumeurs bénignes des tissus mous apparaissant autour de l'épaule sont des lipomes (Kransdorf 1995). Détection par échographie des lipomes superficiels apparaissant dans le tissu sous-cutané (Fig. 165a, b), dans les plans graisseux de l'aisselle ou profondément dans le muscle deltoïde antérieur (Fig.165c,d) n'est généralement pas un problème de diagnostic. En revanche, les lésions profondes à l'intérieur ou entre les muscles de l'épaule peuvent être difficiles à reconnaître avec l'échographie. (Fig. 165e-g). Dans ces cas, le contact de la masse avec les structures anatomiques environnantes lors de certains mouvements du bras peut entraîner des symptômes pouvant mimer un véritable syndrome de conflit. S'ils surviennent dans la région des faisceaux neurovasculaires, les lipomes peuvent également provoquer une compression des nerfs, entraînant faiblesse, douleur et engourdissement. Outre les lipomes, les autres tumeurs des tissus mous apparaissent autour de l'épaule avec une incidence similaire à celle ailleurs dans le corps. Une affection particulière semblable à une tumeur qui a une prédilection pour la région de l'épaule est l'élastofibrome dorsal, qui est presque invariablement situé dans la partie inférieure de l'espace thoracoscapulaire élevant l'angle inférieur de l'omoplate. Cela mérite une discussion à part.
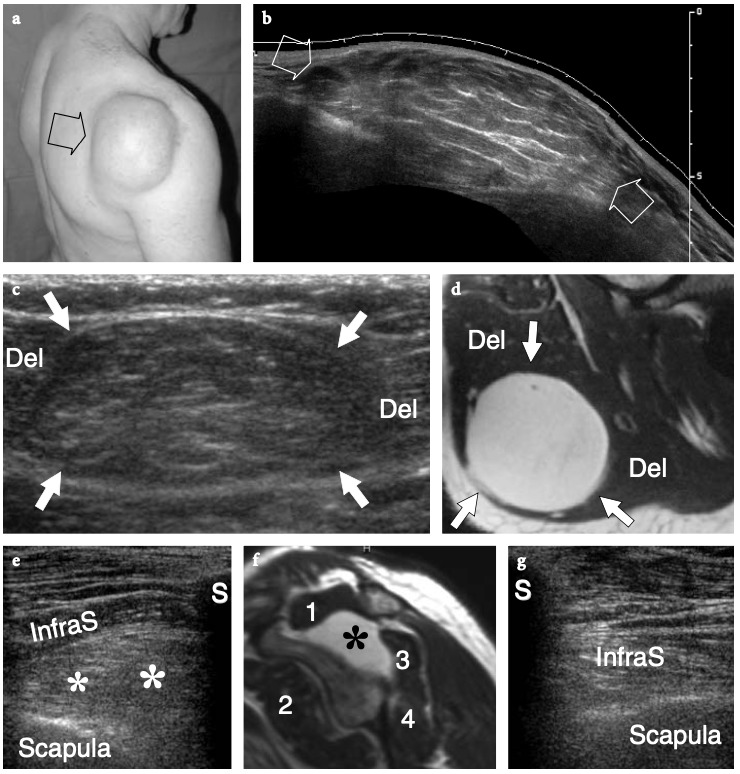
Fig. 165a–g. Lipomes autour de la ceinture scapulaire : spectre des apparitions américaines. a, b Lipome sous-cutané. a La photographie montre une masse proéminente des tissus mous (flèche) située sur la face postérieure de l'épaule. b L'image US à champ de vision étendu de 12 à 5 MHz montre une masse solide superficielle (flèches) dans le tissu sous-cutané, caractérisée par des échos linéaires minces et hautement réfléchissants orientés parallèlement à la peau et intégrés dans un fond hypoéchogène, compatible avec un lipome . c,d Lipome intramusculaire. c L'image US transversale 12–5 MHz avec corrélation d'imagerie IRM pondérée en T1 montre une masse solide compressible ovoïde (flèches) avec des contours bien définis à l'intérieur du muscle deltoïde (Del). Notez l'échotexture typique et l'intensité homogène du signal T1 élevé de la masse. e–g Lipome intermusculaire profond. e Image échographique sagittale 12–5 MHz sur la fosse sous-épineuse droite avec corrélation d'imagerie IRM sagittale f oblique pondérée en T1 révèle un lipome hyperéchogène homogène (astérisque) provoquant un déplacement superficiel du muscle sous-épineux (InfraS). S, spina de l'omoplate ; 1, sus-épineux ; 2, sous-scapulaire ; 3, infrasp- inatus ; 4, petit rond. Le patient se plaignait de douleurs à l'épaule droite exacerbées par la rotation interne du bras et a subi un examen échographique pour une suspicion de syndrome de conflit. g Aspect échographique de la fosse postérieure gauche normale pour comparaison.
68. ELASTOFIBROME DORSAL
L'élastofibrome dorsi est une pseudotumeur réactive à croissance lente composée d'un mélange de tissu fibroélastique et de graisse qui apparaît généralement sur le dos, en profondeur par rapport aux muscles rhomboïde majeur, dentelé antérieur et grand dorsal et adjacent à l'angle inférieur de l'omoplate. Le trouble a une prédominance chez les femmes, est souvent associé à un travail manuel pénible et survient plus fréquemment chez les personnes âgées (Kransdorf et al. 1992). D'après les données histopathologiques, l'élastofibrome dorsal est composé de plusieurs plans de tissus adipeux et fibreux alternés contenant des fibres élastiques épaisses, ce qui donne l'aspect strié typique de la masse. On a émis l'hypothèse que l'élastofibrome dorsal résulte de fibroblastes périostés avec une élastogenèse dérangée, mais on ne sait pas si ce changement est primaire ou résulte d'un frottement mécanique répété entre la pointe de l'omoplate et la paroi thoracique (Kransdorf et al. 1992). Dans plus de la moitié des cas, l'élastofibrome dorsal est bilatéral et asymptomatique, suggérant que de nombreux élastofibromes sont cliniquement occultes. En effet, lorsque le bras est en position neutre, l'omoplate peut recouvrir la tumeur et la masquer complètement (Fig. 166a, b) (Kransdorf et al. 1992) : ceci peut expliquer en partie le décalage entre l'incidence relativement rare de ces masses retrouvées cliniquement et la prévalence plus élevée rapportée dans les grandes séries d'autopsies (Jarvi et Lansimies 1975). Lors de l'examen américain, l'élastofibrome dorsal doit être examiné en gardant les bras en adduction et en rotation interne, afin de le repositionner sous l'omoplate pour un examen adéquat (Bianchi et al. 1997 ; Dalal et al. 2002). Les lésions apparaissent comme des masses en forme de croissant mal définies se développant dans le plan graisseux interposé entre les muscles dorsaux extrinsèques et le plan costal (Fig.166c,d).
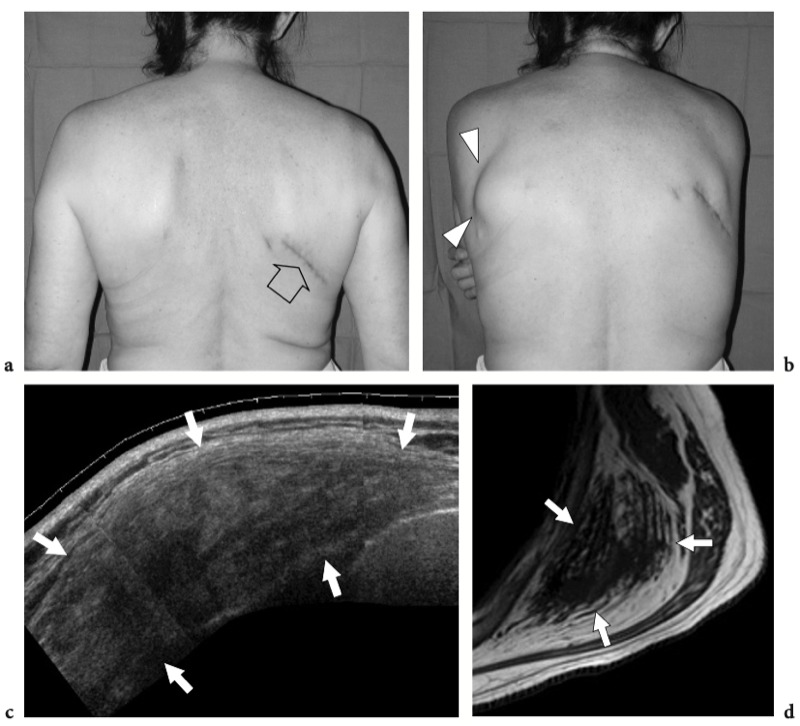
Figures 166a–d. Elastofibrome dorsal chez une femme qui avait déjà subi une intervention chirurgicale pour un élastofibrome droit. a,b Photographies du dos du patient obtenues a bras le long du corps et b en rotation interne. La flèche indique la cicatrisation post-chirurgicale. Lors de la rotation interne, un effet de masse (pointes de flèches) devient évident dans le dos à gauche. c Une image US à champ de vision étendu de 12 à 5 MHz avec une corrélation d'imagerie IRM transversale pondérée en T1 révèle un élastofibrome dorsal (flèches). La masse présente un aspect strié typique dû à des bandes de graisse hypoéchogènes dans un fond échogène reflétant le tissu fibroélastique. Ce motif correspond étroitement aux brins hypointenses intégrés dans un fond gras observés sur l'imagerie IRM.
Leurs limites ne sont pas clairement séparées de celles des muscles superficiels, puisque l'échotexture tumorale se confond avec celle du muscle squelettique. Les élastofibromes ont une texture particulière composée d'un fond échogène inhomogène avec des brins hypoéchogènes linéaires ou curvilignes entrecoupés, reflétant l'histologie de la tumeur : ces brins sont généralement disposés en série avec une orientation oblique dans toute la masse. Une comparaison individuelle avec les résultats de la tomodensitométrie, de l'imagerie par résonance magnétique et de la pathologie macroscopique a révélé que les brins hypoéchogènes sont compatibles avec les zones de graisse, tandis que le fond échogène reflétait la masse principalement fibroélastique de la masse (Fig. 167) (Bianchi et al. 1997). Il est connu que la graisse peut prendre une échogénicité variable à l'US, y compris un aspect anéchoïque (graisse pure) ou un aspect hyperéchogène (graisse entrecoupée d'autres tissus). Il a été clairement démontré que la graisse pure est anéchoïque, alors que la graisse intercalée avec d'autres tissus a tendance à devenir hyperéchogène (Fornage et al. 1991). Le gras à l'intérieur des rayures est relativement homogène. On peut donc s'attendre à ce qu'il soit hypoéchogène. En revanche, l'échogénicité plus élevée du fond fibroélastique de la masse pourrait résulter principalement de la quantité d'interfaces acoustiques causées par le tissu fibreux contre la graisse intercalée ou par l'hétérogénéité intrinsèque du tissu fibreux lui-même, reflétant des proportions et une distribution variables des fibres élastiques dégénérées et du collagène. . Bien qu'il ait été démontré que les élastofibromes avaient un métabolisme accru du fluorodésoxyglucose (FDG) lors de la tomographie par émission de positrons (TEP) et de la TEP-CT (Pierce et Henderson 2004), l'imagerie Doppler couleur ne détecte généralement pas les signaux de flux sanguin en leur sein (Bianchi et al. 1997) . Les principaux diagnostics différentiels des masses parascapulaires sont les lipomes et les métastases (Fig. 168a – c).
Figure 167a,b. Elastofibrome dorsal. a Une image US transversale 12–5 MHz avec corrélation b CT révèle une masse en forme de croissant mal définie (grandes flèches) avec l'aspect strié typique fait d'alternance de plans hypoéchogènes de graisse (petites flèches) et de tissu fibroélastique. L'élastofibrome dorsal se développe dans le plan graisseux interposé entre les muscles dorsaux extrinsèques (tête de flèche) et le plan costal (flèche courbe).
Figures 168a–e. Masses des tissus mous parascapulaires : spectre des résultats. a–c Métastase costale. a Image échographique transversale de 12 à 5 MHz sur une masse parascapulaire droite palpable chez une patiente atteinte d'un carcinome du sein avec une corrélation d'imagerie IRM pondérée en T1 b et pondérée en T2 avec suppression de la graisse c montrant une masse hypoéchogène (flèches) provenant d'une côte, une apparence bien différente de celle de l'élastofibrome. d,e Hémangiome veineux. d L'image US transversale 12–5 MHz sur la paroi thoracique postérolatérale révèle une masse hyperéchogène parascapulaire mal définie (têtes de flèches) contenant des structures hypoanéchogènes tortueuses. Une telle disposition irrégulière des composants hypoéchogènes internes est atypique pour un élastofibrome. Sc, omoplate ; R, côte. e L'IRM transversale pondérée en T2 avec suppression de la graisse a révélé un hémangiome veineux (têtes de flèches) contenant des vaisseaux intratumoraux dilatés. Dans ce cas particulier, l'imagerie Doppler couleur n'a pas aidé au diagnostic car les vitesses dans les vaisseaux intratumoraux étaient trop lentes.
Cependant, l'élastofibrome a un aspect US typique qui devrait permettre de le distinguer de ces lésions sur la base d'un schéma multicouche bien défini. Des écueils diagnostiques peuvent être rencontrés avec l'échographie en cas d'hémangiomes parascapulaires. En fait, les hémangiomes peuvent présenter un aspect complexe mal défini avec des composants hyperéchogènes proéminents reflétant la graisse et des canaux vasculaires hypoéchogènes proéminents. (Fig. 168d, e). L'aspect hypervasculaire de ces masses au Doppler couleur et la détection de phlébolithes (qui surviennent dans environ 50 % des cas) doivent aider au diagnostic différentiel. La distinction entre les élastofibromes et les desmoïdes extra-abdominaux, qui contiennent des quantités variables de collagène et peuvent également se trouver autour de l'épaule, repose essentiellement sur l'absence de stries bien définies à l'échographie. Dans l'ensemble, nous pensons que, dans le cadre clinique approprié, le diagnostic d'élastofibrome basé aux États-Unis peut éviter l'anxiété inutile du patient et la nécessité d'une imagerie supplémentaire et d'une intervention chirurgicale ou d'une biopsie inutile.