1. CONSIDÉRATIONS HISTOLOGIQUES
Dans l'ensemble, les muscles squelettiques peuvent être considérés comme le plus grand organe du corps humain, représentant environ 25 à 35 % du poids corporel total chez les femmes et 40 à 50 % chez les hommes (Hollman et Hettiger 1990). Ils sont constitués de deux composants : les fibres musculaires, de structure longue et cylindrique, représentant l'unité cellulaire du muscle, et le tissu conjonctif stromal. Les fibres musculaires individuelles sont regroupées en faisceaux, communément appelés faisceaux, et plusieurs faisceaux se rejoignent pour former un muscle individuel (Fig. 1a). Les brins de tissu conjonctif minces de l'endomysium - séparent les fibres musculaires individuelles ; une gaine conjonctive plus importante avec de petits vaisseaux et des terminaisons nerveuses, le périmysium (également appelé septa fibroadipeux), enveloppe les fascicules individuels ; une épaisse couche fibreuse, l'épimysium, entoure tout le muscle (Fig. 1a). Les fibres musculaires varient en longueur et en diamètre de section en fonction du muscle individuel. Les faisceaux peuvent être grossiers, comme dans le cas des grands muscles, ou très fins, comme dans le cas des petits muscles qui coordonnent un mouvement précis (Erickson 1997). Ils s'insèrent dans les différents composants du tissu conjonctif du muscle, y compris l'épimysium périphérique et les grands septa centraux formés par des septa fibroadipeux convergents. À leur extrémité distale, les septa intramusculaires se rejoignent en grandes couches tendineuses - communément appelées aponévroses - ou directement aux tendons.
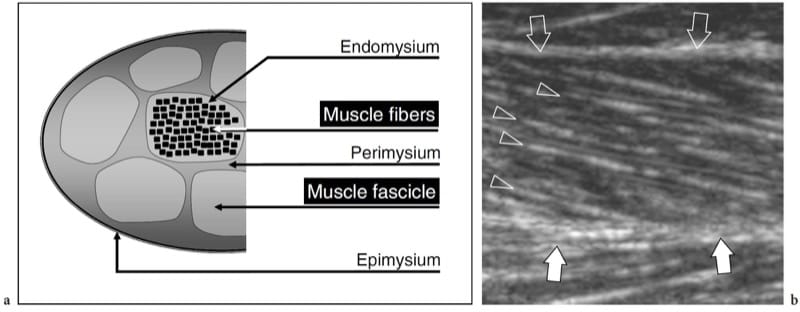
Figure 1.a,b. Anatomie musculaire squelettique. un dessin schématique illustre l'organisation histologique du tissu musculaire. Les fibres musculaires individuelles sont disposées en faisceaux. Des brins de tissu conjonctif lâches enveloppent les fibres (endomysium), les faisceaux (périmysium) et l'ensemble du muscle (épimysium). b L'image américaine à 12.5 MHz sur le grand axe de la tête médiale du gastrocnémien montre d'innombrables lignes hyperéchogènes (têtes de flèches) compatibles avec le périmysium. Notez le trajet oblique de ces échos lorsqu'ils convergent vers l'aponévrose (flèches blanches). L'épimysium (flèches vides) délimite les limites externes du muscle.
La disposition interne du muscle varie en fonction de l'orientation fasciculaire, qui reflète la forme et la fonction musculaire globale. Une disposition parallèle se trouve dans les muscles en forme de sangle (par exemple, couturier) et quadrilatéraux (par exemple, thyrohyoïdien), dans lesquels les fibres parcourent presque toute la longueur du grand axe du muscle; le rectus abdominis présente une disposition similaire, mais le trajet des fibres est interrompu par des intersections tendineuses orientées transversalement (Erickson 1997). Les faisceaux des muscles fusiformes ont une orientation parallèle dans la partie médiane, mais ils convergent vers le tendon aux extrémités musculaires (Fig. 2a). Une disposition fasciculaire oblique (en forme de plume) par rapport à la ligne de traction caractérise les muscles pennés (Fig. 2b, c). Du point de vue biomécanique, l'architecture de ces muscles augmente la surface d'insertion des faisceaux afin de produire une force plus élevée pour un poids musculaire donné. Les muscles pennés comprennent les muscles de forme triangulaire (p. ex. long adducteur), unipennés ou semipennés (p. ex. long fléchisseur du pouce), bipennés (p. ex. droit fémoral), multipennés (p. ex. deltoïde) et circumpennés (p. ex. tibial antérieur) (Erickson 1997). Dans les muscles bipennés, les fascicules convergent en un seul tendon central, tandis que les muscles multipennés présentent plus d'un tendon traversant la substance musculaire. Les fascicules peuvent également prendre une disposition en spirale dans les muscles qui se courbent ou ont une trajectoire en spirale entre l'origine et l'insertion (par exemple, grand pectoral, supinateur). De plus, les muscles sont composés d'un seul ventre ou peuvent avoir une architecture interne complexe composée de plusieurs têtes d'origine différente (par exemple, deux têtes pour le biceps brachial et le biceps femoris ; trois têtes pour le triceps brachial et le triceps sural ) et se rejoignent pour générer un tendon distal. Du point de vue histologique, les fibres musculaires peuvent être divisées en type 1 (fibres rouges) et type 2 (fibres blanches), qui ont une structure, un comportement métabolique et fonctionnel différents. Les fibres de type 1, également appelées fibres à contraction lente, ont un diamètre plus petit, plus de vaisseaux sanguins et de myoglobine, et sont mieux adaptées aux contractions lentes mais prolongées. Les fibres de type 2, également connues sous le nom de fibres à contraction rapide, sont de plus grande taille, ont moins de vaisseaux sanguins et une teneur en myoglobine plus faible, et sont capables de contractions puissantes de courte durée. Chaque muscle est constitué d'un mélange des deux types de fibres : dans certains muscles, les fibres de type 2 sont prédominantes (chef médial du gastrocnémien) ; dans d'autres, les fibres de type 1 sont le principal composant (muscle soléaire).
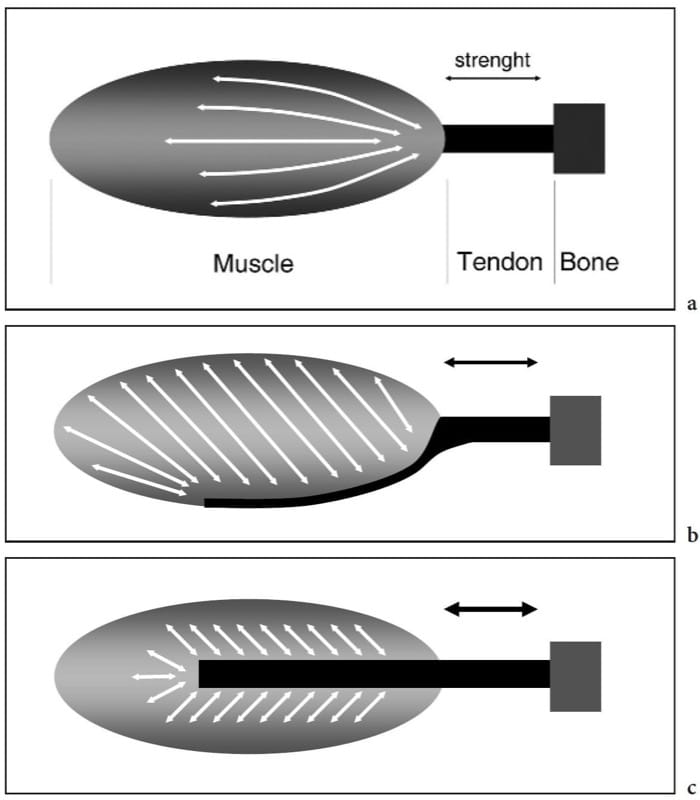
Figure 2. a–c. Anatomie musculaire squelettique. Des dessins schématiques montrent l'architecture interne des muscles squelettiques. un muscle fusiforme. Les faisceaux ont une disposition parallèle dans la partie médiane du muscle et convergent distalement vers le tendon. Cela conduit à une plage de raccourcissement élevée et à une grande vitesse de mouvement, mais entraîne une faible résistance. b Muscle unipenné. Les fascicules sont disposés selon un angle par rapport à la direction dans laquelle le tendon se déplace et sont insérés d'un côté de l'aponévrose. Cela se traduit par une plus grande surface de fibres musculaires le long de l'axe de contraction et produit plus de force au détriment d'une gamme réduite de raccourcissement. c Muscle bipenné. Les fascicules s'insèrent de part et d'autre d'une aponévrose centrale. Cette disposition produit la force la plus élevée mais le raccourcissement inférieur du muscle. Du point de vue biomécanique, la quantité de force qu'un muscle peut générer est proportionnelle à la surface des fibres musculaires multipliée par le cosinus de l'angle muscle-tendon.
Lors de la contraction musculaire, la force est transmise au squelette par le tendon ou l'aponévrose et peut entraîner ou non un mouvement articulaire. Il existe trois types différents de contraction musculaire : isométrique, lorsque le muscle se contracte mais qu'il n'y a pas de changement dans sa longueur (Figures 3a,d); isotonique, lorsque le muscle se contracte et se raccourcit simultanément (Figures 3b, e); et excentrique, lorsque le muscle se contracte et, en même temps, s'allonge (Figures 3c,f).
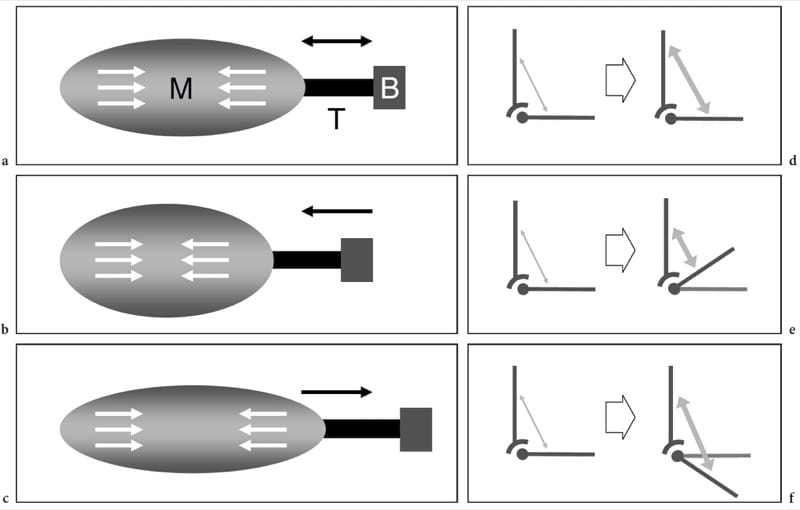
Figure 3. af Biomécanique musculaire. a–c Les dessins schématiques de l'unité muscle (M) – tendon (T) – os (B) avec les diagrammes de force vectoriels d–f correspondants illustrent les principaux types de contraction musculaire. Les flèches blanches dans les muscles et les flèches grises dans les diagrammes indiquent la contraction. a,d Contraction isométrique. La longueur du muscle reste la même lorsqu'il génère une tension (flèches) au tendon. Ce type de contraction est également appelé contraction statique et un exemple consiste à tenter de soulever un objet immobile ou à tenir un poids à bout de bras. b,e Contraction isotonique. Le muscle se raccourcit en se contractant.
De nombreuses activités impliquent ce type de contraction. Un exemple de contraction isotonique est la flexion du muscle biceps pour soulever un objet. c, f Contraction excentrique. Cette contraction est à l'opposé de l'isotonique. Le muscle s'allonge à mesure qu'il gagne en tension (flèches) et la charge est très élevée. Un exemple est de descendre les escaliers ou d'atterrir au sol après un saut.
2. ANATOMIE AMÉRICAINE NORMALE ET TECHNIQUE DE NUMÉRISATION
Lors de l'examen des muscles, le choix du transducteur approprié et de la bande de fréquence US dépend de divers facteurs, notamment la taille globale du ventre musculaire, sa position par rapport à la surface de la peau (profonde ou superficielle) et la visibilité du tissu sous-cutané et plans intermédiaires des tissus mous. Pour un examen adéquat, les muscles de la main nécessitent des sondes de petite taille travaillant à des fréquences élevées (bande de fréquence 7–15 MHz), tandis que les gros muscles profonds de la cuisse ou de la fesse peuvent être mieux évalués au moyen de sondes à basse fréquence (bande de fréquence 3.5). –10 MHz). Plusieurs zones focales doivent être sélectionnées et ajustées à la profondeur appropriée afin d'améliorer les capacités de résolution sur la région d'intérêt. La technologie à champ de vision étendu augmente considérablement la capacité de l'échographie à représenter des muscles larges et longs sur une seule image ainsi qu'à mesurer la taille de grandes lésions intramusculaires, telles que des hématomes et des tumeurs (Barberie et al. 1998).
Le patient doit être examiné dans une position confortable pendant la relaxation complète, la contraction isométrique et isotonique. Avant de commencer l'examen, quelques notes sur l'histoire clinique du patient doivent être recueillies par l'examinateur avec une référence particulière au traumatisme sportif antérieur (date et mécanisme de la blessure). L'inspection de la zone corporelle affectée est également nécessaire pour exclure un gonflement et une ecchymose locaux; ensuite, la palpation du muscle peut révéler une sensibilité locale et un effet de masse. Surtout dans un contexte traumatique, une localisation précise de la douleur référée peut aider à rendre l'examen américain plus ciblé et à raccourcir la durée de l'examen. Ensuite, l'échographie est réalisée au moyen de plans d'image à axe long et court sur le muscle affecté au repos et lors d'activations musculaires répétées. Lors de l'examen des muscles profonds, la compression de la sonde peut aider à réduire l'épaisseur des structures des tissus mous sus-jacentes, facilitant ainsi l'évaluation échographique. Chez les patients présentant une hernie musculaire, une pression excessive de la sonde peut entraîner sa réduction partielle ou complète, rendant le diagnostic difficile. Dans ces cas, l'utilisation d'une quantité généreuse de gel et le positionnement approprié du patient (c'est-à-dire accroupi pour les hémiémies situées dans le compartiment antérolatéral de la jambe) pour augmenter la pression intrafasciale peuvent améliorer la visibilité de la hernie. La taille des muscles peut être facilement évaluée par échographie au moyen de plans de balayage en coupe. Mesurées par dynamométrie, les différences de taille musculaire sont corrélées à la force musculaire (contractions isométriques maximales) chez les sujets sains et les patients atteints de myosite (Chi-Fishman et al. 2004). L'hypotrophie ou l'hypertrophie musculaire physiologique peut être facilement appréciée sur des plans échographiques petit axe : lors de ces mesures, il faut toutefois veiller à éviter toute pression avec la sonde pouvant altérer la précision des mesures et la comparaison avec le muscle controlatéral. Dans l'ensemble, l'échographie peut être considérée comme une alternative valable à l'imagerie par résonance magnétique pour évaluer la section transversale des muscles et est en mesure de fournir des informations sur ses changements en réponse à l'entraînement ou à l'inutilisation (Reeves et al. 2004).
L'échotexture des muscles squelettiques normaux consiste en un fond relativement hypoéchogène reflétant des faisceaux musculaires et des brins hyperéchogènes linéaires clairement délimités liés aux septa fibroadipeux (périmysium). Les tendons intramusculaires et les aponévroses apparaissent sous forme de bandes hyperéchogènes qui sont généralement mieux appréciées sur les images petit axe du muscle (Fig. 4). Le rapport entre les composants hypoéchogènes et hyperéchogènes du muscle reflète la proportion entre le tissu conjonctif et les fascicules musculaires. Il est variable et diffère selon les muscles - par exemple, le triceps brachial est moins échogène que le biceps brachial (Walker et al. 2004). Le schéma interne des septa fibroadipeux change avec l'âge (Binzoni et al. 2001). Sur les balayages à petit axe, l'échotexture musculaire se compose de petits réflecteurs en forme de points représentant des septa fibroadipeux entrecoupés de faisceaux musculaires hypoéchogènes (Fig. 5a). Bien que dans une moindre mesure que dans les tendons, la structure ordonnée des fascicules et des septa fibroadipeux rend les muscles des structures anisotropes, en particulier lorsqu'ils sont examinés sur des plans à petit axe (Fig. 5a, b). L'angle entre le faisceau US et le muscle est critique : un angle qui s'écarte de la perpendiculaire fait apparaître le muscle de manière artificiellement hypoéchogène. Sur les images grand axe, les septa fibroadipeux apparaissent comme des lignes droites hyperéchogènes présentant une disposition grossièrement parallèle. Les échos des septa fibroadipeux sont moins uniformes et moins réfléchissants que ceux observés dans les tendons. Selon la disposition des fibres musculaires et des septa fibroadipeux, l'échographie est capable de reconnaître l'architecture interne des muscles pennés comme semi-pennés, unipennés, bipennés ou multipennés (Fig. 6). Les vaisseaux intramusculaires circulant dans les septa hyperéchogènes sont visibles sur l'imagerie Doppler couleur et puissance. Le fascia musculaire externe (épimysium) apparaît comme une enveloppe échogène bien délimitée circonscrivant le muscle hypoéchogène. De grands septa hyperéchogènes (aponévroses) dirigés à l'intérieur du ventre musculaire peuvent en résulter. Dans les muscles complexes, une gaine fasciale hyperéchogène individuelle entoure chaque ventre musculaire, aidant ainsi l'examinateur à reconnaître les différentes têtes. L'interstice entre les fascias juxtaposés de deux muscles adjacents apparaît comme une bande hypoéchogène et correspond à un tissu conjonctif lâche qui permet un certain glissement des muscles lors de la contraction. Les interruptions focales du fascia musculaire se trouvent aux points où les nerfs, les veines et les artères (vaisseaux perforants) pénètrent dans les muscles. Lorsque le fascia musculaire se trouve sous le tissu sous-cutané, il adhère au fascia superficiel et ne peut en être distingué.
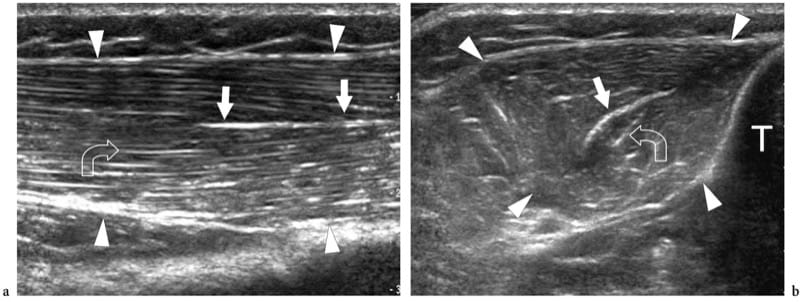
Figure 4.a,b. Aponévroses intramusculaires. a Les images américaines grand axe et b petit axe 12–5 MHz du muscle tibial antérieur normal (têtes de flèches) montrent l'arrangement en forme de plume d'un muscle circumpenné créé par la convergence des septa fibroadipeux sur l'aponévrose interne. L'aponévrose (flèches droites) apparaît comme un écho linéaire hautement réfléchissant dans le muscle qui est plus épais que les septa fibroadipeux (flèche courbe). T, tibia.
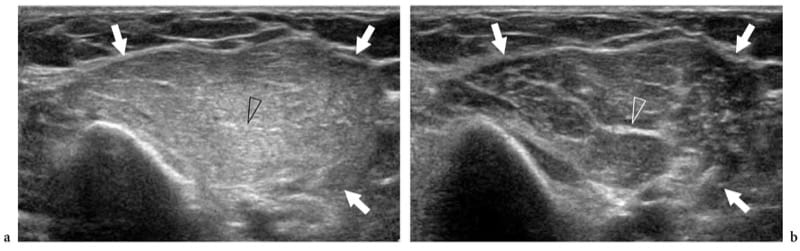
Figure 5.a,b. Anisotropie musculaire. Images US petit axe 17–5 MHz du muscle biceps brachial (flèches) examinées avec un angle perpendiculaire entre la face du transducteur et l'orientation des fibres musculaires et b un angle légèrement déviant de la perpendiculaire. En a, le muscle apparaît hyperéchogène de manière diffuse en raison de la réflectivité spéculaire la plus élevée des interfaces du périmysium. En b, le muscle global devient plus hypoéchogène avec une diminution de l'intensité des échos du périmysium. En revanche, les plus grands septa fibroadipeux (tête de flèche) sont plus visibles. L'inclinaison de la sonde sur le muscle peut être utile pour distinguer les modèles hypoéchogènes artéfactuels des souches légères.
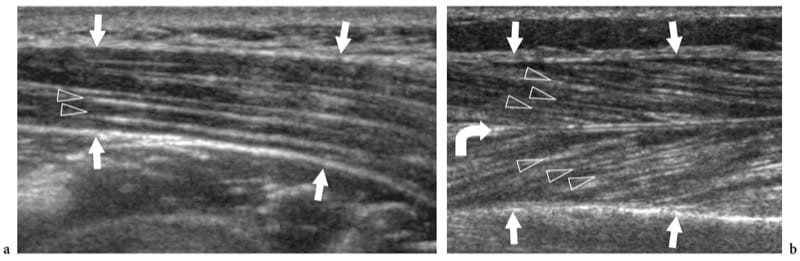
Figure 6.a,b. Architecture interne des muscles squelettiques. un muscle fusiforme. L'image US à axe long 12–5 MHz sur le muscle deltoïde (flèches) montre les septa fibroadipeux (têtes de flèches) sous forme de lignes hyperéchogènes séparant les faisceaux musculaires hypoéchogènes. Ces septa ont une disposition parallèle le long du ventre musculaire. b Muscle penné. L'image américaine à 125 MHz sur le long axe du muscle tibial antérieur (flèches) montre les septa fibroadipeux (têtes de flèches) lorsqu'ils convergent vers l'aponévrose hautement réfléchissante (flèche incurvée), donnant l'apparence d'une plume.
L'échographie dynamique effectuée pendant la contraction musculaire peut montrer des changements dans la taille et la relation des fascicules et des septa fibroadipeux. Sur les plans à petit axe, les muscles contractés apparaissent généralement plus épais et plus hypoéchogènes. Les septa intramusculaires changent d'apparence et d'orientation sous l'action des fibres musculaires qui s'attachent à ces structures. Dans le chef médial du gastrocnémien, par exemple, l'angle de pennation augmente de 15.5 ° à 33.6 ° lorsqu'il est examiné pendant la contraction isométrique (Fig. 7) (Narici et al. 1996). Le raccourcissement des muscles est bien apprécié sur les images grand axe lors de la contraction concentrique. Récemment, une méthode pour mesurer la perfusion des tissus musculaires au moyen d'un Doppler de puissance à contraste amélioré a été développée avec une quantification du flux sanguin intramusculaire effectuée au repos et après l'exercice (Krix et al. 2005).
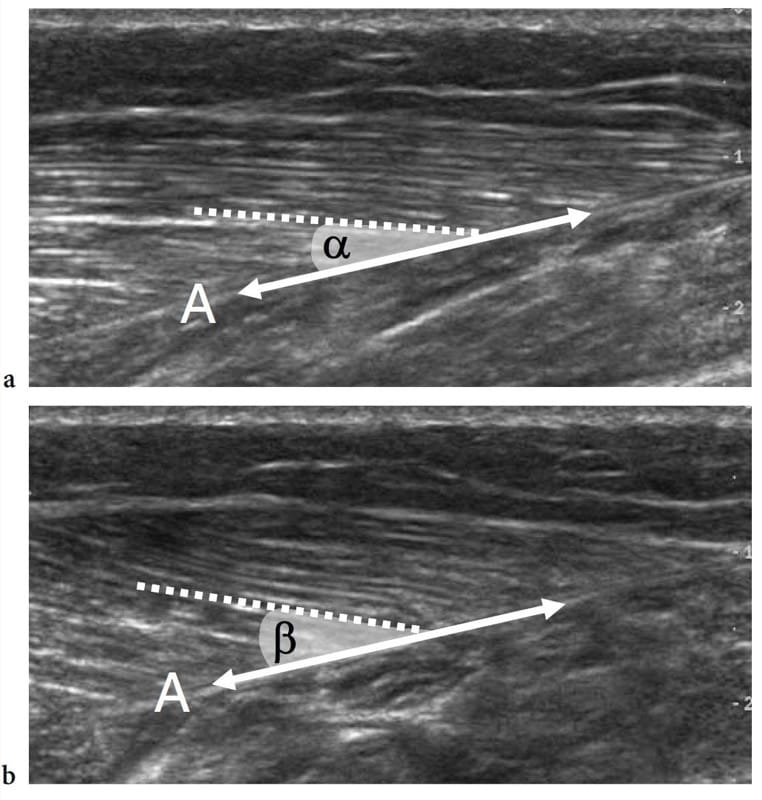
Figure 7.a,b. Angle de fanion. Les images américaines long axe 12–5 MHz de la tête médiale du gastrocnémien obtenues a au repos et b pendant la contraction isométrique démontrent une augmentation de l'angle de pennation lors de l'activation musculaire. L'angle de pennation est donné par l'incidence des fibres musculaires (ligne pointillée) par rapport à l'aponévrose (A), qui représente la direction de génération de force (double flèche). Notez que cet angle est plus grand pendant la contraction (β) qu'au repos (α).
3. VARIANTES ANATOMIQUES ET TROUBLES HERITABLES
Agénésie musculaire, muscles anormaux et accessoires
L'agénésie musculaire indique l'absence d'un muscle ou d'une tête d'un muscle complexe à la suite d'un développement incomplet ou imparfait. En général, le diagnostic est déjà évident à l'examen physique. Un examen américain peut être nécessaire pour confirmer les résultats cliniques (Fig. 8). Une technique de balayage précise est généralement nécessaire pour différencier l'aplasie vraie d'une hypoplasie marquée ou d'une atrophie musculaire. Les muscles grand pectoral et petit pectoral sont les muscles congénitalement absents les plus courants chez l'homme.
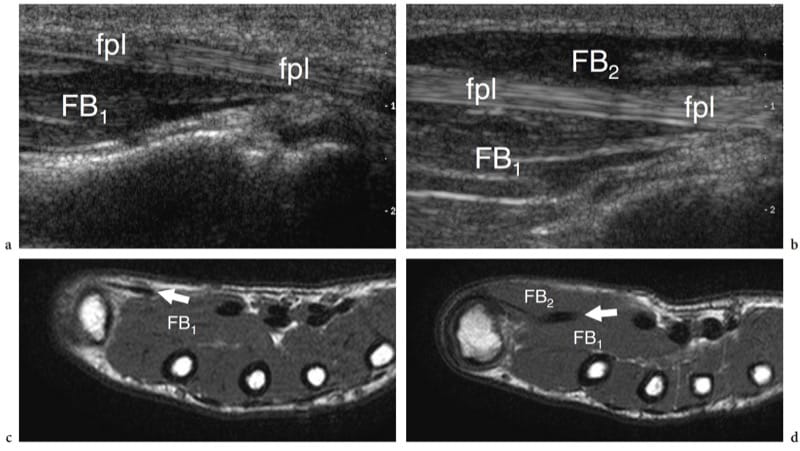
Figure 8. a–d. Agénésie musculaire. Des images échographiques grand axe 12-5 MHz sur les tendons fléchisseurs longs fléchisseurs du pouce gauche et b droit (fpl) chez un enfant de 8 ans présentant une perte chronique de volume de l'éminence thénar gauche montrent l'absence congénitale du ventre superficiel (FB2 ) des muscles court fléchisseur du pouce et court abducteur du pouce. Du côté atteint, le tendon du long fléchisseur du pouce adopte un trajet plus superficiel étant donné l'absence du muscle. Notez le ventre profond intact du court fléchisseur du pouce (FB1). c,d Les images IRM pondérées en T1 corrélatives démontrent la relation entre le tendon du long fléchisseur du pouce (fpl) et les ventres du court fléchisseur du pouce. L'échographie est utile pour distinguer une véritable agénésie d'une hypoplasie marquée ou d'une atrophie musculaire
Les muscles anormaux et accessoires ne sont pas des anomalies du développement rares (Yu et Resnick 1994 ; Zeiss et Guilluiam-Hadet 1996 ; Harvie et al. 2004 ; Kouvalchouk et Fisher 1998). Nous pouvons définir les variantes de l'anatomie musculaire normale comme des «muscles anormaux» et les muscles surnuméraires qui ne sont généralement pas présents comme des «muscles accessoires». Dans la plupart des cas, les muscles anormaux et accessoires passent inaperçus pour le patient car ils sont invisibles et asymptomatiques. Dans certains cas, cependant, ils peuvent devenir cliniquement pertinents. Cela peut se produire : lorsqu'ils sont apparents à la surface de la peau imitant un néoplasme des tissus mous, par exemple palmaris inversé au poignet (Paul et al. 1991 ; Bianchi et al. 1995b) ; lorsqu'ils se développent dans des tunnels ostéofibreux provoquant des symptômes de piégeage des nerfs, par exemple, le long fléchisseur accessoire des doigts et le syndrome du tunnel tarsien (Pla et al. 1996 ; Sammarco et Stephens 1990) ; ou lorsqu'ils provoquent des douleurs pendant l'exercice physique, par exemple, soléaire accessoire) en raison d'une ischémie liée à une augmentation de la pression intrafasciale ou à une tendinopathie de surmenage (Peterson et al. 1993). Le diagnostic d'un muscle anormal/accessoire repose principalement sur la reconnaissance de sa localisation typique et sur les caractéristiques d'imagerie. L'échographie montre que les muscles anormaux/accessoires sont des structures allongées bien circonscrites avec le schéma échotextural typique des muscles normaux (Montet et al. 2002). Un petit tendon peut être trouvé à l'extrémité du muscle. L'examen dynamique révèle un schéma de contraction normal. Lors de l'activation musculaire, les images à petit axe montrent une taille accrue et une diminution de l'échogénicité du ventre musculaire en raison du raccourcissement des fibres musculaires. Les muscles accessoires les plus courants du membre supérieur et inférieur qui se prêtent à l'examen échographique sont : le chondroépitrochléaire au bras, l'épitrochléaire anconé au coude (Masear et al. 1988) ; les muscles longs palmaires anormaux (Schuurman et van Gils 2000) et Gantzer (al-Qattan 1996) au niveau de l'avant-bras ; l'origine proximale des muscles lombricaux (Timins 1999), le ventre musculaire anormal du fléchisseur superficiel des doigts de l'index (Martinoli et al. 2000a), l'abducteur digiti minimi (Harvie et al. 2003, 2004) et l'extenseur digitorum brevis manus (Rodriguez-Niedenfuhr et al. 2002) au poignet et à la main ; le tenseur du fascia sural au niveau du genou (Montet et al. 2002) ; et le soléaire accessoire (Bianchi et al. 1995b), le peroneus quartus (Chepuri et al. 2001) et le long fléchisseur accessoire des doigts (Cheung et al. 1999) à la cheville (Fig. 9). La connaissance de leurs localisations les plus fréquentes et la connaissance des syndromes cliniques possibles produits par ces muscles sont les piliers d'un diagnostic d'imagerie correct, évitant ainsi la confusion avec d'autres conditions pathologiques et une chirurgie inutile. Dans les cas douteux, l'examen échographique du côté controlatéral peut renforcer la confiance de l'examinateur dans la présence d'un muscle anormal/accessoire.
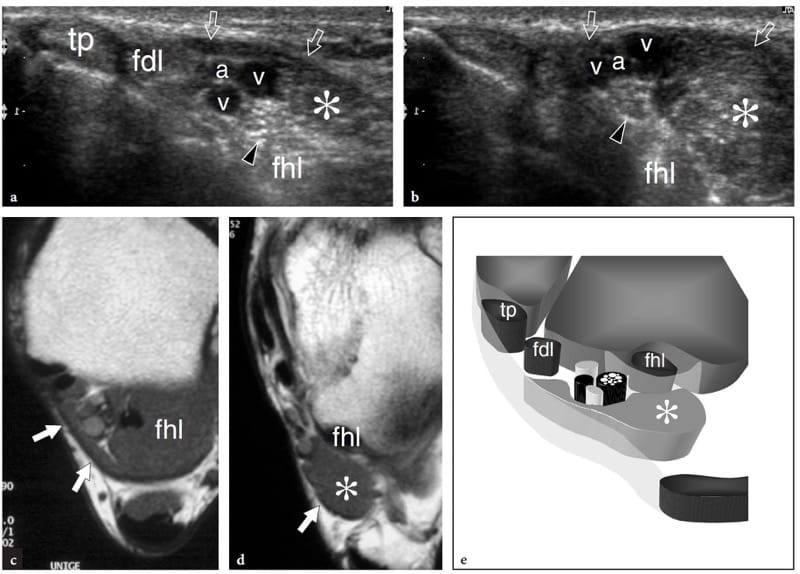
Figure 9. a–e. Muscle accessoire de la cheville. a,b Images échographiques transversales 12-5 MHz sur la cheville médiale a proximale et b distale avec corrélation d'imagerie IRM pondérée c,d T1 chez un patient présentant des picotements sur la face médiale du pied s'étendant dans l'hallux et les deuxièmes orteils. Les images américaines révèlent les structures anatomiques contenues dans le tunnel tarsien, y compris le tibial postérieur (tp), le long fléchisseur des orteils (fdl) et les tendons fléchisseur de l'hallux long (fhl), le nerf tibial (tête de flèche) et l'artère tibiale ( a) et les veines (v). Un muscle accessoire (astérisque) se trouve à l'intérieur du tunnel. Ce muscle est coincé entre le long fléchisseur de l'hallux et le rétinaculum des fléchisseurs (flèches), en arrière du faisceau neurovasculaire et renvoie au long fléchisseur accessoire des orteils. Dans ce cas particulier, le muscle accessoire a provoqué une légère neuropathie tibiale compressive. Le dessin schématique à travers la cheville postéro-médiale illustre la relation du long fléchisseur des doigts accessoire avec les autres structures logées dans le tunnel tarsien. Dans la plupart des cas, ce muscle accessoire naît de la face postérieure du tibia et de la membrane interosseuse, courant à l'intérieur du tunnel tarsien pour s'insérer dans le carré plantaire ou le muscle long fléchisseur des orteils.
4. TROUBLES NEUROMUSCULAIRES
Dans les troubles neuromusculaires, tels que les dystrophies musculaires de Duchenne et Becker, l'amyotrophie spinale et d'autres myopathies congénitales, l'architecture histologique des muscles est perturbée par le remplacement des cellules musculaires par du tissu conjonctif et de la graisse. Cela provoque de profonds changements américains dans l'architecture musculaire avec une échogénicité accrue, une perte d'hétérogénéité et une ombre (Fig. 10). L'échogénicité accrue du muscle reflète un nombre accru d'interfaces acoustiques liées à l'accumulation de graisse, à la fibrose et à l'inflammation. Dans les troubles neuromusculaires, l'augmentation de la réflectivité des muscles est associée à une diminution de la capacité du faisceau US à pénétrer des structures plus profondes, entraînant une perte de définition des bords osseux et d'ombrage osseux (Fischer et al. 1998 ; Walker et al. 2004). De plus, le processus de la maladie brouille la distinction entre les septa fibroadipeux et les fascicules musculaires, rendant l'image plus homogène et échogène (Fig. 10a).
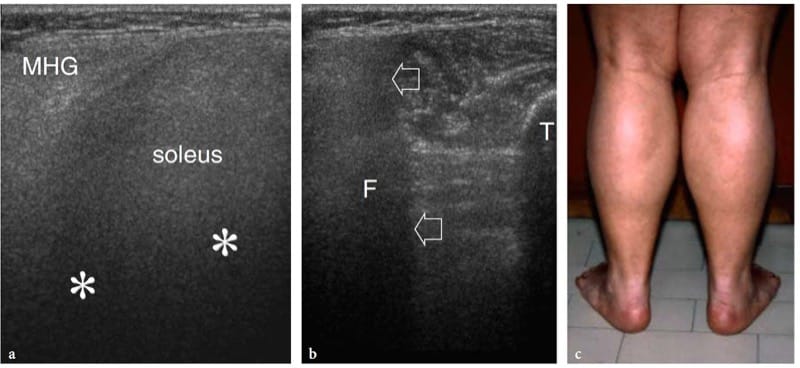
Figure 10. a–c. Troubles neuromusculaires. a,b Images échographiques transversales 12-5 MHz obtenues sur la face a postéromédiale et b postérolatérale du tiers moyen de la jambe chez un enfant de 12 ans atteint de dystrophie de Duchenne. La tête médiale affectée du gastrocnémien (MHG) et du soléaire présente un schéma hyperéchogène diffus avec une forte atténuation du faisceau US (astérisques) et une distinction floue des septa fibroadipeux. L'ombrage acoustique conduit à l'incapacité du faisceau américain à pénétrer les structures profondes. En b, il y a perte de définition du bord osseux du péroné (F) causée par la réflectivité musculaire anormale (flèches). T, tibia. c Photographie montrant une pseudohypertrophie des muscles du mollet. Le patient présentait une faiblesse musculaire symétrique progressive associée à des taux sériques élevés de CK, des myalgies, des crampes et une raideur après l'exercice.
De même, les neuropathies périphériques sont souvent associées à une atrophie sélective des muscles innervés. L'échographie est capable d'évaluer la taille et l'échotexture des muscles affectés en comparant les deux extrémités (Scholten et al. 2003). Une perte nette de volume du muscle affecté suggérerait une atrophie. Cela peut être apprécié par une simple analyse de reconnaissance de formes (limites musculaires concaves ou droites au lieu de la surface convexe normale). Étant donné que les différences d'épaisseur musculaire d'un côté à l'autre dépassent rarement 20 %, la mesure des diamètres musculaires ou de la section transversale avec les pieds à coulisse électroniques de l'équipement semble être un moyen plus fiable pour évaluer les changements de volume dans un groupe donné de muscles que la mesure subjective. évaluation (Bargfrede et al. 1999). Le rapport entre l'épaisseur du muscle et l'épaisseur de la graisse sous-cutanée s'est avéré utile dans des troubles neuromusculaires spécifiques (diminution du rapport dans l'atrophie des muscles spinaux). Dans les maladies neuromusculaires, cependant, l'échographie a montré certaines limites par rapport à l'imagerie par résonance magnétique. La distribution complexe de l'atteinte musculaire dans certaines dystrophies semble mieux cartographiée avec l'IRM en raison de son meilleur rendu anatomique et de sa vue panoramique. Sur la base de l'analyse des modèles échotexturaux, l'échographie n'est pas aussi précise que l'IRM pour distinguer l'atrophie neurogène précoce (dans laquelle les changements sont principalement liés à l'œdème extracellulaire) de l'atrophie tardive (dans laquelle le tissu musculaire est progressivement remplacé par de la graisse). Contrairement à l'IRM, où la dénervation précoce est appréciée par un aspect hyperintense homogène sur les séquences pondérées en T2 et STIR (augmentation de la teneur en eau libre) et la dénervation tardive par un aspect hyperintense sur les images pondérées en T1 (remplacement graisseux), à l'US le deux processus ont un schéma hyperéchogène similaire et peuvent difficilement être différenciés (Fig. 11) (Kullmer et al. 1998). La quantification de l'échotexture musculaire pour estimer la sévérité de l'atrophie réduirait la variabilité de l'observateur mais est fortement influencée par le scanner et les paramètres de l'équipement (Bargfrede et al. 1999 ; Pillen et al. 2003 ; Scholten et al. 2003). Outre les limitations ci-dessus, l'échographie peut être considérée comme un outil utile complémentaire à l'électrophysiologie pour fournir des informations sur la morphologie musculaire, ce qui dépasse le cadre de l'électrodiagnostic.
Chez les patients atteints de troubles unilatéraux, les images échographiques du muscle affecté peuvent être comparées à celles du côté non affecté. Dans ces cas, un positionnement soigneux du transducteur par des repères de surface est nécessaire pour assurer une imagerie symétrique. Les images transversales conviennent mieux aux mesures musculaires. Chez les patients atteints de troubles bilatéraux, une évaluation échographique comparative doit être effectuée en sélectionnant un muscle témoin dans une zone saine, éventuellement avec des degrés similaires de tissu sous-cutané sus-jacent. Enfin, lors de l'examen d'un muscle atrophié infiltré de graisse, l'examinateur doit être conscient que des changements peuvent survenir non seulement à la suite d'un processus de dénervation, mais également à la suite d'une inutilisation ou d'une déchirure complète du tendon (Yao et Metha 2003). Ensuite, l'intégrité du tendon appartenant au muscle affecté doit être soigneusement évaluée.
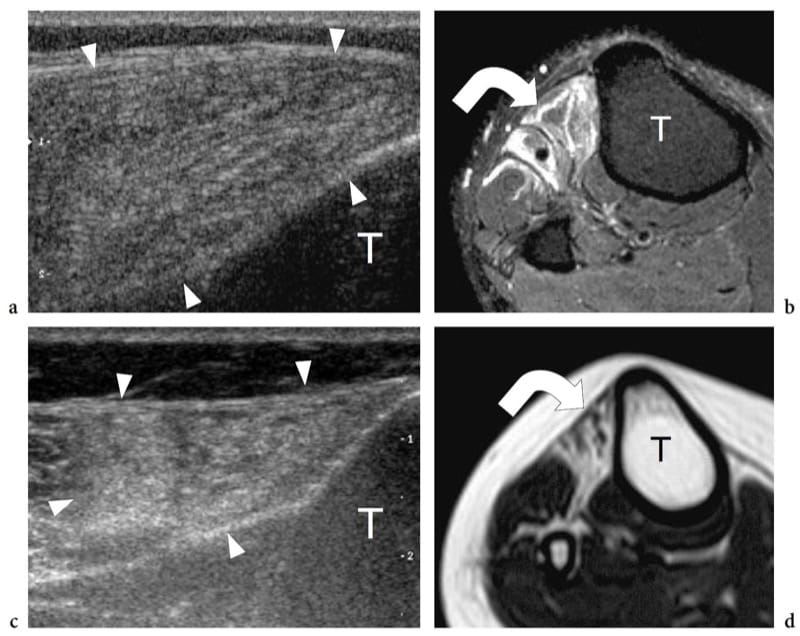
Figure 11. a–d. Atrophie neurogène des muscles chez deux patients différents atteints de neuropathie péronière a,b récente et c,d ancienne. a Image échographique transversale 12–5 MHz sur le muscle tibial antérieur avec corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse b montrant un volume normal et un aspect hyperéchogène diffus du muscle (têtes de flèches). L'échotexture anormale est liée à un œdème intramusculaire (flèche courbe). c Une image échographique transversale 12-5 MHz sur le muscle tibial antérieur avec une corrélation d'imagerie IRM pondérée en T1 révèle une diminution du volume et une apparence hyperéchogène du muscle (têtes de flèches). Bien que similaire à celle observée en a, l'échotexture anormale traduit une atrophie graisseuse (flèche courbe). T, tibia.
5. LÉSIONS TRAUMATIQUES
Sur la base de leur pathomécanisme, les lésions musculaires peuvent être regroupées en deux classes principales : extrinsèques et intrinsèques. Les lésions extrinsèques résultent d'un traumatisme externe, soit une contusion, soit une lésion pénétrante (lacération), tandis que les lésions intrinsèques résultent le plus souvent de la contraction et de l'allongement simultané d'un muscle donné. Dans la première classe, la localisation de la déchirure correspond strictement au site du traumatisme. Ces lésions surviennent généralement dans les zones où le muscle est comprimé entre la force externe appliquée (coup direct) et une surface osseuse dure sous-jacente (par exemple, les muscles quadriceps contre la diaphyse fémorale). D'autre part, les ruptures intrinsèques conduisent presque invariablement à une rupture des fibres musculaires près de la jonction myotendineuse, qui est considérée comme l'anneau le plus faible de l'ensemble muscle-tendon-os car il a une capacité d'absorption d'énergie moindre que les autres structures (Palmer et al. 1999). La jonction myotendineuse est le site le plus courant de lésion musculaire partielle ou complète (Garret 1990). En effet, les fibres musculaires ne se déchirent pas seulement au niveau de la jonction myotendineuse, mais plutôt à une courte distance de celle-ci (Noonan et Garrett 1999). Dans la phase aiguë, la blessure se caractérise par une rupture des fibres musculaires et une hémorragie. L'apparition de modifications oedémateuses et d'infiltrats inflammatoires devient évidente 48 heures après le traumatisme. Après une semaine, le tissu fibreux commence à remplacer la réaction inflammatoire formant une cicatrice (Noonan et Garrett 1999).
6. SOUCHES MYOTENDINOUS
Les tensions musculaires surviennent le plus souvent à la suite d'étirements puissants lorsque le muscle est contracté. Cela se produit généralement lors d'une contraction excentrique, lorsque le muscle s'allonge au fur et à mesure qu'il s'active (Zarins et Ciullo 1983). Dans ces cas, il n'y a pas de cause externe de traumatisme et la lésion résulte essentiellement d'un équilibre altéré entre deux forces antagonistes : l'une produite par une contraction puissante et violente du muscle, l'autre par un sur-étirement musculaire passif simultané, qui est généralement induit par le poids corporel. Il a été noté que la simple activation d'un muscle normal par stimulation nerveuse est incapable de provoquer une lésion musculaire (Noonan et Garrett 1999). Les lésions de souche sont généralement situées à la jonction myotendineuse lorsqu'une résistance à la traction excessive est appliquée (Fig. 12a). Certains muscles sont plus souvent blessés que d'autres. Les muscles utilisés pour des activités à grande vitesse ou une accélération rapide contenant un pourcentage élevé de fibres de type 2 (à contraction rapide) sont plus prédisposés aux blessures. De plus, les muscles dont l'origine et l'insertion traversent deux articulations sont plus à risque de rupture (Noonan et Garrett 1999). Le droit fémoral, le biceps fémoral et le chef médial du gastrocnémien présentent tous ces facteurs de risque : ils traversent deux articulations et agissent de manière excentrée à grande vitesse.
Cliniquement, les microtraumatismes musculaires peuvent être classés selon un système de classement en quatre étapes : le grade 1 indique une déchirure affectant un petit nombre de fibres musculaires avec un fascia intact ; le grade 2 fait référence à une déchirure modérée avec le fascia restant intact ; la lésion de grade 3 est une déchirure de nombreuses fibres avec déchirure partielle du fascia ; une blessure de grade 4 indique une déchirure complète du muscle et du fascia (Ryan 1969). La guérison et la récupération de la fonction prennent plus de temps avec une blessure de haut grade, et les résultats à long terme sont généralement pires (Noonan et Garrett 1999). Initialement, le traitement d'une lésion musculaire comprend du repos, l'application de glace et une compression pour soulager la douleur et l'enflure ; des médicaments inflammatoires non stéroïdiens peuvent également être administrés pour soulager la douleur dans les premiers jours suivant le traumatisme. Après la résolution de la douleur aiguë et de l'enflure, une thérapie physique effectuée en évitant une fatigue excessive et avec un échauffement adéquat avant l'exercice peut contribuer à la restauration de la force et de la flexibilité musculaires (Noonan et Garrett 1999). Le résultat à long terme après une lésion musculaire est généralement bon et les complications sont rares.
Les microtraumatismes musculaires apparaissent à l'échographie sous la forme d'une avulsion et d'une rétraction des fibres musculaires du tendon ou de l'aponévrose dans laquelle elles se fixent (Fig. 12b, c) (Bianchi et al. 1998). L'examinateur doit être conscient que certains muscles (p. ex., droit fémoral) ont une structure complexe avec des tendons internes : dans ces cas, la blessure peut survenir dans la partie médiane du ventre musculaire et non dans sa partie distale comme on pourrait s'y attendre ( Bianchi et al. 2002). Les signes américains de déchirure musculaire comprennent l'avulsion et la rétraction proximale des septa fibroadipeux. Dans les lésions de bas grade, l'espace entre les septa rétractés et l'aponévrose est rempli d'une zone hyperéchogène reflétant l'extravasation de sang et de caillots. Ces petites lésions peuvent passer inaperçues si une technique de balayage précise avec un examen soigneux et systématique de la partie distale des septa fibroadipeux n'est pas employée. D'autre part, les déchirures musculaires plus importantes se caractérisent par une collecte de sang plus importante qui les rend facilement détectables. Cela ne se produit pas immédiatement après le traumatisme, mais 1 à 2 jours plus tard, lorsque la collection a tendance à devenir plus hypoéchogène. Une classification largement acceptée des blessures musculaires est basée sur une échelle à quatre niveaux (Peetrons 2002). Une lésion de grade 0 correspond à un aspect échographique normal malgré la présence de signes cliniques locaux ; en cas de lésion de grade 1, des signes échographiques subtils peuvent être observés, notamment des zones intramusculaires hyperéchogènes ou hypoéchogènes mal définies ou une aponévrose enflée (Fig. 13); les grades 2 et 3 correspondent à des déchirures musculaires partielles et complètes, dans lesquelles se produit une discontinuité incomplète ou totale du muscle. En cas de traumatisme léger, une évaluation précoce par échographie peut conduire à des résultats faussement négatifs car l'hématome est diffus et se manifeste par des zones hyperéchogènes floues dispersées dans le muscle plutôt que par une collection hypoéchogène focale bien définie : l'IRM pondérée en T2 avec suppression de la graisse est supérieure aux États-Unis pour décrire des souches légères peu après le traumatisme. Lors de la cicatrisation, la cavité hémorragique se rétracte et ses parois s'épaississent et s'effondrent progressivement. Le moment où la lésion est comblée peut être considéré comme un indicateur de reprise prudente d'une activité de bas niveau. Cependant, celle-ci ne doit être décidée qu'en l'absence de symptômes cliniques et lorsqu'un délai suffisant s'est écoulé entre la blessure et la reprise des activités sportives (jamais moins de 4 à 6 semaines après la fin des symptômes) (Peetrons 2002). Dans les phases tardives, les cicatrices fibreuses se présentent comme des zones hyperéchogènes floues au sein du muscle : elles sont souvent observées lors de traumatismes importants ou lorsque l'activité sportive a été reprise trop tôt (Fig. 14) (Peetrons 2002). Habituellement, les cicatrices sont peu symptomatiques, mais le risque de récidive semble être proportionnel à leur étendue dans le muscle.
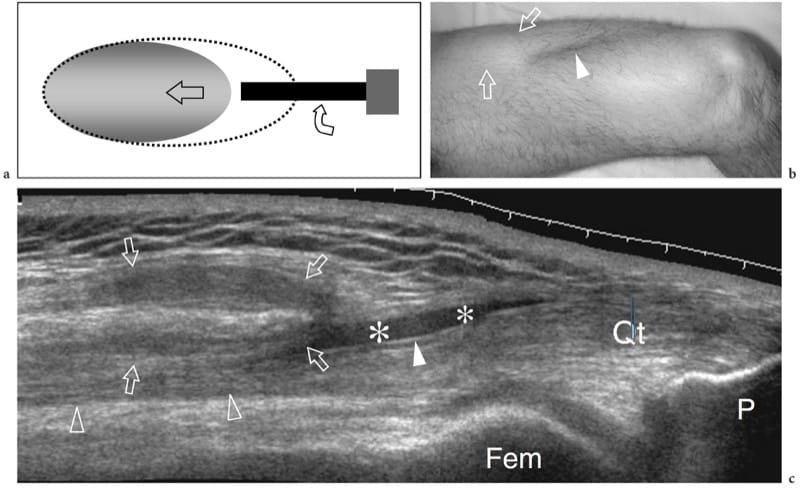
Figure 12. a–c. Rupture complète de la jonction myotendineuse distale du droit fémoral. un dessin schématique illustre le mécanisme traumatique se produisant le long de l'attachement musculaire à l'aponévrose. Le ventre musculaire lésé est rétracté (flèche) et avulsé de l'aponévrose (flèche courbe), alors que le tendon est intact. b La photographie révèle un défaut cutané profond (tête de flèche) au milieu de la cuisse antérieure associé à une masse proximale (flèches) liée au rectus femoris rétracté. c L'image US à champ de vision étendu de 12 à 5 MHz montre le muscle droit fémoral rétracté (flèches vides) détaché de l'aponévrose profonde distale (tête de flèche blanche). Un hématome en plaque (astérisques) sépare le muscle du complexe d'aponévroses du quadriceps (tête de flèche ouverte) formant le tendon du quadriceps (Qt). fem, fémur ; P, rotule.
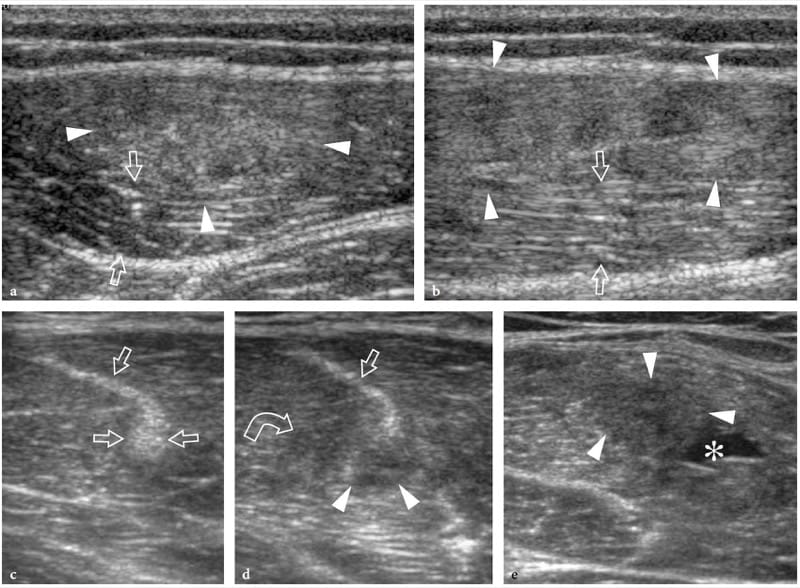
Figure 13. a–e. Souches myotendineuses. Deux cas différents d'atteinte de l'aponévrose centrale du muscle droit fémoral suite à un traumatisme minime. a,b Cas 1. a Les images américaines à petit axe et b à axe long de 12 à 5 MHz sur le tiers médian du muscle droit fémoral montrent une zone hyperéchogène mal définie (têtes de flèches) entourant l'aponévrose liée à l'œdème et aux changements hémorragiques. Notez la partie externe d'apparence normale du muscle (flèches). c–e Cas 2. Les images échographiques 12–5 MHz à petit axe obtenues de c proximal à e distal sur le rectus femoris révèlent un gonflement progressif et une apparence hypoéchogène (têtes de flèche) de l'aponévrose centrale (flèches droites) et des fibres musculaires adjacentes (flèche incurvée ) avec un petit hématome (astérisque) traduisant une souche myotendineuse.
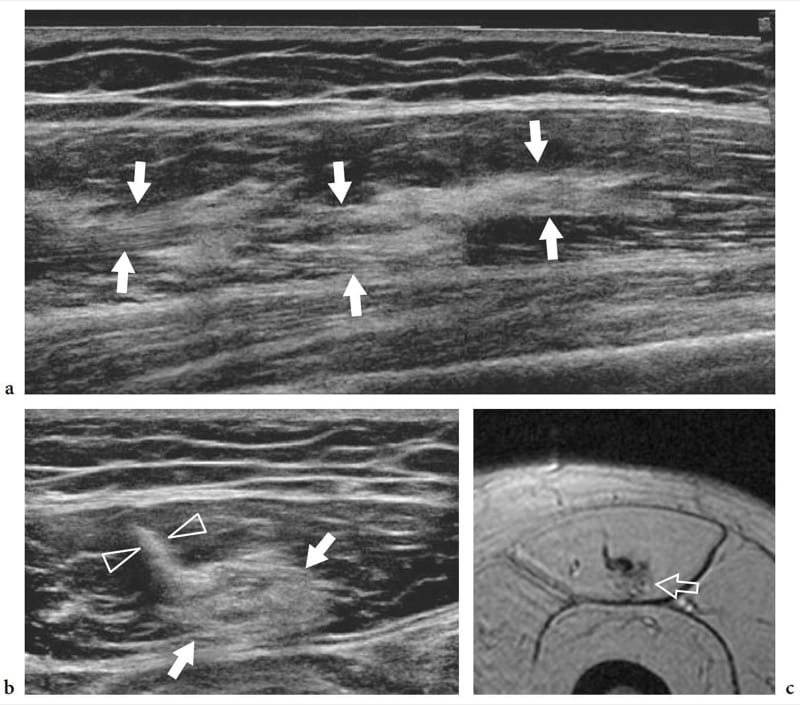
Figure 14. a–c. Guérir la souche rectus femoris. a Champ de vision étendu à axe long et b images échographiques à axe court de 17 à 5 MHz du muscle droit fémoral chez un patient présentant une souche myotendineuse antérieure révèlent une zone échogène intramusculaire (flèches) à proximité de l'aponévrose centrale (têtes de flèches) représentant le tissu cicatriciel résiduel. c Image IRM corrélative en écho de gradient axial pondéré en T2*.
7. CONTUSION ET LACERATION
Un traumatisme externe direct peut entraîner un hématome local, une contusion et une lacération musculaire partielle et complète. Bien que pratiquement tous les muscles puissent être sollicités lors d'activités sportives ou récréatives, les plus fréquemment lésés sont le vaste intermédiaire et le vaste latéral. Ces muscles antérieurs de la cuisse sont particulièrement prédisposés aux blessures chez les athlètes dont les sports nécessitent un contact dur direct (par exemple, le soccer, le football, le rugby et le hockey). Le mécanisme de la blessure consiste souvent en un écrasement du muscle contre la diaphyse fémorale par le genou d'un autre joueur. Les lésions de contusion consécutives à un traumatisme extrinsèque sont représentées par l'échographie comme un gonflement musculaire avec des irrégularités focales et des changements échotexturaux. L'architecture musculaire n'est plus reconnue car elle est altérée par la rupture des fibres musculaires et l'hématome (Fig. 15a). Selon la force globale de la force appliquée, des déchirures partielles ou complètes peuvent se produire. Les anomalies sont généralement localisées au site même du traumatisme et non à la jonction myotendineuse : cela aide à distinguer une contusion d'une élongation musculaire. Si une grande collection de liquide est présente, les extrémités musculaires peuvent être vues flottant dans l'hématome. Un traumatisme musculaire fermé par un objet pointu peut être associé à une lacération du tissu sous-cutané. Dans ces cas, l'hématome se dilate verticalement à travers la couche sous-cutanée et le muscle (Fig. 15b). Une blessure par choc direct peut également entraîner une perturbation du fascia musculaire provoquant une hernie musculaire (Bianchi et al. 1995a; Beggs 2003). Chez ces patients, l'échographie démontre une interruption de la couche fasciale hyperéchogène et une extrusion focale de tissu musculaire dans la graisse sous-cutanée. Les lacérations musculaires sont beaucoup moins fréquentes et surviennent plus souvent après un traumatisme qu'après un accident sportif. Dans ces cas, une irrigation et un débridement suivis d'une réparation par suture du fascia sont indiqués.
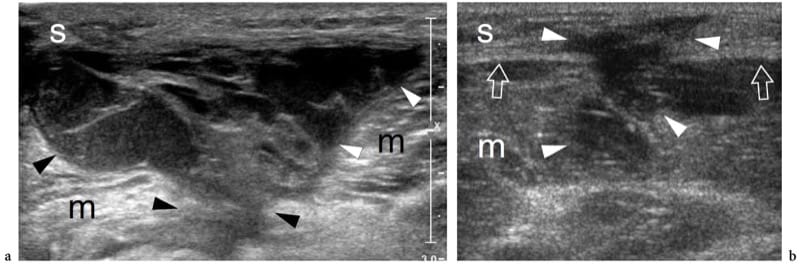
Illustration 15. a, b. Traumatisme par contusion fermée. Deux cas différents de lésions musculaires de la cuisse consécutives à un traumatisme contondant par des objets tranchants. une image US transversale 12–5 MHz sur le vaste latéral (m) révèle une lacération étendue du tissu musculaire remplie d'hématome hypoéchogène (têtes de flèches). Notez le(s) tissu(s) sous-cutané(s) intact(s). b L'image US transversale 12-5 MHz sur la partie médiale de la cuisse montre une lacération combinée du tissu sous-cutané (s) et du muscle gracilis (m) avec interruption du fascia (flèches). Le défect est comblé par un hématome hypoéchogène (têtes de flèches).
8. MYOSITE OSSIFICANTE
Il existe trois principales complications de la déchirure musculaire : les kystes et la myosite ossifiante et, plus rarement, la myonécrose calcifiante (Peetrons 2002). Les kystes intermusculaires et intramusculaires peuvent être rencontrés après un traumatisme musculaire sous forme de masses bien définies sans écho avec un rehaussement acoustique postérieur. Ces kystes ont une forme allongée et représentent le résidu d'un hématome local. Leur localisation la plus courante est le mollet. Dans certains cas, ils peuvent nécessiter une évacuation percutanée à l'aiguille. La myonécrose calcifiante est une masse calcifiée occupant de l'espace qui se développe généralement dans le compartiment antérieur de la jambe tard après un traumatisme fermé du membre inférieur, et est souvent associée à une lésion vasculaire ou à un syndrome de loge (Dhillon et al. 2004). Dans cette condition, le muscle lésé peut être remplacé par une masse complexe constituée d'un noyau kystique central contenant un muscle nécrotique, de la fibrine, du cholestérol et un thrombus organisateur, ainsi qu'un rebord calcifié périphérique. L'échographie démontre une myonécrose calcifiée sous la forme d'une masse calcifiée extensive intramusculaire avec ombrage acoustique postérieur et peut aider à guider l'aspiration du composant liquidien comme aide à la prise en charge (Batz et al. 2006). Le principal diagnostic différentiel de la myonécrose calcifiante est la myosite ossifiante la plus courante, étant donné que l'étendue de la coquille calcifiée peut masquer la composante liquidienne interne à l'examen échographique.
La myosite ossifiante est une affection bénigne spontanément résolutive se présentant comme une masse intramusculaire avec une atteinte prédominante des gros muscles des extrémités, les gros muscles de la cuisse et les muscles antérieurs du bras étant les plus fréquemment touchés (Thomas et al. 1991). Le terme « myosite » est un terme impropre car cette condition n'est pas inflammatoire. Il résulte généralement d'un traumatisme grave par contusion ou d'un microtraumatisme chronique, mais peut également être observé chez des patients atteints d'une autre maladie ou peut se développer spontanément. Il y a cependant un débat quant à savoir si un traumatisme non remémoré est présent dans ces cas. Du point de vue histologique, cette affection présente un schéma de maturation typique qui permet à une réponse mésenchymateuse proliférative (phase pseudosarcomateuse précoce) d'évoluer vers la formation d'os hétérotopique mature. Au cours de la maturation de la lésion, un schéma zonal se développe avec trois zones concentriques : la zone interne est caractérisée par des zones d'hémorragie et de muscle nécrotique avec des fibroblastes proliférants ; la zone médiane consiste en une formation ostéoïde immature et des îlots de cartilage précédant la formation osseuse; et la zone externe est formée d'os mature (Gindele et al. 2000). La formation osseuse périphérique commence généralement 6 à 8 semaines après le traumatisme, mais elle peut survenir plus tôt. A la phase tardive, la lésion peut s'ossifier dans son ensemble avec formation d'un cortex et d'espaces médullaires (Ackermann 1958). En vieillissant, la lésion régresse en taille, disparaissant spontanément dans environ 30 % des cas (Schulte et al. 1995). Le développement de calcifications périphériques est une caractéristique particulière de la myosite ossifiante et rend cette affection plus facilement diagnostiquée avec les modalités radiologiques, y compris les films simples et la tomodensitométrie, qu'avec l'échographie et l'imagerie par résonance magnétique. Aux premiers stades de la maladie (avant la sixième semaine d'évolution), lorsque la formation de calcifications n'a pas encore eu lieu, le diagnostic d'imagerie n'est pas simple : il peut être difficile de distinguer les lésions à ce stade d'une tumeur maligne des tissus mous.
Les résultats américains de la myosite ossifiante changent avec l'âge de la lésion, reflétant l'évolution de l'histologie (Fornage et Eftekhari, 1989 ; Peck et Metreweli, 1988). Initialement, l'aspect américain de la myosite ossifiante a été décrit comme celui d'une masse ovoïde hypoéchogène intramusculaire avec un centre échogène, et même un phénomène dit de zone correspondant au processus de maturation a été rapporté (Kramer et al. 1979 ; Thomas et al. 1991 ; Gindele et al. 2000). Plus en détail, les lésions précoces sont caractérisées par une fine zone hypoéchogène périphérique enveloppant une zone plus large hautement réfléchissante au sein de laquelle se trouve une troisième zone hypoéchogène centrale (Fig. 16a) (Thomas et al. 1991). Avec la maturation progressive, le rebord périphérique hypoéchogène peut devenir hyperéchogène en raison de l'augmentation de l'ossification : un rebord calcifié en forme de feuille ou de coquille d'œuf est considéré comme très évocateur de myosite ossifiante (Peck et Metreweli, 1988). Ensuite, la visualisation du centre de la lésion et la séparation de la lésion du cortex osseux sous-jacent peuvent devenir plus difficiles en raison de l'occultation acoustique des calcifications périphériques (Gindele et al. 2000). Le processus d'ossification est apparent avec les US environ 2 semaines plus tôt qu'avec les radiographies standard (Peetrons 2002). Bien que le schéma typique des calcifications soit caractéristique, nous pensons qu'une radiographie standard doit toujours être obtenue pour confirmer le diagnostic et exclure des lésions calcifiées plus agressives, y compris les sarcomes paraostéaux et des tissus mous (Fig. 16b, c). Après résection chirurgicale, l'échographie s'est avérée capable de détecter la récidive de la myosite ossifiante et de différencier cette affection des sarcomes extraosseux (Okayama et al. 2003).
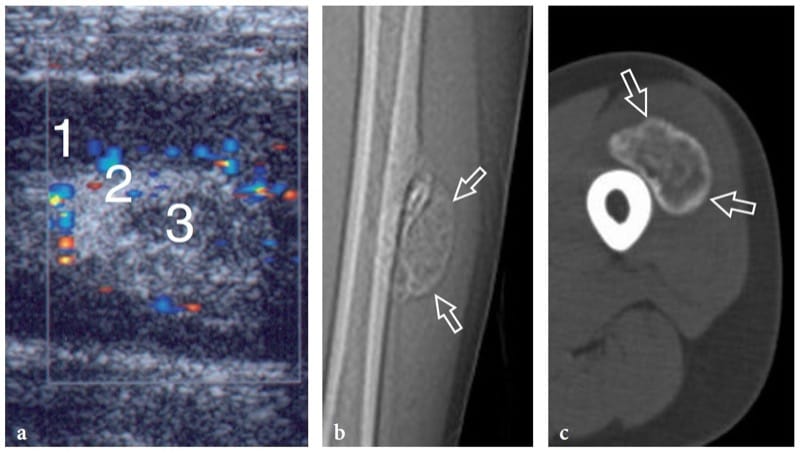
Figure 16. a–c. Myosite ossifiante. une image US transversale 10–5 MHz sur le quadriceps fémoral chez un enfant de 8 ans avec un traumatisme antérieur par contusion et une masse palpable douloureuse sur la partie antérieure de la cuisse révèle un «schéma cible» dans le vaste intermédiaire reflétant les changements précoces de la myosite ossifiante. Trois zones concentriques peuvent être distinguées : une zone hypoéchogène externe (1), une zone hyperéchogène intermédiaire (2) et une zone hypoéchogène centrale (3). b La corrélation radiographique et c CT obtenue 2 mois plus tard démontre le bord calcifié typique en forme de coquille d'œuf (flèches) de la myosite ossifiante. Le scanner a été réalisé pour s'assurer du caractère extrinsèque de la calcification par rapport à la diaphyse fémorale. (Avec l'aimable autorisation du Dr Paolo Tomà, Italie).
9. ÉTATS INFLAMMATOIRES ET ISCHÉMIQUES
Les myopathies inflammatoires comprennent un groupe hétérogène de troubles acquis et potentiellement traitables causés par un processus auto-immun (myosite inflammatoire idiopathique) ou des agents infectieux (pyomyosite). Parmi les affections ischémiques, nous nous concentrons ici principalement sur l'infarctus musculaire diabétique et la rhabdomyolyse.
10. MYOPATHIES INFLAMMATOIRES IDIOPATHIQUES
Sur la base de leurs caractéristiques cliniques, histopathologiques, immunologiques et démographiques uniques, les myopathies inflammatoires idiopathiques peuvent être classées en trois types principaux et distincts : la polymyosite, la dermatomyosite et la myosite sporadique à corps d'inclusion (Dalakas et Hohlfeld 2003). La polymyosite touche principalement les femmes et se caractérise par la présence d'une faiblesse musculaire modérée à sévère et d'une inflammation auto-immune avec des infiltrats lymphohistiocytaires dans les muscles, dont la cause précise est encore inconnue (Garcia 2000). Le diagnostic repose essentiellement sur une faiblesse musculaire proximale et symétrique avec ou sans douleur, une augmentation de l'activité de la créatine kinase sérique, des résultats anormaux à l'électromyographie, une nécrose des fibres musculaires, une régénération et des infiltrats de cellules mononucléaires avec ou sans atrophie périfasciculaire à la biopsie (Fig. 17). Dans la dermatomyosite, les exanthèmes (impliquant généralement le visage, la poitrine et les surfaces d'extension des extrémités) sont associés aux caractéristiques ci-dessus. Néanmoins, le niveau de créatine kinase sérique, isolément, est un mauvais indicateur de la maladie et les signes électromyographiques à l'aiguille ne sont pas spécifiques à la maladie (Garcia 2000; Mastaglia et al. 2003). Chez les patients atteints de polymyosite et de myosite granulomateuse, l'échographie en échelle de gris semble montrer une échogénicité accrue reflétant un œdème musculaire dans les phases aiguës du processus de la maladie, mais ce signe n'est pas spécifique (Reimers et al. 1993 ; Reimers et Finkenstaedt 1997). Bien que l'IRM pondérée en T2 avec suppression de la graisse soit actuellement la modalité d'imagerie de choix dans cette situation en raison de sa capacité à représenter la puissance de l'œdème musculaire, le Doppler US a été proposé comme moyen d'évaluer les modifications de la vascularisation musculaire chez les patients atteints de myosite (Newman et Adler 1998 ; Meng et al. 2001). Un modèle hypervasculaire dans les muscles s'est avéré être en corrélation avec des maladies de plus courte durée et avec l'activité de la créatine kinase (Meng et al. 2001). Les résultats de l'imagerie Doppler couleur variaient davantage avec l'évolution clinique de la maladie que ceux de l'échographie en échelle de gris (Meng et al. 2001). Dans une tentative de quantifier la perfusion capillaire musculaire, une étude récente basée sur l'échographie avec contraste a montré une vitesse de circulation sanguine, un débit sanguin et un volume sanguin significativement plus élevés chez les patients atteints de myosite aiguë que chez les volontaires normaux (Weber et al. 2005). La représentation d'une perfusion musculaire accrue dans la polymyosite et la dermatomyosite peut aider à identifier un site de biopsie approprié chez les patients présentant une présentation typique de la maladie et des résultats de biopsie négatifs ou non spécifiques antérieurs (Weber et al. 2005).
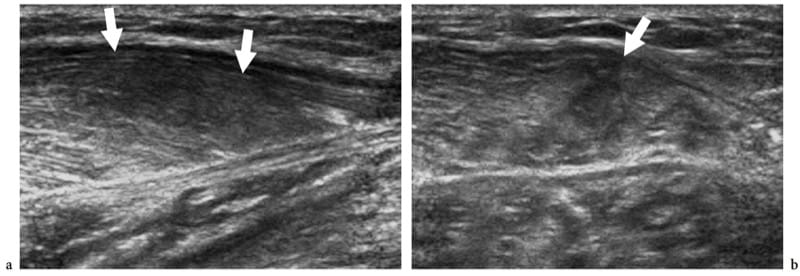
Illustration 17. a, b. Polymyosite et sclérodermie associée. a Les images US grand axe et b petit axe 12–5 MHz sur la tête médiale du gastrocnémien révèlent une zone hypoéchogène intramusculaire mal définie (flèches) avec perte du motif fibroadipeux, reflétant un œdème et une infiltration de tissu adipeux. Le tissu sous-cutané semble normal.
La myosite proliférative est un processus inflammatoire intramusculaire auto-limitant rare se présentant à un âge médian de 50 ans et pouvant simuler cliniquement une tumeur maligne (Pagonidis et al. 2005). Il se caractérise par une masse à croissance rapide (doublant même de taille en quelques jours) qui infiltre de manière diffuse le tissu musculaire avec des éléments en forme de fuseau et de cellules ganglionnaires géantes. Typiquement, la myosite proliférative guérit spontanément et aucun traitement n'est indiqué. L'échographie peut révéler une myosite proliférative sous la forme d'une masse hétérogène avec des calcifications (Mulier et al. 1999 ; Wlachovska et al. 2004). Cette lésion a été décrite comme ayant un motif « d'échafaudage » entre des faisceaux musculaires continus sur les scanners à grand axe et un motif en « damier » sur les images à petit axe (Sarteschi et al. 1997). Les images échographiques longitudinales peuvent également montrer un gonflement musculaire avec préservation du schéma fibrillaire normal, perturbé par des lignes hypoéchogènes de forme géométrique, ressemblant quelque peu à de la « boue fissurée sèche » (Fig. 18) (Pagonidis et al. 2005). Bien que les études d'imagerie puissent suggérer un tel processus inflammatoire (masse à croissance très rapide dans un compartiment musculaire), une biopsie incisionnelle est généralement nécessaire pour exclure une malignité des tissus mous et pour éviter une excision radicale.
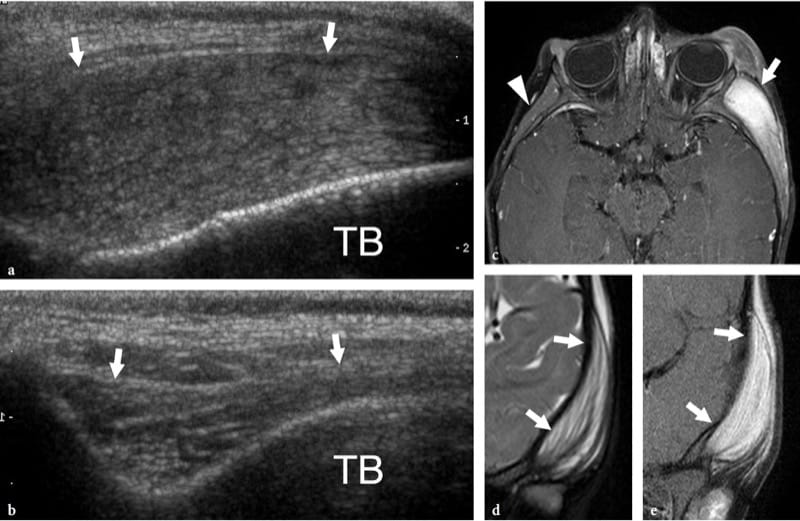
Figure 18. a–e. Myosite proliférative. a Image longitudinale 12–5 MHz US le long du muscle temporal chez un enfant présentant un gonflement intense des tissus mous de la joue gauche et de la région zygomatique. Le muscle (flèches) apparaît gonflé avec des faisceaux hyperéchogènes séparés par des lignes hypoéchogènes distribuées au hasard, un motif ressemblant à de la boue sèche et fissurée. TB, os temporal. b Côté controlatéral normal. c Les images IRM pondérées en T1 avec suppression de la graisse axiale et coronale d et e coronales pondérées en T2 avec suppression de la graisse montrent un muscle temporal gauche hyperintense enflé (flèches) contenant des bandes isointense au muscle. Notez le muscle temporal controlatéral normal (pointe de flèche) pour comparaison.
La sarcoïdose, une maladie granulomateuse systémique, peut parfois impliquer les muscles squelettiques, entraînant soit des nodules palpables, soit une fonte progressive chronique et une atrophie musculaire, soit une myosite aiguë (Otake 1994 ; Tohme-Noun et al. 2003). Les muscles des parties proximales des extrémités sont principalement impliqués. Dans la sarcoïdose de type nodulaire, l'échographie est capable d'afficher des nodules hypoéchogènes bien définis allongés le long des fibres musculaires et de guider la biopsie percutanée vers le site approprié (Levine et al. 1996 ; Tohme-Noun et al. 2003). La détection histologique des granulomes non caséeux entourés de tissu musculaire normal permet un diagnostic définitif. Dans les gros nodules sarcoïdes, un centre hyperéchogène peut être représenté par US (Otake 1994). Chez les patients atteints de sarcoïdose pulmonaire et de muscles des jambes douloureux, la possibilité d'une sarcoïdose musculaire doit être prise en compte par l'examinateur. L'imagerie Doppler couleur peut être utile pour exclure une phlébite.
11. PYOMYOSITE, ABSCÈS ET MALADIE HYDATIDE
La pyomyosite est une infection bactérienne suppurée des muscles, affectant le plus souvent les gros muscles du membre inférieur (Chau et Griffith 2005). Cette condition survient le plus souvent chez les patients immunodéprimés atteints du VIH-SIDA ou de diabète et a une prévalence plus élevée dans les pays tropicaux, où elle est responsable de 3 à 5 % de toutes les hospitalisations (Canoso et Barza 1993 ; Trusen et al. 2003). Cependant, il peut suivre même un traumatisme contondant mineur et un hématome local. Le principal agent causal est Staphylococcus aureus, suivi de Mycobacterium tuberculosis (infection du muscle psoas consécutive à une spondylodiscite tuberculeuse) et de Streptococcus pyogenes (Bickels et al. 2002). Du point de vue clinique, la pyomyosite se présente avec ou sans fièvre, des crampes sourdes pendant 10 à 21 jours et une sensibilité musculaire localisée (Trusen et al. 2003). L'apparition d'infections musculaires aux États-Unis a été décrite aussi bien chez l'adulte (Chau et Griffith 2005) que chez l'enfant (Trusen et al. 2003). Dans un premier temps (phase inflammatoire), l'échographie révèle une tuméfaction musculaire, un aspect hyperéchogène diffus traduisant un œdème et une hyperémie (Fig. 19) (Bureau et al. 1999 ; Chau et Griffith 2005). De petits foyers hypoéchogènes dans le muscle anormal liés à une nécrose précoce et de petits abcès peuvent être notés. À ce stade, la pyomyosite répond généralement bien à l'antibiothérapie. Plus tard au cours de la maladie, un abcès musculaire manifeste se développe (phase suppurative).
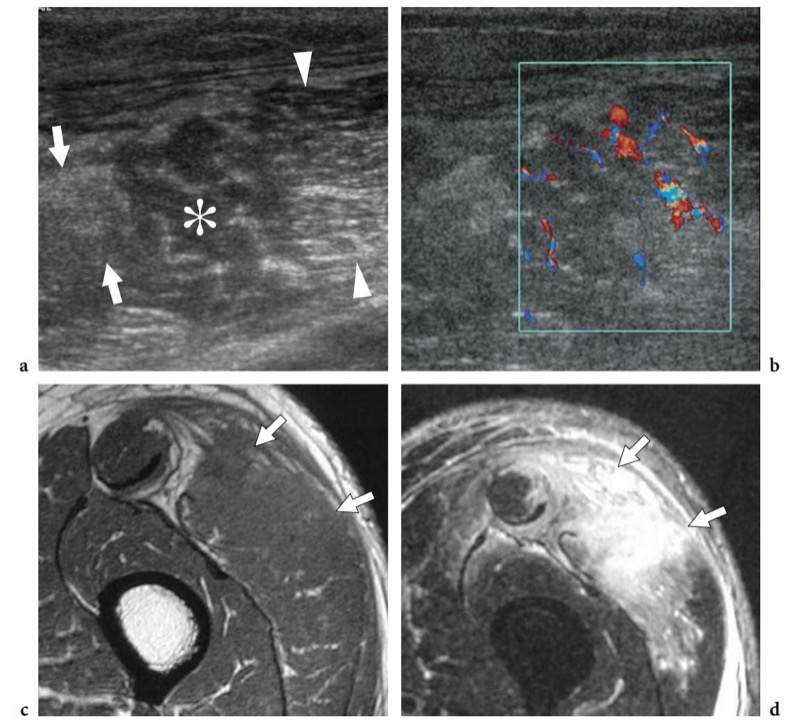
Fig. 19a-d. Pyomyosite chez un homme de 65 ans présentant de la fièvre et des douleurs à la cuisse gauche après avoir subi un traumatisme contondant dans cette zone. a,b Transverse a en niveaux de gris et b couleur Doppler 12–5 MHz Les images américaines révèlent un muscle vaste latéral enflé avec une échotexture hétérogène consistant en une échogénicité accrue (flèches) ainsi que des zones hypoéchogènes (astérisque) dans lesquelles les échos fibroadipeux sont perdus ou espacés en dehors. En arrière de cette zone anormale, le tissu musculaire conserve un aspect normal (têtes de flèches). L'hyperémie intramusculaire diffuse est détectée à l'imagerie Doppler couleur. c,d Les images IRM corrélatives axiales c pondérées en T1 et d en pondération T2 montrent un signal T2 hyperintense marqué et un gonflement du vaste externe avec des bords irréguliers et une atteinte fasciale diffuse (flèches).
Les abcès musculaires apparaissent comme des collections liquidiennes avec un rehaussement postérieur bien défini et une échotexture variable, allant d'hypoéchogène à hyperéchogène (Fig. 20) (Bureau et al. 1999). Des bulles de gaz peuvent parfois être trouvées dans des organismes réfléchissants formant du gaz. L'imagerie Doppler couleur montre une hyperémie des septa internes et, encore plus fréquemment, une augmentation des signaux vasculaires périphériques situés dans la paroi de l'abcès ou dans les tissus environnants (Gottlieb et al. 1995 ; Arslan et al. 1998). Le stade tardif donne des manifestations systémiques plus profondes qui nécessitent un traitement urgent avec une antibiothérapie agressive. Une aspiration et un drainage guidés par échographie des abcès musculaires à l'aide d'aiguilles de gros calibre sont nécessaires pour une résolution complète (Rubens et al. 1997 ; Bureau et al. 1999).
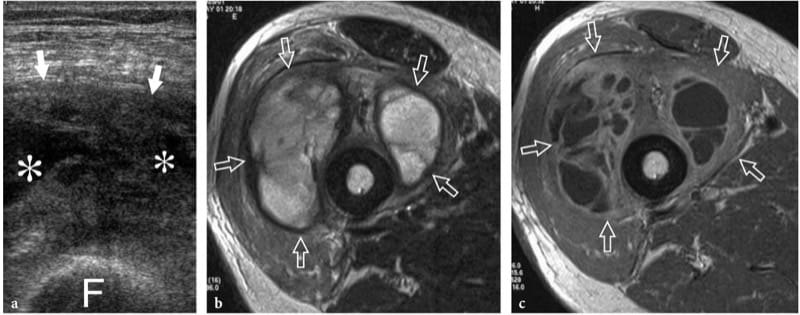
Figure 20. a–c. Abcès musculaire. a Image échographique transversale 12–5 MHz sur la partie antérieure de la cuisse chez un patient immunodéprimé d'âge moyen présentant de la fièvre, des douleurs et des signes locaux d'infection avec une corrélation d'imagerie IRM pondérée en T2 b et en pondération c Gd en T1 montrant un vaste hétérogène enflé muscle intermédiaire (flèches) avec des zones internes remplies de liquide (astérisques) et des débris, compatibles avec la formation d'un abcès local. F, diaphyse fémorale. L'aspiration guidée par échographie a produit un liquide purulent qui a fait pousser Staphylococcus aureus. Les symptômes ont disparu avec un drainage percutané et une antibiothérapie.
Les infections parasitaires et fongiques des muscles sont extrêmement rares. Parmi elles, l'hydatidose est une maladie causée par un ténia, Echinococcus granulosus, qui est généralement ingéré par contact avec des chiens ou par des aliments et des boissons contaminés. Dans le monde occidental, la maladie est plus souvent rencontrée dans les pays méditerranéens à élevage ovin. Bien que le site d'infection préféré soit le foie (65 à 75 %) et le poumon (25 à 30 %), l'hydatidose peut parfois impliquer le système musculo-squelettique (1 à 5 %), y compris les muscles squelettiques et la graisse sous-cutanée, généralement en association. avec d'autres lésions hépatiques ou pulmonaires (Mani et al. 2001; Melis et al. 2002). Le psoas et le quadriceps semblent être les muscles les plus fréquemment impliqués. L'aspect d'imagerie des kystes hydatiques est multiforme (García-Díez et al. 2000). L'échographie ne peut suggérer le diagnostic que dans le cas d'un kyste intramusculaire et intermusculaire contenant des kystes internes arrondis, les soi-disant «kystes dans un kyste», qui représentent des vésicules filles (Fig. 21).
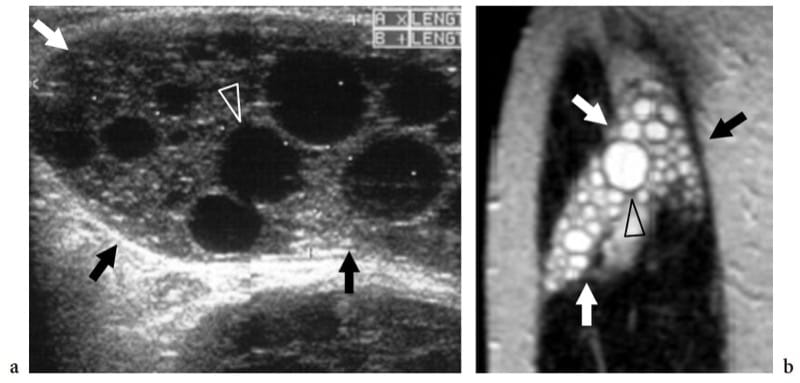
Illustration 21. a, b. Échinococcose (kyste hydatique). a Image échographique longitudinale 10–5 MHz sur le côté de la cuisse avec b corrélation d'imagerie IRM pondérée en T2 montre une masse multiloculaire complexe intramusculaire (flèches) impliquant le vaste externe. La masse contient plusieurs kystes arrondis (tête de flèche), reflétant les vésicules filles dans le kyste mère. (Avec l'aimable autorisation du Dr Vincenzo Migaleddu, Italie).
12. INFARCTUS MUSCULAIRE DIABÉTIQUE ET RHABDOMYOLYSE
L'infarctus musculaire diabétique est une complication rare chez les patients atteints de diabète mal contrôlé de longue date, qui présentent généralement des indices sévères de lésions des organes cibles, notamment une néphropathie, une rétinopathie, une neuropathie et une hypertension (Chason et al. 1996). Cette condition semble être plus probablement due à une thrombose étendue des artérioles moyennes et petites des muscles plutôt qu'à une plaque d'athérosclérose embolisée (Jelinek et al. 1999) : les muscles de la cuisse (le quadriceps) ou du mollet sont les plus fréquemment touchés (Chason et al. 1996 ). Cliniquement, les patients atteints d'infarctus musculaire diabétique présentent une apparition soudaine d'une douleur locale intense, un taux de créatine kinase normal et le développement d'une masse palpable dans une extrémité (Vande Berg et al. 1996 ; Delaney-Sathy et al. 2000). Du point de vue histopathologique, les muscles atteints présentent des zones infarcies avec nécrose zonale, des foyers d'hémorragie avec des fibres à divers stades de dégénérescence et de régénération, une infiltration musculaire graisseuse et une fibrose interstitielle (Jelinek et al. 1999). Au cours de la phase aiguë, l'échographie montre que l'infarctus musculaire diabétique est une lésion hypoéchogène intramusculaire avec une échogénicité mixte et des échos linéaires internes reflétant les fibres musculaires (Fig. 22) (Delaney-Sathy et al. 2000). Comme la lésion n'est pas compressible, l'échographie peut aider à la distinguer d'un abcès. Cependant, le rôle ultime de l'imagerie américaine dans ce domaine reste à définir.
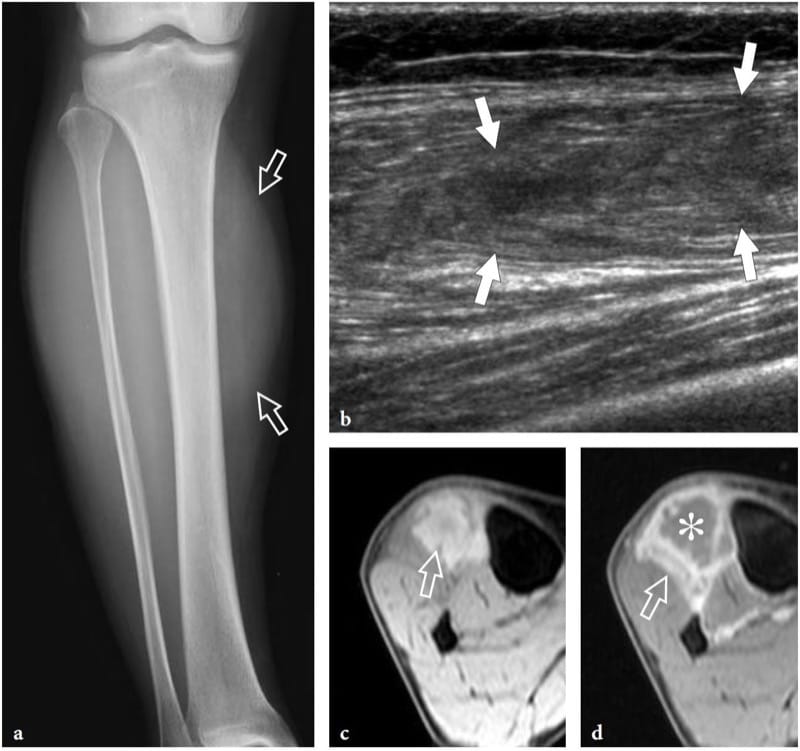
Illustration 22. a–d. Infarctus diabétique. a Un cliché simple antéropostérieur de la jambe droite chez un patient de 60 ans présentant un infarctus diabétique du membre inférieur distal montre une discrète tuméfaction des tissus mous (flèches) dans la musculature du compartiment antérolatéral. b L'image longitudinale 12–5 MHz US révèle une zone intramusculaire hypoéchogène avec une échotexture dérangée (flèches), qui est limitée au muscle tibial antérieur. c,d Les images d'IRM pondérées en T2 en T1* et d avec suppression de la graisse axiale et gadolinium montrent un œdème diffus du muscle tibial antérieur (flèche) et un anneau de haute intensité de signal après l'administration de gadolinium entourant un noyau central non rehaussé ( astérisque).
La rhabdomyolyse indique un processus de lésion musculaire grave caractérisé par la lyse des cellules musculaires squelettiques pouvant résulter de diverses blessures, telles qu'un traumatisme par écrasement, une ischémie, des toxines, des conditions inflammatoires auto-immunes et une thérapie à l'héparine (May et al. 2000). Le diagnostic est souvent manqué car les symptômes cliniques peuvent être indéfinis ou absents. L'échographie montre des zones d'échogénicité réduite et accrue et une désorganisation locale de l'architecture fasciculaire des muscles affectés (Lamminen et al. 1989 ; Steeds et al. 1999). Dans les phases aiguës, l'échographie peut aider à détecter le groupe musculaire affecté pour une décompression chirurgicale immédiate. De plus amples détails sur l'apparition de la rhabdomyolyse aux États-Unis sont illustrés dans les syndromes de compartiment.
13. TUMEURS
Les tumeurs du muscle squelettique sont rares par rapport aux lésions traumatiques. La plupart d'entre eux sont bénins. Cependant, la survenue d'une tumeur maligne doit toujours être prise en compte lors de l'évaluation d'une masse, même dans un contexte post-traumatique, car un traumatisme local n'exclut pas nécessairement la présence d'une tumeur préexistante. Dans cette section, nous nous concentrons sur l'aspect américain des tumeurs musculaires les plus courantes, compte tenu des histotypes dans lesquels cette technique est en mesure de fournir les informations les plus précieuses. Certains histotypes, tels que les lipomes et les hémangiomes, qui impliquent généralement des muscles mais ne sont pas d'origine musculaire, sont également abordés ici.
14. HÉMANGIOME INTRAMUSCULAIRE
Les hémangiomes profonds sont des tumeurs bénignes courantes des tissus mous qui surviennent souvent dans les muscles. Ils impliquent principalement les gros muscles de la cuisse et peuvent être douloureux si le muscle affecté est étroit et long, probablement par étirement des fibres musculaires. Le terme « hémangiome » englobe un large éventail de lésions allant des formes capillaires aux malformations vasculaires - y compris les types capillaires, caverneux, artério-veineux, veineux et mixtes - en fonction du type prédominant de canal vasculaire impliqué (Olsen et al. 2004). En plus de leurs composants vasculaires, les hémangiomes peuvent contenir des thrombus, des calcifications, de l'hémosidérine, de la graisse, des muscles lisses et des tissus fibreux, la graisse réactive étant l'association la plus courante. La variété des tissus retrouvés dans les hémangiomes musculaires explique leur aspect hétérogène. L'échographie montre une masse complexe mal définie dans le muscle affecté, caractérisée par un mélange de composants hypoanéchogènes et hyperéchogènes (prolifération réactive de graisse) (Fig. 23) (Derchi et al. 1989). Les canaux vasculaires proéminents peuvent également être identifiés sur l'imagerie en niveaux de gris et Doppler. La corrélation biunivoque entre les images échographiques et IRM montre une bonne correspondance entre les zones hyperéchogènes intratumorales et la graisse (signal T1 élevé), et les composants hypoéchogènes et les cavités remplies de sang (signal T2 élevé). Les phlébolithes dans la masse sont présents dans environ 50 % des cas et sont mieux identifiés sur des films simples (Fig. 23f) (Murphey et al. 1995). Aux États-Unis, ils apparaissent sous forme de points lumineux avec une ombre acoustique postérieure qui sont généralement situés dans la composante hypoéchogène de l'hémangiome. Dans l'ensemble, l'échographie peut diagnostiquer les hémangiomes, en particulier lorsque des phlébolithes sont détectés dans la masse. Lors d'une observation prolongée, des mouvements sanguins très lents dans les cavités hypoéchogènes de la masse peuvent être appréciés sur l'imagerie en niveaux de gris, comme une « masse grouillante ». Dans certains cas, cependant, l'évaluation des hémangiomes peut être difficile : en particulier, les limites de la lésion sont généralement indéfinies, en particulier dans les masses volumineuses infiltrant plus d'un muscle ou se confondant imperceptiblement avec les plans graisseux intermusculaires.
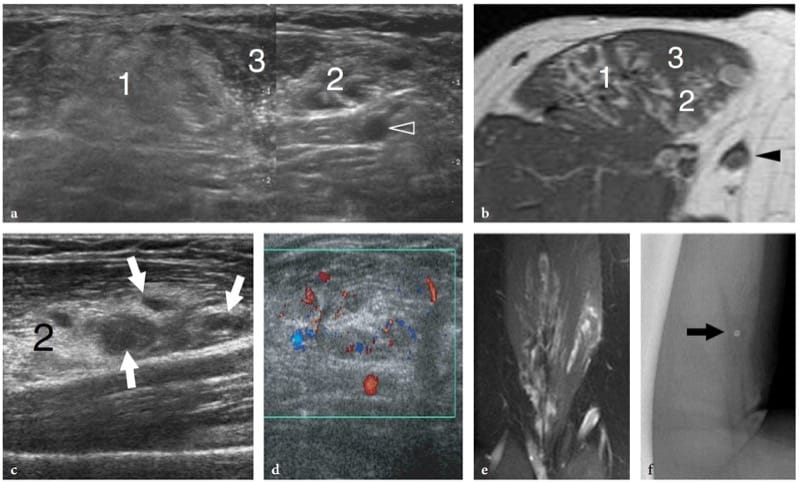
Figure 23. a–f. Hémangiome intramusculaire. a Image échographique transversale 12–5 MHz sur la partie antérieure du bras avec b corrélation d'imagerie IRM pondérée en T1 montre une masse intramusculaire mal définie composée d'un mélange de composants, y compris un tissu hyperéchogène homogène (1) lié à une prolifération de graisse réactive, du tissu musculaire résiduel (3) et un tissu hyperéchogène avec des canaux vasculaires proéminents (2). Pointe de flèche, veine basilique. Une image en écran partagé a été utilisée, les deux écrans étant alignés pour un champ de vision étendu. c, d Un examen plus approfondi de la composante vasculaire de l'hémangiome (2) montre des canaux hypoanéchogènes proéminents (flèches) caractérisés par un flux sanguin lent lors de l'évaluation par imagerie Doppler couleur. L'image IRM coronale pondérée en T2 montre l'extension craniocaudale de l'hémangiome dans le muscle biceps brachial. f La radiographie de profil du bras montre un phlébolith (flèche).
15. LIPOME PROFOND ET LIPOSARCOME
Les lipomes profonds peuvent survenir à l'intérieur (lipome intramusculaire) ou entre les muscles (lipome intermusculaire) et sont moins fréquents que les lipomes sous-cutanés (Fletcher et Martin-Bates 1988). L'origine intramusculaire est plus fréquente que la variante intermusculaire. Les lipomes peuvent affecter à la fois le muscle et le tissu conjonctif intermusculaire (Kransdorf et al. 1993 ; Murphey et al. 2004). Les sites de prédilection des lipomes intramusculaires sont le gros muscle des extrémités (p. ex., cuisse, tronc, épaule et bras). Cliniquement, ils se présentent comme des masses indolores à croissance lente mais, dans certains cas, ils se développent rapidement, provoquant des symptômes de compression nerveuse (Muren et al. 1994). Les lipomes intramusculaires bénins peuvent être arbitrairement subdivisés en un type bien circonscrit et un type infiltrant. Dans le premier cas, le tissu adipeux est clairement délimité du muscle environnant. L'échographie met en évidence une masse ovoïde bien définie contenue à l'intérieur d'un muscle avec l'aspect strié typique des lipomes superficiels : une certaine hétérogénéité peut être liée à des cloisons intrinsèques minces. Dans sa localisation intramusculaire, la masse n'est pas compressible et aucun signal Doppler n'est noté à l'intérieur. Les lipomes intramusculaires peuvent également devenir plus apparents sous forme de masses distinctes avec contraction musculaire. Certaines lésions apparaissent presque isoéchogènes avec le tissu musculaire adjacent. Dans ces cas, une technique de balayage minutieuse est nécessaire pour ne pas manquer même les grosses masses en les confondant avec les ventres musculaires environnants. Dans le type infiltrant, il y a remplacement du tissu musculaire de façon fade par de la graisse, et les fibres musculaires sont séparées par une prolifération de graisse entre elles (Matsumoto et al. 1999). À l'examen échographique, cela produit une masse striée hétérogène avec des caractéristiques indéfinies qui peuvent ne pas ressembler à un lipome (Fig. 24). Il faut se rappeler que le schéma infiltrant ne représente pas un signe de malignité dans les lipomes intramusculaires. Bien que l'aspect hyperéchogène de ces masses suggère de la graisse, d'après notre expérience, l'IRM est bien supérieure à l'échographie pour l'identification fiable du tissu adipeux dans les lipomes infiltrants.
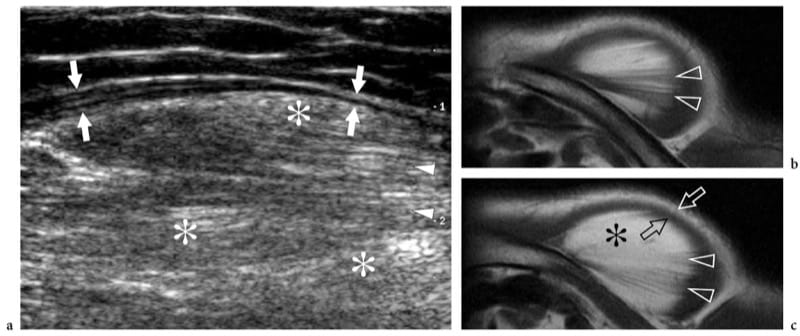
Illustration 24. a–c. Lipome intramusculaire : type infiltrant. a Image échographique transversale 12–5 MHz sur l'épaule antérieure chez un patient présentant une masse indolore à croissance lente avec une corrélation d'imagerie IRM pondérée en T1 axiale b,c montrant une masse importante dans le muscle deltoïde caractérisée par un fond hyperéchogène (astérisques) et une motif strié (têtes de flèches) dû aux fibres musculaires entremêlées avec de la graisse. Le lipome est délimité par un mince rebord hypoéchogène (flèches) reflétant le tissu musculaire déplacé en périphérie.
Après les tumeurs malignes fibreuses et fibrohistocytaires, le liposarcome représente le deuxième type le plus courant de sarcome des tissus mous, représentant environ 10 à 25 % de tous les sarcomes des tissus mous (Murphey et al. 2005). Elle est prédominante chez les hommes autour des cinquième et sixième décennies de la vie et ne représente pas le résultat de la transformation maligne d'un lipome. Sur le plan histopathologique, les liposarcomes sont regroupés en cinq sous-types : bien différenciés, myxoïdes, à cellules rondes, pléomorphes et dédifférenciés. Le liposarcome bien différencié est le type le plus courant (50 %) ; il n'a pas de potentiel métastatique mais a tendance à se reproduire localement. L'échographie montre de grandes masses multilobées bien définies qui, dans la plupart des cas, ne se distinguent pas des lipomes matures (Fig. 25) (Futani et al. 2003 ; Murphey et al. 2005). D'après les résultats de l'échographie en niveaux de gris, les lésions ressemblant à des lipomes d'aspect complexe (contenant des cloisons épaisses et des foyers nodulaires ou globulaires avec une échotexture autre que celle de la graisse) méritent toujours un examen plus approfondi avec une IRM à contraste amélioré (Fig. 26). La détection de signaux de flux sanguin dans une masse ressemblant à un lipome avec une imagerie Doppler couleur et puissance devrait également alerter l'examinateur (Bodner et al. 2002 ; Futani et al. 2003). Contrairement au liposarcome bien différencié, le liposarcome myxoïde se présente comme une masse multinodulaire bien circonscrite dont l'aspect pathologique brut comprend un plus petit volume de graisse (souvent <10 % du total) et un mélange variable de composants myxoïdes et de cellules rondes. L'échographie met en évidence une masse hypoéchogène complexe avec rehaussement acoustique postérieur, un aspect non spécifique assez différent de celui des lipomes typiques (Sung et al. 2000). D'après les résultats de l'IRM non améliorée (signal T2 élevé lié à la composante myxoïde), le liposarcome myxoïde peut souvent ressembler à un kyste. Cet écueil semble particulièrement probable au niveau du creux poplité, où la masse kystique peut mimer un kyste de Baker. Dans ces cas, l'échographie peut être utile pour révéler que la masse ne répond pas aux critères d'un kyste (Sung et al. 2000). Enfin, les formes à cellules rondes, pléomorphes et dédifférenciées sont des tumeurs localement agressives à fort potentiel métastatique. Ils présentent des composants non lipomateux qui peuvent être prédominants avec peu ou pas de graisse (cellules rondes et pléomorphes). En conséquence, le diagnostic par échographie et IRM de ces dernières masses peut être très difficile en raison de leur aspect non spécifique.
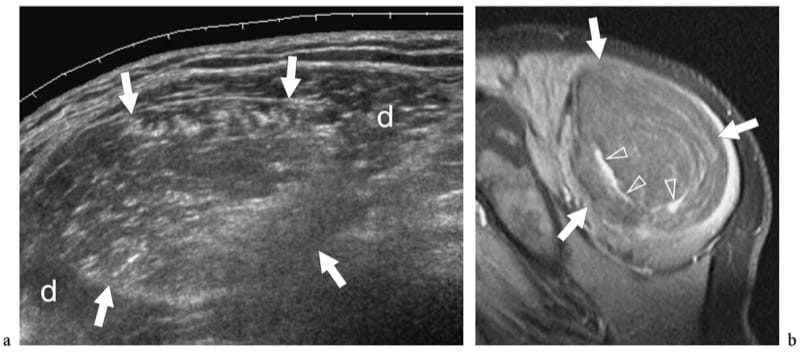
Illustration 25. a, b. Liposarcome intramusculaire bien différencié. une image US sagittale 12–5 MHz au-dessus de l'épaule postéro-latérale montre une grande masse arrondie intramusculaire (flèches) en expansion dans le muscle deltoïde (d). La masse est nettement délimitée et présente une échotexture hyperéchogène hétérogène par rapport à la musculature adjacente suggérant de la graisse. b L'IRM sagittale corrélative pondérée en T1 avec suppression de la graisse après administration de produit de contraste montre une grande masse composée de graisse avec des septa proéminents (têtes de flèches). Un liposarcome bien différencié a été diagnostiqué à l'examen histopathologique. Notez que les septa de renforcement visibles à l'IRM n'ont pas été vus à l'examen américain. Dans l'ensemble, la capacité de diagnostiquer un liposarcome bien différencié avec l'échographie, par rapport à l'imagerie par résonance magnétique, est limitée.
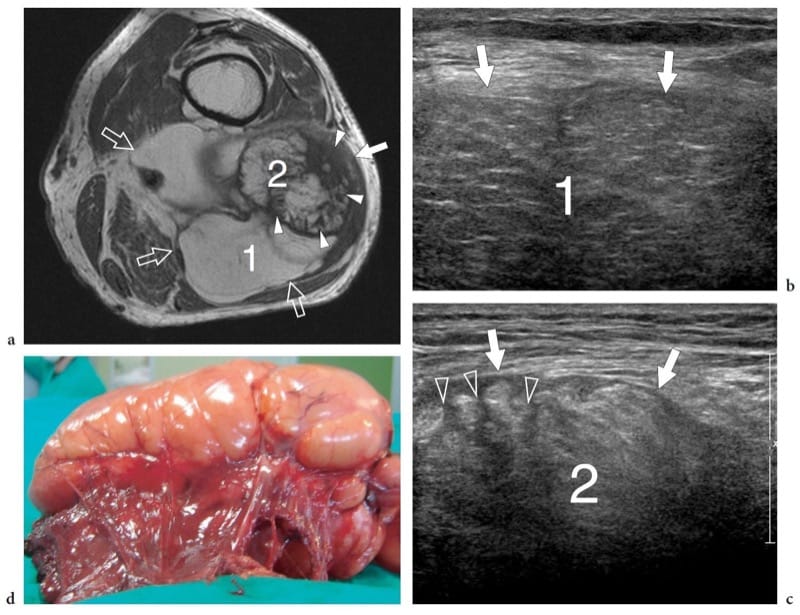
Figure 26. a–d. Liposarcome dédifférencié intramusculaire. une image IRM transversale pondérée en T1 de la région poplitée supérieure chez un homme de 70 ans présentant une lésion indolore, à croissance lente (sur 5 ans) et occupant de l'espace qui avait été cliniquement diagnostiquée comme un kyste poplité, montre un grand lipomateux intramusculaire hétérogène masse (flèches) issue du biceps fémoral avec extension intermusculaire. La masse est caractérisée par une grande partie lipomateuse (1) et une zone supplémentaire (2) avec des septa épais et des zones nodulaires non lipomateuses (têtes de flèches). b,c L'examen échographique transversal 12–5 MHz des deux zones indiquées en a par 1 et 2 révèle une masse hétérogène (flèches) avec à la fois des zones hypoéchogènes striées (1), correspondant à du tissu lipomateux, et des régions d'échogénicité plus élevée ( 2) traversé par d'épaisses cloisons hypoéchogènes (têtes de flèches). d Spécimen chirurgical brut.
16. MYXOME INTRAMUSCULAIRE
Le myxome intramusculaire est une tumeur bénigne à croissance lente composée d'abondants dépôts myxoïdes et de fibroblastes (Murphey et al. 2002; Luna et al. 2005). Les myxomes intramusculaires touchent principalement les patients âgés de 40 à 70 ans avec une prédominance féminine et sont plus fréquemment localisés dans les gros muscles de la cuisse, de l'épaule, des fesses ou du haut du bras. L'échographie démontre le myxome intramusculaire comme une lésion hypoéchogène solide ou mixte bien délimitée avec des fentes remplies de liquide ou des foyers kystiques internes reflétant le stroma myxoïde (Fornage et Romsdahl 1994 ; Murphey et al. 2002). Grâce à la transmission du son est généralement observée. Certains résultats d'imagerie spécifiques suggèrent fortement un myxome intramusculaire et peuvent aider au diagnostic différentiel. Le premier est la présence d'une petite quantité de graisse hyperéchogène entourant le nodule, le plus souvent observée aux pôles supérieur et inférieur de la lésion, appelée calotte graisseuse ou croûte graisseuse (Fig. 27) (Bancroft et al. 2002 ; Murphey et al. 2002 ; Luna et al. 2005). Ce signe peut également être retrouvé dans les tumeurs neurogènes, mais dans ces derniers histotypes, le diagnostic repose sur la détection de la continuité des pôles opposés de la masse avec le nerf parent. Le second est la détection d'un œdème entourant la lésion : pour lequel l'IRM pondérée en T2 semble supérieure à l'échographie (Bancroft et al. 2002). Bien que la reconnaissance de ces caractéristiques n'empêche pas la biopsie, elle permet une planification préopératoire plus précise. Il faut tenir compte du fait que les caractéristiques d'imagerie IRM du myxome intramusculaire peuvent être trompeuses, ressemblant à celles d'un kyste avec une faible intensité de signal homogène sur les images pondérées en T1 et une intensité de signal élevée sur les séquences IRM pondérées en T2 ou sensibles aux fluides (teneur élevée en eau ). L'échographie peut contribuer à distinguer les deux histotypes. De plus, les caractéristiques d'imagerie RM du myxome intramusculaire peuvent être partagées avec d'autres lésions myxoïdes, y compris le liposarcome myxoïde dans une localisation intramusculaire (Sung et al. 2000). La différenciation entre ces deux lésions a des implications majeures car le myxome a une évolution clinique bénigne sans tendance à récidiver ou à métastaser.
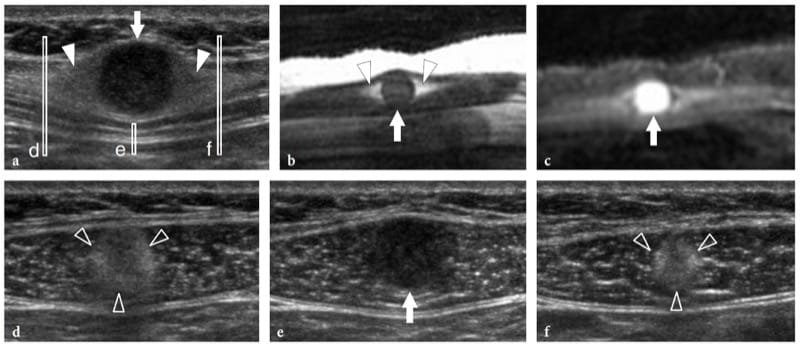
Figure 27. a–f. Myxome intramusculaire. a Image échographique sagittale 12–5 MHz sur la paroi abdominale antérieure chez un patient présentant une petite masse palpable indolore de taille invariable avec des images IRM corrélatives sagittales b pondérées en T1 et c pondérées en T2 avec suppression de la graisse c montrant une hypoéchogène homogène arrondie bien circonscrite masse (flèche) dans le muscle droit de l'abdomen avec une croûte de graisse à ses faces supérieure et inférieure (têtes de flèches). La masse apparaît isointense au muscle sur l'image pondérée en T1 et a une intensité de signal élevée, similaire à celle du liquide, sur l'image pondérée en T2. d–f Les images US transversales 12–5 MHz obtenues aux niveaux indiqués en a (barres blanches verticales) montrent d la calotte graisseuse crânienne (têtes de flèches), e le nodule (flèche) et f la calotte graisseuse inférieure (têtes de flèches). Notez que la lésion est entièrement intramusculaire dans son emplacement.
17. DESMOÏDE
Les desmoïdes extra-abdominaux, également connus sous le nom de fibromatose agressive, sont des tumeurs rares des tissus mous provenant du tissu conjonctif du muscle, du fascia sus-jacent ou de l'aponévrose (Robbin et al. 2001). Le pronostic des desmoïdes est quelque peu lié à l'âge du patient (pic d'incidence entre 25 et 40 ans), les lésions les plus agressives étant retrouvées chez les patients de moins de 30 ans. Bien que la plupart des cas se manifestent par des tumeurs solitaires, les desmoïdes se présentent sous forme de masses multicentriques (synchrones ou métachrones) dans environ 10 à 15 % des cas. Ils ont un comportement agressif avec une croissance tumorale rapide et une infiltration des tissus voisins, et le taux de récidive locale après chirurgie est élevé (Robbin et al. 2001). Les desmoïdes apparaissent préférentiellement dans le membre inférieur le long du trajet du nerf sciatique, dans la ceinture des membres et dans la région de l'épaule. Le terme « desmoïde » désigne une lésion « ressemblant à un tendon » : en fait, la lésion est composée de réseaux de fibroblastes et de quantités variables de collagène dense. Après leur croissance initiale, la plupart des desmoïdes évoluent vers un rétrécissement progressif de la masse, avec une diminution de la cellularité et du volume des espaces extracellulaires jusqu'à devenir une masse de forme irrégulière de tissu dense de collagène (Vandervenne et al. 1997). En conséquence, le schéma d'intensité du signal d'imagerie RM des desmoïdes varie avec le temps, reflétant probablement les différentes proportions de tissu cellulaire, de tissu myxoïde et de collagène (Vandervenne et al. 1997). Peu d'expérience est rapportée dans la littérature sur les caractéristiques échographiques des desmoïdes extra-abdominaux : ces masses s'étendent généralement le long du fascia et engloutissent les fibres musculaires, ont une échogénicité variable (en fonction du degré de cellularité, de la teneur en eau et du collagène), et sont mal définies ou limites nettes (Fig. 28a – c) (Mantello et al. 1989; Casillas et al. 1991). Une faible échotexture fibrillaire et une atténuation acoustique postérieure reflétant un tissu de collagène dense sont souvent détectées. L'imagerie Doppler peut montrer à la fois un aspect hypervasculaire et hypovasculaire : en général, les lésions avec un collagène abondant sont hypovasculaires. Bien qu'étonnamment similaires à d'autres types de desmoïdes extra-abdominaux en termes de caractéristiques histopathologiques et d'imagerie, les tumeurs desmoïdes de la paroi abdominale sont considérées comme une entité distincte en raison de leur relation certaine avec les femmes prenant des contraceptifs oraux (tumeur sensible aux œstrogènes). grossesse (pendant ou après), chirurgie abdominale et traumatisme. De plus, ils peuvent faire partie du syndrome familial de Gardner. Ces tumeurs surviennent le plus souvent dans le muscle droit de l'abdomen et les muscles externes obliques (Fig. 28d, e) (Robbin et al. 2001).
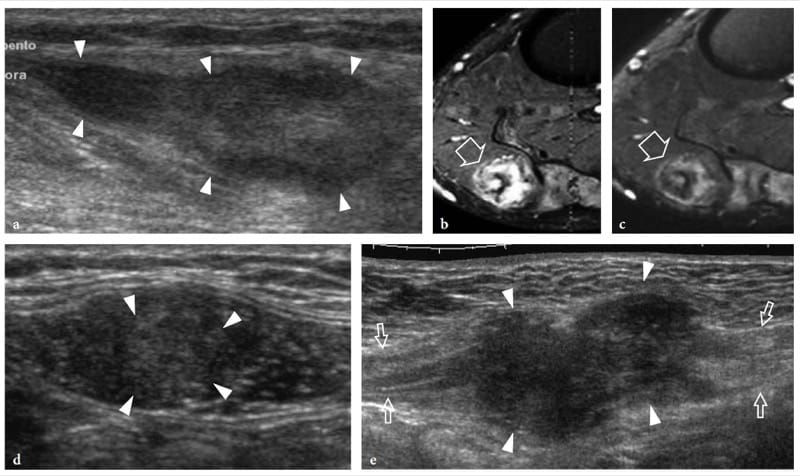
Figure 28. a–e. Desmoïdes intramusculaires : spectre des apparitions américaines. a–c Desmoïde extra-abdominal du creux poplité. a Image échographique longitudinale 12–5 MHz au-dessus de la tête médiale du gastrocnémien avec des images IRM transversales b pondérées en T2 avec suppression de la graisse et c transversales pondérées en T1 avec suppression de la graisse au gadolinium montrant une masse hypoéchogène solide intramusculaire (têtes de flèches) avec quelques légers fibrillaires motif allongé le long du grand axe du gastrocnémien. À l'IRM, la masse (flèche) a une intensité de signal élevée hétérogène sur l'image pondérée en T2, ce qui correspond à une cellularité accrue, et se caractérise par des bandes proéminentes de faible intensité de signal, probablement liées aux zones denses de collagène. d,e Desmoïdes de la paroi abdominale. Deux cas différents observés chez des jeunes femmes d prenant des pilules contraceptives et e en période post-puerpérale. d L'image échographique transversale 12–5 MHz sur le muscle droit de l'abdomen gauche révèle une masse hypoéchogène hétérogène intramusculaire mal définie (têtes de flèches). e L'image américaine à champ de vision étendu longitudinal de 12 à 5 MHz montre une grande masse hypoéchogène (têtes de flèches) avec des marges irrégulières, une croissance infiltrante et un comportement agressif provenant du muscle droit de l'abdomen (flèches).
18. RHABDOMYOSARCOME ET METASTASES
Le rhabdomyosarcome est la principale tumeur maligne primitive du muscle strié. Il est extrêmement agressif et présente un potentiel élevé d'invasion locale, de récidive précoce et de métastases. La tumeur survient tout au long de l'enfance et de l'adolescence avec deux pics d'incidence entre 2 et 6 ans et 14 et 18 ans. Il existe deux histotypes principaux : embryonnaire (botryoïde) et alvéolaire (anaplasique), ce dernier provenant plus souvent des muscles des extrémités et caractérisé par un pronostic plus défavorable (Cohen et al. 2). L'investigation en imagerie diagnostique du rhabdomyosarcome repose essentiellement sur l'imagerie IRM. Avec cette technique, la tumeur est généralement isointense au muscle sur les images pondérées en T1996 et présente une intensité de signal élevée sur les images pondérées en T1 (McCarville et al. 2). Après administration de gadolinium, on observe généralement un rehaussement hétérogène lié à des zones nécrotiques. Les caractéristiques d'imagerie américaines du rhabdomyosarcome manquent de spécificité ; chez ces patients, le rôle de l'échographie se limite à guider la biopsie percutanée.
Dans l'expérience clinique, l'incidence des métastases intramusculaires de tumeurs malignes est faible. De nombreux facteurs (p. ex., l'activité contractile, les changements locaux de pH et d'oxygénation, l'accumulation d'acide lactique, le volume et la pression du flux sanguin intramusculaire, la température locale) sont susceptibles d'interférer avec la croissance intramusculaire des tumeurs secondaires (Williams et al. 1997). Cependant, la prévalence réelle des métastases musculaires striées dans les séries d'autopsies de patients qui présentaient une malignité au moment du décès est beaucoup plus élevée (16 %) que prévu (Pearson 1959). La raison d'un tel écart est probablement liée au fait que ces lésions sont indolores et peuvent ne pas être détectées lorsqu'elles sont petites (Chen et al. 2005). Les tumeurs primaires qui se propagent le plus souvent aux muscles squelettiques sont les carcinomes du sein, du côlon et du poumon (Chen et al. 2005). Bien que le diagnostic puisse être suspecté sur la base des antécédents cliniques, l'imagerie échographique manque de spécificité pour montrer l'origine histologique de la tumeur, qui ne peut être établie que par une biopsie à l'aiguille (Fig. 29) (Rubens et al. 1997 ; Yang et al. 1999 ; Ahuja et al. 2000 ; Chen et al. 2005). Enfin, il faut se rappeler que les procédures percutanées guidées par échographie pour la biopsie et l'ablation thermique des tumeurs abdominales peuvent provoquer l'ensemencement à l'aiguille de cellules tumorales dans le tissu sous-cutané et les muscles de la paroi abdominale (Kanematsu et al. 1997 ; Kim et al. 2000). Cette complication n'est pas négligeable et semble liée au nombre de passages et à la taille de l'aiguille (Kim et al. 2000).
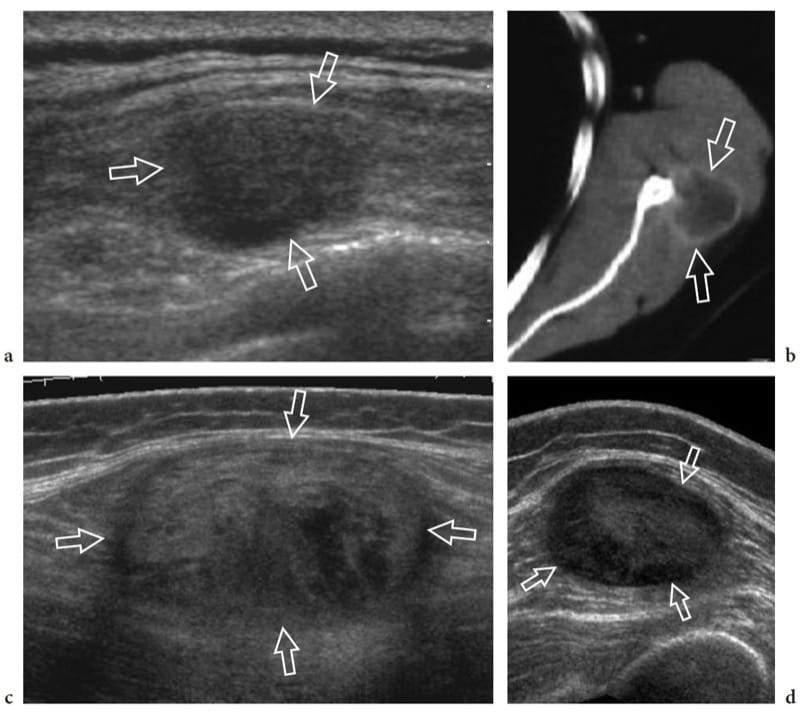
Illustration 29. a–d. Métastases intramusculaires : spectre des apparitions américaines. Trois patients différents avec des antécédents de tumeur maligne. a Image US transversale 12–5 MHz sur la région parascapulaire gauche avec corrélation b CT montre un nodule hypoéchogène solide (flèches) situé dans le muscle sous-épineux. La biopsie a révélé des métastases de mélanome. c,d Les images échographiques transversales 12–5 MHz sur c la région fessière et d la partie antérieure de la cuisse montrent des masses intramusculaires ovales bien définies (flèches) reflétant des métastases musculaires squelettiques de c colique et d carcinome rénal respectivement. Notez l'aspect hétérogène des métastases musculaires squelettiques, allant des nodules hypoéchogènes aux nodules hyperéchogènes.
19. TENDON
Considérations histologiques
Les tendons sont un maillon essentiel du système musculo-squelettique, agissant pour relier les muscles aux os. Ils sont constitués de collagène de type 1 (environ 70 % du poids sec) inclus dans une matrice extracellulaire et se caractérisent par une résistance à la traction élevée, similaire à celle de l'os (Erickson 1997). Il a été estimé qu'une section transversale de 1 cm2 de tissu tendineux est capable de supporter une charge allant jusqu'à 1 tonne (Erickson 1997). Dans les tendons, le collagène a un arrangement complexe, composé de faisceaux de fibres très ordonnés regroupés en fascicules. La plupart des fibres ont une trajectoire longitudinale à l'axe du tendon ; certains, cependant, peuvent supposer des arrangements transversaux et en spirale (Sharma et Maffulli 2005). Cette configuration du collagène conduit à une résistance à la traction plus élevée et au renforcement des sites de fixation du tendon. L'endotendineum et le péritendineum - composés de tissu conjonctif lâche, de fibres élastiques et de petits vaisseaux - enveloppent les faisceaux de collagène et sont en continuité avec l'épitendineum, une couche de tissu conjonctif dense étroitement liée à la surface externe du tendon.
Les tendons peuvent être divisés en deux classes principales : les tendons à trajet rectiligne (type 1) et les tendons qui redirigent leur parcours à travers les articulations synoviales avant d'atteindre leur insertion (type 2). Ces deux types ont des enveloppes différentes afin de réduire les frottements lors des mouvements. Les tendons de type 1 sont entourés par le paratenon, une enveloppe lâche de tissu aréolaire et adipeux qui fournit des pédicules vasculaires pénétrant dans la substance tendineuse à intervalles le long de la longueur du tendon et se répartissant longitudinalement dans l'endotendineux (Fig. 30a). Le paratenon se confond avec l'épitendineum pour former le péritendon. Les tendons de type 2 sont recouverts d'une gaine synoviale avec un revêtement cellulaire identique à la synoviale (Fig. 30b). Cette gaine est une structure complexe composée de deux couches interconnectées : une interne viscérale recouvrant l'épitendinum et une externe pariétale en continuité avec les espaces conjonctifs adjacents (Erickson 1997). La gaine est repliée par le tendon, de sorte que les couches viscérale et pariétale sont reliées par un mésotendon qui fournit une voie pour l'approvisionnement en sang. La cavité virtuelle formée par ces couches contient une petite quantité de fluide qui facilite le glissement sans frottement du tendon à l'intérieur de la gaine. Dans les tunnels ostéofibreux ou à travers les articulations, les tendons avec une gaine synoviale sont retenus dans leur emplacement anatomique approprié par des rétinacules, constitués d'épaississements transversaux focaux du fascia profond attachés aux deux extrémités aux proéminences osseuses (Fig. 30c).
Sur la base de l'angle tendon-os et de la mobilité, les attaches tendineuses à l'os (enthèse) peuvent être fibreuses ou fibrocartilagineuses (Erickson 1997). En général, les tendons qui contrôlent le mouvement dans plus d'un plan et s'insèrent presque perpendiculairement dans l'os (par exemple, le tendon d'Achille) ont une attache fibrocartilagineuse épaisse afin de minimiser l'effilochage du tendon (Erickson 1997). Les bourses péritendineuses, interposées entre la partie préinsertionnelle des tendons avec paraténon et les surfaces osseuses ou cutanées, minimisent la friction entre ces structures lors du mouvement articulaire. Les sésamoïdes, qu'ils soient chondraux ou osseux, peuvent être rencontrés dans les tendons étroitement appliqués à l'os. Certains d'entre eux (par exemple, os peroneum) peuvent être blessés en association avec la déchirure du tendon (Brigido et al. 2005).
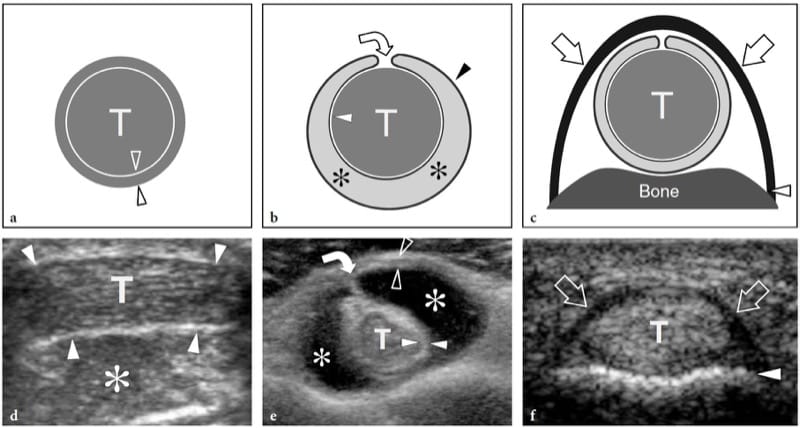
Figure 30. a–f. Enveloppes tendineuses et rétinacules. a Dessin schématique et d Image US 12–5 MHz à petit axe correspondant d'un tendon de type 1 (T) investi par paraténon. Sur l'image US, le péritendon (têtes de flèches) se présente comme une fine enveloppe hyperéchogène qui se distingue de la graisse environnante (astérisque). b Dessin schématique et e image US à petit axe 12–5 MHz correspondante d'un tendon de type 2 (T) investi par la gaine synoviale chez un patient atteint de ténosynovite séreuse. La présence d'un épanchement synovial anéchoïque (astérisques) permet une représentation précise de la gaine synoviale, qui consiste en une combinaison de couches viscérales (têtes de flèches blanches) et pariétales (têtes de flèches ouvertes), et du mésotendon (flèche courbe). c Le dessin schématique et l'image US correspondante à petit axe 12–5 MHz des tendons fl exor digitorum (T) des doigts montrent l'apparence normale d'une poulie annulaire (flèches), un rétinaculum qui empêche la corde d'arc des tendons sous-jacents pendant la flexion des doigts. A noter que la partie superficielle des poulies a un aspect hyperéchogène et fibrillaire du fait de l'incidence perpendiculaire du faisceau US, alors que ses parties latérales sont hypoéchogènes par anisotropie. Pointe de flèche, os phalangien.
20. ANATOMIE AMÉRICAINE NORMALE ET TECHNIQUE DE NUMÉRISATION
Un examen américain réussi des tendons peut être effectué avec presque tous les équipements américains disposant d'une gamme de transducteurs linéaires à haute fréquence de 5 à 13 MHz disponibles, la fréquence américaine optimale étant liée à l'habitus corporel du patient et à la profondeur du tendon examiné. L'évaluation américaine des tendons normaux le long de leur axe longitudinal montre un réseau interne composé de nombreux échos linéaires fins et serrés qui ressemblent à un motif fibrillaire (Fig. 31a) (Fornage 1986; Fornage et Rifkin 1988; Martinoli et al. 1993). Ces échos sont des réflexions spéculaires du faisceau US et deviennent plus clairement visibles et mieux séparés les uns des autres à mesure que la fréquence du transducteur augmente. À des fréquences plus élevées, les fibrilles ont une réflectivité plus élevée et deviennent plus minces et plus nombreuses (Martinoli et al. 1993). Sur les plans à petit axe, l'échographie montre l'écho-texture normale du tendon composée de points groupés pointillés brillants au lieu des échos fibrillaires linéaires (Fig. 31b). La corrélation histologique a démontré que les échos linéaires visibles dans les tendons dépendent des interfaces acoustiques aux limites des faisceaux de collagène et des septa endotendineux, en fonction de leur composition histologique différente (Fig. 31c) (Martinoli et al. 1993). Compte tenu de la structure hautement ordonnée des plans superposés de collagène et de septa, les tendons sont des structures fortement anisotropes à l'examen américain, et les échos fibrillaires ne peuvent être démontrés avec efficacité que lorsque le faisceau américain leur est perpendiculaire (Fornage et al. 1987 ; Fornage et Rifkin 1988). Même une légère obliquité de l'angle d'incidence peut entraîner une diminution de l'échogénicité artificielle qui peut obscurcir les détails de texture et même imiter une maladie tendineuse (Fig. 31d, e). En pratique, cela se produit si un transducteur incurvé plutôt que linéaire est utilisé, ou lorsque des tendons de forme curviligne (c'est-à-dire la coiffe des rotateurs) ou une orientation oblique par rapport à la surface de la peau (c'est-à-dire le tendon distal du biceps) sont examinés. L'épitendinum peut être vu comme une ligne réfléchissante entourant le tendon. Les tendons qui dérivent d'un muscle ont un motif fibrillaire uniforme. Des détails intratendineux supplémentaires peuvent être appréciés dans les tendons qui proviennent d'un ou plusieurs muscles. Dans le tendon d'Achille, par exemple, les contributions convergentes des deux chefs du gastrocnémien et de l'interface entre eux (postérieur) et le soléaire (antérieur) peuvent être visualisées comme des échos épaissis centraux dus à l'union des enveloppes péritendineuses respectives (Bertolotto et al. 1995); dans le tendon du quadriceps, un complexe trilaminaire constitué de couches distinctes superficielles (du rectus femoris), intermédiaires (du vaste médial et latéral) et profondes (du vaste intermédiaire) peut être vu s'unir dans un tronc commun (Bianchi et al. 1994a). En ce qui concerne les enveloppes tendineuses, le para-tenon apparaît comme un tissu hyperéchogène indéfini en continuité avec la graisse sous-cutanée, et fournit des pédicules vasculaires pénétrant dans la substance tendineuse à intervalles le long de la longueur du tendon et se répartissant longitudinalement dans l'endotendineux (Fig. 30d). Dans des conditions normales, l'échographie montre la gaine synoviale comme un mince rebord hypoéchogène entourant les tendons, en raison d'un film de liquide contenu dans l'espace synovial. L'anatomie complexe de la gaine peut être mieux délimitée en cas d'épanchement ténosynovial, lorsque l'espace synovial est distendu par une plus grande quantité de liquide (Fig. 30e).
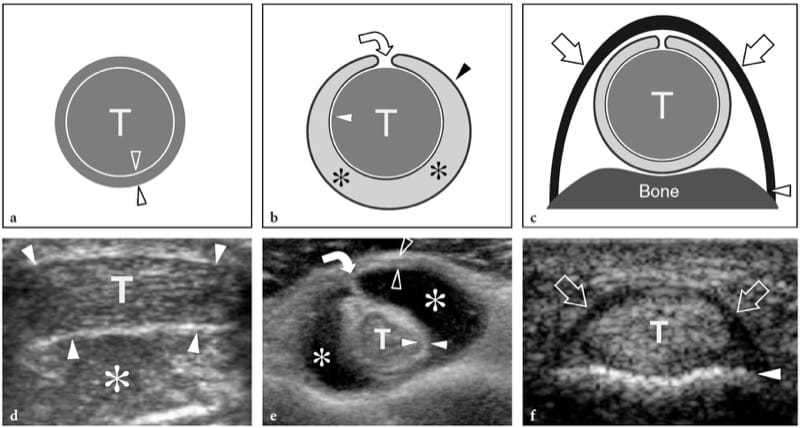
Figure 30. a–f. Enveloppes tendineuses et rétinacules. a Dessin schématique et d Image US 12–5 MHz à petit axe correspondant d'un tendon de type 1 (T) investi par paraténon. Sur l'image US, le péritendon (têtes de flèches) se présente comme une fine enveloppe hyperéchogène qui se distingue de la graisse environnante (astérisque). b Dessin schématique et e image US à petit axe 12–5 MHz correspondante d'un tendon de type 2 (T) investi par la gaine synoviale chez un patient atteint de ténosynovite séreuse. La présence d'un épanchement synovial anéchoïque (astérisques) permet une représentation précise de la gaine synoviale, qui consiste en une combinaison de couches viscérales (têtes de flèches blanches) et pariétales (têtes de flèches ouvertes), et du mésotendon (flèche courbe). c Le dessin schématique et f l'image US à petit axe correspondante de 12 à 5 MHz des tendons fléchisseurs des doigts (T) des doigts montre l'apparence normale d'une poulie annulaire (flèches), un rétinaculum qui empêche la corde d'arc des tendons sous-jacents pendant la flexion de les doigts. A noter que la partie superficielle des poulies a un aspect hyperéchogène et fibrillaire du fait de l'incidence perpendiculaire du faisceau US, alors que ses parties latérales sont hypoéchogènes par anisotropie. Pointe de flèche, os phalangien.
Aux extrémités tendineuses, la fixation au muscle est progressive et se traduit par un encombrement des fibres musculaires, avec diminution rapide du volume du muscle, alors que la fixation à l'os est brutale et comporte une étroite bande hypoéchogène faisant face au cortex osseux en raison de l'interposition de tissu fibreux ou fibrocartilage. Dans certains tendons, l'insertion dans l'os peut être plus importante chez les sujets physiquement actifs. En fonction de l'angle fibre-os, l'anisotropie peut augmenter artificiellement l'étendue de cette zone lorsque les fibres tendineuses passent d'un alignement horizontal à un alignement plus vertical à mesure qu'elles approchent de leur insertion. Les rétinacules apparaissent comme de fines bandes laminaires anisotropes orientées transversalement sur le grand axe du tendon (Fig. 30f). L'identification d'un espace hypoéchogène intermédiaire ou le balayage dynamique facilitent la différenciation des rétinacules fixes des tendons glissants.
Selon le site examiné, le bon positionnement du transducteur perpendiculairement au tendon examiné doit être atteint soit en modifiant l'obliquité du transducteur, soit en déplaçant l'articulation examinée tout en maintenant le transducteur fixe ou en induisant une tension dans le tendon examiné par une contraction active du muscle. Des coussinets flexibles ou des quantités généreuses de gel doivent être utilisés pour l'évaluation des tendons qui s'enroulent autour des surfaces articulaires curvilignes. Cependant, lorsque des proéminences osseuses ou des espaces étroits empêchent un alignement adéquat de la sonde sur le grand axe du tendon, l'évaluation échographique peut être effectuée sur des plans à petit axe. Bien que ces plans ne permettent pas la représentation des échos fibrillaires linéaires, les tendons peuvent également être identifiés de manière fiable, sur la base de la variation critique de leur échogénicité qui peut être induite en faisant basculer la sonde d'avant en arrière. Le balayage systématique sur des plans à axe court a l'avantage supplémentaire de mieux décrire les relations des tendons avec les structures adjacentes, ainsi que de confirmer la présence et l'étendue des résultats pathologiques. De plus, lorsque plusieurs tendons sont adjacents les uns aux autres à travers un espace restreint ou à travers une articulation, il est plus facile de distinguer chaque tendon individuel sur des plans à axe court. La dynamique du mouvement du tendon pendant l'activité articulaire ou la contraction musculaire peut être évaluée par échographie en temps réel, ce qui peut être essentiel pour exclure les anomalies tendineuses, pour différencier les déchirures partielles des déchirures complètes, ainsi que pour évaluer l'état d'un tendon postopératoire.
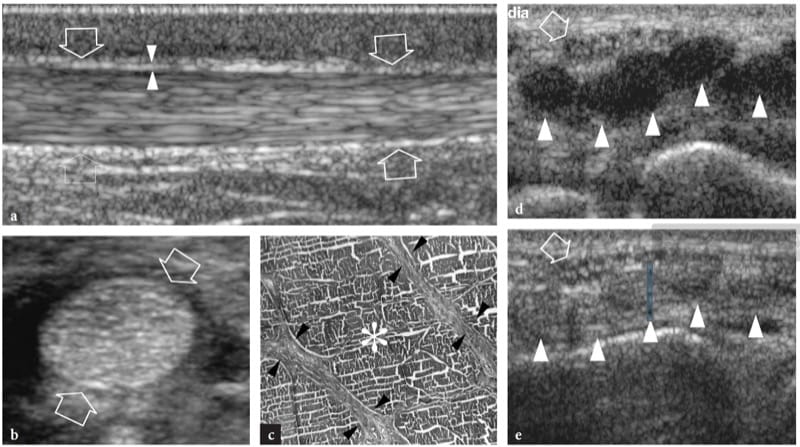
Figure 31. a–e. Échotexture et anisotropie des tendons. une image US à axe long 12–5 MHz du tendon d'Achille normal (flèches) montre de nombreuses interfaces intratendineuses échogènes, entraînant l'aspect fibrillaire typique. Grâce à l'utilisation d'un transducteur à réseau linéaire, la représentation des échos fibrillaires est assez homogène sur toute l'image US, sans zones hypoéchogènes causées par l'anisotropie. Le paraténon apparaît comme une enveloppe hyperéchogène (têtes de flèches) en continuité avec la graisse sous-cutanée. b L'image US à axe court 17–5 MHz du tendon normal du long fléchisseur du pouce (flèches) montre un motif intratendineux homogène composé de points groupés pointillés brillants. c L'échantillon histologique montre la structure fine des tendons constitués de septa endotendineux parallèles (têtes de flèches) qui croisent les fibres de collagène (astérisque). d,e Anisotropie tendineuse. Images échographiques transversales 12–5 MHz des tendons fléchisseurs du poignet obtenues avec un angle d'incidence du faisceau échographique d différent ou e égal à 90°. d Un aspect hypoéchogène artéfact est obtenu lorsque les tendons (têtes de flèches) sont imagés avec le faisceau US à un angle inapproprié. Comme le montre la figure e, cela contraste avec l'aspect fibrillaire hyperéchogène normal affiché lorsque le faisceau US est perpendiculaire à l'axe du tendon. Notez que la structure fasciculaire du nerf médian (flèche) est toujours apparente quel que soit l'angle d'incidence, car les nerfs ne présentent pas d'anisotropie.
21. INSTABILITÉ TENDONIENNE
La luxation survient au niveau des tendons investis par la gaine synoviale, suite à la lésion d'une ou plusieurs structures de contention d'un tunnel ostéofibreux, telles que les ligaments, les rétinacules et les poulies annulaires. Un large spectre de lésions mécaniques, allant des traumatismes aigus violents aux lésions mineures répétitives, peut entraîner une instabilité de certains tendons en se reflétant dans les tunnels ostéofibreux : une hypoplasie congénitale de la gouttière osseuse ou une laxité du toit fibreux du tunnel peuvent prédisposer à l'instabilité tendineuse (Fig. 32a). L'évaluation échographique peut révéler le degré d'instabilité du tendon (c.-à-d. subluxation intermittente, subluxation permanente, luxation) ainsi qu'un certain nombre de signes associés, tels qu'un épanchement péritendineux lié à une ténosynovite ou des lésions de la substance tendineuse dues à un frottement anormal du tendon déplacé contre les bords osseux (Fig. 32b, c). L'examen dynamique peut améliorer la détection de la subluxation intermittente et évaluer si une réduction spontanée est possible. L'imagerie dynamique offerte par l'échographie semble bien adaptée à une telle évaluation, notamment en cas de subluxation, où cette technique est plus efficace et plus facile que l'imagerie IRM obtenue avec des positionnements variés. Les luxations permanentes peuvent être facilement identifiées sur les scanners statiques, tandis que les subluxations intermittentes nécessitent un examen dynamique pour évaluer si une réduction spontanée est possible. Le balayage systématique sur des plans à petit axe est préféré pour évaluer l'instabilité des tendons, car le tunnel vide et le tendon déplacé peuvent être mis en évidence sur une seule image. Dans les chapitres appropriés, les caractéristiques américaines particulières sont décrites en détail pour l'instabilité de la longue portion du tendon du biceps (Farin et al. 1995 ; Ptasznik et Hennessy 1995 ; Prato et al. 1996 ; Martinoli et al. 2003), le péronier tendons (Fessell et al. 1998; Magnano et al. 1998; Neustadter et al. 2004), le tendon tibial postérieur (Prato et al. 2004) et le fléchisseur (Klauser et al. 1999; Hauger et al. 2000; Martinoli et al. 2000 ; Klauser et al. 2002 ; Martinoli et al. 2005) et les tendons extenseurs (Lopez-Ben et al. 2003) des doigts (Fig. 32d, e).
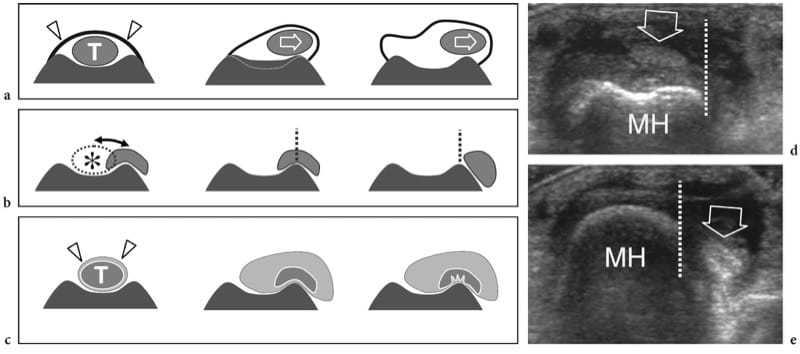
Figure 32. a–e. Instabilité tendineuse. a Les dessins schématiques illustrent les causes congénitales de l'instabilité tendineuse. A gauche, le tendon (T) est stabilisé dans son sillon osseux par un rétinaculum (têtes de flèches). Une instabilité tendineuse peut être observée en cas de sillon osseux plat (au centre) ou de laxité du rétinaculum (à droite). b Des dessins schématiques illustrent les différents degrés d'instabilité d'un tendon par rapport à sa gouttière osseuse (astérisque) : subluxation intermittente (à gauche), subluxation permanente (au centre) ou luxation (à droite). La limite de la rainure est indiquée par la ligne pointillée verticale. c Des schémas illustrent les principales anomalies des tendons (T) investis par une gaine synoviale (têtes de flèches) lors de la subluxation, dont la ténosynovite réactionnelle (au centre) et la déchirure partielle (à droite). d,e Subluxation intermittente du tendon extenseur des doigts. Images échographiques transversales 12–5 MHz de l'articulation du majeur chez un patient présentant une lésion de l'articulation métacarpo-phalangienne et une rupture de la bande sagittale, acquises d alors que la main était étendue et e en position poing fermé. Doigt tendu, le tendon extenseur (flèche) est en position normale par rapport à la tête métacarpienne dorsale (MH) ; poing fermé, il y a luxation antérieure du tendon du côté ulnaire de l'os (ligne pointillée).
22. CHANGEMENTS DÉGÉNÉRATIFS ET DÉCHIRURES TENDONIENNES
Dans un système musculotendineux intact, les ruptures tendineuses sont peu fréquentes et se développent typiquement à l'insertion du tendon dans l'os, avec ou sans avulsion d'un petit fragment osseux, ou à la jonction myotendineuse, à la suite d'un traumatisme important ou d'un taux de chargement excessif. Au contraire, étant donné la nature dure et fibreuse des tendons, les ruptures intrasubstance se produisent rarement en dehors du cadre de changements dégénératifs prédisposants qui affaiblissent la résistance de la structure tendineuse (Kainberger et al. 1997). Plusieurs théories ont tenté d'expliquer le processus dégénératif dans les tendons. La dégénérescence intrasubstance peut provenir de blessures de surutilisation, comme celles qui se produisent dans certains sports (c. qui ne guérissent pas complètement, en particulier dans les zones vulnérables où les tendons présentent un débit sanguin réduit (Herring et Nilsson 1987). Le sus-épineux, la tête longue et le biceps distal, les tendons extenseurs et fléchisseurs autour du coude, les tendons rotulien et d'Achille, les tendons tibial postérieur et long fléchisseur de l'hallux sont plus fréquemment touchés par des lésions de surutilisation. Cependant, la constriction ou la compression derrière un rétinaculum ainsi que des forces de frottement excessives contre les surfaces osseuses ou les tendons accessoires adjacents peuvent également contribuer à des lésions tendineuses à d'autres niveaux (Fessell et van Holsbeeck 1999). De plus, l'abus ou l'injection locale de corticostéroïdes et les troubles systémiques, tels que le lupus érythémateux disséminé, la goutte, la polyarthrite rhumatoïde, le diabète, l'hyperparathyroïdie et l'insuffisance rénale chronique, peuvent avoir un effet néfaste sur la résistance des tendons et les prédisposer à la rupture. Les tendons quadriceps et rotulien, les tendons extenseur et fléchisseur des doigts et le tendon tibial postérieur sont principalement concernés par les atteintes systémiques. Très probablement, une combinaison de traumatismes et de facteurs prédisposants, mécaniques ou biochimiques, est la cause initiale du processus dégénératif des tendons (Campbell et Grainger 2001). Ensuite, un continuum existe avec des changements dégénératifs et une déchirure intrasubstance mineure conduisant à une rupture partielle et complète (Jacobson et van Holsbeeck 1998).
23. TENDINOSE ET DÉCHIRURES PARTIELLES
Bien que la tendinopathie douloureuse soit souvent appelée « tendinite », ce terme est en fait un abus de langage. En fait, ces tendons sont caractérisés par un processus dégénératif non inflammatoire qu'il est préférable d'appeler « tendinose » (Khan et al. 1996 ; Campbell et Grainger 2001). Du point de vue histopathologique, les dommages au collagène qui surviennent dans la tendinose proviennent principalement de la dégénérescence hypoxique et myxoïde et conduisent au dépôt de glucosaminoglycanes interfibrillaires (Khan et al. 1996 ; Movin et al. 1997 ; Schweitzer et Karasick 2000). Le premier processus est probablement causé par une ischémie en raison de zones critiques d'hypovascularisation dans les tendons ; le second reflète le dépôt de grandes plaques mucoïdes et de vacuoles entre les fibres dégénérées amincies. Chez la plupart des patients, les deux processus coexistent et sont associés à une rupture spontanée du tendon (Schweitzer et Karasick 2000).
En ce qui concerne la localisation des zones dégénératives, le risque accru de certains sites anatomiques pour le développement de tendinose a conduit à la notion de zones critiques, dans lesquelles plusieurs facteurs, tels que le vieillissement, l'hypovascularisation et les effets biomécaniques en combinaison avec des traumatismes répétitifs, jouent un rôle causal spécifique (Kainberger et al. 1997; Schepsis et al. 2002). Dans le tendon d'Achille, par exemple, l'atteinte prédominante de son tiers moyen a été attribuée au fait qu'il s'agit d'une zone de faible vascularisation à la ligne de partage des eaux entre deux réseaux vasculaires distincts qui convergent vers le milieu à partir du myotendineux et du téno-osseux. jonction (Kainberger et al. 1997). D'autres facteurs biomécaniques peuvent être impliqués dans l'implication du tiers moyen du tendon d'Achille, comme la différence de tension entre les fibres gastrocnémiennes et soléaires, qui fusionnent pour devenir un seul tendon à environ 5 à 6 cm de l'insertion calcanéenne (Kainberger et al 1997). Ensuite, les fibres autour de la partie médiale du tendon sont spécifiquement impliquées chez les patients présentant une hyperpronation du pied, tels que les sujets présentant un varus marqué de l'avant-pied, en raison de forces de cisaillement excentriques sur les fibres du tendon médial (Fig. 33a) (Gibbon et al. 2000). En revanche, dans la tendinopathie du tiers distal d'Achille, les anomalies concernent le plus souvent la surface profonde du tendon, résultat probable du conflit biomécanique entre ces fibres et l'angle postéro-supérieur du calcanéus en pleine dorsiflexion (Fig. 33b) (Gibbon et al. 2000). Dans le «genou du sauteur», la partie centrale profonde de l'insertion proximale du tendon rotulien est le plus souvent impliquée: un peu similaire à la tendinopathie d'Achille d'insertion, un micro-traumatisme survenant entre la surface inférieure de l'insertion rotulienne et une pointe rotulienne proéminente a été supposé être un facteur causal de conflit chronique et de développement de changements dégénératifs secondaires (Khan et al. 1996). Au coude, dans le tendon extenseur commun, les fibres de l'extensor carpi radialis brevis sont profondes, juste au-dessus du ligament collatéral ulnaire latéral, alors que la contribution de l'extensor digitorum communis est superficielle. Sur la base de ces considérations anatomiques, certains auteurs ont émis l'hypothèse que les anomalies les plus courantes de l'épicondylite latérale impliquent l'origine de l'extensor carpi radialis brevis et, dans une moindre mesure, la face antérieure du tendon extensor digitorum (Connell et al. 2001).
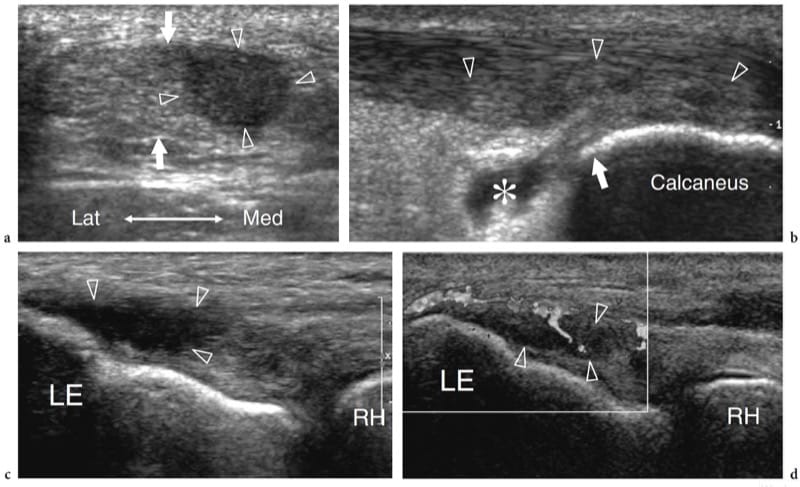
Illustration 33. a–d. Tendinose : spectre des apparitions américaines. une image US à axe court 12–5 MHz sur le tiers médian du tendon d'Achille (flèches) chez un homme de 35 ans présentant une hyperpronation marquée du pied montre une atteinte sélective des fibres du tendon médial (têtes de flèches). b L'échographie 12–5 MHz grand axe du tiers distal du tendon d'Achille révèle une atteinte sélective des fibres tendineuses profondes (têtes de flèches) et une bursite rétrocalcanéenne (astérisque) probablement à la suite d'un conflit chronique avec l'angle postéro-supérieur (flèche) du tendon d'Achille. calcanéum lors de la dorsiflexion. c,d Les images américaines en échelle de gris c et Doppler couleur 17–5 MHz de l'attache du tendon extenseur commun sur l'épicondyle latéral (LE) chez un joueur de tennis de 40 ans montrent des changements intratendineux hypoéchogènes focaux et la disparition de les échos fibrillaires (têtes de flèches), signes typiques des épicondylites latérales. L'imagerie Doppler couleur révèle un schéma hypervasculaire dans la zone hypoéchogène intratendineuse. RH, tête radiale.
D'un point de vue clinique, la tendinose se manifeste généralement par un gonflement du tendon, une sensibilité et une douleur absente ou modérée aggravée par les activités et la coexistence d'une ténosynovite (Fornage et Rifkin 1988 ; Schepsis et al. 2002 ; Premkumar et al. 2002). L'échographie montre des changements dégénératifs comme un épaississement tendineux focal (nodulaire) ou diffus, et des zones hypoéchogènes intratendineuses avec perte des échos fibrillaires, reflétant une structure désorganisée des faisceaux de collagène (Fig. 33a – c) (Fornage et al. 1984 ; Maffulli et al. 1990b ; Martinoli et al. 1993 ; Åström et al. 1996 ; Grassi et al. 2000). Au fur et à mesure que la technologie américaine progresse, de nouveaux développements dans les logiciels de traitement du signal, tels que la technologie de composition, conduisent à une amélioration continue du contraste de l'image et de la résolution des détails. Le résultat est une délimitation améliorée des découvertes pathologiques fines dans les tendons dégénérés. Cela contribue à une différenciation plus sûre entre les états normaux et pathologiques et à une utilisation plus fiable de cette technique. Des précautions doivent cependant être prises pour déterminer la véritable signification pathologique de ces modifications subtiles de la substance tendineuse, car des anomalies mineures peuvent également être trouvées dans les tendons asymptomatiques des personnes âgées (Martinoli et al. 1999).
Des tendons anormalement épaissis avec une échotexture altérée (zones hypoéchogènes focales) peuvent présenter un schéma hypervasculaire à l'imagerie Doppler couleur et puissance (Fig. 33d) (Weinberg et al. 1998 ; Öhberg et al. 2001 ; Terslev et al. 2001 ; Richards et al. 2001, 2005 ; Silvestri et al. 2003). La néovascularisation liée à la tendinose est généralement appréciée en relation avec la partie épaissie du tendon, à la fois à l'intérieur et à l'extérieur de celui-ci (Öhberg et al. 2001 ; Peers et al. 2003). Elle apparaît significativement augmentée par l'activité du tendon avant l'imagerie (Cook et al. 2004). En ce qui concerne l'importance de l'augmentation du flux sanguin dans les tendons, une corrélation positive semble exister entre le nombre global de vaisseaux détectables et la taille du tendon ; la tendinose douloureuse apparaît généralement plus hypervasculaire que la tendinose asymptomatique, alors qu'aucune corrélation n'a été trouvée entre la réponse microvasculaire et la durée des symptômes (Öhberg et al. 2001 ; Richards et al. 2005). Dans tous les cas, la signification du schéma hypervasculaire – qu'il soit causal d'anomalies tendineuses ou secondaire à des tentatives de cicatrisation – reste à définir (Richards et al. 2005). En termes de résultats pour le patient, un schéma hypervasculaire détecté à l'imagerie Doppler couleur et puissance n'est pas un signe défavorable (Zanetti et al. 2003) ; comme on le voit sur les échographies en échelle de gris, l'hétérogénéité des tendons semble plus probablement liée à un résultat clinique plus mauvais après un traitement conservateur (Nehrer et al. 1997 ; Archambault et al. 1998). Procédures interventionnelles guidées par échographie pour traiter les tendinoses douloureuses chroniques.
L'hétérogénéité tendineuse sur les images échographiques en niveaux de gris ne signifie pas nécessairement des changements liés à la tendinose, mais elle peut également refléter une déchirure partielle du tendon (Martinoli et al. 1999 ; Jacobson et al. 1999). Une démarcation abrupte entre dégénérescence, micro-déchirures et déchirures interstitielles est trompeuse, car ces formes reflètent, en elles-mêmes, un continuum du même processus pathologique et, dans de nombreux cas, coexistent et sont traitées de manière identique (Campbell et Grainger 2001). Avec les progrès de la technologie américaine, les déchirures interstitielles peuvent être identifiées dans les zones de dégénérescence tendineuse comme de fines fentes hypoéchogènes orientées le long de l'axe longitudinal du tendon et atteignant éventuellement la surface du tendon (Les figs. 34, 35) (Connell et al. 2001 ; Campbell et Grainger 2001 ; Premkumar et al. 2002). Le déchirement progressif entraîne des irrégularités de contour ou un amincissement focal (Chen et Liang 1997). Les déchirures partielles se produisent dans le sens longitudinal, parallèlement au trajet du tendon (fentes longitudinales, fissures) ou dans le sens transversal, perpendiculairement aux fibres tendineuses (Diaz et al. 1998 ; Bianchi et al. 2005, 2006). À un niveau plus macroscopique, une déchirure partielle du tendon peut impliquer des quantités macroscopiques de fibres et même produire des discontinuités dans des portions individuelles de tendons complexes (Bianchi et al. 1994a). L'évaluation échographique démontre à la fois les parties intactes et les parties rompues rétractées du tendon en association avec un hématome (Kalebo et al. 1990, 1992). Le motif fibrillaire longitudinal est perdu dans la partie fracturée du tendon impliqué, mais il reste inchangé dans la partie intacte (Fig. 35a, b) (Martinoli et al. 1993). L'absence de rétraction du tendon est la caractéristique la plus importante pour distinguer une rupture partielle d'une rupture complète.
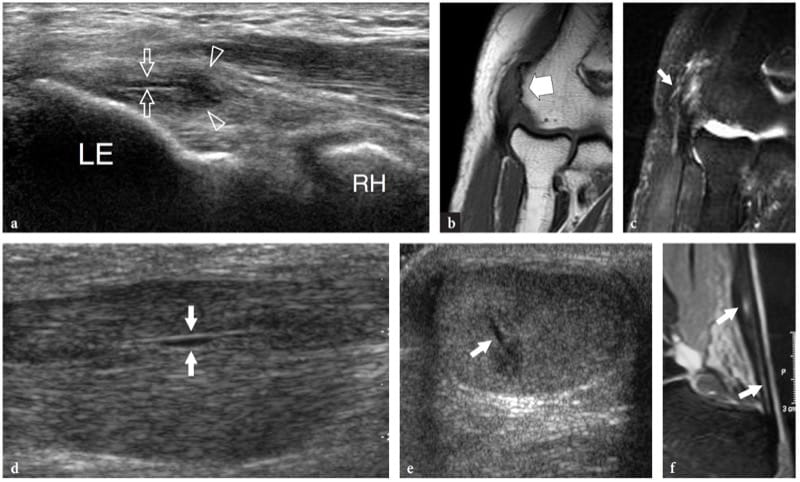
Figure 34. a–f. Fentes longitudinales intratendineuses. Deux cas différents. a Image échographique long axe 17–5 MHz de l'insertion du tendon extenseur commun chez un patient atteint d'épicondylite latérale sévère avec corrélation d'imagerie IRM coronale b pondérée en T1 et c pondérée en T2 avec suppression de la graisse montre une déchirure linéaire intratendineuse remplie de liquide ( flèches) s'étendant de l'insertion osseuse distalement. Notez que la déchirure longitudinale s'est développée dans une zone hypoéchogène focale (têtes de flèches) de dégénérescence tendineuse LE, épicondyle latéral ; RH, tête radiale. d Les images échographiques grand axe et e petit axe 12–5 MHz sur le tiers moyen du tendon d'Achille chez un patient présentant une tendinose de haut grade révèlent une fissuration longitudinale intratendineuse (flèches). f Image IRM sagittale corrélative pondérée en T2.
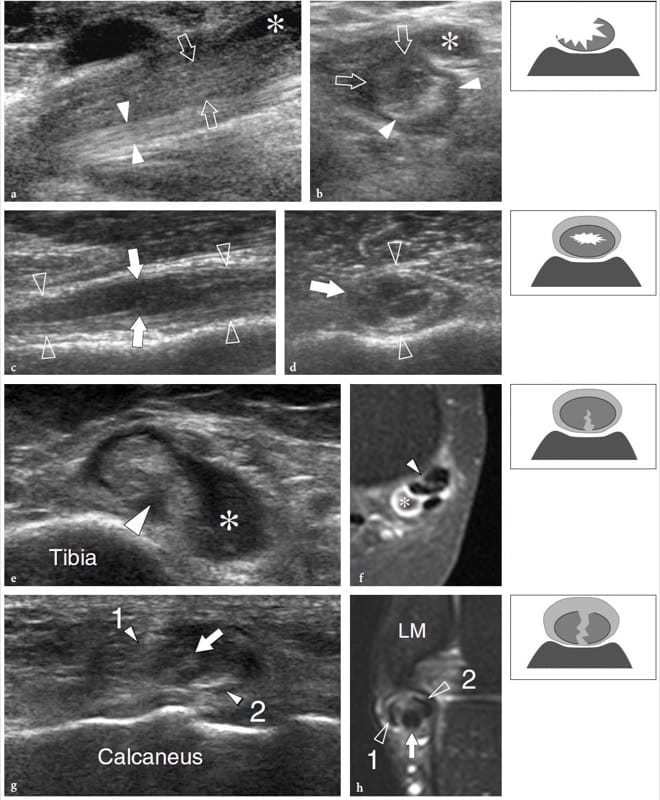
Figure 35. a–h. Déchirures tendineuses partielles : spectre des apparitions américaines. Quatre cas différents. a,b Déchirure partielle du tendon distal du biceps. a Les images américaines grand axe et b petit axe 17–5 MHz montrent un tendon gonflé caractérisé par une moitié hypoéchogène superficielle (flèches) reflétant les fibres déchirées et une moitié postérieure intacte (têtes de flèches) avec une échotexture fibrillaire normale. Astérisque, bursite bicipitoradiale. c,d Rupture partielle de la longue portion du tendon du biceps. c Les images américaines à 12–5 MHz à axe long et à axe court révèlent un tendon gonflé (têtes de flèches) contenant une cavité remplie de liquide bien définie (flèches) qui s'étend le long de l'axe long du tendon, reflétant une fissure centrale. L'examinateur doit être conscient que de telles déchirures intra-substance ne sont pas visibles par inspection directe de la surface du tendon lors d'une arthroscopie ou d'une chirurgie ouverte. e,f Rupture partielle du tendon tibial postérieur. e Image échographique transversale 12–5 MHz obtenue dans la zone supramalléolaire avec une corrélation d'imagerie IRM pondérée en T1 avec suppression de la graisse et au gadolinium montrant une déchirure longitudinale périphérique (tête de flèche) du tendon tibial postérieur impliquant sa surface profonde, associée au liquide ténosynovial ( astérisque). g,h Rupture partielle du tendon du court péronier. g L'image US à axe court 12–5 MHz obtenue dans la zone sous-malléolaire avec une corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse h montre un court péronier divisé en deux moitiés (1, 2). Le tendon intact du long péronier (flèche) s'insinue dans la déchirure du court fibulaire. La présence d'un épanchement synovial facilite la détection de la déchirure. LM, malléole latérale. Les croquis en haut à droite de la figure indiquent les différents types de ruptures tendineuses partielles.
Dans des contextes cliniques spécifiques, les tendons peuvent être impliqués par des troubles métaboliques. Dans la goutte, le dépôt de tophi d'urate dans les tendons d'Achille peut entraîner des nodules intratendineux ou un épaississement diffus du tendon, tandis que dans l'hypercholestérolémie familiale hétérozygote, l'échographie peut dépeindre des xanthomes intratendineux bilatéraux dans les tendons d'Achille grossièrement élargis comme des zones hypoéchogènes focales ou diffuses avant qu'elles ne deviennent apparentes. à l'examen physique (Kainberger et al. 1993; Bude et al. 1993, 1994, 1998; Bureau et al. 1998). Cette condition imite étroitement la tendinose hypoxique de haut grade. Les calcifications peuvent rarement être rencontrées dans les tendons, bien que leur relation avec la dégénérescence tendineuse ne soit pas claire. Les dépôts calciques apparaissent comme des échos linéaires localisés préférentiellement à l'insertion du tendon dans l'os (enthèse), reflétant un processus de dépôt de cristaux d'hydroxyapatite de calcium ou de pyrophosphate de calcium dihydraté. Chez les sujets prédisposés, une ossification extensive en plaque peut survenir après un traumatisme répétitif sévère dans le tiers moyen du tendon d'Achille (Fig. 36) (Yu et al. 1994; Hatori et al. 2002). Dans ces cas, un processus intratendineux d'ossification enchondrale et intramembraneuse est observé (Hatori et al. 2002).
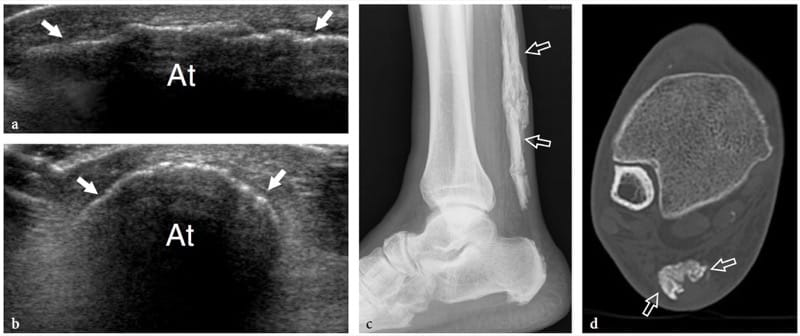
Figure 36. a–d. Ossification intratendineuse. a Les images américaines grand axe et b petit axe 12–5 MHz du tendon d'Achille (At) avec corrélation radiographique c et d CT révèlent une importante ossification intratendineuse en forme de plaque (flèches). Au scanner, l'ossification intratendineuse met en évidence la formation d'os lamellaire mature.
24. DÉCHIRURES COMPLÈTES ET RÉSULTATS POSTOPÉRATOIRES
Le diagnostic clinique des déchirures complètes du tendon est généralement moins difficile que celui des déchirures partielles du tendon. Cependant, d'autres tendons peuvent compenser, dans une certaine mesure, un tendon blessé, et l'œdème des tissus mous peut effacer le défaut tendineux lors d'une déchirure aiguë, rendant ainsi l'examen physique non diagnostique (Hartgerink et al. 2001). Lorsque l'examen clinique est équivoque, l'échographie peut permettre d'éviter un diagnostic tardif (Åström et al. 1996 ; Hartgerink et al. 2001). Ceci est essentiel car les tendons se rétractent avec le temps, ce qui complique la récupération et le rattachement. De manière générale, l'échographie permet d'évaluer précisément la gravité et l'étendue de la lésion tendineuse. En particulier, il est de la plus haute importance de distinguer la tendinose et les déchirures partielles d'une rupture complète du tendon, étant donné que la plupart des déchirures complètes nécessitent une intervention chirurgicale, tandis que les déchirures partielles ou les tendinoses sont gérées de manière conservatrice, la réparation chirurgicale n'étant entreprise qu'après un échec du traitement conservateur (Saltzman et Tearse 1998). L'échographie démontre une rupture complète aiguë d'un tendon comme un défaut focal créé par un degré variable de rétraction des bords déchirés du tendon (Fig. 37) (Fornage et Rifkin 1988 ; Teefey et al. 1999 ; Bianchi et al. 1994b ; Farin 1996). L'ombrage acoustique postérieur au site de la déchirure du tendon ou derrière le moignon du tendon rétracté peut être une constatation associée à la suite de la réfraction du faisceau sonore aux extrémités effilochées du tendon (Fig. 38) (Kainberger et al. 1990 ; Hartgerink et al. 2001). Le défaut créé par la déchirure est généralement rempli de liquide anéchoïque ou hypoéchogène provenant d'un hématome local. Lorsque les gaines tendineuses sont également rompues, l'hématome est généralement plus gros et présente des bords irréguliers et indistincts. Dans les déchirures subaiguës et chroniques, l'absence de liquide hémorragique frais et l'hématome organisé qui remplit le défaut de matériel échogène peuvent être trompeurs, imitant l'intégrité du tendon (Fig. 39). Dans les tendons de la gaine synoviale, une technique de balayage précise peut être nécessaire pour visualiser les extrémités du tendon, qui peuvent être rétractées à une distance variable du site de la déchirure, et pour mesurer la quantité de rétraction du tendon sur les balayages longitudinaux. S'il n'y a pas de rétraction et que les extrémités déchirées du tendon sont enroulées, ou si le liquide ne remplit pas l'espace créé par la déchirure, des mouvements passifs assistés doux peuvent être utiles pour améliorer la séparation des extrémités du tendon pendant l'étirement (Kainberger et al. 1997 ).
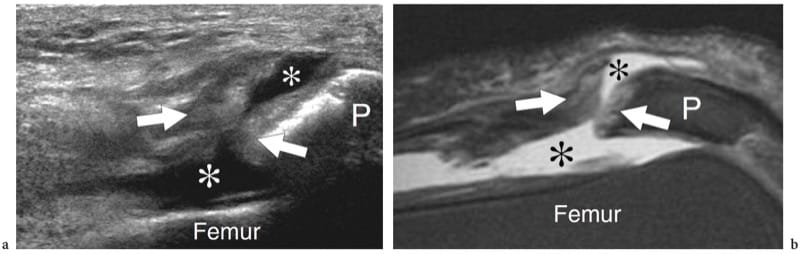
Illustration 37. a, b. Déchirure complète du tendon. une image échographique 12–5 MHz à axe long sur le tendon du quadriceps avec une corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse b montre un écart hypoéchogène transversal dans la substance tendineuse remplie de liquide (astérisques) entre les extrémités proximale et distale (flèches), compatible avec une rupture complète. Notez que la déchirure du tendon forme une communication entre l'articulation et la bourse prépatellaire. P, rotule.
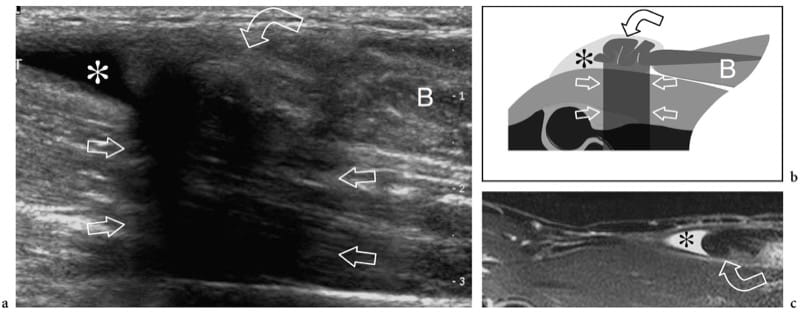
Illustration 38. a–c. Déchirure complète du tendon. a Image échographique 12–5 MHz grand axe sur le coude antérieur avec b dessin schématique et c corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse sagittale montrant un défaut rempli de liquide (astérisque) et l'extrémité proximale du tendon rétracté (flèche courbée) de une rupture du tendon distal du biceps. Le tendon est rétréci et caractérisé par une atténuation acoustique postérieure (flèches droites), résultats compatibles avec une rupture complète. Notez la jonction myotendineuse rétractée du muscle biceps (B).
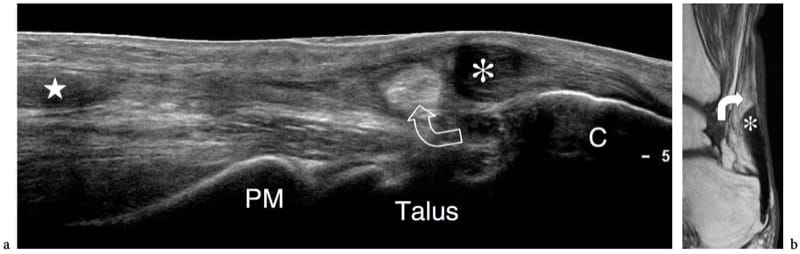
Illustration 39. a, b. Déchirure chronique non opérée du tendon d'Achille. a Image américaine à champ de vision étendu de 17 à 5 MHz sur l'axe postérieur de la cheville chez un patient qui a subi une rupture aiguë du tendon d'Achille 1 an auparavant à la suite d'une blessure à vélo avec b La corrélation d'imagerie IRM pondérée en T1 sagittale démontre un espace d'environ 6 cm entre les extrémités émoussées proximale (étoile) et distale (astérisque) du tendon. Il y a des débris entre les extrémités déchirées du tendon et la hernie postérieure de la graisse pré-achilléenne (flèche courbe) dans le défaut créé par la déchirure. Notez la contraction fusiforme et franche du segment distal du tendon. PM, malléole postérieure ; C, calcanéum.
Dans un contexte dégénératif, une contraction musculaire intense ou des forces de stress anormales exercées sur des tendons sains peuvent entraîner des avulsions au niveau de leurs sites d'insertion dans l'os. Ces déchirures entraînent souvent le décollement et la rétraction d'un fragment osseux qui reste incrusté dans le tendon. Les lésions d'avulsion impliquent généralement le tendon sus-épineux, provoquant la rétraction d'une tache osseuse du trochiter, le court péronier, conduisant à l'avulsion de la base du cinquième métatarsien, des tendons fléchisseurs et extenseurs des doigts, ce qui peut détacher un petit fragment cortical de la base de la phalange distale et le tendon du triceps, entraînant une fracture de l'olécrane (Fig. 40). La taille et le degré de déplacement du fragment osseux avulsé sont variables. Comme les fractures par avulsion sont le plus souvent rencontrées chez les enfants et les adolescents, les blessures par avulsion du tendon.
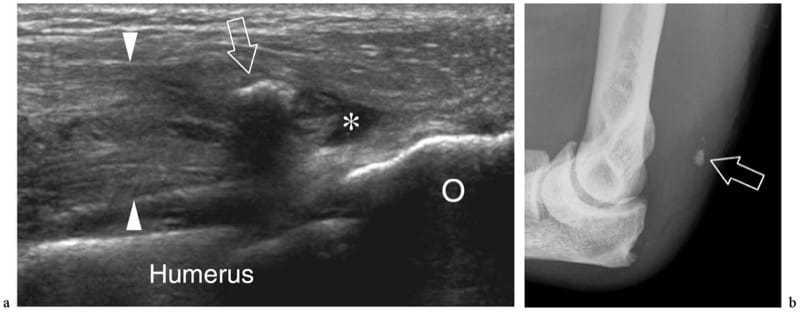
Illustration 40. a, b. Lésion aiguë de type avulsion du chef médial du tendon du triceps. a Image échographique grand axe 12–5 MHz sur la partie postérieure du coude avec corrélation de film simple b montrant une rupture de la tête médiale rétractée du tendon du triceps (têtes de flèches) contenant un fragment d'os (flèche) à l'intérieur, à la suite d'un traumatisme par avulsion de la processus olécranien (O). Le tendon proximal rétracté et épaissi est entouré d'un léger liquide hypoéchogène (astérisque).
Après la réparation chirurgicale d'une déchirure du tendon, l'imagerie échographique peut aider à surveiller le processus de guérison ainsi qu'à exclure les déchirures récurrentes (Campbell et Grainger 2001 ; Müller et al. 2002). Les résultats postopératoires courants incluent une taille de tendon altérée avec des zones d'épaississement ou d'amincissement, quel que soit le moment du suivi, et une échotexture anormale permanente au site de la déchirure. Bien que les changements écho-texturaux puissent partiellement régresser avec le temps, ils persistent pendant de nombreuses années après la chirurgie (Rupp et al. 1995). Une ossification hétérotopique peut parfois se produire. Dans les tendons de type 1 (c'est-à-dire le tendon d'Achille), le paraténon s'épaissit et ne peut pas être différencié du tissu tendineux, entraînant ainsi des irrégularités de contour ; le mécanisme de glissement du tendon est souvent altéré ou limité (Rupp et al. 1995). Le balayage dynamique est essentiel dans l'évaluation postopératoire des tendons de type 2 comme moyen d'évaluer la fonction de glissement du tendon dans la gaine et d'exclure d'éventuelles adhérences. Les sutures intratendineuses apparaissent sous forme de doubles échos linéaires brillants (lignes en forme de rail) en raison de la réflexion de haute amplitude du faisceau US avec artefact de réverbération postérieure (Maffulli et al. 1990a; Rupp et al. 1995). Après réparation des blessures par avulsion, les ancres de suture peuvent être décrites comme de petits défauts de l'os cortical remplis de matériau brillant avec un artefact de réverbération postérieure. Au cours du processus de guérison, ces signes semblent cependant avoir une valeur limitée quant à l'évaluation des résultats fonctionnels tels que la force musculaire, l'endurance et l'amplitude des mouvements (Rupp et al. 1995 ; Müller et al. 2002). La rupture récurrente peut se manifester par une rupture partielle des fibres tendineuses jusqu'à rupture complète de l'anastomose (Fig. 41). Dans ces cas, un épaississement du tendon avec un hématome intra-tendineux ou un amincissement du tendon avec un liquide abondant dans la gaine du tendon peut indiquer une petite déchirure récurrente. Dans les déchirures récurrentes complètes, la discontinuité du tendon peut être associée à des sutures flottant librement dans l'hématome.
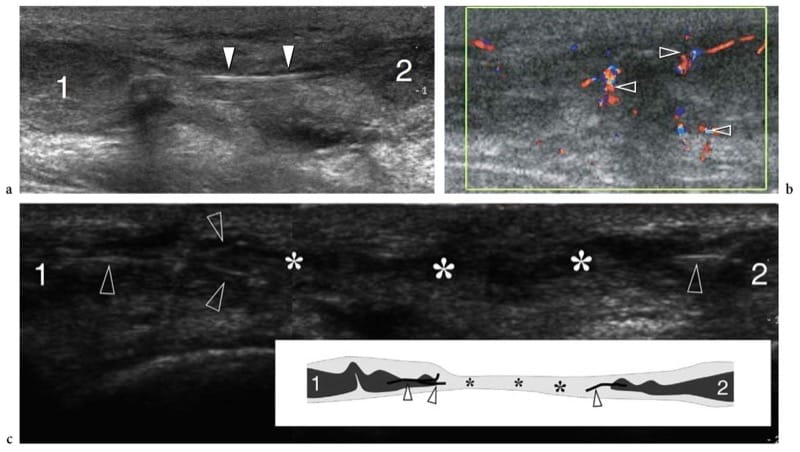
Illustration 41. a–c. Rupture tendineuse post-chirurgicale. Deux cas différents. a,b Rupture du tendon d'Achille. a Échelle de gris grand axe et images Doppler couleur b 12–5 MHz montrent une rupture complète d'un tendon d'Achille préalablement suturé. Les extrémités gonflées du tendon (1, 2) sont séparées par un large espace rempli de débris et de fluide. Notez les points de suture chirurgicaux (pointes de flèche en a) se trouvant libres dans l'espace. Des signaux sanguins locaux (têtes de flèches en b) entourent les extrémités tendineuses reflétant une hyperémie locale. c Rétarer le tendon du long extenseur du pouce. L'image US 12–5 MHz grand axe sur l'aspect dorsoradial de la main avec corrélation de dessin schématique (insert) révèle un espace rempli de liquide (astérisques) entre les deux extrémités rétractées (1, 2) du tendon extensor pollicis longus. Notez les points de suture chirurgicaux déconnectés (pointes de flèche) attachés aux extrémités du tendon qui flottent librement dans la gaine vide du tendon. Une image en écran partagé a été utilisée, les deux écrans étant alignés pour un champ de vision étendu.
25. CONDITIONS INFLAMMATOIRES
Bien que moins fréquentes que les processus dégénératifs, certaines pathologies des tendons sont en réalité de nature inflammatoire, et il est important de distinguer ces formes des tendinoses simples car la prise en charge clinique peut différer. Bien que les affections dégénératives et inflammatoires puissent être traitées avec les mêmes mesures conservatrices (repos, glace et anti-inflammatoires non stéroïdiens), les lésions inflammatoires qui ne régressent pas nécessitent un traitement plus agressif avec des corticostéroïdes ou même des interventions chirurgicales. Le spectre des découvertes échographiques dépend du type de tendon impliqué, ainsi que des changements associés survenant dans les enveloppes tendineuses et les bourses synoviales associées. Le processus inflammatoire se traduit principalement par des « péritendinites » pour les tendons investis par paratenon (type 1) et des « ténosynovites » pour les tendons investis par gaine synoviale (type 2). Pour les deux processus, la signification fonctionnelle est quelque peu équivalente. Les conditions particulières, telles que la tendinite calcifiante, sont traitées ailleurs.
26. PARATENDINITE ET BURSITE D'ATTRITION
La paratendinite (péritendinite) survient le plus souvent au niveau du tendon d'Achille en association avec une tendinose hypoxique de haut grade lors des phases d'exacerbation de la maladie (Fig. 42a) (Schweitzer et Karasick 2000). Cliniquement, la paratendinite s'accompagne d'une gêne diffuse et d'un gonflement et d'une sensibilité péritendineux (Schepsis et al. 2002). Un fluide à l'intérieur et un épaississement inégal du paraténon, des irrégularités des bords du tendon et des adhérences sont généralement observés (Gibbon et al. 2000 ; Martinoli et al. 1999). Dans la paratendinite isolée moins fréquente (sans tendinose), le tendon d'Achille lui-même est normal tandis que les tissus péritendineux présentent des modifications oedémateuses et des nodules douloureux liés à une hypertrophie localisée du tissu conjonctif (Fig. 42b, c). De manière aiguë, cette condition est rencontrée chez les coureurs de longue distance (marathon) en raison d'une biomécanique anormale; il peut également suivre des erreurs d'entraînement, y compris une augmentation soudaine de l'exercice et un changement de terrain, en particulier la course en côte.
Les bourses paratendineuses (p. ex., la bourse rétrocalcanéenne au talon, la bourse infrapatellaire profonde au genou et la bourse bicipitoradiale au coude) agissent principalement comme des amortisseurs en réagissant à l'augmentation des forces de compression et de friction exercées par les tendons sus-jacents (Gibbon et Wakefield 1999). Dans la plupart des cas, le liquide intrabursal ou l'hypertrophie synoviale dénotent un processus inflammatoire d'origine mécanique et se produit à proximité de la partie préinsertionnelle du tendon (Fig. 42d, e). S'il est léger, le liquide n'a pas d'importance clinique et reflète une irritation due à une surcharge locale et au stress au travail. La bursite peut provoquer une gêne locale uniquement lorsque la synovite mécanique est excessive ou lorsque le processus est associé à un épanchement articulaire chez les patients atteints d'arthropathies inflammatoires primaires telles que la polyarthrite rhumatoïde et les spondylarthropathies séronégatives, ou de troubles métaboliques tels que la goutte (Gibbon et Wakefield 1999 ; Ho et al . 2003).
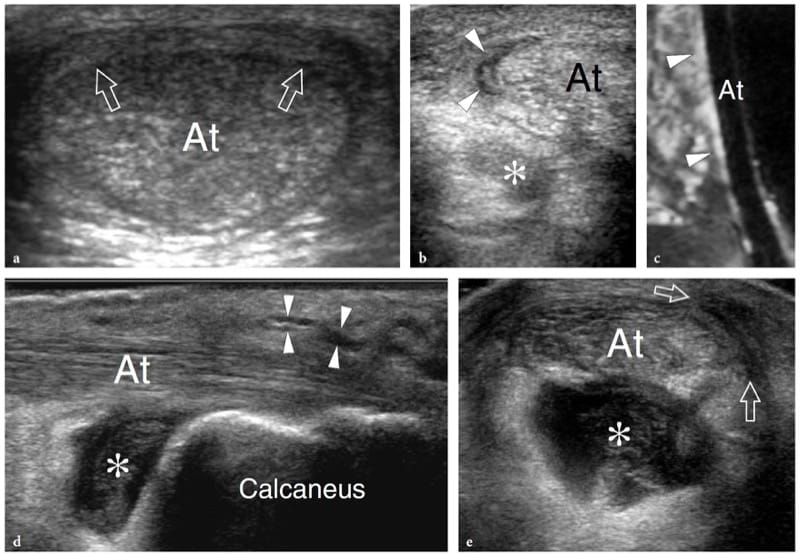
Figure 42. e. Péritendinite et bursite. Trois cas différents. a Péritendinite du tendon d'Achille chez un patient présentant une tendinose de haut grade et des douleurs postérieures sévères à la cheville. L'image échographique 12–5 MHz petit axe sur le tiers moyen du tendon d'Achille montre une couche de tissu hypoéchogène anormale (flèches) sur la face postérieure du tendon (At), signe caractéristique d'une péritendinite. b,c Péritendinite d'Achille isolée chez un coureur de fond de 30 ans souffrant d'une douleur au talon d'apparition récente. b Image échographique à axe court de 17 à 5 MHz sur le tendon d'Achille médio-distal avec c La corrélation d'imagerie IRM pondérée en T2 avec suppression de la graisse sagittale révèle une collection de liquide en forme de croissant (têtes de flèches) autour de la face médiale d'un tendon d'Achille par ailleurs normal ( À). Notez la petite quantité de liquide hypoéchogène (astérisque) distendant la bourse rétrocalcanéenne. d,e Bursite du talon chez une joueuse de tennis de 53 ans souffrant de douleurs chroniques au talon. d Les images échographiques 17–5 MHz grand axe et petit axe sur le tendon d'Achille distal (At) montrent une distension hypoéchogène discrète de la bourse rétrocalcanéenne (astérisque) par une synoviale liquide et hypertrophiée. Un peu de liquide est également visible dans la bourse rétro-Achille (têtes de flèches) et le tissu sous-cutané (flèches) autour de l'insertion du tendon d'Achille.
27. TÉNOSYNOVITE
Dans les tendons à gaine synoviale, l'inflammation est le plus souvent secondaire à des microtraumatismes répétés, dus à une sollicitation excessive ou à des frottements osseux, à des corps étrangers, ou encore à une infection et à une arthrose. La ténosynovite séreuse aiguë est diagnostiquée en identifiant une quantité accrue de liquide dans la gaine du tendon (Gooding 1988; Stephenson 1990). Le liquide encercle généralement le tendon en formant un « halo » autour de lui : ce signe permet de distinguer la nature ténosynoviale de l'épanchement des autres lésions kystiques paratendineuses, telles que les bourses ou les kystes ganglionnaires, dans lesquelles le liquide est situé de manière excentrique par rapport au tendon. Dans les maladies subaiguës ou chroniques, l'épanchement est souvent associé à un épaississement de la gaine (Martinoli et al. 1999). Une technique de balayage minutieuse est nécessaire pour mettre en évidence des épanchements synoviaux petits mais significatifs qui, par exemple, peuvent être facilement méconnus si une pression excessive par le transducteur provoque un affaissement de la gaine.
Selon son contenu cellulaire, le liquide de la gaine synoviale peut être anéchoïque ou contenir de subtils échos en suspension. Le piégeage et le conflit chronique des tendons sous un ligament ou une poulie peuvent provoquer une ténosynovite sténosante, c'est-à-dire la maladie de Quervain, doigt à ressaut (Fig. 43a, b). Les tendons impliqués sont gonflés de manière diffuse avec un désordre textural et un épaississement focal ou diffus de la gaine synoviale. Un épanchement synovial simple est observé dans les cas aigus, alors que les cas chroniques présentent un épaississement du rétinacule, ce qui représente généralement une indication de prise en charge chirurgicale (Fig. 43c–e). L'examen échographique dynamique avec mouvements assistés passifs peut démontrer le piégeage de la gaine synoviale à l'entrée du tunnel rétréci (Fig. 43f, g).
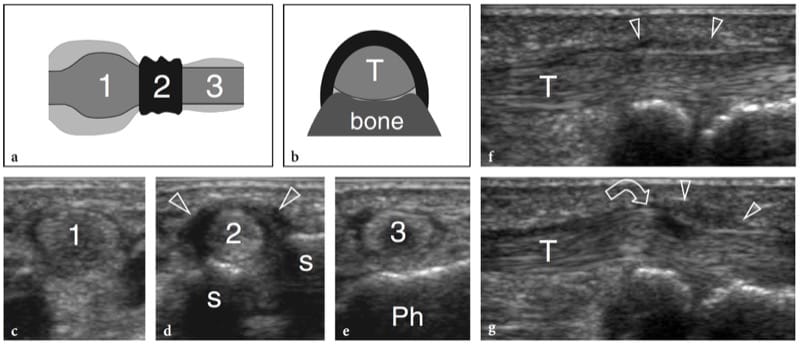
Figure 43. a–g. Ténosynovite sténosante. a,b Des dessins schématiques illustrent le mécanisme pathogénique conduisant au conflit d'un tendon de type 2 sous un rétinaculum épaissi dans un tunnel ostéofibreux. a Les vues grand axe et b petit axe sur le tendon affecté montrent une augmentation de l'épaisseur et du rétrécissement du rétinaculum (noir) qui contraint le tendon sous-jacent (gris intermédiaire), une augmentation de l'épaisseur du tendon (1) à proximité du rétinaculum avec une distension du liquide de la gaine ( gris clair), rétrécissement brutal de la taille du tendon (2) sous le rétinaculum, et anomalies légères du tendon et de la gaine (3) distales au niveau de
le rétinaculum. c–g Déclencher le pouce. c–e Images échographiques à axe court 15–7 MHz obtenues de c proximal à e distal sur la première articulation métacarpo-phalangienne chez une femme de 54 ans présentant une extension douloureuse chronique du pouce correspondant aux niveaux indiqués en a. Proximal à la poulie A1, le tendon du long fléchisseur du pouce montre une augmentation progressive de sa surface de section (1) ; au niveau des sésamoïdes (s), il diminue brutalement de taille (2) sous la poulie épaissie (têtes de flèches) ; après la sortie de la poulie, le tendon reprend sa taille normale (3) sur la phalange proximale (Ph). f,g Images échographiques grand axe 15–7 MHz du tendon fléchisseur du pouce long (T) obtenues sur la poulie A1 épaissie (têtes de flèches) pendant la flexion f et l'extension g de la phalange distale. Le balayage dynamique montre le glissement difficile (flèche incurvée) du tendon lorsqu'il passe profondément dans la poulie épaissie lors de l'extension du pouce.
Dans la ténosynovite infectieuse, l'épanchement a tendance à être plus échogène et le tissu sous-cutané sus-jacent peut apparaître épaissi et hyperéchogène en raison de la cellulite (Brooke Jeffrey et al. 1987 ; Schechter et al. 1989). Cependant, il faut souligner que ces caractéristiques sont trop subtiles pour permettre un diagnostic définitif basé uniquement sur les découvertes américaines. L'aspiration à l'aiguille de liquide, éventuellement obtenue sous contrôle américain, est nécessaire pour confirmer la nature infectieuse de la ténosynovite ainsi que pour identifier les bactéries responsables et choisir l'antibiothérapie appropriée. À titre d'exception à cette règle, le diagnostic peut être simple sur les résultats des États-Unis lorsqu'un corps étranger est reconnu dans la gaine synoviale (Fig. 44) (Howden 1994). Dans le cadre d'une infection, l'imagerie Doppler couleur et puissance peut montrer un flux accru mais est incapable de différencier de manière fiable un état infecté d'un état non infecté (Newman et Adler 1998). De plus, dans certains cas, il peut ne pas y avoir d'augmentation du flux sanguin dans la gaine (Craig et al. 2003). Dans la ténosynovite tuberculeuse, les gaines tendineuses apparaissent nettement épaissies à la suite de modifications granulomateuses (Riehl et al. 1997). L'imagerie Doppler couleur et puissance peut détecter l'état hyperémique sous forme de signaux de flux accrus dans les gaines enflammées (Breidhal et al. 1998).
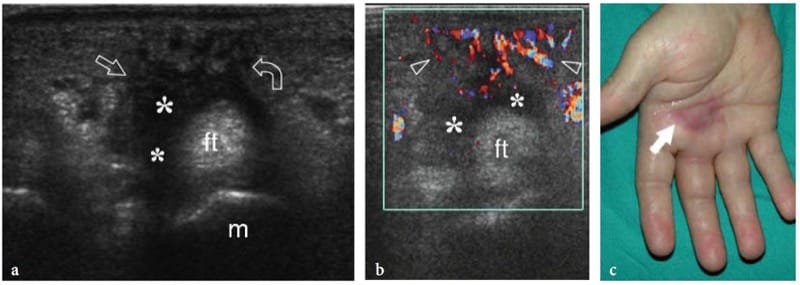
Illustration 44. a–c. Ténosynovite infectieuse. a Échographie en échelle de gris 12-5 MHz petit axe et b couleur Doppler sur la paume droite chez un patient de 35 ans qui s'est plaint d'une douleur croissante et de symptômes inflammatoires locaux une semaine après un traumatisme pénétrant mineur démontrant une distension de la gaine des tendons fléchisseurs ( ft) du doigt long par un épanchement échogène et des modifications hypéchogènes des tissus environnants liés à la cellulite (flèches). Notez les limites externes indéfinies de la gaine tendineuse et l'hyperémie superficielle intense (têtes de flèches). m, troisième métacarpe. c La photographie de la main du patient révèle une peau rougeâtre (flèche) due à une intense inflammation locale.
Dans les troubles rhumatologiques, tels que la polyarthrite rhumatoïde et le rhumatisme psoriasique, des projections villeuses hypoéchogènes de la synovie (pannus) peuvent se développer à l'intérieur de l'épanchement et peuvent même remplir l'espace synovial (Fig. 45a-c) (Milosavljevic et al. 2005). Plusieurs tendons peuvent être impliqués simultanément, en particulier l'extenseur cubital du carpe ainsi que d'autres tendons fléchisseurs et extenseurs des doigts au poignet et le tendon tibial postérieur. Dans les synovites persistantes, les dommages biochimiques et compressifs liés à l'envahissement du pannus et les contraintes mécaniques provoquées par le frottement du tendon contre l'os, comme dans le cas d'un cubitus subluxé dorsalement ou d'un tubercule de Lister, augmentent l'incidence des ruptures tendineuses (Swen et al. 2000). La propension à la rupture tendineuse est considérée comme indépendante de l'étendue de la ténosynovite et semble corrélée à une polyarthrite rhumatoïde agressive avec des titres élevés de facteur rhumatoïde et des érosions osseuses à un stade précoce de la maladie (Swen et al. 2000). Chez ces patients présentant une perte de fonction des doigts, l'échographie peut être utilisée pour différencier la déficience fonctionnelle due à une maladie articulaire des déchirures des tendons ainsi que pour détecter des déchirures partielles des tendons qui ne peuvent pas être identifiées à l'examen physique (Swen et al. 2000). La compression de la sonde peut être utile pour différencier l'épanchement complexe de l'épaississement synovial, car le liquide peut être expulsé, contrairement à la synoviale non compressible. De même, l'imagerie Doppler a une valeur pour distinguer le pannus hypoéchogène de l'épanchement en fonction de la présence ou de l'absence de signaux de flux, ainsi que pour différencier le pannus actif hautement vascularisé du pannus fibreux hypovasculaire (Fig. 45d) (Newman et al. 1996). Surtout chez les patients réfractaires au traitement médicamenteux, un diagnostic précoce de l'atteinte du tendon avec US est essentiel à la fois pour planifier et améliorer les résultats après ténosynovectomie prophylactique (Brumfield et al. 1990). Les possibilités futures incluent le suivi de la progression de la maladie et la quantification de la réponse au traitement (Newman et al. 1996). Parce que les techniques d'imagerie Doppler sont limitées dans leur capacité à détecter le sang qui coule lentement et les petits vaisseaux, le contraste US à base de microbulles semble prometteur pour augmenter la sensibilité US pour détecter les états hyperémiques dans les tendons. Dans le tibial postérieur, l'échographie et l'IRM ont une précision similaire pour révéler les signes de paratendinopathie, y compris l'épanchement péritendineux de la gaine et l'hyperémie (Premkumar et al. 2002).
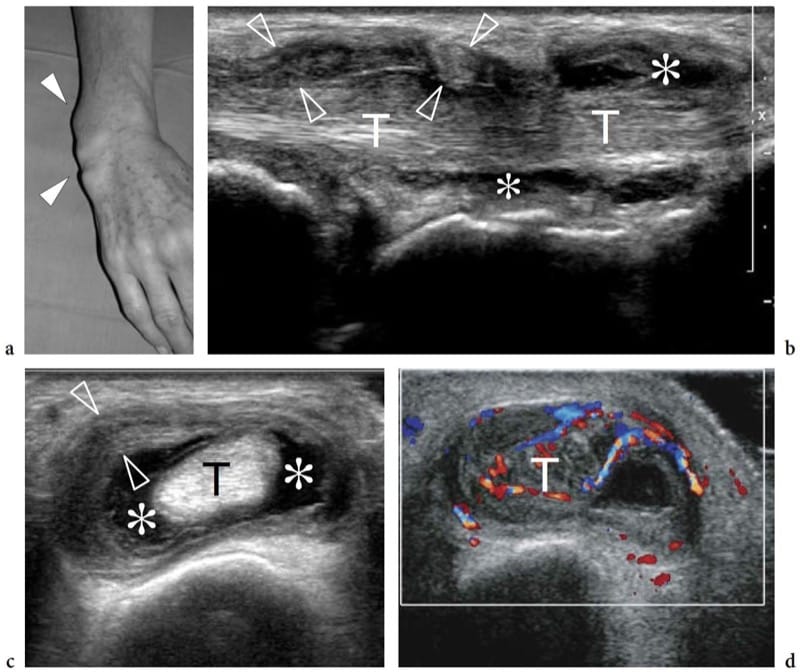
Illustration 45. a–d. Ténosynovite hypertrophiée chez une femme de 63 ans atteinte de polyarthrite rhumatoïde ancienne. a La photographie montre un gonflement considérable des tissus mous (têtes de flèches) sur la face dorso-soulnarienne du poignet du patient. b Les images américaines 17–5 MHz à axe long et c à axe court sur la face ventrale du poignet ulnaire révèlent un épaississement irrégulier marqué de la gaine synoviale (têtes de flèches) du tendon extenseur carpi ulnaris (T) avec du liquide intragaine (astérisques). d L'image Doppler couleur corrélative montre des parois synoviales hyperémiques et un signal de flux intratendineux, suggérant une maladie active. Dans ce cas particulier, il y avait une atteinte concomitante de l'articulation radioulnaire distale et des érosions osseuses sur la tête ulnaire.
28. ENTHÉSOPATHIE
Une enthèse est le point d'union entre un os et un tendon, un ligament, une aponévrose ou une capsule. L'inflammation se produit généralement au niveau de l'enthèse dans la spondylarthropathie séronégative et, dans une moindre mesure, dans la polyarthrite rhumatoïde et la goutte, entraînant un épaississement des tissus mous, une rupture de l'os cortical et une nouvelle prolifération osseuse (Gibbon et Wakefield 1999 ; Balint et al. 2002). La bursite et la synovite surviennent souvent dans les tissus environnants. Dans la spondylarthropathie, les sites d'atteinte les plus fréquents sont le genou (pôles supérieur et inférieur de la rotule, tubérosité tibiale), le talon (pôles postéro-supérieur et postéro-inférieur du calcanéum) et la tubérosité ischiatique entraînant une douleur et une raideur locales (Balint et al. 2002). Les films de douleur sont normaux au début de la maladie, mais ils peuvent révéler des caractéristiques radiographiques spécifiques, telles que l'érosion osseuse, l'hyperostose, la fragmentation et le dépôt de cristaux comme manifestation tardive de l'enthésite (Barozzi et al. 1998 ; Gnenc et al. 2005). Mieux encore que la radiographie, l'échographie s'est avérée être un moyen sensible de détecter les érosions osseuses comme des ruptures corticales avec un défaut de contour en abaissement, et les enthésophytes comme des proéminences osseuses en élévation à la fin du contour osseux normal (Barozzi et al. 1998 ; Balint et al. 2002 ; Kamel et al. 2003 ; Gnenc et al. 2005). Cependant, les avantages de l'échographie reposent sur sa capacité à décrire les modifications associées des tissus mous, y compris l'œdème périosseux, l'épaississement focal du tendon, l'échotexture anormale du tendon avec calcifications et la distension du liquide de la bourse au site de sensibilité (Lehtinen et al. 1994 ; Barozzi et al. 1998 ; Kamel et al. 2003).
29. TUMEURS ET ÉTATS DE TYPE TUMEUR
Les tumeurs primitives (fibrome de la gaine tendineuse, sarcome à cellules claires) issues du tendon et de sa gaine sont exceptionnelles (Gandolfo et al. 2000 ; Fox et al. 2003). Au contraire, les lésions encombrantes non néoplasiques, telles que les kystes ganglionnaires et la tumeur localisée à cellules géantes de la gaine tendineuse, sont beaucoup plus fréquentes. Bien que la plupart de ces lésions se présentent comme des gonflements indolores des tissus mous à croissance lente dans les extrémités, leur effet de masse peut entraîner une compression des structures adjacentes et un arrêt transitoire du glissement du tendon dans un doigt, en particulier si la masse se développe à proximité des rétinacules ou dans un tunnel ostéofibreux (Bertolotto et al. 1996).
30. GANGLIONS INTRATENDINEUX ET GANGLAIRES TENDONIENS
Les kystes ganglionnaires proviennent généralement des tissus para-articulaires, mais ceux qui se forment à l'intérieur d'un tendon sont rares (Bianchi et al. 1993). L'étiologie des ganglions intra-tendineux n'est pas complètement élucidée : une lésion récurrente du tendon suivie d'une dégénérescence kystique semble être une cause possible (Kannus et Jozsa, 1991). La pertinence clinique des ganglions intra-tendineux repose sur le fait qu'ils fragilisent la structure des tendons et les prédisposent à la rupture. Une masse palpable qui se déplace avec l'excursion du tendon affecté est généralement observée à l'examen physique et l'échographie dynamique est un moyen idéal pour définir la localisation intratendineuse du kyste. L'échographie montre des ganglions intratendineux sous forme de kystes fusiformes ou lobulés contenus dans un tendon intact mais élargi (Fig. 46c–e). En règle générale, ils sont remplis de matériau gélatineux et présentent une amélioration acoustique postérieure bien définie, bien que des échos internes de bas niveau puissent être rencontrés dans les lésions de longue date ou enflammées. A certains sites, comme la cheville, les ganglions intra-tendineux doivent être distingués des fissures longitudinales traduisant des déchirures tendineuses. Dans ces cas, la ténographie CT et MR peut aider au diagnostic en montrant un matériau de contraste dans la substance tendineuse dans les déchirures partielles, tandis que les ganglions intratendineux restent non rehaussés (Costa et al. 2003). Les ganglions intratendineux doivent être distingués des ganglions de la gaine tendineuse plus courants, qui sont des masses rigides mobiles issues de la couche viscérale de la gaine tendineuse (Fig. 47). Ces derniers ganglions se dilatent dans l'espace ténosynovial, alors que la substance tendineuse n'est pas affectée. Une aspiration à l'aiguille guidée par échographie du contenu liquidien des kystes ganglionnaires a été rapportée, mais les récidives sont fréquentes.
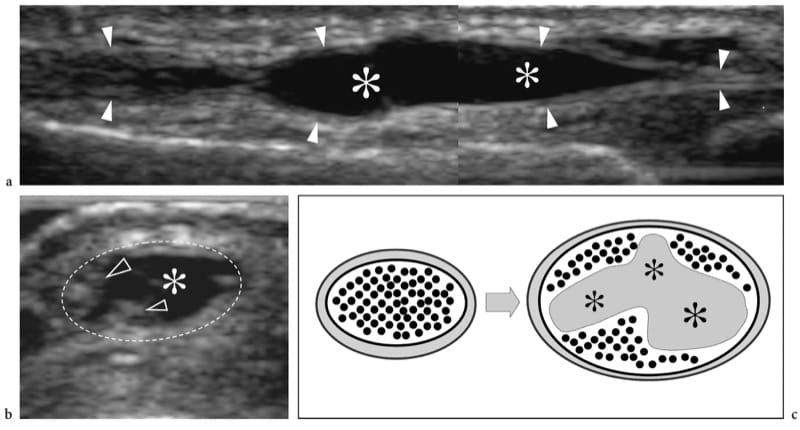
Illustration 46. a–c. Ganglion intratendineux. a Les images américaines à axe long et b à axe court 15–7 MHz sur une masse mobile des tissus mous sur la face dorsale du pouce montrent un kyste ganglionnaire fusiforme (astérisques) se développant dans la substance du tendon extensor pollicis longus (têtes de flèches) . Sur l'image à petit axe, la ligne pointillée indique les limites extérieures du tendon. Notez que certaines fibres tendineuses (têtes de flèches) sont déplacées par le kyste en expansion (astérisque). c Le dessin schématique illustre comment le kyste ganglionnaire (astérisques) se développe dans la substance tendineuse.
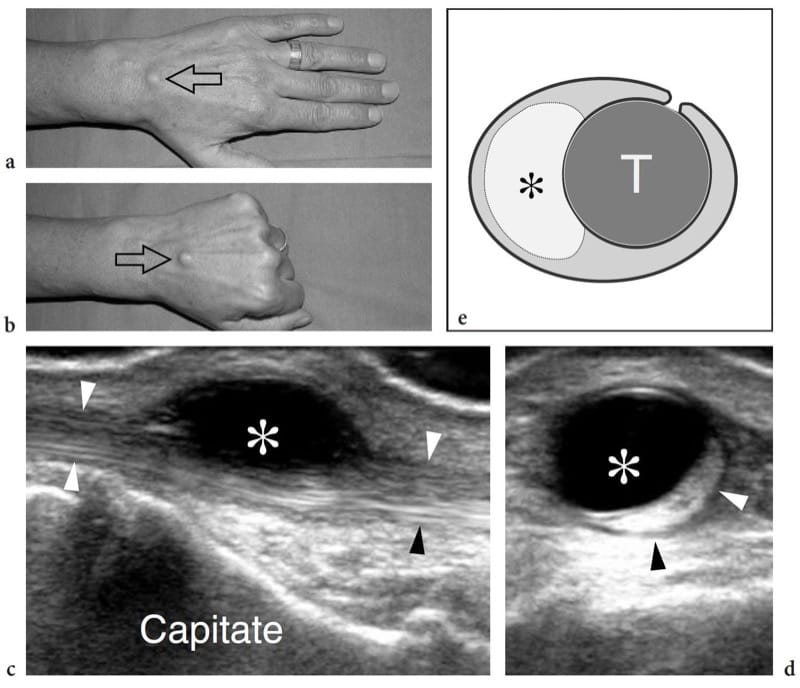
Illustration 47. a–e. Ganglion de la gaine tendineuse. a,b Les photographies de la face dorsale de la main montrent une petite masse raide (flèche) qui se déplace d'avant en arrière le long de l'axe du majeur lors d'une extension du doigt et d'une contraction du poing. c Les images américaines à axe long et à axe court 17–5 MHz montrent un kyste ganglionnaire (astérisque) adhérent au tendon extenseur (têtes de flèche) du majeur. Comme le montre la figure d, le kyste se développe à l'intérieur de la gaine et provoque une compression sur le tendon adjacent. e Le dessin schématique illustre le kyste (astérisque) tel qu'il provient de la couche viscérale de la gaine tendineuse (T) et se dilate dans l'espace synovial.
31. TUMEUR CELLULAIRE GÉANTE DE LA GAINE TENDONNELLE
La tumeur à cellules géantes de la gaine tendineuse concerne préférentiellement les trois premiers doigts et les deux premiers orteils. Il s'agit d'une affection bénigne d'évolution lente qui survient préférentiellement au niveau de la synoviale des gaines tendineuses et peut provoquer des érosions osseuses. Il se présente comme une masse solide contenant des cellules multinucléées et des dépôts d'hémosidérine. La lésion est localement agressive, nécessite une exérèse chirurgicale et le taux de récidive postopératoire est élevé. Parce que la tumeur à cellules géantes naît de la gaine tendineuse, elle est en contact étroit avec un tendon dans une mesure variable. Le plus souvent, l'étendue du contact de la masse avec le tendon est large et, au niveau des doigts, l'atteinte circonférentielle de la tumeur autour de la phalange est étendue (Kitagawa et al. 2003). L'échographie montre la tumeur à cellules géantes de la gaine du tendon comme une masse hypoéchogène homogène solide bien définie entourant un tendon (Fig. 48) (Horcajadas et al. 2003 ; Middleton et al. 2004). Malgré le contact étroit, la masse ne bouge pas avec le tendon lorsque le tendon glisse : ceci est lié au fait que la lésion provient de la gaine et non du tendon lui-même. Les caractéristiques d'imagerie IRM de la tumeur à cellules géantes reflètent la composition histologique sous-jacente et sa teneur en hémosidérine (faible signal T2) (Figures 48d–f) (De Beuckeleer et al. 1997 ; Kitagawa et al. 2003).
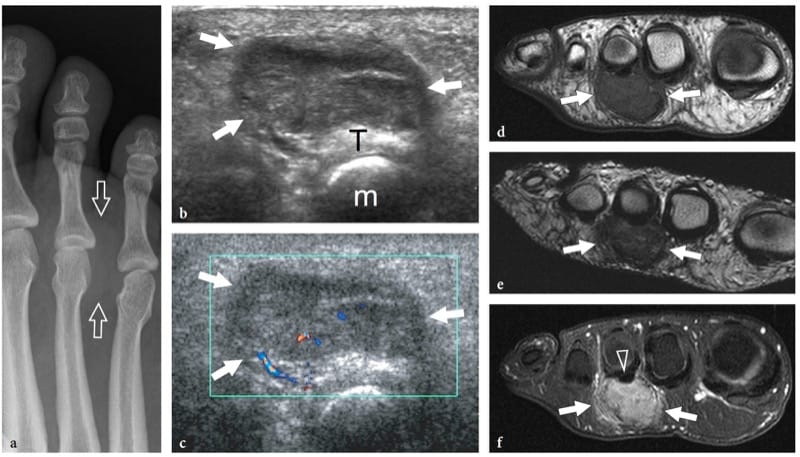
Figure 48. a–f. Tumeur à cellules géantes de la gaine tendineuse. a Radiographie de l'avant-pied chez une femme de 56 ans présentant une lésion palpable douloureuse envahissant l'espace plantaire montrant un effet de masse des tissus mous (flèches) au niveau du troisième espace intermétatarsien. b,c Petit axe b échelle de gris et c Doppler couleur 12–5 MHz Les images US sur la face plantaire du pied montrent une masse hypoéchogène solide bien définie (flèches) qui se développe près du tendon fléchisseur (T) du troisième orteil. La tumeur révèle un flux sanguin détectable situé en périphérie et au centre (m, métatarsien). d–f Les images IRM corrélatives axiales d pondérées en T1, e pondérées en T2 et f pondérées en T1 avec suppression de la graisse et gadolinium montrent la tumeur (flèches) immédiatement adjacente au troisième tendon fléchisseur (tête de flèche). La masse présente une faible intensité de signal sur l'image IRM pondérée en T2 en raison de dépôts d'hémosidérine et d'une absorption discrète de gadolinium sur l'image post-contraste, qui sont des résultats caractéristiques d'une tumeur à cellules géantes. Aucune érosion osseuse n'est observée dans ce cas particulier.