Tos persistente
Introducción
La tos prolongada y persistente o crónica (más de 4 semanas de duración) supone un motivo de consulta común; aunque ha variado con la pandemia de SARS-COV-2. En ocasiones, no es suficientemente considerada por los clínicos. Deben tenerse en cuenta las expectativas de los padres, si hay tabaquismo en el entorno, y las causas más probables por edad y ámbito de atención (rural, urbano, región).
La tos es un motivo de consulta muy frecuente en Pediatría, sobre todo, en infecciones virales agudas no complicadas y autolimitadas. También, la tos prolongada y persistente o crónica supone un motivo de consulta común. La prevalencia estimada(1,2) es del 5-7% en la edad preescolar, y del 12 al 15% en los niños mayores. En ocasiones, no es suficientemente considerada por los clínicos. Hay que diferenciarla de la tos aguda de lenta resolución y de la tos aguda recurrente.
Tanto en adultos como en niños, en los últimos años, se ha investigado mucho sobre las causas de tos crónica(3). En niños parece que destacan por frecuencia: tos postinfecciosa, bronquitis bacteriana persistente, bronquiectasias, malacia de la vía aérea y asma. Por el contrario, en el adolescente predominan las causas de la edad adulta: reflujo gastroesofágico, asma y síndrome de la vía aérea superior. Esta diferencia está en relación con las características propias del niño frente a adultos en el tracto respiratorio, el sistema inmune, así como en el sistema nervioso(4).
Por otro lado, en los niños mayores, particularmente en la adolescencia, hay mayor vulnerabilidad para el desarrollo de sintomatología psicosomática; no se debe olvidar abordar la repercusión personal de los síntomas crónicos si estos afectan a la esfera social(5,6).
La duración de más de 3-4 semanas marca el límite para distinguir la tos aguda de la prolongada o crónica en la mayoría de las guías pediátricas; y ese sería el periodo de tiempo para considerar su evaluación y seguimiento. En adultos, se considera a partir de 8 semanas(7,8).
Únicamente, la Sociedad Británica del Tórax considera la tos crónica en Pediatría la que dura más de 8 semanas, con lo cual la unifica con la tos crónica en adultos.
En la consulta, se suele apreciar discordancia entre los síntomas y la apreciación subjetiva de los padres, esto es, sus expectativas. El consumo de tabaco por los padres es un factor presente en la tos persistente hasta en un 50% de los niños menores de 11 años, algo menos en los adolescentes.
En el manejo de la tos crónica, hay que tener en cuenta las diferentes etiologías por edades. Para los pacientes de 14 años y menores, se utilizarán protocolos pediátricos. Para los adolescentes de 15 años o más, muchos autores plantean que se pueden utilizar protocolos de adultos(7,9,10).
El uso de algoritmos debe tener en cuenta el lugar de evaluación, esto es, Atención Primaria o especializada de Neumología pediátrica. Para la implementación de protocolos, es indispensable tener formación dirigida especialmente a reconocer los puntos específicos de la tos y su significación clínica.
Etiología
Tras valorar si es una tos esperada o dentro de límites y frecuencia normal, en la tos prolongada podemos considerar dos grandes grupos:
• Tos específica: secundaria a procesos fisiopatológicos pulmonares y también extrapulmonares.
• Tos inespecífica: sin una causa aparente tras una valoración inicial(2,11,12).
De mayor a menor prevalencia, en Pediatría la tos crónica inespecífica suele ser de origen: postinfeccioso, tos como equivalente asmático, tos psicógena y tos crónica por síndrome de la vía aérea superior.
Tos crónica aislada sin sibilancias
Aparece en niños aparentemente sanos. Entre sus causas estarían:
• Anomalía pulmonar o reflujo gastroesofágico en lactantes.
• Tos como única manifestación de asma.
• Tos postinfecciosa.
• Infecciones respiratorias: bronquitis viral recurrente simple o bien la tos prolongada o pertusoide: Bordetella pertusis, parapertusis, Mycoplasma, Chlamydia, citomegalovirus, adenovirus y Ureaplasma.
• En la actual pandemia de coronavirus SARS Cov-2 o Covid-19, en alguna ocasión, se ve en Pediatría tos prolongada más allá de un mes(13). Se recomienda solicitar estudio (PCR Covid-19) si hay alguna enfermedad subyacente o comorbilidad, y contacto conocido con coronavirus.
• Rinosinusitis. Alérgica o no, y asociada o no a asma.
• Tos psicógena (actual síndrome de tos somática). Hábito de tos (actual tic de tos).
• Síndrome de tos crónica de la vía aérea superior (anteriormente denominado síndrome de goteo postnasal).
Tos crónica en niños con una patología pulmonar de base
• Tos como manifestación de asma.
• Reflujo gastroesofágico, con o sin aspiración.
• Bronquitis bacteriana persistente (BBP).
• Bronquitis crónica: eosinofílica o no.
• Otras patologías: tuberculosis, fibrosis quística, aspiración de cuerpo extraño, inmunodeficiencia, malformaciones broncopulmonares, disfunción ciliar, déficit de alfa-1-antitripsina, traqueomalacia, bronquiolitis obliterante, bronquitis crónica, etc.
Véase en la tabla I, la etiología más frecuente según la edad.

Clínica
La anamnesis debe ir dirigida a datos de alarma (edad neonatal, asociación a síntomas generales, aspiración y signos de inflamación bronquial supurativa), así como por: edades, modo de presentación, si la tos es seca o productiva, y según la situación epidemiológica.
En la consulta, las preguntas sobre la tos prolongada o crónica se dirigirán(1,2,6) a:
• Inicio de la tos, edad y si se asoció a una infección respiratoria o no.
• Características de la tos: forma de toser habitual, para clasificarla en tos seca y productiva.
• Si es discontinua, metálica, con estridor, paroxística, ritmo horario, nocturna o desaparece durante el sueño, relación con la ingesta, inicio brusco, relación con el ejercicio o el esfuerzo (llorar, reír).
• Si hay posibilidad de distraer la tos o si hay una desproporcionada preocupación por la tos. Si hay relación con: humedades, mascotas, humo, contaminantes ambientales.
• Se debe considerar: tabaquismo, vapeo (cigarros electrónicos), uso de drogas vía inhalada, irritantes o contaminantes químicos de uso, como aficiones o hobbies (pegamentos, pinturas) o en el ámbito laboral.
• Signos de alarma: inicio en o cerca de periodo neonatal, o bien asocia síntomas generales (hay pérdida de peso, dificultades en la alimentación, diarrea crónica, acropaquias) o si hay hemoptisis.
• Otros datos relevantes: fiebre, rinorrea, catarro, atragantamiento o aspiración de cuerpo extraño, vómitos habituales, producción de esputo, riesgo de contacto con tuberculosis o VIH, tabaquismo de los padres, posible alergia y estado vacunal.
• Antecedentes personales: enfermedades previas, pulmonares (neumonías, alteraciones congénitas cardiopulmonares, autoinmunes, neoplasias, inmunodeficiencias y medicaciones). En su caso, procedencia geográfica y posibilidad de enfermedades endémicas parasitarias: tuberculosis, histoplasmosis (EE.UU.), toxocara (China), equinococosis (zonas rurales sin adecuado control sanitario).
• Hay que valorar las exploraciones complementarias previamente realizadas: radiografías de tórax o analíticas. Enfermedades asociadas, cardíacas o neurológicas, otras, comorbilidades (obesidad, apnea del sueño, atopia). También valorar en su caso qué alivió la tos (corticoide inhalado, antibióticos, antihistamínicos)(1,2,6).
• En el abordaje es importante tener en cuenta el impacto en la calidad de vida del niño y del adolescente en sus diversos entornos de vida, y hay que preguntar por ello, así como las expectativas de los padres(5). En Pediatría, hay cuestionarios multidimensionales (esfera física, emocional, funcionamiento escolar y social), como el PedsQL o KIDSCREEN (kidscreen.org), de uso recomendable no solo en estudios de investigación.
Complicaciones
Entre las complicaciones por la presión tóraco-abdominal que produce la tos, y por el impacto en la vida social, se incluyen: vómitos, petequias, hemorragia subconjuntival, síncope tusígeno, incontinencia urinaria, dolor musculoesquelético, ronquera, agotamiento, timidez, alteración en la relación social, insomnio, cefalea, mareos, transpiración excesiva, y preocupación de que “algo anda mal”, alteración en la calidad de vida, cambios en el estilo de vida, hernias abdominales; menos frecuentes: fracturas de costillas (sobre todo, de la 5º a la 7º) inducidas por la tos, enfisema intersticial pulmonar, neumotórax, arritmias, etc.(1,2).
Diagnóstico
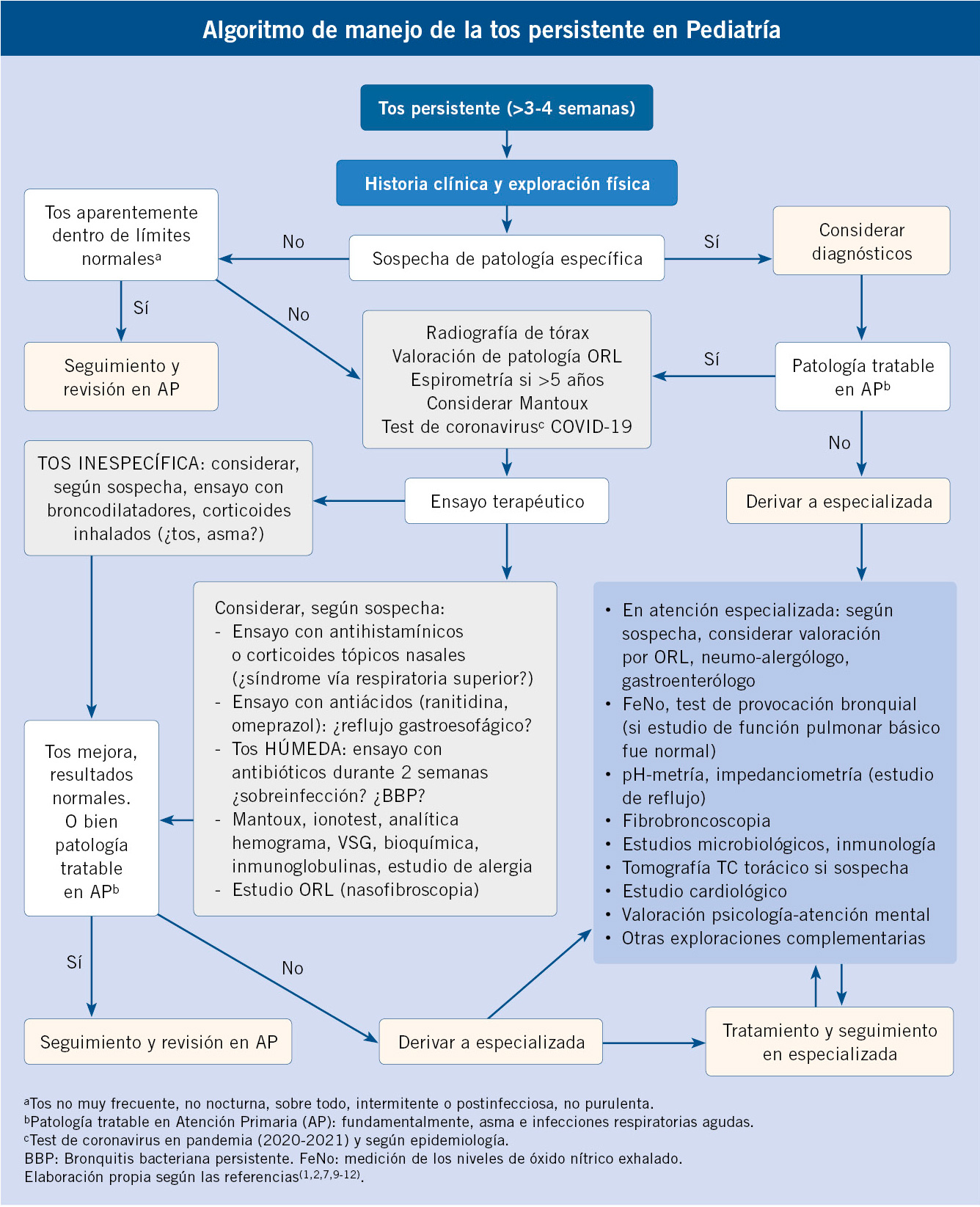
Se basa en una valoración clínica sistemática, con anamnesis y exploración física general. Una primera visita se debe dirigir a preguntar por: existencia de infección respiratoria aguda previa, tipo de tos, presencia de signos de enfermedad específica y si hay indicadores de tos específica o factores de riesgo (infección, asma, aspiración de cuerpo extraño, etc.)(1,2,14). Esa primera visita, así como la reevaluación a los 7-14 días, son determinantes para iniciar una orientación diagnóstica y considerar exploraciones complementarias dirigidas.
Resulta decisiva: reevaluación periódica, control clínico para objetivar la evolución natural o respuesta al tratamiento orientado inicialmente.
Hay que tener en cuenta que la tos prolongada puede mejorar espontáneamente, con lo cual hay que evitar realizar sobrediagnósticos y tratamientos innecesarios. Además, a veces, puede haber dos o más causas para la tos (p. ej.: asma, rinitis, bronquitis bacteriana persistente, anomalías congénitas de la vía aérea y tabaquismo).
La exploración física debe ser completa, destacando: desarrollo ponderoestatural, color de la piel, signos de atopia, deformidad torácica, acropaquias, auscultación cardiopulmonar y exploración detallada de faringe, nariz y oídos, incluido cuello (explorar la existencia de bocio). Podemos encontrar una alteración auscultatoria persistente, más asociada con tos húmeda y otros síntomas, además de la tos(14,15).
Pruebas complementarias
En el estudio diagnóstico de la tos crónica, se debe tener en cuenta la diferente etiología predominante según la edad, así como no demorar el diagnóstico y tratamiento dirigido en cuadros de riesgo. Para los pacientes de 14 años y menos, se utilizarán protocolos pediátricos.
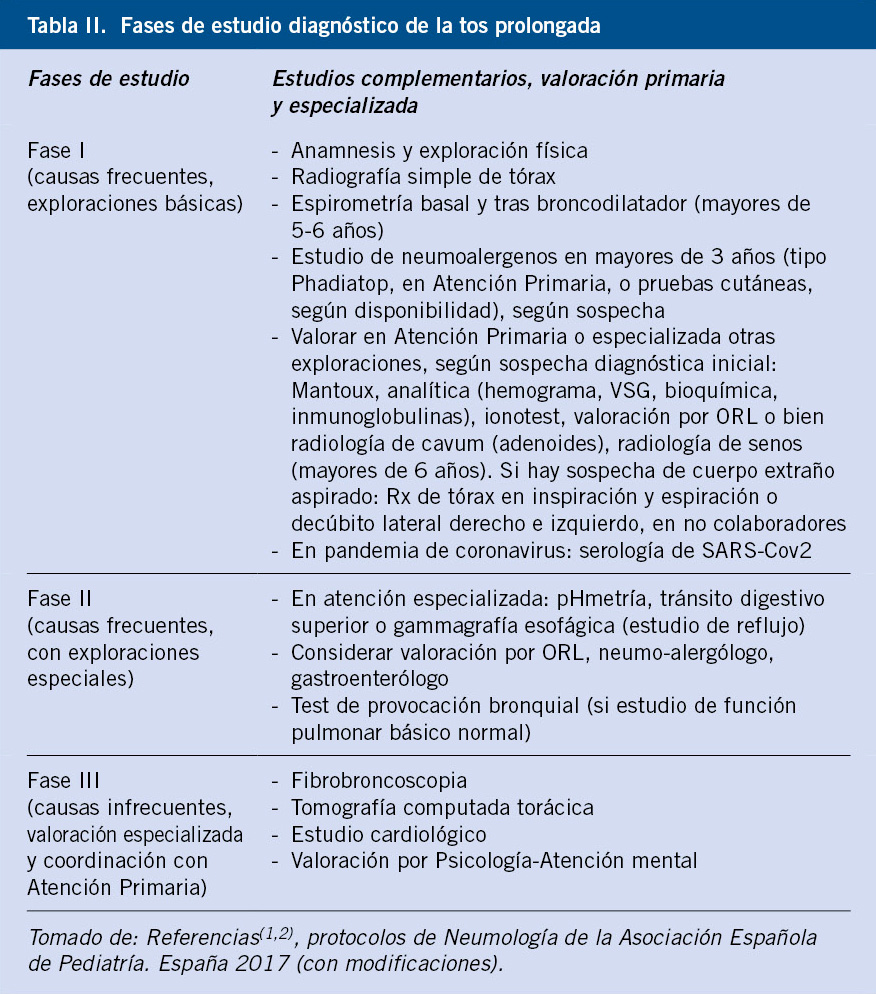
Se puede plantear un abordaje secuencial guiado por: anamnesis, exploración física y realización de radiografía y espirometría forzada. Véase tabla II de fases o niveles de estudio de tos prolongada y el algoritmo de manejo(7,9,10). En niños mayores y adolescentes, si hay sospecha diagnóstica de rinitis o tos como expresión de “goteo postnasal”, se podría empezar por un ensayo terapéutico inicial en Atención Primaria.
• Radiografía de tórax: generalmente se solicita una proyección frontal (AP hasta los 6 años, PA a partir de esa edad). En el caso de que se desee valorar localización de una lesión o estudiar las bases pulmonares (p. ej., en COVID-19), se solicitarán dos proyecciones, PA y lateral. Permite: objetivar asimetrías, visualizar anomalías congénitas, cuerpos extraños radiopacos, infiltrados y atelectasias, aumento de silueta cardiaca. Otros estudios de imagen según sospecha: radiografía de senos paranasales ante la sospecha de sinupatía, ecografía si se desea valorar mediastino, la tomografía computarizada puede ser útil si se desea un estudio más completo de senos paranasales, o alteraciones de la vía aérea superior, si hay radiografía de tórax alterada o sospecha de enfermedad pulmonar. La resonancia magnética será de utilidad en alteraciones vasculares.
• La espirometría basal y tras broncodilatación en colaboradores y mayores de 5-6 años (si está entre parámetros normales, considerar espirometría tras tratamiento con corticoide inhalado o sistémico). En caso de sospecha de asma, el registro de variabilidad en flujo espiratorio máximo o pico-flujo y los test de broncoprovocación (este solo disponible en centros especializados) pueden revelar obstrucción reversible e hiperreactividad, o sugerir anomalías anatómicas (estenosis de las vías aéreas o malacia).
• Medición de los niveles de óxido nítrico exhalado (FeNO), disponible en centros especializados, contribuye al diagnóstico de asma eosinofílico. El punto de corte propuesto generalmente como patológico es de 50 ppm. Tiene alto valor predictivo negativo, hasta el 93%.
• Intradermorreacción de Mantoux. El cribado de tuberculosis también podría hacerse con IGRA (Ensayo de Liberación de Interferón Gamma, como el Quantiferon)(16). Dependiendo del área geográfica o riesgo de exposición, muchos consideran que la tuberculina debería estar en la valoración inicial o de primer nivel.
• Estudio de alergia a aeroalérgenos en mayores de 3-4 años, con sospecha diagnóstica, quizá más concretamente a hongos o ácaros. Estudios según disponibilidad: test in vivo como las pruebas cutáneas (“prick”), o test in vitro (analítica de sangre) tipo Phadiatop, Cap system (IgE específica en grupos de alérgenos), factible en muchos centros de Atención Primaria. Se utilizaría el perfil pneumoalérgenos, o bien IgE específica por alérgenos individualizados. Un Phadiatop negativo indica muy baja probabilidad de sensibilización alérgica.
• Hemograma con VSG, bioquímica básica y TSH. En caso de posible infección activa. El bocio o la tiroiditis pueden ser causa excepcionalmente de tos, como único síntoma aparente inicial. En la pandemia de coronavirus SARS-Cov2 puede considerarse su estudio serológico.
• Estudio de reflujo gastroesofágico. Solo en el 3-8% de los casos pediátricos coinciden reflujo y tos crónica; esto es más frecuente en los lactantes, que no suelen manifestarse solo como tos, y en niños o adolescente, de mayor edad, especialmente si hay otros síntomas: pirosis o regurgitación. Puede plantearse el ensayo terapéutico durante 8 semanas con un inhibidor de la bomba de protones (p. ej., omeprazol), y si no hay respuesta, derivar para estudio por gastroenterólogo pediátrico, que puede indicar: endoscopia digestiva, pHmetría esofágica en su caso con impedanciometría intraluminal de doble canal u otros (tránsito digestivo superior o bien gammagrafía esofágica). La acalasia se ha descrito como causa de tos crónica.
• Valoración por especialista ORL. Si se sospecha sinupatía crónica o alteración de la vía aérea superior. Con nasofibroscopia se puede realizar el diagnóstico de hipertrofia de cornetes con rinitis y poliposis.
• Si se puede obtener esputo se hace gram y cultivos. Y si está disponible: el estudio de eosinófilos y células metacromáticas en el esputo inducido. Contribuye al diagnóstico de asma y de inflamación eosinofílica de la vía aérea.
• Test serológicos: estudio de infección pasada por virus, Mycoplasma pneumoniae, B pertussis, otros.
• Determinación de inmunoglobulinas y sus clases, y otros test de inmunocompetencia están indicados en casos de infección crónica. Estudio de infección VIH.
• Broncoscopia. Broncoscopio rígido o con fibrobroncoscopio. Sus indicaciones son: extracción de un cuerpo extraño, en caso de anomalías congénitas, para obtener muestras de vías bajas (lavado broncoalveolar [LBA]), para cultivo y microscopia. Un aumento de lípidos en el lavado broncoalveolar puede revelar microaspiración. La realización de una fibrobroncoscopia con LBA para estudio citológico, cultivo y realización de PCR, constituye la prueba definitiva para el diagnóstico de bronquitis bacteriana persistente, aunque su escasa accesibilidad hace que se reserve para aquellos pacientes con una respuesta insuficiente al tratamiento antibiótico o que presenten una BBP recurrente (más de 3 episodios al año).
Hay una asociación frecuente de traqueobroncomalacia y BBP (48-74% de los casos).
• El test del sudor, para descartar fibrosis quística (FQ), se debe hacer ante tos prolongada si hay desnutrición o tos productiva crónica. Desde hace unos 11 años (desde 2009), se ha generalizado el cribado neonatal con tripsina inmunoreactiva en sangre en todas las comunidades autónomas españolas. Por tanto, hay que tener en cuenta que los adolescentes o migrantes pueden no tener cribado neonatal realizado de FQ.
• La discinesia ciliar primaria se excluye solo en centros especializados y requiere: pruebas in vivo e in vitro, microscopía electrónica y cultivos de epitelio. En caso de inicio neonatal de la tos pensar en ella, así como en situs inversus o anomalías congénitas de la vía aérea.
• En personas con drepanocitosis, el asma puede ser una comorbilidad que incremente la gravedad de la hemoglobinopatía; pero no suele ser la tos un síntoma único de complicaciones.
Evaluación de la tos en Pediatría de Atención Primaria
Es importante valorar si la tos está aparentemente dentro de lo normal o no, considerar las expectativas de los padres, tranquilizar a la mayoría de las familias. En la consulta de Atención Primaria pediátrica, ante un niño conocido, la anamnesis sobre las características de la tos, la presencia de otros signos de enfermedad y la exploración física nos orientará en su caso a sospechar un proceso de base. No olvidar considerar la bronquitis bacteriana persistente como una causa no rara en la tos húmeda en menores de 6 años. Se realizará una radiografía de tórax, así como las exploraciones complementarias dirigidas a descartar tuberculosis, Coronavirus SARS-Cov 2, y una espirometría en niños mayores de 5 años.
Se utilizará la Fase I de estudio y el lado izquierdo y central del algoritmo.
Para un adecuado tratamiento de la tos prolongada en Pediatría, se debe intentar esclarecer la causa, excluyendo enfermedades subyacentes graves. La presencia de tos de larga evolución debe ser investigada hasta su desaparición completa o hasta llegar a un diagnóstico definitivo. Mejorías parciales o transitorias de la tos no deben ser tenidas en cuenta como éxitos terapéuticos definitivos. Con un abordaje adecuado se determinan hasta el 80% de las causas de tos crónica en la edad pediátrica, y hay mejoría en el 90% de los tratamientos(7,9-11,17).
Tratamiento
Medidas generales
Hidratación oral y lavados nasales. Evitar exposición a tabaco e irritantes.
Tratamiento con medidas ambientales
No hay evidencias de que el manejo ambiental domiciliario, incluidos: desionizadores, vaporizadores, humificadores, filtros de aire y otros, sean eficaces en el tratamiento de la tos inespecífica prolongada en Pediatría.
Tratamiento etiológico
Cuando se identifique la causa.
• Antibióticos para infección establecida o sospechada, en caso de clínica de BBP (2 semanas con amoxicilina-clavulánico a 80 mg/kg/día –dosis de adulto, 875 mg amoxicilina/125 mg de clavulánico–, como primera elección), o bien cotrimoxazol o cefalosporinas o macrólidos (azitromicina 10 mg/kg/día, y hasta 500 mg cada 24 h, 3 días, o claritromicina). La buena respuesta a antibioterapia también caracteriza y contribuye al diagnóstico de la BBP(12).
• Macrólidos en el caso de tos ferina (ya no acortaría la fase de estado a partir de las 2 semanas de inicio de la clínica de tos).
• En rinitis o síndrome de tos crónica de la vía aérea superior, antihistamínicos de primera generación, por su efecto anticolinérgico o corticoides nasales.
• Tratamiento de la enfermedad alérgica con medidas ambientales y esteroides inhalados. En tos seca, se puede hacer el ensayo de corticoide inhalado 4 semanas o inhibidor de leucotrienos (montelukast en mayores de 6 meses de edad, según ficha técnica), como segunda opción. Si el tratamiento antiasmático de prueba ha fallado, es importante suspenderlo.
• Tratamiento quirúrgico en anomalías anatómicas.
• El reflujo se puede tratar médicamente (ranitidina en lactantes o bien omeprazol y estilos de vida evitando bebidas ácidas, colas, ingesta inmediatamente antes de acostarse, almohada sobreelevada), o quirúrgicamente (funduplicatura de Nissen), en casos de no respuesta al tratamiento conservador, la tos aislada crónica excepcionalmente será una indicación de intervención quirúrgica de reflujo.
• Otros: algunos autores han encontrado respuesta a la lidocaína nebulizada en tos refractaria seca en adultos y niños. En adultos con tos crónica que no responde a tratamiento, se han usado off-label (fuera de indicación de la ficha técnica), la guanfacina o bien la gabapentina. La guanfacina es un agonista selectivo de receptor alfa2A adrenérgico, un antihipertensivo de acción central, también aprobado para TDAH. La gabapentina es fármaco anticomicial, que se usa también comúnmente para el tratamiento del dolor neuropático.
Apoyo psicológico. Información adecuada
En la tos prolongada inespecífica y no sugestiva de patología, es importante indagar sobre la necesidad de información individualizada al paciente y a la familia. En ocasiones, hay miedos o prejuicios que no se informan en primeras visitas, y que deben ser estudiados y atendidos adecuadamente mediante técnicas de asesoramiento (counseling).
El tratamiento de la tos psicógena (síndrome de tos somática) irá dirigido a localizar el conflicto subyacente, tranquilizar a los padres y familiares, explicando el carácter benigno del proceso de una forma clara y no suspender la escolarización. Pueden dar resultado las técnicas de relajación para disminuir la tensión músculo-esquelética de cuello y tórax. En casos extremos, derivar al psiquiatra y considerar la hipnosis familiar. Hay técnicas de sugestión para mejorar la tos de origen psicógeno: tos como círculo vicioso originado por irritante, que ya no actúa, concentrarse en espaciar progresivamente la tos, maniobras para aliviar la irritación, etc.(18).
Tratamiento farmacológico de la tos
Los antitusígenos no deben ser fármacos más que de uso puntual, concreto, nunca en primera línea y respetando la indicación y contraindicaciones según edad.
Los antitusivos son algunas veces de ayuda en casos de tos intratable, especialmente debida a infecciones virales, pero no deben estar en 1ª línea del tratamiento de la tos prolongada, pues pueden retrasar un diagnóstico específico y su tratamiento. Para el uso de los fármacos antitusivos más comunes en Atención Primaria, véase la tabla III.

Los adolescentes y los padres deben recibir información sobre los fármacos y su parcial eficacia, así como de la posibilidad de efectos adversos asociados a su uso. La codeína es el más importante a nivel central; pero la Agencia Española del Medicamento desde 2015 recomienda no utilizar codeína en menores de 12 años, ni en adolescentes de 12 a 18 años de edad que presenten compromiso de la función respiratoria de origen pulmonar, neuromuscular, traumático o quirúrgico. También, hay una variedad de remedios caseros con efecto más bien placebo.
• No hay lugar para los mucolíticos, incluidos bromhexina y acetilcisteína para la tos crónica, porque no hay evidencia de eficacia y, además, pueden causar irritación de la vía aérea. La DNasa recombinante humana (alfa-dornasa) inhalada puede ser eficaz en niños con secreciones viscosas purulentas y está indicada en fibrosis quística.
• Hay numerosas líneas de investigación actuales de nuevos antitusivos, para actuar sobre la multiplicidad de receptores o dianas potenciales del mecanismo de la tos.
• En caso de tos asociada a tratamiento con antihipertensivos inhibidores de la angiotensina II (IECA), estará indicado suspenderlos y, en su caso, utilizar ARA-II como losartan o valsartan, que no inhiben el metabolismo de las quininas. Esto no es frecuente en la edad pediátrica.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.*** Pascual Sánchez MT, Urgelles Fajardo E. Tos persistente. Protoc diagn ter pediatr. 2017; 1: 1-14. Acceso el 26 septiembre de 2020. Disponible en:
http://www.neumoped.org/docs/PROTOCOL_DIAGN_TERAP.pdf.
2.*** Chang AB, Marchant JM, Mallory GB, Hoppin AG. Approach to chronic cough in children. UpToDate 2020. Versión octubre 2018. Acceso el 26 octubre de 2020.
3.* Kantar A, Seminara M, Why chronic cough in Children is different. Pulmonary Pharmacol Therapeut. 2019; 56; 51-6.
4. Mazzone SB, Undem BJ. Vagal afferent innervation of the airways in Health and Disease. Physiol Rev. 2016; 96: 975-1024.
5.* Newcombe PA, Sheffield JK, Petsky HL, Marchant JM, Willis C, Chang AB. A child chronic cough-specific quality of life measure: development and validation. Thorax. 2016; 71: 695-700.
6.** Zafra Anta MA. Tos crónica. En: Hidalgo Vicario MI, Rodríguez Molinero L, Muñoz Calvo MT. Eds. Medicina de la adolescencia. Atención integral. Majadahonda (Madrid): Ergon. 3ª ed; 2021. p. 585-90.
7.* Chang AB, Oppenheimer JJ, Weinberger M, Weir K, Rubin BK, Irwin RS. Use of management pathways or algorithms in children with chronic cough: Systematic reviews. Chest. 2016; 149: 106-19.
8.* Silvestri RC, Weinberger SE, Barnes PJ, King TE, Hollingsworth H. Evaluation of subacute and chronic cough in adults. UpToDate 2018. Versión octubre 2020. Acceso el 26 octubre de 2020.
9.** Moneo Hernández I, Asensi Monzó M, Rodríguez Fernández-Oliva CR. Guía de Algoritmos en Pediatría de Atención Primaria. Tos crónica en AP. AEPap. 2017 (en línea). Consultado el 14 de noviembre de 2020. Disponible en: algoritmos.aepap.org.
10. O’Grady KAF, Grimwood K, Torzillo PJ, Rablin S, Lovie-Toon Y, Kaus M, et al. Effectiveness of a chronic cough management algorithm at the transitional stage from acute to chronic cough in children: a multicenter, nested, single-blind, randomised controlled trial. Lancet Chil Adolesc Health. 2019; 3: 889-98.
11.** Ridao Redondo M. Tos crónica en Pediatría. Pediatr Integral. 2016; XX(1): 7-15.
12.*** Busquets Monge RM, Castillo Corullón S, Aguilar Fernández AJ. Tos húmeda: bronquitis bacteriana persistente, enfermedad supurativa bronquial y bronquiectasias. Protoc diagn ter pediatr. 2017; 1: 15-29. Acceso el 26 septiembre de 2020. Disponible en:
http://www.neumoped.org/docs/PROTOCOL_DIAGN_TERAP.pdf.
13.** Devilla JG, Song E, Ouellette CP, Edwards MS, Torchia MM. Coronavirus Disease 2019 (COVID-19): clinical manifestations and diagnosis in Children. UptoDate 2020. Versión noviembre 2020. Acceso el 12 noviembre de 2020.
14.* Zafra Anta MA. Semiología Respiratoria. Regreso a las Bases. Pediatr Integral. 2016; XX(1): 62.e1-62.e12.
15. Fernández Manso B, Albañil Ballesteros MR, Zafra Anta MA. Auscultación patológica persistente: no todo son broncoespasmos. Rev Pediatr Aten Primaria. 2019; 21: 173-9.
16. Zafra Anta MA, Rivero Calle I, García Begoña S. Tuberculosis (v.3/2020). En Guía-ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico (en línea). Consultado el 3 de abril de 2020. Disponible en: https://www.guia-abe.es; https://guia-abe.es/files/pdf/Guia-ABE_Tuberculosis_v.3_2020.pdf.
17.** Seoane M, Sanz V, Villa JR. Tos crónica en la adolescencia. Adolescere. 2018; VI(3): 6-13.
18. Weinberger M, Lockshin B. When is cough functional, and how should it be treated? Breathe. 2017; 13: 22-30.
Bibliografía recomendada
– Pascual Sánchez MT, Urgelles Fajardo E. Tos persistente. Protoc diagn ter pediatr. 2017; 1: 1-14.
Artículo que resume las características y recomendaciones fundamentales para el manejo de la tos persistente en nuestro medio, tanto en Atención Primaria como especializada.
– Chang AB, Marchant JM, Mallory GB, Hoppin AG. Approach to chronic cough in children. UpToDate 2020. Versión octubre 2018.
Revisión con metodología de la medicina basada en la evidencia de las características clínicas y epidemiológicas de la tos prolongada, realizada por uno de los mayores expertos internacionales en el tema, que se mantiene constantemente actualizada.
– Zafra Anta MA. Tos crónica. En: Hidalgo Vicario MI, Rodríguez Molinero L, Muñoz Calvo MT. Eds. Medicina de la adolescencia. Atención integral. Majadahonda (Madrid): Ergon. 3ª ed. 2021; p. 585-90.
Texto actualizado muy dirigido al grupo de edad de diez a veinte años.
– Moneo Hernández I, Asensi Monzó M, Rodríguez Fernández-Oliva CR. Guía de Algoritmos en Pediatría de Atención Primaria. Tos crónica en AP. AEPap. 2017 (en línea). Disponible en: algoritmos.aepap.org.
Guía que sirve de apoyo y aval en la decisión para realizar estudios complementarios y derivación en su caso.
– Busquets Monge RM, Castillo Corullón S, Aguilar Fernández AJ. Tos húmeda: bronquitis bacteriana persistente, enfermedad supurativa bronquial y bronquiectasias. Protoc diagn ter pediatr. 2017; 1: 15-29.
Análisis exhaustivo sobre la tos húmeda crónica, no tan excepcional como se puede pensar, y cuyo tratamiento precoz disminuye el riesgo de complicaciones crónicas pulmonares.
– Chang AB, Oppenheimer JJ, Irwin RS; CHEST Expert Cough Panel. Managing Chronic Cough as a Symptom in Children and Management Algorithms: CHEST Guideline and Expert Panel Report. Chest. 2020; 158: 303-329.
Es una excelente revisión, con niveles de evidencia, de las guías recientes respecto de la de 2006. Se recomienda seguir guías diagnósticas por edades. Se exponen recomendaciones diagnóticas y de tratamiento.
– Morice AH, Millqvist E, Bieksiene K, et al. ERS guidelines on the diagnosis and treatment of chronic cough in adults and children. Eur Respir J. 2020; 55: 1901136 Disponible en: [https://doi.org/10.1183/13993003.01136-2019].
La tos crónica se reconoce como entidad diferenciada. Esta guía europea incorpora los recientes avances en fisiopatología, el diagnóstico y el tratamiento farmacológico y no farmacológico de la tos crónica.
Enlaces de interés:
- Guía GEMA. Para el manejo del asma: https://www.gemasma.com/.
- Página de la Sociedad Española de Neumología Pediátrica: http://www.neumoped.org/.
- Grupo de Vías Respiratorias de la AEPap: http://www.respirar.org/.
| Caso clínico |
|
Tomás tiene 5 años y consulta en Atención Primaria, porque en el contexto de cuadro catarral comenzó con una tos húmeda persistente, hace más de 4 semanas. Sus padres refieren que, en ocasiones, tiene fatiga, pero poco tiempo, al final de los frecuentes accesos de tos. No tiene antecedente de atragantamiento durante una comida, ni aspiración de cuerpo extraño. No hay síntomas de Covid-19 en la familia. No hay fumadores en el domicilio. No ha perdido peso. Sigue tratamiento desde hace dos años por asma moderado con budesonida espray con cámara a dosis medias y montelukast. En la exploración está afebril, destacan sibilantes espiratorios, dispersos, sin dificultad respiratoria, el resto de la exploración es normal. Se inició tratamiento con salbutamol y corticoide oral 3 días, mejorando la auscultación, pero no la tos, que persistía. Se realizó una radiografía de tórax, informada como sin hallazgos. Se considera la posibilidad de asma mal controlada y se cambia la budesonida por salmeterol-fluticasona en spray con cámara. No hay cambios en la tos. La saturación con pulsioximetría de dedo, en varias ocasiones, es 96-99%. Se añadió al tratamiento, amoxicilina-clavulánico oral durante 2 semanas, con mejoría en los primeros 2-3 días, desapareciendo la tos y normalizando la auscultación.
|
|
|