|
| Temas de FC |
M.T. Giner Muñoz
Sección de Alergia e Inmunología Clínica. Hospital San Juan de Dios. Barcelona
| Resumen
La alergia a medicamentos se manifiesta con cuadros clínicos de gran polimorfismo y la edad pediátrica no es diferente en esto. Su frecuencia aumenta con la exposición a fármacos y, a pesar de que hay pocos datos estadísticos, se acepta que es menor en el niño que en el adulto. |
| Abstract
Drug allergy is manifested with clinical pictures having great polymorphism, this being similar in the pediatric age. Its frequency increases with exposition to drugs and, even though the statistical data available are limited, it is accepted that drug allergy is less in the child than in the adult. |
Palabras clave: Alergia; Hipersensibilidad; Reacción adversa; Fármaco.
Key words: Allergy; Hypersensitivity; Adverse reaction; Drug.
Pediatr Integral 2013; XVII(9): 637-651
Alergia a medicamentos. Conceptos básicos y actitud a seguir por el pediatra
Tipos de reacciones adversas a medicamentos
Las mayoría de las reacciones adversas a los fármacos no son alérgicas y tienen relación con las acciones farmacológicas del medicamento. Una reacción de hipersensibilidad debe tener unas características independientes de las acciones propias del medicamento, dependientes de una respuesta anómala del paciente.
Las reacciones adversas a medicamentos (RAM) son efectos perjudiciales o indeseados, con dosis utilizadas para la profilaxis, diagnóstico o tratamiento de las enfermedades(1).
La mayoría de las reacciones adversas a medicamentos no responden a mecanismos inmunológicos, se relacionan con los efectos farmacológicos conocidos del fármaco y, por ello, son previsibles. Este tipo de reacciones se denominan de tipo A, son las más frecuentes y corresponderían al 85-90% del total de las reacciones adversas.
Las reacciones alérgicas a medicamentos se engloban en las de tipo B (no previsibles) y se deben a respuestas anómalas de una pequeña parte de la población. Pueden deberse a intolerancia, idiosincrasia o hipersensibilidad resultante de una respuesta inmune; estas últimas son las reacciones alérgicas a medicamentos (Tabla I).
Las reacciones por hipersensibilidad tienen características diferentes de las reacciones de tipo A:
• Son distintas de las acciones farmacológicas conocidas del fármaco.
• Existe un contacto previo con el fármaco implicado (continuo o intermitente), que causa la sensibilización del paciente.
• Sus manifestaciones clínicas deben concordar con las propias de las reacciones alérgicas conocidas.
• Son recurrentes ante nuevas exposiciones al alérgeno.
• La reacción debe mejorar al retirar el fármaco.
• La reacción debe ser reproducible con dosis mínimas de fármaco.
• Es posible la reactividad cruzada con fármacos de estructura similar.
En las reacciones por intolerancia, los pacientes presentan reacciones tóxicas predecibles frente a uno o varios fármacos, a dosis bajas o incluso infraterapéuticas. En las idiosincrásicas, las reacciones son cualitativamente distintas de la toxicidad conocida del fármaco y pueden deberse a alteraciones genéticas en el paciente y, a pesar de que hay algunos ejemplos bien descritos, como las anemias hemolíticas por primacina en deficiencia de glucosa-6-fosfato deshidrogenasa, sus mecanismos no son bien conocidos.
Las reacciones por hipersensibilidad a medicamentos de tipo inmune(2) pueden ser mediadas por inmunoglobulina E, o responder a otros mecanismos inmunes (Fig. 1).
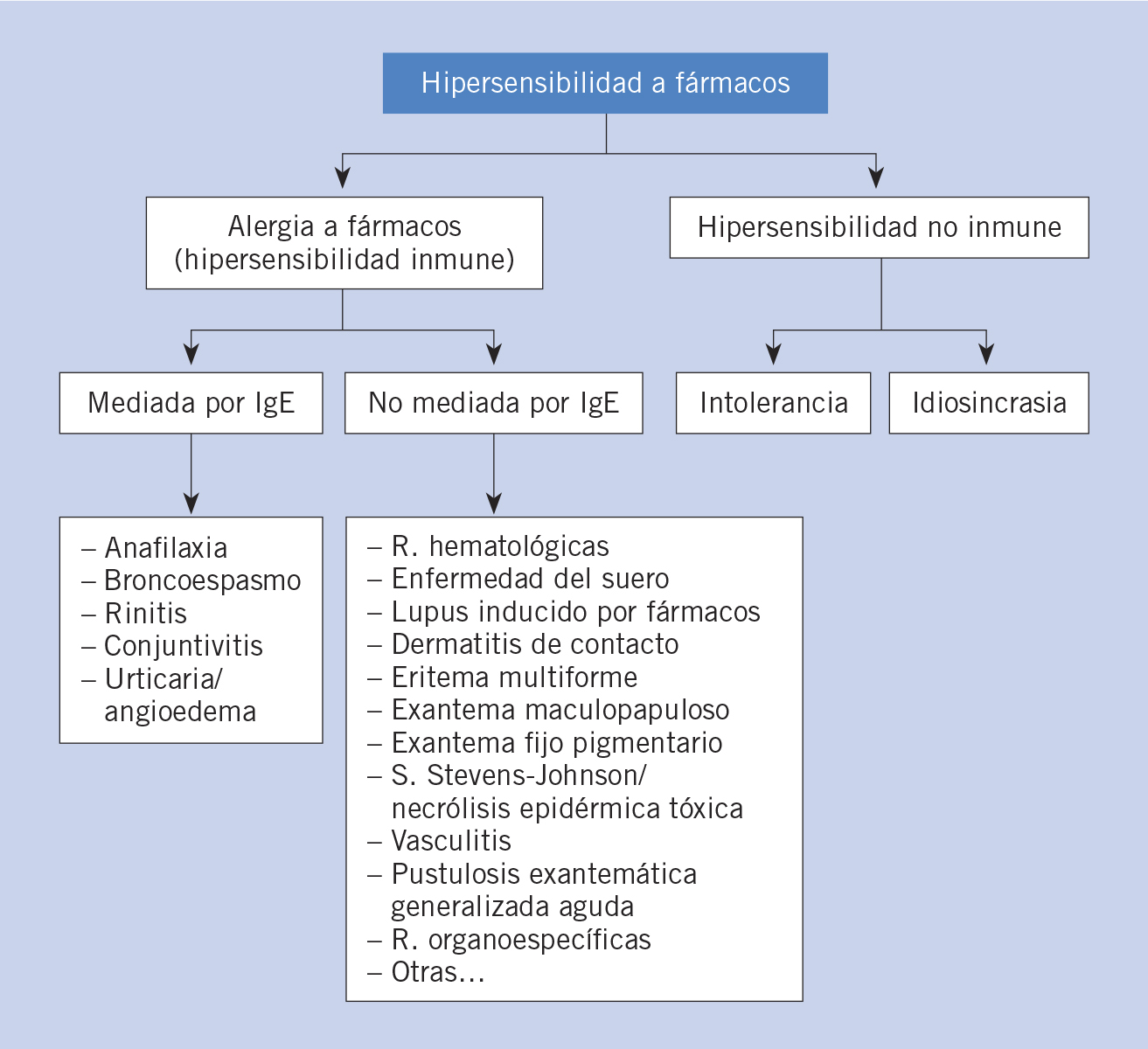
Figura 1. Reacciones por hipersensibilidad a fármacos.
Epidemiología
La prevalencia real de la alergia a medicamentos es mal conocida, la mayoría de autores aceptan porcentajes entre el 6 y el 10% de las reacciones adversas a fármacos(1). La mayoría de estudios realizados se han llevado a cabo en medio hospitalario, lo que ya supone un sesgo importante. En edad pediátrica, se supone baja, menor que en el adulto, y aún peor conocida.
Demoly, basándose en datos publicados, estima que las reacciones adversas a fármacos podrían afectar al 10-15% de los pacientes hospitalizados y las reacciones por hipersensibilidad representarían un tercio de éstas aunque, en la mayoría de los casos, no se comuniquen.
Factores de riesgo para desarrollar alergia a fármacos
Sexo femenino
Por motivos mal conocidos, las mujeres tienden a presentar con mayor frecuencia que los hombres alergia a los medicamentos, tanto para reacciones de tipo inmediato como tardío(3).
Historia previa de reacciones alérgicas a medicamentos
Una historia previa de reacciones alérgicas a uno o más fármacos aumenta el riesgo de desarrollar otras alergias medicamentosas, incluso con fármacos no relacionados.
Las reacciones no inmunes frente a AINES pueden aparecer en AINES sin relación estructural entre sí; ya que, el mecanismo que las produce está en relación con la alteración de la vía metabólica de inhibición de la ciclooxigenasa tipo 1 (COX-1) que es propia de la acción de estos fármacos.
El término “alergia a múltiples medicamentos” debe aplicarse a personas que han experimentado reacciones inmunológicas (de cualquier tipo de Gell y Coombs), bien documentadas, frente a dos o más fármacos no relacionados químicamente, y parece relacionarse con un aumento de la capacidad de respuesta de sus células T frente a sustancias farmacéuticas(4).
Exposición recurrente a fármacos
Tratamientos repetidos con los mismos fármacos favorecen la alergia a fármacos (por ejemplo, los pacientes con fibrosis quística).
Tipo de HLA
Hay pruebas de propensión familiar a desarrollar reacciones de hipersensibilidad graves a medicamentos concretos en presencia de ciertos tipos de alelos HLA-B; por ejemplo, el SJS/TEN por carbamazepina, en pacientes chinos de la etnia Han se asocia a la presencia de HLA-B*1502(5). Otros alelos HLA-B se han asociado a reacciones graves por otros fármacos, entre ellos el alopurinol y el abacavir.
Algunas situaciones clínicas
• En los pacientes con linfocitos anormales o atípicos, se presentan con mayor frecuencia reacciones a aminopenicilinas (por ejemplo: infecciones por virus de Ebstein-Barr, por virus herpes, leucemias…).
• Los pacientes con inmunodeficiencia adquirida (SIDA) tienen con frecuencia reacciones por sulfamidas y otros fármacos. La infección por HIV crea un entorno inflamatorio que favorece la alergia medicamentosa.
Atopia
Los pacientes con enfermedades atópicas no tienen riesgo mayor de presentar alergia a medicamentos, pero sí pueden presentar reacciones mediadas por IgE de mayor gravedad.
Edad
La edad no es un factor de riesgo independiente para la alergia a medicamentos, pero los datos se confunden dados los diferentes patrones terapéuticos usados en las distintas edades.
Los fármacos como alérgenos-interacción con el sistema inmune
Las moléculas capaces de provocar una respuesta inmune por sí mismas suelen ser proteínas de alto peso molecular. Muy pocos fármacos cumplen este requisito, y esto hace que interaccionen con moléculas proteicas circulantes o de células, adquiriendo así una capacidad inmunógena que no poseen por sí solos y que se conoce mal en la mayoría de los casos.
La mayoría de medicamentos son compuestos de bajo peso molecular y composición química simple, y sus estructuras no son fácilmente reconocibles por el sistema inmune, que sólo de forma excepcional es capaz de reconocer substancias de peso molecular inferior a 5.000 d.
Son moléculas demasiado pequeñas para interactuar con los receptores inmunes con suficiente potencia para activar las células T o B. En su estado original, la mayoría de fármacos no tienen capacidad inmunógena.
Sin embargo, si el fármaco es presentado a los linfocitos por una célula presentadora de antígeno (una célula dendrítica, por ejemplo) tanto en su forma original como si se modifica tras su metabolización, puede desarrollar una respuesta inmune específica mediada por células T, o mediada predominantemente por anticuerpos, o tener características de ambos tipos de respuesta.
Fármacos capaces de estimular una respuesta de anticuerpos
Los fármacos capaces de provocar este tipo de respuesta directamente son pocos. Lo hacen estimulando las células T como antígenos proteicos, y suelen ser macromoléculas, por ejemplo: insulina u otras hormonas, enzimas, protamina, antisueros, anticuerpos monoclonales, vacunas…
Hay algunos compuestos de bajo peso molecular que tienen múltiples recurrencias de un único epítopo y pueden actuar como alérgenos: los ejemplos más conocidos son la carboximetilcelulosa (estabilizante en inyectables) y algunos compuestos de amonio cuaternario usados en la inducción anestésica como bloqueantes neuromusculares (succinilcolina, vecuronio, atracurio…)(6).
Haptenos
Algunos compuestos de bajo peso molecular (<1.000 d) pueden adquirir inmunogenicidad por unión covalente a macromoléculas que, en general, son proteínas plasmáticas o proteínas de la superficie celular. El medicamento se conoce como hapteno y la nueva molécula, complejo hapteno-portador.
Como ejemplos de las moléculas de la membrana celular capaces de unirse a haptenos, tenemos las integrinas, y péptidos del CMH (complejo mayor de histocompatibilidad).
Los complejos hapteno-portador son capaces de estimular los linfocitos T y/o respuestas de anticuerpos. La penicilina es un fármaco que se comporta como hapteno, ya que el anillo betalactámico en condiciones fisiológicas se abre y reacciona con los residuos de lisina de las proteínas, formando un complejo que es el determinante antigénico principal de la penicilina y otros betalactámicos y es capaz de estimular respuestas mediadas por anticuerpos, o por las células T(7).
Entre los fármacos capaces de comportarse como haptenos, los mejor conocidos son los betalactámicos, pero otros como la penicilamina y los metales pesados también pueden comportarse como tales.
Metabolitos reactivos
Fármacos que, en su forma original, no son reactivos con macromoléculas, pueden hacerse reactivos tras su metabolización en el organismo. El metabolismo de los fármacos se realiza principalmente en los hepatocitos a través de los enzimas asociados al citocromo P450.
Algunos fármacos, si no se detoxifican adecuadamente, pueden actuar como haptenos al unirse con proteínas intracelulares, o secretarse (en este caso se denominan prohaptenos) y contactar con células presentadoras de antígeno estimulando las células T y éstas pondrán en marcha una respuesta celular o mediada por anticuerpos.
Entre los fármacos que con más frecuencia pueden dar lugar a metabolitos reactivos, estarían el trimetoprim-sulfametoxazol, anticomiciales (fenitoína, carbamazepina, lamotrigina) y la procainamida.
Interacción farmacológica de los fármacos con receptores inmunes (p-i concept)
Este concepto propone una interacción de los medicamentos con el sistema inmune, que surge de la observación de que algunos fármacos, en su estado original y sin procesos metabólicos, pueden estimular las células T, incluso sin ser capaces de unirse covalentemente a macromoléculas(8).
El medicamento, o parte de él, puede interactuar directamente con un receptor de las células T (TCR) o con moléculas HLA (p-i HLA).
• p-i TCR: si el fármaco interacciona con determinados TCR, ante una segunda interacción con el TCR y las moléculas MCH de las células presentadoras de Ag, dará lugar a proliferación celular, producción de citocinas y citotoxicidad por las células T estimuladas.
• p-i HLA: en el modelo de HLA p-i, un fármaco se une preferentemente a una molécula de HLA-determinado. Esto explica la fuerte asociación para algunos alelos HLA de algunas reacciones de hipersensibilidad a fármacos(9). Las células T son tolerantes sólo a los péptidos del CMH a los que estaban expuestas durante su desarrollo en el timo, y el conjunto de los péptidos modificado puede ser interpretado como extraño por las células T.
Entre los medicamentos que tienen esta capacidad de interacción se encuentran: sulfametoxazol, lamotrigina, carbamazepina, alopurinol, abacavir, lidocaína y mepivacaína. Este mecanismo, sospechado a finales de los 90, podría estar implicado en reacciones de hipersensibilidad inducida por fármacos y como reacciones exfoliativas graves, como el síndrome de Stevens-Johnson(10) (tipo IVb, IVc de la clasificación de Gell y Coombs).
Solapamiento entre mecanismos
Los fármacos pueden generar respuestas inmunes por varios mecanismos simultáneamente; pueden estimular respuestas por interacción farmacológica y actuar como haptenos tras su metabolismo, por ejemplo, el sulfametoxazol y la carbamazepina. Esta superposición de mecanismos puede dar lugar a un cuadro clínico mixto, e imitar a una gran variedad de enfermedades, dificultando el diagnóstico.
Clasificación de las reacciones de alérgicas a fármacos
La correcta clasificación cronológica de las reacciones a fármacos, teniendo en cuenta la aparición de los síntomas en relación con la exposición al fármaco, nos indica que tipo de mecanismos podrían estar implicados en estas reacciones. La sintomatología de las reacciones puede a veces ser parecida en mecanismos patogénicos diferentes (la urticaria puede verse en una anafilaxia y en una enfermedad del suero, por ejemplo).
1. Cronológica (según la cadencia de aparición de los síntomas). Hasta hace unos años se siguió usando la clasificación que Levine presentó para clasificar las reacciones a penicilina(11). Ordenaba las reacciones basándose en el momento de la aparición de los síntomas:
• Inmediatas: 1-60 minutos tras la administración del fármaco.
• Aceleradas: 1-72 horas tras la administración del fármaco.
• Tardías: a partir de las 72 horas tras la administración del fármaco.
En la revisión de la nomenclatura alergológica realizada en 2003 por la WAO (World Allergy Organization)(2), se decidió dividirlas en tardías, las que aparecen después de una hora de la exposición al fármaco, e inmediatas, si se presentan antes de una hora desde la exposición.
1. Inmediatas: hay que tener en cuenta que, si la administración del fármaco es por vía oral, es posible que los síntomas se retrasen, especialmente si el medicamento se toma tras las comidas. Sin embargo, el periodo de una hora permite identificar a la gran mayoría de reacciones mediadas por IgE.
2. Tardías: la mayoría de las reacciones tardías suelen aparecer entre 6 horas tras la exposición y, en general, después de unos días de tratamiento, incluso después de haber cesado éste. Algunas reacciones tardías pueden iniciarse después de varias semanas de tratamiento continuo, por ejemplo, en el síndrome de hipersensibilidad inducida por fármacos.
2. Según el tipo de reacción. A pesar de los conocimientos posteriores sobre la patogénesis de las reacciones por hipersensibilidad y los posibles solapamientos de los mecanismos que las desencadenan, la antigua clasificación de Gell y Coombs sigue siendo útil.
Clásicamente, las reacciones inmunes se dividen en cuatro categorías (I, II, III, y IV) según la clasificación de Gell y Coombs, pero ésta se originó antes de conocer los distintos tipos de las células T; de modo que, posteriormente, las reacciones de tipo IV, se subdividieron en subtipo IVa, IVb, IVc y IVd.
Los fármacos causan con más frecuencia reacciones de los tipos I y IV, la mayoría de ellos causan sólo un tipo de reacción, pero algunos, como la penicilina, pueden causar reacciones de todos los tipos.
1. Tipo I: inmediatas, mecanismo mediado por IgE.
2. Tipo II: retardadas, mediante lisis célular, mediada, en general, por IgG.
3. Tipo III: retardadas, por depósito de inmunocomplejos y activación del complemento.
4. Tipo IV: inicio retardado, mediadas por células T.
La clasificación de una reacción alérgica es importante para determinar los procedimientos diagnósticos, las opciones para su tratamiento y las posibilidades de reactividad cruzada con medicamentos similares.
Patogénesis y manifestaciones clínicas de las reacciones alérgicas a fármacos
En pediatría, los tipos de reacciones más frecuentes quizá son los exantemas maculopapulosos retardados y, algo menos, las reacciones inmediatas. Sin embargo, las reacciones cutáneas graves por hipersensibilidad pueden verse también en edad pediátrica y debemos ser capaces de sospecharlas.
Reacciones tipo I (mediadas por IgE, anafilácticas)
Requieren una fase de sensibilización previa que dé lugar a la presencia de IgE específica frente al fármaco, o a un metabolito del mismo, que se una a la superficie de mastocitos y basófilos. Esta fase es asintomática. Una vez unida la IgE específica a mastocitos y basófilos, cuando el individuo se expone al fármaco, éste se une a las proteínas transportadoras y el complejo hapteno-portador puentea dos moléculas de IgE específica que está unida a la superficie celular de los mastocitos, causando la liberación de mediadores vasoactivos.
Estos mediadores ponen en marcha las manifestaciones clínicas, siendo las más comunes el prurito, la urticaria y el angioedema, que pueden presentarse simultáneamente. Si el edema afecta a la laringe, puede causar dificultad respiratoria con disfonía, estridor y, en raras ocasiones, asfixia; y también broncoespasmo, síntomas digestivos y/o hipotensión.
La vía de exposición al fármaco tiene también importancia en cuanto al tipo de sintomatología de una anafilaxia. Si la administración es parenteral, predominan los síntomas cardiovasculares y la hipotensión y en la administración oral predominan los síntomas cutáneos y respiratorios (Fig. 2).

Figura 2. Esquema fisiopatológico de la anafilaxia.
La anafilaxia es, potencialmente, fatal y es la presentación más grave de una reacción mediada por IgE. Debe sospecharse cuando una reacción de inicio brusco afecta a dos o más órganos o sistemas del paciente. Hay que recordar que la progresión rápida de los síntomas sugiere una mayor gravedad del episodio de anafilaxia y, en estos casos, la afectación cutánea puede aparecer más tardíamente.
Los fármacos más frecuentemente implicados en pediatría y en adultos en las reacciones inmediatas son los antibióticos betalactámicos y, por detrás de ellos: bloqueantes musculares, látex, otros antibióticos, citostáticos que contienen sales de platino y anticuerpos monoclonales.
Es posible que la exposición previa al fármaco sea desconocida por el paciente, o éste haberse sensibilizado a otro fármaco con reactividad cruzada al que cause la reacción.
Cronología de las reacciones tipo I: las reacciones de tipo I se presentan rápidamente tras la exposición al fármaco, influyendo en su cronología la vía de administración. Por vía endovenosa, los síntomas se pueden manifestar en segundos o minutos (3-30 min) y, por vía oral, desde pocos minutos en ayunas, hasta 10-60 minutos si se toma el fármaco después de comer.
En las reacciones inmediatas mediadas por IgE, si la administración es continua, los síntomas pueden no aparecer en algunos días durante el curso del tratamiento, pero si se saltan varias dosis, los síntomas pueden reaparecer al reanudar la administración.
Reacciones tipo II (lisis celular mediada por anticuerpos, citotóxicas)
Estas reacciones requieren la presencia previa de IgG (y, rara vez, IgM). Son reacciones poco frecuentes y se ven en individuos tratados con dosis elevadas, de forma prolongada o recurrente.
Surgen cuando el fármaco se une a proteínas de la superficie celular y actúa como antígeno, dando lugar a la síntesis de anticuerpos, que quedarán unidos a la membrana celular, de manera que posteriormente los macrófagos causan la lisis celular. El consumo de complemento es variable en este tipo de reacciones.
Manifestaciones clínicas y cronología de las reacciones tipo II: habitualmente dan lugar a anemia hemolítica, neutropenia o trombopenia y las manifestaciones clínicas corresponden a las de estas entidades; de modo que, el diagnóstico no es fácil y, en ocasiones, se lleva a cabo en una nueva exposición al fármaco en la que la recurrencia de los síntomas suele ser más precoz, aun con dosis bajas.
En cuanto a la gravedad del cuadro clínico, hay mucha disparidad, desde casos asintomáticos a cuadros clínicos fulminantes. La aparición es más frecuente entre los 5 y 8 días tras la exposición, pero el periodo de latencia puede prolongarse hasta meses.
Los fármacos implicados en este tipo de reacciones son variados y numerosos: quinidina, quinina, heparina, carbamazepina, abciximab, propiluracilo, y otros, muchos de ellos poco usados en edad pediátrica. La vancomicina, los betalactámicos y los antiinflamatorios no esteroideos son, también, fármacos causales de este tipo de reacciones y más frecuentemente usados en nuestros pacientes.
Reacciones tipo III (mediadas por inmunocomplejos)
Son reacciones poco comunes, en las que el medicamento actúa como un antígeno soluble y se une a anticuerpos específicos de tipo IgG, formando inmunocomplejos que precipitan en diferentes tejidos. Estos inmunocomplejos se unen a los receptores Fc de la IgG o a los receptores de las células inflamatorias, desencadenando este tipo de respuesta. Una nueva exposición al fármaco provoca la misma respuesta de forma más precozmente y con mayor gravedad.
Manifestaciones clínicas y cronología de las reacciones tipo III: los síntomas de las reacciones a medicamentos mediadas por inmunocomplejos suelen aparecer una semana o más tras la exposición al fármaco; cuando se alcanzan las cantidades suficientes de anticuerpos para generar los síntomas.
• Enfermedad del suero: la forma clásica se acompaña de fiebre, exantema urticarial o purpúrico, artralgias y/o glomerulonefritis aguda, y con frecuencia también adenomegalias. Se describió por primera vez a principios del siglo XX en pacientes tratados con suero antidiftérico de origen equino y sus causas más clásicas son las proteínas heterólogas.
Los medicamentos más frecuentemente implicados son los betalactámicos (especialmente, el cefaclor) y el trimetoprim-sulfametoxazol y, más recientemente, se han descrito con las globulinas antilinfocíticas, o antitimocito y con Ac. monoclonales. Se inicia entre 2 y 21 días tras la administración del fármaco.
• Vasculitis: se presentan como púrpuras palpables que suelen afectar a extremidades inferiores y, con menor frecuencia, pueden afectar al tracto gastrointestinal o al riñón. Además de los betalactámicos, se presentan por diuréticos tiazídicos, fenitoína y alopurinol.
• Fiebre medicamentosa: puede ser el único síntoma y, en algún caso, puede acompañarse de un exantema no urticarial. Los fármacos causales incluyen: azatioprina, sulfasalazina, minociclina, trimetoprim-sulfametoxazol, sirolimus y tacrolimus.
Reacciones tipo IV (mediadas por células)
Este tipo de reacciones mediadas por linfocitos T activados puede incluir a distintos tipos de células, como: macrófagos, eosinófilos o neutrófilos. Clínicamente, presentan manifestaciones cutáneas, ya que la piel es un depósito de células T(12), y muchas de estas células T cutáneas son células efectoras de memoria, que reaccionan si los antígenos penetran la barrera cutánea, o se difunden por la piel desde el torrente sanguíneo.
Son reacciones que requieren tiempo (desde horas a días tras la exposición al antígeno) para que se desarrolle la activación y expansión de las células T; de ahí que, también se denominen reacciones retardadas por hipersensibilidad.
Los mecanismos de tipo IV se relacionan con distintas presentaciones clínicas, y el mecanismo preciso para cada manifestación no está completamente demostrado.
Las células T son capaces de generar diferentes tipos de respuesta inflamatoria en dependencia de las citocinas producidas y de las otras células implicadas en la reacción, dando lugar a los distintos subtipos de reacciones tipo IV, y esto se refleja en los datos histológicos de la reacción inflamatoria. Por ello, la cronología de las reacciones es variable, pero siempre retardada. Este tipo de interacciones entre las células T y otras células efectoras se observa también en enfermedades infecciosas, autoinmunes y autoinflamatorias.
La clasificación de los subtipos de las reacciones mediadas por células se basa en las células efectoras implicadas, que se reflejan en los datos histológicos y datos de laboratorio de los pacientes. En este grupo de reacciones, debemos recordar que el solapamiento de los mecanismos de las reacciones inmunológicas es frecuente.
Reacciones tipo IVa
Mediadas por linfocitos Th1, con secreción de INF-?; TNFa, e IL-18, y activación de macrófagos.
• Dermatitis de contacto: es una reacción por fármacos de aplicación tópica que se caracteriza por eritema, con vesículas o flictenas que evolucionan a costras. Como en otros eccemas, las fases subagudas o crónicas se caracterizan por liquenificación y descamación. El periodo de latencia varía entre 7-21 días y se acorta con las exposiciones subsiguientes.
Reacciones tipo IVb
Las reacciones tipo IVb son secundarias a una respuesta Th2, con secreción de IL-4, IL-5, IL-13; que desencadenan síntesis de IgE e IgG4, desactivación de macrófagos y respuesta de mastocitos y basófilos. Estas reacciones pueden estar también implicadas en la fase tardía de la inflamación alérgica.
La IL-5 favorece la inflamación eosinofílica, característica de muchas reacciones por hipersensibilidad.
• Exantemas morbiliformes (maculopapulosos): pueden presentarse entre el 1-5% de la primera administración del fármaco. Son erupciones cutáneas de elementos rosados de diferente intensidad cromática, que pueden confluir entre sí, en las que el prurito es habitual, aunque la intensidad de este síntoma es variable. Las lesiones cutáneas son simétricas y consisten en maculopápulas que tienden a confluir; palmas, plantas y cara están preservadas y no hay lesiones urticariales.
En la mayoría de los casos, estas reacciones son leves y suelen resolverse un par de días después de retirar el fármaco, a veces con descamación.
Muchas veces obligan a realizar un diagnóstico diferencial con enfermedades exantemáticas, especialmente virales, que son más frecuentes en edad pediátrica(13).
Un exantema maculopapular que aparece varios días tras el inicio de un tratamiento sistémico es la forma más común de una reacción alérgica retardada a medicamentos(14,15). A diferencia de las reacciones mediadas por IgE, la mayoría de estas reacciones son mediadas por células T y pueden recurrir tras décadas de provocar la reacción.
A menudo las reacciones exantemáticas por fármacos en un paciente no sensibilizado previamente, aparecen tras un periodo de tiempo entre 4 y 21 días; así, un exantema que aparezca antes de 3 días del inicio del tratamiento, es más probablemente infeccioso que por hipersensibilidad a fármacos.
Los exantemas morbiliformes o maculopapulosos con una infiltración eosinofílica importante en la biopsia, probablemente son secundarios a reacciones tipo IVb.
• Síndrome de hipersensibilidad inducido por fármacos: citado en la literatura anglosajona como drug-induced hypersensitivity syndrome (DiHS), o también como drug rash with eosinophilia and systemic symptoms (DRESS).
Los síntomas aparecen usualmente antes de las 8 semanas de iniciado el tratamiento. Es una reacción grave por hipersensibilidad, que se presenta con exantema cutáneo, hipertermia, y puede presentarse también fallo multiorgánico(16). Hígado, riñón, corazón y pulmones son los órganos más afectados.
Ya que la eosinofilia se detecta en menos de la mitad de los casos, la presencia de linfocitos circulantes CD8+ atípicos, es el hallazgo diagnóstico más consistente y puede persistir meses después de retirar el fármaco.
En edad pediátrica, los fármacos más frecuentemente implicados son los anticomiciales (carbamazepina, fenitoína, fenobarbital…). Otros fármacos también implicados son minociclina, alopurinol, dapsona, abacavir y nevirapina.
Reacciones tipo IVc
Las reacciones de tipo IVc implican a células T efectoras citotóxicas, capaces de migrar al tejido inflamado y matar o inducir apoptosis de las células tisulares, como hepatocitos o queratinocitos.
Las células T citotóxicas son importantes en la patogénesis de múltiples reacciones retardadas, como: dermatitis de contacto, erupciones bullosas y hepatitis inducidas por fármacos.
• Síndrome de Stevens-Johnson (SJS), necrólisis epidérmica tóxica (TEN): son reacciones con mortalidad elevada y se caracterizan por fiebre alta, lesiones bullosas mucocutáneas, con necrosis y despegamiento de la epidermis. En la exploración, el signo de Nikolsky es positivo. En el SJS se pueden ver lesiones atípicas “en diana”, pero no las lesiones típicas del eritema multiforme minor.
El eritema multiforme minor, con lesiones típicas en diana pero sin afectación de mucosas, es de causa infecciosa la mayoría de los casos, y se observa especialmente por virus herpes y en edad pediátrica por Micoplasma pneumoniae(17). En el caso de que esté inducido por fármacos, aparece típicamente entre 1 y 2 semanas después de la exposición al fármaco.
El diagnóstico de uno u otro síndrome entre el SJS y la necrólisis epidérmica tóxica depende de la extensión de la necrolisis. Si es inferior al 10% se considera un SJS, si está entre el 10 y el 30% se considera un SJS-TEN y, si es superior al 30%, una necrólisis epidérmica tóxica.
Este tipo de reacción se cree debida a una expansión incontrolada de células T oligoclonales, estimuladas de forma masiva por el fármaco, recordando las reacciones por superantígenos.
• Reacciones órgano-específicas: ocasionalmente, la respuesta de las células T, de tipo IVc, puede afectar a órganos aislados, sin afectación cutánea, como la nefritis intersticial aislada, hepatitis inducida por fármacos o neumonitis, y el diagnóstico etiológico en estos casos es difícil.
Reacciones tipo IVd
Las reacciones tipo IVd dan lugar a una inflamación neutrofílica estéril mediada por células T. La pustulosis exantemática generalizada aguda, es un ejemplo de este tipo de reacción cutánea, que también se ha descrito en la enfermedad de Behçet y en la psoriasis pustulosa.
Reacciones de mecanismos mal conocidos
Autoinmunidad inducida por fármacos
A pesar de investigarse intensamente, su patogénesis es desconocida.
• Lupus inducido por fármacos: es el mejor ejemplo y los fármacos más comúnmente implicados son: procainamida, isoniazidas, fenitoína, amiodarona, minociclina y penicilamina.
• Se ha descrito también pseudopénfigo por penicilamina y la dermatitis bullosa por IgA se ha asociado con vancomicina, ceftriaxona, ciprofloxacino y metronidazol.
Exantema fijo pigmentario
No puede ser claramente clasificado, pero se demuestra síntesis de INF-? por las células T cutáneas(18). Es relativamente frecuente, y se caracteriza por placas eritematosas con un centro grisáceo, o con bullas francas. Las lesiones recurren exactamente en el mismo lugar, y desarrolla hiperpigmentación postinflamatoria.
Anafilaxia no inmune (no mediada
por IgE)
Estas reacciones idiosincrásicas, anteriormente denominadas “anafilactoides” y también “pseudoalérgicas” causan la liberación de mediadores vasoactivos por mecanismos no inmunológicos.
El clínico debe tener en cuenta que todas las formas de anafilaxia son potencialmente fatales. Sus manifestaciones clínicas y su gravedad son las mismas que las de una anafilaxia inmune y, por tanto, el modo de tratarlas debe ser idéntico.
Los fármacos más frecuentemente implicados en las anafilaxias no inmunes son: radio-contrastes, opiáceos, antiinflamatorios no esteroideos (AINES), vancomicina, quimioterápicos, anticuerpos monoclonales u otros fármacos biológicos usados en la terapia antineoplásica (Tabla II).
Diagnóstico
El diagnóstico en alergia a medicamentos debe ser de certeza, sobre todo si se da un diagnóstico negativo. Si esto no fuera posible, la prudencia aconsejaría retirar el medicamento al paciente. Los protocolos de diagnóstico suelen requerir una prueba de exposición controlada (PEC) y el grado de riesgo de ésta condiciona el protocolo diagnóstico.
El diagnóstico se basa en cuatro pilares, la historia clínica, las pruebas in vitro e in vivo, y la prueba de exposición controlada, que es la prueba de referencia.
Historia clínica
En la historia clínica se deben recoger, de forma sistemática y fidedigna, los síntomas y signos clínicos y su cronología y ésta es tarea del médico que atiende la reacción sospechosa.
La información que aporta la historia debería ser suficiente para:
• Confirmar que la reacción adversa es compatible con una reacción alérgica.
• Orientar hacia qué tipo de reacción de hipersensibilidad corresponde.
• Descartar otras causas no atribuibles al o a los fármacos sospechosos.
• Evaluar la indicación del estudio alergológico.
Para ello, deberían obtenerse los siguientes datos, especialmente en pacientes polimedicados:
• Nombre comercial y presentación del fármaco o fármacos implicados. (tener en cuenta los medicamentos que el paciente puede haber tomado sin prescripción médica).
• Cuándo fue la reacción y qué cuadro clínico motivó el uso del fármaco o fármacos sospechosos.
• Sintomatología de la reacción, gravedad de la misma, órganos afectados, descripción cuidadosa de las lesiones cutáneas (habones, máculas, pápulas, pústulas, bullas…) y su extensión.
• Intervalos de tiempo (para cada fármaco):
– Desde el inicio del tratamiento a la aparición de los síntomas.
– Desde la última dosis administrada.
• Historia de reacciones previas a otros fármacos.
• Tratamiento de la reacción (fármacos, necesidad de asistencia urgente o ingreso).
El diagnóstico, basado en la historia clínica, tiene limitaciones y, de hecho, en series largas de pacientes con sospecha de reacción inmediata a medicamentos, se produce respuesta en las pruebas de provocación en menos del 20%(19).
Esto puede deberse a diferentes motivos. Uno, que el fármaco no hubiera causado reacción alguna pero la relación temporal despertara la sospecha clínica y éste suele ser el más probable, pero otro motivo importante es que el recuerdo de los detalles de la historia clínica se diluye con el tiempo, y si no están documentados en la historia, los datos para programar el tipo de estudio a realizar, suelen ser insuficientes.
Otro motivo es la pérdida de sensibilidad de las respuestas mediadas por IgE con el tiempo, por ejemplo: hasta en el 80% de los pacientes alérgicos a la penicilina, a los 10 años de la reacción.
La historia clínica sigue siendo primordial, porque la prueba de exposición controlada suele ser necesaria para el diagnóstico y, si carecemos de información suficiente o la que tenemos es errónea, podemos exponer al paciente a riesgos innecesarios.
En el caso de las reacciones cutáneas retardadas graves por hipersensibilidad a fármacos, es interesante conocer los síntomas de alarma precoces(20) que nos pueden hacer sospecharlas y que se resumen en la tabla III.
Pruebas diagnósticas para reacciones inmediatas
Marcadores de anafilaxia:
• Triptasa: es detectable varias horas después de producirse una reacción anafiláctica y ser liberada por mastocitos y basófilos, a diferencia de la histamina, cuya elevación en sangre es muy fugaz. Aun así, la determinación de triptasa suele realizarse en reacciones intrahospitalarias.
Cualquier elevación de la triptasa es sugestiva de anafilaxia, pero los valores normales no excluyen el diagnóstico. Debe determinarse de forma seriada (entre 15 min y 3 h tras la reacción y a las 24 h), para obtener un valor basal que descarte una mastocitosis indolente.
Unos valores de triptasa descendentes (aun dentro de los valores normales) sugieren una anafilaxia. Si los valores basales se triplican, apoyan el diagnóstico de anafilaxia, ya que los valores basales son, en general, bastante constantes.
• Pruebas cutáneas para detectar IgE-específica al fármaco: el prick test y la intradermorreacción se usan para el diagnóstico de las reacciones inmediatas, detectando la IgE específica unida a los mastocitos cutáneos, y si aparece un habón con eritema entre 15 y 20 min tras la prueba, apoya el diagnóstico de una reacción de tipo I.
Se debe tener en cuenta que el fármaco no cause directamente la degranulación del mastocito como ocurre, por ejemplo, con los opioides, las quinolonas o la vancomicina. Por otro lado, las concentraciones del fármaco no deben ser irritantes.
Hay publicadas concentraciones recomendadas para pruebas cutáneas con una especificidad del 95% para betalactámicos, fármacos peroperatorios, heparinas, sales de platino y medios de radiocontraste(21). Otros fármacos en los que las pruebas cutáneas son útiles son las pirazolonas (metamizol) y los anestésicos locales.
La penicilina es una excepción y se dispone de metabolitos y complejos metabolito/proteína transportadora para diagnóstico, pero esto no ocurre con otros fármacos, por lo que se usa el fármaco en forma original (no metabolizado).
Un resultado positivo indica alergia, siempre que esté probado que las concentraciones usadas no son irritantes. Un resultado negativo NO excluye alergia al fármaco.
• Pruebas “in vitro”: determinación de IgE específica: se han desarrollado técnicas de detección de IgE específica (RAST, ELISA, CAP-RAST…) para numerosos fármacos, utilizando sueros de pacientes con pruebas cutáneas positivas para su estandarización, siendo útiles en laboratorios especializados de investigación. En el uso clínico común, a pesar de que existen comercializados métodos de detección de IgE específica para numerosos fármacos, muchos de ellos no han publicado su validación.
Disponemos de reactivos estandarizados y fiables sólo para algunos fármacos: penicilina, aminopenicilinas, cefaclor, insulina, toxoide tetánico, látex, gelatina… y pocos más. Las pruebas in vitro siguen considerándose menos sensibles que las pruebas in vivo(22). Como en el caso de las pruebas cutáneas, una IgE circulante negativa NO descarta alergia al fármaco.
• Activación de basófilos inducida por fármacos (TAB): este prometedor método se basa en medir los marcadores de superficie de activación del basófilo (CD63, CD203 y otros) mediante citometría de flujo. La determinación de los cistenil-leucotrienos por los leucocitos tras incubación aumenta el valor de la citometría aislada. Estas técnicas, sin embargo, están menos estandarizadas y se encuentran en desarrollo, pero no a disposición del clínico en todos los centros.
Pruebas diagnósticas para reacciones retardadas
A diferencia de las reacciones mediadas por IgE, la mayoría de estas reacciones son mediadas por células T y pueden recurrir tras décadas de ocurrir la reacción.
Pruebas para reacciones tipo II y tipo III
En las citopenias inmunes, en general mediadas por IgG y rara vez IgM, se utilizan métodos de detección de Ac frente a hematíes (T. de Coombs), o bien de Ac frente a plaquetas o neutrófilos.
Sin embargo, en las reacciones mediadas por inmunocomplejos (tipo III), no disponemos de métodos específicos y el diagnóstico se basa en la sintomatología clínica y los hallazgos de laboratorio. En ocasiones, los valores del complemento pueden ser útiles, así como la biopsia del tejido afectado.
Pruebas para reacciones tipo IV
• Pruebas de parche: el fármaco se prepara en vaselina o suero fisiológico y se aplica en cura oclusiva durante 48 horas, se retira y la lectura se hace a las 48 y 96 horas. Las concentraciones del fármaco para pruebas de parche están bien referenciadas para distintos medicamentos(21).
Las pruebas de parche son útiles para pacientes con exantemas maculopapulosos, pustulosis exantemática aguda generalizada, DiHS/DRESS y exantema flexural. No suelen ser positivas si el exantema es predominantemente macular (sin infiltración celular apenas), urticarial o en reacciones organoespecíficas (nefritis, hepatitis).
En general, el resultado es negativo en pacientes con reacciones exfoliativas (S. Stevens Johnson y TEN) en las que no se recomienda.
• Lectura tardía de la intradermorreacción (IDR): la concentración usada en la prueba no debe ser irritante y debe realizarse solamente si se dispone de una presentación inyectable. Previamente a la IDR, debe realizarse un prick test para descartar una reacción inmediata.
Esta prueba es un poco más sensible que la prueba de parche, pero algo menos específica. Las indicaciones son las mismas que para las pruebas de parche, y también están indicadas en el exantema fijo pigmentario. Son poco útiles en reacciones exfoliativas, maculares o urticariales. También, en edad pediátrica son poco rentables(23).
• Pruebas “in vitro”: incluyen test de transformación linfocitaria (TTL), de activación o de aumento de marcadores de activación, producción de citocinas y ensayos de citotoxicidad inducida por fármacos, y todos ellos se consideran herramientas de investigación. Si se dispone de ellos pueden ser útiles cuando las pruebas cutáneas son negativas.
La sensibilidad de las pruebas basadas en expansión o activación celular, y producción de citocinas es alta en DRESS, pero baja en reacciones exfoliativas. Las pruebas para citotoxicidad inducida por fármacos podrían ser interesantes en reacciones exfoliativas u organoespecíficas, pero siguen considerándose métodos de investigación y no están disponibles para uso clínico común.
Pruebas de exposición controlada (PEC)
Consisten en la administración gradual del medicamento bajo estricto control, y se han denominado también pruebas de provocación.
Indicaciones
La PEC se utiliza para excluir alergia al fármaco sospechoso; por tanto, solamente está indicada si es improbable que el paciente sea alérgico, y no debe llevarse a cabo si el paciente ha presentado una prueba positiva previamente (cutánea o in vitro).
Si la historia clínica y las pruebas complementarias son insuficientes para descartar una alergia a medicamentos, la indicación de una PEC se basará en la sospecha de causalidad, la gravedad de la reacción sospechosa, los riesgos propios del paciente y posibilidad de substituir con garantías el fármaco o aquellos que tengan reactividad cruzada con él, sin riesgo para el paciente.
En pediatría, los pacientes no suelen ser de alto riesgo, y uno de los motivos más frecuentes para realizar una PEC es la posibilidad de que ese paciente pierda la ocasión de recibir tratamiento con un fármaco de primera elección por una sospecha de alergia al mismo, indicándole fármacos con menor eficacia o mayores efectos secundarios.
Una PEC con tolerancia al fármaco estudiado, descarta la alergia al medicamento testado.
Contraindicaciones
La PEC está contraindicada en los siguientes tipos de reacciones(24):
• Erupciones bullosas generalizadas (necrólisis epidérmica tóxica, S. de Stevens-Johnson…).
• Pustulosis aguda generalizada.
• S. de hipersensibilidad inducido por fármacos (DHiS/DRESS).
• Vasculitis sistémicas.
• Manifestaciones organoespecíficas (citopenias, hepatitis…).
• Anafilaxia grave.
• Enfermedades autoinmunes inducidas por fármacos.
En algunos tipos de reacciones retardadas, cantidades mínimas del medicamento sospechoso pueden reactivar las reacciones y éstas, progresar a pesar de retirar el fármaco.
Requerimientos para realizar una PEC
Especialmente en las reacciones inmediatas, se debe contar con medios suficientes para diagnosticar y tratar una reacción anafiláctica. En cuanto al diagnóstico, tratamiento y manejo de la anafilaxia, es muy útil el documento de posición de la Sección Pediátrica de la EAACI(25). Estos requisitos deben aplicarse también en aquellas reacciones en que la historia clínica o las pruebas complementarias generen dudas acerca del tipo de reacción.
• Espacio físico adyacente a una UCI o unidad de reanimación.
• Presencia física de un médico y una enfermera entrenada en este tipo de pruebas.
• Acceso inmediato a un médico experto en reanimación y material necesario para la misma.
• Es obligado disponer de una hoja de consentimiento informado, firmada por el paciente, sus padres o tutores, antes de iniciar las pruebas.
No se debe administrar pre-medicación con antihistamínicos o corticoides, que pueden enmascarar síntomas precoces. El paciente debe estar clínicamente estable, especialmente en enfermos respiratorios y, en caso de recibir tratamiento con betabloqueantes, se deben retirar 24 h antes si es posible.
PEC en reacciones inmediatas
Se inicia con dosis bajas (tanto más, cuanto más grave fue la reacción sospechosa), en general a dosis de 1/1.000 o 1/100 de la dosis terapéutica, preferentemente por vía oral, siempre que sea posible (la vía parenteral da lugar a reacciones más precoces y graves). Se administran dosis crecientes con intervalos entre 30 y 60 minutos. En los pacientes con ansiedad o reacciones subjetivas, especialmente en escolares y adolescentes, se recomienda el uso de placebo.
PEC en reacciones retardadas
Los protocolos para erupciones exantemáticas retardadas están menos estandarizados. La variedad de los mecanismos implicados en estas reacciones y de sus manifestaciones clínicas hacen que el abordaje óptimo no sea bien conocido y los expertos tienen diferencias en la práctica. Algunas reacciones aparecen tras varios días de haber alcanzado la dosis terapéutica, o en presencia de una infección viral concomitante(23).
Los protocolos de exposición se basan en la cronología de la reacción sospechosa, y algunos de ellos utilizan intervalos entre las dosis a administrar hasta de una semana(26). Por tanto, hay algunos tipos de reacciones que no pueden provocarse con facilidad. Actualmente, no disponemos de pruebas de referencia para el diagnóstico de una alergia de tipo retardado(27).
Tratamiento de las reacciones
Ante la sospecha de una alergia a un medicamento, la primera medida es suspender su administración.
Reacciones de tipo I (inmediatas)
Si la manifestación clínica es una urticaria de aparición inmediata, que puede acompañarse de angioedema sin compromiso de otros órganos o sistemas, puede ser suficiente el uso de un antihistamínico. En general, si el prurito es intenso, se tiende a usar los de primera generación por su mayor capacidad sedante, pero son también útiles los de segunda generación.
Ante la sospecha de una reacción anafiláctica, hay que recordar que, en pediatría, no hay contraindicaciones absolutas para el uso de adrenalina, y que en la mayoría de reacciones anafilácticas graves o incluso letales, o no se ha administrado, o se ha administrado tardíamente este fármaco.
La mayoría de las reacciones anafilácticas no van a acabar en un choque anafiláctico, pero la mejor forma de que esto no ocurra es la administración precoz de adrenalina si los síntomas sugieren una posible reacción grave o progresan muy rápidamente; y siempre por vía intramuscular(25,28), que proporciona mayor eficacia y rapidez de actuación que la subcutánea, y mayor nivel de seguridad que la vía endovenosa (Tabla IV).
Reacciones retardadas
Las urticarias tardías y los exantemas maculopapulosos leves se beneficiarán del efecto antipruriginoso de los antihistamínicos.
En los exantemas maculopapulosos no complicados, no se aconseja el uso de corticoides. Si la sintomatología sugiere una reacción grave por hipersensibilidad, un tratamiento corto con corticoides (prednisona a 1-2 mg/kg/día) puede ser de utilidad(29).
En las dermatitis de contacto, son útiles los corticoides tópicos de potencia media o incluso alta, en el tratamiento de lesiones agudas; pero, en el caso de que existan flictenas en un eccema agudo, deberemos recurrir a los corticoides sistémicos.
Las reacciones de hipersensibilidad graves, con lesiones descamativas extensas, como el síndrome de Stevens Johnson o la necrólisis epidérmica tóxica, requieren un tratamiento multidisciplinar y pueden requerir ingreso en unidades especializadas de cuidados intensivos.
Opciones terapéuticas alternativas
Uso de fármacos no relacionados
Es la opción más sencilla y más segura en cuanto a la hipersensibilidad y, por tanto, la primera opción; sin embargo, los tratamientos de segunda línea pueden tener otros inconvenientes a tener en cuenta: menor eficacia, mayor coste, más efectos secundarios y favorecer resistencias microbianas.
Uso de fármacos relacionados
Una segunda opción sería utilizar fármacos químicamente relacionados. La probabilidad de que exista reactividad cruzada es menor en las reacciones mediadas por células T que en las reacciones mediadas por IgE.
En este caso, un prick previo es informativo (si es negativo sugiere tolerancia) y es recomendable en función de la situación clínica del paciente someterlo a una prueba de exposición controlada con el fármaco. La reactividad cruzada entre grupos de fármacos es distinta entre los grupos y el enfoque debe ser específico.
En el caso de los betalactámicos y sintetizando, la reactividad cruzada va a depender de si el paciente está sensibilizado al anillo betalactámico, con lo que la alergia puede ser múltiple, o bien la sensibilización implica a las cadenas laterales de la moléculas, con lo que el paciente puede presentar reactividad cruzada con los betalactámicos, que compartan la cadena lateral.
Los alérgicos a penicilina, o a amoxicilina, tienen más riesgo de presentar reacción con cefalosporinas de primera generación que, con las de segunda o tercera generación, y menos aún con carbapenemos o monobactamos(30,31). En la tabla V, figuran las reactividades cruzadas entre los betalactámicos de mayor uso, de forma orientativa (Tabla V).
Otro grupo de fármacos importante para el pediatra son los anticomiciales, y, entre ellos, puede existir también reactivad cruzada.
Desensibilización del fármaco causal
La desensibilización es una técnica que puede ser adecuada y útil para les reacciones de tipo I (mediadas por IgE), consiste en la administración escalonada del fármaco y se ha utilizado también en otras reacciones a medicamentos, tanto inmunológicas como no inmunológicas. Debe llevarse a cabo por personas con la formación y experiencia necesarias para ello, y sólo en situaciones en que el fármaco sea imprescindible.
Función del pediatra de Atención Primaria
La función del pediatra en cuanto a la alergia a medicamentos es importante. La prevención de sensibilizaciones en lo posible, el tratamiento de las reacciones en el momento agudo, la recogida de los datos clínicos imprescindibles para el estudio alergológico y su derivación temprana, son actos que corresponden al pediatra.
Para la prevención de la alergia a antibióticos hay que limitar su uso innecesario, y ello, no sólo requiere limitar la prescripción, sino tratar los cuadros clínicos que predisponen a infecciones, por ejemplo: el asma debe estar correctamente controlada, y también las rinitis alérgicas que están muy frecuentemente infratratadas y son causa común de sinupatías y otitis por sobreinfección.
La recogida de los datos de la reacción en la historia clínica es fundamental y no vamos a insistir en ello, si estos datos constan en la historia siempre se dispondrá de ellos. Si no hay datos en la historia, ni el pediatra ni la familia suelen ser capaces de recordarlos, y el estudio alergológico se va a basar en datos poco fiables.
En la historia el paciente, debe constar de forma llamativa la sospecha de alergia al fármaco implicado y se hará desaparecer de la historia si se descarta tras el estudio, cosa que, con frecuencia, se olvida.
En cuanto a la derivación a asistencia especializada, un problema frecuente con que se encuentra el especialista es que recibe a pacientes para estudio que presentaron una sospecha de reacción a un fármaco en sus primeros meses de vida y que acuden a estudio cuando requiere tratamiento con varios años de edad con el fármaco sospechoso.
Además de la pérdida de información con el tiempo transcurrido, esto da lugar a la negativización de los datos analíticos y de la mayoría de las pruebas in vivo; de manera que, obliga a pruebas de exposición prácticamente siempre. El periodo ideal para hacer un estudio alergológico a medicamentos sería entre 3 semanas y tres meses tras la reacción, aunque la carga asistencial de algunos centros de atención especializada no permita la asistencia en este periodo, hay que remitirlo precozmente.
Si el alergólogo no puede ver al paciente en un periodo de tiempo inferior a un año, puede ser muy útil que el pediatra solicite una IgE específica frente al fármaco a partir de las 3 semanas de una reacción inmediata, acompañado de una determinación de IgE total (los valores muy altos de la IgE total hacen perder especificidad a la determinación de IgE específica) para los que disponemos de ensayos validados. En pediatría, los betalactámicos son los más sospechosos y disponemos de determinaciones fiables para: penicilina G, penicilina V, amoxicilina, ampicilina y cefaclor.
La edad del paciente no debe tenerse en cuenta para un estudio alergológico de ningún tipo, y tampoco para los fármacos.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.* Cortada Macías JM, López Serrano MC, Blasco Sarramián A, Mayorga C, Torres MJ. Introducción, conceptos generales, epidemiología. Fisiopatología: los fármacos como antígenos. En: Peláez Hernández A, Dávila González IJ, eds. Tratado de Alergología. Madrid: Ergon; 2007. p. 1297.
2. Johansson SGO, Bieber T, Dahl R, Friedmann PS, Lanier BQ, Lockey RF, et al. Revised nomenclature for allergy for global use: Report of the Nomenclature Review Committee of the World Allergy Organization, October 2003. J Allergy Clin Immunol. 2004; 113(5): 832-6.
3. Demoly PBJ. Epidemyology of drug allergy. Curr Opin Allergy Clin Immunol. 2001; 1: 305.
4. Daubner B, Groux-Keller M, Hausmann OV, Kawabata T, Naisbitt DJ, Park BK, et al. Multiple drug hypersensitivity: normal Treg cell function but enhanced in vivo activation of drug-specific T cells. Allergy. 2012; 67(1): 58-66.
5. Chung W, Hung SI, Hong HS. Medical Genetics: a marker for Stevens-Johnson syndrome. Nature. 2004; 428: 486.
6. Baldo BA, Fisher MM, Pham NH. On the origin and specificity of antibodies to neuromuscular blocking (muscle relaxant) drugs: an immunochemical perspective. Clin Exp Allergy. 2009; 39(3): 325-44.
7. Brander C, Mauri-Hellweg D, Bettens F, Rolli H, Goldman M, Pichler WJ. Heterogeneous T cell a response to beta-lactam-modified self-structures are observed in penicillin-allergic individuals. J Immunol. 1995; 155(5): 2670-8.
8. Pichler WJ. Pharmacological interaction of drugs with antigen-specific immune receptors: the p-I concept. Curr Opin Allergy Clin Immunol. 2002; 2(4): 301.
9. Adam J, Eriksson KK, Schnyder B, Fontana S, Pichler WJ, Yerly D. Avidity determines T-cell reactivity in abacavir hypersensitivity. Eur J Immunol. 2012; 42(7): 1706-16.
10. Wei C, Chung W, Huang H, Chen Y, Hung S. Direct interaction between HLA-B and carbamazepine activates T cells in patients with Stevens-Johnson syndrome. J Allergy Clin Immunol. 2012; 129(6): 1562-1569.e5.
11. Levine BB. Immunologic Mechanisms of Penicillin Allergy. N Engl J Med. 1966 11/17; 2013/07; 275(20): 1115-25.
12. Clark RA, Chong B, Mirchandani N, Brinster NK, Yamanaka K, Dowgiert RK, et al. The Vast Majority of CLA+ T Cells Are Resident in Normal Skin. J Immunol. 2006; 176(7): 4431-9.
13.** Stern RS. Exanthematous Drug Eruptions. NEJM. 2012; 366(26): 2492.
14.** Romano A, Blanca M, Torres MJ, Bircher A, Aberer W, Brockow K, et al. Diagnosis of nonimmediate reactions to ß-lactam antibiotics. Allergy. 2004; 59(11): 1153-60.
15. Yawalkar N, Pichler WJ. Immunohistology of drug-induced exanthema: clues to pathogenesis. Curr Opin Allergy Clin Immunol. 2001; 1(4): 299-303.
16. Cacoub P, Musette P, Descamps V, Meyer O, Speirs C, Finzi L, et al. The DRESS Syndrome: A Literature Review. Am J Med 2011; 124(7): 588-97.
17. Schalock PC, Dinulos JGH, Pace N, Schwarzenberger K, Wenger JK. Erythema Multiforme due to Mycoplasma pneumoniae Infection in Two Children. Pediatr Dermatol. 2006; 23(6): 546-55.
18. Mizukawa Y, Shiohara T. Fixed drug eruption: a disease mediated by self-inflicted responses of intraepidermal T cells. Curr Allergy Asthma Rep. 2009; 9(1): 71.
19. Messaad D, Sahla H, Benahmed S, Godard P, Bousquet J, Demoly P. Drug Provocation Tests in Patients with a History Suggesting an Immediate Drug Hypersensitivity Reaction. Ann Intern Med 2004; 140: 1001.
20.** Bircher AJ. Symptoms and danger signs in acute drug hypersensitivity. Toxicology. 2005; 209(2): 201-7.
21.** Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013; 68(6): 702.
22. Fontaine C, Mayorga C, Bousquet PJ, Arnoux B, Torres M, Blanca M, et al. Relevance of the determination of serum-specific IgE antibodies in the diagnosis of immediate ?-lactam allergy. Allergy. 2007; 62(1): 47-52.
23. Blanca-López N, Zapatero L, Alonso E, Torres MJ, Fuentes V, Martínez-Molero MI, et al. Skin testing and drug provocation in the diagnosis of nonimmediate reactions to aminopenicillins in children. Allergy. 2009; 64(2): 229-33.
24. Aberer W, Bircher A, Romano A, Blanca M, Campi P, Fernández J, et al. Drug provocation testing in the diagnosis of drug hypersensitivity reactions: general considerations. Allergy. 2003; 58(9): 854-63.
25.*** Muraro A, Roberts G, Clark A, Eigenmann PA, Halken S, Lack G, et al. The management of anaphylaxis in childhood: position paper of the European academy of allergology and clinical immunology. Allergy. 2007; 62(8): 857-71.
26. Romano A, Gaeta F, Valluzzi RL, Alonzi C, Viola M, Bousquet PJ. Diagnosing Hypersensitivity Reactions to Cephalosporins in Children. Pediatrics. 2008; 122(3): 521-7.
27. Schnyder B, Pichler WJ. Nonimmediate drug allergy: Diagnostic benefit of skin testing and practical approach. J Allergy Clin Immunol. 2012; 129(4): 1170-1.
28. Simons FER, Gu X, Simons KJ. Epinephrine absorption in adults: Intramuscular versus subcutaneous injection. J Allergy Clin Immunol. 2001; 108(5): 871-3.
29. Schneck J, Fagot JP, Sekula P, et al. Effects of treatments on the mortality of Stevens-Johnson syndrome and toxic epidermal necrolysis: A retrospective study on patients included in the prospective EuroSCAR Study. J Am Acad Dermatol. 2008; 58: 33.
30. Baldo BA. Penicillins and cephalosporins as allergens: structural aspects of recognition and cross-reactions. Clin Exp Allergy. 1999; 29(6): 744-9.
31. Romano A, Gaeta F, Valluzzi RL, Caruso C, Rumi G, Bousquet PJ. IgE-mediated hypersensitivity to cephalosporins: Cross-reactivity and tolerability of penicillins, monobactams, and carbapenems. J Allergy Clin Immunol. 2010; 126(5): 994-9.
Bibliografía recomendada
– Cortada Macías JM, López Serrano MC, Blasco Sarramián A, Mayorga C, Torres MJ. Introducción, conceptos generales, epidemiología. Fisiopatología: los fármacos como antígenos. En: Peláez Hernández A, Dávila González IJ, eds. Tratado de Alergología. Madrid: Ergon; 2007. p. 1297.
Interesante como texto de consulta. Es un tratado de alergología general.
– Stern RS. Exanthematous Drug Eruptions. NEJM. 2012; 366(26): 2492.
Excelente artículo con un interesante diagnóstico diferencial con enfermedades exantemáticas pediátricas.
– Romano A, Blanca M, Torres MJ, Bircher A, Aberer W, Brockow K, et al. Diagnosis of nonimmediate reactions to ß-lactam antibiotics. Allergy. 2004; 59(11): 1153-60.
Bien estructurado artículo del Grupo de interés en hipersensibilidad a fármacos de ENDA/EAACI.
– Bircher AJ. Symptoms and danger signs in acute drug hypersensitivity. Toxicology. 2005; 209(2): 201-7.
Interesante desde el punto de vista del clínico. Datos de alarma precoces.
– Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs – an ENDA/EAACI Drug Allergy Interest Group position paper. Allergy. 2013; 68(6): 702.
Útil para planificar pruebas cutáneas con concentraciones validadas.
– Muraro A, Roberts G, Clark A, Eigenmann PA, Halken S, Lack G, et al. The management of anaphylaxis in childhood: position paper of the European academy of allergology and clinical immunology. Allergy. 2007; 62(8): 857-71.
Imprescindible. El correcto tratamiento de una anafilaxia debe ser conocido por todo pediatra.
| Caso clínico |
|
Niña de 4 años que a los 18 meses se remitió a la Sección de Alergia por sospecha de alergia a la amoxicilina. Se trata de una paciente de origen ruso, sin datos de interés en los antecedentes personales, y en los antecedentes familiares, que son anodinos, destaca que ambos padres tienen una alergia a penicilina (no estudiada). La enfermedad actual comienza el 27 de abril de 2011, con un cuadro de fiebre sin foco, para el que la madre le administra ibuprofeno y ese mismo día inicia una diarrea que trata con dieta y dura unas 24 horas. Vuelve a presentar fiebre el 2 de mayo y su pediatra diagnostica una faringoamigdalitis y le prescribe amoxicilina. La fiebre persiste y el 6 de mayo acude a urgencias por un exantema que en el informe de urgencias se describe como una urticaria de habones confluentes. Se retiró la amoxicilina, el exantema persistió dos días más. No requirió tratamiento. Sin embargo, la madre explicaba que las lesiones que persistieron fijas unos días no eran evanescentes, no eran pruriginosas, apenas eran sobreelevadas y las describía como un exantema maculopapular; lo que era discordante con las lesiones descritas en el informe de urgencias. La madre apreció las lesiones cutáneas al despertarla, con lo que no se puede saber el intervalo exacto desde la última toma de amoxicilina. Al explicarle las características de los habones, comentó que eso le salía con la tortilla y el huevo pasado por agua. Tolera el huevo cocido y la bollería. Al interrogar a la madre sobre otros fármacos administrados, recuerda que el 26 de abril se le había administrado la vacuna triple vírica. Había vuelto a tomar ibuprofeno después de este cuadro clínico tan abigarrado, con buena tolerancia. Se realizaron pruebas cutáneas a amoxicilina (prick test e intradermorreacción), que fueron negativas. Se determinó IgE específica frente a amoxicilina y peniciloil G que fueron negativas. Se hicieron también pruebas cutáneas a clara de huevo, ovoalbúmina y ovomucoide, siendo positivas a clara y a ovoalbúmina, pero no al ovomucoide; concordando con la historia clínica y la tolerancia a huevo cocido pero no crudo. Se sometió a la paciente a PEC a amoxicilina sin presentar efecto adverso alguno, descartándose alergia a la misma. |