|
| Temas de FC |
L. Prieto-Torres, A. Torrelo
Servicio de Dermatología. Hospital Infantil Niño Jesús, Madrid
| Resumen
El eczema es un concepto clínico-patológico que comprende una serie de enfermedades dermatológicas que comparten una serie de manifestaciones clínicas en forma de pápulas y placas con: eritema, edema, vesiculación, descamación, hiperqueratosis, fisuración, excoriación y liquenificación, con un patrón histológico donde predomina la espongiosis en la epidermis. Clásicamente, estas enfermedades se clasifican, en función de su origen, en: exógenas y endógenas. Los últimos descubrimientos apuntan a una importante implicación: la de función barrera de la piel y las proteínas que la componen, en concreto la filagrina, en el desarrollo, tanto de la dermatitis atópica (DA) como principal representante de los eczemas endógenos, como de la dermatitis alérgica de contacto (DAC), como principal representante de los exógenos. Hasta un 20% de la población infantil se ha visto afecta por DA y un correcto diagnóstico y manejo de la misma es fundamental para el pronóstico y la calidad de vida de los niños afectados por la enfermedad. |
| Abstract
Eczema is a clinicopathologic concept comprising a number of dermatological diseases that share a series of clinical manifestations, that include papules and plaques with erythema, edema, blistering, scaling, hyperkeratosis, fissuring, excoriation and lichenification, as well as a histological pattern with spongiosis in the epidermis. Classically, eczema is classified according to its origin in exogenous and endogenous. Recent discoveries point to an important implication of the skin barrier function and epidermal proteins, in particular filaggrin, in the development both of atopic dermatitis (AD) as the main representative of endogenous eczema and allergic contact dermatitis (ACD) as the main representative of exogenous eczema. Up to 20% of children are affected by AD, and proper diagnosis and management are essential for the prognosis and quality of life of these children. |
Palabras clave: Eczemas; Dermatitis atópica; Dermatitis alérgica de contacto; Dermatitis seborreica; Dermatitis del pañal
Key words: Eczema; Atopic dermatitis; Allergic contact dermatitis; Seborrheic dermatitis; Diaper dermatitis
Pediatr Integral 2016; XX (4): 216-226
Dermatitis atópica y otras erupciones eczematosas
Introducción
Las enfermedades dermatológicas son frecuentes en los niños y, dentro de ellas, las más habituales son las eccematosas, que comprenden eczemas de tipo endógeno y exógeno en función de su etiología.
El término eczema o eccema engloba una serie de dermatosis con un patrón clínico e histológico de inflamación cutánea característicos. Algunos autores utilizan “eczema” y “dermatitis” como sinónimos, pero, aunque todos los eczemas son dermatitis, no todas las dermatitis son eczemas.
Clínicamente, las dermatosis eccematosas se caracterizan por presentar prurito y escozor en grados variables como principal síntoma, acompañados de lesiones cutáneas en forma de pápulas y placas con: eritema, edema, vesiculación, descamación, hiperqueratosis, fisuración, excoriación y liquenificación. En algunos eczemas, como el atópico o el de contacto alérgico, las lesiones evolucionan con el tiempo, desde formas más agudas donde predominan el edema y la vesiculación, a formas más crónicas donde predominan la excoriación y la liquenificación. Histológicamente, es muy característico de estas lesiones la presencia de espongiosis y acantosis en epidermis, acompañadas de edema e infiltrado inflamatorio en dermis superficial, que puede variar en intensidad y en la naturaleza de las células que lo componen en función de la etiología.
Existen numerosos tipos de eczemas con características clínicas y etiología diferentes. Clásicamente, se ha utilizado para clasificarlos una división en exógenos y endógenos, en función del origen de su causa, que tiene implicaciones en el tratamiento, ya que los exógenos se resuelven eliminando el agente causal y los endógenos generalmente requieren tratamientos farmacológicos más agresivos y con un curso más variable (Tabla I).
Esta clasificación es un tanto artificial, ya que está ampliamente demostrado que las características genéticas de cada individuo, en especial las relacionadas con los componentes de la barrera cutánea, como es el caso de las mutaciones en el gen de la filagrina(1), no solo influyen en el desarrollo de la dermatitis atópica (DA) y otros eczemas endógenos, sino que también hacen al individuo más susceptible de desarrollar eczemas exógenos, como se ha demostrado en el caso de la dermatitis alérgica de contacto (DAC). También, se han relacionado factores ambientales con el desarrollo y empeoramiento de algunos eczemas endógenos, como la DA. En este capítulo, nos centraremos en la dermatitis atópica, como principal forma de eczema en la infancia, y desarrollaremos también otras dermatosis eccematosas relevantes en la edad pediátrica, para facilitar su diagnóstico y clarificar como realizar un buen manejo desde una consulta de Pediatría en Atención Primaria.
Dermatitis atópica
La dermatitis atópica es una enfermedad crónica inflamatoria de la piel muy frecuente en la infancia, cuyo síntoma principal es el prurito. Los pacientes con DA requieren un seguimiento estrecho por pediatras y dermatólogos para un correcto control de la enfermedad y de sus posibles complicaciones.
Epidemiología
La DA o eczema atópico se define como una enfermedad inflamatoria pruriginosa y crónica de la piel, que cursa en brotes recidivantes y que se asocia a menudo con una IgE sérica elevada e historia personal o familiar de hipersensibilidad tipo I, rinitis alérgica y asma(2).
El concepto de marcha atópica se introdujo para explicar la tendencia al desarrollo de asma y rinitis alérgica posteriores a la aparición de la DA(3), lo cual podría indicar un papel iniciador de esta en el desarrollo del proceso. Además, se ha postulado que las alergias alimentarias podrían incluirse en esta marcha atópica(4) y que la alteración de la barrera cutánea por mutaciones en el gen de la filagrina, explicarían parte de la fisiopatología del proceso a través de una sensibilización percutánea.
La DA es más frecuente en niños que en adultos. Se estima que afecta a más de un 20% de la población infantil en países occidentales y entre un 2-3% de los pacientes adultos.
El inicio de la enfermedad se produce durante el primer año de vida en un 60% de los pacientes, más frecuentemente entre los 3 y los 6 meses.
Etiopatogenia y factores asociados con el desarrollo de DA
La DA tiene un claro componente genético en su etiología, demostrado por la mayor prevalencia de la enfermedad en los pacientes con historia familiar de DA (hasta un 70% de los pacientes con DA tienen familiares atópicos, con un riesgo 2-3 veces mayor si tienen un padre atópico y 3-5 veces mayor si ambos padres lo son(5).
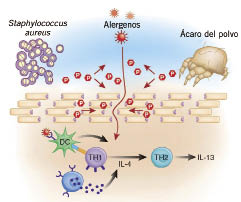
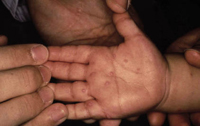
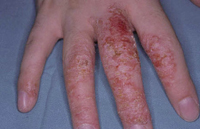
En lo que respecta a estos factores genéticos y endógenos, las últimas teorías acerca de la etiopatogenia de la DA y de los síndromes que incluyen el eczema atópico y/o el asma entre sus manifestaciones, apuntan a que no solo hay un problema de disregulación de la respuesta inmunitaria, que se ha relacionado con mutaciones en diversos genes relacionados con la producción de la IgE y algunas citoquinas(6) que causan una respuesta Th2 exagerada en los individuos atópicos(7), sino que también, existen mutaciones en proteínas epiteliales epidérmicas que alteran la función barrera de la piel, lo cual a su vez puede provocar una hiperestimulación antigénica del sistema inmune cutáneo a través de esta. Se han identificado, por un lado, mutaciones con pérdida de función en el gen de la filagrina, que provocan alteraciones en el citoesqueleto y en las uniones intercelulares de las células del estrato córneo, que conducen a una deficiente barrera cutánea. Por otro lado, las mutaciones en el gen SPINK5, que codifica la proteína LEKT1, un inhibidor de serín-proteasas expresadas en epidermis y mucosas con una función importante también en el mantenimiento de una buena función barrera epitelial, originan el síndrome de Netherton, en el que los pacientes presentan DA grave. También, se han observado cambios en la secuencia del gen SPINK5 en pacientes atópicos que no tienen este síndrome(8).
Estas mutaciones en proteínas estructurales, en concreto las mutaciones en la filagrina, se han relacionado no solo con la aparición de la enfermedad, sino con: una mayor gravedad clínica, un inicio precoz, un aumento de producción de IL-1? en el estrato córneo, presencia de hiperlinealidad palmar, dermatitis fisurada del dorso de las manos, niveles superiores de IgE sérica, aumento de sensibilización alérgica, aumento del riesgo de asma y aumento hasta 10 veces del riesgo de eczema herpéticum(1).
Respecto a cómo influyen los factores exógenos en la aparición de DA y en su empeoramiento, hay mucha controversia, especialmente en lo que se refiere a los factores de la dieta. Se publicó recientemente una revisión de Cochrane sobre las dietas y la DA, donde se concluye que hay poca evidencia de que el uso de dietas que excluyen alimentos, como la leche de vaca, sean beneficiosas para los pacientes con DA. Esto no significa que no sean necesarias para los pacientes con alergia probada a la leche de vaca. También, concluyen que podría haber algún beneficio del uso de dieta sin huevo en pacientes atópicos con IgE específica frente a proteína del huevo en sangre, pero no parece haber ningún beneficio en el uso de dietas con exclusión de muchos alimentos en pacientes no seleccionados con eczema atópico(9). Un metaanálisis sobre novedades publicadas en DA indica que no existe una evidencia científica para recomendar los alimentos orgánicos como una forma de prevenir la aparición de DA.
Por último, diversos estudios demuestran que vivir en un medio urbano supone un riesgo añadido para padecer DA frente a los niños que viven en el medio rural(10). En relación a esto, el riesgo de desarrollo de DA por la convivencia con mascotas no está claro. Parece ser que la convivencia con gatos, pero no con perros, puede potenciar el efecto de las mutaciones de la filagrina en el desarrollo de DA. Por el contrario, los perros, la exposición a endotoxinas y los animales de granja podrían proteger frente al desarrollo de DA. No hay conclusiones claras sobre el uso de antibióticos en los lactantes y el desarrollo posterior de DA.
Manifestaciones clínicas
Prurito y DA
El síntoma principal y el que más morbilidad ocasiona a los pacientes con DA es el prurito. Los mediadores y el mecanismo por el que se produce no han podido esclarecerse por el momento. Una forma de evaluar las causas del prurito en los pacientes atópicos, es la respuesta frente a los distintos tratamientos que se administran para mejorarlo. Pese a que se creía que la degranulación mastocitaria mediada por IgE podría ser importante en el eczema atópico, la histamina no es el mediador principal del prurito en la atopia y los antihistamínicos tienen generalmente poco efecto sobre este en los pacientes atópicos. Los antiH1 de primera generación, por su acción sedante, mejoran la sensación subjetiva de confort y permiten un sueño más profundo, mejorando el descanso de los niños atópicos. La ciclosporina les mejora rápidamente el prurito, lo que podría indicar el papel etiopatogénico de los linfocitos mediante la producción de citoquinas y prostaglandinas(11). Los neuropéptidos, los opiodes, algunas proteasas y la kalicreína, entre otros, también se han relacionado con el prurito que se produce en la DA.
Lesiones cutáneas características de DA
Las lesiones cutáneas no son iguales en todos los pacientes con DA. Para facilitar el estudio y la clasificación de estas lesiones, se pueden dividir en dos grandes formas: la DA clásica y las formas menores o atípicas de DA(12).
La dermatitis atópica clásica se caracteriza por una combinación de:
1. Lesiones tipo prurigo, consistentes en pápulas inflamatorias coronadas por una vesícula que aparece erosionada por el rascado en muchas ocasiones.
2. Lesiones tipo eczema, en forma de pápulas y placas con vesiculación, fisuración y costras, que pueden ser a su vez: agudas, con mayor edema y exudación, más propias de los lactantes; subagudas, con abundantes costras seguidas de descamación; y, por último, más crónicas y secas, propias de niños más mayores y adolescentes, generalmente.
3. Lesiones de liquenificación, que consisten en placas con importante engrosamiento dermo-epidérmico y aumento de los pliegues cutáneos superficiales, que se deben en gran medida al rascado crónico de las otras lesiones cutáneas y que suelen presentar también signos de este (escoriaciones y erosiones).
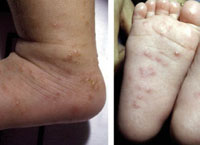
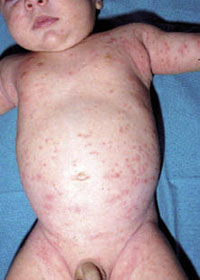
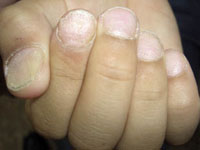
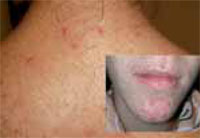
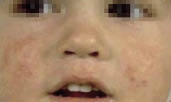
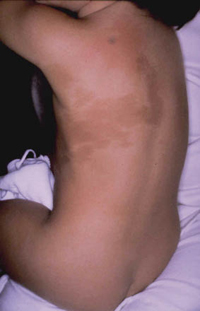
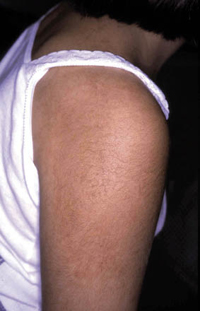
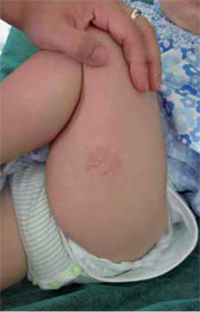
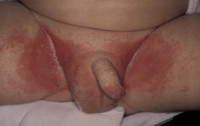
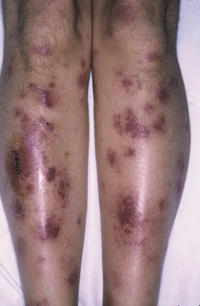
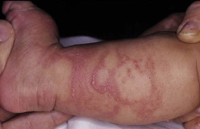
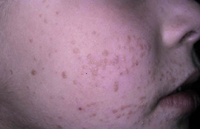
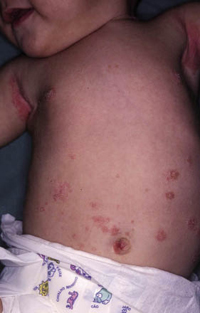
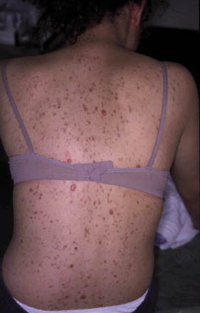
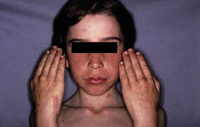
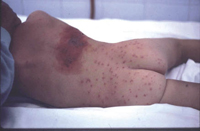
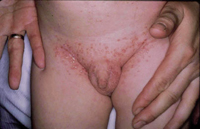
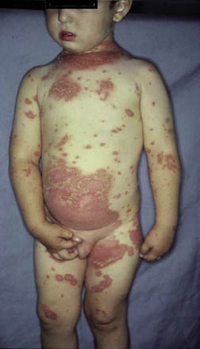
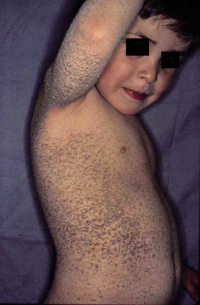
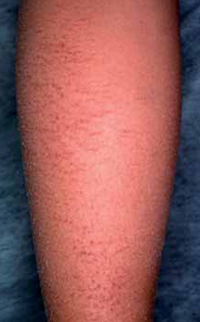
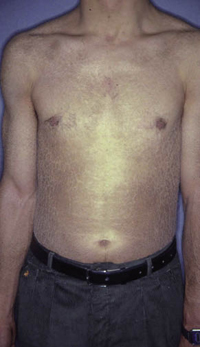
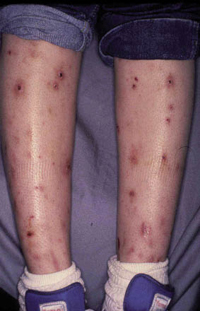
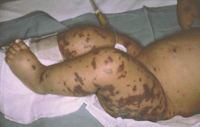
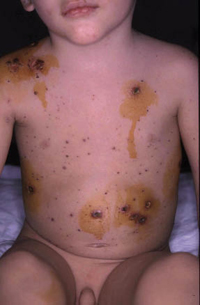
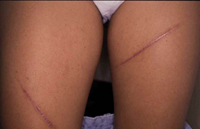
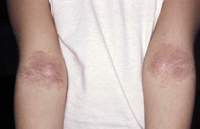
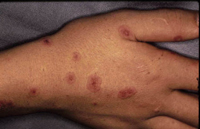
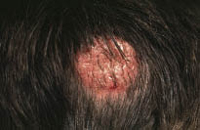
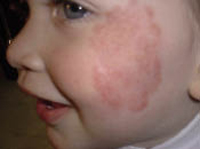
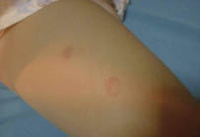
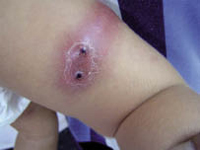
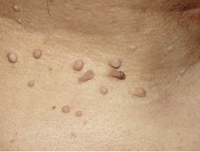
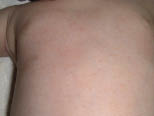
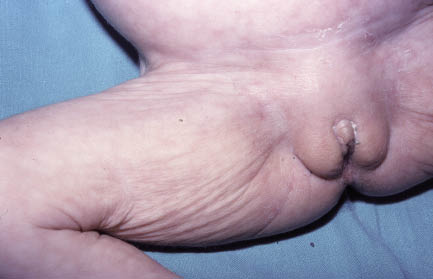
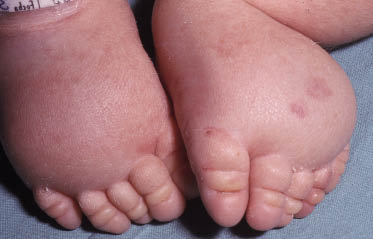
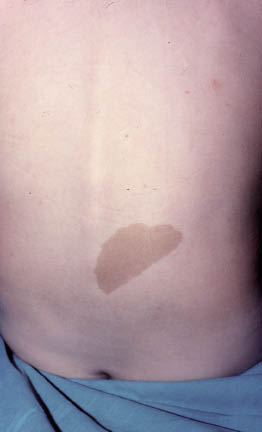
Esta forma clásica de la enfermedad presenta una evolución en la que se diferencian 3 fases. La primera es la fase del lactante, que suele presentarse hasta los 2 años de edad y que suele comenzar con lesiones faciales, que respetan habitualmente el área nasogeniana, y que son principalmente de tipo eczematoso, con importante exudación. Del resto del tegumento, se afectan típicamente: la región anterior del tórax, la región deltoidea, la cara externa de los muslos y de las piernas, el dorso de las manos y región del carpo y el dorso de los pies y zonas maleolares (Fig. 1).
Figura 1. Dermatitis atópica del lactante severa con afectación de la región anterior del tórax, región deltoidea y cara interna de muslos y piernas.
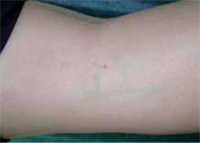
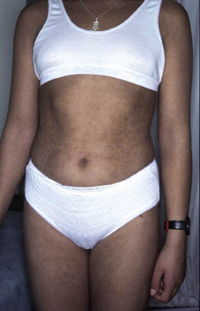
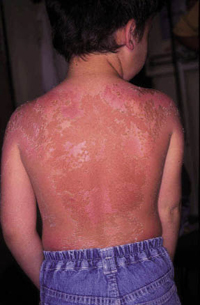
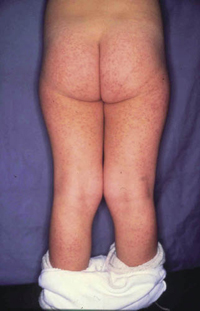
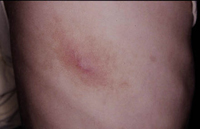
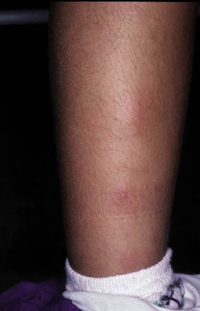
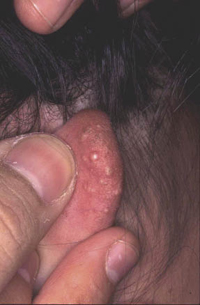
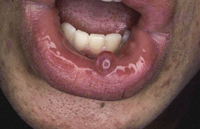
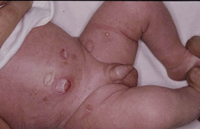
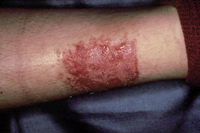
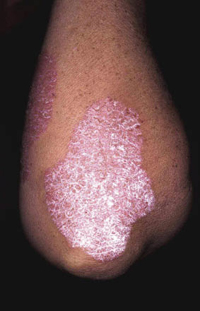
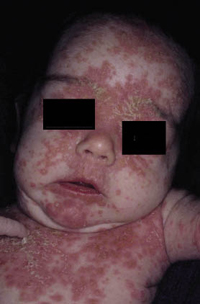
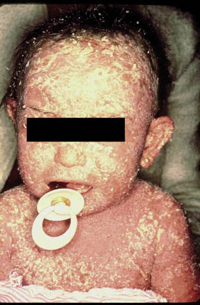
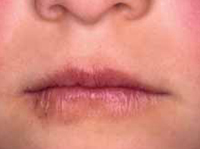
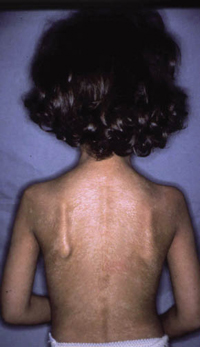
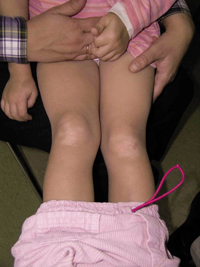
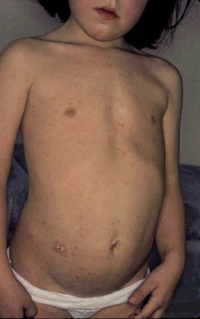
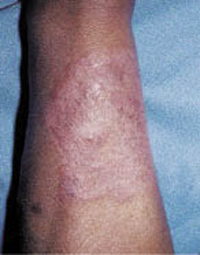
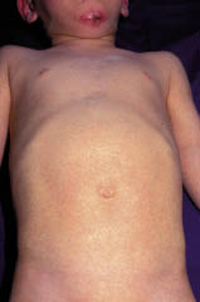
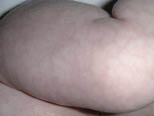
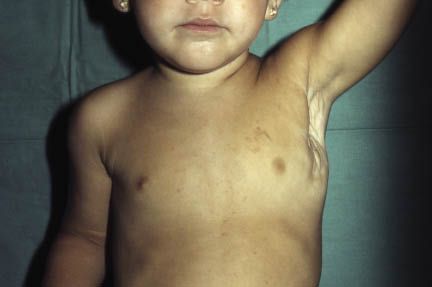
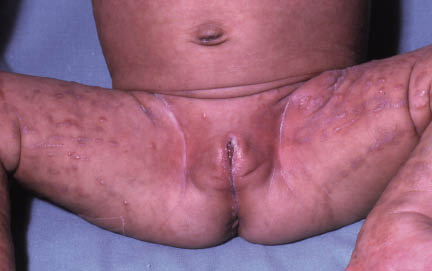
La segunda es la fase infantil o del niño, que predomina entre los 4 y 10 años y se caracteriza por placas bien delimitadas localizadas en flexuras de los miembros, dorso de muñecas y manos, nuca, tronco y en labios y alrededor de la boca. En esta fase, predominan: la descamación, la tendencia a la liquenificación y un prurito intenso, aunque muchas veces conviven con lesiones más exudativas, tipo eczema, y en algunos pacientes predominan las lesiones tipo prurigo (Fig. 2).
Figura 2. Afectación de las flexuras poplíteas con placas liquenificadas y excoriadas propia de la dermatitis atópica infantil.
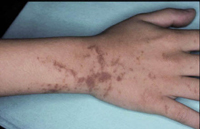
Por último, la fase del adolescente y de adultos jóvenes que no siempre está presente, es más típica entre los 12 y los 26 años; pero, en ocasiones, puede permanecer toda la vida adulta. Se caracteriza por ser una continuación de la fase del niño, con placas engrosadas y predominio de la liquenificación, con aparición de lesiones localizadas predominantemente en: cara, cuello, tórax, flexuras de miembros, muñecas y dorso de manos. Por la cronicidad de la enfermedad en esta fase y por el rascado, se modifica la piel del paciente, adoptando un aspecto reticulado más marcado en las flexuras, con piel gruesa y zonas hiperpigmentadas con numerosas excoriaciones.
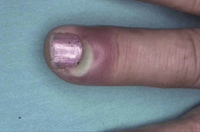
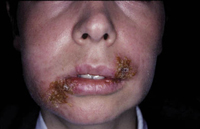
Además de la forma clásica de la DA, existen una serie de formas menores o atípicas, que algunos autores consideran como entidades independientes y que son aún más frecuentes que la DA clásica en la infancia y, en muchas ocasiones, pueden aparecer acompañando a esta. Estas formas menores son: la queilitis descamativa, la pitiriasis alba, el eczema dishidrótico o dishidrosis, la pulpitis digital crónica, la dermatosis plantar juvenil, el prurigo estrófulo, el eczema numular, la dermatitis perioral atópica y la foliculitis atópica(12).
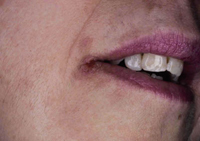
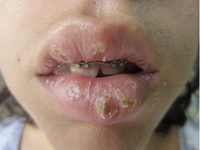
La queilitis descamativa se caracteriza por la presencia de: eritema, exudación y descamación en la zona de los labios, que se desencadena o perpetúa con el chupeteo de la zona, con importante componente irritativo. A veces, tras la aplicación de corticoides potentes o emolientes, esta queilitis puede transformarse en una dermatitis perioral, más típica del adulto, especialmente de mujeres por factores hormonales y englobada en el espectro de la rosácea, con una clínica de pápulas eritematosas puntiformes, que dejan una pequeña franja de piel sana justo alrededor de los labios.
La pitiriasis alba consiste en pequeñas maculas redondeadas u ovaladas de coloración blanquecina-despigmentada, situadas principalmente en el área de la cara y que son más notables en verano. No son fruto de la acción de ningún agente infeccioso, ni fúngico ni bacteriano.
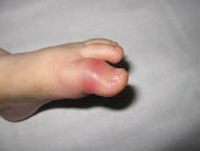
El eczema dishidrótico o pónfolix se trata de una forma de eczema, en la que el edema se acumula formándose vesículas que aparecen generalmente en los laterales de los dedos y que se extienden posteriormente a palmas y plantas. La etiología es compleja, habiéndose relacionado clásicamente los brotes con el estrés.
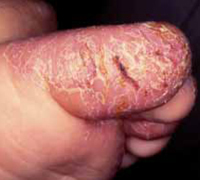
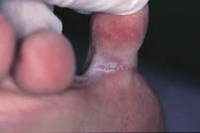
La pulpitis digital crónica aparece en forma de un eritema brillante, con descamación y, en ocasiones, formación de grietas en los pulpejos de los dedos de manos y pies. El frío, el contacto repetido con agua o la fricción se han relacionado con empeoramiento.
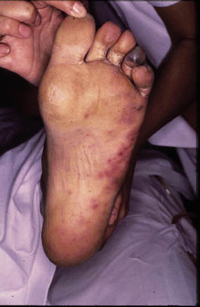
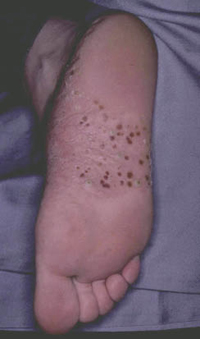
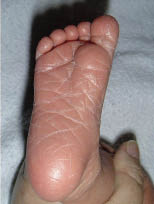
La dermatosis plantar juvenil se caracteriza por enrojecimiento y dolor en la superficie plantar de las parte superior del pie, más cercana a los dedos. Esta aparece con un eritema brillante, de aspecto acristalado y agrietada. Entre los dedos no suele haber lesiones, lo que ayuda a diferenciarla de la tiña pedís. Es más frecuente en invierno, en relación a la hipersudoración causada por calzado más oclusivo.
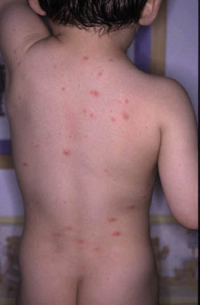
El prúrigo estrófulo o urticaria papulosa es una reacción exagerada a las picaduras de artrópodos, con presencia de lesiones ampollosas y lesiones tipo prurigo, que es más frecuente en niños con DA.
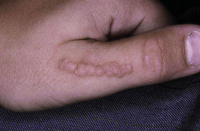
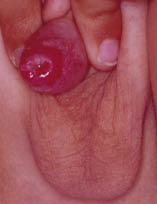
El eczema numular o discoide algunos autores lo consideran una entidad en sí mismo y otros una forma de DA. Las lesiones consisten en placas redondeadas (del latín, nummulus = monedas) constituidas por agrupación de múltiples pápulas con vesiculación central. Las lesiones tienen un borde muy marcado que, en ocasiones, puede simular el de un herpes circinado y presentan infiltración y liquenificación que les hace muy resistentes a los tratamientos tópicos.
La foliculitis atópica se caracteriza por la presencia de pápulas y pústulas foliculares, generalmente localizadas en la región de las nalgas que se acentúan y empeoran con el uso de bañadores por un mecanismo de oclusión e irritación con la humedad de estos.
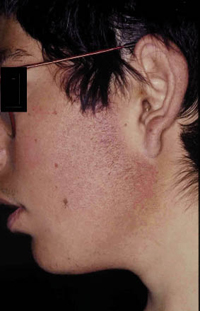
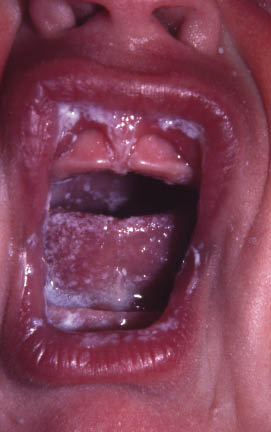
Además de estas formas menores de atopia, clásicamente, se han reconocido una serie de rasgos físicos denominados “estigmas de atopia” que, aunque no son exclusivos de pacientes con DA, aparecen con más frecuencia en estos, respecto a la población general. Estos rasgos son: la xerosis, la queratosis folicular, el signo de Dennie-Morgan (doble pliegue del párpado inferior), el signo de Hertogue (alopecia de la cola de la ceja), la palidez y el eritema facial, la lengua geográfica y el “mechón atópico”.
Criterios diagnósticos
El diagnóstico de la DA es fundamentalmente clínico y se basa en una serie de criterios que tienen en cuenta la epidemiología, además de la morfología, naturaleza y distribución de las lesiones, junto a la presencia de otros rasgos clínicos asociados frecuentemente a la atopia, en ausencia de otras enfermedades que los justifiquen(2). Históricamente, los primeros y más reconocidos criterios a seguir para el diagnóstico de la DA, fueron los criterios que Hanifin y Rajka publicaron en 1980 y que requieren la presencia de 3 de 4 criterios mayores y 3 de 23 criterios menores para el diagnóstico de DA. En 1994, Rudzki et al. publicaron un estudio en el que analizaban la frecuencia de los distintos criterios de Hanifin y Rajka en los pacientes con DA, y observaron que algunos de los criterios menores estaban poco definidos y eran muy inespecíficos, como la pitiriasis alba, y otros, como la queilitis atópica o el eczema del pezón, eran bastante específicos, pero infrecuentes(2). Por todo ello, se han realizado reuniones de expertos para revisar los criterios y adaptarlos. El grupo de trabajo del Reino Unido (RU) hizo una revisión de los criterios que resulta muy útil para estudios epidemiológicos y para el uso por médicos no dermatólogos y que ha sido validado en otros estudios(2). El problema de los criterios del grupo de RU es que no pueden aplicarse a los lactantes, por lo que el grupo de trabajo de la Academia Americana de Dermatología (AAD) también publicó, en 2003, unos criterios que se resumen en la tabla II y que simplifican el diagnóstico a la vez que pueden aplicarse a todos los grupos de edad(13).
Diagnóstico diferencial de la DA (Tabla III). Recomendaciones sobre el uso de biomarcadores y escalas de calidad de vida en pacientes con DA
No hay criterios claros sobre el uso de biomarcadores en la DA. Parece que, niveles altos en suero de IgE y mutaciones hipofuncionantes en el gen de la filagrina se relacionan con enfermedad más severa y de curso más prolongado.
Se han diseñado unas 22 escalas de calidad de vida para pacientes con DA, con poco uso en la consulta habitual por su laboriosidad. Lo más importante para evaluar la calidad de vida en estos pacientes, es tener en cuenta la intensidad del prurito y como los síntomas interfieren en su rutina habitual, viendo si impiden la realización de actividades cotidianas y en qué medida dificultan su descanso(14).
Asociaciones clínicas frecuentes y complicaciones en pacientes con DA
Hay una serie de comorbilidades que aparecen con cierta frecuencia en los pacientes con DA, entre ellas, las más destacadas son: por un lado, las pertenecientes a la “marcha atópica”, entre las que incluimos la rinitis/rinoconjuntivitis, el asma y las alergias alimentarias y, por otro lado, las comorbilidades relacionadas con el prurito y la afectación emocional que este implica en los pacientes con DA, entre las que destacan, la mala calidad del sueño y la depresión, esta es importante especialmente en pacientes adolescentes.
Hay estudios transversales que sugieren una asociación entre el trastorno por déficit de atención e hiperactividad (TDAH) y la presencia de eczema, aunque no se ha probado una relación causal(10). Hay publicaciones que muestran una relación inversa entre la presencia de eczema y la aparición de gliomas y leucemia linfoblástica aguda(10).
Existe una asociación estadísticamente significativa entre la dermatitis atópica y otras dermatosis, como: la alopecia areata, la ictiosis vulgar y la dermatitis herpetiforme.
Las infecciones bacterianas secundarias de la piel por Staphylococcus aureus y Streptococcus pyogenes, en forma de impétigo simple o contagioso e impétigo ampolloso, son más frecuentes en los niños con DA. Estas infecciones contribuyen, además, a exacerbaciones de la dermatitis.
Se cree que, algunas infecciones víricas, también, son más frecuentes en individuos atópicos. Aunque no está claramente demostrado que tengan mayor predisposición a tener verrugas vulgares o molusco contagioso, se ha demostrado que los pacientes con DA tienen riesgo de una extensión de las lesiones en las zonas previamente afectadas por su dermatitis, en forma de eczema molluscatum. Cabe destacar el riesgo que presentan los niños con DA de desarrollar infecciones generalizadas por el virus del herpes simple, denominadas eczema herpeticum o erupción variceliforme de Kaposi, que consiste en brotes repetidos de lesiones vesiculosas que adquieren un aspecto pustuloso y, posteriormente, erosivo-costroso, afectando áreas ocupadas por la dermatosis previa. Este cuadro puede ser grave con presencia de afectación del estado general, fiebre elevada, adenopatías regionales y, en ocasiones, diseminación de las lesiones por grandes zonas de la superficie corporal, simulando una varicela y siendo frecuentes también aquí las sobreinfecciones bacterianas(12).
Otro cuadro clínico, similar clínicamente al eczema herpeticum y que hoy en día es su principal diagnóstico diferencial, con un aumento de la prevalencia y los casos descritos en los últimos años, es el eczema coxackium, causado por el enterovirus Coxsackie A6 y que también aparece en zonas dañadas previamente por la DA(15).
Evolución y pronóstico
La DA sigue un curso crónico recurrente, con un número variable de brotes a lo largo de la enfermedad. Normalmente, los pacientes están peor en primavera y en otoño, con mejoría sustancial durante el verano. Aunque, generalmente, no se sabe cuándo remitirá la enfermedad, se ha observado que muchos pacientes mejoran con la edad.
Tratamiento
Es fundamental para el niño con DA, realizar un tratamiento adecuado de los brotes, aplicando los tratamientos tópicos y/o sistémicos que sean necesarios para conseguir su mejoría.
1. Medidas no farmacológicas: el uso de emolientes es una parte importante del manejo de los pacientes con DA en el periodo entre los brotes, existiendo evidencia en estudios aleatorizados, de que un uso correcto de emolientes en esos periodos puede reducir la severidad de la enfermedad y el número de brotes. No existe un estándar sobre la frecuencia y la duración de los baños recomendados en los pacientes con DA. Se recomienda que los emolientes y los tratamientos tópicos se apliquen después del baño para mejorar su acción. Como tratamiento de los pacientes con DA, no hay evidencia para recomendar el uso de aceites, emolientes y otros aditivos para la ducha(16).
2. Tratamientos tópicos: los corticoides tópicos son la primera elección en el tratamiento de la DA leve o moderada. Los factores que deben tenerse en cuenta para elegir un determinado corticoide tópico en los pacientes con DA, son: la edad, las áreas en las que va a aplicarse, el grado de liquenificación de las lesiones y las preferencias y recursos económicos de los pacientes. El uso de inhibidores de la calcineurina (tacrólimus y primecrólimus) es efectivo en el tratamiento de la dermatitis atópica, aunque menos potente que los corticoides de potencia moderada-alta. Se prefiere su uso en situaciones clínicas determinadas, como: la DA resistente a corticoides, áreas sensibles como la cara, el área genital y los pliegues, en zonas con atrofia inducida por corticoides y para ahorrar su uso en periodos de mejoría de la enfermedad. El tratamiento pro-activo intermitente con corticoides tópicos e inhibidores de la calcineurina es más efectivo para evitar las recurrencias que el uso únicamente de emolientes. En niños menores de dos años, se prefiere el uso de tacrólimus al 0,03% y primecrólimus frente al tacrólimus al 1%. No se han demostrado datos concluyentes sobre un aumento de enfermedades virales cutáneas o tumores con el uso de inhibidores de la calcineurina. El uso de antibióticos tópicos, en ausencia de infección de las lesiones, no está demostrado que modifique el curso de la enfermedad(16).
3. Fototerapia y tratamientos sistémicos en la DA moderada-severa que no se controla con tratamiento tópico. La fototerapia se utiliza como tratamiento de segunda línea tras el fallo de los tratamientos tópicos. Puede utilizarse como terapia de mantenimiento en algunos pacientes con enfermedad crónica. Para su uso, debe tenerse en cuenta el fototipo de los pacientes y el riesgo de estos de desarrollar cáncer cutáneo. De los tratamientos sistémicos, los utilizados con mayor frecuencia, por haber demostrado su eficacia en el tratamiento de la DA, son: los corticoides sistémicos, la ciclosporina, el metrotrexato, la azatioprina y el micofenolato mofetilo. Otros tratamientos, como inhibidores de la calcineurina orales y anticuerpos antimonoclonales, como el omalizumab, no parecen ser eficaces. Estos fármacos no tienen la misma eficacia en todos los pacientes y, por los efectos secundarios que ocasionan, requieren un control más estrecho por parte del dermatólogo, con controles analíticos periódicos en algunos casos(17). Educación a los padres y corticofobia. En el caso de la DA, ya que se trata de una enfermedad crónica y que los niños, especialmente los lactantes y los niños pequeños necesitan a sus cuidadores para poder aplicarse los tratamientos, es fundamental educar a los padres, especialmente al que se encargue de forma más continuada de los cuidados del niño. Debemos asegurarnos en la consulta, de que entienden bien el tratamiento y van a aplicarlo correctamente. A veces, es de ayuda para evaluar el control de la enfermedad, la realización por su parte de un diario del tratamiento. Otro punto clave en la relación con los padres, es detectar los que sufren de “corticofobia”, que se traduce en un miedo al uso de los corticoides en los niños, lo que conlleva, en ocasiones, un mal control de la enfermedad con aumento de la sintomatología y de la morbilidad para los niños. Se han realizado diversos estudios que demuestran que la corticofobia es un padecimiento común en sociedades occidentales que se puede acrecentar por la lectura de algunas publicaciones pseudocientíficas y por la falta de acuerdo entre los distintos profesionales sanitarios, como: dermatólogos, pediatras y farmacéuticos. La calidad de la relación médico-paciente y, en este caso, médico-cuidador es fundamental para una buena adherencia al tratamiento(18). La influencia de la dieta y las recomendaciones respecto a esta se han incluido en el apartado de factores exógenos que influyen en el desarrollo de la DA.
Dermatitis del pañal
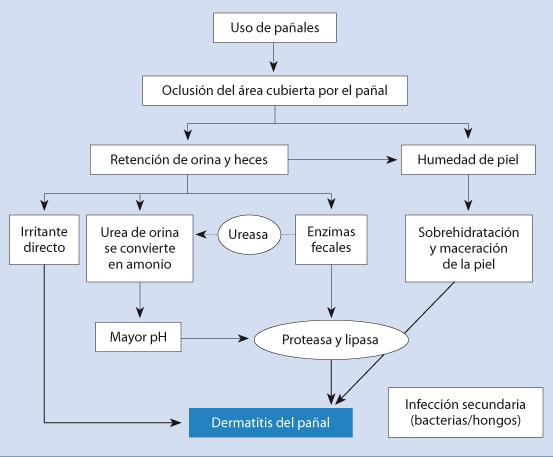
La dermatitis del pañal es un eczema de contacto irritativo que se produce por el roce con las heces y la orina. Lo más importante para prevenir su aparición es mantener la piel limpia y seca. No se debe abusar de corticoides y antifúngicos en su tratamiento.
La dermatitis del pañal es la forma más frecuente de dermatitis en los lactantes. Se trata de un eczema irritativo de contacto, en el que la principal fuente de irritación son: la orina, las heces o ambas. Las bacterias y levaduras (Candida) pueden actuar secundariamente agravando el proceso.
Hay distintas formas clínicas de dermatitis del pañal.
• El eritema en W es la forma más común y afecta fundamentalmente a las zonas que están más en contacto con el pañal, incluyendo: glúteos, genitales y superficies convexas de los muslos, respetando generalmente el fondo de los pliegues.
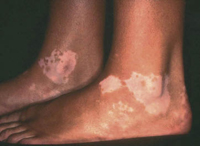
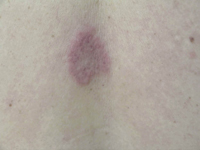
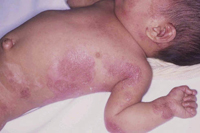
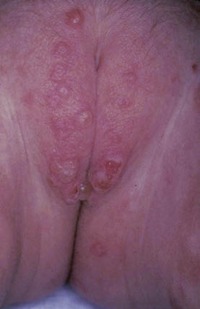
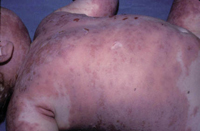
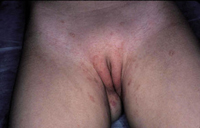
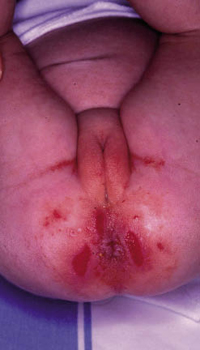
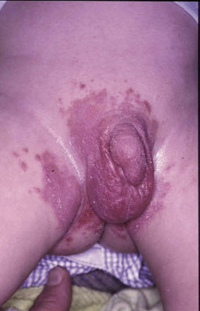
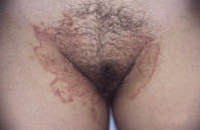
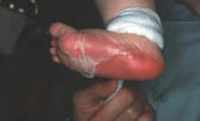
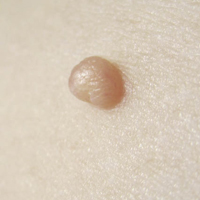
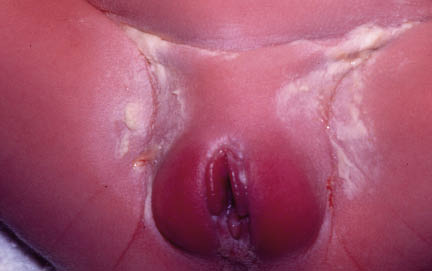
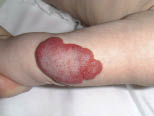
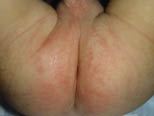
• Eritema confluente, con lesiones rojo brillantes que avanzan hacia el fondo de los pliegues (Fig. 3).
Figura 3. Dermatitis del pañal en forma de eritema confluente rojo vivo, que en este caso llega a afectar el fondo de los pliegues, predominando en las zonas en contacto con el pañal, la orina y las heces.
• Sifiloides de Sevestre-Jaquet, se caracteriza por la aparición de escaso número de úlceras superficiales con aspecto de sacabocados, salpicadas por la zona perineal que pueden confundirse con las lesiones de la sífilis congénita.
• Eritema rojo-violáceo. Esta forma se caracteriza por la presencia de lesiones de aspecto vegetante y vesículo-pustulosas que, en muchas ocasiones, se han asociado con la presencia de sobreinfección bacteriana o por Candida.
• Granuloma glúteo infantil. Es una forma poco frecuente y relacionada con el tratamiento de la dermatitis del pañal con corticoides potentes. Consiste en la aparición de lesiones nodulares rojo-violáceas o marronáceas en zona glútea.
Los principales diagnósticos diferenciales de la dermatitis del pañal son: la dermatitis seborreica infantil, la psoriasis, algunas infecciones cutáneas y fúngicas, la histiocitosis de células de Langerhans (que característicamente sí afecta pliegues y es más extensa, con confluencia de múltiples lesiones pápulo-costrosas), la acrodermatitis enteropática, la dermatitis irritativa perianal típica de diarreas crónicas y la celulitis perianal estreptocócica.
Lo más importante es la prevención de su aparición mediante medidas higiénicas, con cambio frecuente de los pañales mojados, manteniendo la zona limpia y seca. Son útiles las pastas que contienen óxido de zinc para formar una película protectora y hay que evitar el abuso de corticoides y antifúngicos. En ocasiones, cuando está en fase muy exudativa, es útil el uso de fomentos astringentes con sulfato de zinc al 1/1.000.
Dermatitis seborreica
La dermatitis seborreica es frecuente y generalmente autorresolutiva en los lactantes, por lo que suelen desaconsejarse los tratamientos agresivos para abordarla. En ocasiones, se solapa con el inicio de una DA o una psoriasis infantil.
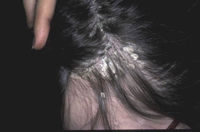
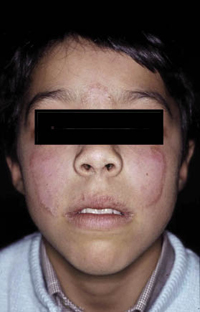
La dermatitis seborreica es una dermatitis eritemato-descamativa, costrosa, muy frecuente, especialmente en las formas leves, que cuando aparece en los lactantes tiende a desaparecer espontáneamente a los pocos meses, aunque en algunos casos, puede solaparse con el inicio de una DA o ser el inicio de una psoriasis infantil. En su etiopatogenia, se han implicado: una alteración de la función de las glándulas sebáceas por su localización, la infección por levaduras del género Malassezia y la predisposición genética.
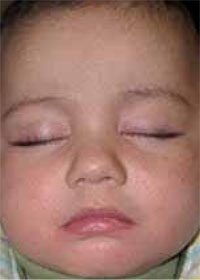
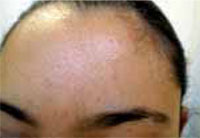
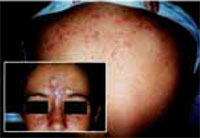
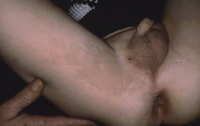
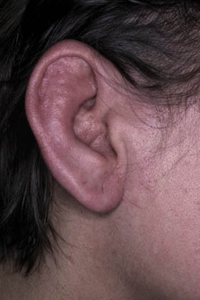
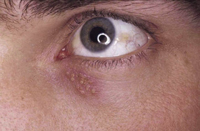
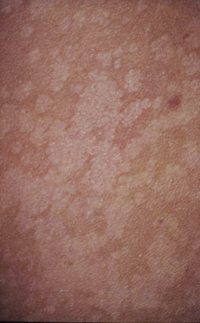
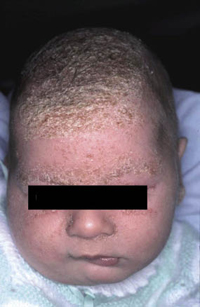
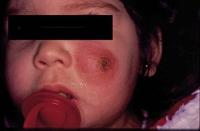
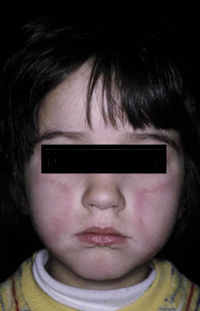
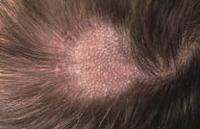
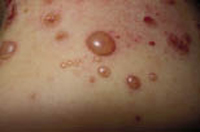
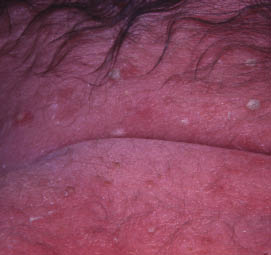
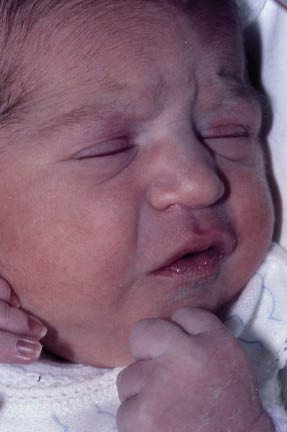
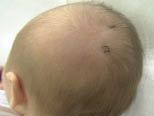
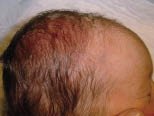
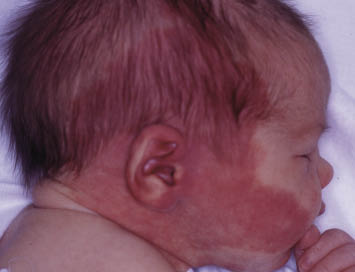
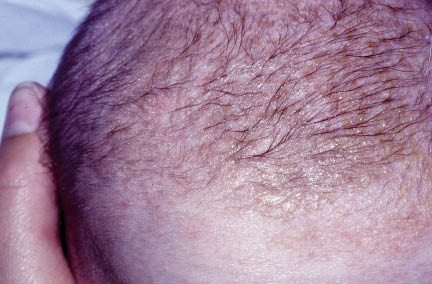
Existen dos formas clínicas: la del lactante (Fig. 4), que para muchos autores incluye la costra láctea, y la del adolescente, ya muy similar a la del adulto. Sus principales características se resumen en la tabla III.
Figura 4. Afectación clásica de la dermatitis seborreica del lactante con descamación fina en frente y costras amarillentas en región de cejas.
Respecto al tratamiento de la dermatitis seborreica, dado que en muchos niños es autorresolutiva, no recomendamos ser muy agresivos con el tratamiento, comenzando por corticoides de potencia baja ayudados de vaselina para descostrar las zonas de cuero cabelludo. En niños mayores y adolescentes, han demostrado su utilidad para el control de brotes leves los inhibidores tópicos de la calcineurina (tacrólimus y primecrólimus).
Dermatitis alérgica de contacto en la infancia
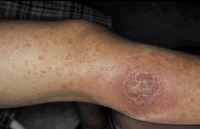
La DAC en la infancia está aumentando su frecuencia. Los niños con alteraciones de la función barrera de la piel tienen más riesgo de desarrollarla. Ante una localización de eczema recalcitrante, en sitios expuestos a determinados alérgenos, hay que sospecharla.
La DAC en la infancia está aumentando en los últimos años su prevalencia(19). La realización de pruebas epicutáneas es necesaria para su diagnóstico.
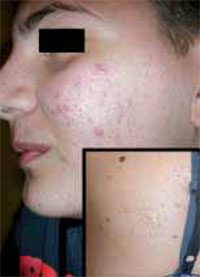
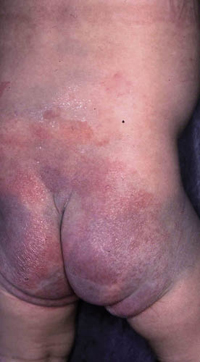
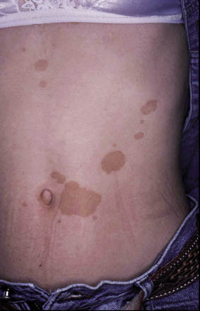
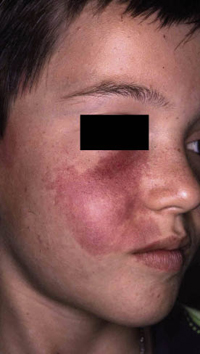
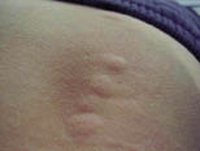
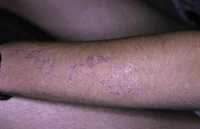
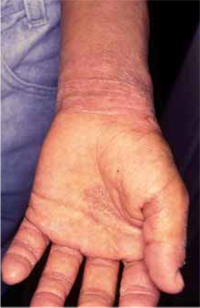
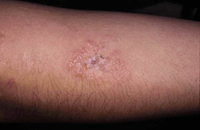
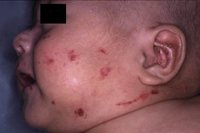
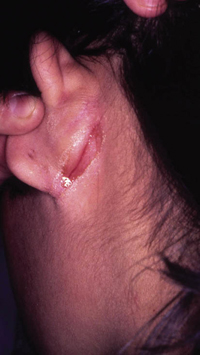
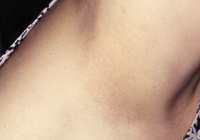
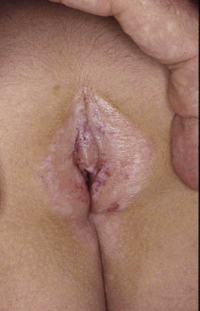
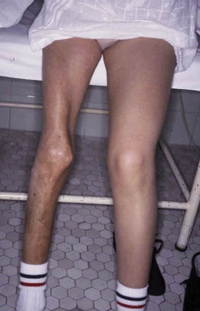
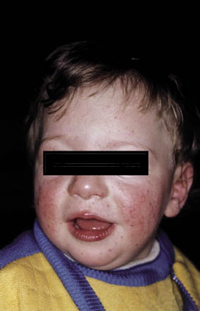
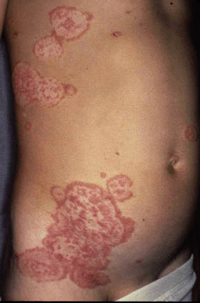
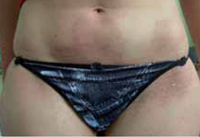
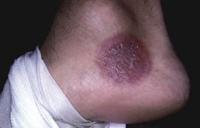
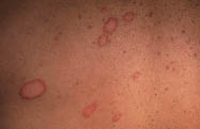
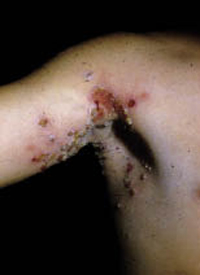
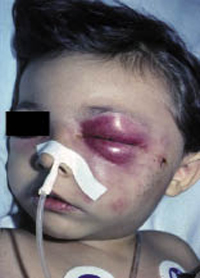
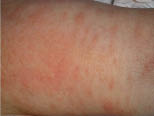
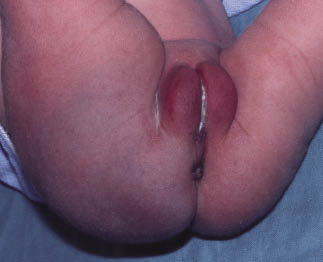
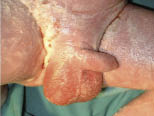
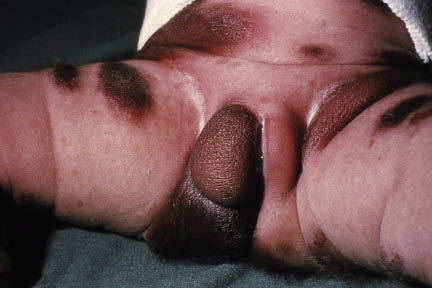
Clínicamente, el aspecto de la DAC es el de un eczema, pasando por las fases aguda, subaguda y crónica (Fig. 5), aunque se ve modificado por el grado de exposición, el tiempo y el grado de sensibilización del individuo(12).
Figura 5. Eczema de contacto agudo con vesiculación y exudado en un niño por las gomas con las que fabrican los zapatos.
Los factores que favorecen la aparición de eczemas de contacto en la infancia son: la presencia de DA y otros factores que ocasionen alteraciones en la barrera cutánea, como las mutaciones hipofuncionantes en la filagrina y el contacto a edades tempranas con diferentes haptenos capaces de sensibilizar a los niños, destacando el níquel y el PPD (parafenilendiamina) que se encuentra en los tatuajes de henna, por lo que se desaconsejan enérgicamente en los niños(19).
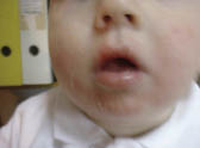
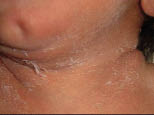
Los alérgenos que más frecuentemente ocasionan DAC en niños son: los metales, las fragancias, los conservantes, la neomicina, las gomas químicas y los colorantes. La DAC debida al uso de determinados zapatos y espinilleras debe ser considerada en pacientes con erupciones persistentes en pies, en ocasiones diagnosticadas de dermatosis plantar juvenil, y en dermatitis bien definidas de la zona pretibial en niños que juegan al fútbol. Otra causa potencial de DAC en niños son: los componentes de algunos juguetes y, especialmente, los cosméticos que tienen perfumes, barras de labios o sombras de ojos. La DAC debido al uso de pañales es rara, destacando la dermatitis lateral del pañal ‘Lucky Luke’, que se denomina así, porque por su localización y su morfología simula las pistolas de los vaqueros y se debe a algunas resinas del pegamento que se usa para cerrarlos. Es curioso que está descrita con mayor intensidad en el lado derecho cuando los padres son diestros, ya que ajustan más el lado izquierdo, produciéndose más roce y fricción en el derecho(20). Otro cuadro clínico distintivo de DAC en la infancia es el denominado síndrome del babuino, que es una forma de reacción sistémica aerotransportada con gran eritema y descamación en pliegues y nalgas, con una imagen de “culo de babuino” característica.
Lo más importante en la DAC en la infancia es sospecharla para realizar las pruebas que permitan un diagnóstico precoz y evitar los agentes causales que perpetúan el eczema en estos niños. Los corticoides tópicos y orales permiten el control del brote agudo, aunque se han descrito casos de sensibilización a la terapia corticoidea tópica en estos niños.
Funciones del pediatra en Atención Primaria
• Realizar un diagnóstico precoz de la DA en lactantes y niños y un tratamiento adecuado de la DA leve-moderada, que permita el control de la enfermedad y una educación de los padres y los niños sobre el uso adecuado de los corticoides tópicos en el brote.
• Derivar con prontitud a los niños con DA moderada-severa para permitir tratamiento sistémico adecuado cuando lo precisen para un buen control de la enfermedad.
• Saber hacer un correcto diagnóstico diferencial de las enfermedades eccematosas más frecuentes de la infancia.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Armengot-Carbo M, Hernández-Martín Á, Torrelo A. The role of filaggrin in the skin barrier and disease development. Actas Dermosifiliogr. 2015; 106: 86-95.
2.*** Eichenfield LF, Tom WL, Chamlin SL, et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014; 70: 338-51.
3. Spergel JM, Paller AS. Atopic dermatitis and the atopic march. J Allergy Clin Immunol. 2003; 112: S118-27.
4. Allen KJ, Dharmage SC. The role of food allergy in the atopic march. Clin Exp Allergy. 2010; 40: 1439-41.
5.** Wen HJ, Chen PC, Chiang TL, et al. Predicting risk for early infantile atopic dermatitis by hereditary and enviromental factors. Br J Dermatol. 2009; 161: 1166-72.
6. Sandford AJ, Shirakawa T, Moffatt MF, et al. Localisation of atopy and beta subunit of high-affinity IgE receptor (Fc epsilon RI) on chromosome 11q. Lancet. 1993; 341: 332-4.
7. Lange J, Ngoumou G, Berkenheide S, et al. High interleukin-13 production by phytohaemagglutinin and Der p1-stimulated cord blood mononuclear cells is associated with the subsequent development of atopic dermatitis at the age of 3 years. Clin Exp Allergy. 2003; 33: 1537-43.
8. Kato A, Fukai K, Oiso N, et al. Association of SPINK5 gene polymorphisms with atopic dermatitis in the Japanese population. Br J Dermatol. 2003; 148: 665-9.
9.** Bath-Hextall F, Delamere FM, Williams HC. Dietary exclusions for established atopic eczema. Cochrane Database Syst Rev. 2008; (1): CD005203.
10. *Shams K, Grindlay DJ, Williams HC. What’s new in atopic eczema? An analysis of systematic reviews published in 2009-2010. Clin Exp Dermatol. 2011; 36: 573-7.
11. Sonkoly E, Muller A, Lauerma AI, et al. IL-31: a new link between T cells and pruritus in atopic skin inflammation. J Allergy Clin Immunol. 2006; 117: 411-7.
12.** Torrelo A. Dermatología en pediatría general. Madrid: Grupo Aula Médica, 2007.
13. Eichenfield LF, Hanifin JM, Luger TA, et al. Consensus conference on pediatric atopic dermatitis. J Am Acad Dermatol. 2003; 49: 1088-95.
14.** Bender BG, Ballard R, Canono B, et al. Disease severity, scratching, and sleep quality in patients with atopic dermatitis. J Am Acad Dermatol. 2008; 58: 415-20.
15. Mathes EF, Oza V, Frieden IJ, et al. “Eczema Coxsackium” and Unusual Cutaneous Findings in an Enterovirus Outbreak. Pediatrics. 2013; 132: e149-57. doi:10.1542/peds.2012-3175.
16.*** Eichenfield LF, Tom WL, Berger TG, et al. Guidelines of care for the management of atopic dermatitis: section 2. Management and treatment of atopic dermatitis with topical therapies.J Am Acad Dermatol. 2014; 71: 116-32.
17. Sidbury R, Davis DM, Cohen DE, et al; American Academy of Dermatology. Guidelines of care for the management of atopic dermatitis: section 3. Management and treatment with phototherapy and systemic agents. J Am Acad Dermatol. 2014; 71: 327-49.
18.** Aubert-Wastiaux H, Moret L, Le Rhun A, et al. Topical corticosteroid phobia in atopic dermatitis: a study of its nature, origins and frequency. Br J Dermatol. 2011; 165: 808-14.
19.*** De Waard-van der Spek FB, Andersen KE, Darsow U, et al. Allergic contact dermatitis in children: which factors are relevant? (review of the literature).Pediatr Allergy Immunol. 2013; 24: 321-9.
20. Roul S, Ducombs G, Leaute-Labreze C, Taieb A, “Lucky luke” contact dermatitis due to rubber components of diapers. Contact Dermat. 1988: 38: 363-4.
Bibliografía recomendada
– Eichenfield LF, Tom WL, Chamlin SL, et al. Guidelines of care for the management of atopic dermatitis: section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014; 70: 338-51.
Interesante artículo de revisión sobre DA de la Academia Americana de Dermatología (AAD), actualizado, donde detallan los criterios diagnósticos y los factores que han demostrado, en la literatura, una asociación con el desarrollo y el pronóstico de la DA.
– Eichenfield LF, Tom WL, Berger TG, et al. Guidelines of care for the management of atopic dermatitis: section 2. Management and treatment of atopic dermatitis with topical therapies.J Am Acad Dermatol. 2014; 71: 116-32.
Consenso para el tratamiento de la dermatitis atópica leve-moderada con terapias tópicas. Basado en la evidencia publicada hasta la fecha, es un documento muy útil para que los pediatras de Atención Primaria aprendan a manejar la enfermedad.
– Aubert-Wastiaux H, Moret L, Le Rhun A, Fontenoy AM, et al. Topical corticosteroid phobia in atopic dermatitis: a study of its nature, origins and frequency. Br J Dermatol. 2011; 165: 808-14.
Artículo que tiene gran valor para concienciar al personal sanitario de la importancia de educar a los padres y cuidadores de los niños con DA, para evitar que las creencias populares impidan que los niños reciban un adecuado tratamiento.
– Armengot-Carbo M, Hernández-Martín Á, Torrelo A. The role of filaggrin in the skin barrier and disease development. Actas Dermosifiliogr. 2015; 106: 86-95.
Muy interesante para comprender la patogenia de la DA y la importancia de la mutación del gen de la filagrina como factor genético en el desarrollo de esta y otras enfermedades cutáneas muy prevalentes, permitiendo integrar el papel de la filagrina en la función barrera cutánea y las consecuencias de la pérdida de esta.
– de Waard-van der Spek FB, Andersen KE, Darsow U, et al. Allergic contact dermatitis in children: which factors are relevant? (review of the literature). Pediatr Allergy Immunol. 2013; 24: 321-9.
Útil para aprender a reconocer cuando puede haber un componente alérgico de contacto en un eczema en un niño. Recomendable para entrenar el índice de sospecha clínica en los pediatras de Atención Primaria.
| Caso clínico |
|
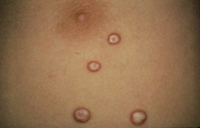
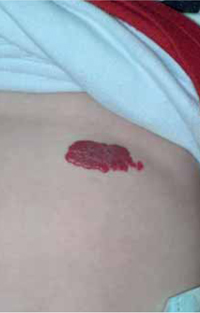
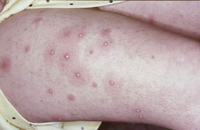
Niño de 10 años, sin antecedentes de interés ni alergias conocidas hasta la fecha. Acude a urgencias de Pediatría por episodio de infección respiratoria de vías altas y fiebre de 5 días de evolución, acompañado en las últimas 12 horas de lesiones cutáneas pruriginosas en región de glúteos y zona poplítea. La madre del niño refería que el día anterior se había roto un termómetro de mercurio en la habitación del paciente. Exploración física A la exploración, se apreciaba una erupción maculo-papular confluente localizada en glúteos y región posterior de muslos y flexuras poplíteas (Fig. 6). Pruebas complementarias Se solicitaron pruebas epicutáneas que se realizaron 1 mes tras la resolución del cuadro, siendo positivas para el mercurio. Evolución y tratamiento El paciente fue tratado con corticoides tópicos durante 7 días, resolviéndose por completo las lesiones cutáneas sin hiperpigmentación residual. Hasta la fecha no ha vuelto a presentar lesiones similares. |
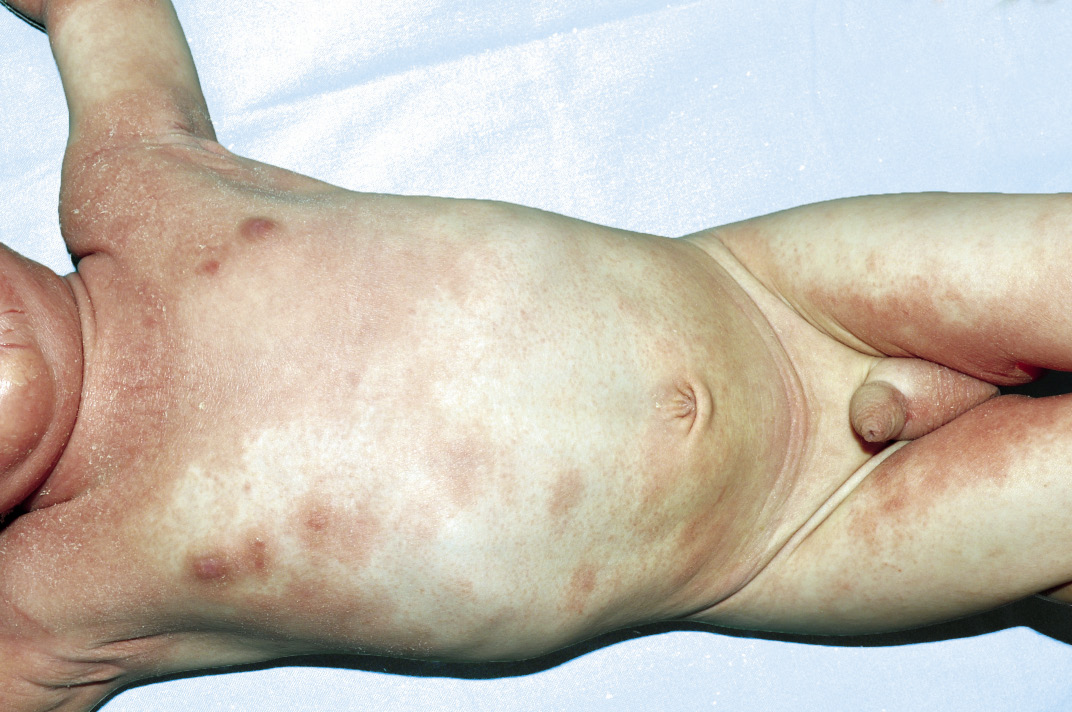
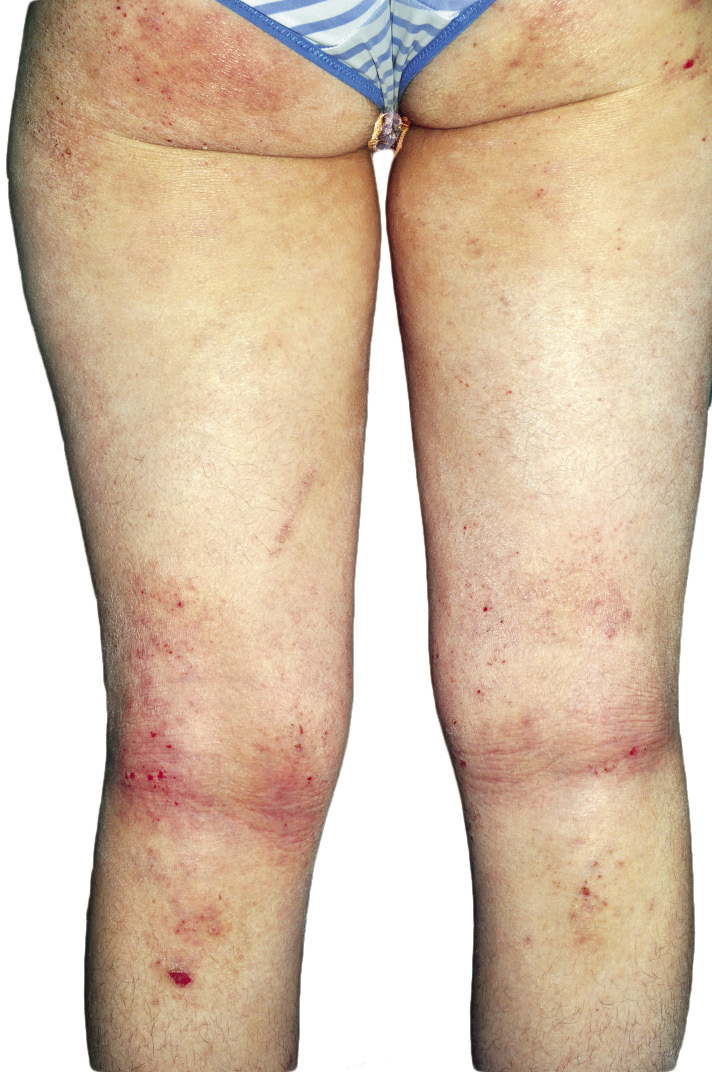
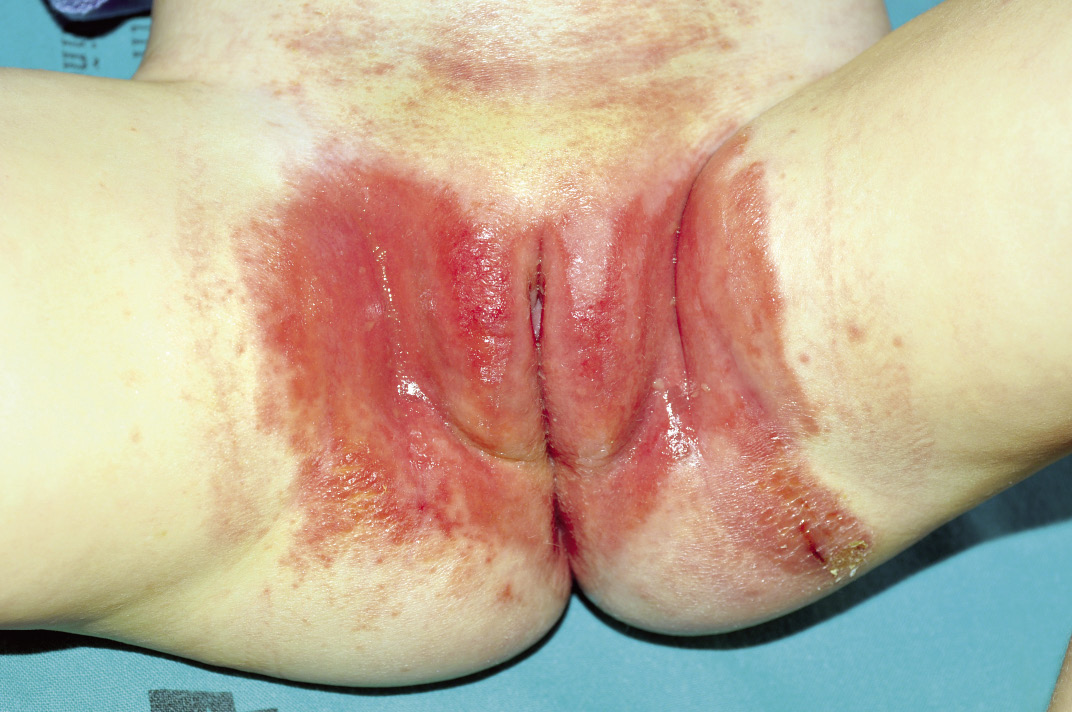
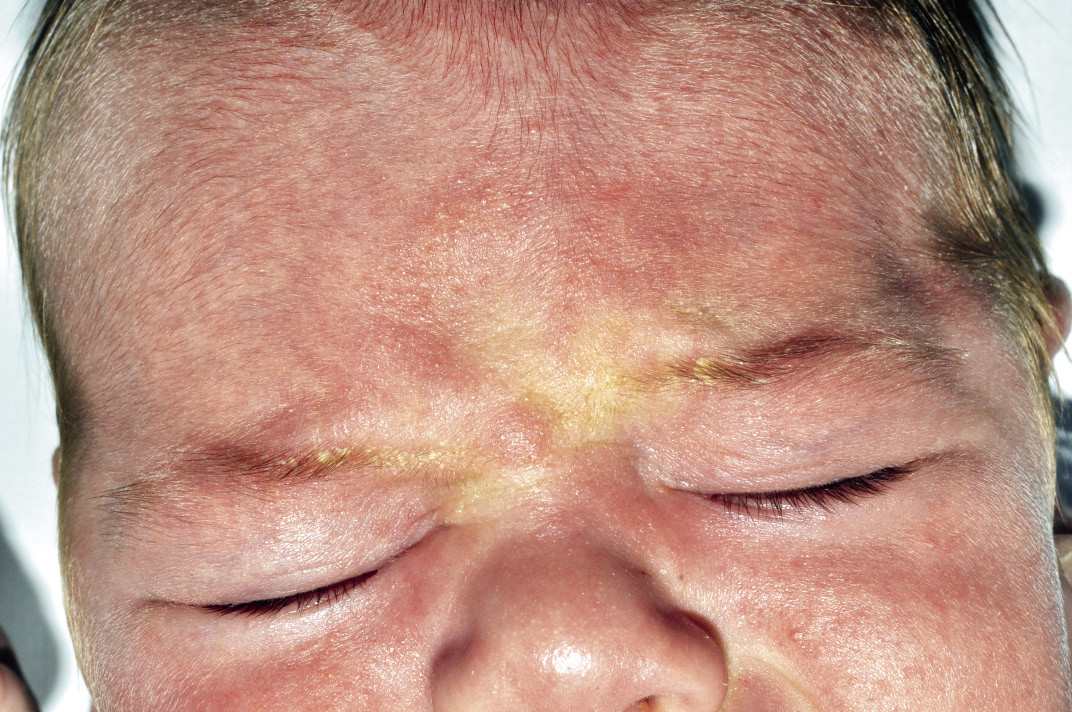

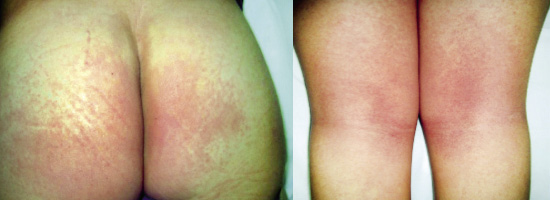



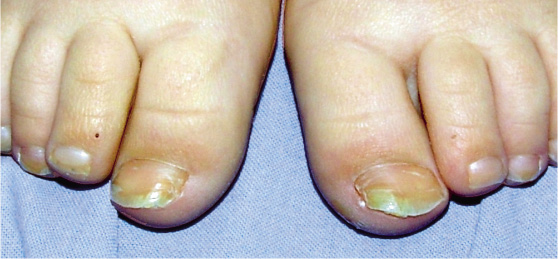
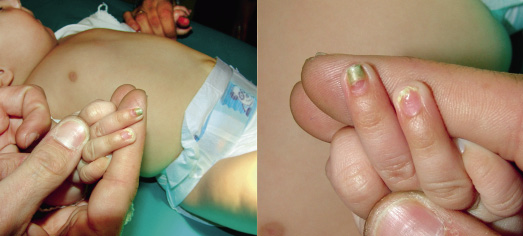
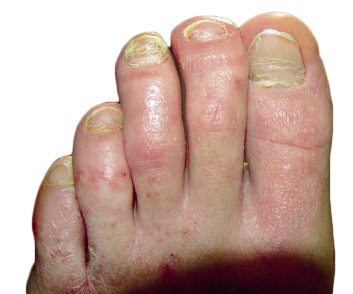
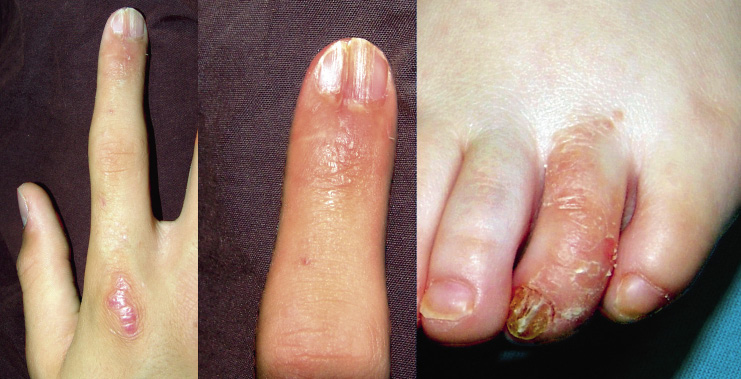
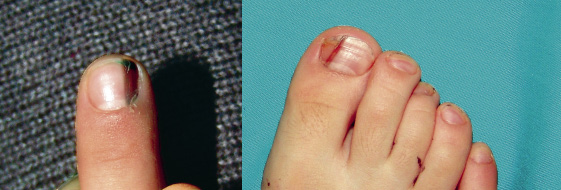

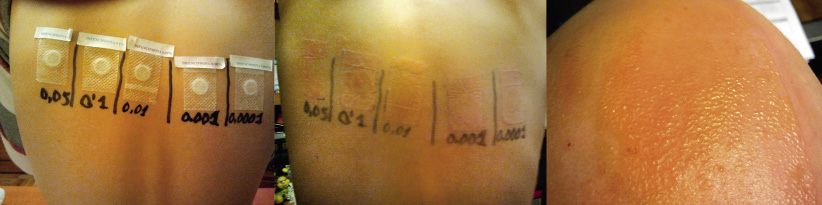

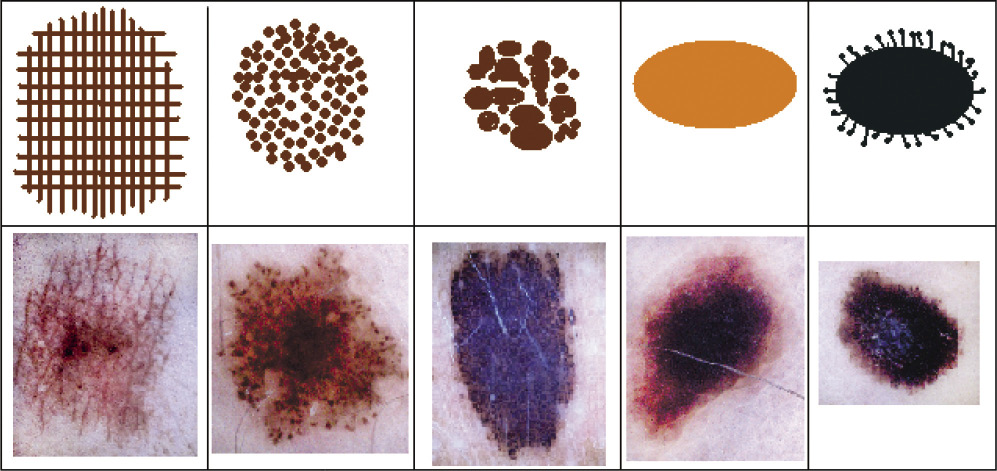
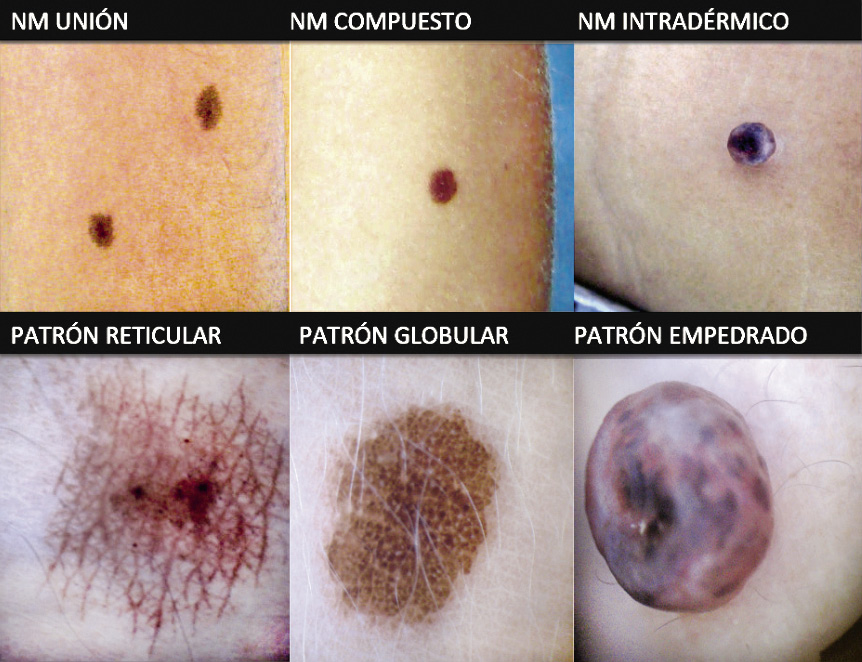
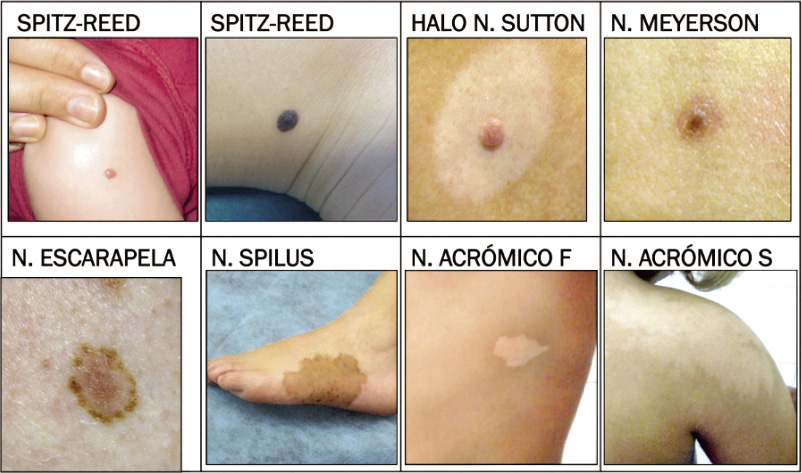

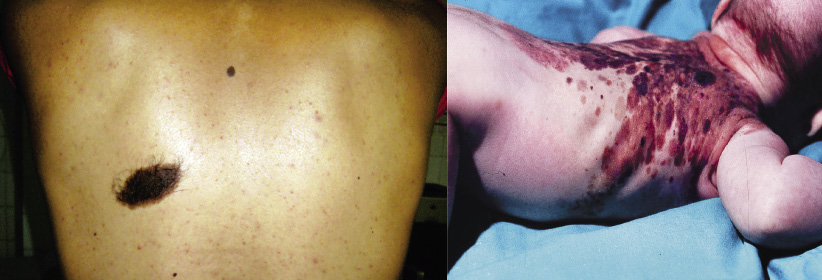
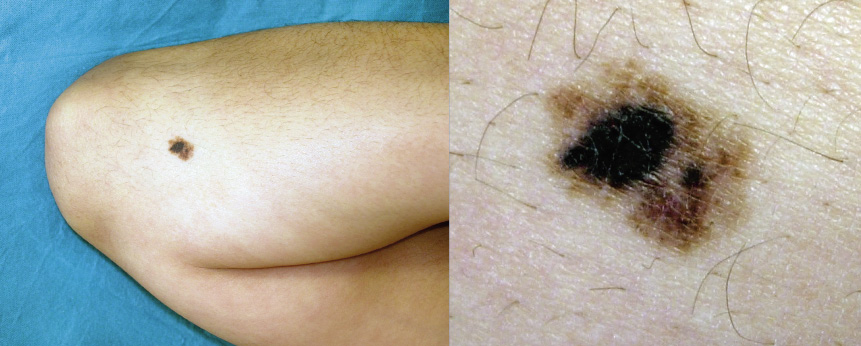





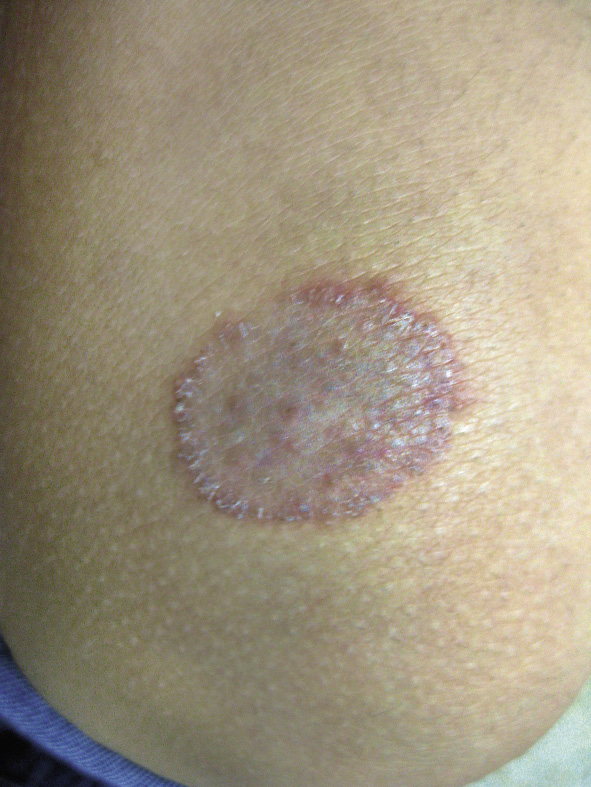
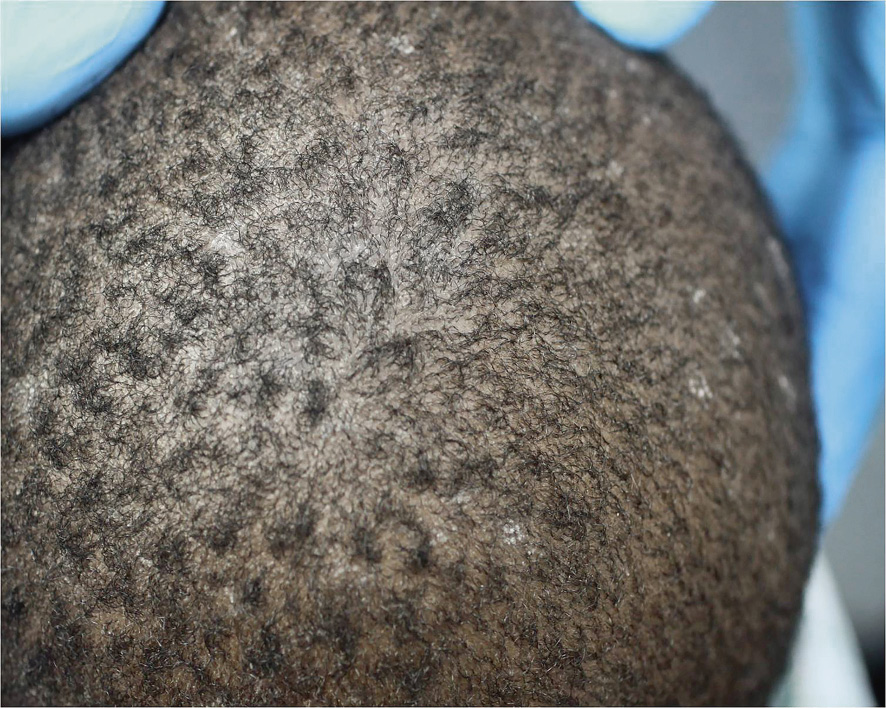

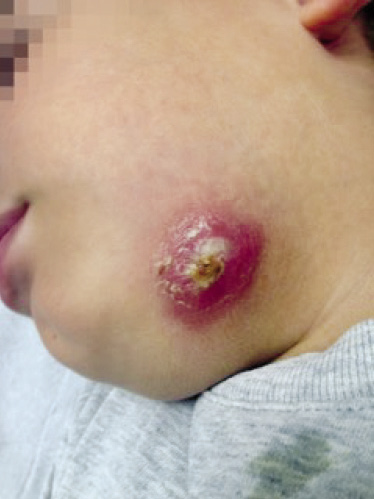
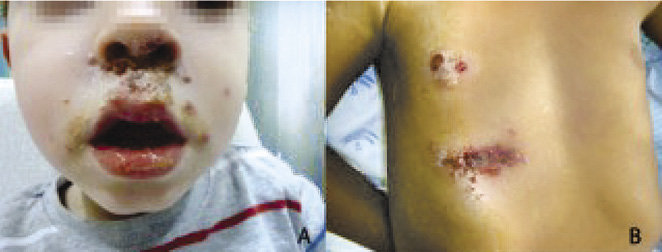




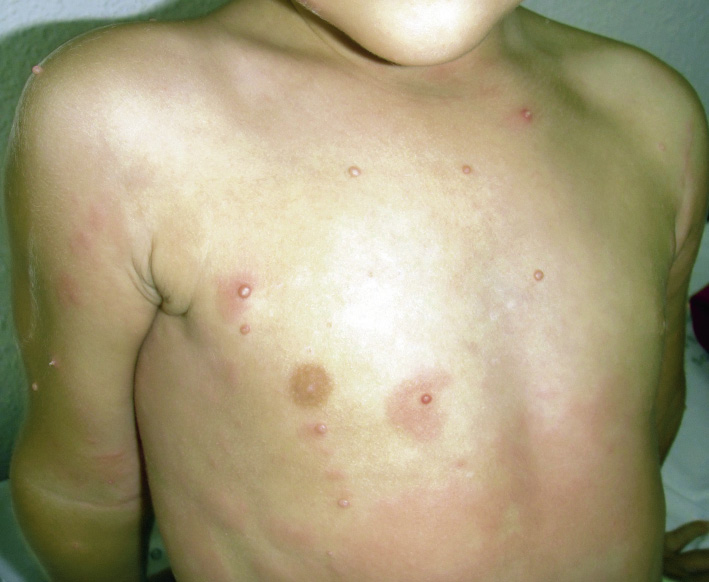







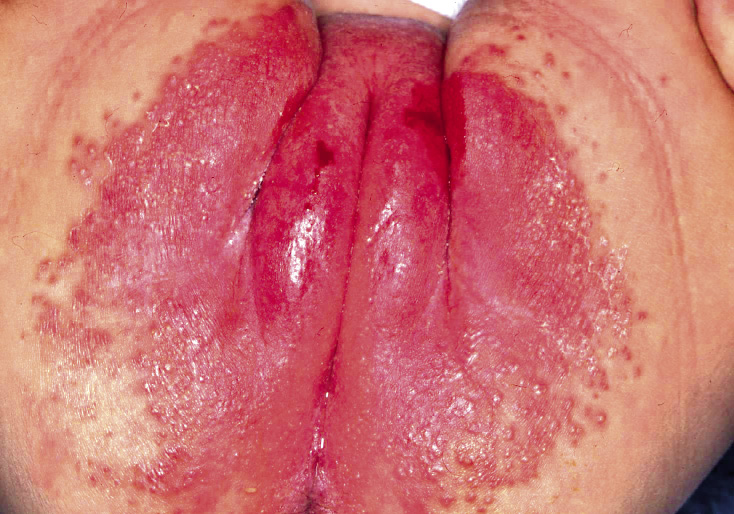

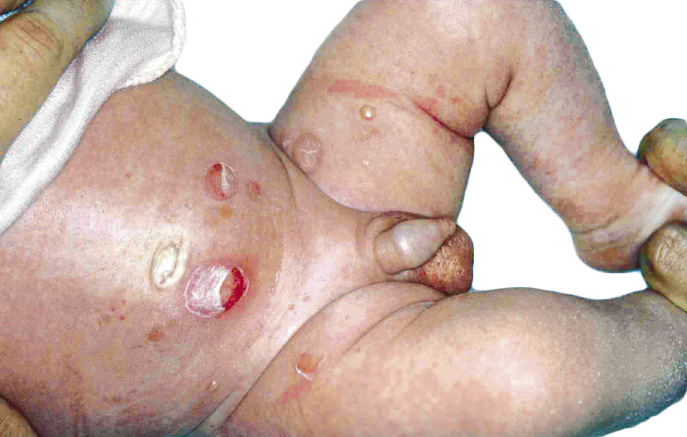

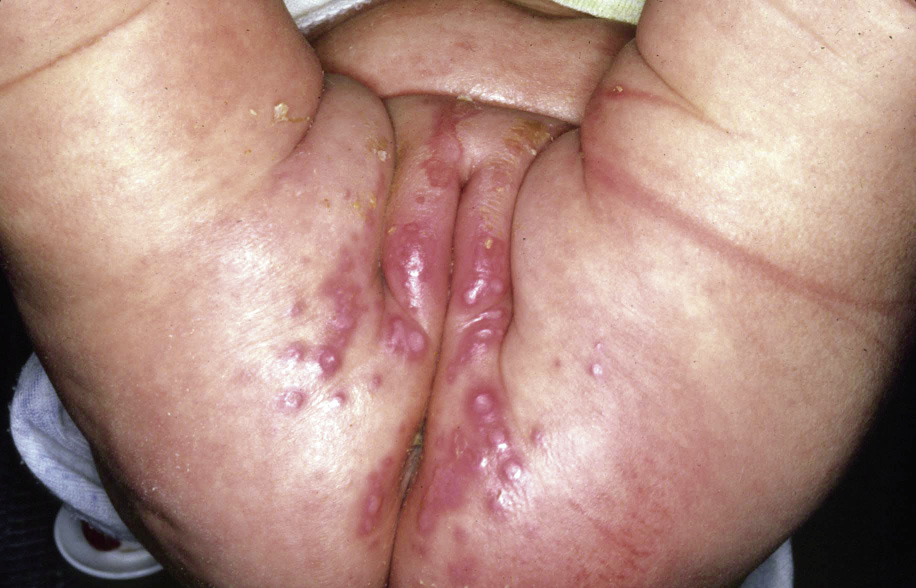

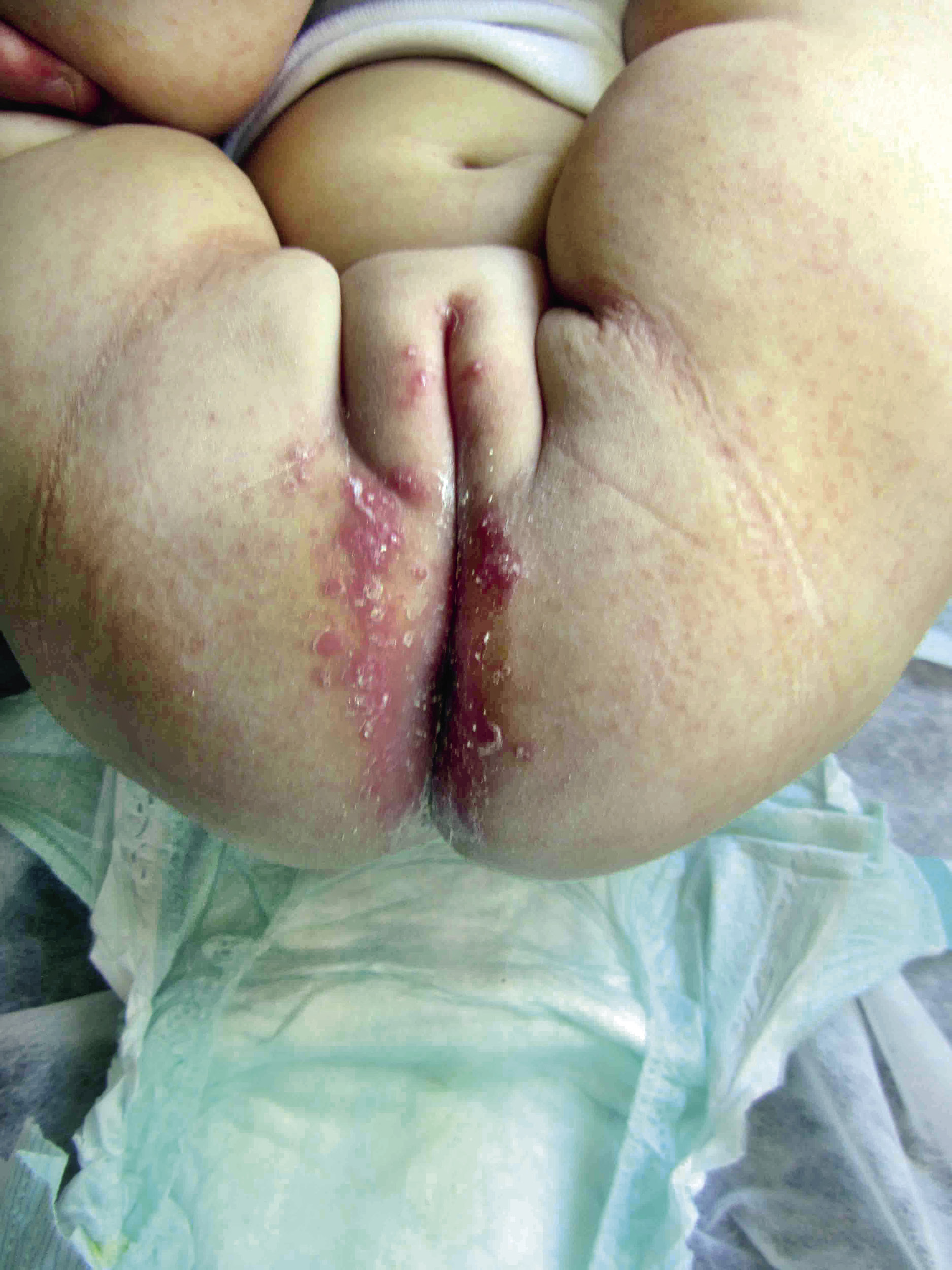
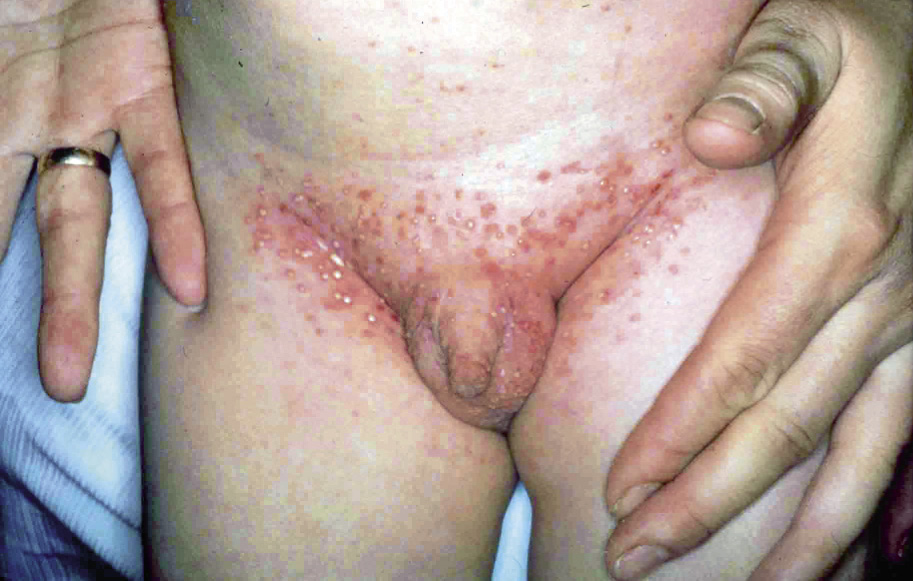
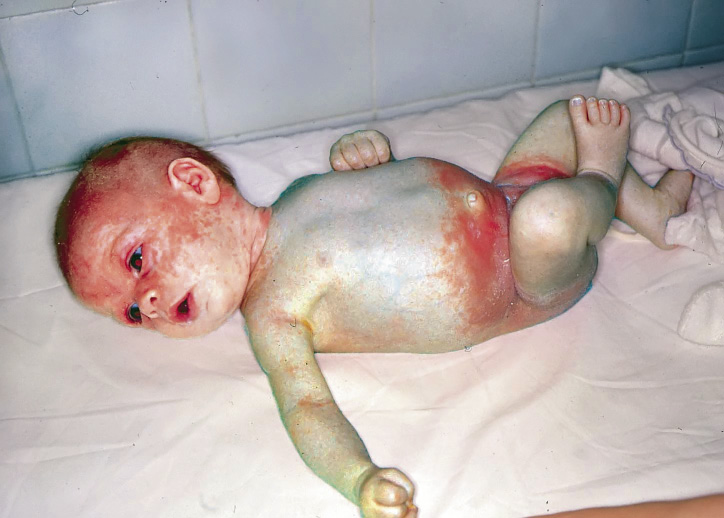



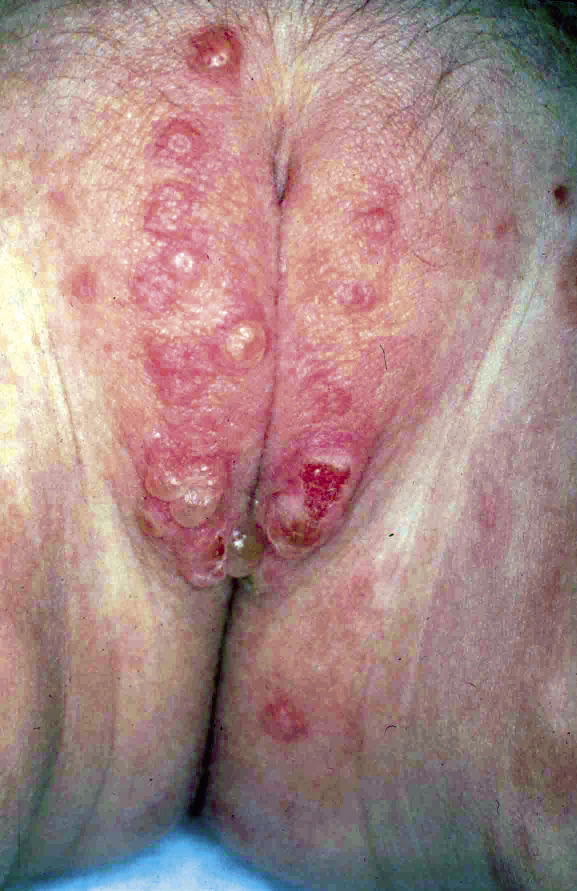
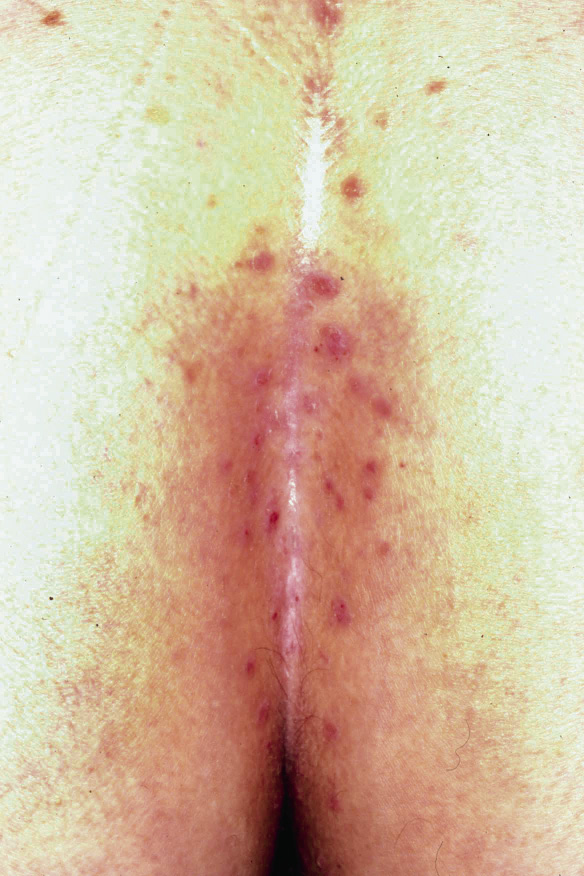

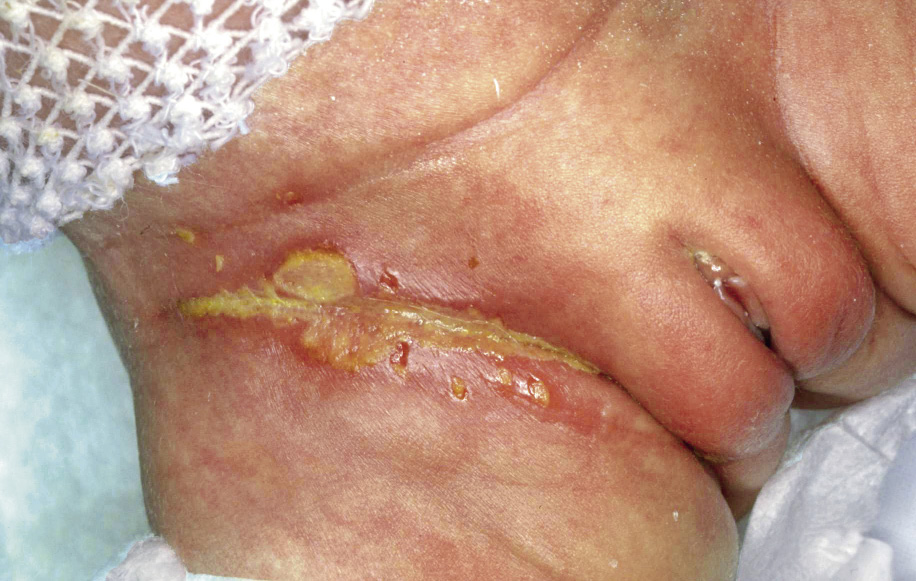

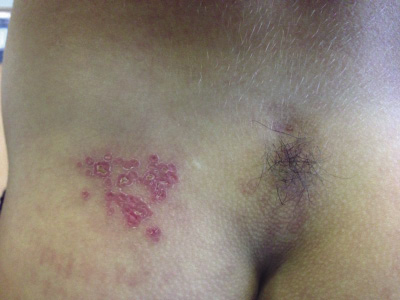 Figura 1.
Figura 1.
 Figura 2.
Figura 2.



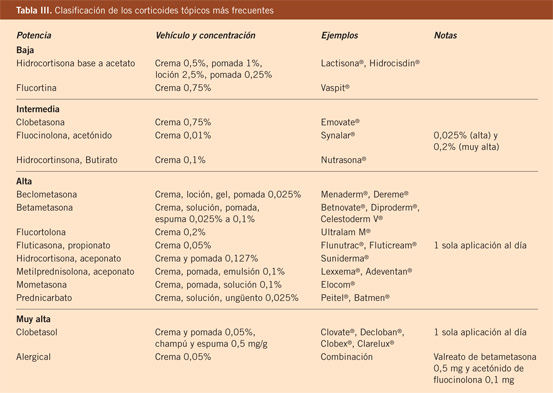

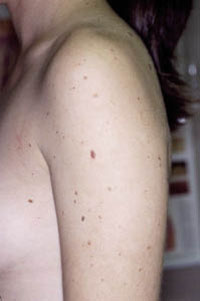 Figura 1. Paciente con abundantes nevus junturales o de la unión (lesiones planas, máculas) y nevus compuestos (sobreelevadas).
Figura 1. Paciente con abundantes nevus junturales o de la unión (lesiones planas, máculas) y nevus compuestos (sobreelevadas).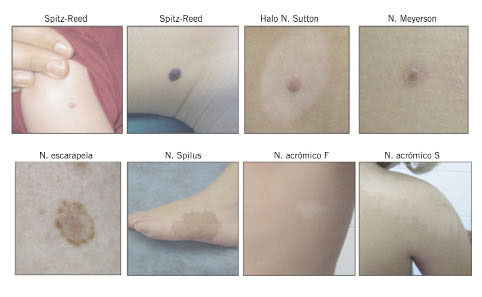 Figura 2. Figura resumen de los diferentes tipos de nevus especiales.
Figura 2. Figura resumen de los diferentes tipos de nevus especiales.
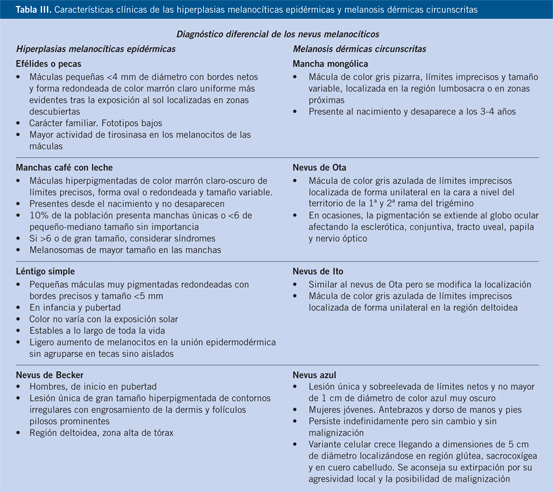
 Figura 3. Nevus de Becker. Mácula pigmentada con hipertrofia folicular en la zona abdominal de un paciente de 11 años.
Figura 3. Nevus de Becker. Mácula pigmentada con hipertrofia folicular en la zona abdominal de un paciente de 11 años.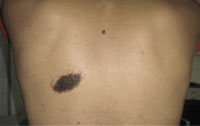 Figura 4. Nevus congénito mediano de características clínicas típicas.
Figura 4. Nevus congénito mediano de características clínicas típicas.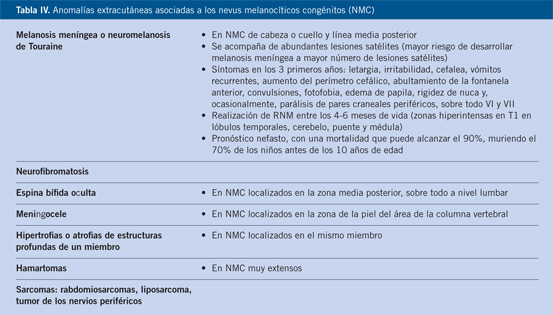
 Figura 5. Nevus congénito gigante vestimentario en capellina con morfología atípica: múltiples colores, nódulos proliferativos, bordes irregulares….
Figura 5. Nevus congénito gigante vestimentario en capellina con morfología atípica: múltiples colores, nódulos proliferativos, bordes irregulares….

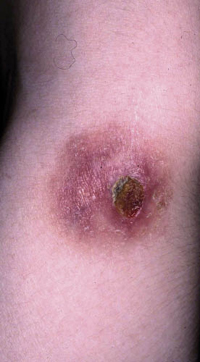
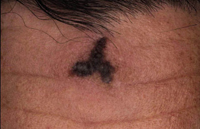
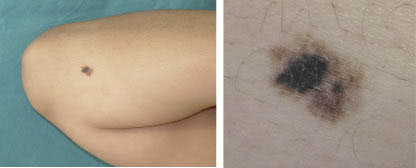 Figura 6. Melanoma de extensión superficial sobre nevus atípico en paciente de 13 años. Lesión asimétrica, de bordes irregulares con entrantes y salientes, coloración no homogénea y diámetro mayor de 6 mm.
Figura 6. Melanoma de extensión superficial sobre nevus atípico en paciente de 13 años. Lesión asimétrica, de bordes irregulares con entrantes y salientes, coloración no homogénea y diámetro mayor de 6 mm. Figura 7
Figura 7