登录方式
方式一:
PC端网页:www.rccrc.cn
输入账号密码登录,可将此网址收藏并保存密码方便下次登录
方式二:
手机端网页:www.rccrc.cn
输入账号密码登录,可将此网址添加至手机桌面并保存密码方便下次登录
方式三:
【重症肺言】微信公众号
输入账号密码登录
注:账号具有唯一性,即同一个账号不能在两个地方同时登录。
一、ARDS概述
2012年柏林定义中,急性呼吸窘迫综合征(ARDS)是指发病1周以内,有已知的呼吸系统受损的临床表现或新/加重的呼吸系统症状,胸部影像学表现为双肺斑片影—不能完全由渗出、肺不张或结节病变来解释;肺水肿起因不能完全由心力衰竭或容量过负荷解释的呼吸衰竭,没有发现危险因素时,应进行客观评估(如超声心动图等检查),以排除高静水压性肺水肿。
根据氧合指数将ARDS分为轻、中、重度三级:轻度:200 mmHg<PaO2/FiO2≤300 mmHg,PEEP or CPAP≥5 cmH2O,中度:100 mmHg <PaO2/FiO2≤200 mmHg,PEEP≥5 cmH2O;重度:PaO2/FiO2≤100 mmHg,PEEP≥5 cmH2O。其中,轻度患者没有使用呼吸机,在这一阶段也应加入膈肌保护性策略,主要涉及对膈肌的营养和支持,而ARDS中、重度患者则涉及机械通气。
在膈肌保护性通气中也会涉及ARDS的病理分期。例如在渗出期、增生期和纤维化期的病理生理改变不同,实施机械通气时的膈肌保护策略也有所差异。
ARDS的治疗包括原发病治疗、呼吸支持、ECMO、肺和膈肌保护性通气策略及液体通气。液体通气是将携氧液体通过气管灌入肺中取代气体进行氧气和二氧化碳交换的通气技术,通过携氧液体在肺泡膜形成液-液界面,气体由分压高的一侧向分压低的一侧弥散,进而达到气体交换的目的。其他治疗手段还包括液体控制、激素及药物治疗。
在ARDS的治疗流程中,在每一个时间段ARDS严重程度不同,选择的通气策略亦不同,对膈肌及肺的保护措施不同。在不同时期,应根据患者的氧合指数进行不同程度的呼吸支持。
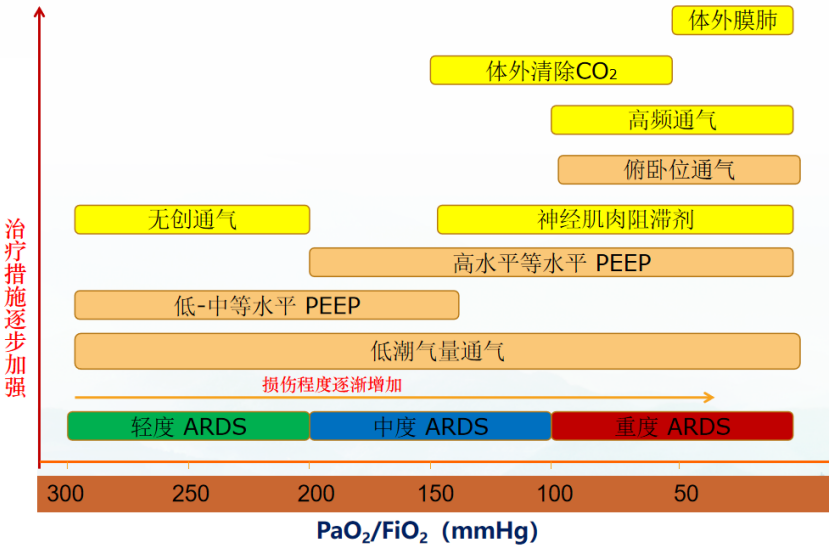
二、膈肌损伤原因及危害
膈肌是位于胸腔与腹腔之间的肌肉-纤维结构,其周围为肌腹,中央为腱膜,又被译为横膈,是机体重要的呼吸肌,占所有呼吸肌功能的60%~80%。在吸气相,膈肌收缩,膈顶下降,胸腔容积增大,压力减小;在呼气相,膈肌舒张,膈顶上升,胸腔容积减小,压力增大。在进行肺保护通气或机械通气时,不仅要关注膈肌上胸腔内的脏器,还要关注腹腔脏器。因此,在进行俯卧位通气时,也要监测腹腔压力。
2012年《新英格兰医学杂志》发表了一篇综述,其中阐述了导致膈肌功能障碍的原因,除了神经系统相关疾病外,还包括呼吸系统常见疾病(如慢阻肺和肺气肿)以及全身性疾病及废用性萎缩等[1]。
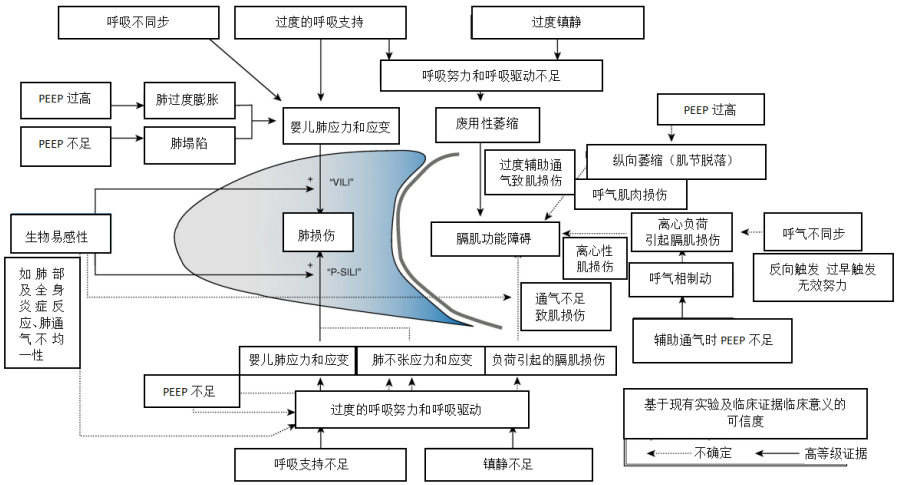
图源: N Engl J Med, 2012, 366(10):932-942.
三、ARDS膈肌保护性通气策略
Goligher等2018年提出了膈肌保护性通气策略的概念,膈肌增厚变异率可作为机械通气过程中保护膈肌功能的一个指标。该前瞻性队列研究发现,膈肌增厚变异率增加或降低10%以上时,均与膈肌功能障碍相关,而维持膈肌增厚变异率在±10%以内可在一定程度上保护膈肌功能。
过度机械通气导致膈肌活动减少,膈肌过度去负荷,对肌肉结构和功能产生有害影响。重症患者机械通气期间进行过度呼吸支持、深镇静、肌松治疗时,膈肌收缩负荷明显降低,肌原纤维内在张力负荷下降,即膈肌过度去负荷。研究显示,过度去负荷可导致膈肌蛋白合成系统下调及蛋白水解系统上调,产生膈肌萎缩和功能障碍。有研究显示肌原纤维中的主要结构蛋白肌动蛋白可能发挥了生物传感器的作用。来自动物模型和脑死亡器官供体的观察显示,膈肌中的线粒体功能障碍可能引发氧化应激和蛋白质水解,参与膈肌去负荷损伤,但也有研究显示患者机械通气早期发生膈肌萎缩,但不伴有膈肌线粒体功能障碍[6,7]。
Goligher等2018年发表了一篇文章,对需要有创机械通气的成人进行超声检查,每日测定膈肌厚度,通过膈肌增厚分数评估吸气努力,观察每天从机械通气脱机的概率与膈肌厚度相对于基线的变化幅度之间的关系[8]。如下图所示,黑色实线为膈肌厚度的基线,灰色阴影区域代表估计相对危险的95%CI。当膈肌厚度比基线值降低时,膈肌释放的概率较低。在膈肌厚度比基线增加的时间段,虽然观察到了类似的趋势(调整后的危险比为0.81;95%CI为0.62~1.06;厚度比基线增加10%),但脱机可能性并未显著降低。机械通气期间膈肌萎缩的逐渐进展与机械通气和ICU入院时间延长以及急性呼吸衰竭并发症风险增加有关。
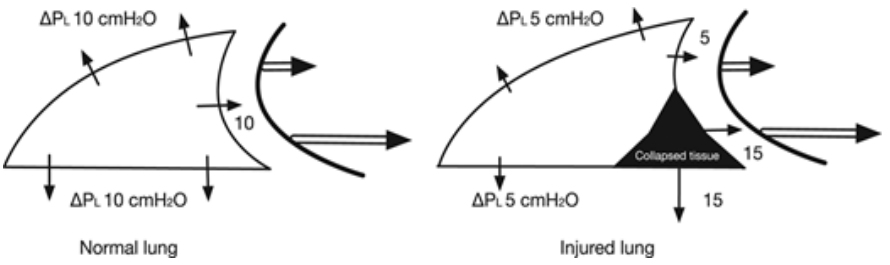 图源:Anesthesiology, 2019, 130(4):620-633.
图源:Anesthesiology, 2019, 130(4):620-633. 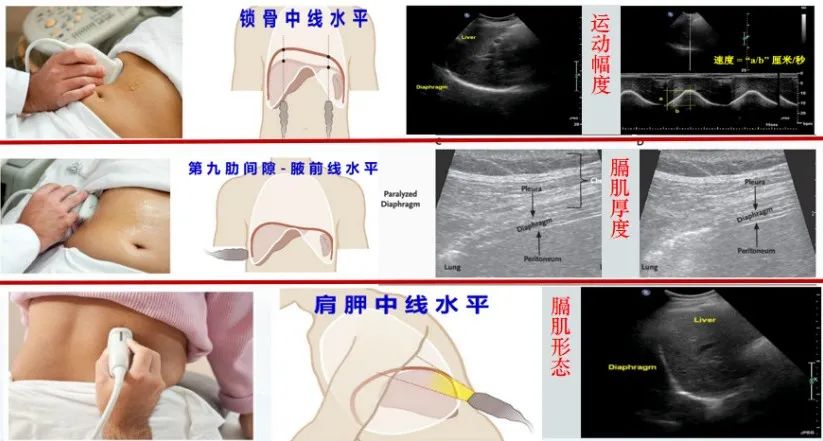
为实现膈肌保护性机械通气在重症患者中的精准化治疗,包括清醒状况下ECMO等问题仍需进一步探讨。首先,重症患者呼吸力学、血流动力学等的改变复杂,均影响自主呼吸膈肌收缩负荷和做功水平,如何实现机械通气下膈肌负荷测定和最佳负荷滴定,需要深入研究。其次,化学感受器的调节通常无法控制重症患者的吸气努力和膈肌做功,调节镇静和肌松是临床控制吸气做功的常用手段,如何合理滴定呼吸机的支持力度和镇静肌松以达到膈肌最佳负荷,仍有待研究膈肌保护策略需要确保总体肺应激的安全限度,避免通气不均匀和过度的区域应激,保持吸气努力的最佳范围,监测呼吸肌努力对于未来重症监护病房医生的技能组合至关重要。
四、总结
参考文献
[1] McCool F D, Tzelepis G E. Dysfunction of the diaphragm[J]. N Engl J Med, 2012, 366(10):932-942.
[2] Goligher E C, Dres M, Patel B K, et al. Lung-and Diaphragm-Protective Ventilation[J]. Am J Respir Crit Care Med, 2020, 202(7):950-961.
[3] Heunks L M, van der Hoeven J G. Clinical review: the ABC of weaning failure--a structured approach[J]. Crit Care, 2010, 14(6):245.
[4] Schreiber A, Bertoni M, Goligher E C. Avoiding Respiratory and Peripheral Muscle Injury During Mechanical Ventilation: Diaphragm-Protective Ventilation and Early Mobilization[J]. Crit Care Clin, 2018, 34(3):357-381.
[5] Dennis McCool F, Tzelepis G E. Dysfunction of the diaphragm[J]. N Engl J Med, 2012, 366(10):932-942.
[6] Yang L, Luo J, Bourdon J, et al. Controlled mechanical ventilation leads to remodeling of the rat diaphragm[J]. Am J Respir Crit Care Med, 2002, 166(8):1135-1140.
[7] van den Berg M, Hooijman P E, Beishuizen A, et al. Diaphragm Atrophy and Weakness in the Absence of Mitochondrial Dysfunction in the Critically Ill[J]. Am J Respir Crit Care Med, 2017, 196(12):1544-1558.
[8] Goligher E C, Dres M , Fan E , et al. Mechanical Ventilation-induced Diaphragm Atrophy Strongly Impacts Clinical Outcomes[J]. Am J Respir Crit Care Med, 2018, 197(2):204-213.
[9] Jiang T X, Reid W D, Road J D. Delayed diaphragm injury and diaphragm force production[J]. Am J Respir Crit Care Med, 1998, 157(3Pt 1):736-742.
[10] Orozco-Levi M, Lloreta J, Minguella J, et al. Injury of the human diaphragm associated with exertion and chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2001, 164(9): 1734-1739.
[11] Gea J, Zhu E, GáldizJ B, et al. Functional consequences of eccentric contractions of the diaphragm[J]. Arch Bronconeumol, 2009, 45(2):68-74.
[12] Schepens T, Goligher E C. Lung-and Diaphragm-protective Ventilation in Acute Respiratory Distress Syndrome: Rationale and Challenges[J]. Anesthesiology, 2019, 130(4):620-633.
[13] de Vries H J, Jonkman A H, de Grooth H J, et al. Lung- and Diaphragm-Protective Ventilation by Titrating Inspiratory Support to Diaphragm Effort: A Randomized Clinical Trial[J]. Crit Care Med, 2022, 50(2):192-203.
[14] Georgopoulos D, Prinianakis G, Kondil iE. Bedside waveforms interpretation as a tool to identify patient-ventilator asynchronies[J]. Intensive Care Med, 2006, 32(1):34-47.
[15] Llamas-Álvarez A M, Tenza-Lozano E M, Latour-Pérez J. Diaphragm and Lung Ultrasound to Predict Weaning Outcome:Systematic Review and Meta-Analysis[J]. Chest, 2017, 152(6):1140-1150.
[16] Farghaly S, Hasan A A. Diaphragm ultrasound as a new method to predict extubation outcome in mechanically ventilated patients[J]. Aust Crit Care, 2017, 30(1):37-43.
[17] Reynolds S C, Meyyappan R, Thakkar V, et al. Mitigation of Ventilator—induced Diaphragm Atrophy by Transvenous Phrenic Nerve Stimulation[J]. Am J Respir Crit Care Med, 2017, 195(3):339-348.
[18] Mankowski R T, Ahmed S, Beaver T, et al. Intraoperative hemidiaphragm electrical stimulation reduces oxidative stress and upregnlates autophagy in surgery patients undergoing mechanical ventilation: exploratory study[J]. J Transl Med, 2016, 14(1):305.
作者简介
 后可发表评论
后可发表评论




友情链接
联系我们
 公众号
公众号
 客服微信
客服微信