全民健康助力全面小康·专题笔谈│ 儿童肺血管疾病的影像学诊断
段晓岷,于 彤
中国实用儿科杂志 2020 Vol.35(9):704-711
摘要
肺血管疾病是一组累及包括各级肺动、 静脉及肺毛细血管在内的肺循环疾病, 其致病因素各异, 病理改变多样。儿童与成人肺血管疾病从致病因素、 发病机制、 病理生理学, 临床表现及预后等方面均存在较大差异。儿童肺血管性疾病包括以下几大类别:(1)先天性肺血管病变,包括各级别的肺动、 静脉畸形、 肺毛细血管发育异常、 气管支气管畸形伴肺血管畸形、 血管淋巴异常等;(2)肺血管栓塞性病变, 包括炎症性栓塞, 肿瘤性栓塞;(3)肺血管炎性病变;(4)肺动脉高压性病变;(5) 肺部血管源性肿瘤。儿童常见肺血管疾病常用的影像学检查方法有胸部X线平片、 超声心动图、 胸部CT增强扫描、 肺血管造影检查、 核医学肺通气/灌注显像等。该文对上述儿童常见肺血管疾病影像学检查方法的选择及影像学诊断要点进行概述。
关键词
儿童;肺血管疾病;先天性肺血管病;肺血管栓塞;肺血管炎;肺动脉高压;血管源性肿瘤
肺血管疾病是一组累及肺循环各级肺动、 静脉及肺毛细血管的广泛而病理改变多样的疾病,其发生是多因素导致的。正常情况下肺组织是双重循环器官, 即肺循环和体循环两套血管系统, 并各自执行不同的功能与作用, 但在病理状态下,体循环的支气管动脉、 冠状动脉、 肋间动脉等, 也会参与一部分肺循环, 出现相应病症。儿童肺血管疾病与成人肺血管疾病从致病因素、 发病机制、病理生理学, 临床表现及预后等方面均存在较大差异。儿童肺血管疾病的致病因素通常与年龄相关, 婴幼儿多与遗传或先天性畸形、 免疫状态、 早产、 缺氧、 吸入相关, 年长儿则多与感染性、 炎症性、 代谢性、 肿瘤性及外伤性等因素相关[1-4] 。
儿童肺血管性疾病包括以下几大类别:(1)先天性肺血管病变,包括肺动脉起源异常及肺静脉回流异常,发生在肺动脉各级分支血管、毛细血管、各级肺静脉分支血管的肺动静脉畸形;(2)肺血管栓塞性病变,包括炎症性栓塞,肿瘤性栓塞;(3)肺血管炎性病变;(4)肺动脉高压性病变;(5)肺部血管源性肿瘤。
1 儿童肺血管疾病影像学评价方法
影像学检查对肺血管性疾病的诊断、 鉴别诊断和病情评价具有重要价值。常用的影像学检查方法有胸部X线平片、 超声心动图、 胸部CT增强扫描, 肺血管造影检查、 核医学肺通气/灌注显像等[1-5] 。
1.1 胸部X线平片 受到其空间分辨率的限制,普通的胸部平片的敏感性和特异性较低, 对于肺血管病变的诊断价值有限, 常用于排除其他疾病,如大叶性肺炎、气胸等。
1.2 超声心动图 能够很好地观察心脏大血管结构, 血流方向, 并且可以快速评估心室功能, 测定肺动脉压力, 加之超声心动图没有辐射问题, 因此是进行心脏大血管结构和功能评价的首选检查方法, 其局限性在于诊断范围仅限于心脏大血管,无法显示肺动静脉主干以下分支肺血管的异常。
1.3 CT扫描 近年来CT技术发展迅速,使CT成为诊断肺血管疾病的常规影像学检查方法。CT扫描速度快,可以在一次屏气中完成整个胸部扫描并成像,实现容积采集,能提供精确的空间、密度和时间分辨率,可以一次检查同时对多个环节进行评价,除肺动静病变外,肺间实质病变、心脏病变、纵隔病变甚至腹部病变等导致的肺血管病变亦可进行评价。
CT观察肺组织较其他检查方法有明显优势,尤其CT高分辨扫描对小血管、小气道、小叶间隔等肺间质结构的敏感性特异性高。CT增强分期(动脉期和静脉期)扫描,不仅可以区分肺动、静脉,显示肺组织内血管的分布、血管管腔通畅性,还可以对肺实质病变内肺血管的状况进行判断,粗略的评估肺血流的灌注情况,可以显示扫描范围内心脏及胸部其他大血管。对于怀疑心脏大血管病变或冠状动脉病变的患儿,可以采用心脏CT扫描模式进行相关病变的诊断。
CT图像是数字化图像, 利用软件对原始图像进行二维、 三维重建处理, 可多角度、 多模式来观察肺血管、 气道、 骨骼及病灶状况, 极大的拓展了CT在肺血管疾病中应用和诊断价值。近年来, CT能谱技术在评价肺血管疾病如肺栓塞(pulmonary embolism,PE)中的潜在附加值引起了人们极大的兴趣, 除了标准的灰度CT图像外, 还生成了碘分布图, 该图与肺灌注相关, 可以评估由各种原因造成的肺灌注不足的程度, 其敏感性和特异性均高于胸片和常规CT, 与核医学V/Q扫描的敏感性和特异性几乎相同。
CT检查的不足为具有辐射性,不能进行血管压力的测定。
1.4 肺血管造影 肺血管造影是肺血管显像的金标准,主要用于观察大血管及分支的走行及分布,准确判断动静脉畸形的部位,动静脉分流(瘘)程度,测定肺动脉压力。其缺点是有创性检查,并且对比剂使用相对过多,无法显示肺组织或纵隔结构,目前很少单纯用于肺血管疾病的诊断,更多用于肺血管病变的治疗,如药物或机械性溶栓、动静脉畸形(瘘)的栓塞、侧支血管的栓塞以及狭窄段血管的支架置入等。
1.5 核医学的通气/灌注显像 用于评估肺实质通气和血流灌注状况,优点是对肺内病变进行通气障碍及灌注障碍的鉴别诊断,对于肺内微小的肺动静脉瘘的诊断具有极高的灵敏性和特异性。缺点是空间分辨力低,无法获得高分辩的解剖结构异常。
1.6 磁共振(MR)成像 MR检查的优点是无射线暴露,组织分辨率高,缺点是扫描时间长,噪音大,价格昂贵,图像质量受患儿呼吸运动影响较大,不合作患儿需深度镇静或麻醉后检查。MRA是非对比剂血管成像,无需使用对比剂,是观察血管病变的方法,其对管腔显示较敏感,但对管壁的显示不佳。大血管炎观察血管壁的病变常用T2W抑脂序列,表现为血管壁的增厚,信号增高及管腔狭窄,尤其管壁水肿提示活动期病变,但其应用仅限于大、中血管病变。MR对于肺血管病变,尤其是中小血管病变的诊断价值有限。心脏MR是评估心室功能、血流、心肌病变的金标准,对于无需评估右心功能的患儿,暂不推荐做心脏MR。
对于肺血管疾病的影像学检查报告, 需要对血管的起源, 走行路径, 管径, 管壁, 管腔的状况等特征进行描述, 对于肺内血管畸形性病变的部位进行准确描述, 并描述供血动脉及引流静脉, 对于大于2 mm血管畸形性病变需要进行三维层面的测量,对于小于2 mm血管畸形性病变仅需进行描述;对于大动脉炎, 需要对受累的血管进行列举, 对一级及二级血管管径、 管壁厚度进行描述和测量,对于三级及以下分支血管病变仅需对管腔的经线是否均匀, 管壁是否增厚进行描述;对于肺血管内的栓子, 需要进行定位描述, 并对栓子周围肺野病变进行描述。另外由于小血管病变不能通过直接征象进行诊断, 更需要关注可能出现的间接征象, 如肺野透光度减低, 侧枝血管丰富, 肺内有无病变及病变性质, 心脏异常增大等征象。
综上,影像科医生需要根据患儿肺血管疾病的特点,合理有效应用不同的影像学技术,以实现为临床提供更精准更丰富的信息,协助临床进行诊断及监测疗效。
2 各种儿童肺血管疾病的影像学特点
2.1 先天性肺血管病 先天性肺血管病分为肺动脉系统发育畸形、肺静脉系统发育畸形、体肺循环异常沟通三大类,另外,肺血管与气道发育高度协调,从胚胎期到儿童期肺的生长发育一直在持续,肺血管发育略早于气道发育,当血管发育异常时常会伴有气道及肺组织的发育异常[6-8] 。本文仅对肺内肺动静脉畸形进行阐述。
肺动静脉畸形(pulmonary arteriovenous malformation,PAVM)是指肺动脉与肺静脉之间缺乏正常的毛细血管网,存在低阻力的、高流量的异常血管交通,导致肺内循环出现右向左分流,PAVM可以是全身性AVM的一部分。原发性PAVM大多数是先天性的,其中80%~90%为遗传性出血性毛细血管扩张症(HHT / Osler-Weber-Rendu综合征,OWRS)。余为散发性及继发性。继发性PAVM常继发于胸部手术、创伤、肺结核、放线菌病、血吸虫病、肝硬化相关肝肺综合征(hepatopulmonary syndrome,HPS)和转移癌等。
PAVM的临床表现取决于病变区右向左分流的程度。轻者无症状,偶然发现,重者常表现有低氧血症,肺动脉高压,血管出血的相关症状,PAVM好发于下叶、中叶和舌叶,直立位血管内因重力作用,分流量增多,更易导致缺氧加重。严重的PAVM可出现大咯血和自发性血胸,还可引起脑短暂性缺血发作、脑卒中、内脏或四肢缺血/梗死,脑脓肿及心内膜炎等。
CT增强检查是PAVM诊断的金标准(图1)。CT影像学上,PAVM病灶可见供血动脉及引流静脉。大约90%的PAVM是单一供血动脉,少数可见多支供血动脉,单支或多支引流静脉。供血动脉大部分起源于正常肺动脉分支,很少可见起自体动脉,如肋间动脉、胸膜动脉、隔膜动脉,支气管动脉和内乳动脉。通常是通过肺静脉引流,少数情况下汇入下腔静脉和左心房。供血动脉及引流静脉之间的连接区域可能表现为动脉瘤样、海绵状/窦腔样、 迂曲扩张的血管团(丛), 或扭曲扩张的异常交通血管, 血管张力略高, 根据CT影像学特点,PAVM可表现为4种类型:(1)毛细血管扩张型PAVM:是PAVM病变的早期,多见于儿童及HHT患儿,病变为毛细血管网后静脉及毛细血管网扩张引起,在CT影像学上表现为磨玻璃影,偶见中间小结节,为扩张的小静脉。如果伴随其他较为显著的PAVM病灶或确诊HHT者,可提示诊断。CT增强的MIP图像,能够提高小病灶的检出率。这种病灶可以发展为单纯型或混杂型PAVM。(2)单纯型PAVM:肺野内不规则软组织密度占位,单发或多发。病变多位于下肺野,肺野中外带分布,病变呈类圆形,分叶状、条状或不规则状,边缘清晰锐利,增强后病变可见单支供血动脉,一支或多支引流静脉,血管可见不均匀扭曲、扩张,引流静脉较供血动脉略粗大,病变区可见明显迅速强化,强化程度同供血动脉,并动脉期可见引流静脉显示,亦可见病变侧肺静脉早显,当病变的窦腔内及血管内有血栓形成时,增强后表现为造影剂充盈缺损区。(3)混杂型PAVM:病变可见多支供血动脉,多支引流静脉,余影像学表现与单纯性病变相似,病变区的软组织密度分隔影不一定明确显示。(4)弥漫型PAVM:是一种较为特殊的PAVM,常见于HHT及下腔静脉与肺动脉相关的Glenn分流术后,病变广泛累及整个肺叶、肺段及肺亚段的血管,亦可全肺血管受累。病变血管均匀扩张,无占位样病灶,无病变血管的扭曲及不均匀扩张。

2.2 肺栓塞 (pulmonary embolism,PE) 儿童肺栓塞多见于先天性心脏病、肠外营养、手术、中心静脉导管留置、炎症、肿瘤、肾病综合征及先天性抗凝机制缺陷,这与成人肺栓塞不同,成人肺栓塞多由深静脉血栓脱落所致。儿童肺血管内的栓子根据病变血管不同分为静脉栓子及动脉栓子;根据栓子在管腔内位置的不同分为血管中心型栓子及附壁栓子;根据栓子形成时间分为急性栓子及机化型栓子;根据栓子成份不同分为血栓、瘤栓、菌栓及其他生物性栓子等[9] 。
对于临床怀疑有肺栓塞的患儿,目前首选的影像学检查方法是胸部增强CT。随着CT设备空间分辨率、时间分辨率及各种后重建算法的提高和进步,胸部增强CT不仅能够准确检测出肺动脉干、左右主肺动脉、肺叶动脉、肺段动脉分支内的血栓,也大大提高了亚段肺栓塞(subsegmental pulmonary embolism,SSPE)(肺动脉血管中直径2~3 mm的充盈缺损)的检出率[10] 。为临床医生制定治疗计划、评价治疗效果提供了有价值的信息。如肺栓塞仅发生在亚段,小栓子可通过肺血管固有的纤溶活性溶解,无需特殊处理;如发生在大肺动脉分支的新鲜栓子,需要采取积极溶栓处理;如栓子为机化型栓子,溶栓处理往往得不到预期疗效。
肺血管栓子的影像学表现分为直接征象和间接征象。肺血管栓塞的直接影像学征象为血管腔内的对比剂充盈缺损(图2),中心型栓子表现为完全性对比剂充盈缺损、轨道征或环形征,附壁栓子表现为管腔限局性偏心性狭窄,狭窄段是由于贴于肺动脉壁的广基底血栓向管腔内凸起所致。部分陈旧栓子及瘤栓在CT平扫序列图像可见结节样钙化灶。肺血管栓塞的间接影像学征象为:(1)CT增强图像可见栓塞血管所属肺野透亮度增高,是由于栓塞动脉血管及分支血管对比剂充盈减少所致;(2)栓塞血管所属肺野实变不张,实变肺野呈楔形或三角形,宽基底贴近外周胸膜,尖端指向肺门,病理改变为栓塞血管所属肺实质内出血、渗出、水肿及肺不张;(3)增强后,如果出现一支肺静脉回流较正常肺静脉分支延迟,提示所属肺段肺动脉灌注延迟,存在肺动脉分支的狭窄、栓塞或闭塞,此时肺动脉的灌注阻力增加可能通过邻近肺野肺动脉侧枝或通过体循环侧枝来保障肺灌注,致静脉回流延迟[11] ;(4)节段肺野内中心肺动脉及分支较邻近肺野的动脉增粗时,需警惕所属肺段肺静脉栓塞的可能。

2.3 肺血管炎(pulmonary vasculitis) 血管炎是指血管壁的炎症,可发生于全身各处的血管,是儿童较少见的病症,根据病因可将其分为原发性血管炎和继发性血管炎。原发性血管炎是一组病因不清,以血管壁的炎症和纤维素样坏死为病理变化,以多器官系统受累为主要临床表现的一组疾病,其发病的靶器官为血管。继发性血管炎可由药物反应、感染、免疫反应等引起,血管及血管壁周围有炎症细胞浸润,并伴有血管损伤。2005年,欧洲抗风湿病联盟(EULAR)和欧洲儿童风湿病学会(PRES)根据病变血管大小,将儿童血管炎分为大血管炎、中血管炎、小血管炎(肉芽肿性和非肉芽肿性)和“其他”血管炎四大类[12] 。儿童肺部常见的大血管炎为多发性大动脉炎,中血管炎为川崎病,小血管炎及“其他”血管炎主要是结缔组织病引起的肺血管炎。血管受累的部位、受累血管的大小、血管损伤的程度直接影响到血管炎的临床表现和影像学特点。
对于儿童大、中血管炎影像学关注要点:(1)大血管管壁是否光滑, 是否增厚, 增厚的程度;(2)管腔是否有狭窄及扩张, 管壁是否有血栓、 动脉瘤形成;(3)对管腔最狭窄处、扩张处及狭窄段峰流速进行测量;(4)病变血管所属组织脏器是否受累及累及范围, 超声多普勒技术和CT增强扫描是检测的首选检查方法;对于肺部小血管炎及其并发症, 影像学主要关注的是小血管、 小气道及两肺间实质状况, 故胸部CT扫描是首选检查方法。
多发性大动脉炎:肺动脉可以单独或合并其他大血管(如主动脉、颈总动脉、头臂动脉、锁骨下动脉等)受累,急性期的影像学特点为肺动脉管壁增厚,管腔狭窄或闭塞,部分病例肺动脉内可有血栓形成,主要累及段和亚段肺动脉,少部分累及叶或主肺动脉。静止期表现为管腔形态不规则,管壁增厚不明显,管壁上可有钙化。
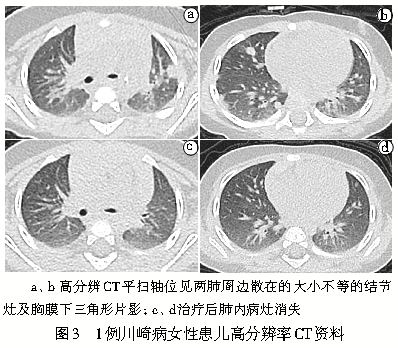
儿童最常见的中动脉炎是川崎病。它是一种急性、自限性的系统性血管炎,主要累及中等大小的肌性动脉,除了累及冠状动脉还可累及肺血管。川崎病导致的冠状动脉炎如果处于疾病早期,及时诊治可降低冠状动脉瘤的发生率。部分川崎病患儿早期的胸部CT可表现为肺门淋巴结肿大、肺门周围血管增粗、边缘毛糙,或肺内散在的小的磨玻璃结节伴或不伴胸膜渗出,这可能与血管炎症导致血管通透性增加有关(图3)。在临床工作中发现部分川崎病患儿肺内多发实性结节,其病理改变是淋巴细胞和组织细胞浸润性血管炎伴有梭形细胞增殖[12] 。
小血管炎最常见的是抗中性粒细胞胞浆抗体(ANCA)相关性血管炎, 是以坏死性炎症为特点的血管炎, 包括无肉芽肿形成的显微镜下多血管炎(microscopic polyangiitis, MPA)及有肉芽肿形成的肉芽肿性血管炎(granulomatosis with polyangiitis,GPA)和嗜酸性肉芽肿性血管炎(eosinophilic granulomatosis with polyangiitis, EGPA)[13-14]。AAV 最常受累的器官是肺和肾。MPA表现为非肉芽肿性, 病理学表现为坏死性中性粒细胞性毛细血管炎。是肺肾综合征最常见的病因, 病变常同时累及肺毛细血管和肾小球, 临床表现以肺出血、 肾脏功能损害多见, 可累及多脏器血管, 造成多脏器病损。对于临床出现有肺出血且肾功能有损伤的患儿, 均应接受胸部CT检查。MPA在高分辨率CT上常表现为双侧斑片状或弥漫性磨玻璃影, 有肺野周边分布趋势, 中下肺野病变较上肺野严重, 提示肺出血, 出血量大时可有片状实变影, 病灶内可伴小叶间隔增厚, 如果反复出血可导致肺纤维化表现为双肺网格状影、 支气管牵拉性扩张、 支气管管壁增厚扭曲等(图4)。韦格纳肉芽肿属于有肉芽肿形成的GPA,常先累及肺部, 其中常累及口、 鼻、 气管及近端支气管等呼吸系统中心区域, 患儿可表现有鼻漏、 鼻出血, 甚至鼻甲及鼻中隔的骨破坏。CT三维气道重建可显示气管支气管壁增厚, 气管管腔变窄。双肺CT可见单发或多发的大小不等的结节、 肿块及空洞, 随机分布, 以胸膜下多见, 结节从数毫米到10 cm, 5 mm以上较多见, 结节较小时其内可有支气管充气征穿行。病变进展期结节周围可出现磨玻璃影(晕征), 是肺泡出血或有血管渗出的表现。增强CT扫描时, 实性结节或肿块内呈弱或不强化的低密度区, 提示缺血坏死, 坏死物排出会呈现为厚壁空洞, 内壁常不光整且无钙化。肺内细小支气管受累可导致局部节段性气肿或气道阻塞性肺不张, 两肺弥漫的磨玻璃影提示血管炎性肺出血, 胸膜下楔形肺实变灶提示肺梗塞。EGPA也称Churg-Strauss综合征, 发病年龄偏大, 婴幼儿少见。其组织病理学特点是坏死性小血管炎、 嗜酸性粒细胞浸润伴坏死性肉芽肿。临床上几乎所有患儿均有哮喘, 肺出血少见。影像学表现为双肺内一过性非节段性实变或磨玻璃影, 可发生于肺的任何部位, 以肺周边为多见,类似嗜酸细胞性肺炎。部分患儿可有小叶间隔增厚(可能嗜酸性细胞浸润所致)。由于嗜酸性细胞可浸润支气管, 胸部CT可出现小叶中心结节、 树芽征、 支气管扩张、 支气管壁增厚等气道病变, 尤其是有哮喘的患儿气道病变更为常见。当患儿出现心衰或嗜酸细胞刺激胸膜时出现胸腔积液。

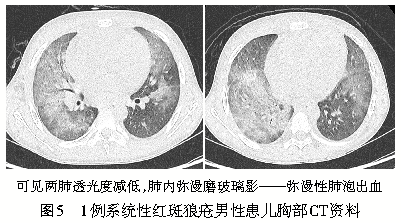
“其他”类血管炎以结缔组织病(connective tissue disease,CTD)相关血管炎为主,其中系统性红斑狼疮(SLE)性小血管炎最为常见。SLE血管炎常累及次级肺小叶内小动脉,是免疫复合物介导的坏死性小动脉炎和毛细血管炎。胸部高分辨CT扫描呈小叶中心性结节伴或不伴有小叶内间隔增厚,且肺周边明显,部分病例可有胸膜下小的楔形梗死灶;当出现弥漫性肺出血时,两肺透光度减低,肺内斑片状、大片状或弥漫性磨玻璃影(图5),同时可合并急性狼疮性肺炎、肺水肿或胸腔积液。病程较长及病情反复时,可导致肺间质纤维化,肺静脉闭塞和肺动脉高压,当两肺周围或叶间裂胸膜下可见多发的成串的大小不等的囊泡影,此征象提示病变已进展至肺纤维化阶段且病变不可逆。
2.4 肺动脉高压(pulmonary arterial hypertension,PAH) PAH是指一组肺血管压力增高性疾病,可以是一种独立的疾病,也可以是并发症,还可以是综合征。可以是肺循环本身血管病变,也可以在其他疾病进展中发生,并随着疾病的进展,最后发生右心衰竭。
由于胎儿出生时具有胎儿循环特征,肺循环的压力与体循环压力相似,直到2~3月龄以后才降低到成人的水平, 因此大于3月龄婴幼儿及儿童平均PAH (mPAP)≥25 mmHg(1 mmHg=0.133 kPa),定义为儿童肺动脉高压。对于先心病性儿童PAH,建议使用单位体表面积的肺血管阻力,即肺血管阻力指数( pulmonary vascular resistance index,PVRI)做为评价PAH的参数,PVRI ≥3 WU·m2可以诊断为PAH。
2018 6th WSPH[3]对肺动脉高压进行了最新分类。儿童肺动脉高压以特发性、遗传性、先天性心脏病相关性、系统性或代谢性、支气管肺发育不良性肺动脉高压为多见。新生儿多为新生儿持续性肺动脉高压。
影像学检查可以对肺动脉高压的诊断提供两方面信息,一是确定是否存在肺动脉高压,二是判断导致肺动脉高压的可能病因。最常用的影像学检查方法是超声心动图,CT增强扫描及心脏MR检查。超声心动图是肺动脉高压初诊及筛查的首选检查,它通过测量三尖瓣返流峰值流速来判断是否存在肺动脉高压,而且可以显示心内结构。CT增强扫描是评估肺动脉高压的影像学检查方法之一。在CT增强图像上,肺动脉主干直径(pulmonary trunk diameter,PTD)以及肺动脉主干直径与同层面升主动脉直径的比值(PTD-to-ascending aorta diameter ratio,rPTAo)是评估肺动脉高压的主要CT参数。成人肺动脉主干直径超过29 mm,或者rPTAo>1,可诊断肺动脉高压,这种评价标准不适合处在生长发育期的儿童。Shyh-Jye Chen等[15] 研究显示儿童PTD及rPTAo与身高密切相关,PTD与身高呈正相关,rPTAo与身高呈负相关。因此儿童要想使用PTD及rPTAo作为CT评估肺动脉高压的指标,需使用身高值进行标准化处理。除了进行血管管径的测量和评估,CT还可以提供扫描范围内心脏大血管的形态及结构,协助了解是否存在先心病及大血管病变等。
CT检查一个巨大优势是对肺野内病变的显示,在儿童引起肺动脉高压的病因众多,其中肺内病变如气管支气管肺发育异常性病变,肺间质疾病,肺部小血管性病变、遗传代谢病等是导致儿童肺动脉高压的常见原因。对于肺动脉高压明确的患儿,胸部HRCT扫描是查找病因的有效方法,如甲基丙二酸血症(methylmalonic academia,MMA)伴同型半胱氨酸血症(homocysteinemia,Hcy)是引起肺动脉高压比较常见的遗传代谢性病,其胸部CT肺内改变有一定的特征性,表现为两肺弥漫性磨玻璃结节,边缘模糊,及小叶间隔增厚(图6),据文献尸检报道MMA、Hcy患儿肺部病变的病理改变为毛细血管后肺静脉内皮细胞明显增生影,提示为肺静脉闭塞[16] 。

2.5 肺部血管源性肿瘤(pulmonary vascular tumors) 儿童血管源性肿瘤常见发生于皮肤及肝脏,肺血管瘤较为罕见[4,17] ,笔者所在北京儿童医院临床所见包括先天型血管瘤(congenital hemangioma)、婴儿型血管瘤(infantile hemangioma),肺上皮样血管内皮细胞瘤(pulmonary Epithelioid hemangioendothelioma,P- EHE)及卡波西样血管内皮瘤(Kaposiform hemangioendothelioma,KHE)。肺内血管源性肿瘤的诊断首选胸部CT增强扫描。
先天型血管瘤及婴儿型血管瘤都是良性的血管增生性病变。先天性血管瘤指在子宫内发生、生长,出生即存在,但以后不再生长的血管瘤。婴儿型血管瘤是出生时不存在或病灶不明显,在临床上有三个明显的发展阶段:快速增生期(6~12个月)、退化期和伴有程度不同的纤维脂肪残留的末期。全身各部位均可发病,非关键部位的瘤体可自发消退,但在咽喉部及气管内等关键部位的血管瘤,常在快速增生期引起临床症状,出现气道阻塞导致呼吸困难甚至死亡,CT扫描可以定性,平扫时瘤体呈软组织密度,增强后瘤体明显强化,边缘清晰锐利,压迫邻近气道。
肺上皮样血管内皮细胞瘤(P-EHE)罕见,发生于肺及胸膜,影像学上需与转移瘤、肺结核、真菌感染等鉴别。其恶性程度介于血管瘤和血管内皮肉瘤之间,儿童可发病,并且女性发病多见。胸部CT是诊断的主要检查方法,表现为肺内支气管周围及胸膜下多发小结节灶、肿块伴结节灶、单发肿块病变,瘤灶呈稍低软组织密度,内可见有点状或粗大钙化,增强后瘤灶强化,延迟期为轻度强化。上皮样血管内皮细胞瘤可发生于身体任何部位,多系统受累是诊断重要线索之一(图7)。

KHE是罕见血管源性肿瘤。可以出生时即发病, 也可以出生后形成, 常为1岁前发病。病变具有侵袭性, 可造成邻近骨骼破坏及出现卡梅现象。KHE常发生于四肢和躯干, 胸部受累时常发生于纵隔、肺及胸壁, 可采用增强的胸部CT或MR检查进行显像。
(2020-07-20收稿) 返回搜狐,查看更多
责任编辑: