2021年11月,美国食品和药物管理局(FDA)已批准BESREMi(ropeginterferon alfa-2b-njft),用于治疗成年人真性红细胞增多症(PV)。该批准是基于PEGINVERA研究(NCT01193699)的结果,这是一项为期 7.5 年的前瞻性、多中心、单臂试验。
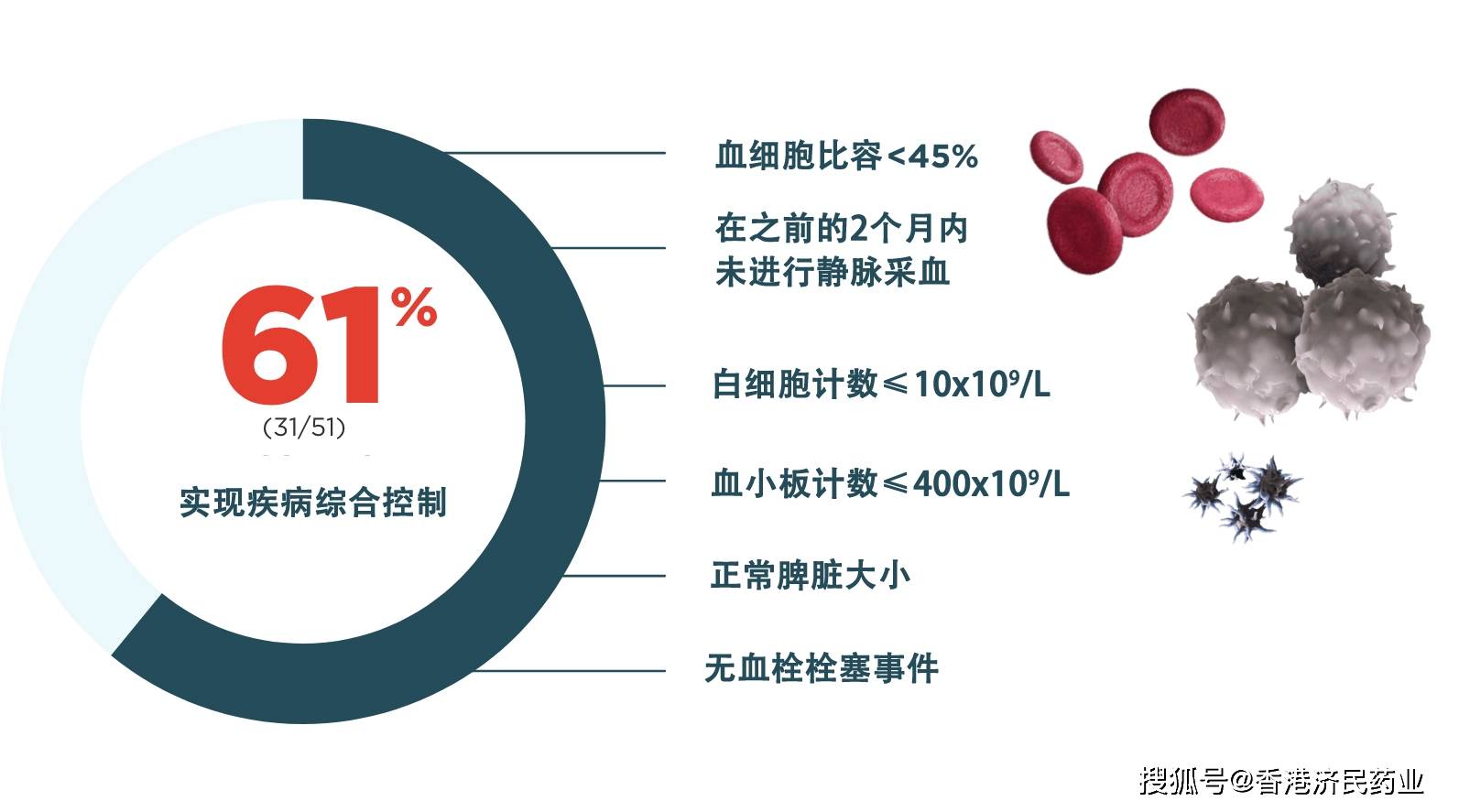
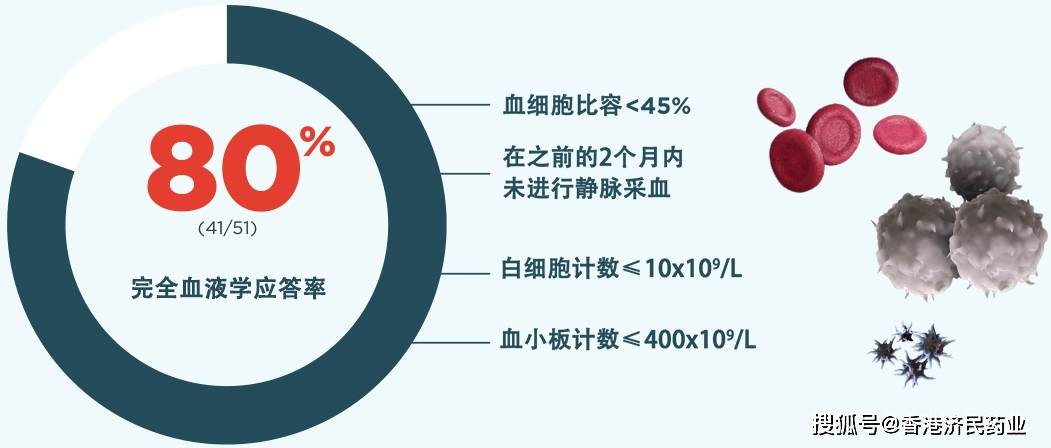
研究结果显示,61%的患者在治疗期间达到完全血液学应答(CHR) ,80%的患者产生血液学应答。血液学应答定义为血细胞比容< 45%,且在之前的2个月内未进行静脉采血,血小板< 400 x 109/L且白细胞< 10 x 109/L,超声评估脾脏大小正常且无血栓栓塞事件。
真性红细胞增多症是一种源于骨髓中致病干细胞的癌症,会导致红细胞、白细胞和血小板慢性增加。该症可导致血栓形成、栓塞等心血管并发症,并常转化为继发性骨髓纤维化病或白血病。尽管该症的分子机制仍需要深入研究,但目前的结果表明该症存在一系列获得性突变,其中最重要的是JAK2突变。

该症的治疗包括静脉切开术(通过静脉中的针头去除多余血细胞的手术)以及减少血细胞数量的药物;Besremi就是其中一种药物,这是一种创新的单PEG化长效干扰素,靶向骨髓、真性红细胞增多症的根源,可以解决潜在的疾病。它被认为是通过附着在体内的某些受体上,引发连锁反应,使骨髓减少血细胞的产生。
在给药方面,患者每两周皮下注射一次。如果Besremi能够减少多余的血细胞并维持正常水平至少一年,则给药频率可降至每四周一次。

BESREMi在美国获得治疗真性红细胞增多症的孤儿药称号。其于2019年获得欧洲药品管理局(EMA)批准,2021年在美国获得批准,最近在台湾和韩国获得批准。在美国批准的3个月后,NCCN指南纳入了BESREMi,将其作为成人真性红细胞增多症的推荐治疗方案。
注:本文旨在介绍医药健康研究,不作任何用药依据,具体用药指引,请咨询主治医师。返回搜狐,查看更多
责任编辑: