|
败血症是指各种致病菌侵入血液循环,并在血中生长繁殖,产生毒素而发生的急性全身性感染,是重症监护病房(ICU)住院患者中最常见的死亡原因之一。
01、发病机制
败血症不仅是全身性炎症反应或免疫失调的过程,而且还涉及体内多个器官功能的改变。如图所示在细胞和分子水平上,败血症的发病机理极为复杂,包括炎症反应失衡,免疫功能异常,线粒体损伤,凝血病,神经内分泌免疫网络异常,内质网应激,自噬和其他病理生理过程,最终导致器官功能障碍。

败血症的复杂机制。
1.炎症失衡
炎症失衡是败血症发病机理的最关键基础,并贯穿败血症的整个过程,引起这种反应的病原体包括细菌,真菌,寄生虫和病毒等生物。机体最初应对病原体侵入通常会导致巨噬细胞吞噬病原体并产生一系列促炎细胞因子的,进而触发细胞因子风暴和激活先天免疫系统。
2.免疫功能障碍
当败血症发生炎症时,中性粒细胞与内皮细胞相互作用,并在趋化因子的驱动下迁移到炎症部位,识别并吞噬病原体,释放各种活性因子和蛋白水解酶,并消除病原体。单核/巨噬细胞在受到细胞因子(例如,粒细胞巨噬细胞集落刺激因子(GM-CSF),TNF-α,INF-γ)或病原微生物,化学介质,免疫复合物等刺激后被激活。活化的细胞吞噬并杀死多种病原体并呈递抗原。分化的效应T细胞进一步促进巨噬细胞的活化并分泌大量活性介质,从而引起组织的损伤和纤维化。
3.线粒体损伤
线粒体是涉及能量产生,蛋白质合成和分解代谢的主要部分。然而,败血症引起的线粒体损伤或功能障碍可导致细胞代谢紊乱,能量产生不足和氧化应激,从而引起器官细胞和免疫细胞的凋亡,从而最终导致免疫紊乱,多器官功能衰竭甚至死亡。
4.神经内分泌-免疫网络异常
体内平衡也依赖于神经内分泌免疫系统的相互作用,是感染性休克在宿主应答的关键组成部分。在发生威胁的情况下,中枢神经系统通过以下三种主要机制对败血症做出反应:(1)自主神经系统,其中原发神经(迷走神经和三叉神经)和感觉神经与PAMP相关,并导致炎症性细胞因子激活; (2)循环炎症介质,通过脉络丛与中枢神经系统相连的心室器官发挥作用;(3)通过血脑屏障激活内皮细胞,引起炎症介质(NOS代谢物)释放。
02、标志物
促炎细胞因子
TNF,IL-1β和IL-6是介导先天免疫系统对损伤或感染产生初始应答的细胞因子。在内毒素相关的革兰氏阴性感染的败血症中,TNF和IL-1β的含量均升高。事实上,在诱发败血症性休克方面,给实验动物使用TNF(或IL-1β)和使用内毒素一样有效。与其他两种细胞因子相比。IL-6在血浆中的检测更可靠,并且还具有其他潜在的临床用途,例如自身免疫性风湿病的诊断和处理。像TNF和IL-1β一样,IL-6对败血症也不具有特异性,它作为脓毒症生物标志物的主要作用与预后相关,而不是诊断。研究表明,败血症患者IL-6水平升高与死亡率增加相关。
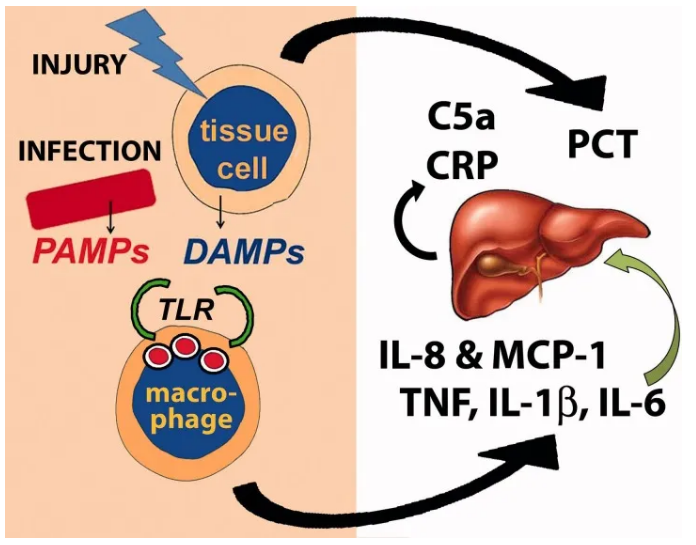 败血症始于感染或组织损伤。巨噬细胞受体(例如TLR)可以识别来自入侵生物的PAMP或来自受损组织细胞(或两者)的DAMP。这导致促炎细胞因子例如TNF,IL-1β和IL-6以及趋化因子例如IL-8和MCP-1的产生。IL-6刺激肝脏产生CRP和补体蛋白。机体中的许多细胞也会对感染和伤害产生PCT。 败血症始于感染或组织损伤。巨噬细胞受体(例如TLR)可以识别来自入侵生物的PAMP或来自受损组织细胞(或两者)的DAMP。这导致促炎细胞因子例如TNF,IL-1β和IL-6以及趋化因子例如IL-8和MCP-1的产生。IL-6刺激肝脏产生CRP和补体蛋白。机体中的许多细胞也会对感染和伤害产生PCT。
PCT和CRP
PCT和CRP都是响应感染和/或炎症而产生的蛋白质。CRP是公认的感染和炎症生物标志物。它是急性期反应物之一,这些蛋白质在肝脏合成被IL-6上调。CRP在急性炎症中的作用尚不完全清楚。它可能会结合微生物(和受损的宿主细胞)的磷脂成分,从而促进它们被巨噬细胞去除。Pentraxin 3(PTX3)是另一种与CRP结构相似的蛋白,它主要由炎症细胞而非肝脏。像CRP一样,PTX3的升高与败血症的严重程度相关。
中性粒细胞表面受体(CD64)
Fc-γ受体1(FcγR1),通常称为CD64,属于主要在巨噬细胞和单核细胞上表达的免疫球蛋白家族,也是先天性和适应性免疫应答的关键免疫调节剂。在健康志愿者中,FcγR1/ CD64在嗜中性粒细胞中的表达极低,但在炎症或感染后会明显升高。也有报道中性粒细胞上的FcγR1/ CD64表达与SIRS和败血症的严重程度有关。
基质金属蛋白酶(MMP)
MMP和金属蛋白酶组织抑制剂(TIMPs)是调节内部损伤后伤口愈合的关键介质。在败血症中,MMP-9,TIMP-1和TIMP-2的表达水平也升高显著。MMP-9,TIMP-2和TIMP-1对败血症具有更高的敏感性,特异性和阳性预测值。
03、免疫系统的作用
免疫抑制
败血症的发病伴随着先天和适应性免疫反应的缺陷,进而导致败血症早期的免疫抑制。败血症通过至少三种不同的机制引起免疫抑制。淋巴结,脾脏,肠道,肺以及其他器官中T细胞和B细胞的大量凋亡是导致免疫反应不良的明显原因。T和B细胞凋亡是通过内在途径(线粒体)和外在途径(涉及Fas和Fas配体以及TNFα及其受体)的结合诱导的。巨噬细胞和树突状细胞功能障碍和耗尽在败血症期间也有发生,导致抗原呈递给T细胞受损。进而损害了适应性免疫。在败血症中,吞噬细胞的先天免疫功能(例如趋化和杀菌反应)受到损害,这也会大大降低对传染性生物的抵抗力。
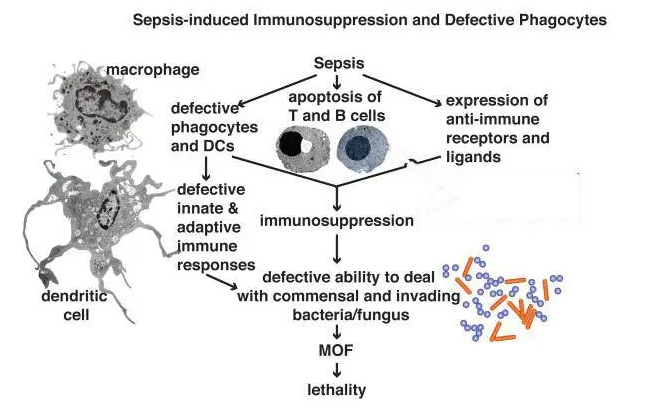
败血症导致的免疫抑制和吞噬细胞缺陷。败血症会导致免疫抑制和吞噬功能缺陷,这是由于巨噬细胞和DC的耗竭或功能缺陷,T细胞和B细胞的凋亡以及抑制免疫反应的抑制性配体和受体的组织表达(主要是通过靶向T细胞)引起的。免疫抑制和吞噬细胞功能缺陷,导致无法清除入侵的细菌和真菌。
固有免疫
在败血症期间,存在大量的内皮细胞(EC)功能障碍,并表现为几种病理过程,包括毛细血管渗漏,血管舒缩张力改变和微血管血栓形成。败血病患者的单核细胞也表现出LPS刺激后分泌促炎性细胞因子TNF,IL-1β,IL-6和IL-12的能力降低。单核细胞分泌促炎细胞因子的能力降低,表明细胞内信号转导已转向产生抗炎介质,这与医院获得性、持续和继发性感染有关,最终会增加脓毒症相关的死亡率。
适应性免疫
在大多数败血症患者中,循环的淋巴细胞和胃肠道上皮细胞会发生明显的细胞凋亡。淋巴细胞凋亡现在已被认为是败血症发病机理中的重要步骤,并导致败血症的免疫抑制。阻断淋巴细胞凋亡和/或恢复淋巴细胞功能的治疗已经产生了很有前途的临床前数据,这些数据可能导致人类脓毒症发作后新的治疗方法。
04、败血症与肠道菌群
败血症患者的肠道菌群组成严重失调。一般而言,败血症患者入院后微生物群的多样性迅速下降,这一发现在其住院后期变得更加明显。微生物群组成的这些变化可以部分归因于临床干预,如肠内喂养、机械通气,以及质子泵抑制剂、阿片类药物、血管加压素,尤其是抗生素的使用。此外败血症患者胃肠蠕动减弱,肠上皮完整性受损,导致有益的厌氧菌菌群减少,导致进一步损伤肠上皮功能,有益菌移位。

肠道微生物组破坏和败血症之间途径的概念图。肠道微生物组的改变导致致病微生物的紊乱(可能存在于肠道微生物组中的潜在致病细菌),免疫失调和短链脂肪酸(肠道微生物组产生的有益产物)的产生减少。这些变化可以降低败血症发生的阈值。败血症和抗生素治疗可在一个恶性循环中加剧微生物组破坏,导致持续的终末器官功能障碍。
产品推荐
单/多因子检测
| 种属 |
检测技术 |
检测方向 |
货号 |
检测因子 |
| Human |
MSD |
Viral Infection |
LX-K15345D-1 |
IL-1β, IL-6, IL-8, TNF-α |
| Human |
MSD |
Viral Infection |
LX-K15346D-1 |
IFN-γ, IL-1β, IL-4, IL-6, IL-8, IL-10, TNF-α |
| Human |
MSD |
Viral Infection |
LX-K15347D-1 |
IFN-γ, IL-1β, IL-4, IL-5, IL-6, IL-8, IL-10, IL-12p70, TNF-α |
| Human |
Luminex |
Sepsis |
LX-HSP1MAG-63K-06 |
sFAS / TNFRSF6,sFasL,sICAM-1,MIF,PAI-1 (total),sVCAM-1 |
| Human |
Luminex |
Sepsis |
LX-HSP2MAG-63K-07 |
Granzyme B,HSP70,IL-1α,IL-8/CXCL8,MIP-1α/CCL3,MIP-1β/CCL4,MMP-8 |
| Human |
Luminex |
Sepsis |
LX-HSP3MAG-63K-05 |
Lactotransferrin (LTF),Neutrophil Elastase-2(ELA2),NGAL/Lipocalin-2,Resistin,Thrombospondin-1(TSP-1) |
| Human |
Luminex |
Cytokine |
LX-12007283 |
FGF-basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-1α, IL-2Rα, IL-3, IL-12(p40), IL-16, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, GRO-α, HGF, IFN-α2, LIF, MCP-3, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIG, β-NGF, SCF, SCGF-β, SDF-1α, MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF, CTACK, MIF, TRAIL, IL-18, M-CSF, TNF-β |
| Human |
Luminex |
Chemokine |
LX-171AK99MR2 |
6Ckine/CCL21,BCA-1/CXCL13,CTACK/CCL27,ENA-78/CXCL5,Eotaxin/CCL11,Eotaxin-2/CCL24,Eotaxin-3/CCL26,Fractalkine/CX3CL1,GCP-2/CXCL6,GM-CSF,Gro-α /CXCL1,Gro-β/CXCL2,I-309/CCL1,IFN-I,IL-18,IL-2,IL-4,IL-6,IL-8/CXCL 8,IL-10,IL-16,IP-10/CXCL 10,I-TAC /CXCL11,MCP-1 /CCL2,MCP-2 /CCL8,MCP-3 /CCL7,MCP-4 /CCL13,MDC/CCL 22,MIF,MIG/CXCL19,MIP-1α/CCL3,MIP-1δ/CCL15,MIP-3a/CCL20,MIP-3β/CCL19,MPIF-1/CCL23,SCYB16/CXCL 16,SDF-1α+β/CXCL12,TARC/CCL17,TECK/CCL25,TNF-α |
| Human |
Luminex |
Cytokine |
LX-M500KCAF0Y |
FGF basic, Eotaxin, G-CSF, GM-CSF, IFN-γ, IL-1β, IL-1rα, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-12(p70), IL-13, IL-15, IL-17, IP-10, MCP-1(MCAF), MIP-1α, MIP-1β, PDGF-BB, RANTES, TNF-α, VEGF |
| Human |
MSD |
Proinflammatory |
LX-K15049D-1 |
IFN-γ, IL-1β, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12p70, IL-13, TNF-α |
| Mouse |
Luminex |
Chemokine |
LX-12009159 |
BCA-1/CXCL13, CTACK/CCL27, ENA-78/CXCL5, Eotaxin/CCL11, Eotaxin-2/CCL24, Fractalkine/CX3CL1, GM-CSF, I-309/CCL1, IFN-γ, IL-1β, IL-2, IL-4, IL-6, IL-10, IL-16, IP-10/CXCL10, I-TAC/CXCL11, KC/CXCL1, MCP-1/CCL2, MCP-3/CCL7, MCP-5/CCL12, MDC/CCL22, MIP-1α/CCL3, MIP-1β/CCL4, MIP-3α/CCL20, MIP-3β/CCL19, RANTES/CCL5, SCYB16/CXCL16, SDF-1α/CXCL12, TARC/CCL17, TNF-α |
| Mouse |
Luminex |
Cytokine |
LX-M60009RDPD |
IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-9, IL-10, IL-12 (p40), IL-12 (p70), IL-13, IL-17A, Eotaxin, G-CSF, GM-CSF, IFN-γ, KC, MCP-1 (MCAF), MIP-1α, MIP-1β, RANTES, TNF-α |
| Mouse |
MSD |
Proinflammatory |
LX-K15048D-1 |
IFN-γ, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-10, IL-12p70, KC/GRO, TNF-α |
| Rat |
Luminex |
Cytokine |
LX-12005641 |
G-CSF, GM-CSF, GRO/KC, IFN-γ, IL-1α, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12(p70), IL-13, IL-17A, IL-18, M-CSF, MCP-1, MIP-1α, MIP-3α, RANTES, TNF-α, VEGF |
| Rat |
MSD |
Proinflammatory |
LX-K15059D-1 |
IFN-γ, IL-1β, IL-4, IL-5, IL-6, IL-10, IL-13, KC/GRO, TNF-α |
参考文献:
[1]Max W. Adelman, Michael H. Woodworth, Charles Langelier, Lindsay M. Busch, Jordan A. Kempker, Colleen S. Kraft, and Greg S. Martin. The gut microbiome’s role in the development, maintenance, and outcomes of sepsis. Crit Care. 2020; 24: 278.
[2]Min Huang, Shaoli Cai Jingqian Su. The Pathogenesis of Sepsis and Potential Therapeutic Targets. Int J Mol Sci. 2019 Nov; 20(21): 5376.
[3]James D. Faix. Biomarkers of sepsis. Crit Rev Clin Lab Sci. 2013 Jan; 50(1): 23–36.
[4]Markus Bosmann, Peter A. Ward. The Inflammatory Response in Sepsis. Trends Immunol. 2013 Mar; 34(3): 129–136.
[5]Jordi Rello, Francisco Valenzuela-Sánchez, Maria Ruiz-Rodriguez, Silvia Moyano. Sepsis: A Review of Advances in Management. Adv Ther. 2017; 34(11): 2393–2411.
[6]Matthew J. Delano1 Peter A. Ward.The Immune System’s Role in Sepsis Progression, Resolution and Long-Term Outcome. Immunol Rev. 2016 Nov; 274(1): 330–353.
|












 沪公网安备31011502400759号
沪公网安备31011502400759号
 营业执照(三证合一)
营业执照(三证合一)


