修回日期: 2011-07-06
接受日期: 2011-07-11
在线出版日期: 2011-07-28
胃肠道类癌并不多见, 尤其是胃肠镜下活检钳净的微小类癌更是少见. 本文报道2例胃底及回肠末端活检钳净的微小类癌, 并结合文献, 就胃肠道的微小类癌的内镜下表现, 诊断及治疗进行复习.
引文著录: 许良璧, 项一宁, 车筑平, 谭庆华. 胃肠镜下活检钳净微小类癌2例. 世界华人消化杂志 2011; 19(21): 2297-2300
Revised: July 6, 2011
Accepted: July 11, 2011
Published online: July 28, 2011
The incidence of gastrointestinal carcinoids is low. Complete remove of minute tumors (≤5 mm) by gastrointestinal endoscopic biopsy is rare. Here we report two cases of carcinoids in the fundus and distal ileum which were completely removed by endoscopic biopsy. We also performed a literature review to summarize the endoscopic features, diagnosis and treatment of minute carcinoids.
- Citation: Xu LB, Xiang YN, Che ZP, Tan QH. Complete removal of carcinoids by gastroenterological endoscopic biopsy: a report of two cases. Shijie Huaren Xiaohua Zazhi 2011; 19(21): 2297-2300
- URL: https://www.wjgnet.com/1009-3079/full/v19/i21/2297.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v19.i21.2297
胃肠道类癌发病率较低, 近年来由于内镜检查的广泛开展, 胃肠类癌的发生率有了上升趋势. 其预后与病变直径、浸润深度、有无转移等相关. 因此对于局限的、直径较小的类癌, 早期诊断及内镜下的治疗, 可以改善其预后. 我们报道2例胃底及回肠末端微小类癌, 经内镜下活检钳净并诊断.
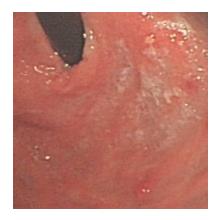
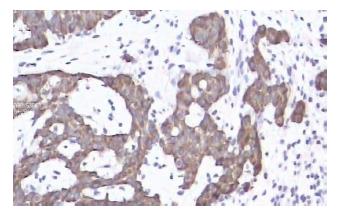
患者1, 女, 52岁, 因上腹部不适3 mo, 就诊贵阳医学院附属医院门诊. 查体: 无异常. 胃镜检查发现胃底穹隆部见一直径约0.4 cm的息肉样隆起(图1), 表面颗粒样改变, 局部充血明显, 活检质软钳净. 另见一淡黄色粗糙黏膜, 稍隆起, 活检质软. 余胃窦、胃体黏膜充血, 散在红斑渗出. 病理示: 胃底息肉样隆起为类癌, 免疫组织化学CK(+)、CgA(+)、CD56(+)、Syn(+)和NES(+)(图2); 胃底淡黄色粗糙黏膜为慢性炎症并泡沫细胞增生. 入院后患者进行血常规正常, 其中HGB 124 g/L. 肝肾功能、血糖等生化检查正常, CA199、CA125、CA153均正常. 腹部CT示: 胃窦壁稍增厚, 胆囊未见, 肝脏未见异常, 余正常. 患者强烈要求手术治疗, 行近端胃大部切除术, 切除术后标本提示胃黏膜慢性炎症, 未见残余癌, 切缘未见癌累计, 找到淋巴结4枚, 未见癌转移.
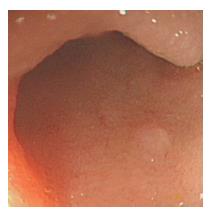
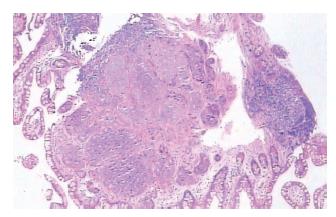
患者2, 男, 72岁, 因腹痛、腹泻2 mo入院. 入院查体: 无异常. 肠镜检查示全大肠散在多发圆形小溃疡及糜烂. 末端回肠距回盲瓣10 cm, 见一小白色小隆起约0.3 cm, 边界不清(图3), 活检钳净质软. 病理结果(图4): 回肠末端隆起为类癌, 免疫组织化学: CK(+)、CgA(+)、Syn(+)、CD56(+)NSE(+). 结肠、直肠糜烂黏膜为慢性中-重度炎. 胸片正常. 腹部CT: 无异常. 血常规、肝肾功、血糖、CEA正常. 患者行回盲部切除术. 术后病理: 回盲部黏膜中度慢性炎, 未见残余类癌、两切断未见癌累积, 找到淋巴结5枚, 呈反应性增生.
胃类癌发病率较低, 近年来由于内镜检查的广泛开展, 胃类癌的发生率有了上升趋势[1]. 大部分的胃内分泌肿瘤为高分化非功能性肠嗜铬样(enterochromaffin-like, ECL)样细胞类癌, 发生于胃底或胃体的嗜酸性黏膜. Rindi等[2]将胃类癌分3型: Ⅰ型与自身免疫性慢性萎缩性胃炎(A-CAG)有关, Ⅱ型与多发性内分泌肿瘤Ⅰ型和卓-艾综合征有关, Ⅲ型散在分布, 与高胃泌素血症或A-CAG无关.
Ⅰ型和Ⅱ型类癌的内镜下表现相似, 一般为多发、小的圆形、广基息肉样病变或黄褐色的小结节, 直径0.5-1.0 cm, 病变多位于胃体, 局限于胃黏膜层或黏膜下层. Ⅲ型类癌多为单一的病变, 可发生于胃内任何位置, 1/3的患者诊断时病变直径>2 cm. Nakamura等[3]报道的8例胃类癌内镜下表现为: 胃体或胃底的光滑圆形隆起、被覆正常黏膜, 肿瘤中央可表现为不规则形凹陷性红斑或溃疡, 可单发(5/8)或多发(3/8); 而且该部位进行活检阳性率高(6/8).
目前认为ECL细胞类癌的发展经过为: 增生-异性增生-肿瘤, 在既往的研究中已得到证实[1,4]. 增生和异性增生被视为胃类癌的癌前病变[1]. 在既往的报道中也显示[5,6], 恶性贫血伴高胃泌素血症的患者, 胃镜检查并活检证实为多发胃体、胃底类癌, 当胃窦切除、胃泌素恢复正常后, 类癌消失. 这就提示这些类癌有可能是ECL细胞增生, 而不是真正的肿瘤. 2000年WHO胃类癌诊断标准中提出[1], 当结节>0.5 cm或浸润至黏膜下层时才能被分类为类癌.
我们报道的这例胃类癌, 没有类癌综合征, 病变于胃底、孤立的结节直径0.4 cm, 活检钳一钳取净, 病理活检诊断类癌, 切除胃底、胃体黏膜也未发现萎缩, 也没有发现类癌细胞的残留. 这里出现一个问题, 我们所诊断的这例患者到底是胃类癌, 还是ECL细胞增生? 病变直径0.4 cm, 活检标本未能达黏膜下层, 术后切除胃的标本也未找到类癌细胞, 按照2000年WHO的诊断标准是否应诊断为ECL细胞增生.
然而, 近期也有文献报道[7], 病变局限在黏膜或黏膜下层<0.5 cm的胃微小类癌, 发生肝转移. 而活检钳净的胃微小类癌国内外也有报道[8]. 此外胃镜操作中活检时, 标本深度一般为黏膜层, 达到黏膜下层有一定的困难. 胃类癌多数发生于胃底、胃体, 该部位血管丰富, 深取材后易造成大出血. 虽然可以采用超声内镜来了解病变浸润深度, 但对于此类微小病变浸润深度的判断准确性又有多大? 因此, 用病变直径<0.5 cm或浸润至黏膜下层, 作为区别类癌和癌前病变的标准是否合适?
如前所述的ECL细胞增生, 多数发生在A-CAG的基础上. A-CAG在中国人群中并不多见. 遗憾的是患者当时没有进行血清胃泌素的检查. 然而我们报道这例患者, 切除的胃底体标本中无萎缩, 患者无贫血, 我们推测患者没有高水平的胃泌素, 无刺激ECL细胞的增生的基础; 再结合病理切片的镜下表现, 我们认为病变是胃微小类癌, Ⅲ型.
的确在明确的增生和明确的肿瘤之间总存在一系列连续改变, 这就造成在区分这两种病变中带有主观判断性. 我们必须清楚地认识到这种情况可能只是在肿瘤发展过程中的一个特定时间点的表现, 肿瘤的体积大小并不能改变多数肿瘤的恶性生物学行为的实质. 然而, 就微小胃类癌的治疗及预后来说, 只要病变没有出现转移, 如果内镜下钳除或内镜下EMR术后, 只需要定期随访即可, 不需要进行外科手术.
近期亦有较多文献报道质子泵抑制剂(proton pump inhibitors, PPIs)的使用和胃类癌的发病率升高有关. Hodgson等[9]报道, 在1981-2000年其间, 美国的胃类癌发病率升高了8-9倍, 这和1980年后PPIs的使用是有关的. 如今PPIs在中国也被广泛使用, 因此对于长期使用PPIs的患者, 内镜医生进行胃镜检查时, 发现胃底胃体息肉样隆起性病变时要引起重视, 应考虑类癌的可能, 并行活检.
小肠内分泌肿瘤的患者, 多因间隙性腹痛就诊, 这提示存在间隙性的肠梗阻. 小肠类癌, 尤其是小类癌的诊断是相当困难的. 用肿瘤的直径来判断转移情况是不可靠的, 有文献报道直径<0.5 cm的类癌发生转移[10]. 国内也有报道距回盲瓣25 cm的回肠微小类癌(直径0.5 cm), 引起消化系出血[11].
我们报道的这例回肠末端类癌, 患者因为慢性腹泻而就诊, 但结肠镜检查显示大肠散在多发糜烂, 患者没有出现其他类癌综合征的临床表现, 因此不好用类癌来解释患者的腹泻. 病变是活检后诊断的.
回肠末端是一个淋巴组织比较丰富的部位, 肠镜操作时易在回肠末端发现小的黏膜下隆起, 通常被认为是淋巴滤泡增生. 回肠末端的淋巴滤泡在儿童及年轻人多见, 一般为多发, 大小不等圆形黏膜下隆起, 半透有明感, 活检对鉴别淋巴滤泡与类癌很有帮助. 由于回肠末端类癌最常见发生于60-70岁老年人, 可单发或多发, 因此对于老年人进行肠镜检查时, 可根据需要对这种小的隆起性病灶进行活检.
有学者[7]提出病变局限在胃肠道黏膜或黏膜下的类癌称为早期类癌, 如病变直径≤5 mm称为微小类癌, 直径5-10 mm称为小类癌. 在他们的报道中, 这种直径10 mm以下的早期类癌最好发的是直肠(44%), 其次是胃(23.5%), 空肠回肠早期类癌仅占0.08%. 我们所报道的这两例微小类癌, 活检钳均钳净, 术后标本未见癌残留, 无转移, 可称为"一钳类癌". 因此提醒消化内镜医生注意, 应加强对微小病变活检, 避免漏诊.
随着消化内镜技术在临床上的广泛开展, 胃肠道类癌的诊断有增多趋势. 然而, 经活检钳净的微小的胃肠道类癌报道并不多见.
张小晋, 主任医师, 北京积水潭医院消化内科
Soga教授研究了1 914例直径≤5 mm及5.1-10 mm、浸润深度在黏膜及黏膜下层的胃肠道类癌, 就其分布部位, 转移情况, 5年生成率等相关资料进行分析统计.
本文病例罕见, 具有临床指导价值.
编辑:李薇 电编:何基才
| 1. | Hamilton SR, Aaltonen LA, 虞 积耀, 崔 全才. 消化系统肿瘤病理学和遗传学. 北京: 人民卫生出版社 2006; 63. |
| 2. | Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a clinicopathologic study. Gastroenterology. 1993;104:994-1006. [PubMed] |
| 3. | Nakamura S, Iida M, Yao T, Fujishima M. Endoscopic features of gastric carcinoids. Gastrointest Endosc. 1988;37:535-538. [PubMed] [DOI] |
| 4. | Solcia E, Bordi C, Creutzfeldt W, Dayal Y, Dayan AD, Falkmer S, Grimelius L, Havu N. Histopathological classification of nonantral gastric endocrine growths in man. Digestion. 1988;41:185-200. [PubMed] |
| 5. | Hagarty S, Hüttner I, Shibata H, Katz S. Gastric carcinoid tumours and pernicious anemia: case report and review of the literature. Can J Gastroenterol. 2000;14:241-245. [PubMed] |
| 6. | Richards AT, Hinder RA, Harrison AC. Gastric carcinoid tumours associated with hypergastrinaemia and pernicious anaemia--regression of tumors by antrectomy. A case report. S Afr Med J. 1987;72:51-53. [PubMed] |
| 7. | Soga J. Early-stage carcinoids of the gastrointestinal tract: an analysis of 1914 reported cases. Cancer. 2005;103:1587-1595. [PubMed] [DOI] |
| 9. | Hodgson N, Koniaris LG, Livingstone AS, Franceschi D. Gastric carcinoids: a temporal increase with proton pump introduction. Surg Endosc. 2005;19:1610-1612. [PubMed] [DOI] |
| 10. | Makridis C, Oberg K, Juhlin C, Rastad J, Johansson H, Lörelius LE, Akerström G. Surgical treatment of mid-gut carcinoid tumors. World J Surg. 1990;14:377-383; discussion 384-385. [PubMed] [DOI] |