修回日期: 2012-12-12
接受日期: 2012-12-17
在线出版日期: 2012-12-28
目的: 探讨有效提高结直肠子宫内膜异位症术前活检诊断准确率的方法及思路.
方法: 回顾性分析我院2002年至今收治的6例结直肠子宫内膜异位症患者的临床表现、肠镜结果, 对比术前活检和术后手术标本的组织病理学表现, 分析误诊的原因, 同时行ER、PR、CK7、CK20和CD10的免疫组织化学检测.
结果: 结直肠子宫内膜异位和结直肠癌临床表现、肠镜结果、B超和CT检查结果在一定程度上相似; 本组6例结直肠子宫内膜异位症肠镜活检诊断中, 3例误诊为慢性炎症, 其中1例认为伴有中度异型增生; 1例误诊为溃疡, 误诊率达67%(4/6). 异位子宫内膜的免疫组织化学表型为腺体Ck7阳性, 腺体及内膜间质ER、PR阳性以及间质细胞CD10阳性, 而正常结直肠黏膜免疫组织化学表型为: 腺上皮Ck7阴性, 上皮及黏膜固有层间质ER、PR及CD10阴性. CK20在异位子宫内膜腺体及肠黏黏膜腺上皮内表达均为阴性. 本组6例手术后大标本免疫组织化学检测结果与术前肠镜活检标本免疫表型均显示一致.
结论: 本研究表明仅根据临床症状, 影像学和内镜检查结果, 临床医生很难将其与恶性肿瘤区分; 而通过形态学观察, 并且综合特征性的临床病史、结合免疫组织化学检测ER、PR及CK7可以有效提高结直肠子宫内膜异位症术前活检诊断的准确率.
引文著录: 余俊, 李燕, 潘华雄, 贺骏, 聂秀. 结直肠子宫内膜异位症术前活检病理误诊分析6例. 世界华人消化杂志 2012; 20(36): 3795-3800
Revised: December 12, 2012
Accepted: December 17, 2012
Published online: December 28, 2012
AIM: To discuss the methods for improving the accuracy of preoperative diagnosis of rectosigmoid endometriosis.
METHODS: From December 2002 up to now, six patients with intestinal endometriosis were treated at our hospital. The clinical manifestations, enteroscopic findings, and histopathological manifestations of preoperative biopsy specimens and postoperative specimens removed by laparotomy or laparoscope resection were analyzed. A review of the literature was also performed.
RESULTS: Four (66.7%) cases of the rectosigmoid endometriosis were misdiagnosed clinically, including 1 case misdiagnosed as glandular dysplasia and 3 cases as chronic inflammation (including 1 case as ulcers). Immunohistochemical staining for ER, PR, CK7, K20 and CD10 were performed. Normal colorectal epithelia were negative for CK7, ER, and PR, whereas rectosigmoid endometriosis was positive for CK7, ER, and PR and showed endometrial stromal expression of CD10.
CONCLUSION: Combination of clinical manifestations, colonoscopic findings, and immunohistochemistry can improve the accuracy of preoperative diagnosis of endometriosis.
- Citation: Yu J, Li Y, Pan HX, He J, Nie X. Rectosigmoid endometriosis: Practical approaches to improve the possibility of obtaining a definite preoperative biopsy diagnosis. Shijie Huaren Xiaohua Zazhi 2012; 20(36): 3795-3800
- URL: https://www.wjgnet.com/1009-3079/full/v20/i36/3795.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v20.i36.3795
子宫内膜异位症是指子宫内膜组织存在于子宫腔以外的部位, 是育龄妇女的一种常见疾病. 结直肠子宫内膜异位症相对少见, 可引起严重的胃肠道和盆腔炎的症状, 容易误诊为结直肠恶性疾病. 由于肠镜和影像学结果类似, 结直肠子宫内膜异位症和结直肠癌的鉴别诊断困难. 对于结直肠子宫内膜异位的诊断, 目前尚没有可靠的放射或内镜学的诊断方法, 即使是内镜活检有时也不具有诊断作用. 因此, 结直肠子宫内膜异位症的术前诊断通常较困难. 本研究收集6例结直肠子宫内膜异位症的病例, 这些患者术前临床和病理曾诊断为结直肠癌、溃疡或炎症, 本研究我们将分析结直肠子宫内膜异位症术前活检容易误诊的原因以及探讨解决的方法.
收集武汉协和医院自2002-12至今诊治的结直肠子宫内膜异位症患者共6例, 6例均被临床作为结直肠癌行根治性手术, 术后病理诊断均证实为结直肠子宫内膜异位症.
标本经10%中性甲醛固定, 常规脱水透明, 石蜡包埋制片, HE染色. 免疫组织化学检测采用石蜡切片Envision法, 所用试剂购自Dako公司. 我们回顾了病史、肠镜表现, 复查了病例的术前肠镜活检标本和剖腹手术或腹腔镜切除术的术后标本的病理切片, 对术前活检标本和术后大标本组织块进行ER、PR、CK7、CK20和CD10的免疫组织化学检测. 同时进行了相关文献复习.
6例患者的平均年龄为44.8年(38-49岁). 3例有腹痛症状. 3例患者有大便变化, 2例主诉便血, 2例有肠梗阻. 1名患者的症状与月经周期相关. 其中有3例患者有左侧卵巢受累及的情形; 1例患者有阴道和子宫受累的情况. 其中1例表现为直肠上段左侧壁类圆形软组织密度结节影, 向腔内外生长, 边缘光滑, 横断面直径2.27 cm, 前缘紧贴子宫二者界限不清. 子宫稍大. 子宫左上方类圆形囊实性包块2.9 cm×3.6 cm; 1例表现为直肠前壁与阴道残端黏连, 左卵巢1.5 cm囊肿; 还有1例在阴道后穹隆可见3 cm×2 cm×2 cm囊性包块.
1例行电子肠镜及超声, 结果显示: 黏膜下层和肌层消失, 肠壁明显增厚. 该患者同时进行了CT检查, 结果显示在降结肠左侧壁上发现软组织密度的圆形结节, 突向肠腔生长, 子宫左上方可见圆形光滑的实性及囊性肿块.
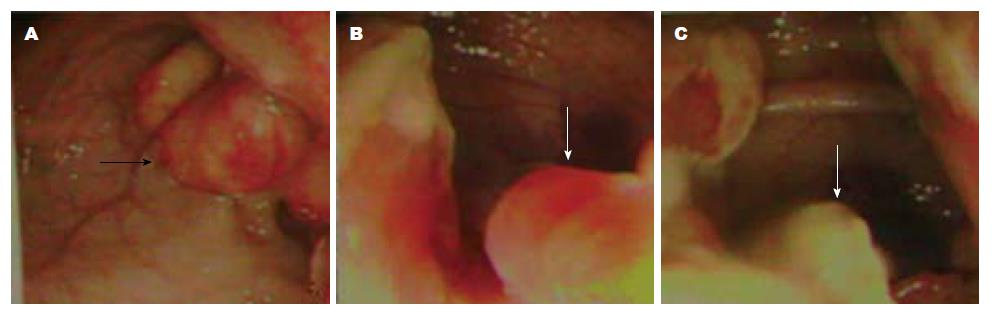
5例患者进行了结肠镜检查. 1例患者显示为溃疡, 1例显示为黏膜突起、1例为管腔狭窄、3例为息肉样肿块. 例1: 直肠新生物; 例2: 直肠一扁平隆起病灶, 表面粗糙; 例4: 距肛门6-12 cm直肠新生物, 表面菜花状, 伴糜烂, 占肠腔周径约1/3; 例5: 直肠乙状结肠交界处距肛门约12 cm菜花样肿物, 1.0-1.6 cm ,表面溃烂, 质硬脆, 易出血; 例6: 克隆氏病, 肠结核, 直乙狭窄.
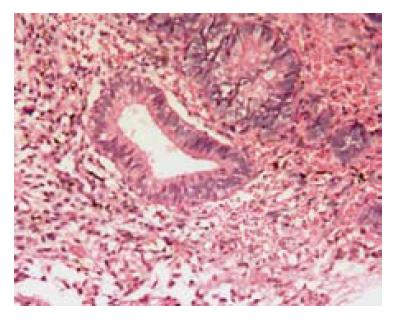
6例结肠镜活检的本院病理诊断分别是: 3例诊断为慢性炎症, 其中1例认为伴有中度异型增生; 1例诊断为溃疡; 2例考虑诊断为子宫内膜异位症, 其中1病例(No. 3)在外院会诊, 分别诊断为: (1)炎症伴腺体轻度异型增生; (2)腺体重度异型增生, 腺癌不能排除(图1).
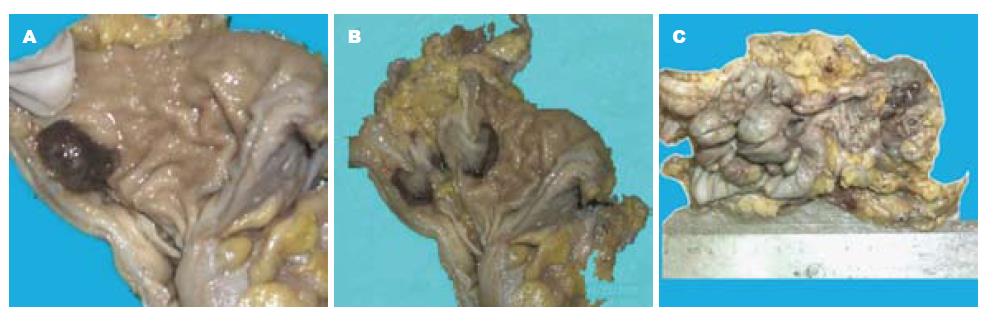
6例病例与邻近脏器关系可分别表现为: 直肠前壁与阴道残端黏连, 阴道后壁与直肠前壁紧密融合成整体; 盆腔受累情况可包括: 左卵巢囊肿, 阴道后穹隆囊性包块; 病变的大体可为表现: (1)直肠左后壁位于黏膜下肿块; (2)直肠壁增厚僵硬, 狭窄明显; (3)直肠前壁菜花状新生物, 表面溃烂, 质硬脆, 易出血; (4)肠管内多处糜烂及溃疡, 水肿增厚明显, 局部肠管狭窄明显, 部分肠管严重扩张(图2).
2例考虑诊断为子宫内膜异位症的活检组织HE切片上于肠黏膜内可见子宫内膜样腺体及间质. 与周边具有细杆状核的肠杯状细胞相比, 异位的内膜腺体呈低柱状, 可有纤毛, 胞质透明, 黏液减少, 核圆形或椭圆形, 异位的子宫内膜腺体周围可见子宫内膜间质细胞紧密环绕, 与肠固有层内疏松结缔组织纤维间质细胞相比, 异位子宫内膜间质排列明显密集. 3例考虑诊断为慢性炎症或溃疡的活检标本HE切片上可见主为肠黏膜组织, 但其中似杂少量子宫内膜样腺体, 其上皮胞质内黏液减少、核圆. 诊断为溃疡的1例活检镜下主为溃疡面坏死炎性渗出物以及肉芽组织, 于肉芽组织内也可见个别子宫内膜样腺体, 子宫内膜间质不明显(图3).
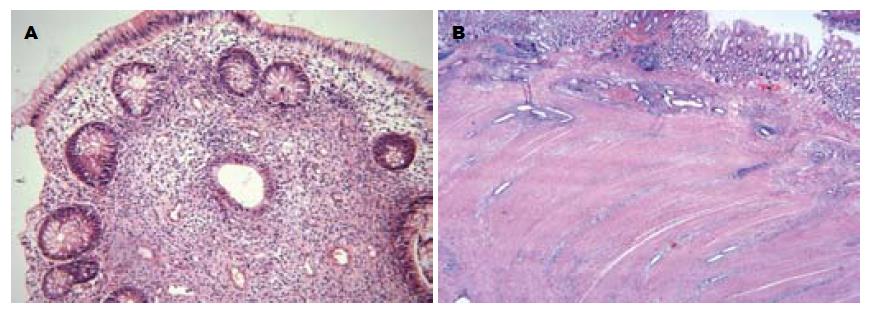
6例术后标本HE切片上均检出肠壁内存在明确的异位子宫内膜腺体及间质, 异位内膜腺体呈管状或向腔内形成乳头状, 主要沿肠壁肌束间隙膨胀性生长, 其成长长径基本与疏松结缔组织分布方向基本一致, 表现为在黏膜下层呈平行腔面生长, 在固有肌层的肌束间则呈垂直腔面生长(图4). 个别病例可见异位子宫内膜自浆膜层全层穿透肠壁至黏膜面, 形成息肉.
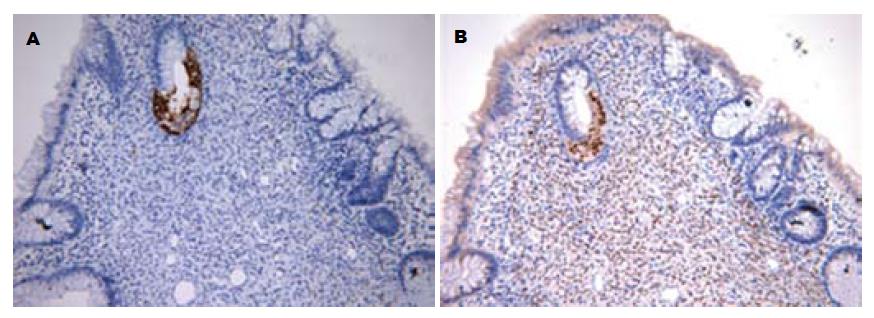
4例肠镜活检诊断为慢性炎症或溃疡的病例及2例考虑为子宫内膜异位症的病例免疫组织化学表型均符合子宫内膜异位症. 异位子宫内膜的免疫组织化学表型为腺体CK7阳性, 腺体及内膜间质ER和PR阳性以及间质细胞CD10阳性, 而正常结直肠黏膜免疫组织化学表型为: 腺上皮CK7阴性, 上皮及黏膜固有层间质ER、PR及CD10阴性, CK20在异位子宫内膜腺体及肠黏膜腺上皮内表达均为阴性. 6例手术后大标本免疫组织化学检测结果与术前肠镜活检标本免疫表型均显示一致(图5).
本组结直肠子宫内膜异位症患者为育龄妇女, 通常有生育史. 1例患者的症状与月经周期相关. 其中有3例患者有左侧卵巢受累及的情形; 1例患者有阴道和子宫受累的情况. 卵巢子宫内膜异位囊肿合并盆腔局部黏连者, 早期囊肿与周围组织(包括子宫后壁、阔韧带后叶、侧盆壁以及结肠、直肠等)膜状或片状黏连, 晚期则为致密黏连. 侵犯结直肠者, 可伴有受侵肠道壁僵硬结节; 侵犯阴道穹窿可看到及触及阴道穹窿的触痛结节. 子宫直肠窝部分或完全封闭常常提示更深处病变的存在, 也提示可能有直肠黏连包裹于其中[1-5].
患者常有腹痛、大便形状改变、出血和肠梗阻等症状, 导致临床容易诊断为结直肠癌. 本组病例中有1例表现为周期性的与月经期相关的出血和腹部疼痛的症状. B超和CT检查表现为肠黏膜肿块, 肠壁增厚, 肌层消失, 这些影像学特点与结直肠癌相似. 在结肠镜下, 结直肠子宫内膜异位和结直肠癌表现也相似, 本组病例显示可形成溃疡、息肉样隆起性占位及肠腔狭窄等. 因此, 仅根据临床症状、影像学结果和内镜检查做出判断时, 临床医生很难将其与恶性肿瘤区分[6-13]在本组病例中, 即使结肠镜活检提示为炎症或溃疡的病例, 临床医生依然选择了行根治术手术的治疗方案, 提示结直肠子宫内膜异位症在临床容易被误诊为结直肠癌. 临床医生应提高对结直肠子宫内膜异位症的认识, 对于育龄期妇女询问出血和腹部疼痛的症状是否与月经周期相关, 是区别肠道子宫内膜异位症与结直肠癌最具价值的临床症状. B超和CT检查对两者之间的鉴别作用有限[14-18].
本组病例手术大标本巨检分别表现为溃疡、息肉样隆起性占位或肠腔狭窄等, 与结直肠癌相似. 我们发现, 结直肠癌发现时通常临床分期较晚, 溃疡一般较深, 或表现为息肉状时, 息肉表面粗糙、菜花状. 而肠道子宫内膜异位症通常溃疡浅表, 当表现为息肉状隆起时, 息肉表面常较光滑, 可呈分叶状, 出血明显时, 呈褐色外观[14-16].
结直肠子宫内膜异位症手术大标本的病理特征明显, 可见小的溃疡面、坏死和炎性渗出物, 黏膜息肉样增生, 间质细胞丰富, 核呈椭圆形, 细胞质半透明, 一些子宫内膜腺体间仍然可见少数色素沉着; 异位子宫内膜沿肠壁肌束间隙生长. 有经验的病理医师通常不易误诊, 而肠镜活检标本即使在高年资病理医生, 其误诊率也高, 本组病例活检误诊率达67%[19-24]. 分析本组误诊的原因, 包括: (1)活检样本取材浅表, 镜下钳取的大部分为肠黏膜组织, 异位的子宫内膜组织与肠固有腺体混杂, 在炎症的背景下难以观察; (2)由于病变出血及黏膜溃疡, 继发引起黏膜腺上皮修复性增生, 表现出一定程度的肠上皮异型, 容易被病理医师注意到, 而忽略了主要病变; (3)因肠道子宫内膜异位症少见, 病理医师的诊断意识不强, 从而忽略了真正的病变, 或将异位的子宫内膜视为异型增生的肠腺体. 对于同一病例的同一张HE切片, 3家医院给出了3种不同的诊断, 包括子宫内膜异位症、腺体中度不典型以及癌不能排除.
结直肠子宫内膜异位症通常主要累及肠壁外层部分, 黏膜部分的内镜检查往往正常或只显示有轻微的病变, 因此需要建立更为敏感的病理诊断方法, 避免漏诊. 我们分析肠黏膜和子宫内膜腺体及间质的不同免疫表型, 重点筛选ER、PR、CK7、CK20和CD10作为观察指标, 发现ER、PR、CK7及CD10均可以区分结直肠黏膜和异位的子宫内膜, CK20不具鉴别价值(图5)[25-27]. 我们术前肠镜活检误诊的4例患者用免疫组织化学标记均清楚地显示出了位于肠黏膜内的异位子宫内膜腺体或间质. 因固有层内中性粒细胞也表达CD10, 在黏膜重度急性炎症的情况下, CD10表达模式的观察受到干扰. 而ER、PR及CK7特异性高, 是最具有价值的免疫组织化学检测指标.
结合形态学及免疫表型特点, 肠镜活检诊断结直肠子宫内膜异位症可以更加明确, 避免误诊漏诊的发生. 对于拟诊病例, 可进一步询问患者是否具有痛经等症状或是否因子宫内膜异位症已行子宫或卵巢切除. 对于育龄妇女, 病理医师应提高结直肠子宫内膜异位症的诊断意识.
当肠镜活检诊断为结直肠子宫内膜异位症时, 可选择腔内超声检查以了解病变的形状、大小、位置、侵犯肠壁深度或与周围组织关系, 帮助临床选择治疗方案. 结直肠子宫内膜异位症的治疗是整个子宫内膜异位症治疗的一个组成部分. 药物治疗的目的是缓解症状及促进生育功能, 也可用于术前准备, 但不能达到根治目的. 当恶性肿瘤的诊断不能完全被排除或者患者出现持续顽固性的症状时, 可考虑手术根治治疗[28-30].
子宫内膜异位症是指子宫内膜组织存在于子宫腔以外的部位, 是育龄妇女的一种常见疾病. 结直肠子宫内膜异位症相对少见, 可引起严重的胃肠道和盆腔炎的症状, 容易误诊为结直肠恶性疾病. 由于肠镜和影像学结果类似, 结直肠子宫内膜异位症和结直肠癌的鉴别诊断困难. 对于结直肠子宫内膜异位的诊断, 目前尚没有可靠的放射或内镜学的诊断方法, 即使是内镜活检有时也不具有诊断作用. 因此, 结直肠子宫内膜异位症的术前诊断通常较困难.
陈云昭, 副教授, 新疆石河子大学医学院/一附院病理科
通过形态学观察, 并且综合特征性的临床病史、结合免疫组织化学检测ER、PR及CK7可以有效提高结直肠子宫内膜异位症术前活检诊断的准确率.
本文立题较为新颖, 结合实际病例对于结直肠癌及结直肠子宫内膜异位症的误诊原因回顾及分析, 对少见部位子宫内膜异位症的误诊起到警醒的作用, 提供了包括临床病史、临床检查结果、大体所见、镜下观察及免疫组织化学分析, 提供素材较为具体和清晰.
编辑:田滢 电编:鲁亚静
| 1. | Gambone JC, DeCherney AH. Surgical treatment of minimal endometriosis. N Engl J Med. 1997;337:269-270. [PubMed] [DOI] |
| 2. | Nisolle M, Alvarez ML, Colombo M, Foidart JM. [Pathogenesis of endometriosis]. Gynecol Obstet Fertil. 2007;35:898-903. [PubMed] [DOI] |
| 3. | Hunter T, Hart R. Endoscopic surgery for female infertility: a review of current management. Aust N Z J Obstet Gynaecol. 2009;49:588-593. [PubMed] [DOI] |
| 4. | Seoud AA, Saleh MM, Yassin AH. Endometriosis: a possible cause of right shoulder pain. Clin Exp Obstet Gynecol. 2010;37:19-20. [PubMed] |
| 5. | Giudice LC. Clinical practice. Endometriosis. N Engl J Med. 2010;362:2389-2398. [PubMed] [DOI] |
| 6. | Kwok RM, Moawad FJ, Laczek JT, Horwhat JD. Intestinal endometriosis: an uncommon cause of rectal bleeding. Endoscopy. 2010;42 Suppl 2:E112-E113. [PubMed] [DOI] |
| 7. | González-Pezzat I, Soto-Pérez-de-Celis E, García-Lascurain JL. Bowel endometriosis as an unusual cause of rectal bleeding. Am Surg. 2011;77:239-241. [PubMed] |
| 8. | Pickron TB, Cooper J. Laparoscopic hysterectomy and ileocecal resection for treatment of endometriosis. JSLS. 2009;13:224-225. [PubMed] |
| 9. | Podgaec S, Gonçalves MO, Klajner S, Abrão MS. Epigastric pain relating to menses can be a symptom of bowel endometriosis. Sao Paulo Med J. 2008;126:242-244. [PubMed] [DOI] |
| 10. | Maytham GD, Dowson HM, Levy B, Kent A, Rockall TA. Laparoscopic excision of rectovaginal endometriosis: report of a prospective study and review of the literature. Colorectal Dis. 2010;12:1105-1112. [PubMed] [DOI] |
| 11. | Kondo W, Bourdel N, Jardon K, Tamburro S, Cavoli D, Matsuzaki S, Botchorishvili R, Rabischong B, Pouly JL, Mage G. Comparison between standard and reverse laparoscopic techniques for rectovaginal endometriosis. Surg Endosc. 2011;25:2711-2717. [PubMed] [DOI] |
| 12. | Vercellini P, Barbara G, Buggio L, Frattaruolo MP, Somigliana E, Fedele L. Effect of patient selection on estimate of reproductive success after surgery for rectovaginal endometriosis: literature review. Reprod Biomed Online. 2012;24:389-395. [PubMed] [DOI] |
| 13. | Ruffo G, Stepniewska A, Crippa S, Serboli G, Zardini C, Steinkasserer M, Ceccaroni M, Minelli L, Falconi M. Laparoscopic ileocecal resection for bowel endometriosis. Surg Endosc. 2011;25:1257-1262. [PubMed] [DOI] |
| 14. | Daraï E, Lesieur B, Dubernard G, Rouzier R, Bazot M, Ballester M. Fertility after colorectal resection for endometriosis: results of a prospective study comparing laparoscopy with open surgery. Fertil Steril. 2011;95:1903-1908. [PubMed] [DOI] |
| 15. | Stepniewska A, Pomini P, Guerriero M, Scioscia M, Ruffo G, Minelli L. Colorectal endometriosis: benefits of long-term follow-up in patients who underwent laparoscopic surgery. Fertil Steril. 2010;93:2444-2446. [PubMed] [DOI] |
| 16. | de Ziegler D, Borghese B, Chapron C. Endometriosis and infertility: pathophysiology and management. Lancet. 2010;376:730-738. [PubMed] [DOI] |
| 17. | Pereira RM, Zanatta A, Serafini PC, Redwine D. The feasibility of laparoscopic bowel resection performed by a gynaecologist to treat endometriosis. Curr Opin Obstet Gynecol. 2010;22:344-353. [PubMed] [DOI] |
| 18. | Jelenc F, Ribič-Pucelj M, Juvan R, Kobal B, Sinkovec J, Salamun V. Laparoscopic rectal resection of deep infiltrating endometriosis. J Laparoendosc Adv Surg Tech A. 2012;22:66-69. [PubMed] [DOI] |
| 19. | Gupta RK, Agrawal CS, Yadav RP, Uprety D, Sah PL. Rectosigmoid endometriosis causing an acute large bowel obstruction: a report of a case and a review of the literature. JNMA J Nepal Med Assoc. 2011;51:83-86. [PubMed] |
| 20. | Uchiyama S, Haruyama Y, Asada T, Nagaike K, Hotokezaka M, Yorita K, Chijiiwa K. Rectal endometriosis masquerading as dissemination in a patient with rectal cancer: report of a case. Surg Today. 2010;40:672-675. [PubMed] [DOI] |
| 21. | Kim JS, Hur H, Min BS, Kim H, Sohn SK, Cho CH, Kim NK. Intestinal endometriosis mimicking carcinoma of rectum and sigmoid colon: a report of five cases. Yonsei Med J. 2009;50:732-735. [PubMed] [DOI] |
| 22. | Lin PY, Cheng CJ, Lou HY, Tiong C, Fang SU, Cheng YC, Chang CC. Deep infiltrating cervical endometriosis mimicking rectosigmoid cancer. Am J Med Sci. 2011;342:239. [PubMed] [DOI] |
| 23. | Ret Dávalos ML, De Cicco C, D'Hoore A, De Decker B, Koninckx PR. Outcome after rectum or sigmoid resection: a review for gynecologists. J Minim Invasive Gynecol. 2007;14:33-38. [PubMed] [DOI] |
| 24. | Sassi S, Bouassida M, Touinsi H, Mongi Mighri M, Baccari S, Chebbi F, Bouzeidi K, Sassi S. Exceptional cause of bowel obstruction: rectal endometriosis mimicking carcinoma of rectum--a case report. Pan Afr Med J. 2011;10:33. [PubMed] |
| 25. | De Cicco C, Corona R, Schonman R, Mailova K, Ussia A, Koninckx P. Bowel resection for deep endometriosis: a systematic review. BJOG. 2011;118:285-291. [PubMed] [DOI] |
| 26. | Gajjar KB, Mahendru AA, Khaled MA. Caesarean scar endometriosis presenting as an acute abdomen: a case report and review of literature. Arch Gynecol Obstet. 2008;277:167-169. [PubMed] [DOI] |
| 27. | Cinardi N, Franco S, Centonze D, Giannone G. Perineal scar endometriosis ten years after Miles' procedure for rectal cancer: Case report and review of the literature. Int J Surg Case Rep. 2011;2:150-153. [PubMed] [DOI] |
| 28. | Streuli I, de Ziegler D, Borghese B, Santulli P, Batteux F, Chapron C. New treatment strategies and emerging drugs in endometriosis. Expert Opin Emerg Drugs. 2012; Mar 23. [Epub ahead of print]. [PubMed] [DOI] |
| 29. | Chen N, Zhu L, Lang J, Liu Z, Sun D, Leng J, Fan Q, Zhang H, Cui Q. The clinical features and management of perineal endometriosis with anal sphincter involvement: a clinical analysis of 31 cases. Hum Reprod. 2012;27:1624-1627. [PubMed] [DOI] |
| 30. | Zhu L, Lang J, Wang H, Liu Z, Sun D, Leng J, Zhou H, Cui Q, Wong F. Presentation and management of perineal endometriosis. Int J Gynaecol Obstet. 2009;105:230-232. [PubMed] [DOI] |