修回日期: 2022-04-24
接受日期: 2022-05-25
在线出版日期: 2022-06-08
动物和人类研究的有力证据表明, 交感神经系统(sympathetic nervous system, SNS)的高度激活是代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)发展的关键因素. SNS的激活在包括肥胖、代谢综合征(metabolic syndrome, Mets)、糖尿病、高血压和MAFLD等在内的发病机制中起着重要作用. 当遗传易感对象暴露于多种表观遗传改变时, 其肝脏损伤可能会发展为MAFLD. 由此可见MAFLD的发病机制错综复杂, 涉及胰岛素抵抗、激素分泌异常、肥胖、饮食、遗传因素、免疫激活、肠道微生物等多种因素的复杂相互作用, 在上述这些过程中交感神经起到不可低估的作用. 值得注意的是通过抑制交感神经后对MAFLD的有益作用, 提出SNS作为MAFLD的治疗靶点, 值得进一步探讨与研究.
核心提要: 中枢交感神经过度活动在多种代谢状态的病因和并发症中包括代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)、肥胖、代谢综合征、糖尿病、高血压和冠心病中起着关键作用. 近年的研究发现, 抑制交感神经活性在MAFLD治疗上的有益作用, 直接针对交感神经系统作为治疗靶点.
引文著录: 池肇春. 代谢相关脂肪性肝病是交感神经系统激活相关性疾病的研究进展. 世界华人消化杂志 2022; 30(11): 465-476
Revised: April 24, 2022
Accepted: May 25, 2022
Published online: June 8, 2022
Strong evidence from animal and human studies shows that sympathetic nervous system (SNS) activation is a key factor in the development of metabolic associated fatty liver disease (MAFLD). Activation of the sympathetic nervous system plays an important role in the pathogenesis of obesity, metabolic syndrome, diabetes, hypertension, and MAFLD. When genetically susceptible subjects are exposed to a variety of epigenetic changes, their liver damage may develop into MAFLD. Thus, the pathogenesis of MAFLD is complex, involving the complex interaction of insulin resistance, abnormal hormone secretion, obesity, diet, genetic factors, immune activation, gut microbiota, and other factors. In these processes, the role of sympathetic nerves cannot be underestimated. Notably, SNS has been proposed as a therapeutic target for MAFLD by inhibiting sympathetic nerves. It is worthy of further discussion and research.
- Citation: Chi ZC. Metabolic associated fatty liver disease is a disease related to sympathetic nervous system activation. Shijie Huaren Xiaohua Zazhi 2022; 30(11): 465-476
- URL: https://www.wjgnet.com/1009-3079/full/v30/i11/465.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v30.i11.465
脂肪性肝病(metabolic associated fatty liver disease, MAFLD)是影响全球1/4-1/3人口的最常见肝病, 我国最新的一份流行病学调查显示在139170人中, MAFLD患病率为26.1%(男性为35.4%, 女性为14.1%). MAFLD组代谢异常率明显高于非MAFLD组, 丙氨酸氨基转移酶(alanine aminotransferase, ALT)升高组为42.5%, 高于非MAFLD组11%(P<0.001). 代谢综合征(metabolic syndrome, Mets)、血脂异常和高尿酸血症发生率, MAFLD组分别为53.2%、80.0%和45.0%, 明显高于非MAFLD组(10.1%、41.7%和16.8%)[1]. MAFLD的发病率增加与Mets和肥胖常同时发生, 这一点也说明了MetS和肥胖在MAFLD发病上的重要性. 然而, MAFLD的发病机制至今尚不完全清楚. 动物和人类研究的有力证据表明, 交感神经系统(sympathetic nervous system, SNS)的高度激活是MAFLD发展的关键因素. 事实上, 对代谢疾病的常见治疗策略, 如饮食和运动诱导体重减轻, 已经被证明至少部分通过相关的交感神经抑制发挥了有益的作用. 此外, 以药物和设备为基础的减少交感神经激活的方法已经被证明可以改善肥胖症、糖尿病患者经常出现的代谢改变. 目前仍有证据表明[2], 交感神经激活在MAFLD的发病机制中起着特殊的作用, 因此可能为减轻MAFLD相关的不良结果提供一个有吸引力的治疗靶点.
有强有力的证据表明, SNS的激活在包括肥胖、Mets、糖尿病、高血压(hypertension, HTN)和MAFLD在内的心脏代谢疾病的发病机制中起着重要作用. 内分泌机制、免疫激活、微生物失调等的复杂相互作用可使SNS在代谢性疾病连续体中长期存在[3], 导致严重的后果, 如胰岛素抵抗和全身炎症发生[4].
MAFLD的发病始于肝细胞内三酰甘油(triglyceride, TG)的积聚, 肝细胞TG的积累, 如不能逆转, 则可发展为代谢相关脂肪性肝炎(metabolic associated steatohepatitis, MASH)[5].
研究表明[5,6], 在MAFLD患者中, 60%的肝脏TG积累来自循环游离脂肪酸(free fatty acid, FFA), 25%来自新生脂肪, 15%来自饮食. 脂肪性肝炎的特点是小叶性炎症, 肝细胞膨胀, 纤维化和肝硬化. 大约1/3的MAFLD患者进展为脂肪性肝炎, 少数患者发展为肝硬化, 肝硬化可能转化为肝细胞癌[7].
由于只有一部分患者进展为脂肪性肝炎、纤维化和肝硬化, 因此导致MAFLD发展的因素尚未完全确定[8]. 传统的MAFLD进展理论是Day和他的同事提出的"双击理论". 然而, "两击"假说现在已经过时, 因为它无法解释MAFLD中发生的大量分子和代谢变化. 因此, 提出了"多重打击"假说, 即当遗传易感对象暴露于多种表观遗传改变时, 其肝脏损伤可能会发展为MAFLD. 这一假说强调MAFLD的发病机制和进展非常复杂, 涉及胰岛素抵抗、激素分泌异常、肥胖、饮食、遗传因素、免疫激活等多种因素的相互作用, 最近提出肠道微生物引起肠道炎症和肠黏膜屏障功能障碍, 通过小肠细菌过度生长 、内毒素血症、肠道与肝的炎症、肠道免疫异常等机制发生MAFLD[9,10].
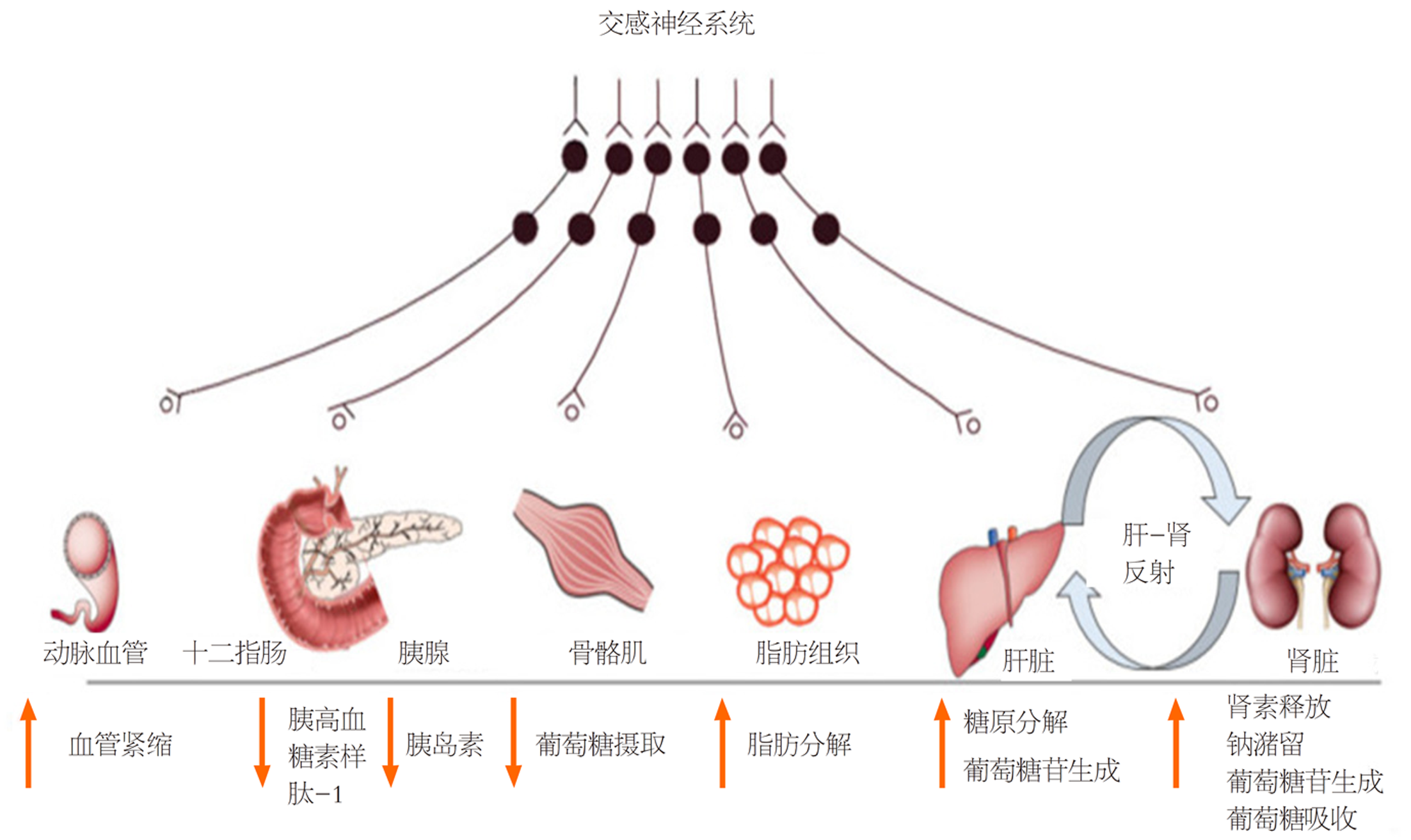
交感神经介导的代谢效应(图1)使人类有机体在需要增加能量时, 能够应付短期紧情况.
然而, 持续的交感神经过度运动往往会导致心血管和代谢方面的不良后果, 包括MAFLD. 交感神经刺激肝神经可引起肝脏快速而明显的葡萄糖输出, 而胰腺交感神经的刺激则与减少胰岛素和增加胰高血糖素分泌到门静脉循环有关[11]. 此外, 交感神经激活的增强导致骨骼肌神经介导的外周血管收缩, 这与葡萄糖摄取和胰岛素抵抗受损以及脂肪细胞的脂解增强有关. 交感神经过度活动引起的这种脂肪状态导致循环和内脏沉积中游离脂肪酸和三酰甘油的增加, 可加重MAFLD[12].
Mets是一种交感神经疾病[11], 并被发现是MAFLD的一个强有力的预测因子. MAFLD的内分泌和生化紊乱与交感神经活动增加有关[13]. SNS介导的胰岛素抵抗, 受下丘脑神经肽Y等因素的影响, 导致代偿性高胰岛素血症和代谢疾病状态下的高血糖, 从而导致MAFLD的进展[14]. 在肝硬化和代谢性疾病患者中, 使用金标技术, 如全身和个别器官的微量描记和去甲肾上腺素溢出, 已经证明了交感神经激活的增强[15]. 糖代谢紊乱和肥胖患者伴有肝硬化, 其进展导致心血管和代谢稳态紊乱所介导的进行性交感神经激活, 反之亦然[16]. 此外, 各种脂肪因子如瘦素和脂联素也影响MAFLD的进展. 瘦素在动物模型中被证明能引起纤维化, 并且已知它能防止脂质的积累, 这可能是导致肥胖患者出现代偿性高瘦素血症的原因之一. 脂联素具有抗炎作用, 通过阻断抑制核因子κB激酶(inhibitor of nuclear factor kappa-B kinase, IKK-NF-κB)的炎症通路来改善胰岛素抵抗和预防肝损伤, 而肥胖时这种途径常常被下调. 此外, 在脂联素缺乏的动物模型中已经证实了增强的成纤维作用. 肥胖合并低脂联素血症和高瘦素血症促进了MAFLD的恶化. 此外, 高瘦素血症是一种交感神经兴奋症, 因为它能够通过瘦素受体跨越血脑屏障并调节交感神经脑中枢, 并与肥胖和Mets中的高血压有关[2].
此外, Mets和肥胖的营养过剩需要扩大肠系膜的氧气的需求, 减少门静脉氧和肝氧的输送. 肝动脉缓冲反应, 通过腺苷诱导的动脉血管舒张反应, 维持稳定的肝静脉流出. 最终, 腺苷会被餐后门脉流量的增加冲走, 从而恢复动脉阻力. 慢性门脉氧缺乏限制了三磷酸腺苷(adenosine triphosphate, ATP)的产生, 并诱导腺苷释放, 从而进一步增加肝脏交感神经张力, 触发"肝-肾反射". 肝脏交感神经激活增加导致血流减少, 肝小动脉阻力增加, 引起反射性肾交感神经激活, 引起肾小动脉血管收缩和肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteroneSystem, RAAS)激活[17]. 肾反射介导的RAAS激活进一步降低了肾血流量, 肾小球滤过, 增加了全身性钠潴留. 肝脏交感神经传入活动的增加是由低压肝压力感受器介导的, 激活后的压力感受器会增加心肺和肾输出交感神经放电, 尽管心率没有大的变化.
MAFLD静脉周围肝细胞脂质积聚, 使供氧进入肝细胞[17]. 此外, Mets的低ATP状态还可能导致代谢的僵化和β-氧化的减弱, 因而进一步加重了MAFLD肝脏脂质的积累. 同样, MAFLD中代谢相关性肝炎的发生也进一步阻碍了肝脏微循环持续低氧, 诱导了ATP/AMP去磷酸化机制, 触发了肝-肾反射. 在高果糖诱导的Mets动物中也有类似的观察, ATP耗竭丰富了腺苷的产生. 肝细胞果糖代谢完全由果糖激酶介导, 果糖激酶从ATP中摄取无机磷酸盐, 形成果糖-1-磷酸、腺嘌呤核苷酸和尿酸, 这是肝ATP耗竭的一个非常敏感的指标. 在临床情况下, 因为ATP恢复受损使糖尿病患者不能忍受大剂量的静脉注射果糖的挑战[18]. 此外, 在病态肥胖症中进行的代谢手术要么绕过营养接触, 要么减少营养接触, 以降低内脏需氧量, 提高门脉供氧率. 这将导致ATP的增加和尿酸的减少, 从而削弱了减肥手术后的肾反射和交感神经活动.
交感神经系统的激活在能量平衡中是不可或缺少的, 并能产生深远的代谢效应, 这一点还不太容易被人们所认识. 从动物和人类研究中积累的数据表明, 中枢交感神经过度活动在多种代谢状态的病因和并发症中起着关键作用, 这些代谢条件可聚在一起形成Mets. 许多因素被认为是导致代谢异常交感神经活动增加的原因, 包括肥胖、压力感受器敏感性受损、高胰岛素血症和脂肪因子水平升高. 此外, 有越来越多的证据表明, 慢性交感神经过度活动可以增强Mets的两项关键代谢改变, 即中枢肥胖和胰岛素抵抗[19].
从动物和人类研究中积累的数据表明, 中枢交感神经活动在Mets的病因和并发症及其相关情况中起着关键作用. Mets患者表现出明显的慢性交感神经兴奋症状, 如尿去甲肾上腺素水平升高, 骨骼肌的交感神经活动增加, 血浆去甲肾上腺素溢出率升高[20], 即使在没有高血压的情况下, 也证明了这一点.
中枢交感神经输出主要由位于延髓腹外侧端的神经元网络驱动. 这些神经元向位于脊髓中间外侧细胞柱的节前神经元提供兴奋性输出, 这些神经元通过神经节后交感神经纤维支配多个靶器官. 兴奋性驱动可以通过中枢神经系统的皮层、边缘和中脑区域产生、化学介导或差异控制. 外周反射的许多传入输入(即动脉压力反射、趋化受体和激素介质)可通过延髓孤束核的终末神经元刺激延髓端腹外侧区, 改变交感神经活动. 此外, 能够通过脑室穿过血脑屏障的循环因素也会影响中心交感神经的输出.
虽然支配交感神经系统的神经解剖相互作用尚未完全阐明, 交感神经张力被认为是心血管功能的重要介质. 在代谢方面, 交感神经系统是控制日常能量消耗的基础, 它通过调节静止代谢率和根据生理相关刺激(即能量状态变化、食物摄入、碳水化合物消耗、高胰岛素血症和寒冷暴露)而启动热发生. 激活支配肝脏、胰腺、骨骼肌和脂肪组织的交感神经也可引起急性分解反应(即糖原溶解和脂解). 值得注意的是, 并不是所有器官都是交感神经系统的目标, 中枢交感神经输出增加所产生的代谢效应取决于靶器官中的肾上腺素受体、吸收的神经元数量以及个体是否处于禁食状态或餐后状态[19].
急性激活支配肝脏实质细胞的内脏交感神经可在餐后产生快速和显著的葡萄糖生成, 但在禁食时促进糖异生. 肾上腺髓质的激活也能刺激儿茶酚胺的释放, 进一步促进肝脏葡萄糖的产生. 在胰腺中, 内脏交感神经的激活通过胰岛细胞的β-肾上腺素能受体促进胰高血糖素的分泌, 这是通过α-肾上腺素能受体激活抑制胰岛素分泌的次要机制. 支配骨骼肌的交感神经通过激活β-肾上腺素能受体(cAMP)作为第二信使, 独立于血浆胰岛素水平的同时调节葡萄糖摄取. 相反, 神经元对小动脉α-肾上腺素能受体的刺激会引起血管收缩, 从而影响骨骼肌的葡萄糖摄取[21].
25年前, Landsberg首次提出代谢异常的发展与交感神经系统之间的联系, 当时他假设, 肥胖引起的胰岛素抵抗导致循环胰岛素水平升高, 导致中枢交感神经活性升高, 从而导致高血压的发展. 他的假设是基于对啮齿类动物的观察, 这些观察表明, 喂食过量会导致交感神经活动增加, 血压升高. 随后对健康成人的研究证实, 在葡萄糖水平稳定的情况下, 注射胰岛素可增加肌交感神经活动, 而不依赖于胰岛素的血管舒张作用[22].
有关促进交感神经过度活动的神经体液通路, 包括在喂食过量和下丘脑胰岛素信号中断时, 更高的脑核可直接激活交感神经系统. 其他间接机制(在肥胖的情况下)包括高胰岛素血症, 增加瘦素和非酯化脂肪酸(non-esterified fatty acids, NEFAs)从多余的内脏脂肪释放, 降低压力感受器敏感性和激活下丘脑-垂体-肾上腺轴.
2.2.1 饮食过量: 动物和人类研究清楚地表明, 过量和过低喂养可以调节交感神经活动. 有人认为肥胖患者的慢性交感神经活动是一种适应性的生理反应, 用于刺激肥胖期间的发热量和稳定体重[23]. 自主神经系统对抗体重变化的观点得到了正常体重和肥胖受试者的证据的支持, 这些证据表明体重的适度增加与交感神经活动的增加和副交感神经活动的减少有关. 然而, 由于喂食过多而导致的慢性中枢热的产生, 是以外周血管和肾脏中持续的β-肾上腺素能激活为代价的, 后者可通过钠潴留和导致肥胖相关高血压的血压下降而导致血压的二次升高.
2.2.2 高胰岛素血症: 胰岛素与交感神经调节之间的生理联系是复杂的. 在体内, 胰岛素通过直接抑制肝糖原溶解或间接抑制脂肪组织中的脂解、胰高血糖素的产生或刺激下丘脑胰岛素依赖的信号通路来减少内源性葡萄糖的产生.
有证据表明, 胰岛素通过中枢神经系统的作用发挥交感神经兴奋作用. 的确, 动物研究清楚地表明, 脑室内注射胰岛素可以增强中枢交感神经活动. 虽然胰岛素在中枢神经系统中没有大量产生, 但循环胰岛素可以通过饱和运输介导的跨越血脑屏障的摄取而获得. Cassaglia等[24]最近发现下丘脑弓状核是胰岛素增加交感神经活动和交感神经压力反射的关键部位之一. 推测胰岛素的交感神经兴奋作用是由于抑制了从弓状核投射到室旁核的神经肽Y(neuropeptide Y, NPY)神经所致.
在人类中, 全身而不是局部注射胰岛素会刺激交感神经活动的增加, 从而支持胰岛素的交感神经兴奋效应不是由局部机制介导的. 值得注意的是, 胰岛素在人类体内引起的交感神经反应远比动物体内的交感神经反应更加复杂. 在健康的年轻人中, 在恒定的血糖浓度下注射胰岛素会导致骨骼肌交感神经活动的区域性升高, 而不是肾脏. 此外, 急性高胰岛素血症对肌肉交感神经活动的影响在瘦成人中比肥胖者更明显[22]. 在循环胰岛素水平长期升高的高胰岛素血症肥胖人群中, 胰岛素的正常中枢效应减弱, 导致内源性葡萄糖生成增加(通过激活交感神经向肝脏流出), 并通过胰岛素反馈回路持续激活交感神经.
由于观察到高胰岛素血症只引起局部交感神经活动(特别是骨骼肌), 并且肥胖和高血压患者肾去甲肾上腺素溢出到血浆中, 高胰岛素血症是否是Mets观察到的中央交感神经过度活动的主要介质是值得怀疑的.
2.2.3 内脏脂肪增多: 动物和人类数据显示, 白色脂肪组织表达的某些脂肪因子, 即瘦素和非酯化脂肪酸, 可间接促进交感神经活动. 瘦素存在于与脂肪组织质量成正比的血清浓度中, 并且在人类肥胖中被证明是升高的. 它可以直接作用于骨骼肌, 损害葡萄糖转运蛋白-4(glucose transporter type 4, Glut-4)的易位, 导致高胰岛素血症, 引起交感神经系统的协同激活. 或者, 瘦素可以集中作用于几个大脑区域(主要是下丘脑和脑干), 这些区域通过黑素皮质激素系统依赖的途径控制多种代谢功能, 从而增加交感神经活动[24]. 最近的数据表明, 瘦素也作用于孤束核的水平, 可改变参与压力反射敏感性的神经元[25].
瘦素的主要中枢作用是通过交感神经激活减少食欲和增加能量消耗. 据推测, 在肥胖时, 位于下丘脑腹内侧核表达瘦素受体的神经元对长期升高的瘦素(高瘦素血症)失去敏感, 同时有选择地保持交感神经兴奋(称为"选择性瘦素抵抗"). 肥胖的动物模型支持这一观点, 下丘脑瘦素抵抗可以降低饱腹感, 但保持交感神经活动. 虽然急性注射瘦素会导致健康瘦弱男性肌肉交感神经活动显著增加[26], 但对于瘦素是否是慢性交感神经激活的主要驱动因素仍有一些疑问. 对年轻成年人的纵向研究表明[27], 血浆去甲肾上腺素水平的升高会先于体重增加和血浆瘦素水平的升高, 这表明高瘦素血症是与肥胖相关的交感神经刺激的辅助因素.
在人类的一些研究表明[28], 循环血浆非酯化脂肪酸(non-esterified fatty acids, NEFAs), 肥胖和胰岛素抵抗之间的正相关. 与瘦素一样, NEFAs能够在外周组织局部作用, 破坏胰岛素信号, 抑制葡萄糖摄取. 虽然目前尚不清楚NEFA如何激活中枢交感神经活动, 但注射NEFA可提高瘦健康成人的肌肉交感神经活动. 也有证据表明, 中枢交感神经激活有助于增加α-肾上腺素受体介导的升压敏感性, 可观察到NEFA的急性升高.
2.2.4 下丘脑-垂体-肾上腺轴的激活: 应激引起的糖皮质激素升高与严重的代谢异常有关, 包括胰岛素抵抗、葡萄糖不耐受、血脂异常、中央脂肪增多和高血压, 提示慢性应激可能在一定程度上促进代谢紊乱的发生. 一项嵌套的病例对照研究的结果显示, Mets受试者下丘脑-垂体-肾上腺(hypothalamus -pituitary -adrenal, HPA)轴和交感神经活动都有升高[29], 提供了慢性应激与交感神经激活之间的可能因果联系. 动物和人类研究的实验结果进一步支持在代谢异常(即肥胖引起的高胰岛素血症)期间这些大脑中心的共同激活. 在交感神经活动增加的肥胖成年人中, 慢性使用地塞米松可以降低血浆皮质醇和肌肉交感神经活动的升高, 但在瘦成人中没有降低.
为了支持交感神经系统在代谢异常中的主要作用, 这些代谢改变聚集形成了代谢异常, 一些前瞻性研究清楚地表明, 升高的去甲肾上腺素水平可以在肥胖和高血压的临床表现之前出现.
2.3.1 肥胖: Julius等[30]首先提出, 增加交感神经活性是导致肥胖成年人胰岛素抵抗和体重增加的主要原因. 交感神经活性的增加在食物消耗后通过激活β受体而消耗能量是至关重要的, 并认为慢性交感神经活动可以增加体重, 导致肥胖, 这是β-肾上腺素受体敏感性降低的结果. 在体外和体内的研究清楚地表明, 延长肾上腺素能刺激导致β受体介导的反应脱敏. β-肾上腺素受体的下调导致对食物产生温和的热原反应, 这会增强胰岛素抵抗, 并使胰岛素之间的负反馈循环永久化, 从而调节交感神经传出. 研究确立支持体重增加与β-肾上腺素能反应性降低直接相关, 证据表明[31], 短期和慢性药物阻断β-受体都会导致体重增加.
2.3.2 胰岛素抵抗: 由于交感神经系统、高血糖、高胰岛素血症、代谢和胰岛素抵抗之间的复杂相互作用, 很难界定导致代谢功能障碍的主要原因. 如前所述, 有证据支持高胰岛素血症促进交感神经活动. 也有人认为胰岛素抵抗是交感神经张力增加而引起的次要现象. 有关交感神经过度活动先于胰岛素抵抗和糖尿病前期发展的证据得到了研究结果的支持, 研究表明[32], 在寒冷的升压试验中血浆去甲肾上腺素的升高可以预测18年随访时的高血糖和胰岛素敏感性受损(用HOMA-IR指数来衡量).
增加交感神经向骨骼肌的传出在糖代谢中起着重要的作用, 主要是通过引起骨骼肌血流量的减少. 事实上, 交感神经活动的急性增加已被证明会引起健康成年人胰岛素抵抗. 慢性交感神经活动引起的α-肾上腺素能收缩可抑制骨骼肌餐后血流量的增加, 损害葡萄糖摄取, 刺激胰腺产生额外的胰岛素, 导致胰岛素抵抗发生[33].
肥胖症正在全球范围内流行, 并且是导致共同疾病的一个主要原因, 主要与心血管疾病有关. 自主神经系统(autonomic nervous system, ANS)功能障碍与肥胖有双向关系. 事实上, ANS的改变可能参与了肥胖的发病机制, 显示作用于不同的途径. 另一方面, 超重会导致ANS功能障碍, 这可能与血液动力学和代谢改变有关, 从而增加肥胖人群的心血管风险, 即高血压、胰岛素抵抗和血脂异常[34].
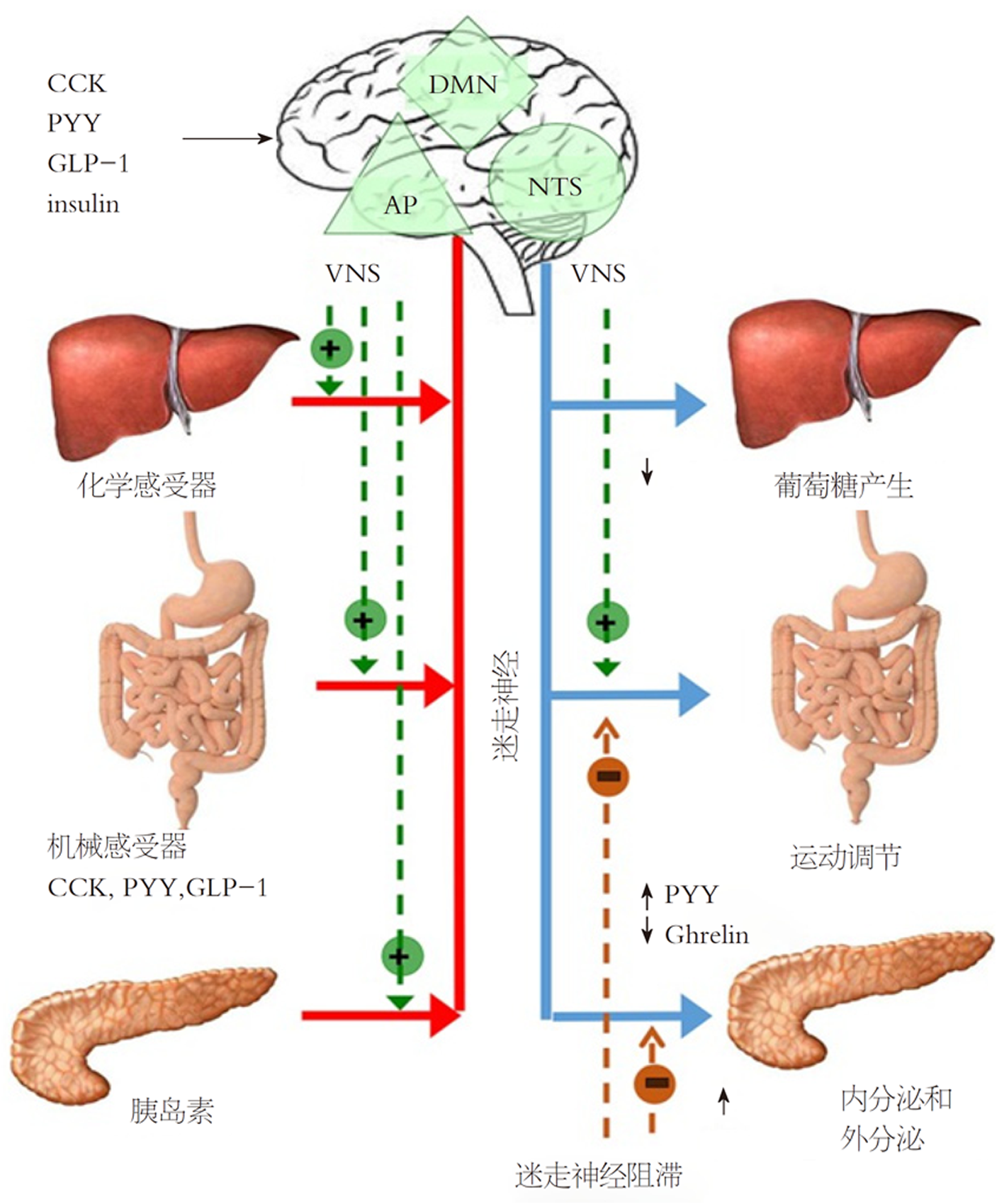
在体重的短期或长期调节中, ANS起着核心作用. 特别是由于迷走神经的激活和肠道激素的释放, 体重的短期调节主要是通过胃胀引起的饱腹感. 然而, 迷走神经活动也参与了后一种途径, 因为现在已经认识到迷走神经传入的激活是肠激素通过调节食物摄入和胃排空来控制肠内营养供应的一个早期步骤(图2)[34]. 因此, 肠激素和迷走神经传入神经元被认为在肥胖的发病机制中起着重要的作用.
更复杂的是肥胖和交感神经活动之间的双向关系. 在胰岛素抵抗状态下, 如肥胖时, 基础交感神经活性的增加与IR的程度有关[35], 提示肥胖患者体温降低和代谢率低最终会导致IR和代偿性高胰岛素血症.
胰岛素对SNS活性的刺激作用直接作用于大脑: 在禁食状态下, 低水平的血浆胰岛素降低下丘脑神经元的胰岛素介导的葡萄糖代谢, 从而激活抑制通路, 抑制脑干交感神经中枢的慢性活动. 摄入碳水化合物后, 胰岛素浓度增加会刺激同一神经元中胰岛素介导的葡萄糖代谢, 导致胰岛素介导的葡萄糖代谢增强, 抑制途径减少, 最终刺激脑干交感神经中心, 从而增加中枢交感神经的传出[36]. 这一机制被认为是为了解释胰岛素在易感人群中的"亲高血压"效应[37], 在这种情况下, 高血压可能代表肥胖者为恢复能量平衡和限制进一步体重增长而招募的代偿机制所造成的后果. 换句话说, 肥胖受试者虽然抵抗胰岛素对外周葡萄糖摄取的影响, 但不应对胰岛素对SNS的影响产生抵抗力, 尽管这并不一定与血管代偿机制的平衡导致血压升高有关[38]. 研究显示[39], 肥胖受试者对胰岛素对交感神经活动的影响很敏感, 尽管胰岛素对葡萄糖摄取有抵抗力, 但24 h尿去甲肾上腺素排泄量增加, 排出的去甲肾上腺素量与肥胖程度有关. 然而, 最近, 在成年肥胖患者中, 交感神经的餐后增强已经被证实. 这一有趣的发现, 可能代表了一种抑制餐后热发生的机制, 从而有利于体重增加.
胃肠道除了在消化和吸收营养物质方面起主要作用外, 还通过肠道激素调节食物的摄入. 有趣的是, 他们的部分行为是由迷走神经介导的. 肠激素对迷走神经传入神经元的作用现在被认为是通过调节食物摄入和胃排空来控制营养物质进入肠道的早期步骤. 因此, 肠道激素和迷走神经传入神经元被认为在肥胖的发病机制中起着重要作用[40].
饱腹感是在进食过程中产生的神经体液刺激的结果, 导致控制食物的大小和终止,因此, 肥胖的发病机制中涉及到的饱腹感的改变. 控制饥饿和饱足的主要下丘脑区域是弓状核(arcuate nucleus, ARC)、室旁核、下丘脑背内侧区和腹内侧区以及下丘脑外侧区. 这些区域受来自肝脏和肠道、内分泌胰腺和脂肪细胞的不同外周信号的影响, 这些信号可以直接作用于中枢神经系统中的神经元或通过传入神经元. 的确, 迷走神经传入通路可能是肠道和大脑之间最重要的联系, 以达到满足信号调节的目的. 迷走神经传入神经元通过机械感受器刺激从胃肠道接收摄食后的信息[41], 以响应胃扩张、肠道激素释放以响应所消耗的食物的营养成分以及某些营养物质的直接作用, 例如短链脂肪酸. 最后, 迷走神经通过位于肝门脉系统中的化学感受器接收代谢信息[42](图2). 外周感受器的信号通过迷走神经传入脑干的孤束核(nucleus of the solitary tract, NTS)/后区复合体(NTS/AP), 它整合了来自胃肠道和腹部内脏的感觉信息和来自口腔的味觉信息. NTS通过Vago-迷走神经自主神经反射通过背侧运动核投射到肠道. 这一途径的刺激导致肠道反应, 包括控制肠道转运时间和运动(即胃排空延迟), 肠内分泌细胞(enteroendocrine cells, EECS)对营养的吸收和暴露, 胃肠激素和胰腺分泌的变化与饱腹感有关.
虽然还不完全清楚, 但在能源消耗和储存方面, ANS似乎起到了一定的作用. 在人体中, 能量主要储存在胰岛素作用下的WAT中, SNS的激活主要是从WAT中调动能量. 此外, SNS还可能通过作用于棕色脂肪组织(brown adipose tissue, BAT)的热发生或心血管系统来增加能量消耗: 这种神经元通路受瘦素的调节[43].
3.2.1 SNS在脂解中的作用: 众所周知, WAT中的脂解受SNS和胰岛素的调节, 胰岛素分别是脂解的主要引发剂和有效的脂解抑制剂. 的确, 交感神经刺激会导致脂肪酸的释放, 而交感神经或神经节阻滞则会抑制脂质动员. 另一方面, 肾上腺髓质儿茶酚胺对脂质动员没有影响, 证实SNS向WAT的流出量增加会引起脂解. Kreier等[44]在动物模型中也假设WAT的副交感神经支配, 可能是以合成的方式调节胰岛素介导的葡萄糖摄取和游离脂肪酸代谢, 从而促进脂质的积累. 根据这一假设, 肥胖中的脂质积累可能是由于SNS活动减少或副交感神经活动增加所致[45].
3.2.2 SNS在能量消耗中的作用: 包括静止代谢率(包括心脏呼吸功和静息时跨膜离子梯度的维持)、体力活动和热发生(颤抖和非颤抖)以及食物的热效应. SNS激活可引起总能量消耗, 增加心肺功或增加热发生.
众所周知, SNS通过调节心输出量、外周血管阻力和热产生而在血压和代谢稳态控制中发挥着关键作用, 这些因素占静止代谢率的很大一部分. 事实上, 药物肾上腺素能封锁能够减少静息能量消耗[46].
与以前的想法不同的是, BAT不仅存在于儿童中, 而且还存在于瘦弱和肥胖的成年人中. 其主要功能是通过诱导冷或饮食刺激的热量产生来增加能源消耗, 以及通过BAT线粒体解偶联蛋白-1解除ATP合成的氧化磷酸化[47]. BAT热发生受交感神经的调节. 如前所述, 交感神经激活会导致脂肪酸的动员, 这些脂肪酸随后被BAT用来散热. 就交感神经控制而言, 行单侧交感神经切除术的患者显示, 未受影响侧正电子发射断层扫描可检测到18F-氟代脱氧葡萄糖(fluorodeoxyglucose, 18F-FDG)在BAT中的摄取, 但未发现在手术交感神经切除术一侧. 使用β-肾上腺素能受体阻断剂可降低已知或疑似癌症患者和副神经节瘤患者的BAT 18F-FDG摄取, 这种情况的特点是过度循环儿茶酚胺引起代谢BAT活性大幅度增加[48]. α受体和α阻断剂的作用尚不清楚,1例儿茶酚胺分泌副神经节瘤患者, α阻断后BAT 18F-FDG摄取被抑制[49]. 模拟交感神经药物麻黄碱能激活瘦弱而非肥胖受试者中的BAT, 尽管其激活程度远低于冷暴露后观察到的水平[50]. 相反, 副交感神经系统对BAT的作用似乎是间接的. 事实上, 在动物模型中, 在迷走神经切断术后, 胃动素输注所引起的抑制BAT去甲基肾上腺素(norepinephrine, NE)释放的现象已被取消, 推测迷走神经介导了生长激素释放肽(ghrelin)的外周作用, 从而抑制了交感神经向BAT方向的交通.
肝脏中的自主神经纤维分布于门脉, 参与调节血流、胆汁分泌和肝脏代谢, 从而促进系统的稳态. 慢性肝炎(尤其是病毒性肝炎)的总神经纤维和交感神经纤维的神经纤维面积比(nerve fiber area ratio, NFAR)明显降低, 晚期肝纤维化也是如此. 然而, 炎症活动的程度不影响NFAR的整个神经或交感神经. 对HCV抗病毒治疗前后的标本进行比较, 结果显示NFAR的恢复与肝纤维化的改善有关[51].
肝纤维化是肝细胞损伤和修复反复循环的结果, 肝纤维化使静止的HSCs转化为肌成纤维细胞表型, 其特征是胶原等细胞外基质蛋白的分泌增加[52]. HSCs是胶原产生的主要来源, 位于靠近人肝脏交感神经纤维的位置. HSCs是一种肝神经胶质细胞, 表达α1A、α2B、β1、β2和β3肾上腺素能受体和神经肽Y(neuropeptide Y, NPY)受体[53,54], 是去甲肾上腺素(norepinephrine, NE)合成和释放的关键酶, 即多巴胺-β-羟化酶和酪氨酸羟化酶. 此外, 在不同的动物实验中, α-和β-受体拮抗剂对HSC的生长有抑制作用[54]. 这些结果提示交感神经通过自分泌和旁分泌机制调节HSCs.
胃肠道与自主神经系统的关系已经得到了广泛的研究, 特别是在消化道运动、液体输送和内分泌系统等方面. 肝脏由交感神经和副交感神经支配. 交感神经纤维是与腹腔神经节和肠系膜上神经节相连的交感神经纤维, 其来源于T7-T12处的节前神经纤维, 而副交感神经纤维从迷走神经分支而来, 被认为直接支配着脑干背侧运动核的节前神经纤维或肝门神经节内的突触[55]. 然而, 肝神经节的位置仍不清楚. 这些神经纤维从肝门进入肝脏, 并分布在门脉三位一体. 在人的肝脏中, 交感神经纤维延伸到肝小叶, 而副交感神经只分布在门脉. 虽然动物种类之间存在一定的差异, 但据报道, 肝内神经纤维在大多数情况下围绕着肝动脉、门静脉和胆管.
在肝神经纤维中, 传入神经纤维负责向大脑报告渗透压和肝脏葡萄糖和脂质浓度等信息[55,56,57], 而传出纤维则传递来自大脑的调节血流、胆汁分泌、脂类合成和糖化的命令, 以维持机体内环境平衡[55,58,59]. 在肝移植中, 虽然血管和胆管都是解剖重建的, 但神经仍然不连接. 据报道, 肝移植受者经常出现各种系统性疾病, 如肥胖、血脂异常、高血压和糖尿病[60], 推测这种系统失调可能与肝失神经有关.
据报道, 肝内神经纤维参与肝纤维化和肝再生. 肝星状细胞(hepatic stellate cells, HSCs)在肝损伤期间被激活, 并转化为肌成纤维细胞样细胞, 产生胶原纤维. HSCs具有肾上腺素受体, 交感神经刺激促进了HSCs的生长, 而交感神经刺激也参与了肝纤维化的进展. 虽然肝前体细胞在严重肝损伤后被激活并分化为肝细胞, 但其增殖可通过抑制交感神经系统而增强, 从而减轻肝损伤[61]. 相反, 迷走神经切断术损害肝脏再生[62].
慢性肝病患者肝内神经纤维较正常肝脏明显减少. HSCs在肝脏损伤后被激活并转化为成纤维细胞, 产生胶原纤维. HSCs被认为是受交感神经调节的, HSCs本身能够合成和释放儿茶酚胺, 如去甲肾上腺素. 提示神经纤维在肝纤维化中起着重要作用. 研究中比较了轻度纤维化和晚期纤维化之间的神经纤维面积比(nerve fiber area ratios, NFARs), 发现NFARs随着肝纤维化程度的增加而降低. 这似乎与交感神经刺激后胶原纤维释放的增加相矛盾. 因此, 假设神经纤维在肝纤维化的发展中起着重要的作用. 随着慢性肝炎所致纤维化的进展, 神经纤维也会受到物理损伤的影响, 导致纤维退行性变. 为了澄清这种可能性, 需要进一步的研究, 包括对神经递质的分析.
虽然晚期纤维化组NFAR较轻度纤维化组显著降低, 但无论是病理分级还是血清ALT水平, 肝脏炎症程度与NFAR均无显著性关系. 这是第一个评估神经纤维分布与炎症和纤维化的关系的研究[51]. 此外已经得到证明是纤维化, 而不是炎症, 是与神经纤维减少有关.
在严重纤维化时, 门脉区的神经分布相对于轻度纤维化更为稀疏. 随着肝病的发展, 少量的神经纤维需要调节更广泛的区域. 这可能是肝再生失败的原因之一. 提示慢性肝炎肝内神经纤维减少, 损害程度可能与疾病病因有关. 神经纤维也随着纤维化的进展而明显减少. 改善纤维化后, 神经纤维数量得到恢复. 肝纤维化而非炎症活动似乎与病变肝脏中神经纤维的数量有关[51]. 因此为了阐明肝脏代谢与神经纤维分布之间的关系, 有必要进行深入的研究.
交感神经系统作为目前治疗的靶点, MAFLD患者的主要治疗目标是控制肥胖、血压、葡萄糖、脂肪代谢障碍等个体危险因素. 随着MAFLD和相关代谢疾病发病率的增加, 减肥和运动, 开发有效的治疗方法是当务之急. 目前的方法包括改变生活方式; 具体来说, MAFLD的首选治疗形式是通过持续的运动方案或饮食限制和认知行为疗法来减轻体重. 许多研究探讨了涉及运动或热量限制或两者均可导致体重减轻、腹部和肝脏脂肪减少和胰岛素敏感性改善的生活方式干预措施, 这些措施均可使MAFLD获得改善[63,64]. 相反, 身体素质下降与MAFLD的严重程度增加有关. 有氧训练和阻力训练都被证明是有效的, 但可能取决于患者的喜好, 以确保对锻炼制度的承诺, 使其达到有效的目的[64]. 解决"心理社会需求和行为支持"的多学科方法可能是有效的[65], 但往往受到人格因素和精神健康问题的影响, 例如抑郁症、低意识和神经质.
除减肥和运动外, 对交感神经系统的药物抑制可能是治疗MAFLD及相关代谢紊乱的合理方法[66]. 以减轻体重为靶点的交感神经过度驱动已被证明可以改善高血压患者心脏代谢异常和肝脏损害的标志. α-肾上腺素能阻滞剂可降低交感神经活性, 降低血糖、血脂水平和血压. 然而, β阻滞剂在肥胖人群中的使用可能存在问题. 研究清楚地表明, 美托洛尔、阿替洛尔和普萘洛尔等β阻滞剂与体重增加、胰岛素抵抗和血脂状况恶化有关, 从而使Mets患者发展为糖尿病[67], 因此, 在治疗中应严格权衡利弊.
相比之下, 双子座试验显示, 卡维地洛(Carvedilol)的使用并没有导致体重大幅增加, 实际上与改善胰岛素抵抗、血脂状况和大量减少微量白蛋白尿等有益影响有关[68]. 此外, 与传统的β受体阻滞剂相比, 高心脏选择性的第三代β阻滞剂奈维波洛尔(Neviibolol)与传统的β受体阻滞剂相比, 在炎症、血脂和血糖方面有明显的降低[69].
咪唑啉I1(Imidazoline I1)受体激动剂是一种抗高血压药物, 主要作用于延髓头端腹外侧, 抑制交感神经的激活. 除了可以与其他类别的抗高血压药物相媲美的降血压外, 莫索尼定等药物在胰岛素敏感性、糖代谢和血脂异常方面也有改善, 并与靶器官损害的消退有关, 如内皮功能改善所证明的, 可减少左室肥厚, 改善肾功能和减少微量白蛋白尿. 联合使用莫索尼定和减肥计划对年轻超重男性的代谢状况和末梢器官损伤有着有益的影响[70]. 在对超重/肥胖相关血压升高和代谢紊乱患者的实际初级护理环境中(Mersy研究), 在治疗方案中加入莫索尼定不仅可以降低血压, 而且还能改善体重和代谢状况[71]. 尽管如此, 这些药物对MAFLD, Mets和肥胖相关高血压患者是否应该优先使用于其他药物类别之前仍有待证实.
除生活方式干预和药物治疗外, 基于装置的方法不仅用于高血压及其心血管并发症的治疗, 而且也用于与交感神经过度驱动相关的代谢状况, 如2型糖尿病和Mets[72]. 导管为基础的肾脏和最近的肝去神经被证明是安全的, 并显示了心脏代谢剖面的显著改善, 符合前面描述的病理生理学考虑, 如肾脏反射和SNS与葡萄糖代谢之间的密切相互作用[72,73]. 骨骼肌血管中交感神经张力的增加在糖代谢中起着重要作用, 主要是通过减少流向骨骼肌的血流量, 从而减少葡萄糖摄取, 这是胰岛素抵抗的一个标志[66]. 抗高血压患者肾交感神经失神经可显著降低交感神经活性[74], 改善糖代谢, 降低血压. 多囊卵巢综合征患者肾失神经, 通常以超重/肥胖、胰岛素抵抗、交感神经过度驱动和血压升高为特征, 在3个月无任何体重变化并伴有肾损害消退的情况下, 胰岛素敏感性提高17.5%[75].
此外, 肝、胰和十二指肠交感神经张力的衰减通过肝失神经来调节心脏和肾交感神经活动, 并可能提供深远的心血管和代谢益处[76-78]. 肝失神经可通过肝到脑的传入神经途径减少交感神经中央传出, 从而影响其他自主神经的控制, 从而促进血压和代谢的改善[72]. 其他介入性交感神经溶解技术包括压力反射激活疗法, 这种疗法在耐受性高血压中显示了适度的代谢益处[79].
为了减少肝交感神经的活动, 目前采用了两种方法: 一是药物消融交感神经, 另一种是酚基肝交感神经去神经. 饮食诱导的MAFLD与肝交感神经的近双倍放电率有关, 这主要是由于传出神经的增加所致. 此外, 建立的高脂饮食诱导的肝脂肪变性可以有效地减少药物或苯酚为基础的肝交感神经切除, 而不依赖于体重、热量摄入或脂肪的变化. 肝交感神经的消融也与改善肝脏三酰甘油积累途径有关, 包括游离脂肪酸摄取和新生脂肪形成. 这些发现突出了肝交感神经传出与肝脂肪变性之间的一种未知的致病联系, 提示对肝交感神经的操纵可能是NAFLD的一种新的治疗策略[78].
总之, 目前研究显示交感神经系统在MAFLD、Mets、心血管疾病等的发病机制中发挥重要作用, 随着发病率和死亡率的增加, 已成为全球卫生保健的一个主要问题. 因此, 研究其发病机制对于寻找新的治疗靶点至关重要. 人工神经网络在综合短期调节体重、调节满足信号和能量消耗等方面起着重要作用. SNS通过白色和棕色脂肪组织的交感神经支配, 具有增加脂肪分解和能量消耗的生理功能, 因此在肥胖患者中具有代偿性但无效的异常激活作用.
从动物和临床研究中积累的证据证实了交感神经系统在心血管和代谢稳态紊乱中的重要作用. 通过使用最先进的方法, 在动物和肥胖患者、Mets和MAFLD患者身上, 交感神经活动得到了明显的增强. 此外, 与代谢疾病谱有关的心血管和代谢紊乱, 如血压升高、舒张功能障碍和肾损害, 也受到交感神经系统的调节. 交感神经激活会影响MAFLD的代谢紊乱的相关方面和代谢效应, 这是由于肝脏交感神经张力增加而发生的. 虽然交感神经激活与MAFLD的确切联系仍有待确定, 但有证据表明交感神经系统在MAFLD的发生和发展中起着重要作用. Mets的共同管理策略, 如减肥和运动, 均与交感神经活化显著减少有关. 随着肥胖症和Mets的发病率不断上升, 直接针对交感神经系统, 无论是药物治疗还是新的基于设备的策略似乎是一个合理且有吸引力的治疗策略, 值得今后进一步全面和深入的研究, 在MAFLD目前尚无特效治疗的情况下, 寻求在MAFLD治疗上获得新的有效治疗途径, 是今后研究的重点课题之一.
学科分类: 胃肠病学和肝病学
手稿来源地: 山东省
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): B, B
C级 (良好): C, C
D级 (一般): 0
E级 (差): 0
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Chen YL, Li H, Li S, Xu Z, Tian S, Wu J, Liang XY, Li X, Liu ZL, Xiao J, Wei JY, Ma CY, Wu KN, Ran L, Kong LQ. Prevalence of and risk factors for metabolic associated fatty liver disease in an urban population in China: a cross-sectional comparative study. BMC Gastroenterol. 2021;21:212. [PubMed] [DOI] |
| 2. | Carnagarin R, Tan K, Adams L, Matthews VB, Kiuchi MG, Marisol Lugo Gavidia L, Lambert GW, Lambert EA, Herat LY, Schlaich MP. Metabolic Dysfunction-Associated Fatty Liver Disease (MAFLD)-A Condition Associated with Heightened Sympathetic Activation. Int J Mol Sci. 2021;22. [PubMed] [DOI] |
| 3. | Carnagarin R, Matthews V, Zaldivia MTK, Peter K, Schlaich MP. The bidirectional interaction between the sympathetic nervous system and immune mechanisms in the pathogenesis of hypertension. Br J Pharmacol. 2019;176:1839-1852. [PubMed] [DOI] |
| 4. | Thorp AA, Schlaich MP. Relevance of Sympathetic Nervous System Activation in Obesity and Metabolic Syndrome. J Diabetes Res. 2015;2015:341583. [PubMed] [DOI] |
| 5. | Peverill W, Powell LW, Skoien R. Evolving concepts in the pathogenesis of NASH: beyond steatosis and inflammation. Int J Mol Sci. 2014;15:8591-8638. [PubMed] [DOI] |
| 6. | Sakamoto M, Tsujikawa H, Effendi K, Ojima H, Harada K, Zen Y, Kondo F, Nakano M, Kage M, Sumida Y, Hashimoto E, Yamada G, Okanoue T, Koike K. Pathological findings of nonalcoholic steatohepatitis and nonalcoholic fatty liver disease. Pathol Int. 2017;67:1-7. [PubMed] [DOI] |
| 7. | Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016;64:73-84. [PubMed] [DOI] |
| 8. | Than NN, Newsome PN. A concise review of non-alcoholic fatty liver disease. Atherosclerosis. 2015;239:192-202. [PubMed] [DOI] |
| 9. | Jasirwan COM, Lesmana CRA, Hasan I, Sulaiman AS, Gani RA. The role of gut microbiota in non-alcoholic fatty liver disease: pathways of mechanisms. Biosci Microbiota Food Health. 2019;38:81-88. [PubMed] [DOI] |
| 10. | 池肇春, 段钟平(主编). 肠道微生物与消化系统疾病. 上海: 上海科学技术出版社 2020; 157-168. |
| 11. | Schlaich M, Straznicky N, Lambert E, Lambert G. Metabolic syndrome: a sympathetic disease? Lancet Diabetes Endocrinol. 2015;3:148-157. [PubMed] [DOI] |
| 12. | Bruinstroop E, Pei L, Ackermans MT, Foppen E, Borgers AJ, Kwakkel J, Alkemade A, Fliers E, Kalsbeek A. Hypothalamic neuropeptide Y (NPY) controls hepatic VLDL-triglyceride secretion in rats via the sympathetic nervous system. Diabetes. 2012;61:1043-1050. [PubMed] [DOI] |
| 13. | Smits MM, Ioannou GN, Boyko EJ, Utzschneider KM. Non-alcoholic fatty liver disease as an independent manifestation of the metabolic syndrome: results of a US national survey in three ethnic groups. J Gastroenterol Hepatol. 2013;28:664-670. [PubMed] [DOI] |
| 14. | Gaggini M, Morelli M, Buzzigoli E, DeFronzo RA, Bugianesi E, Gastaldelli A. Non-alcoholic fatty liver disease (NAFLD) and its connection with insulin resistance, dyslipidemia, atherosclerosis and coronary heart disease. Nutrients. 2013;5:1544-1560. [PubMed] [DOI] |
| 15. | Thorp AA, Schlaich MP. Relevance of Sympathetic Nervous System Activation in Obesity and Metabolic Syndrome. J Diabetes Res. 2015;2015:341583. [PubMed] [DOI] |
| 16. | Carnagarin R, Gregory C, Azzam O, Hillis GS, Schultz C, Watts GF, Bell D, Matthews V, Schlaich MP. The Role of Sympatho-Inhibition in Combination Treatment of Obesity-Related Hypertension. Curr Hypertens Rep. 2017;19:99. [PubMed] [DOI] |
| 17. | Wider MD. Metabolic syndrome and the hepatorenal reflex. Surg Neurol Int. 2016;7:99. [PubMed] [DOI] |
| 18. | Koliaki C, Roden M. Hepatic energy metabolism in human diabetes mellitus, obesity and non-alcoholic fatty liver disease. Mol Cell Endocrinol. 2013;379:35-42. [PubMed] [DOI] |
| 19. | Thorp AA, Schlaich MP. Relevance of Sympathetic Nervous System Activation in Obesity and Metabolic Syndrome. J Diabetes Res. 2015;2015:341583. [PubMed] [DOI] |
| 20. | Schlaich M, Straznicky N, Lambert E, Lambert G. Metabolic syndrome: a sympathetic disease? Lancet Diabetes Endocrinol. 2015;3:148-157. [PubMed] [DOI] |
| 21. | Carnagarin R, Matthews VB, Herat LY, Ho JK, Schlaich MP. Autonomic Regulation of Glucose Homeostasis: a Specific Role for Sympathetic Nervous System Activation. Curr Diab Rep. 2018;18:107. [PubMed] [DOI] |
| 22. | Vollenweider P, Tappy L, Randin D, Schneiter P, Jéquier E, Nicod P, Scherrer U. Differential effects of hyperinsulinemia and carbohydrate metabolism on sympathetic nerve activity and muscle blood flow in humans. J Clin Invest. 1993;92:147-154. [PubMed] [DOI] |
| 23. | Landsberg L. Insulin-mediated sympathetic stimulation: role in the pathogenesis of obesity-related hypertension (or, how insulin affects blood pressure, and why). J Hypertens. 2001;19:523-528. [PubMed] [DOI] |
| 24. | Cassaglia PA, Hermes SM, Aicher SA, Brooks VL. Insulin acts in the arcuate nucleus to increase lumbar sympathetic nerve activity and baroreflex function in rats. J Physiol. 2011;589:1643-1662. [PubMed] [DOI] |
| 25. | Ciriello J. Leptin in nucleus of the solitary tract alters the cardiovascular responses to aortic baroreceptor activation. Peptides. 2013;44:1-7. [PubMed] [DOI] |
| 26. | Machleidt F, Simon P, Krapalis AF, Hallschmid M, Lehnert H, Sayk F. Experimental hyperleptinemia acutely increases vasoconstrictory sympathetic nerve activity in healthy humans. J Clin Endocrinol Metab. 2013;98:E491-E496. [PubMed] [DOI] |
| 27. | Masuo K, Mikami H, Ogihara T, Tuck ML. Weight gain-induced blood pressure elevation. Hypertension. 2000;35:1135-1140. [PubMed] [DOI] |
| 28. | Florian JP, Pawelczyk JA. Sympathetic and haemodynamic responses to lipids in healthy human ageing. Exp Physiol. 2010;95:486-497. [PubMed] [DOI] |
| 29. | Brunner EJ, Hemingway H, Walker BR, Page M, Clarke P, Juneja M, Shipley MJ, Kumari M, Andrew R, Seckl JR, Papadopoulos A, Checkley S, Rumley A, Lowe GD, Stansfeld SA, Marmot MG. Adrenocortical, autonomic, and inflammatory causes of the metabolic syndrome: nested case-control study. Circulation. 2002;106:2659-2665. [PubMed] [DOI] |
| 30. | Julius S, Valentini M, Palatini P. Overweight and hypertension : a 2-way street? Hypertension. 2000;35:807-813. [PubMed] [DOI] |
| 31. | Lithell H, Pollare T, Berne C, Saltin B. The metabolic and circulatory response to beta-blockade in hypertensive men is correlated to muscle capillary density. Blood Press. 1992;1:20-26. [PubMed] [DOI] |
| 32. | Flaa A, Aksnes TA, Kjeldsen SE, Eide I, Rostrup M. Increased sympathetic reactivity may predict insulin resistance: an 18-year follow-up study. Metabolism. 2008;57:1422-1427. [PubMed] [DOI] |
| 33. | Julius S, Valentini M. Consequences of the increased autonomic nervous drive in hypertension, heart failure and diabetes. Blood Press Suppl. 1998;3:5-13. [PubMed] [DOI] |
| 34. | Guarino D, Nannipieri M, Iervasi G, Taddei S, Bruno RM. The Role of the Autonomic Nervous System in the Pathophysiology of Obesity. Front Physiol. 2017;8:665. [PubMed] [DOI] |
| 35. | Feldstein C, Julius S. The complex interaction between overweight, hypertension, and sympathetic overactivity. J Am Soc Hypertens. 2009;3:353-365. [PubMed] [DOI] |
| 36. | Frontoni S, Bracaglia D, Gigli F. Relationship between autonomic dysfunction, insulin resistance and hypertension, in diabetes. Nutr Metab Cardiovasc Dis. 2005;15:441-449. [PubMed] |
| 37. | Chen W, Leo S, Weng C, Yang X, Wu Y, Tang X. Mechanisms mediating renal sympathetic nerve activation in obesity-related hypertension. Herz. 2015;40 Suppl 2:190-196. [PubMed] [DOI] |
| 38. | Battault S, Meziat C, Nascimento A, Braud L, Gayrard S, Legros C, De Nardi F, Drai J, Cazorla O, Thireau J, Meyer G, Reboul C. Vascular endothelial function masks increased sympathetic vasopressor activity in rats with metabolic syndrome. Am J Physiol Heart Circ Physiol. 2018;314:H497-H507. [PubMed] [DOI] |
| 39. | Xu X, Chen DD, Yin J, Chen JD. Altered postprandial responses in gastric myoelectrical activity and cardiac autonomic functions in healthy obese subjects. Obes Surg. 2014;24:554-560. [PubMed] [DOI] |
| 40. | Dockray GJ. Gastrointestinal hormones and the dialogue between gut and brain. J Physiol. 2014;592:2927-2941. [PubMed] [DOI] |
| 41. | Ikramuddin S, Blackstone RP, Brancatisano A, Toouli J, Shah SN, Wolfe BM, Fujioka K, Maher JW, Swain J, Que FG, Morton JM, Leslie DB, Brancatisano R, Kow L, O'Rourke RW, Deveney C, Takata M, Miller CJ, Knudson MB, Tweden KS, Shikora SA, Sarr MG, Billington CJ. Effect of reversible intermittent intra-abdominal vagal nerve blockade on morbid obesity: the ReCharge randomized clinical trial. JAMA. 2014;312:915-922. [PubMed] [DOI] |
| 42. | Yi CX, la Fleur SE, Fliers E, Kalsbeek A. The role of the autonomic nervous liver innervation in the control of energy metabolism. Biochim Biophys Acta. 2010;1802:416-431. [PubMed] [DOI] |
| 43. | Pandit R, Beerens S, Adan RAH. Role of leptin in energy expenditure: the hypothalamic perspective. Am J Physiol Regul Integr Comp Physiol. 2017;312:R938-R947. [PubMed] [DOI] |
| 44. | Kreier F, Fliers E, Voshol PJ, Van Eden CG, Havekes LM, Kalsbeek A, Van Heijningen CL, Sluiter AA, Mettenleiter TC, Romijn JA, Sauerwein HP, Buijs RM. Selective parasympathetic innervation of subcutaneous and intra-abdominal fat--functional implications. J Clin Invest. 2002;110:1243-1250. [PubMed] [DOI] |
| 45. | Bartness TJ. Dual innervation of white adipose tissue: some evidence for parasympathetic nervous system involvement. J Clin Invest. 2002;110:1235-1237. [PubMed] [DOI] |
| 46. | Shibao C, Gamboa A, Diedrich A, Ertl AC, Chen KY, Byrne DW, Farley G, Paranjape SY, Davis SN, Biaggioni I. Autonomic contribution to blood pressure and metabolism in obesity. Hypertension. 2007;49:27-33. [PubMed] [DOI] |
| 47. | Saito M. Brown adipose tissue as a regulator of energy expenditure and body fat in humans. Diabetes Metab J. 2013;37:22-29. [PubMed] [DOI] |
| 48. | Cheng W, Zhu Z, Jin X, Chen L, Zhuang H, Li F. Intense FDG activity in the brown adipose tissue in omental and mesenteric regions in a patient with malignant pheochromocytoma. Clin Nucl Med. 2012;37:514-515. [PubMed] [DOI] |
| 49. | Søndergaard E, Gormsen LC, Christensen MH, Pedersen SB, Christiansen P, Nielsen S, Poulsen PL, Jessen N. Chronic adrenergic stimulation induces brown adipose tissue differentiation in visceral adipose tissue. Diabet Med. 2015;32:e4-e8. [PubMed] [DOI] |
| 50. | Carey AL, Formosa MF, Van Every B, Bertovic D, Eikelis N, Lambert GW, Kalff V, Duffy SJ, Cherk MH, Kingwell BA. Ephedrine activates brown adipose tissue in lean but not obese humans. Diabetologia. 2013;56:147-155. [PubMed] [DOI] |
| 51. | Mizuno K, Haga H, Okumoto K, Hoshikawa K, Katsumi T, Nishina T, Saito T, Katagiri H, Ueno Y. Intrahepatic distribution of nerve fibers and alterations due to fibrosis in diseased liver. PLoS One. 2021;16:e0249556. [PubMed] [DOI] |
| 52. | Oben JA, Diehl AM. Sympathetic nervous system regulation of liver repair. Anat Rec A Discov Mol Cell Evol Biol. 2004;280:874-883. [PubMed] [DOI] |
| 53. | Oben JA, Roskams T, Yang S, Lin H, Sinelli N, Torbenson M, Smedh U, Moran TH, Li Z, Huang J, Thomas SA, Diehl AM. Hepatic fibrogenesis requires sympathetic neurotransmitters. Gut. 2004;53:438-445. [PubMed] [DOI] |
| 54. | Oben JA, Roskams T, Yang S, Lin H, Sinelli N, Li Z, Torbenson M, Huang J, Guarino P, Kafrouni M, Diehl AM. Sympathetic nervous system inhibition increases hepatic progenitors and reduces liver injury. Hepatology. 2003;38:664-673. [PubMed] [DOI] |
| 55. | Jensen KJ, Alpini G, Glaser S. Hepatic nervous system and neurobiology of the liver. Compr Physiol. 2013;3:655-665. [PubMed] [DOI] |
| 56. | Kandilis AN, Papadopoulou IP, Koskinas J, Sotiropoulos G, Tiniakos DG. Liver innervation and hepatic function: new insights. J Surg Res. 2015;194:511-519. [PubMed] [DOI] |
| 57. | Uno K, Yamada T, Ishigaki Y, Imai J, Hasegawa Y, Sawada S, Kaneko K, Ono H, Asano T, Oka Y, Katagiri H. A hepatic amino acid/mTOR/S6K-dependent signalling pathway modulates systemic lipid metabolism via neuronal signals. Nat Commun. 2015;6:7940. [PubMed] [DOI] |
| 58. | Mizuno K, Ueno Y. Autonomic Nervous System and the Liver. Hepatol Res. 2017;47:160-165. [PubMed] [DOI] |
| 59. | Hirako S, Wada N, Kageyama H, Takenoya F, Izumida Y, Kim H, Iizuka Y, Matsumoto A, Okabe M, Kimura A, Suzuki M, Yamanaka S, Shioda S. Autonomic nervous system-mediated effects of galanin-like peptide on lipid metabolism in liver and adipose tissue. Sci Rep. 2016;6:21481. [PubMed] [DOI] |
| 60. | Munshi VN, Saghafian S, Cook CB, Werner KT, Chakkera HA. Comparison of post-transplantation diabetes mellitus incidence and risk factors between kidney and liver transplantation patients. PLoS One. 2020;15:e0226873. [PubMed] [DOI] |
| 61. | Zanchi A, Reidy J, Feldman HJ, Qualter J, Gouw AS, Osbeck J, Kofman A, Balabaud C, Bioulac-Sage P, Tiniakos DG, Theise ND. Innervation of the proximal human biliary tree. Virchows Arch. 2020;477:385-392. [PubMed] [DOI] |
| 62. | Izumi T, Imai J, Yamamoto J, Kawana Y, Endo A, Sugawara H, Kohata M, Asai Y, Takahashi K, Kodama S, Kaneko K, Gao J, Uno K, Sawada S, Kalinichenko VV, Ishigaki Y, Yamada T, Katagiri H. Vagus-macrophage-hepatocyte link promotes post-injury liver regeneration and whole-body survival through hepatic FoxM1 activation. Nat Commun. 2018;9:5300. [PubMed] [DOI] |
| 63. | Zhang HJ, Pan LL, Ma ZM, Chen Z, Huang ZF, Sun Q, Lu Y, Han CK, Lin MZ, Li XJ, Yang SY, Li XY. Long-term effect of exercise on improving fatty liver and cardiovascular risk factors in obese adults: A 1-year follow-up study. Diabetes Obes Metab. 2017;19:284-289. [PubMed] [DOI] |
| 64. | Hashida R, Kawaguchi T, Bekki M, Omoto M, Matsuse H, Nago T, Takano Y, Ueno T, Koga H, George J, Shiba N, Torimura T. Aerobic vs. resistance exercise in non-alcoholic fatty liver disease: A systematic review. J Hepatol. 2017;66:142-152. [PubMed] [DOI] |
| 65. | Ibrahim MA, Kelleni M, Geddawy A. Nonalcoholic fatty liver disease: current and potential therapies. Life Sci. 2013;92:114-118. [PubMed] [DOI] |
| 66. | Schlaich M, Straznicky N, Lambert E, Lambert G. Metabolic syndrome: a sympathetic disease? Lancet Diabetes Endocrinol. 2015;3:148-157. [PubMed] [DOI] |
| 67. | Sharma AM, Pischon T, Hardt S, Kunz I, Luft FC. Hypothesis: Beta-adrenergic receptor blockers and weight gain: A systematic analysis. Hypertension. 2001;37:250-254. [PubMed] [DOI] |
| 68. | Bell DS, Bakris GL, McGill JB. Comparison of carvedilol and metoprolol on serum lipid concentration in diabetic hypertensive patients. Diabetes Obes Metab. 2009;11:234-238. [PubMed] [DOI] |
| 69. | Hussain M, Saeed M, Babar MZM, Atif MA, Akhtar L. Nebivolol Attenuates Neutrophil Lymphocyte Ratio: A Marker of Subclinical Inflammation in Hypertensive Patients. Int J Hypertens. 2017;2017:7643628. [PubMed] [DOI] |
| 70. | Lambert EA, Sari CI, Eikelis N, Phillips SE, Grima M, Straznicky NE, Dixon JB, Esler M, Schlaich MP, Head GA, Lambert GW. Effects of Moxonidine and Low-Calorie Diet: Cardiometabolic Benefits from Combination of Both Therapies. Obesity (Silver Spring). 2017;25:1894-1902. [PubMed] [DOI] |
| 71. | Vonend O, Marsalek P, Russ H, Wulkow R, Oberhauser V, Rump LC. Moxonidine treatment of hypertensive patients with advanced renal failure. J Hypertens. 2003;21:1709-1717. [PubMed] [DOI] |
| 72. | Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, Mattheus M, Devins T, Johansen OE, Woerle HJ, Broedl UC, Inzucchi SE; EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373:2117-2128. [PubMed] [DOI] |
| 73. | Carnagarin R, Kiuchi MG, Goh G, Adams L, Cohen N, Kavnoudias H, Gan SK, Van Schie G, Esler MD, Matthews VB, Schlaich MP. Role of the sympathetic nervous system in cardiometabolic control: implications for targeted multiorgan neuromodulation approaches. J Hypertens. 2021;39:1478-1489. [PubMed] [DOI] |
| 74. | Kiuchi MG, Ganesan K, Keating J, Carnagarin R, Matthews VB, Herat LY, Goh G, Adams L, Schlaich MP. Combined renal and common hepatic artery denervation as a novel approach to reduce cardiometabolic risk: technical approach, feasibility and safety in a pre-clinical model. Clin Res Cardiol. 2021;110:740-753. [PubMed] [DOI] |
| 75. | Schlaich MP, Hering D, Sobotka P, Krum H, Lambert GW, Lambert E, Esler MD. Effects of renal denervation on sympathetic activation, blood pressure, and glucose metabolism in patients with resistant hypertension. Front Physiol. 2012;3:10. [PubMed] [DOI] |
| 76. | Kraft G, Vrba A, Scott M, Allen E, Edgerton DS, Williams PE, Vafai SB, Azamian BR, Cherrington AD. Sympathetic Denervation of the Common Hepatic Artery Lessens Glucose Intolerance in the Fat- and Fructose-Fed Dog. Diabetes. 2019;68:1143-1155. [PubMed] [DOI] |
| 77. | Bruinstroop E, Eliveld J, Foppen E, Busker S, Ackermans MT, Fliers E, Kalsbeek A. Hepatic denervation and dyslipidemia in obese Zucker (fa/fa) rats. Int J Obes (Lond). 2015;39:1655-1658. [PubMed] [DOI] |
| 78. | Hurr C, Simonyan H, Morgan DA, Rahmouni K, Young CN. Liver sympathetic denervation reverses obesity-induced hepatic steatosis. J Physiol. 2019;597:4565-4580. [PubMed] [DOI] |
| 79. | Wallbach M, Lehnig LY, Helms HJ, Schroer C, Müller GA, Wachter R, Koziolek MJ. Long-term effects of baroreflex activation therapy on glucose metabolism. Acta Diabetol. 2015;52:829-835. [PubMed] [DOI] |