脂解与压力
HPA轴
在应激状态下,下丘脑分泌促肾上腺皮质激素释放激素(CRH),CRH刺激垂体合成促肾上腺皮质激素(ACTH),ACTH刺激肾上腺分泌糖皮质激素(在啮齿动物中主要是皮质酮,在人类中主要是皮质醇),这一过程称为HPA(下丘脑-垂体-肾上腺)轴[1]。

抑制脂解促进压力激素释放
脂肪组织脂解产生游离脂肪酸给身体供能,抑制脂解会降低游离脂肪酸水平。
文献[2]中,研究者向老鼠注入脂解抑制剂(烟酸、胰岛素或SDZ WAG 944)降低了游离脂肪酸水平,结果发现,1小时内皮质酮、ACTH升高;当重新输入脂质乳剂至基础水平后,ACTH和皮质酮均下降,但未完全恢复。作者提到:
脂肪乳内主要由植物来源的必需脂肪酸(亚油酸和亚麻酸)组成,而大鼠血浆中则主要包含非必需脂肪酸,例如棕榈酸和油酸。因此,当将总游离脂肪酸水平维持在基础水平时,非必需脂肪酸的血浆水平可能仍显着低于其基础水平。

文献[3]中,6名年轻女性接受脂肪乳输注后,ACTH和皮质醇显著降低;当脂肪乳输注结束后,ACTH和皮质醇升高至原有水平。

但文献[4]观察到脂肪乳输注会提高大鼠的皮质酮,这表明不同的脂肪酸可能具有不同的影响。
不同脂肪酸对压力激素的影响
不饱和脂肪酸直接促进压力激素释放,饱和脂肪酸抑制压力激素释放。
文献[5]中,研究者先用烟酸降低大鼠的游离脂肪酸水平,使血浆ACTH和皮质酮升高,然后输注含有不同脂肪酸种类的脂肪乳。结果发现椰子油(而非橄榄油或红花油)完全阻止了压力激素的释放;进一步,研究者发现椰子油中的棕榈酸与抑制压力激素有关。

文献[6]研究了不同脂肪酸对CRH刺激的ACTH释放的影响,结果发现:
- 饱和脂肪酸(丁酸、辛酸、月桂酸、棕榈酸、硬脂酸)抑制了ACTH的基础释放,并显著抑制了CRH刺激的ACTH的释放,其中辛酸剂量依赖地抑制了ACTH释放;
- 不饱和脂肪酸(油酸、亚麻酸、亚油酸、花生四烯酸)均增加了ACTH的基础释放,并增强了CRH刺激的ACTH的释放,其中花生四烯酸显著提高了ACTH的释放。

文献[7]观察到油酸与亚油酸(而非硬脂酸或辛酸)均刺激了大鼠肾上腺皮质细胞的皮质酮合成,且持续90分钟;仅油酸刺激的皮质酮最大可达到仅ACTH刺激的皮质酮的50%。

地塞米松是一种人工合成的皮质类固醇,可结合糖皮质激素受体,模拟压力激素的作用。文献[8]观察到花生四烯酸、DHA以剂量依赖性方式将地塞米松诱导的转录增强1.4-2.3倍,这表明这种两种不饱和脂肪酸与地塞米松具有协同作用。
因此,除了游离脂肪酸浓度,游离脂肪酸中的不饱和脂肪酸与饱和脂肪酸之比(U/S)也影响压力激素的释放。
由于外部压力本身会促进脂解,因此如果脂解的不饱和脂肪酸浓度过高,则容易形成一种“压力-脂解-压力”的恶性循环。
亚油酸衍生物促进压力激素释放
不饱和脂肪酸导致的脂质过氧化也会促进压力激素释放。EKODE是一种亚油酸的过氧化衍生物。老鼠位于肾上腺的束状带细胞受ACTH刺激分泌皮质酮。文献[9][10]均观察到EKODE对皮质酮分泌的刺激作用。
在文献[9]体外的实验中,在没有ACTH的情况下,EKODE使束状带细胞皮质酮产生增加至3倍,在ACTH存在的情况下,则使ACTH对束状带细胞的刺激增加至3倍。

咖啡和运动对压力激素的影响
对于健康人群来说,咖啡因会提高游离脂肪酸和皮质醇,但含咖啡因的咖啡会提高游离脂肪酸却降低皮质醇。
文献[11]的双盲交叉试验比较了不同咖啡对健康受试者的皮质醇的影响,结果发现咖啡餐后受试者的唾液皮质醇均显著降低。

文献[12]研究了咖啡和运动对健康受试者的影响,结果发现咖啡组、运动组、咖啡加运动组的游离脂肪酸均提高,且运动组提高幅度最大;与咖啡组相比,运动组、咖啡加运动组的U/S比均显著提高。
喝咖啡后U/S呈下降趋势,且咖啡提高了游离脂肪酸,这可能是咖啡缓解皮质醇的机制之一。
运动显著升高了U/S比,短期内不利于缓解压力;从另一个角度看,运动促进不饱和脂肪酸的氧化,减少了组织中的不饱和脂肪酸,因此长期来看可降低U/S比。

文献[13]发现,与餐后休息相比,餐后有氧运动增加了总游离脂肪酸与U/S比;文献[14]发现4周的有氧运动干预使受试者唾液皮质醇提高120%。

饮食中的饱和脂肪酸对游离脂肪酸的影响
饮食中的饱和脂肪酸促进脂解并维持较高的游离饱和脂肪酸,碳链越长的饱和脂肪酸促进脂解程度越大。
文献[15]中,受试者被分为2组,分别接受饱和脂肪酸为主和不饱和脂肪酸为主的脂肪乳输注,每30分钟注一次,共注6次。结果发现与不饱和脂肪组相比,饱和脂肪组如预期提高了游离脂肪酸的释放;根据测得的游离脂肪酸成份,整理出U/S比后可发现,饱和脂肪酸组的U/S比总是低于不饱和脂肪酸组,且呈下降趋势,这表明摄入饱和脂肪酸后,血液中的饱和脂肪酸对压力激素的抑制作用超过不饱和脂肪酸对压力激素的促进作用。
同时,随着饮食中的饱和脂肪酸的摄入,脂肪组织中的不饱和脂肪酸被替代,长期干预可能会降低脂肪组织内不饱和脂肪酸,从而降低血清中的不饱和游离脂肪酸。

文献[16]中,受试者接受不同油脂的大餐,结果发现,富含饱和脂肪的黄油组在8小时后依然维持高水平的游离脂肪酸,这表明饮食中的饱和脂肪酸可维持较长的压力抑制时间。

文献[17]比较了富含饱和脂肪酸或多不饱和脂肪酸的饮食对超重者的代谢差异,尽管文章提到“血清皮质醇没有差异”,但可从下面整理出的表格中看到差异。
| 饱和脂肪组 | 单不饱和脂肪组 | 多不饱和脂肪组 | 对照组 | |
|---|---|---|---|---|
| 摄入前 | 347.5 | 364.5 | 337.4 | 330.4 |
| 摄入后24小时 | 328.6 | 363.5 | 374.3 | 334.1 |
| 差异 | -18.9 | -1 | +37.9 | +3.7 |
饮食中的多不饱和脂肪酸对游离脂肪酸成分的影响
文献[18]的3组实验研究了不同饮食模式对卷尾猴血清脂肪酸成分的影响:
- 2组卷尾猴接受含15%玉米油和45%玉米油的饮食8个月,之后切换为无脂饮食;
- 6只卷尾猴先接受7-10个月的无脂饮食。之后摄入一次含有45%玉米油的饮食,之后再接受无脂饮食;
- 4只卷尾猴先接受7-10个月的含45%椰子油的饮食,之后摄入一次含有45%玉米油的饮食,之后恢复椰子油饮食。
结果发现,在一次富含多不饱和脂肪酸的大餐后,血清多不饱和脂肪酸先升高,之后下降,但会维持比初始水平高的状态。

饮食中的碳水比例对游离脂肪酸的影响
饮食中的碳水比例越高,游离脂肪酸越低。文献[19]中,3组受试者分别采用20%碳水、40%碳水、60%碳水的饮食,并保证饮食期间体重下降2公斤。结果发现随着碳水比例的增多,空腹和餐后游离脂肪酸均显著下降。
文献[20]的交叉实验中,在随意摄入的情况下,采用10%碳水饮食的受试者的空腹和餐后游离脂肪酸高于采用90%碳水饮食的受试者。

因此,在采用以饱和脂肪为主的低碳水饮食的情况下,可维持高水平的游离脂肪酸和低水平的U/S比。
酮症促进压力激素释放
文献[21]的动物实验中,两组大鼠分别采用含有90%脂肪的生酮饮食(F3666饲料)和含60%碳水的对照饮食,结果发现生酮饮食组的清晨皮质酮快达到对照组的2倍;在压力环境下,生酮饮食组表现出更显著的皮质酮反应。

接下来,为了验证生酮饮食上调皮质酮是否是酮症的作用,在另一组实验中,研究者分别向三组大鼠喂食中链甘油三酯(MCT)、玉米油(LCT)和水,其中MCT可诱导急性酮症(约1.7mM)。结果发现,MCT组的ACTH和皮质酮均高于其他组,且随着酮症的增加,ACTH和皮质酮线性增加。

文献[22]中对断奶后北象海豹的研究显示,随着禁食天数的增加,皮质醇线性增加。

文献[23]比较了不同比例碳水对减重期间指标的影响,结果发现,采用10%碳水饮食组的尿皮质醇高于采用40%和60%碳水的另外两组,酮体浓度升高可能是皮质醇升高的原因之一。
文献[24]中,8名健康受试者接受等卡路里的生酮饮食(5%碳水,50%脂肪)或对照饮食,结果显示与对照饮食相比,生酮饮食干预后,静息时的BOHB酮体浓度达到2mM,且皮质醇也更高。
文献[25]中,一名超重男性接受连续禁食34天干预。结果显示禁食6天后出现明显酮症,尿酮水平超过1200mg/天;禁食17天后,尿去甲肾上腺素和肾上腺素水平分别增加了2倍和9倍。
文献[26]记录了一名禁食44天男性恢复进食期间的指标变化,结果显示,复食前酮体达到4.92mM,皮质醇达到770nM;复食第3天酮体降至0.81mM,皮质醇也降至390nM。
饮食模式对酮症的影响
急性酮症受MCT影响,而慢性酮症受饮食中的碳水、蛋白质和脂肪酸饱和度影响。
当饮食中的碳水或蛋白质较高时,由于草酰乙酸充足,肝脏的生酮作用受到抑制,身体难以进入酮症;当饮食中的碳水化合物和蛋白质较低时,脂肪酸饱和度是酮体浓度的主要决定因素,酮体由脂肪酸产生,碳链越短、双键越多的脂肪酸的生酮作用越快。
不饱和脂肪酸比饱和脂肪酸更容易生酮;n-3不饱和脂肪酸比n-6不饱和脂肪酸更容易生酮。
文献[27]中,两组受试者分别采用饱和脂肪为主或多不饱和脂肪为主的生酮饮食(持续5天),结果发现多不饱和脂肪组产生的酮体是饱和脂肪组的2倍。

文献[28]对几种常见脂肪酸的生酮能力进行排序:亚麻酸>亚油酸>油酸>棕榈酸>硬脂酸。
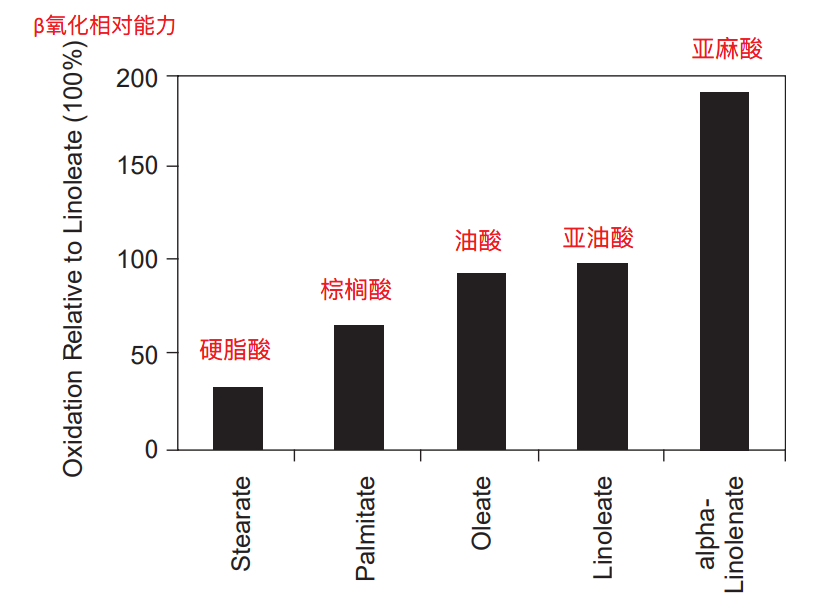
文献[29]分别采用棕榈油、红花油、紫苏油(富含亚麻酸)和鱼油(富含EPA、DHA)对老鼠进行喂养(脂肪占总卡路里的15%),结果发现与饱和脂肪酸或n-6相比,n-3显著上调了肝脂肪酸氧化水平,特别是鱼油组,其肝细胞的CPT1活性比棕榈油组高61%。
因此,当采用以不饱和脂肪酸为主的低碳水饮食时,可能会促进酮症并导致压力激素释放。
皮质醇的负反馈
11β-HSD2主要在富含盐皮质受体的肾脏、结肠、唾液和汗腺表达,负责将皮质醇转化为失活的可的松;11β-HSD1主要在富含糖皮质受体的肝脏、脂肪和神经系统表达,负责将可的松转化为有活性的皮质醇。
HPA轴分泌的皮质醇和由可的松经过11β-HSD1转化的皮质醇均可向HPA轴发送负反馈信号,从而抑制皮质醇继续释放。
另外,5α-还原酶和5β-还原酶将皮质醇转化为失活的5α-四氢皮质醇和5α-四氢可的松。
文献[30]观察到肥胖与代谢综合征人群中的脂肪组织的11β-HSD1过度表达,但肝的11β-HSD1表达降低。
当肝11β-HSD1被抑制或5α-还原酶和5β-还原酶被活化时,皮质醇被大量回收,同时被可的松转化的皮质醇降低,无法向HPA轴发送负反馈信号[31],导致皮质醇过多分泌,这与过多的能量摄入有关。

高脂饮食对皮质醇的影响
文献[32]研究了随意摄入的高脂饮食(66%脂肪,4%碳水)与中脂饮食(35%脂肪,35%碳水)对肥胖受试者的影响,结果发现与老鼠相反,人类采用随意摄入的中高脂饮食反而减少了总能量摄入,同时高脂饮食与中脂饮食皮质醇无差异。
在老鼠中,中高脂饮食导致肝11β-HSD1被抑制,脂肪组织11β-HSD1被上调[33][34],使HPA轴负反馈失调;而在人类实验中,肥胖受试者的肝11β-HSD1被活化,过高的5α-还原酶和5β-还原酶被抑制,这表明采用高脂饮食对人类的皮质醇代谢有积极作用。

总结
- 抑制游离脂肪酸促进压力激素;
- 饱和脂肪酸抑制压力激素,不饱和脂肪酸及其衍生物促进压力激素;
- 咖啡可能通过提高游离脂肪酸和降低U/S比抑制压力激素;
- 运动可能通过提高U/S比促进压力激素;
- 降低饮食中的多不饱和脂肪酸有助于降低U/S比,从而可能抑制压力激素;
- 酮症促进压力激素,而采用MCT、以不饱和脂肪酸为主的低碳水饮食可促进酮症;
- 高脂饮食在老鼠中使压力激素代谢失调,而在人类中促进压力激素正常代谢。
参考
- ^Bowden SA, Connolly AM, Kinnett K, Zeitler PS. Management of Adrenal Insufficiency Risk After Long-term Systemic Glucocorticoid Therapy in Duchenne Muscular Dystrophy: Clinical Practice Recommendations. J Neuromuscul Dis. 2019;6(1):31-41. doi:10.3233/JND-180346
- ^Oh YT, Oh KS, Kang I, Youn JH. A Fall in plasma free fatty acid (FFA) level activates the hypothalamic-pituitary-adrenal axis independent of plasma glucose: evidence for brain sensing of circulating FFA. Endocrinology. 2012 Aug;153(8):3587-92. doi: 10.1210/en.2012-1330. Epub 2012 Jun 5. PMID: 22669895; PMCID: PMC3404348.
- ^Lanfranco F, Giordano R, Pellegrino M, Gianotti L, Ramunni J, Picu A, Baldi M, Ghigo E, Arvat E. Free fatty acids exert an inhibitory effect on adrenocorticotropin and cortisol secretion in humans. J Clin Endocrinol Metab. 2004 Mar;89(3):1385-90. doi: 10.1210/jc.2004-031132. PMID: 15001638.
- ^Widmaier EP, Rosen K, Abbott B. Free fatty acids activate the hypothalamic-pituitary-adrenocortical axis in rats. Endocrinology. 1992 Nov;131(5):2313-8. doi: 10.1210/endo.131.5.1330498. PMID: 1330498.
- ^Oh YT, Kim J, Kang I, Youn JH. Regulation of hypothalamic-pituitary-adrenal axis by circulating free fatty acids in male Wistar rats: role of individual free fatty acids. Endocrinology. 2014;155(3):923-931. doi:10.1210/en.2013-1700
- ^Katoh K, Asari M, Ishiwata H, Sasaki Y, Obara Y. Saturated fatty acids suppress adrenocorticotropic hormone (ACTH) release from rat anterior pituitary cells in vitro. Comp Biochem Physiol A Mol Integr Physiol. 2004 Feb;137(2):357-64. doi: 10.1016/j.cbpb.2003.10.011. PMID: 15123208.
- ^Sarel I, Widmaier EP. Stimulation of steroidogenesis in cultured rat adrenocortical cells by unsaturated fatty acids. Am J Physiol. 1995 Jun;268(6 Pt 2):R1484-90. doi: 10.1152/ajpregu.1995.268.6.R1484. PMID: 7611525.
- ^Vallette, G., Sumida, C., Thobie, N., & Nunez, E. A. (1995). Unsaturated fatty acids synergistically enhance glucocorticoid-induced gene expression. Cellular Signalling, 7(4), 319–323. doi:10.1016/0898-6568(95)00010-m
- ^abBruder ED, Ball DL, Goodfriend TL, Raff H. An oxidized metabolite of linoleic acid stimulates corticosterone production by rat adrenal cells. Am J Physiol Regul Integr Comp Physiol. 2003 Jun;284(6):R1631-5. doi: 10.1152/ajpregu.00753.2002. Epub 2003 Apr 10. PMID: 12689852.
- ^Goodfriend TL, Ball DL, Raff H, Bruder ED, Gardner HW, Spiteller G. Oxidized products of linoleic acid stimulate adrenal steroidogenesis. Endocr Res. 2002 Nov;28(4):325-30. doi: 10.1081/erc-120016804. PMID: 12530633.
- ^Papakonstantinou E, Kechribari I, Sotirakoglou Κ, et al. Acute effects of coffee consumption on self-reported gastrointestinal symptoms, blood pressure and stress indices in healthy individuals. Nutr J. 2016;15:26. Published 2016 Mar 15. doi:10.1186/s12937-016-0146-0
- ^Mougios, V., Ring, S., Petridou, A., & Nikolaidis, M. G. (2003). Duration of coffee- and exercise-induced changes in the fatty acid profile of human serum. Journal of Applied Physiology, 94(2), 476–484. doi:10.1152/japplphysiol.00624.2002
- ^Kokalas, N., Petridou, A., Nikolaidis, M., & Mougios, V. (2005). Effect of aerobic exercise on lipaemia and its fatty acid profile after a meal of moderate fat content in eumenorrhoeic women. British Journal of Nutrition, 94(5), 698-704. doi:10.1079/BJN20051530
- ^Alghadir AH, Gabr SA, Aly FA. The effects of four weeks aerobic training on saliva cortisol and testosterone in young healthy persons. J Phys Ther Sci. 2015;27(7):2029-2033. doi:10.1589/jpts.27.2029
- ^Bradley N S, Heigenhauser G J F, Roy B D, et al. The acute effects of differential dietary fatty acids on human skeletal muscle pyruvate dehydrogenase activity[J]. Journal of applied physiology, 2008, 104(1): 1-9.
- ^López S, Bermúdez B, Pacheco YM, Villar J, Abia R, Muriana FJ. Distinctive postprandial modulation of beta cell function and insulin sensitivity by dietary fats: monounsaturated compared with saturated fatty acids. Am J Clin Nutr. 2008 Sep;88(3):638-44. doi: 10.1093/ajcn/88.3.638. PMID: 18779278.
- ^Xiao, C., Giacca, A., Carpentier, A., & Lewis, G. F. (2006). Differential effects of monounsaturated, polyunsaturated and saturated fat ingestion on glucose-stimulated insulin secretion, sensitivity and clearance in overweight and obese, non-diabetic humans. Diabetologia, 49(6), 1371–1379. doi:10.1007/s00125-006-0211-x
- ^Portman O W, Hayashida T, Bruno D. Repletion and depletion of polyunsaturated fatty acids in cebus monkeys[J]. The Journal of nutrition, 1959, 69(3): 245-252.
- ^Shimy KJ, Feldman HA, Klein GL, Bielak L, Ebbeling CB, Ludwig DS. Effects of Dietary Carbohydrate Content on Circulating Metabolic Fuel Availability in the Postprandial State. J Endocr Soc. 2020;4(7):bvaa062. Published 2020 May 26. doi:10.1210/jendso/bvaa062
- ^Hall, K.D., Guo, J., Courville, A.B. et al. Effect of a plant-based, low-fat diet versus an animal-based, ketogenic diet on ad libitum energy intake. Nat Med 27, 344–353 (2021). https://doi.org/10.1038/s41591-020-01209-1
- ^Ryan KK, Packard AEB, Larson KR, et al. Dietary Manipulations That Induce Ketosis Activate the HPA Axis in Male Rats and Mice: A Potential Role for Fibroblast Growth Factor-21. Endocrinology. 2018;159(1):400-413. doi:10.1210/en.2017-00486
- ^Ortiz R M, Wade C E, Ortiz C L. Effects of prolonged fasting on plasma cortisol and TH in postweaned northern elephant seal pups[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2001, 280(3): R790-R795.
- ^Ebbeling CB, Swain JF, Feldman HA, et al. Effects of Dietary Composition on Energy Expenditure During Weight-Loss Maintenance. JAMA. 2012;307(24):2627–2634. doi:10.1001/jama.2012.6607
- ^Langfort J, Pilis W, Zarzeczny R, Nazar K, Kaciuba-Uściłko H. Effect of low-carbohydrate-ketogenic diet on metabolic and hormonal responses to graded exercise in men. J Physiol Pharmacol. 1996 Jun;47(2):361-71. PMID: 8807563.
- ^Garruti G, De Pergola G, Cignarelli M, Marangelli V, Santoro G, Triggiani V, Ciampolillo A, Giorgino R. 34-day total fast in an adult man. Int J Obes Relat Metab Disord. 1995 Jan;19(1):46-9. PMID: 7719390.
- ^Korbonits M, Blaine D, Elia M, et al. Metabolic and hormonal changes during the refeeding period of prolonged fasting[J]. European journal of endocrinology, 2007, 157(2): 157-166.
- ^Fuehrlein BS, Rutenberg MS, Silver JN, Warren MW, Theriaque DW, Duncan GE, Stacpoole PW, Brantly ML. Differential metabolic effects of saturated versus polyunsaturated fats in ketogenic diets. J Clin Endocrinol Metab. 2004 Apr;89(4):1641-5. doi: 10.1210/jc.2003-031796. PMID: 15070924.
- ^Cunnane SC. Metabolism of polyunsaturated fatty acids and ketogenesis: an emerging connection. Prostaglandins Leukot Essent Fatty Acids. 2004 Mar;70(3):237-41. doi: 10.1016/j.plefa.2003.11.002. PMID: 14769482.
- ^Ide, T., Kobayashi, H., Ashakumary, L., Rouyer, I. A., Takahashi, Y., Aoyama, T., … Mizugaki, M. (2000). Comparative effects of perilla and fish oils on the activity and gene expression of fatty acid oxidation enzymes in rat liver. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 1485(1), 23–35. doi:10.1016/s1388-1981(00)00026-3
- ^Espíndola-Antunes D, Kater C E. Adipose tissue expression of 11beta-hydroxysteroid dehydrogenase type 1 in Cushing's syndrome and in obesity[J]. Arquivos Brasileiros de Endocrinologia & Metabologia, 2007, 51(8): 1397-1403.
- ^Harno E, White A. Will treating diabetes with 11β-HSD1 inhibitors affect the HPA axis?[J]. Trends in Endocrinology & Metabolism, 2010, 21(10): 619-627.
- ^Stimson RH, Johnstone AM, Homer NZ, Wake DJ, Morton NM, Andrew R, Lobley GE, Walker BR. Dietary macronutrient content alters cortisol metabolism independently of body weight changes in obese men. J Clin Endocrinol Metab. 2007 Nov;92(11):4480-4. doi: 10.1210/jc.2007-0692. Epub 2007 Sep 4. PMID: 17785367.
- ^Morton NM, Ramage L, Seckl JR. Down-regulation of adipose 11beta-hydroxysteroid dehydrogenase type 1 by high-fat feeding in mice: a potential adaptive mechanism counteracting metabolic disease. Endocrinology. 2004 Jun;145(6):2707-12. doi: 10.1210/en.2003-1674. Epub 2004 Mar 25. PMID: 15044372.
- ^Drake AJ, Livingstone DE, Andrew R, Seckl JR, Morton NM, Walker BR. Reduced adipose glucocorticoid reactivation and increased hepatic glucocorticoid clearance as an early adaptation to high-fat feeding in Wistar rats. Endocrinology. 2005 Feb;146(2):913-9. doi: 10.1210/en.2004-1063. Epub 2004 Nov 18. PMID: 15550507.
