黏膜免疫学(1)


粘膜免疫系统的结构
译自; Reinhard Pabst and Per Brandtzaeg: Chapter 1,Overview of the mucosal immune system structure. In Principles of Mucosal immunology,D.Smith et al,Society for Mucosal Immunology,2nd, CRC Press
译者的话
与新冠病毒的全球战争已持续三年,人类在一场场战役和一个个战斗中,付出了巨大牺牲。在这全方位的、与时间赛跑的战争面前。一位老医务人员,对免疫学痴迷了大半辈子的临床试验室工作者怎能袖手旁观?
全世界曾将本次疫情的终结寄希望于新冠疫苗。当我们看到,基本完成疫苗全程甚至加强肌注的群体、地区乃至国家,仍都未能幸免之时,我们不得不反思到目前为止的预防免疫策略。我们还需要学习,不断地学习,批判地学习,向疫情学习,向同行学习,从书本里学习,在实践中学习。人类就是这样一种不断学习的动物!
今天,黏膜免疫学被推到了风口浪尖,人们一口气涌向这个主题;在学习中越觉得知之甚少,越发感到希望之门将被打开!或许,随着对黏膜免疫认识的深入,我们终将战胜新冠疫情!
这是与病毒的生死斗争,不仅有恶战,也有分秒必争的急行军。这篇译作就是用极短的时间匆忙赶出来的。当然,也是对这个主题的系列学习的开始,我会不断在这个公众号上分享原始译作,也会在这些艰苦工作的基础上,发表科普文字。由于专业性太强,自己对有些内容或许理解不到位,甚至有错,请将它们看做一些抛出砸向新冠病毒的砖头吧。
本文没有获得原著作者的授权,这些文字仅作为学习交流的资料。我们每次阅读(包括我在翻译)时,应当对两位作者Reinhard Pabst 博士和已故的Per Brandtzaeg教授表示极大的尊敬和感谢,也向总编们和黏膜免疫学会表示感谢。
汪子伟于杭州青园
2022.5.22
20世纪60年代初的开创性实验表明,大的淋巴细胞(淋巴母细胞)从胸导管进入血液,迁移到肠道固有层,并最终分化为浆母细胞和浆细胞。许多循环中的淋巴母细胞表达表面IgA (sIgA),而肠道含有细胞质IgA。这些淋巴样细胞被认为主要来自派尔集合淋巴结( Peyer’s patche,PP),因为转移研究表明,与周围淋巴结和脾脏相比,PP和引流肠系膜淋巴结(MLN)是肠黏膜中产生IgA浆细胞前体的丰富来源。浆细胞分化也发生在粘膜B细胞的播散过程中。因此,具有胞浆IgA的细胞比例从最初在PP中的2%增加到在MLN中的50%,在胸导管淋巴中的75%,最后在肠道固有层中增加到90%。
这些开创性的研究引出了术语“IgA细胞循环(IgA cell cycle)”,随后的研究表明,携带IgA以外的其他sIg类的B细胞,以及T细胞,当在PP中被激活时,也表现出寻找肠道的特性。后来发现,不同的分泌效应者位点都可以从多种黏膜相关淋巴组织(MALT)接收激活的记忆/效应B细胞。
这项工作引起了一个概念,即粘膜免疫系统分为不同的诱导位点和效应者位点。诱导位点是有组织的MALT结构和粘膜引流淋巴结,而效应者位点则是黏膜上皮和底层固有层,其中包含基质细胞和相关的结缔组织基质。粘膜和相关外分泌腺拥有迄今为止最大的被激活的B细胞系统,主要产物(包含J链的二聚体IgA和一些五聚体IgM)立即被多聚体免疫球蛋白受体 (pIgR)向外转运,经过分泌上皮细胞进入粘膜表面的粘液层,提供抗体介导的免疫(见第9章)。
一、免疫诱导淋巴组织
引入MALT的概念是为了强调单独有组织的黏膜相关淋巴滤泡和较大的滤泡聚集有共同的特征,是运输到分泌效应者位点的T细胞和B细胞源头。这种功能上的区别很重要,因为虽然不同的组织可以通过组织学来识别和区分,但从粘膜表面制备的单细胞悬液包含了来自无法分离的小MALT结构和结缔组织的混合细胞。 这在人类中尤其是个问题,因为切除的肠组织看不到孤立的滤泡。
1.1黏膜相关淋巴组织不同于(黏膜)固有层(lamina propria)或腺体基质(glandular
stroma)
MALT根据解剖区域进行细分(表1.1),这些淋巴样结构的细胞含量取决于组织是正常的还是慢性炎症,叠加在显著的年龄和物种差异上(图1.1)。人类、啮齿动物和兔子远端小肠的PP是典型的MALT结构。PP是诱导部位,产生表达(B-2)sIgA的传统记忆/效应B细胞和T细胞,这些细胞通过淋巴和外周血进入肠黏膜。这种“归巢(homing)”似乎与抗原无关,但局部抗原渗透到固有层,促进了渗出的淋巴样细胞的局部滞留、增殖和分化。因此,尽管黏膜固有层被认为是一个效应者部位,它显然对T细胞和B细胞的扩张和终末分化很重要。粘膜表面上皮中也可能出现一些粘膜记忆/效应T细胞的扩张,这两个效应者分隔位点间存在相当大的“串音(cross talk)”。
人类MALT的主要成分包括肠道相关的淋巴组织(GALT),包括PP、阑尾和许多孤立的滤泡(见图1.1),现在被称为“孤立的淋巴组织(solitary isolated lymphoid Tissue,SILT)” (Herbrand等,2008)。粘膜免疫反应的诱导也可发生在鼻咽相关淋巴组织(NALT)、扁桃体(咽部、腭部、舌部、咽部)和支气管相关淋巴组织(BALT)中。此外,小MALT样淋巴聚集存在于结膜中,并与喉部和各种导管(如连接眼和鼻室的导管)相关。
MALT类似于B细胞滤泡的淋巴结、滤泡间T细胞区和多种抗原提呈细胞(APC),但缺乏输入淋巴管和包膜。因此,MALT通过滤泡相关上皮(FAE)直接从粘膜表面提取外源性抗原,FAE包含M(为“membrane” 或 “microfold”第一个字母,分别有“膜”或“微褶”之意)细胞(见第13章)。这些特化的薄上皮细胞不作为APC,但在吸收微生物和其他颗粒抗原方面有效; 它们也是粘膜屏障中脆弱的“缝隙”。 此外,对小鼠的研究表明,在MALT圆顶区域(dome region)的树突状细胞(DC)发送加工经FAE提取的肠道抗原。
| 表1.1不同区域的MALT及其组成 | |
|---|---|
| 区域 | 组成 |
| GALT(肠道相关淋巴组织) | 派尔集合淋巴结和孤立的淋巴样滤泡是GALT的主要组成部分,但阑尾也包括在内。 |
| NALT(鼻咽相关淋巴组织)和扁桃体 | 啮齿动物没有扁桃体,但在鼻腔底部背侧有配对的NALT结构。 |
| 人类的扁桃体由淋巴组织组成瓦尔代尔扁桃体环,包括腺样体(未配对的鼻咽扁桃体)和成对的腭扁桃体。散在分离的淋巴样滤泡也可出现在鼻黏膜(NALT)。 | |
| BALT(支气管相关淋巴组织) | 在成年人的正常肺中一般检测不到。 |
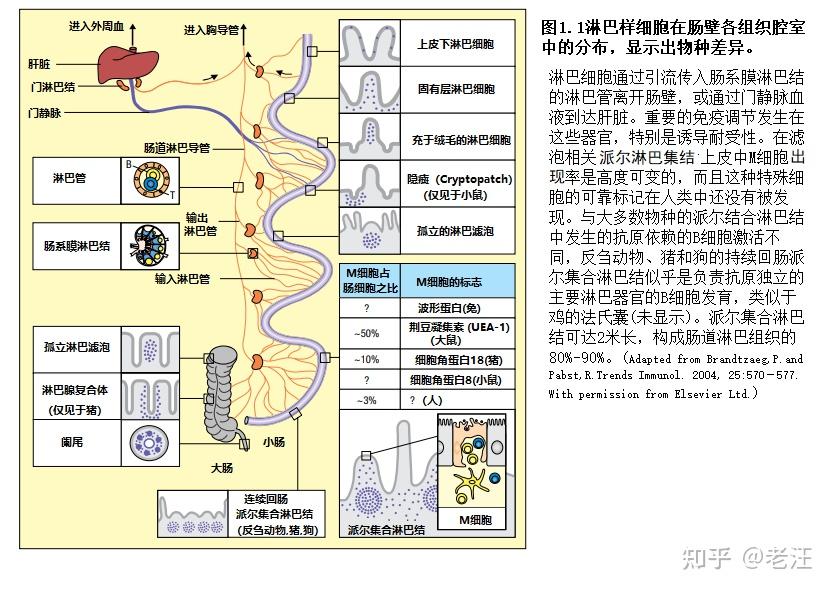
黏膜诱导部位和效应者部位之间的区别不是绝对的,因为处女B细胞与记忆/效应B细胞和T细胞外溢和积累的信号是不同的。因此,当用MALT来指粘膜效应部位(例如,固有层和肠道表面上皮及其弥漫性分布的免疫细胞,图1.2)时,人们会感到困惑。这与淋巴组织的经典定义相冲突,粘膜免疫学会和国际免疫学会联合会已就所列术语达成一致,见表1.1。因此,粘膜引流的局部/区域淋巴结不应该被称为MALT,因为它们不直接从粘膜表面提取抗原。因此,虽然MLN是肠道免疫系统的一部分,但不应被认为是GALT的一部分。同样,将头颈引流颈部淋巴结作为上呼吸道免疫系统的一部分是合适的,但这些不是MALT。最后,由于在不同的MALT位点上标记了多种归巢分子,所以应该避免使用“共同的黏膜免疫系统”的旧术语,尽管激活的淋巴样细胞迁移到不同的效应者位点确实发生了一些整合。因此,我们更倾向于使用“整合黏膜免疫系统”这个术语。健康志愿者口腔感染大肠杆菌后,唾液和颌下腺分泌物中出现特异性IgA抗体是一个很好的例子(Aase等人,2016)。

1.2黏膜免疫系统包含不同类型的肠道相关淋巴组织
在人类和啮齿动物中,PP主要发生在回肠,空肠较少。根据Cornes在20世纪60年代提出的最初定义,PP由至少5个聚集的淋巴样滤泡组成,但可以包含多达200个(图1.3)。人类PP在妊娠11周开始形成,孤立的T细胞和B细胞区在19周出现;但是直到出生后不久才出现生发中心,这反映了对外源性刺激的依赖——这一过程也会诱导滤泡增生。因此,宏观上可见妊娠PP从最后三个月开始的大约50上升到出生时为100,青少年时期为250,老年时减少到100左右。略多于50%的人类PP发生在回肠。
在小鼠的盲肠里有一个集合淋巴结(patch)。这似乎是在结肠中形成产生IgA的前体,而在小肠中PP更多用于向小肠输出IgA前体。老鼠的盲肠集合淋巴结可能相当于其他物种的阑尾。
人小肠粘膜可至少有30,000个孤立淋巴样滤泡,其密度远端增加。 因此,据报道,正常小肠在空肠的269根绒毛中平均只有1个滤泡,而在回肠的28根绒毛中平均就有1个滤泡。 在正常的大肠中,淋巴样滤泡的密度远端也增加。孤立淋巴组织(SILT)已经在小鼠中进行了免疫鉴定,并显示出与B细胞诱导肠道IgA反应兼容的特征。
有趣的是,与PP不同,小鼠孤立淋巴样滤泡在出生后就开始形成器官。孤立淋巴组织实际上可能在诱导分泌型IgA (SIgA)反应中发挥特殊作用,控制共生菌群,其数量和大小取决于肠道细菌水平。这些结构可以以T细胞独立的方式发挥作用,并不能完全弥补T细胞依赖抗体反应中PP的缺失。孤立淋巴组织可能确实反映了古老的先天免疫系统和现代适应性免疫系统之间的桥梁。SILT在很大程度上依赖于肠腔内的微生物群。在固有层中,巨噬细胞具有巨大的异质性,并受到肠腔内微生物群的很大影响。Bain等人(2014)通过异种共生结合现代分子生物学技术的实验证明,断奶后,血液中的单核细胞不断补充小鼠固有层中的巨噬细胞。最近,先天淋巴样细胞(ILC)被证实存在于固有层和肠道上皮中,并被细分为不同的亚群。这些细胞很难定位,因为这些细胞主要具有调节作用,例如,响应IL-12、IL-15产生γ-干扰素等(Fuchs等人, 2013)。有时自然杀伤细胞(NK)也包括在这组免疫细胞中。
1.3 小鼠派尔集合淋巴结、孤立淋巴样滤泡和鼻咽相关淋巴样组织的器官形成不是同步的
基因敲除小鼠的实验在很大程度上有助于理解诱导淋巴组织是如何发展的,并且在位点之间存在显著差异。PP和MLN的胎儿器官发生依赖于造血淋巴组织诱导(LTi)细胞和间充质基质细胞之间的多重相互作用。LTi细胞的发育需要两种转录因子:抑制性碱性螺旋-环-螺旋转录因子(Id2)和视黄酸相关孤核受体(RORγt)。
细胞相互作用包括淋巴毒素(LT),它是肿瘤坏死因子(TNF)超家族成员,以及两个TNF受体(TNF- R) I和II(55和75 kDa)。核因子(NF)受体激活因子κB(RANK)-TNF受体相关因子家族6 (TRAF6)通路刺激后,特别是在PP中,可通过白细胞介素-7受体传递替代细胞因子信号(IL-7R),CD3−CD4+CD45+IL-7R+ LTi细胞上LTα1β2的膜表达是一个关键的分化事件。随后是LTi细胞与LTi β受体的相互作用(LTβR)-阳性基质细胞,血管细胞粘附分子(VCAM)-1阳性,被称为淋巴组织组织者细胞,但在淋巴结和PPs的器官发生中显示不同的激活谱。敲除小鼠缺乏LTα或LTβ几乎缺乏淋巴结,没有检测到的PPs。器官的发育也涉及到一些与趋化因子和粘附分子有关的反馈环,如CXC趋化因子配体13 (CXCL13) - CXCR5和CXCR5诱导的α4β1整合素-VCAM-1相互作用。
妊娠15天,VCAM-1+基质细胞在胎鼠小肠内积累。17.5 d时,出现了LTi细胞,血管上表达了黏膜地址素细胞粘附分子-1 (MAdCAM-1)。T细胞和B细胞从18.5天开始移入PPs,形成T细胞区和B细胞区。PP和MLN(按未知的机制)在胎儿的无菌环境中发育。 相反,小鼠分离的淋巴样滤泡仅在出生后发育,以响应来自肠道微生物群的固有信号,但它们仍然需要LTα1β2-LTβR相互作用和TNF-RI功能,以及典型的LTi细胞。 此外,CXCL13已被证明通过促进LTi细胞的积累对孤立的淋巴样滤泡的形成很重要。
有趣的是,淋巴组织在小鼠鼻黏膜中出现的动力学是不同的,因为发育完全是在出生后。
与GALT结构不同,小鼠NALT器官发生不依赖于LTα1β2-LTβR信号通路,尽管NALT抗原显然需要CD3−CD4+CD45+细胞和转录因子Id2的存在。然而,NALT在RORγ t缺乏的小鼠中发生CD3−CD4+IL-7R+ PP-型LTi细胞。然而,要完全发育成具有滤泡树突状细胞(fdc)和最佳功能,小鼠NALT以及诱导小鼠BALT结构依赖于LT-LTβR通路。
与功能相关的详细本体论研究只适用于老鼠和人类,但揭示了巨大的差异。老鼠具有独特的结构,称为“加密集合淋巴结(cryptopatch)”,即c-kit+,谱系阴性的常见淋巴样前体细胞簇。然而,加密集合淋巴结可以成熟成孤立淋巴样滤泡,在那里可以产生初级和次级的适应性黏膜IgA反应。加密集合淋巴结和分离的淋巴样滤泡依赖于LTi细胞,在RORγt缺失小鼠中不存在。在胎儿和无菌小鼠中存在加密集合淋巴结,但未分离出淋巴滤泡。证据表明,孤立淋巴滤泡的发育需要来自微生物菌群的信号,通过上皮细胞中的核苷酸结合寡聚化域1 (NOD1)来吸引LTi细胞,然后形成淋巴滤泡:因此,从经典免疫学的角度来看,隐癍可能被认为是初级淋巴器官和孤立淋巴样滤泡,其次是淋巴样结构。加密集合淋巴结和孤立淋巴样滤泡似乎形成了一个连续体,但在小鼠中,它们可能更像在兔子中,青春期前,GALT作为主要的淋巴样器官发挥作用,在生命后期成熟为次要器官。
同样的事件是否也会在人类身上发生还很难确定。一种CD127+、RORC+和CD4 -的LTi细胞已经在人类胎儿组织中被描述。人类LTi细胞缺乏CD4有点令人惊讶,因为许多年前人类胎儿肠道显示含有CD4+ CD3 -细胞簇,这被认为是最早的PP抗原。然而,VCAM-1的免疫染色在推测妊娠11周开始的PPs中非常强,这表明即使在人类中,VCAM-1也参与了黏膜淋巴组织器官的形成。从妊娠14-15周开始,人小肠含有松散的T细胞和B细胞,以及强烈的主要组织相容性复合体(MHC) II类+细胞,但黏膜缺乏滤泡结构。通过19周,有组织的带FAE的小PP,可见初级B细胞滤泡和T细胞区。FAE以下的CD11c+ DC簇群,如成人PP所示。尽管很少有关于两者之间发展的信息,如果是20周和出生,对现有标本的分析显示,在1到2天的组织中有组织良好的大型派尔集合淋巴结,在发育的生发中心包含似乎是具有IgM+母细胞的早期继发滤泡,可能是对肠道微生物定植的反应。
加密集合淋巴结在人体内不存在,不应与充满淋巴细胞的绒毛相混淆(见图1.1)。人类孤立的淋巴样滤泡是否具有与小鼠相似的特性尚不清楚。然而,不规则淋巴样聚集物(可能含有滤泡树突状细胞的生发中心)可诱导慢性炎症性肠病病变,尽管这些孤立的淋巴滤泡样结构的功能尚不清楚。然而,不规则淋巴样聚集物(可能含有滤泡树突状细胞的生发中心)可诱导慢性炎症性肠病病变,尽管这些孤立的淋巴滤泡样结构的功能尚不清楚。据推测,结肠中孤立的滤泡也在结肠癌变中发挥作用。
1.4 淋巴样组织存在于鼻、咽和支气管
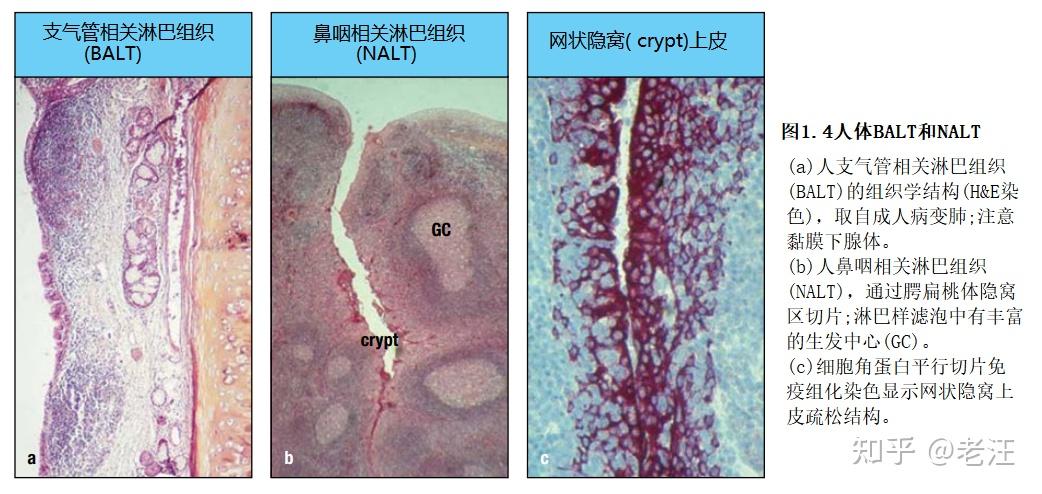
GALT是MALT中最大、定义最明确的部分,但其他潜在重要的黏膜B细胞反应诱导位点包括BALT、NALT和人类的扁桃体,特别是不成对的鼻咽扁桃体(通常称为腺样体)和成对的腭扁桃体。这些结构构成了瓦尔代尔咽部淋巴样环(瓦尔代尔扁桃体环)之大部,在人呼吸道黏膜免疫中可能比BALT发挥更重要的作用(图1.4a),因为后者在成年人的正常肺中很少见,只有在40%~50%的青少年和儿童小支气管活检标本才能检测到,但在大量尸检标本中经常遇到。类似地,人类鼻粘膜仅偶见孤立的淋巴样滤泡,它们在婴儿中很难发现。
啮齿动物没有扁桃体,但有两对钟形的NALT结构,在鼻腔底部的鼻咽管外侧,软骨软腭背侧。小鼠经鼻接种可诱导局部保护性IgA反应。事实上,小鼠的NALT可以驱动IgA特异性富集高亲和力记忆B细胞,但也产生了一个主要的生发中心群体的IgG产生细胞——非常类似于在人类扁桃体中看到的。然而,与扁桃体相反,间叶原基与PP出现在相同的胎龄,鼠NALT的器官发生始于出生后,类似于鼠分离的淋巴样滤泡。小鼠BALT也是诱导的,人类BALT和鼻腔分离的淋巴样滤泡也是诱导的。因此,BALT也被归类为三级淋巴组织和/或与其他物种的扁桃体相比。
与所有哺乳动物物种的GALT一样,啮齿动物NALT有一个光滑的表面,上面覆盖着一个FAE。人类扁桃体有深而分叉的抗原保留隐窝,其中网状上皮含有M细胞(图1.4b和c)。这种差异可能解释了为什么在人的NALT中,生发中心在出生后不久发育,类似于大量微生物暴露的GALT,而缺乏丰富的鼻微生物群意味着啮齿动物的NALT需要感染或危险信号,如霍乱毒素来驱动生发中心的形成。这是一个有趣的物种差异,在通过鼻腔接种诱导B细胞的多样性和记忆中很重要。
1.5可能来自于MALT以外组织的黏膜B细胞
在小鼠中,活化的T细胞在MLN抗原启动过程中迅速获得肠道归巢特性。最有可能的是,区域黏膜引流淋巴结通常与相关的MALT结构共享免疫诱导特性,它们通过传入淋巴和抗原转运DC从MALT结构接收抗原。许多树突状细胞存在于上皮表面,它们可以通过其突起穿透紧密连接而获取腔内抗原(见图1.2)。在小鼠小肠中,CX3CR1+ DC亚群已被证明以这种方式积极提取腔内细菌抗原。重要的是,人类鼻黏膜上皮内和上皮下的树突状细胞极其丰富,表面上皮下有公认为APC的上皮下区带,人类肠道PP的FAE中也有。重要的是,在PP中采集共生细菌的小鼠DC通常不会迁移到引流的MLN之外,从而限制了对清洁无病原体小鼠黏膜免疫系统的抗体反应。这与人类的情况明显不同,人类体内的共生体(commensals)抗体通常是低滴度存在的。
腹膜腔被认为是小鼠粘膜B细胞的另一个来源,可能提供高达50%的肠道IgA+浆细胞。其前体是自我更新的sIgM+ B-1 (CD5+)细胞,可产生不依赖T细胞的多反应性(“天然”)SIgA抗体,特别是针对来自共生细菌的多糖抗原。然而,小鼠B-1细胞与传统骨髓来源的B-2细胞的关系仍然未知。值得注意的是,来自小鼠的B-1细胞在作为选择标志的Ig重链V区(VH)基因可显示高度突变,而不是只在生殖细胞中编码。
IgA浆细胞B-1亚群分化的位置是有争议的,尽管有人建议将小鼠肠道固有层作为类转换的位置。然而,值得注意的是,没有证据表明腹膜B-1细胞有助于人体黏膜IgA的产生。但是在人的外分泌液中存在大量针对自身和微生物抗原的交叉反应性SIgA抗体(见第9章)。原因可能是在GALT中,微生物多克隆激活了B细胞,而不依赖于B细胞受体(BCR)介导的抗原识别。在人体内,产生IgA的浆细胞(CD45−)在小肠内可存活数十年。
二、B细胞在MALT中的活化
MALT是定植粘膜表面并由此侵入人体的许多病原体的公认前沿。它们也可能在控制应答无害环境抗原和食物的强度和质地上发挥重要作用。虽然有大量关于实验动物的MALT的文献,但对人类的研究相对较少。
1.6 滤泡相关上皮(FAE)是肠内抗原摄取的重要部位
在肠道,FAE的M细胞提取腔管的抗原,值得注意的是,肠道致病菌(如沙门氏菌、耶尔森氏鼠疫杆菌)和病毒(如呼肠孤病毒、脊髓灰质炎病毒和朊病毒)利用M细胞进入GALT淋巴组织的门户可能进一步蔓延到全身。同样,鼠NALT的M细胞已被证实提供了病原体进入通道(A族链球菌),尤其与呼吸道感染有关。
M细胞袋(M cell pocket)清楚地代表了外部环境与黏膜免疫系统之间的亲密接触面(图1.5)。在小鼠中,FAE表达趋化因子(例如,CCL9和CCL20),这些趋化因子可能吸引聚集在PP穹丘中“专业”APC。许多假定的APC也直接出现在人类FAE下,而M细胞袋以记忆T淋巴细胞和B淋巴细胞为主,其比例大致相等。有趣的是,活化的B细胞可能会在典型的肠上皮细胞上诱导出上皮M细胞表型。此外,在无菌和常规化的大鼠中进行的研究表明,细菌定植推动了M细胞袋中T和B细胞的积累和分化,显然最初伴随抗原转运DC介入,随后是生发中心的形成。
M细胞袋可能代表专为快速回忆反应设计的生发中心延伸。在这些微室中,最可能介导MHC II类与同源T细胞相互作用的细胞类型是长寿的sIgD - IgM+Bcl-2+CD27+记忆性B细胞(见图1.5)。在人类扁桃体中,记忆性B细胞定位于抗原运输的网状隐窝上皮,并通过共刺激因子B7分子的快速上调,获得了强有力的抗原提呈特性。同样,人类PPs的M细胞区存在的记忆性B细胞相对经常表达B7.2 (CD86),有时也表达B7.1(CD80),可能是刺激分泌粘液免疫的先决条件(见图1.5)。这些记忆细胞在表型上类似于所谓的脾外“边缘区B细胞”,通常表现出高频率的BCR IgVH突变,表明广泛的抗原刺激。
FAE不表达pIgR,而在M细胞中发现了非特征性的IgA顶端受体。SIgA可能利用这一受体靶向PP中DC的抗原。人类唾液和粪便中的许多共生细菌都包裹着SIgA,这可能有助于它们被M细胞摄取。大多数穿过上皮细胞的细菌被上皮下巨噬细胞破坏,但有些细菌被树突状细胞少量吸收(0.001%),足以诱导小鼠产生仅限于GALT和MLN的免疫反应。然而,总的来说,粘膜抗体反应限制了细菌进入体内,GALT被SIgA抗体“屏蔽”。然而,正反馈机制可能意指M细胞顶端的IgA受体可跟哺乳新生儿GALT中与母体同源SIgA抗体(与腔内相关抗原形成免疫复合物)靶向结合。许多报告显示,母乳喂养的婴儿随着时间的推移,分泌免疫力增强。

人们付诸相当大的努力描述M细胞受体的特征,它们或可用于开发以GALT为目标的疫苗和佐剂。小鼠M细胞表达toll样受体(TLR),从而使TLR激动剂成为潜在的黏膜疫苗佐剂。例如,脑膜炎奈瑟菌外膜蛋白与TLR2激动剂PorB混合后,增强了M细胞的微粒转运能力,诱导DC向FAE迁移。此外,在小鼠M细胞顶部表达的糖蛋白2已被证明是携带FimH(I型菌毛的一种成分)的共生菌和致病菌的胞浆受体。
1.7肠道细菌对生发中心形成所需的分子相互作用很重要
初级淋巴滤泡含有循环的处女B淋巴细胞(sIgD+IgM+),通过抗原捕获FDC形成的网络。FDC的起源尚不清楚,但它们的发育和簇状形成都依赖于LT信号,而B细胞是LT的一个重要来源。可溶性同型三聚体LTα的作用包括增强B细胞增殖和表达粘附分子;跨膜LTβ缺乏的小鼠没有检测到FDC。
生发中心的反应导致初级卵泡向次级卵泡转化。在人类中,这一过程已在扁桃体中被广泛研究,但相关的机制信息依赖于对免疫动物的淋巴结和脾脏的观察。一般来说,生发中心对于T细胞依赖的传统(B-2)记忆/效应B细胞的刺激、BCR的亲和性成熟和Ig-同种型转换(见第8章)至关重要。处女B细胞首先在T细胞区,就在初级滤泡外,通过与活化的CD4+ T细胞的同源性相互作用,并暴露于加工过的抗原复合物MHC II类分子在交叉指状DC上。然后,B细胞再次进入卵泡,成为增殖的sIgD+IgM+CD38+生发中心“奠基细胞(founder cells)”,在人类扁桃体中观察到。
最初激活的B细胞产生未突变的IgM(和一些IgG)抗体,以低亲和力结合循环抗原。然后,B细胞可以利用其补体受体携带调理过的抗原或免疫复合物进入滤泡,沉积在FDC(滤泡树突状细胞)上。抗原被长时间保留在这个网络中以维持B细胞记忆。在缺乏天然(“非特异性”)背景IgM抗体的基因敲除小鼠中,IgM诱导继发性免疫反应与抗体亲和力成熟的作用得到了强有力的支持。
补体受体CR1/CR2 (CD35/CD21)在生发中心反应中起关键作用。CD21在B细胞和FDC上大量表达,因此其功能可能不仅是将抗原定位到FDC,而且通过募集CD19进入BCR降低B细胞活化的阈值。携带免疫复合物的FDC上补体的激活是由调节因子控制的,但一些炎症介质的释放可能会诱导水肿,促进FDC来源的“免疫复合物包被体”或二十面体(iccosome)的分散,从而增强BCR介导的B细胞对其所含抗原的摄取。
天然免疫系统的其他几个组成部分可能参与了生发中心的形成。在一定的实验条件下,
由肠道细菌驱动的IgA分化甚至可能绕过通常的sIgM(或sIgD) BCR要求。然而,似乎总是依赖于一些卵泡样B细胞聚集物,有趣的是,这些聚集物可能缺乏保留抗原的fdc和生发中心。 正常情况下,生发中心反应是由对有限数量抗原的竞争驱动的,但也可能存在如前面所讨论的对分离的淋巴滤泡的先天驱动。 由此产生的B细胞将以有限的细胞库和相当低的BCR亲和力存活。
在无菌兔阑尾中,只有特定的共生菌有效地促进了GALT的发育,而这取决于同一菌群的应激反应,提示对GALT的影响是非特异性的。其他实验表明,GALT的发育可以独立于BCR的参与而发生,这显然是因为共生细菌通过与先天免疫受体相互作用促进了PP和MLN中的生发中心反应。这一信息有助于解释在缺乏高亲和力BCR发育的情况下,肠道菌群提供了巨大的IgA驱动,从而导致了大量的限制性IgA的产生,以及以低亲和力结合共生细菌冗余表位的能力(见第8章)。
因此,肠道微生物群是必需的,并在GALT的激活和正常肠道浆细胞的发育中发挥关键作用,尽管食物蛋白也可能有助于这一发育。值得注意的是,共生细菌塑造了宿主的BCR库。可能生发中心反应起源于GALT,产生一种不具有抗原特异性而具有交叉反应性的保护性抗体库。在这种情况下,本地微生物可能通过包括TLR信号转导在内的多种机制发挥多克隆b细胞激活剂的作用。共生细菌诱导IgA似乎代表了一种原始机制,可以限制细菌定植和穿透上皮屏障,而不将它们从肠道中清除(Pabst等人,2016)。在这种“先天样”防御的基础上,B-2系统能够通过生发中心驱动的高亲和力BCR选择来清除病原体的特定抗原(见第8章)。
三、B细胞在MALT生发中心分化
在组织切片中,MALT最明显的形态学特征是大量的大的、激活的生发中心。这在回肠中尤其如此。在小鼠中,生发中心的扩张使派尔集合淋巴结能够从浆膜表面识别出来,这样就可以将它们分离出来进行功能研究。通常,在每个FAE下面都有一个大的生发中心。
1.8 IgA表达和类别转换(class switching,重链转类)依赖于活化诱导的胞苷脱氨酶(cytidine deaminase)
如前所述,小鼠B-1细胞中的IgA转换可能会绕开需要T细胞辅助提供CD40−CD154/CD40L相互作用。相反,B-1细胞可能依赖于TNF家族的增殖和生存诱导细胞因子如BAFF/BLyS(TNF家族的B细胞活化因子/B淋巴细胞刺激因子)和由DC或激活巨噬细胞分泌的 APRIL(增殖诱导配体,例如在暴露于脂多糖后)。在APRIL-缺陷小鼠中,IgA抗体反应显著降低,可能BAFF和APRIL也参与了T细胞依赖性IgA转换。在人类肠道中,(免疫球蛋白)类别转换似乎主要是生发中心反应的一部分——但在某种程度上也可能是不依赖T细胞的——BAFF和APRIL的作用尚不清楚(见第8章)。
生发中心的类别转换是在生发中心奠基细胞被激活后开始的,这些细胞在亲和成熟后将其BCR组成由sIgD+IgM+转变为sIgD−IgM+记忆/效应细胞。然后,它们可能会通过直接或顺序地将内含子Cµ-转换(S)区域与下游同型的S区域重组,从而转换到另一类,如IgG或IgA(图1.6)。在浆细胞分化过程中,BCR与其他几个B细胞标记物一起逐渐丢失,特别是CD20和CD19(在小鼠中也是B220)。
Ig类别转换过程需要多种转录因子和酶活性,这些转录因子和酶活性由细胞类型特异性和更广义的DNA修复酶表达,特别是活化诱导的胞苷脱氨酶(AID,见图1.6)。AID在类别转换重组中的存在,可能与IgV基因片段的体细胞高突变有关。这发生在生发中心反应期间(见第8章)。缺乏AID的小鼠在肠道固有微生物过度生长的情况下,孤立淋巴滤泡会显著增生,类似于淋巴样增生发生在免疫球蛋白缺乏的人身上,他们经常感染兰第鞭毛虫寄生虫。这可能反映出,由于这些小鼠体内SIgM缺乏部分取代SIgA的体细胞高突变,肠道内的代偿抗体库不足。

在类别转换重组之前,任何生殖细胞CH位点的特定改变包括染色质结构的打开,这是转录激活的关键事件。因此,人类IgA1和IgA2的转换需要激活位于这两个亚类CH-基因片段各自S区上游的Iα1和Iα2启动子。然后将S位点之间的DNA环出并切除,从而删除Cµ和其他中间CH基因。直接切换到IgA1后,由切除的重组DNA衍生的种系Iα1-C循环转录本在后代中通过稀释逐渐丢失。
1.9 不同的类别转换通路在不同的粘膜部位起作用
人类IgA应答,在扁桃体和区域分泌效应位点均由IgA1主导,这表明在这些位点的黏膜B细胞分化主要发生在sIgD - IgM+CD38+中心细胞,它们通过序列下游的CH-基因转换实现(见图1.6)。相反,IgA2表达在PP和人类远端肠道(包括MLN)的相对增强(图1.7),则反映从Cµ到Cα2直接转换。小鼠PP中的B细胞可以直接从C µ-转换为C α,而在人B细胞中,这一直接途径可能优先导致IgA2的产生。
生发中心反应在人PP和阑尾中比在扁桃体中产生更多的滤泡内表达J链的IgA+浆细胞。此外,就在GALT滤泡外,IgA+浆细胞与IgG+浆细胞相等,甚至在数量上超过IgG+浆细胞,而在扁桃体中,滤泡外产生IgG浆细胞的优势是前者的两倍多。 因此,IgA转换和J链表达的驱动在GALT中明显比在扁桃体中更明显(见图1.7)。这种差异的原因尚不清楚,因为扁桃体隐窝上皮(tonsillar crypt epithelium)可以分泌BAFF和胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,一种细胞因子,通过激活产生BAFF的DC进一步促进类开关重组和局部B细胞的广泛反应)。一种可能性是,PP中肠道菌群不断叠加的新刺激增强了早期记忆/效应B细胞克隆的发育,从而增加了产生IgA和J链的潜力。

在扁桃体生发中心暗区发现了独特的sIgD+IgM - CD38+生发中心母细胞,进一步证明了微生物对黏膜B细胞分化的区域性影响。该亚群中S -µ、C -µ基因片段缺失,通过“非经典”的CH -基因转换,选择性的产生IgD+浆细胞(见图1.6)。分子生物学证据表明在正常瓦尔代尔扁桃体环(人类 NALT)和上呼吸道分泌效应位点优先出现C-µ缺失的B细胞,但这些细胞归巢于小肠黏膜的情况非常罕见。这种区隔化的(compartmentalized)B细胞反应解释了IgD+浆细胞在呼吸道中相对较高的频率,特别是IgD+浆细胞经常见于IgA缺乏中。流感嗜血杆菌和卡他莫拉菌是鼻咽的常见定植菌,大多数菌株表达外膜IgD结合因子,后者通过交叉结合sIgD/ BCR激活sIgD+ B细胞。通过这种方式,sIgD+扁桃体中心细胞可能被刺激增殖和多克隆分化,从而驱动V基因超突变和Sµ / Cµ缺失。相反,大量存在于远端肠道的LPS可能会抑制IgD的表达,这除了区隔化归巢机制外,可能还会导致胃肠道中产生IgD的浆细胞的缺乏。
S-µ / C-µ缺失在病变的扁桃体和腺样体中比在临床正常的扁桃体和腺样体中更常见,复发的扁桃体炎和腺样体增生中滤泡外IgD+浆细胞较多,这支持了微生物对B细胞分化的影响。但个体差异很大,在滤泡外扁桃体腔室中产生IgD的浆细胞的平均比例远低于所有同型的5%。
有趣的是,非经典转换产生的sIgD+IgM - B细胞似乎表达了V基因组群(repertoires),这可能会产生相当大的交叉反应,包括自身免疫,但这一观察结果的生物学意义尚不清楚。虽然在小鼠和人血清中已检测到大量抗微生物和其他IgD抗体活性,但循环IgD的保护或致病作用只是最近才被探索。因为IgD并不激活经典补体通路,它可能会阻断粘膜内的其他抗体防御功能,并在面对驱动IgD产生的细菌感染时,降低上呼吸道SIgA和SIgM抗体的免疫排除效率。IgD结合单核/巨噬细胞和嗜碱性粒细胞的能力,并诱导释放促炎细胞因子,包括白细胞介素(IL)-1, IL-6, IL-8和TNF-α可能增加IgD抗体的致病性。值得注意的是,IgA缺乏的个体若仅表现在鼻黏膜大量替代的IgM+和IgG+浆细胞,则比局部有大量IgD+浆细胞者呼吸道临床问题更少。
四、粘膜免疫细胞如何归巢
第14章包含关于淋巴细胞归巢到粘膜表面的广泛信息; 然而,这里有一些更适合讨论的领域。 一般来说,免疫细胞通过引流淋巴管从诱导部位排出。这些管道被认为是盲目地从一个有孔的内皮开始,淋巴样细胞的出口依赖于一个由鞘氨醇-1-磷酸介导的信号。此外,淋巴内皮细胞与高内皮小静脉(HEV)共同表达CCL21/SLC和其他粘附分子如细胞间粘附分子(ICAM)。例如,在肠道中,活化的T和B细胞离开PP,进入输入淋巴管,并排入MLN。细胞从那里离开输出淋巴管,最终流入胸导管,胸导管在左锁骨下静脉和左颈静脉的交界处进入血液。人类每天大约有4L的淋巴液流入血液,大部分来自肠道。
1.10 处女和激活的免疫细胞在GALT中占据不同的微环境
在人GALT中,具有高水平α4β7整合素的记忆B (sIgD−)和T(CD45RO+)淋巴细胞通常位于微淋巴附近和内部,以及一些CD19+CD38hiα4β7 hi B母细胞。而淋巴管主要含有处女α4β7淋巴细胞。对人肠系膜淋巴结的细胞化学和流式细胞术分析也提供了类似的标记;同样值得注意的是,一小部分已鉴定的B母细胞(2%-6%),据报道其细胞质还有的IgA、IgM和IgG比例为5:1: < 0.5。
在人GALT中,α4β7 hi亚群通过淋巴管排出,可能代表了第一个归巢步骤,特别是具有活化淋巴样细胞的肠道固有层。相对较少的记忆细胞在肠和肠系膜淋巴中高水平表达CD62L/ L-选择素;那些细胞重返GALT或通过与HEV上的外周淋巴结地址蛋白(PNAd)结合,与处女细胞一起从MLN、外周淋巴结或瓦尔代尔(扁桃体)环中溢出。
在缺乏CD62L/ L-选择素的情况下,活化的淋巴样细胞向肠道固有层的归巢显然依赖于其表面高水平的α4β7。循环细胞表达的α4β7允许其与固有层微血管内皮细胞顶部表达的未修饰MAdCAM-1结合。α4β7 hi表型主要是在人肠内(经口)免疫后外周血中出现的抗原特异性B细胞上诱导的,而系统免疫诱导的对应细胞优先表达CD62L/ L-选择素,而α4β7相对较少。虽然MAdCAM-1与CD62L的相互作用主要是在小鼠中进行的研究,但在人肠道固有层中缺乏携带CD62L的细胞,这强烈表明该分子不与GALT外的MAdCAM-1分子结合。尽管CD38和胞质IgA共表达丰富,但许多大的B细胞在迁移到固有肠层后仍保留了高水平的α4β7。因此,α4β7可能皆有介导效应细胞外溢,以及与CD44一起促进效应细胞的局部滞留的作用。
此外,T和B细胞向小肠固有层的迁移和/或滞留似乎是由胸腺表达的趋化因子(CCL25/TECK)介导的。值得注意的是,这种与CCR9相互作用的趋化因子是由人类和小鼠正常肠道的这部分隐窝上皮选择性产生的(图1.8)。几项小鼠研究表明,小肠趋向性直接与高α4β7和CCR9表达以及(PP和MLN中DC导致的)T细胞极少表达CD62L相关。

在健康小肠中,α4β7和CCR9归巢分子决定了记忆/效应B细胞的向外溢出。这种肠道归巢特性的获得显然至少部分依赖于维生素A氧化转化产生的维甲酸。巨噬细胞和GALT、MLN和肠黏膜中的树突状细胞表达视黄醛脱氢酶,驱动这种转化。相反,在大肠中,α4β7似乎由粘膜相关趋化因子(CCL28/MEC)辅助,作为吸引具有高水平CCR10的IgA+淋巴细胞的决定性线索。由于CCL28的上皮细胞在结肠中的表达高于小肠和阑尾,该趋化因子可能在肠B细胞归巢过程中起着分区化的作用。此外,有趣的是,CCL25和CCL28都增强了IgA+胞浆细胞对MAdCAM-1的整合素α4依赖性粘附。
循环中GALT和MLN来源的B细胞在肠道归巢的线索也可能有助于GALT结构的侧移,直接进入肠道固有层。PP和周围固有层之间的血管连接可能用于运输B细胞,这可能解释了为什么当无菌小鼠转移到常规条件下时,第一批IgA+浆细胞聚集在PP周围。大鼠经胸导管的B细胞流量被淋巴管转移时,肠道内的IgA+浆细胞数量通过局部增殖维持,这表明分离的淋巴滤泡与周围环境之间存在类似的通路。 在羔羊的多肠环模型中,高度定位的B细胞反应也得到了类似的观察结果。在羔羊的多肠环模型中,高度定位的B细胞反应也得到了类似的观察结果。然而,一些通常附着在GALT卵泡附近的胞浆细胞显然属于枯竭的B细胞克隆J链表达的潜力和不成比例地增加类转换到IgG。
1.11归巢分子在细胞归巢到肠外位点中起重要作用
GALT来源的B细胞向肠外分泌效应位点的播散(Dissemination)已被充分证明,但在啮齿动物和猪的免疫或感染实验中,只有有限的归巢从NALT或BALT到肠道。然而,间接证据表明,IgA+浆母细胞从瓦尔代尔环(人类NALT)分散到区域分泌效应位点。鼠NALT和兔腭扁桃体免疫已获得这种区域归巢的直接证据。人体扁桃体sIgD+IgM−CD38+胞浆细胞的弥散进一步支持了上下体区域的两分法(图1.9)。在循环中,这些细胞是可变的CCR10+,但表现出一种不利于小肠粘膜的归巢受体(α4β7int /loCCR9loCCR7hiCD62Lhi),它们几乎被排除在该效应位点之外。相反,这种“标记细胞”出现在淋巴结和骨髓中。这些细胞的组织分布可能反映了瓦尔代尔环中所有粘膜表型(J链+)浆细胞前体的迁移特性。为了与这一概念保持一致,通过腹腔转移到SCID(严重联合免疫缺陷)小鼠的人扁桃体活化B细胞迁移到其肺而不是肠粘膜。

早期研究表明,α4β7在人、小鼠或羊的淋巴样细胞归巢到呼吸道中很少或没有发挥作用。在这方面,鼻内免疫诱导抗原特异性的人B细胞上的α4β7水平不足,而向肠道探索,但抗体的产生在腺样体和鼻黏膜中都被诱发。与经口(肠)免疫诱导的高表面α4β7相比,循环特异性B细胞显示大量的CD62L和α4β7共表达。小鼠实验确实表明,CD62L参与B细胞归巢到肠外黏膜效应位点,在小鼠气道的研究中也暗示了CCR7的类似作用。
非肠道归巢受体可能解释B细胞从NALT迁移到泌尿生殖道。这反映在用多种抗原鼻内免疫小鼠、猴子和人类宫颈阴道分泌物中的IgA和IgG抗体。NALT来源的B细胞中CD62L和CCR7相对一致的水平,使它们能够与淋巴结内HEV上的PNAd、CCL21/SLC和CCL19/ELC结合,同样可以解释上呼吸道和消化道黏膜免疫与全身免疫之间惊人的整合。这是一种很有吸引力的特性,可以预防许多病原体,并已在啮齿动物、人类和非人灵长类动物的免疫接种中得到证明。向肠道外的分泌组织迁移也可能涉及NALT来源的B细胞表达的α4β1 (CD49d/CD29)。这种整合素的主要反受体是VCAM-1,它可能存在于人支气管、鼻腔和子宫颈粘膜的微血管内皮。
除了引导激活的粘膜B细胞到肠固有层,CCR10似乎是一个统一的趋化因子受体,有助于浆母细胞归巢到肠外分泌效应位点。最近的几项研究表明,CCR10在人类和小鼠的每个黏膜效应位点均由IgA+浆母细胞表达(而较少由IgA+浆细胞表达)。这种表达模式也表现在上呼吸道中IgD+浆母细胞/浆细胞,以及IgA缺陷受试者肠道中IgM+和IgG+浆母细胞/浆细胞取代IgA+浆细胞。如前所述,CCR10配体CCL28/MEC由肠道上皮形成,特别是在大肠中,并且在上气消化道和泌乳乳腺的分泌上皮中也有较高水平的表达。有趣的是,体外实验显示CCL28(而不是CCL25)能吸引扁桃体IgA+胞浆母细胞。因此,分级组织部位依赖的CCR10-CCL28相互作用,加上经典肠道归巢分子水平不足,最有可能解释观察到的来自瓦尔代尔环的记忆/效应B细胞的两向扩散(dispersion dichotomy)。因为据报道骨髓基质细胞产生CCL28,这种趋化因子与CCR10+ B细胞可能进一步促进粘膜和全身免疫的整合。
五、总结
粘膜免疫系统可分为诱导型MALT结构和免疫细胞弥漫性分布的效应位点(如肠、气道黏膜的固有层和上皮,以及外分泌腺的基质)。大量证据支持这一观点,即人类肠道浆细胞主要来源于最初在GALT中激活的B细胞。然而,关于腔内抗原的摄取、加工和呈递完成了粘膜B细胞和T细胞的启动和持续扩张,目前尚不完全清楚。同样不清楚的是,为何与其他MALT结构相比,GALT的生发中心反应如此重要,即促进类别转换到IgA和J链的表达,尽管共生菌群似乎有助于多样化和记忆。B细胞和T细胞从GALT迁移到肠道固有层是由相当明确的粘附分子和趋化因子/趋化因子受体引导的,但指向肠道以外的分泌效应位点的信号需要更好地确定。在这方面,瓦尔代尔环(包括腺样体和腭扁桃体)作为区域性人类MALT的作用必须得到更好地确定,尽管平衡的证据表明,其功能与啮齿动物特有的NALT结构一样。因此,在开发有效的局部疫苗以保护小肠和大肠、呼吸道和女性生殖道时,必须考虑到黏膜免疫系统的显著分隔化(compartmentalization)。
附注:Buettner和Lochner在2016年总结了小肠和结肠中三级淋巴器官的功能作用。Mann等人研究了人类结肠和回肠树突状细胞之间的差异。2016:CD103+, CD11b+树突状细胞驱动粘膜T辅助细胞17分化(Persson 等人, 2013)。在小鼠和人类肠道分化中,转录和功能分析是不同的(Watchmaker等人,2014)。在人肠道中分泌抗体的浆细胞的寿命具有很大的临床相关性(Landsverk等人, 2017)。记忆CD4+ CDR5+ T细胞在新生儿肠壁中已经大量存在,这与母婴传播HIV-1有很大的相关性(Bunders et al. 2012)。据文献记载,在移植患者中,驻留记忆CD8T细胞在人类小肠中可存活数年(Bartolomé-Casado等人,2019)。M细胞的激活是口服疫苗的一个方面,迄今已在小鼠中进行了研究(Kimura等人,2019)。从隐窝底部的干细胞到成熟的M细胞的成熟步骤已总结(Nakamura等人,2018)。
人类肠壁巨噬细胞的特征可以通过转录和功能分析进入不同的群体。使用移植患者的材料,研究十二指肠壁的转换率和定位:类型在3周内被替换,其他显示较慢的转换率
(Bujko A 等人,2017)。
最近对先天淋巴样细胞(ILS)进行了更详细的研究(例如Penny等人,2018)。一个主要的问题是固有层内的定位,例如隐窝或绒毛部分,因为这些细胞的功能特征,而不是通过细胞表面标记进行免疫组织学(Kortekaas Krohn等人2018)。ILS亚群的组成在肠道不同部位的定位不同,在HIV感染患者中显著改变(Krämer等人,2017)。有时,自然杀伤细胞也包括在ILS家族中。在人类生命的最初几年,NK细胞的数量逐渐减少。这些细胞的特征是表达曙核蛋白体(Eosomes)、穿孔素(perforin)和颗粒酶B (Sagebiel2019)。
延伸阅读
- Aase, A., Sommerfelt, H., Petersen, L.B. et al.: Salivary IgA from the sublingual compartment as a novel noninvasive proxy for intestinal immune induction. Mucosal Immunol. 2016, 9:884–893.
- Bain, C.C., Bravo-Blas, A., Scott, C.L. et al.: Constant replenishment from circulating monocytes maintains the macrophage pool in the intestine of adult mice. Nat. Immunol. 2014, 15:929–937.
- Bartolomé-Casado, R., Landsverk, O.J.B., Chauhan, S.K. et al.: Resident memory CD8 T cells persist for years in human small intestine. J. Exp. Med. 2019, 216: 2412–2426.
- Brandtzaeg, P.: Function of mucosa-associated lymphoid tissue in antibody formation. Immunol. Invest. 2010, 39:303–355.
- Brandtzaeg, P., Farstad, I.N., Johansen, F.-E. et al.: The B-cell system of human mucosae and exocrine glands. Immunol. Rev. 1999, 171:45–87.
- Brandtzaeg, P., and Johansen, F.-E.: Mucosal B cells: Phenotypic characteristics, transcriptional regulation, and homing properties. Immunol. Rev. 2005, 206:32–63.
- Brandtzaeg, P., and Pabst, R.: Let’s go mucosal: Communication on slippery ground. Trends Immunol. 2004, 25:570–577.
- Buettner, M., and Lochner, M.: Development and function of secondary and tertiary lymphoid organs in the small intestine and the colon. Front Immunol.2016, 7:342.
- Bujko, A., Atlasy, N., Landsverk, O.J.B. et al.: Transcriptional and functional profiling defines human small intestinal macrophage subsets. J. Exp. Med. 2018, 215:441–458.
- Bunders, M.J., van der Loos, C.M., Klarenbeek, P.L. et al.: Memory CD4(+)CCR5(+) T cells are abundantly present in the gut of newborn infants to facilitate mother-to-child transmission of HIV-1. Blood 2012, 120:4383–4390.
- Cella, M., Fuchs, A., Vermi, W. et al.: A human natural killer cell subset provides an innate source of IL-22 for mucosal immunity. Nature 2009, 457:722–725.
- Fuchs, A., Vermi, W., Lee, J.S. et al.: Intraepithelial type 1 innate lymphoid cells are a unique subset of IL-12- and IL-15-responsive IFN-γ-producing cells. Immunity 2013, 38:769–781.
- Heier, I., Malmström, K., Sajantila, A. et al.: Characterisation of bronchus-associated lymphoid tissue and antigen-presenting cells in central airway mucosa of children. Thorax 2011, 66:151–156.
- Herbrand, H., Bernhardt, G., Förster, R. et al.: Dynamics and function of solitary intestinal lymphoid tissue. Crit. Rev. Immunol. 2008, 28:1–13.
- Juelke, K., Romangnani, C.: Differentiation of human innate lymphoid cells (ILCs). Curr. Opin. Immunol. 2016, 38:75–85.
- Kimura, S., Kobayahi, N., Nakamura, Y. et al.: Sox8 is essential for M cell maturation to accelerate lgA response at the early stage after weaning in mice. J. Exp. Med. 2019, 216:831–846.
- Kiyono, H., and Fukuyama, S.: NALT- versus Peyer’spatch-mediatedmucosal immunity. Nat. Rev. Immunol. 2004, 4:699–710.
- Kortekaas Krohn, I., Shikhagaie, M.M., Golebski, K. et al.: Emerging roles of innate lymphoid cells in inflammatory diseases: Clinical implications. Allergy 2018, 73:837–850.
- Krämer, B., Goeser, F., Lutz, P. et al.: Compartmentspecific distribution of human intestinal innate lymphoid cells is altered in HIV patients under effective therapy. PLoS Pathog. 2017, 13:e1006373.
- Kunkel, E.J., and Butcher, E.C.: Chemokines and the tissue-specific migration of lymphocytes. Immunity 2002, 16:1–4.
- Landsverk, O.J., Snir, O., Casado, R.B. et. al: Antibodysecreting plasma cells persist for decades in human intestine. J. Exp. Med. 2017, 214:309–317.
- Landsverk, O.J., Snir, O., Casado, R.B. et al.: Antibodysecreting plasma cells persist for decades in human intestine. J. Exp. Med. 2016, 214:309–317.
- Liu, Y.J., and Arpin, C.: Germinal center development. Immunol. Rev. 1997, 156:111–126.
- Lügering, A., Kucharzik, T.: Induction of intestinal lymphoid tissue: The role of cryptopatches. Ann. N. Y. Acad. Sci. 2006, 1072:210–217.
- Macpherson, A.J., McCoy, K.D., Johansen, F.-E. et al.: The immune geography of IgA induction and function. Mucosal Immunol. 2008, 1:11–22.
- Mann, E.R., Bernardo, D., English, N.R. et al.: Compartment-specific immunity in the human gut: Properties and functions of dendritic cells in the colon versus the ileum. Gut 2016, 65:256–270.
- Masahata, K., Umemoto, E., Kayama, H. et al.: Generation of colonic IgA-secreting cells in the caecal patch. Nat. Commun. 2014, 5:3704.
- Mowat, A.M., and Bain, C.C.: Mucosal macrophages in intestinal homeostasis and inflammation. J. Innate Immun. 2011, 3:550–564.
- Nakamura, Y., Kimura, S., Hase, K.: M cell-dependent antigen uptake on follicle-associated epithelium for mucosal immune surveillance. Inflamm. Regen.2018, 38:15.
- Neutra, M.R., Mantis, N.J., and Kraehenbuhl, J.P.: Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2001, 2:1004–1009.
- Newberry, R.D., and Lorenz, R.G.: Organizing a mucosal defense. Immunol. Rev. 2005, 206:6–21.
- Pabst, O., Cerovic, V., Hornef, M.: Secretory IgA in the coordination of establishment and maintenance of the microbiota. Trends Immunol. 2016, 37:287–296.
- Pabst, R., and Tschernig, T.: Bronchus-associated lymphoid tissue. An entry site for antigens for successful mucosal vaccination? Amer. J. Respir. Cell Mol. Biol. 2010, 43:137–140.
- Pabst, R.: Mucosal vaccination by the intranasal route. Nose-associated lymphoid tissue (NALT)—Structure, function and species differences. Vaccine 2015,33:4406–4413.
- Penny, H.A., Hodge, S.H., Hepworth, M.R.: Orchestration of intestinal homeostasis and
- tolerance by group 3 innate lymphoid cells. Semin Immunopathol. 2018, 40:357–370.
- Persson, E.K., Uronen-Hansson, H., Semmrich, M. et al.: IRF4 transcription-factor -dependent CD103(+) CD11b(+) dendritic cells drive mucosal T helper 17 cell differentiation. Immunity. 2013, 38:958–969.
- Quiding-Järbrink, M., Nordström, I., Semmrich, M. et al.: Differential expression of tissue-specific adhesion molecules on human circulating antibody-forming cells after systemic, enteric, and nasal immunizations. A molecular basis for the compartmentalization of effector B cell responses. J. Clin. Invest. 1997, 99:1281–1286.
- Sagebiel, A.F., Steinert, F., Lunemann, S.: Tissue-resident Eomes+ NK cells are the major innate lymphoid cell population in human infant intestine. Nat. Commun. 2019 10:975.
- Sipos, F., and Muzes, G.: Isolated lymphoid follicles in colon:Switch points between inflammation and colorectal cancer? World J. Gastroenterol. 2011, 17:1666–1673.
- Tait Wojno, E.D., and Artis, D.: Emerging concepts and future challenges in innate lymphoid cell biology. J. Exp. Med. 2016, 213:2229–2248.
- Watchmaker, P.B., Lahlki, K., Lee, M. et al.: Comparative transcriptional and functional profiling defines conserved programs of intestinal DC differentiation in humans and mice. Nature Immunol. 2014, 15:98–108.