Documentos de Académico
Documentos de Profesional
Documentos de Cultura
Chimica Classificazione e Nomenclatura Dei Composti
Cargado por
kim313Título original
Derechos de autor
Formatos disponibles
Compartir este documento
Compartir o incrustar documentos
¿Le pareció útil este documento?
¿Este contenido es inapropiado?
Denunciar este documentoCopyright:
Formatos disponibles
Chimica Classificazione e Nomenclatura Dei Composti
Cargado por
kim313Copyright:
Formatos disponibles
Capitolo 13
Classificazione e nomenclatura
dei composti
1. I nomi delle sostanze
2. Valenza e numero di ossidazione
3. Leggere e scrivere le formule più semplici
4. La classificazione dei composti inorganici
5. Le proprietà dei composti binari
6. La nomenclatura dei composti binari
7. Le proprietà dei composti ternari
8. La nomenclatura dei composti ternari
Copyright ©2009 Zanichelli editore Le idee della chimica
1. I nomi delle sostanze
La nomenclatura chimica è regolamentata da
un’associazione internazionale: la IUPAC
(International Union of Pure and Applied
Chemistry):
Ancora oggi viene utilizzata spesso la
nomenclatura tradizionale.
Esiste anche la cosiddetta nomenclatura di Stock.
Copyright ©2009 Zanichelli editore Le idee della chimica
2. Valenza e numero di ossidazione
La valenza rappresenta il numero di elettroni che
l’atomo guadagna o mette in comune quando si
lega ad altri atomi.
La valenza di un atomo corrisponde in genere al
numero di legami che l’atomo può formare.
Copyright ©2009 Zanichelli editore Le idee della chimica
2. Valenza e numero di ossidazione
Il numero di ossidazione rappresenta la carica
che ogni atomo, in una molecola o in uno ione
poliatomico, assumerebbe se gli elettroni di legame
fossero assegnati all’atomo più elettronegativo.
Copyright ©2009 Zanichelli editore Le idee della chimica
2. Valenza e numero di ossidazione
3. Leggere e scrivere le formule più semplici
La formula chimica di un composto mostra da quali
elementi è formato.
Gli indici numerici in posizione di pedici, indicano quanti
atomi di ogni elemento sono presenti nella molecola.
I composti si dicono:
• binari se formati da due elementi;
• ternari se costituiti da tre elementi.
Copyright ©2009 Zanichelli editore Le idee della chimica
3. Leggere e scrivere le formule più semplici
L’elemento più metallico, i cationi e gli atomi con
numero di ossidazione positivo, si scrivono per primi, a
sinistra nella formula. Seguono l’anione non metallico o
poliatomico.
es. NaOH, KCl
Nei composti binari, il n.o. del non metallo diventa
l’indice del non metallo e viceversa.
Se i due indici della formula hanno un divisore comune,
di solito si semplifica.
Copyright ©2009 Zanichelli editore Le idee della chimica
3. Leggere e scrivere le formule più semplici
Il nome di un composto binario
si costruisce a partire da quello
dell’elemento scritto a destra.
Gli indici delle formule vengono
identificati attraverso dei prefissi.
La somma dei numeri di ossidazione di tutti gli atomi
presenti nella molecola, è uguale a zero.
Copyright ©2009 Zanichelli editore Le idee della chimica
4. La classificazione dei composti inorganici
La classificazione dei composti inorganici si basa sulle loro
proprietà chimiche, in particolare sulla natura metallica o
non metallica degli elementi costituenti, sulla reattività
con acqua e sulla reattività con ossigeno.
Copyright ©2009 Zanichelli editore Le idee della chimica
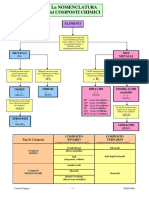
5. Le proprietà dei composti binari
I composti binari si possono distinguere in ionici
e in molecolari.
COMPOSTI BINARI
Ionici
Molecolari
Ossidi Idracidi
Sali (acidi binari) Ossidi
(binari) basici acidi (anidridi)
Idruri Idruri
metallici covalenti
Copyright ©2009 Zanichelli editore Le idee della chimica
5. Le proprietà dei composti binari: idruri
GLI IDRURI
Gli idruri metallici (H+Me) sono composti
dell’idrogeno con metalli fortemente elettropositivi (I e
II gruppo).
Gli idruri covalenti (H+nonMe) sono composti
dell’idrogeno con semimetalli e non metalli (IV, V, VI
gruppo).
Negli idruri l’idrogeno ha numero di ossidazione –1 e si
trova a destra nella formula (CH4, NH3, CaH2).
Copyright ©2009 Zanichelli editore Le idee della chimica
5. Le proprietà dei composti binari: idracidi
GLI ACIDI BINARI
HF Acido
fluoridrico
Gli idracidi (o acidi binari) sono HCl Acido
composti formati da idrogeno e un cloridrico
non metallo. HBr Acido
bromidrico
Negli idracidi l’idrogeno ha numero HI Acido
iodidrico
di ossidazione +1 e si trova a
sinistra nella formula. H2S Acido
solfidrico
Copyright ©2009 Zanichelli editore Le idee della chimica
5. Le proprietà dei composti binari: ossidi
GLI OSSIDI
L’ossigeno forma composti praticamente con tutti gli
elementi della tavola periodica.
Con i metalli forma ossidi basici, con i non metalli dà
luogo a ossidi acidi (o anidridi).
Negli ossidi l’ossigeno ha numero di ossidazione –2 e si
trova a destra nella formula (CO2, MgO).
Copyright ©2009 Zanichelli editore Le idee della chimica
5. Le proprietà dei composti binari: ossidi
L’ossigeno forma anche degli ossidi
particolari, detti perossidi, che
contengono due atomi di ossigeno
legati tra loro.
Nei perossidi l’ossigeno ha numero di
ossidazione –1 e si trova a destra nella
formula (H2O2).
Copyright ©2009 Zanichelli editore Le idee della chimica
6. La nomenclatura dei composti binari
La nomenclatura chimica identifica i composti
attraverso un nome specifico a partire dalla
formula chimica della sostanza.
Nomenclatura tradizionale: fa riferimento al
numero di ossidazione degli elementi presenti nella
molecola del composto.
Notazione di Stock: fa riferimento al numero di
ossidazione che gli elementi presentano nella
molecola, ma ne dà specificazione mettendoli tra
parentesi in cifre romane.
Copyright ©2009 Zanichelli editore Le idee della chimica
6. La nomenclatura dei composti binari: sali
Copyright ©2009 Zanichelli editore Le idee della chimica
6. La nomenclatura dei composti binari: ossidi
La nomenclatura IUPAC indica la relazione fra
il nome della sostanza e la sua formula chimica.
Copyright ©2009 Zanichelli editore Le idee della chimica
6. La nomenclatura dei composti binari: ossidi
7. Le proprietà dei composti ternari
I principali composti ternari sono
• gli idrossidi (composti ionici);
• gli ossiacidi (composti molecolari);
• i sali derivati dagli ossiacidi.
COMPOSTI TERNARI
Ionici
Molecolari
IDROSSIDI
(Me + OH)
OSSIACIDI
anidridi + H2O)
Sali degli
ossiacidi
Copyright ©2009 Zanichelli editore Le idee della chimica
7. Le proprietà dei composti ternari: idrossidi
Gli idrossidi sono composti ionici formati da un
metallo e dallo ione idrossido OH–.
Nella formula il metallo si trova a sinistra e il gruppo
ossidrile a destra:
Me(OH)n
Copyright ©2009 Zanichelli editore Le idee della chimica
7. Le proprietà dei composti ternari: ossiacidi
Gli ossiacidi sono composti formati da idrogeno,
un non metallo e ossigeno.
Gli ossiacidi derivano dalla reazione fra un ossido
acido (anidride) e una o più molecole d’acqua.
Copyright ©2009 Zanichelli editore Le idee della chimica
7. Le proprietà dei composti ternari: sali
I sali ternari sono composti formati da un metallo,
un non metallo e l’ossigeno.
I sali ternari si formano per sostituzione degli atomi di
idrogeno dell’ossiacido corrispondente con un metallo.
7. Le proprietà dei composti ternari: sali
Se i sali provengono da acidi poliprotici (con più di due
atomi di idrogeno), la sostituzione può risultare parziale
e prendono il nome di sali acidi.
8. La nomenclatura dei composti ternari: idrossidi
Nomenclatura degli idrossidi:
• IUPAC: idrossido di ___ (nome del metallo), preceduto dal
prefisso per il numero di ioni OH- presenti nella molecola.
es.: NaOH (Idrossido di Sodio)
Ca(OH)2 (Diidrossido di Calcio)
Stock: per metalli con due possibili n.o., si specifica il n.o. del
catione e lo si riporta tra parentesi in cifre romane.
Tradizionale: per metalli con due possibili n.o., si mette il suffisso
–oso per il valore più piccolo e –ico per il più grande.
8. La nomenclatura dei composti ternari: ossiacidi
Nomenclatura degli ossiacidi
• IUPAC: acido + non metallo con desinenza riferita al n.o. posto fra
parentesi;
Tradizionale: acido + non metallo con suffisso relativo al n.o.
Distinguiamo i possibili stati di ossidazione tramite i suffissi -oso o -ico
come per gli idrossidi. Se il non metallo ha più di due n.o. (es il Cl), si
usano i prefissi ipo- e -per riferiti, in modo crescente, ai diversi n.o. del
non metallo.
8. La nomenclatura dei composti ternari: sali ternari
Nomenclatura dei sali ternari:
• IUPAC: si sopprime il termine acido, si sostituisce il suffisso –
ico con il suffisso –ato, il suffisso -oso con -ito e si specifica il
nome del metallo.
Tradizionale: si trasformano i suffissi, ma non i prefissi.
ossiacido sale
ipo…oso ipo…ito
…oso …oso
…ico …ato
per…ico per…ato
Copyright ©2009 Zanichelli editore Le idee della chimica
También podría gustarte
- Nomenclatura chimica inorganica. Reazioni redox. Principi di stechiometriaDe EverandNomenclatura chimica inorganica. Reazioni redox. Principi di stechiometriaAún no hay calificaciones
- Power Point ChimicaDocumento33 páginasPower Point Chimicamartina maccarioAún no hay calificaciones
- NOMENCLATURADocumento41 páginasNOMENCLATURAcelesteAún no hay calificaciones
- NOMENCLATURADocumento29 páginasNOMENCLATURAelia dettiAún no hay calificaciones
- Cap. 6 Fondamenti Di Chimica InorganicaDocumento30 páginasCap. 6 Fondamenti Di Chimica InorganicaPavlov Garcia MelgarejoAún no hay calificaciones
- Nomenclatura Dei CompostiDocumento14 páginasNomenclatura Dei CompostibhuAún no hay calificaciones
- Valitutti PPT 82074 c14Documento44 páginasValitutti PPT 82074 c14Aurora NuciforaAún no hay calificaciones
- Cap 9 - La Nomenclatura Dei CompostiDocumento41 páginasCap 9 - La Nomenclatura Dei CompostiStefano CorreaAún no hay calificaciones
- Lezione Di Chimica N. 4Documento5 páginasLezione Di Chimica N. 4the andrix splatterAún no hay calificaciones
- 2 Parte Tavola PeriodicaDocumento31 páginas2 Parte Tavola PeriodicaЛол ПриколAún no hay calificaciones
- NomenclaturaDocumento25 páginasNomenclaturafrancescoAún no hay calificaciones
- Nomenclatura InorganicaDocumento57 páginasNomenclatura InorganicapietroAún no hay calificaciones
- I Composti Chimici e La NomenclaturaDocumento3 páginasI Composti Chimici e La NomenclaturaAlessioContuAún no hay calificaciones
- Regole Di Nomenclatura ChimicaDocumento28 páginasRegole Di Nomenclatura ChimicaGayyyyyyAún no hay calificaciones
- Zanichelli Chimica Intorno Sintesi10Documento2 páginasZanichelli Chimica Intorno Sintesi10dmfra08Aún no hay calificaciones
- NOMENCLATURADocumento9 páginasNOMENCLATURAnicolepesce01Aún no hay calificaciones
- Mappa Nomenclatura 1Documento3 páginasMappa Nomenclatura 1albi07gtAún no hay calificaciones
- La NomenclaturaDocumento63 páginasLa NomenclaturaromersadavideAún no hay calificaciones
- Lezione 1. Nomenclatura ChimicaDocumento57 páginasLezione 1. Nomenclatura ChimicaRagne FranciscoAún no hay calificaciones
- NomenclaturaDocumento32 páginasNomenclaturaMarta DomenighiniAún no hay calificaciones
- NomenclaturaDocumento16 páginasNomenclaturaSant NientAún no hay calificaciones
- NomenclaturaDocumento12 páginasNomenclaturaFrank VillalvaAún no hay calificaciones
- NomenclaturaDocumento17 páginasNomenclaturaermelinda memoliAún no hay calificaciones
- Biologia 05 - Nomenclatura ChimicaDocumento5 páginasBiologia 05 - Nomenclatura ChimicaAnonymous oG0VPL2YAún no hay calificaciones
- Matdid 877546Documento3 páginasMatdid 877546Aurora ConsortiAún no hay calificaciones
- Nomenclatura Química InorganicaDocumento9 páginasNomenclatura Química InorganicaANELISS CRESPOAún no hay calificaciones
- Nomenclatura InorganicaDocumento10 páginasNomenclatura InorganicaLucaAún no hay calificaciones
- Nomenclatura Chimica: Appunti DiDocumento19 páginasNomenclatura Chimica: Appunti Dihaconep181Aún no hay calificaciones
- Chimica Cap 1Documento6 páginasChimica Cap 1vincenzo luca SalvoAún no hay calificaciones
- Nomenclatura Composti ChimiciDocumento21 páginasNomenclatura Composti ChimiciKnabodinalioAún no hay calificaciones
- 1 - ComplessiDocumento13 páginas1 - Complessialm43541Aún no hay calificaciones
- Nomenclatura ChimicaDocumento8 páginasNomenclatura ChimicaDaniele CenedaAún no hay calificaciones
- Regole Di NomenclaturaDocumento7 páginasRegole Di NomenclaturaSKYN3T21100% (1)
- Lezione 14 Chimica - YMP1 - Classe 1 - AllegatoDocumento60 páginasLezione 14 Chimica - YMP1 - Classe 1 - AllegatoFrancesco CarrozzoAún no hay calificaciones
- Nomenclatura ChimicaDocumento14 páginasNomenclatura Chimicanever97Aún no hay calificaciones
- La Nomenclatura ChimicaDocumento5 páginasLa Nomenclatura ChimicaAlex SeveroniAún no hay calificaciones
- Nomenclatura ChimicaDocumento29 páginasNomenclatura ChimicastudentiaristofaneAún no hay calificaciones
- Stechiometria 2Documento80 páginasStechiometria 2ijjaneAún no hay calificaciones
- Elementi Composti NomenclaturaDocumento7 páginasElementi Composti NomenclaturaTed SukuboAún no hay calificaciones
- 1.nomenclatura ChimicaDocumento65 páginas1.nomenclatura ChimicaNaomi BellomoAún no hay calificaciones
- CHNomenclatura Composti InorganiciDocumento38 páginasCHNomenclatura Composti InorganicimattiaAún no hay calificaciones
- Lezione1 Stechiometria Nomenclatura ChimicaDocumento21 páginasLezione1 Stechiometria Nomenclatura ChimicaLeo Bursese100% (1)
- F4 UvoifevgujdxfyvyukcvyukfeqguvkfequykvfecygiqkDocumento63 páginasF4 Uvoifevgujdxfyvyukcvyukfeqguvkfequykvfecygiqkjacoponavari2004Aún no hay calificaciones
- Mappa Nomenclatura ChimicaDocumento3 páginasMappa Nomenclatura ChimicaSandra Ortega NavasAún no hay calificaciones
- Scienze ScuolaDocumento7 páginasScienze Scuolaettorino74Aún no hay calificaciones
- Introduzione Chimica OrganicaDocumento48 páginasIntroduzione Chimica OrganicaCristian ChirAún no hay calificaciones
- Nomenclatura ChimicaDocumento2 páginasNomenclatura ChimicaJIrapowaAún no hay calificaciones
- Nomenclatura Molecole InorganicheDocumento25 páginasNomenclatura Molecole InorganicheLorenzo GregorisAún no hay calificaciones
- NomenclaturaDocumento3 páginasNomenclaturaCalisthenicsMarcoAún no hay calificaciones
- NomenclaturaDocumento48 páginasNomenclaturafeklendAún no hay calificaciones
- CHIMICA FormularioDocumento9 páginasCHIMICA FormularioAlessio LeredeAún no hay calificaciones
- Nomenclatura ChimicaDocumento19 páginasNomenclatura Chimicaapi-253266324Aún no hay calificaciones
- Appunti Di Scienze (Classe Seconda)Documento47 páginasAppunti Di Scienze (Classe Seconda)Liceo F. Vercelli100% (1)
- Nomenclatura Dei Composti BinariDocumento4 páginasNomenclatura Dei Composti Binarinicolacaddeo07Aún no hay calificaciones
- 1 NomenclaturaDocumento47 páginas1 NomenclaturaJekyll RevAún no hay calificaciones
- NomenclaturaDocumento4 páginasNomenclaturaAnonymous Gp0K9p7vAún no hay calificaciones
- Biologia 2Documento32 páginasBiologia 2rug65eculetsgpAún no hay calificaciones
- Nomenclatura ZanicchelliDocumento28 páginasNomenclatura ZanicchelliAndrea GregoAún no hay calificaciones
- La NomenclaturaDocumento4 páginasLa NomenclaturaSerena GionfriddoAún no hay calificaciones
- Esteri e SaponificazioneDocumento5 páginasEsteri e SaponificazionevomuAún no hay calificaciones
- Valitutti Soluzioni Esercizi 82074 c21Documento5 páginasValitutti Soluzioni Esercizi 82074 c21Lorenzo PaganAún no hay calificaciones
- Composti Organici Dello ZolfoDocumento16 páginasComposti Organici Dello ZolfomahchenesoAún no hay calificaciones
- TRANSCODIFICADocumento66 páginasTRANSCODIFICALUCA ARCHETTIAún no hay calificaciones
- Acido Nitrico - Chimica Industriale EssenzialeDocumento14 páginasAcido Nitrico - Chimica Industriale Essenzialepaola.cattozzoAún no hay calificaciones
- Analisi N 12 v2 Calcio MagnesioDocumento5 páginasAnalisi N 12 v2 Calcio MagnesioKevin VecchiAún no hay calificaciones