8.4: Abundancia de isótopos
- Page ID
- 77745
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Abundancia de isótopos.
La existencia de isótopos fue observada por primera vez por Aston usando un espectrómetro de masas para estudiar iones de neón. Al interpretar los espectros de masas es importante recordar que la masa atómica relativa o peso atómico de un elemento es un promedio ponderado de los isótopos naturales. Los espectrómetros de masas separan estos isótopos y cada uno se observa en su respectiva relación masa/carga. La abundancia relativa utilizada para determinar la masa atómica relativa se determina mediante espectrometría de masas. Aunque esto complica el espectro de masas, también proporciona información útil para identificar los elementos en un ion. El cloro es un excelente ejemplo de cómo las distribuciones de isótopos son útiles para la interpretación. El peso molecular del cloro es\(35.45 \mathrm{u}\). Esto se calcula a partir de la abundancia natural de\({ }^{35} \mathrm{Cl}(75 \%)\) y\({ }^{37} \mathrm{Cl}(25 \%)\). Para evitar ambigüedades, el ion molecular se define como el ión con los isótopos que ocurren con mayor frecuencia. Para\(\mathrm{CH}_{3} \mathrm{Cl}\) el ion molecular está\({ }^{12} \mathrm{C}^{1} \mathrm{H}_{3}{ }^{35} \mathrm{Cl}\) a 50 m/z.
Abundancia isótopo de cloro
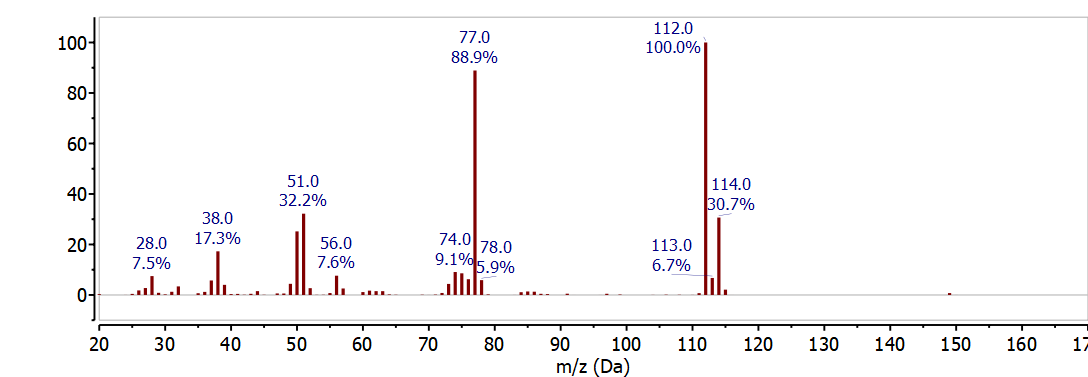
La abundancia natural de estos dos isótopos se observa en el espectro de masas como dos picos separados por 2 m/z con una intensidad relativa de\(3: 1\). El espectro de masas del clorobenceno C 6 H 5 Cl en la Figura muestra\(\PageIndex{1}\) claramente la distribución de isótopos de cloro a 112 m/z y 114 m/z. Estos picos corresponden al ión molecular -el ión molecular tiene el isótopo más abundante para cada elemento- a 112 m/z (6x12 + 5x1 + 35) y el pico de isótopo de 37 Cl a 114 m/z (6x12 + 5x1 + 37) y la intensidad relativa está determinada por la abundancia natural del Isótopo de 37 Cl. El otro pico principal en este espectro a 77 m/z corresponde a la pérdida de cloro del ión molecular o el pico del isótopo de 37 Cl para dar C 6 H 5 + (112 - 35 = 77 OR 114 - 37 = 77).
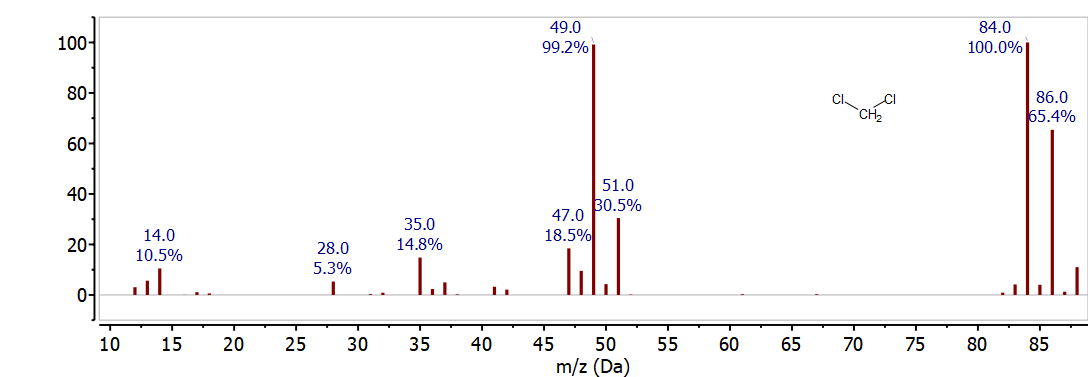
Si está presente más de un átomo de cloro, la abundancia de isótopos es más compleja. Un ion con dos átomos de cloro tiene tres posibles combinaciones de isótopos. Este patrón es evidente en el espectro de masas de CH 2 Cl 2 mostrado en la Figura\(\PageIndex{2}\). Se observan iones para\(\mathrm{CH}_{2}{ }^{35} \mathrm{Cl}_{2}^{+}\) at 84 m/z,\(\mathrm{CH}_{2}{ }^{35} \mathrm{Cl}^{37} \mathrm{Cl}^{+}\) at 86 m/z y\(\mathrm{CH}_{2}{ }^{37} \mathrm{Cl}_{2}^{+}\) at 88 m/z. Basado en la probabilidad de cada combinación de isótopos, la intensidad relativa de estos picos es\(10: 6: 1\). La relación de\(3: 1\) isótopos para un ion con un solo átomo de cloro se observa a 49 m/z y 51 m/z. Esto corresponde a\(\mathrm{CH}_{2}{ }^{35} \mathrm{Cl}^{+}\) y\(\mathrm{CH}_{2}{ }^{37} \mathrm{Cl}^{+}\) fragmentos formados por la pérdida\(\mathrm{Cl}\) del ion molecular. Un examen cuidadoso del espectro también muestra iones producidos por pérdida de H • y\(\mathrm{H}_{2}\).
Abundancia de isótopos de bromo
El bromo también tiene dos isótopos naturales, 79 Br es el más abundante y 81 Br tiene una abundancia relativa de 98% lo que resulta en una intensidad relativa para estos dos picos de 1:1. Esto se observa en el espectro de masas de bromobenceno mostrado en la Figura\(\PageIndex{3}\). El patrón de isótopos de bromo se observa en los picos a 156 m/z y 158 m/z que tienen la abundancia relativa 1:1 característica del bromo. Estos dos picos corresponden al ion molecular C 6 H 5 79 Br a 156 m/z y C 6 H 5 81 Br a 158 m/z. El pico base en este espectro es de pérdida de Br a la forma C 6 H 5 observada a 77 m/z.

Pico de isótopo de carbono 13
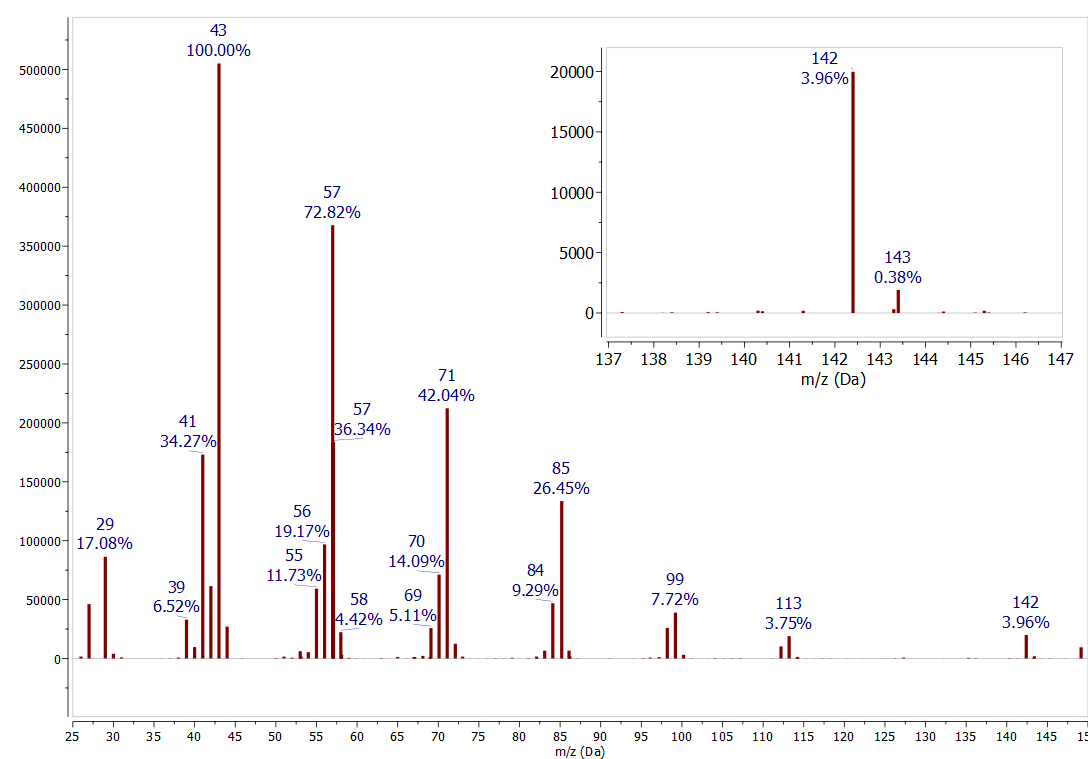
La abundancia natural\(1.1 \%\) de\({ }^{13} \mathrm{C}\) es otra herramienta útil para interpretar los espectros de masas. La abundancia de un pico un valor m/z mayor, donde un solo\({ }^{12} C\) es reemplazado por a\({ }^{13} C\), está determinada por el número de carbonos en el ión. La regla general para los compuestos pequeños es que cada átomo de carbono en el ion aumenta la abundancia del\(M+1\) pico por\(1 \%\). Este efecto se observa en todos los espectros discutidos en este trabajo. Por ejemplo, en el espectro de masas\(n\) -decano (Figura\(\PageIndex{4}\)) comparar el pico para\({ }^{12} \mathrm{C}_{9}{ }^{13} \mathrm{C}^{1} \mathrm{H}_{22}\) a 143 m/z (0.38% de abundancia relativa) con el pico para\({ }^{12} \mathrm{C}_{10}{ }^{1} \mathrm{H}_{22}\) a 142 m/z (3.96% relativo abundancia). La abundancia del\(13 \mathrm{C}\) pico es\(10 \%\) la abundancia del\({ }^{12} \mathrm{C}\) pico, consistente con un compuesto que contiene 10 átomos de carbono. Ahora mira algunos espectros anteriores para encontrar más ejemplos de este patrón. Tenga en cuenta que para compuestos con bajas abundancias de iones moleculares la incertidumbre en la medición de esta relación puede ser +/- varios átomos de carbono.
Abundancias de isótopos
Debido a que todos los átomos tienen varios isótopos naturales, los patrones discutidos aquí se vuelven más complejos. Afortunadamente, la mayoría de los elementos comunes en la espectrometría de masas orgánica tienen un isótopo predominante. La alta abundancia de los dos isótopos de cloro es inusual, por lo que son fáciles de identificar. Las abundancias relativas para isótopos de elementos frecuentemente encontrados se dan en la Tabla\(\PageIndex{1}\). Para las moléculas con patrones de isótopos más complejos hay una serie de programas y sitios web disponibles para modelar las distribuciones. La calculadora proporcionada por Scientific Instrument Services está disponible en: https://www.sisweb.com/mstools/isotope.htm.
| Atom | Isótopo A | Ístope A+1 | Isótopo A+2 | |||||
| masa | % | masa | % | masa | % | |||
| H | 1 | 100 | 2 | 0.015 | ||||
| C | 12 | 100 | 13 | 1.1 | ||||
| N | 14 | 100 | 15 | 0.37 | ||||
| O | 16 | 100 | 17 | 0.04 | 18 | 0.20 | ||
| F | 19 | 100 | ||||||
| Si | 28 | 100 | 29 | 5.1 | 30 | 3.4 | ||
| P | 31 | 100 | ||||||
| S | 32 | 100 | 33 | 0.80 | 34 | 4.4 | ||
| Cl | 35 | 100 | 37 | 32.5 | ||||
| Br | 79 | 100 | 81 | 98.0 | ||||
| I | 127 | 100 | ||||||


