Vacunación en enfermedades crónicas, inmunodeprimidos y trasplantes
Introducción
Gracias a los avances de la medicina en las últimas décadas, estamos asistiendo a un aumento de los pacientes con enfermedades crónicas, inmunodepresión, o que vayan a recibir un trasplante o lo hayan recibido, dado que los nuevos tratamientos han desencadenado un aumento de la supervivencia de estos pacientes. Además, existen más pacientes con enfermedades crónicas bajo tratamiento inmunosupresor que hace unos años, debido al auge de las terapias biológicas. Afortunadamente, en la actualidad, nacen menos niños con infección por el VIH en nuestro medio, gracias a las medidas de prevención de la transmisión vertical, y los existentes sobreviven con una aceptable calidad de vida y sin inmunodepresión.
Entre los cuidados de todos estos pacientes, se encuentra la optimización de la prevención de enfermedades infecciosas, fundamentalmente con unas estrategias de vacunación adaptadas específicamente para ellos. Asimismo, es muy importante que dicha optimización abarque a los convivientes y al entorno sanitario de estos pacientes, con el fin de disminuir al máximo la circulación de los virus y bacterias prevenibles con vacunas a su alrededor, haciendo especial énfasis en la vacunación frente a triple vírica, varicela y gripe.
Además, la vacunación de estos pacientes no solo busca su protección individual, sino que tiene un objetivo secundario no menos importante: el de impedir que se genere una bolsa de personas susceptibles que pueda dar lugar a brotes de enfermedades inmunoprevenibles.
Consideraciones, generalidades
Los niños con enfermedades crónicas o inmunodepresión tienen ciertas particularidades para la administración tanto de las vacunas sistemáticas, como no sistemáticas, que deben ser bien conocidas por todos los pediatras.
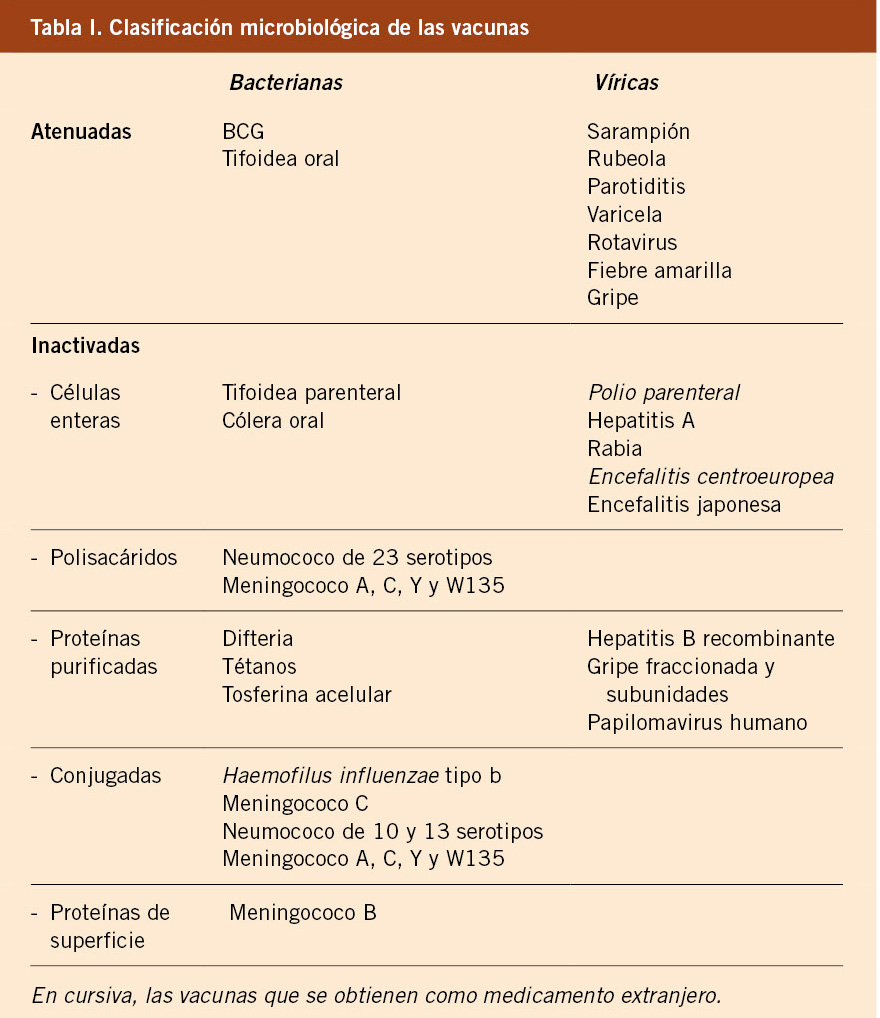
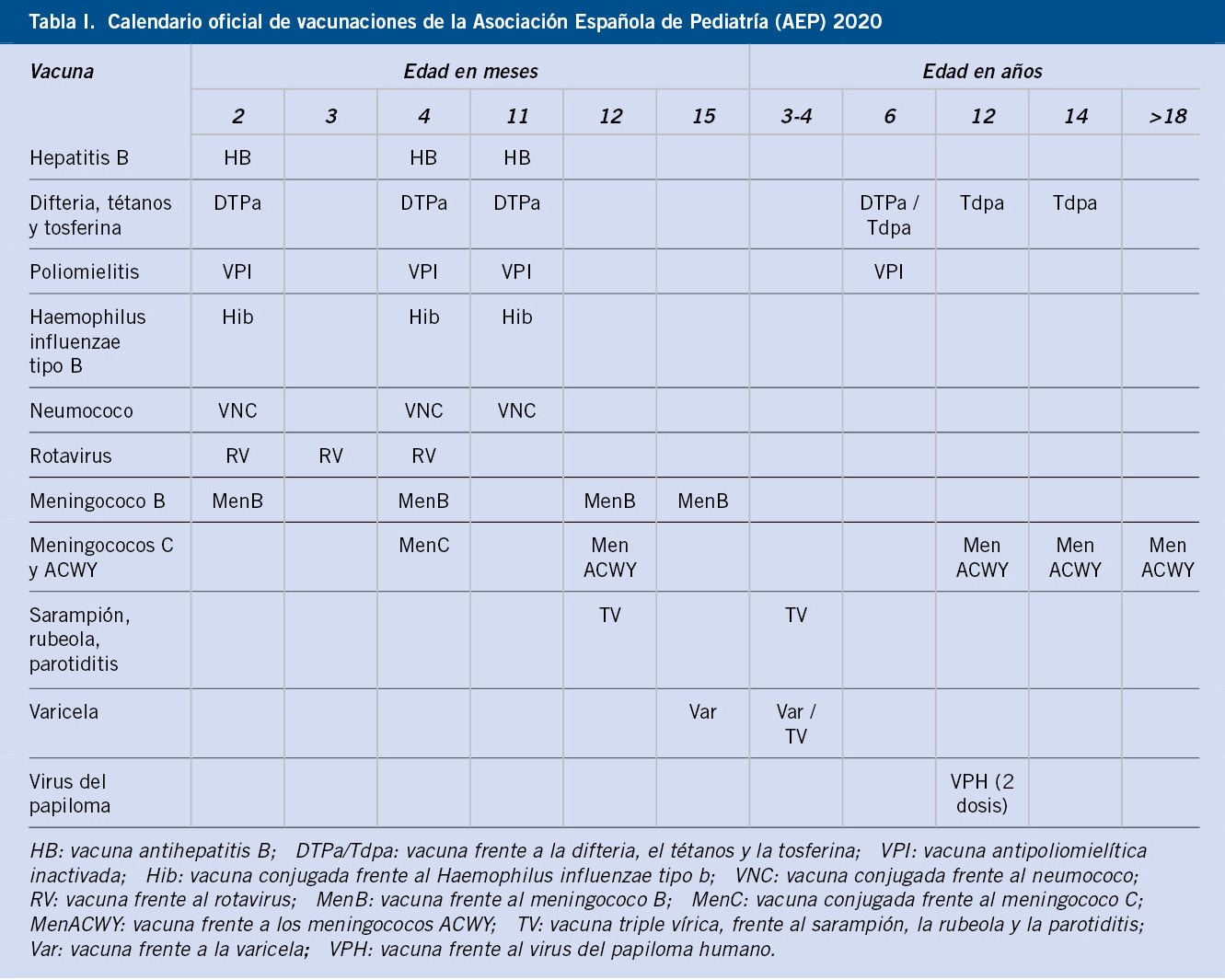
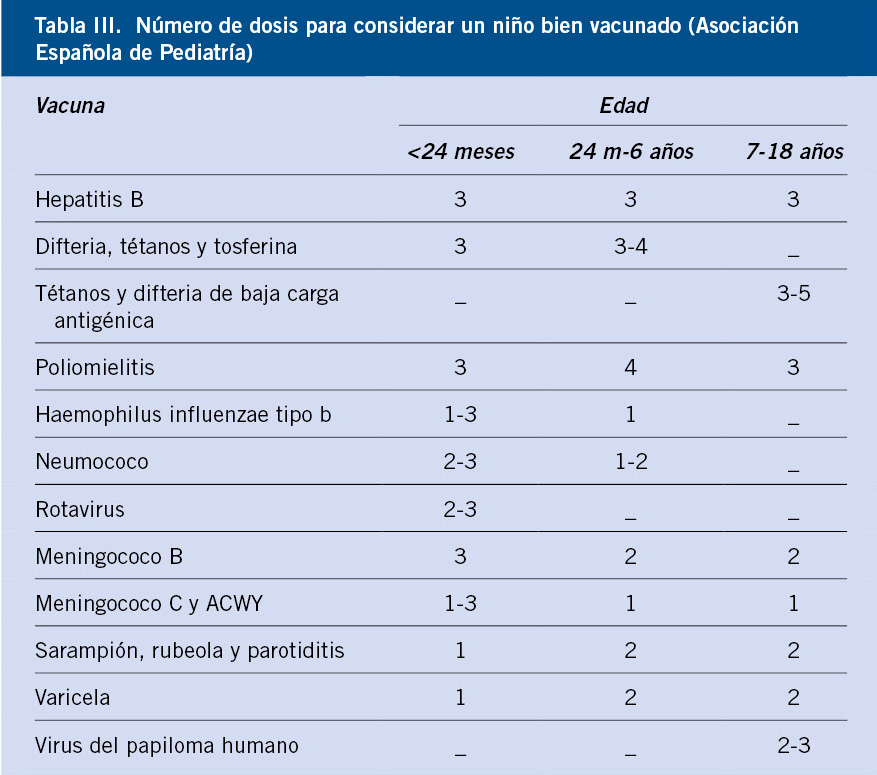
Salvo excepciones, que se especificarán en apartados específicos, la mayoría de estos pacientes deben seguir las recomendaciones oficiales de cada comunidad autónoma, no existiendo recomendaciones especiales en cuanto a vacunas frente a gérmenes como: difteria, tétanos, tosferina, poliomielitis, hepatitis B, meningococo C o Haemophilus influenzae tipo B. Se comentan a continuación algunos aspectos generales destacables.
Vacunación antineumocócica
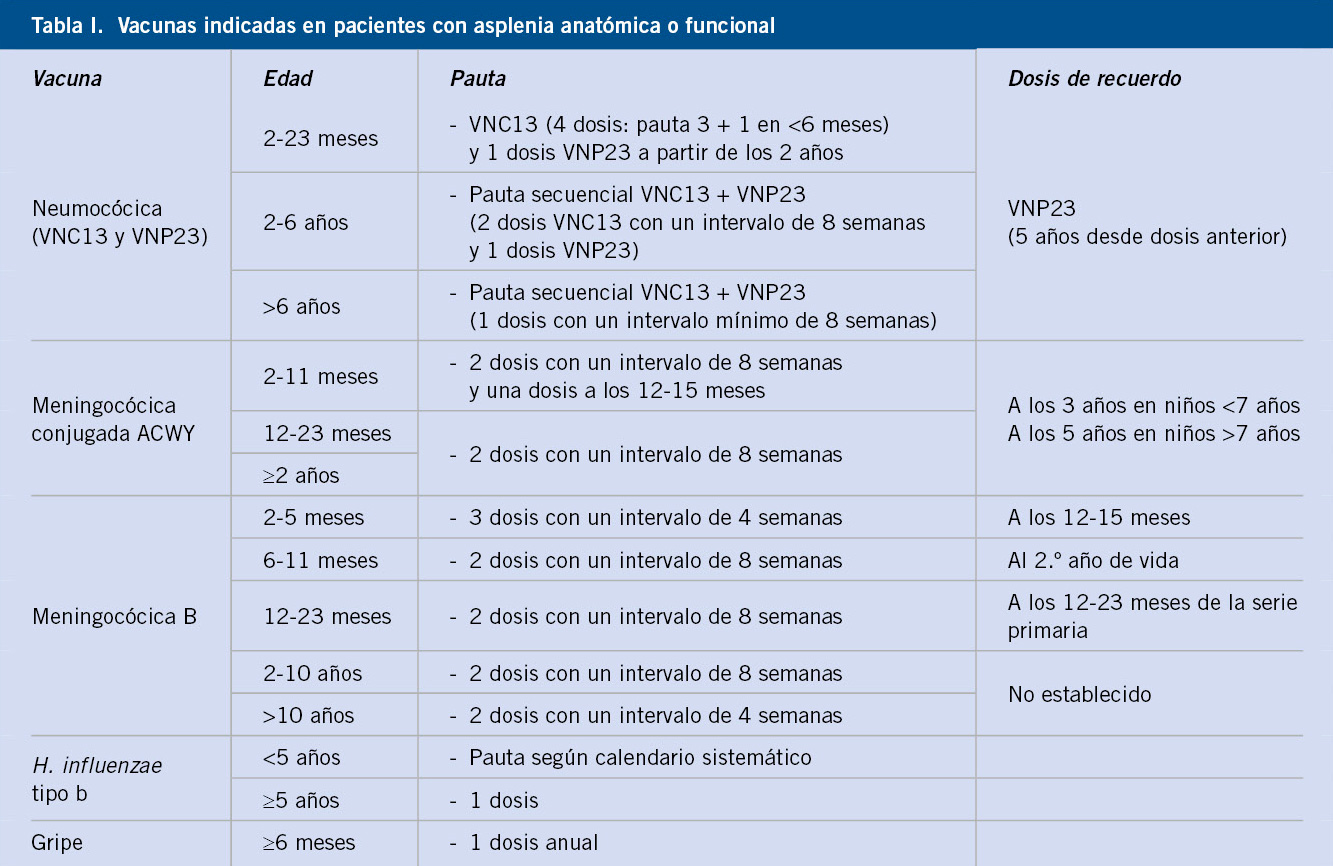
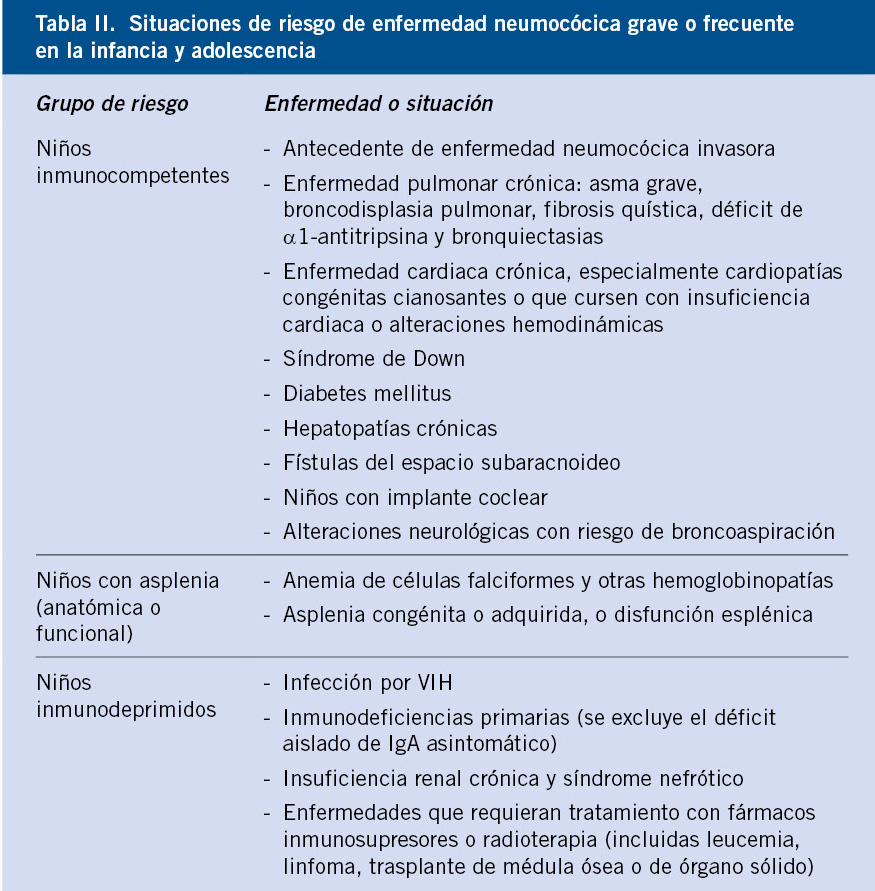
Todos estos pacientes deben estar correctamente vacunados frente al neumococo (Tabla I).
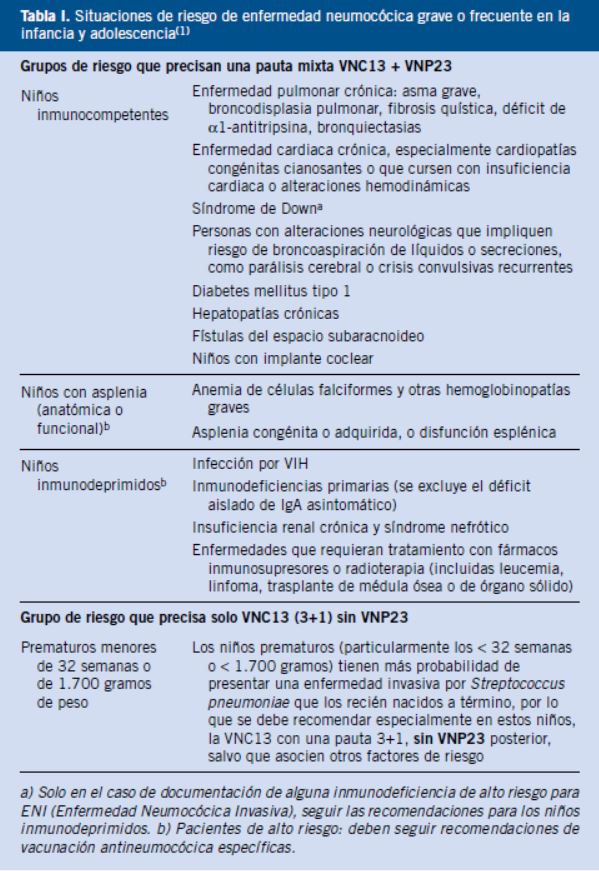
Dada la epidemiología actual de la enfermedad neumocócica invasora en nuestro medio, la vacuna recomendada es la vacuna conjugada tridecavalente (VNC13), ya que ofrece la cobertura más amplia de serotipos(1). En pacientes inmunodeprimidos y con riesgo elevado de padecer infecciones neumocócicas graves (Tabla I), se deben emplear pautas especiales, con esquemas mixtos, que incluyan la VNC13 y la vacuna neumocócica 23-valente de polisacáridos (VNP23) no conjugada(1,2). Esta vacuna VNP23, con mayor cobertura, pero mucho menos inmunógena que las conjugadas, solo puede administrarse a partir de los 24 meses de edad. En pacientes con enfermedades crónicas o inmunodepresión, a partir de esta edad, se recomienda la administración de esta vacuna, con un intervalo mínimo de 2 meses tras la última dosis de vacuna conjugada, lo que se llama vacunación antineumocócica secuencial(1,2):
• En los niños ≤ 5 años con inmunodepresión o con asplenia orgánica o funcional (anemia de células falciformes u otras hemoglobinopatías):
- Se deben emplear siempre esquemas 3+1 cuando se inicia la vacunación a los 2 meses con las otras vacunas del calendario.
- Es preceptivo que reciban 2 dosis de VNC13 si no han recibido en el primer año de vida, al menos, 2 dosis de esta vacuna.
- Los niños de 2-5 años de edad que no han recibido ninguna dosis de VNC13 deben recibir 2 dosis de esta vacuna separadas por un intervalo mínimo de, al menos, 2 meses.
- Una vez completada la inmunización con VNC13, los mayores de 2 años de edad deben recibir una dosis de VNP23, con un único refuerzo a los 5 años de esta dosis (no se administrarán más de dos dosis de VNP23 a lo largo de toda la vida).
• En los niños ≤ 5 años de riesgo (no inmunodeprimidos ni asplénicos, pero con riesgo de padecer infecciones neumocócicas más frecuentes o graves) (Tabla I), puede optarse por la pauta de los niños inmunodeprimidos o por la del calendario de vacunación sistemático, completándose la inmunización, cuando sean mayores de 2 años, con una sola dosis de VNP23 separada por un intervalo mínimo de 2 meses desde la última dosis de VNC13.
• En todos los niños de riesgo (Tabla I) de 6-17 años de edad:
- Administrar una dosis de VNC13.
- Aplicar una dosis de VNP23 separada por un intervalo mínimo de 2 meses de la dosis de VNC13.
- Solo en los inmunodeprimidos y asplénicos, se administrará una 2ª y última dosis de VNP23, 5 años después de la 1ª de VNP23.
Si se hubiese administrado VNP23 en primer lugar antes que VNC13, por el motivo que fuese, deben pasar, al menos, 2 meses desde la VNP23 para la administración de VNC13.
Si la primovacunación se produjo en situación de inmunodepresión, la revacunación debe ser considerada cuando se haya conseguido la reconstitución inmune.
Vacunación antigripal
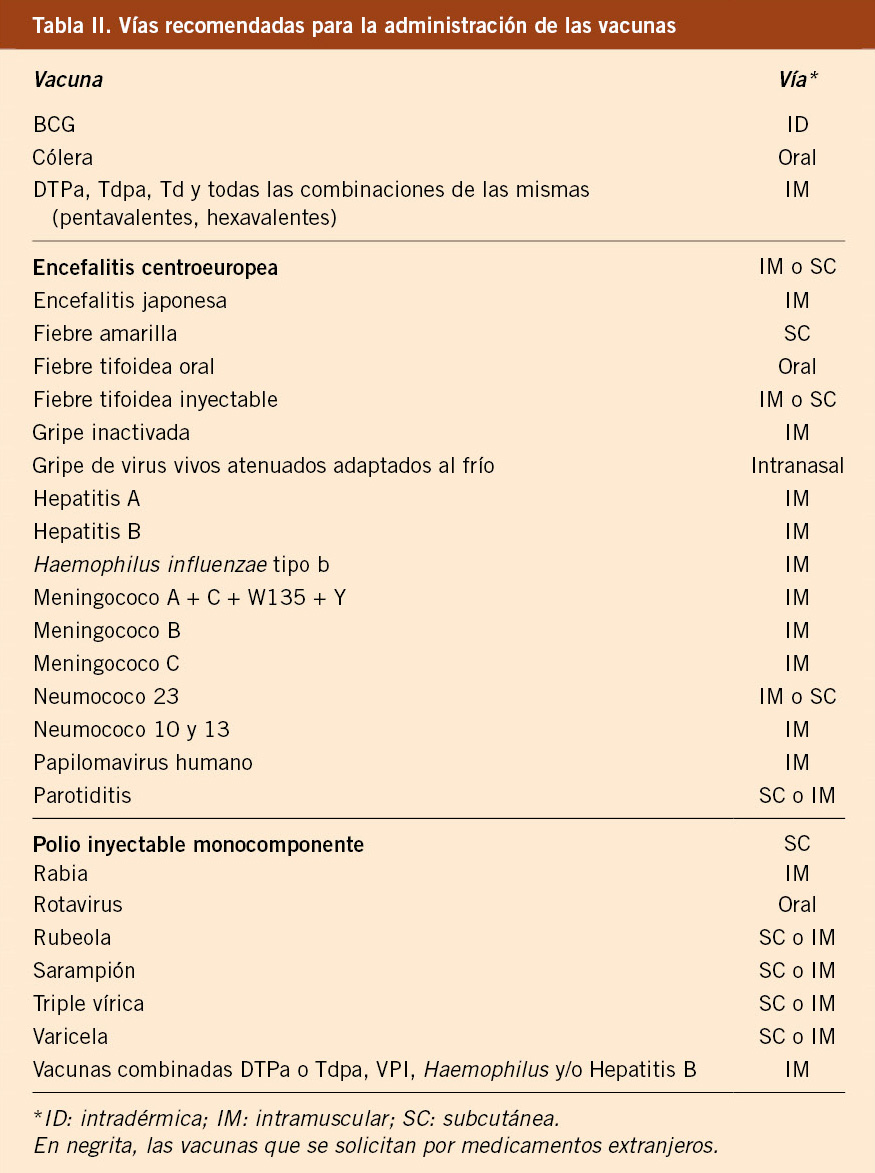
Se recomienda su empleo anual en todos los pacientes inmunodeprimidos y sus convivientes (así como cuidadores y sanitarios), siempre que tengan más de 6 meses de edad, con dos dosis separadas por 4-6 semanas el primer año, si tienen menos de 9 años de edad, y con una si es mayor de esta edad y, posteriormente, en dosis anual única antes del inicio de cada epidemia (Tabla II y III)(3). La vacunación de contactos domiciliarios cobra especial importancia si el paciente es menor de 6 meses y, por tanto, no puede ser vacunado(3,4).


Los preparados actualmente comercializados más empleados en nuestro medio, autorizados para niños a partir de 6 meses de edad, son las vacunas inactivadas de administración intramuscular. La inmunogenicidad que inducen estas vacunas es baja, sobre todo en niños pequeños, más si cabe si están inmunodeprimidos. Las vacunas tetravalentes pueden estar especialmente más indicadas en estos pacientes, para abarcar mayor cobertura.
En cuanto a la vacuna antigripal intranasal, aunque no hay datos suficientes en personas con enfermedades crónicas, se puede emplear en mayores de 24 meses, salvo en los siguientes casos: inmunodepresión, tratamiento crónico con salicilatos y asma grave con vigilancia activa(3). Mientras que no exista más información sobre la seguridad de la vacuna intranasal, en los pacientes con enfermedades crónicas, se prefiere las vacunas antigripales inactivadas.
La vacuna antigripal intranasal no está contraindicada en los convivientes de estos pacientes, pero los receptores de la vacuna deben intentar evitar, en lo posible, el contacto estrecho con personas gravemente inmunodeprimidas (p. ej., receptores de trasplantes de médula ósea que requieren aislamiento) durante 1-2 semanas después de la vacunación. La incidencia máxima de excreción del virus vacunal tiene lugar 2-3 días después de la vacunación en los estudios clínicos. En circunstancias en las que sea inevitable el contacto con personas gravemente inmunodeprimidas, el posible riesgo de transmisión del virus vacunal contra la gripe debe evaluarse frente al riesgo de adquirir y transmitir cepas salvajes del virus influenza. Se recuerda que para la EMA (European Medicines Agency) la edad autorizada es de 2 a 18 años, y para la FDA (Food and Drug Administration) de 2 a 49 años.
Vacunación frente a varicela y triple vírica
Para obtener una correcta protección, son necesarias 2 dosis, a los 12-15 meses y a los 2-3 años de edad (preferiblemente a los 2 años)(1). Se debe hacer coincidir ambas vacunas el mismo día y, si no es posible, debe respetarse un intervalo mínimo de un mes. En pacientes en los que fuera preciso adquirir una inmunidad adecuada lo antes posible (p. ej.: infección por el VIH con CD4 >15%, situación pretrasplante), puede adelantarse la segunda dosis, con un intervalo mínimo entre dosis de 1 a 3 meses(5). En algunos pacientes inmunodeprimidos están contraindicadas, especificándose en un apartado específico más adelante.
En cuanto a los convivientes, es imperioso conocer si han pasado estas infecciones o están correctamente vacunados, para actualizar su calendario si es necesario. Está especialmente indicado realizar este esfuerzo en convivientes de niños que no pueden vacunarse con estas vacunas atenuadas, como son aquellos con inmunodepresión grave por: inmunodeficiencia congénita, infección VIH, leucemia, linfoma, trasplante, tratamientos inmunosupresores o tratamiento prolongado con ácido acetil-salicílico (este último caso, en relación a la varicela)(4).
Vacunas frente al papilomavirus humano
Los pacientes inmunodeprimidos que se infectan por el VPH tienen un riesgo mucho más elevado (entre 20 y 100 veces más) de padecer cáncer cervical y ano-genital que la población general, por lo que la vacunación estaría indicada en todos ellos.
Son vacunas inactivadas, por lo que no plantean ningún problema de seguridad. Actualmente, existen dos preparados, uno bivalente (Cervarix®, serotipos 16 y 18) y otro tetravalente (Gardasil®, 6, 11, 16 y 18). Actualmente, la vacunación se realiza a los 12 años en las CC.AA.(6). Se recomienda un rescate para todas las adolescentes no vacunadas, entre 13 y 26 años, aunque el nivel de protección alcanzado se va a relacionar con el grado de inmunodepresión. La vacuna tetravalente ya está autorizada en varones para la prevención de verrugas genitales, lesiones anales precancerosas y cáncer anal(1), pero no se conoce el papel que puede ofrecer en pacientes inmunodeprimidos.
El esquema recomendado es de tres dosis (0, 1-2 y 6 meses), a pesar de que en niñas adolescentes sanas ya se ha aprobado el esquema de 2 dosis para ambas vacunas. Organismos como la OMS o el CDC continúan recomendando 3 dosis para este tipo de pacientes hasta tener más datos(8). No se sabe, si como sucede con otras vacunas, puede ser útil administrar dosis extra de refuerzo para paliar la posible pérdida de anticuerpos.
Vacunación frente a la hepatitis A
Existen vacunas pediátricas monocomponentes (Havrix 720®, Vaqta 25®) y pediátrica combinada de hepatitis A y B (Twinrix pediátrico®). La edad mínima autorizada para su administración son los 12 meses de edad. El esquema vacunal completo con vacuna monocomponente es de 2 dosis, con una separación de, al menos, 6 meses(1).
Si se utiliza la vacuna combinada de hepatitis A y B, se administrarán tres dosis (0, 1 y 6 meses). También puede realizarse una pauta rápida de cuatro dosis (0, 7, 21-30 días y 12 meses), especialmente indicada si urge una protección acelerada para hepatitis B. La presentación de adultos es la ideal, pues lleva mayor concentración de antígeno del VHB y consigue una mejor respuesta inmune.
Los pacientes a los que se pretende proteger especialmente, así como a sus convivientes, son: pacientes con infección por hepatitis B o C, enfermedad hepática crónica, tratamientos con fármacos hepatotóxicos, insuficiencia renal crónica en programa de diálisis, candidatos y receptores de trasplante de órganos sólidos, síndrome de Down, hemofilia en tratamiento con hemoderivados e infección por VIH(4).
Vacunación frente al rotavirus
Se trata de una vacuna de virus vivos atenuados para administración por vía oral. Actualmente, solo se encuentra disponible en nuestro medio la vacuna pentavalente RotaTeq®. Solo es posible su aplicación en las primeras 32 semanas de vida, siempre la primera dosis antes de las 12 semanas de vida. Aquellos pacientes que se encuentren en situación de inmunodepresión conocida ya a esta corta edad, no deben ser vacunados por precaución.
Sí la pueden recibir los convivientes lactantes de los inmunodeprimidos, teniendo la precaución de que estos no manipulen las heces del vacunado durante las 4 semanas siguientes a la vacunación, sobre todo, tras la primera dosis(7).
Vacunación antimeningocócica C
En todos los niños inmunodeprimidos, se recomienda la vacunación frente al meningococo con las vacunas conjugadas de meningococo C, según la pauta de calendario de cada CC.AA., con un refuerzo a los 12 años de edad(6).
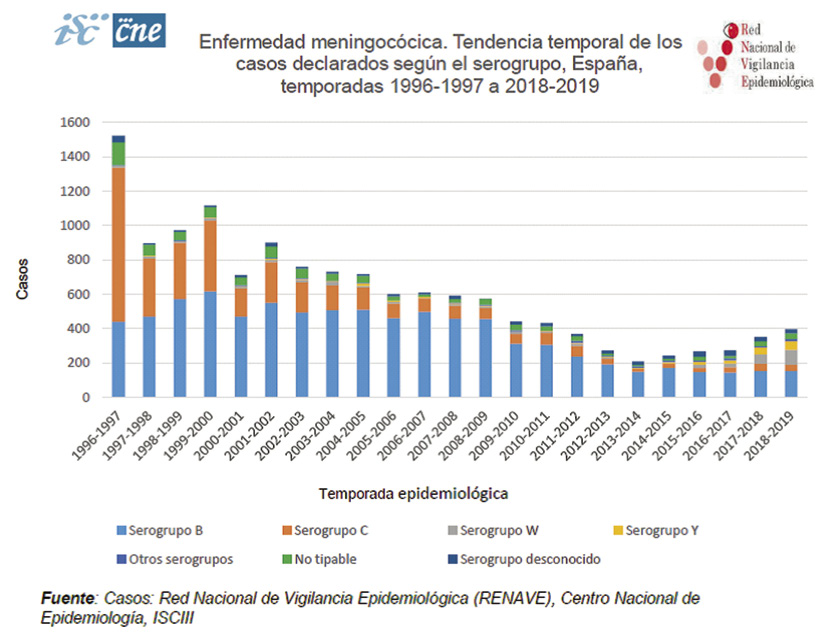
El ACIP (Advisory Committee on Immunization Practices) recomienda que todos los niños de riesgo, entre los que se encuentran todos los niños inmunodeprimidos, reciban dos dosis de una vacuna meningocócica conjugada tetravalente entre los 2 y los 55 años de edad(9). En España, la gran mayoría de los casos de enfermedad meningocócica está producida por los grupos C y B y un número muy escaso por el grupo Y. Por tanto, la recomendación del ACIP no es extrapolable a nuestro país, donde existe la vacunación universal frente al meningococo C. Sin embargo, en los niños inmunodeprimidos es recomendable, al menos, una dosis de la vacuna meningocócica tetravalente a partir de los 2 años de edad. En los niños con deficiencias del complemento, asplénicos, que presentan una mayor proporción de enfermedad meningocócica y, en general, aquellos niños que pueden viajar a zonas endémicas de estos otros serogrupos, puede incluso ser aconsejable sustituir la dosis de vacuna conjugada frente al meningococo C, contemplada en la adolescencia en los calendarios, por una dosis de vacuna meningocócica conjugada tetravalente(1).
Vacunación antimeningocócica B
Como en cualquier niño sano a partir de los 2 meses de edad, se recomienda esta vacunación(1). Pero al igual que se ha comentado en el apartado anterior, está especialmente indicada en niños con asplenia anatómica o funcional y en aquellos con déficit de complemento, aunque no existen datos de inmunogenicidad y seguridad en pacientes de este tipo ni otros inmunodeprimidos(10).
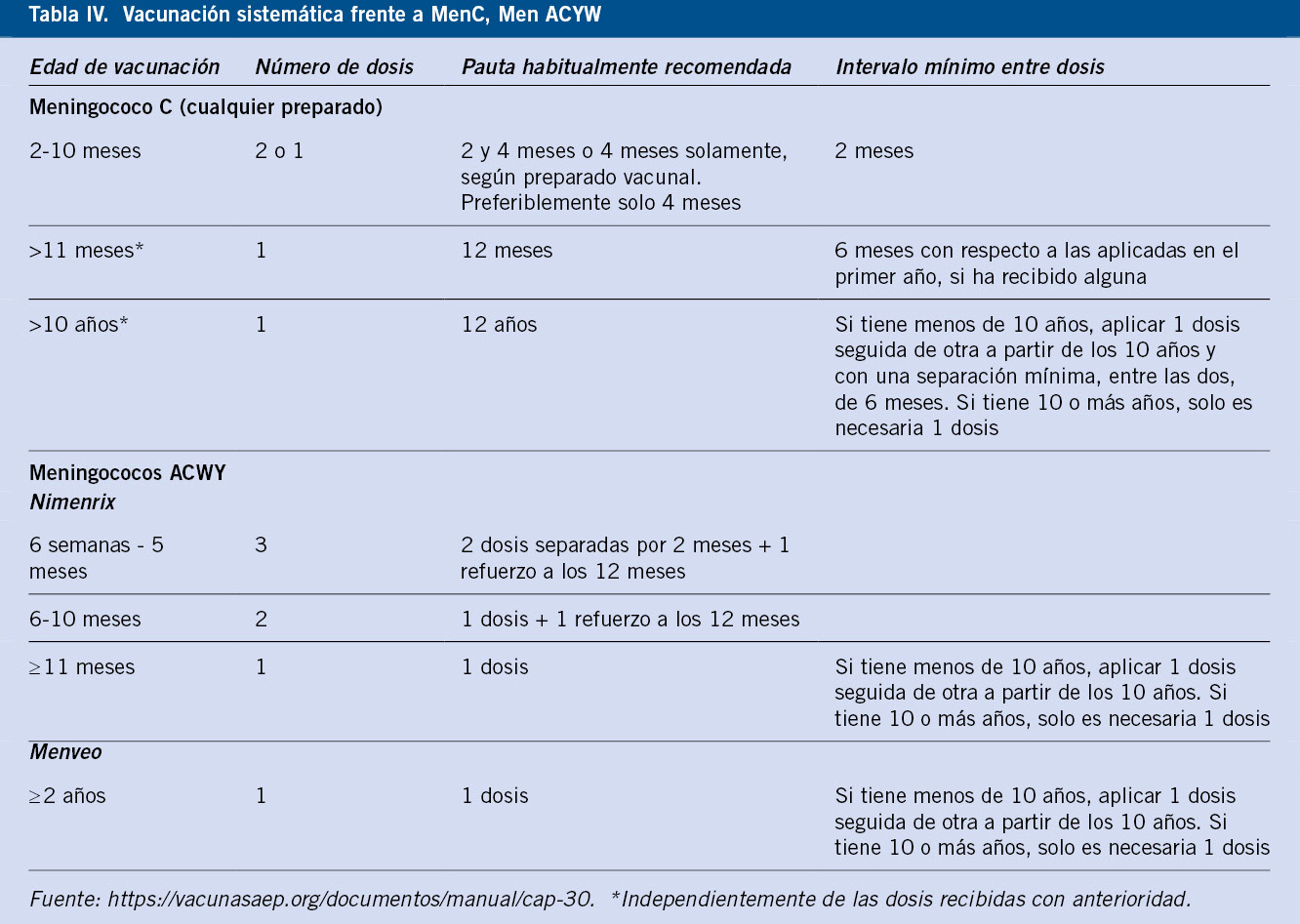
La posología es igual que en el niño sano (Tabla IV).

Vacunación en niños con enfermedades crónicas
Los enfermos crónicos y sus convivientes deben cumplir unos calendarios de vacunaciones optimizados, ya que presentan mayor riesgo de padecer formas graves de la mayoría de las enfermedades inmunoprevenibles. Por diferentes motivos, en numerosas ocasiones, estos pacientes se hayan infravacunados y en riesgo, por lo que se deben realizar esfuerzos para evitar estas situaciones.
Este apartado abarca aquellas enfermedades crónicas que de por sí, sin influencia de una posible inmunodepresión asociada, precisa un asesoramiento especial y optimización en el ámbito de las inmunizaciones. Esto es muy difícil en numerosas ocasiones, ya que las reagudizaciones y los episodios intercurrentes pueden entorpecer algunas dosis y retrasar las pautas recomendadas. Es muy importante aprovechar los momentos de estabilidad clínica para completar y actualizar los calendarios de vacunaciones. Habitualmente, la desinformación y los miedos de los padres y, a veces, de los propios pediatras, así como el descuido y otros factores, contribuyen a la infravacunación de estos pacientes.
El padecimiento de cualquier enfermedad inmunoprevenible puede desestabilizar al paciente con una enfermedad crónica, incluso de forma grave y letal, con mayor frecuencia que a individuos sanos. Por ejemplo, según un estudio publicado, el riesgo de padecer una enfermedad neumocócica invasora es 2,4 veces mayor (IC95%: 2,0-2,9) en niños con enfermedades crónicas que en niños sanos. Y, en otros estudios, se observa un riesgo de padecer una infección grave por influenza de 2 a 4 veces superior en niños pertenecientes algunos de los grupos de riesgo clásicos(11).
La mayoría de estos pacientes, si no están inmunodeprimidos, pueden recibir todas las vacunas oficiales del calendario de su Comunidad Autónoma. Asimismo, de forma general, se recomienda que estén adecuadamente inmunizados con las siguientes vacunas: antineumocócica secuencial; antigripal anual; frente a varicela, con dos dosis; antimeningocócica B; rotavirus, si no existe ninguna malformación digestiva que pueda predisponer a invaginación; y hepatitis A en caso de hepatopatía o administración crónica de fármacos con potencial hepatotóxico.
Finalmente, debe considerarse siempre la optimización de la vacunación en convivientes de enfermos crónicos, tanto de las vacunas incluidas en el calendario oficial como otras no sistemáticas, como gripe y varicela. Esta es una forma muy eficaz de protección indirecta de los niños inmunodeprimidos y de los que padecen enfermedades crónicas.
Recomendaciones específicas según tipo de enfermedad crónica
Enfermedades cardíacas, broncopulmonares y renales
Se incluyen aquellos pacientes con patologías graves como, por ejemplo: cardiopatía cianosante, fibrosis quística, asma moderado-grave, síndrome nefrótico y, en general, todos aquellos con malnutrición moderada-grave.
Se recomienda vacunación antigripal anual a partir de los 6 meses de vida (Tablas II y III), así como la vacunación antineumocócica secuencial (ver Vacunación antineumocócica). También se recomiendan triple vírica y varicela (preferiblemente el mismo día) a partir de los 12 meses de edad, con dos dosis, si no están inmunosuprimidos(12). En pacientes con nefropatía sometidos a hemodiálisis, es fundamental asegurar la protección frente a hepatitis B, por lo que deben hacerse controles serológicos y revacunación si es necesario(12).
Enfermedad hepática crónica
Al calendario oficial, debe sumarse la vacunación antigripal anual desde los 6 meses de vida y la vacunación antineumocócica secuencial. Si no están inmunosuprimidos, deben recibir vacunas vivas (triple vírica, varicela). De forma específica, estos pacientes, como aquellos con hepatitis B o C o bien con trasplante hepático, deben ser vacunados frente a hepatitis A (ver Vacunación frente a la hepatitis A). Todos estos pacientes no tienen mayor riesgo de infectarse por este virus, pero sí tienen un alto riesgo de desarrollar una hepatitis grave si se infectan.
En estos pacientes, es importante ver la respuesta a la vacuna de la hepatitis B. Solo se considerará fiable el resultado de los anti-HBs si se efectúa 1-2 meses después de la dosis final de la pauta (en hijos de madres HBsAg positivas, nunca antes de los 9 meses de edad y junto con la determinación de HBsAg). Si no hay respuesta (anti-HBs < 10 mUI/ml), se recomienda una nueva serie completa de 3 dosis con la pauta habitual (0, 1 y 6 meses) y, si la determinación posterior de anti-HBs, 1-2 meses después persistiese negativa (< 10 mUI/ml), deberán ser considerados finalmente como no respondedores a la vacunación frente a la hepatitis B y no debe aplicárseles más dosis. Estos pacientes, en caso de exponerse a un riesgo de infección, deberán recibir inmunoglobulina específica antihepatitis B(1,12).
Enfermedades neurológicas
Al calendario oficial, debe sumarse la vacunación antigripal anual desde los 6 meses de vida y la vacunación antineumocócica secuencial. Deben vacunarse frente a hepatitis A si toman fármacos hepatotóxicos, como el ácido valproico (ver Vacunación frente a la hepatitis A).
En presencia de una enfermedad neurológica evolutiva, inestable o no filiada, es recomendable retrasar las vacunas que pudieran desestabilizar la enfermedad, como las vacunas con componente pertúsico, hasta que el paciente esté estable o con un diagnóstico definitivo. En niños epilépticos, en principio, no está contraindicada ninguna vacuna. Aunque la vacunación con DTPa, y más raramente triple vírica o varicela, puede aumentar el riesgo de convulsiones, estas son autolimitadas, asociadas a fiebre y no dejan secuelas. De todos modos, el empleo de vacuna pertúsica acelular en vez de los preparados de células enteras, ha disminuido enormemente la incidencia de convulsiones febriles asociadas a la DTP. En niños que padecieron una encefalopatía aguda, con secuelas permanentes en los 7 días posteriores a una vacunación frente a tosferina, está contraindicada la administración de nuevas dosis del mismo preparado o equivalentes(12).
En niños que hayan sufrido una enfermedad neurológica inflamatoria autoinmune (por ejemplo: encefalomielitis, síndrome de Guillain-Barré) en la que exista una sospecha razonable relacionada con alguna vacuna, se debería prescindir de administrar nuevas dosis.
Enfermedades cutáneo-mucosas crónicas
Se incluyen enfermedades como: dermatitis atópica moderada-grave, epidermolisis ampollosa, mastocitosis, acrodermatitis enteropática, etc. No existe ninguna contraindicación en cuanto al calendario oficial habitual, salvo que estén inmunocomprometidos de forma importante, debiéndose evitar las vacunas vivas.
En cuanto a otros inmunosupresores tópicos (tacrolimus y pimecrolimus), se deben realizar las siguientes consideraciones. Existen escasos datos de inmunogenicidad y seguridad de las vacunas en pacientes tratados con estos fármacos. Con tacrolimus, hay estudios en los que se evidencia que no existen problemas de seguridad ni de respuesta inmunitaria con vacunas inactivadas, pero no existen datos con vacunas atenuadas(12). A pesar de ello, en la ficha técnica recientemente actualizada en 2012, no se realiza ninguna advertencia especial en relación a vacunas en estos pacientes. En cambio, con pimecrolimus, se advierte en la ficha técnica aún, que ante la falta de datos, en pacientes con afectación cutánea extensa en tratamiento, se vacune mejor en periodos sin tratamiento(12).
Se recomienda, si no existe contraindicación, la vacunación frente a la varicela, con 2 dosis, administrándose la primera a partir de los 12 meses de vida(12). Aunque la segunda dosis suele administrarse a los 2-3 años de edad, puede adelantarse en estos casos incluso con un intervalo de un mes (idealmente 3 meses) con la primera dosis(12). En caso de exantema florido tras la vacuna de la varicela, puede tratarse con aciclovir.
Genéticas (incluido síndrome de Down)
En general, estos pacientes, deben recibir todas las vacunas indicadas en el calendario infantil. Además, está recomendada la vacunación antigripal anual a partir de los 6 meses de vida, la vacunación frente a hepatitis A y la vacunación antineumocócica secuencial. Estos niños presentan un riesgo incrementado de infecciones respiratorias de vías altas y bajas, incluido otitis media y neumonía, así como un mayor riesgo de gravedad. Si existe una inmunodeficiencia celular confirmada, estarían contraindicadas las vacunas atenuadas.
Hay recomendaciones específicas recientes sobre vacunación en niños con síndrome de Down(13).
Hemoglobinopatías
Además de seguir el calendario oficial, es fundamental asegurar la vacunación frente a neumococo de forma secuencial. Debido a que algunos pacientes proceden de países con calendarios diferentes a los existentes en España, es imprescindible la actualización del calendario incluyendo vacunas contra Haemophilus influenzae tipo b, así como meningococo B y C. También se recomienda vacunación antigripal anual a partir de los 6 meses de vida, frente a varicela según pauta estándar, y si existe hepatopatía, hepatitis A a partir de los 12 meses de vida(12).
Las formas heterocigotas asintomáticas de las hemoglobinopatías más frecuentes en nuestro medio, como la beta talasemia minor y la presencia del rasgo falciforme, no suponen inmunosupresión, por lo que sus portadores deberán recibir la misma pauta de vacunaciones que la población general(12).
Endocrinopatías y enfermedades metabólicas
Al calendario oficial, debe añadirse la vacunación antigripal anual desde los 6 meses de vida. La obesidad mórbida es una indicación para esta inmunización anual. Está indicada la vacunación antineumocócica secuencial y la vacunación frente a varicela y hepatitis A.
Implante coclear
Estos pacientes tienen un riesgo incrementado de padecer meningitis y otitis media. Por ello, está especialmente recomendada la vacunación antineumocócica secuencial, así como las vacunas frente al Hib y la antigripal. Solo deben recibir una única dosis de VNP23 a lo largo de su vida.
Enfermedades inflamatorias crónicas
Se incluyen en este apartado aquellas personas con enfermedades reumáticas (artritis idiopática juvenil, lupus, etc.), enfermedad inflamatoria intestinal (enfermedad de Crohn, colitis ulcerosa) y enfermedades cutáneas crónicas, muchas de ellas con tratamiento inmunosupresor. Ver más adelante, en apartado de inmunosupresores.
Tratamiento crónico con salicilatos
Estos pacientes que reciben habitualmente dosis bajas de ácido acetil-salicílico no tienen por qué tener un riesgo especial de sangrado/hematoma después de las inyecciones. Deben seguir el calendario sin modificaciones. Sin embargo, se deben realizar unas consideraciones sobre la vacunación antigripal y frente a la varicela:
• Se recomienda la vacunación antigripal anual a partir de los 6 meses de vida, para disminuir el riesgo de síndrome de Reye. No deben recibir la vacuna antigripal atenuada intranasal, dado el hipotético riesgo de este síndrome. Por otro lado, en un paciente que hubiese recibido esta vacuna, se deben esperar 4 semanas para poder iniciar el tratamiento con salicilatos.
• Debe considerarse la vacunación frente a la varicela, a pesar de ser una contraindicación, para evitar el padecimiento de varicela salvaje, ya que esta afecta prácticamente de forma universal a casi todos los niños no vacunados durante los primeros 10 años de vida. En aquellos casos en los que se pudiera suspender transitoriamente el ácido acetil salicílico, podría evitarse este hasta 6 semanas después de la administración de la vacuna frente a la varicela. Si esto no fuera posible, se puede vacunar, realizando seguimiento estrecho del paciente.
Inmunodeficiencias primarias (IDP)
En niños con inmunodeficiencias primarias en tratamiento con inmunoglobulina intravenosa polivalente periódica (IGIV), se recomienda la administración de vacunas inactivadas para aumentar los niveles de protección a través de la respuesta celular.
Las IDP representan un grupo muy heterogéneo en relación a la susceptibilidad a infecciones, así como en la respuesta a las inmunizaciones. Por tanto, la eficacia, seguridad y contraindicaciones de las diferentes vacunas dependerán del tipo y del grado de inmunosupresión de cada entidad, así como del tipo de vacuna (Tabla V).

Como aspectos generales, destacar:
- Aunque algunas guías no lo recomiendan por falta de evidencia, en aquellas IDP en las que está indicado el tratamiento sustitutivo con IGIV, a pesar del efecto protector de esta frente a ciertas enfermedades inmunoprevenibles, se recomienda el empleo de vacunas inactivadas, porque son seguras y con el fin de optimizar la protección a través de la respuesta celular(14).
- En pacientes que reciben IGIV no se recomienda la determinación de anticuerpos posvacunales, dado que la inmunoglobulina polivalente tiene una gran variedad de anticuerpos específicos, por lo que su presencia en el suero de las personas que reciben estos preparados no puede ser atribuida a la inmunogenicidad de la vacuna(15).
Inmunodeficiencias humorales (IH)
No todas las entidades incluidas en este grupo comportan el mismo tipo o grado de inmunosupresión; por ello, cada grupo tendrá unas consideraciones específicas (Tabla V). Las vacunas inactivadas son seguras y están recomendadas en estos pacientes, incluso en las más graves, ya que aunque produzcan una deficiente o nula respuesta humoral, son capaces de inducir respuestas celulares que pueden resultar parcialmente protectoras(14,15). En los casos en los que esté indicado el tratamiento con IGIV, estas vacunas inactivadas pueden administrarse en cualquier momento: antes, simultáneamente o después de la administración de IGIV.
En cuanto a las vacunas de virus vivos, parecen ser seguras, pero no se administran habitualmente por la interferencia con la IGIV que en algunos pacientes se emplea. En el caso de que se decida la administración de estas vacunas para obtener el beneficio de la respuesta celular, se recomiendan cuando la cifra de inmunoglobulinas séricas se encuentre en valle; es decir, unos días antes de la siguiente dosis de IGIV, para minimizar la interferencia(14,16).
El resto de vacunas de los calendarios oficiales pueden administrarse en estos pacientes sin problemas, haciéndose especial hincapié en la vacuna antigripal, así como antineumocócica, tanto conjugada como no conjugada. El déficit de IgA no representa actualmente un factor de riesgo extra para la enfermedad neumocócica invasiva(16).
Inmunodeficiencias celulares o combinadas
Las vacunas inactivadas oficiales pueden ser administradas, dado el alto riesgo de adquirir la enfermedad y desarrollar complicaciones, a pesar de que no se dispongan de datos de inmunogenicidad ni de seguridad (Tabla V). Se recomienda vacunación antineumocócica secuencial y antigripal anual(16).
En estos pacientes están contraindicadas todas las vacunas vivas por el alto riesgo de producirse enfermedad diseminada. Respecto a la vacuna frente al rotavirus, se han notificado casos de gastroenteritis asociada con el virus de la vacuna en niños con inmunodeficiencia combinada grave en la fase postcomercialización(17), incluso infecciones crónicas por virus vacunal(18). En algunos defectos parciales de células CD4, como el síndrome de Di George, se debe considerar la vacunación con TV y varicela, ya que el beneficio supera al riesgo de contraer la enfermedad en casos con inmunodeficiencia leve-moderada, como se ha observado en algún estudio(19).
Defectos de la fagocitosis
Estas IDP se caracterizan por mayor susceptibilidad a infecciones bacterianas y fúngicas. Pueden administrarse tanto vacunas inactivadas como vacunas vivas. Se recomienda vacunación antineumocócica secuencial y antigripal. Está especialmente indicada la vacuna frente a varicela por la posibilidad de complicaciones bacterianas asociadas (sobre todo, por S. pyogenes y S. aureus). La única contraindicación la constituyen las vacunas de bacterias vivas atenuadas: fiebre tifoidea oral y principalmente BCG, ya que hay casos descritos de diseminación en pacientes con enfermedad granulomatosa crónica.
Deficiencia del complemento
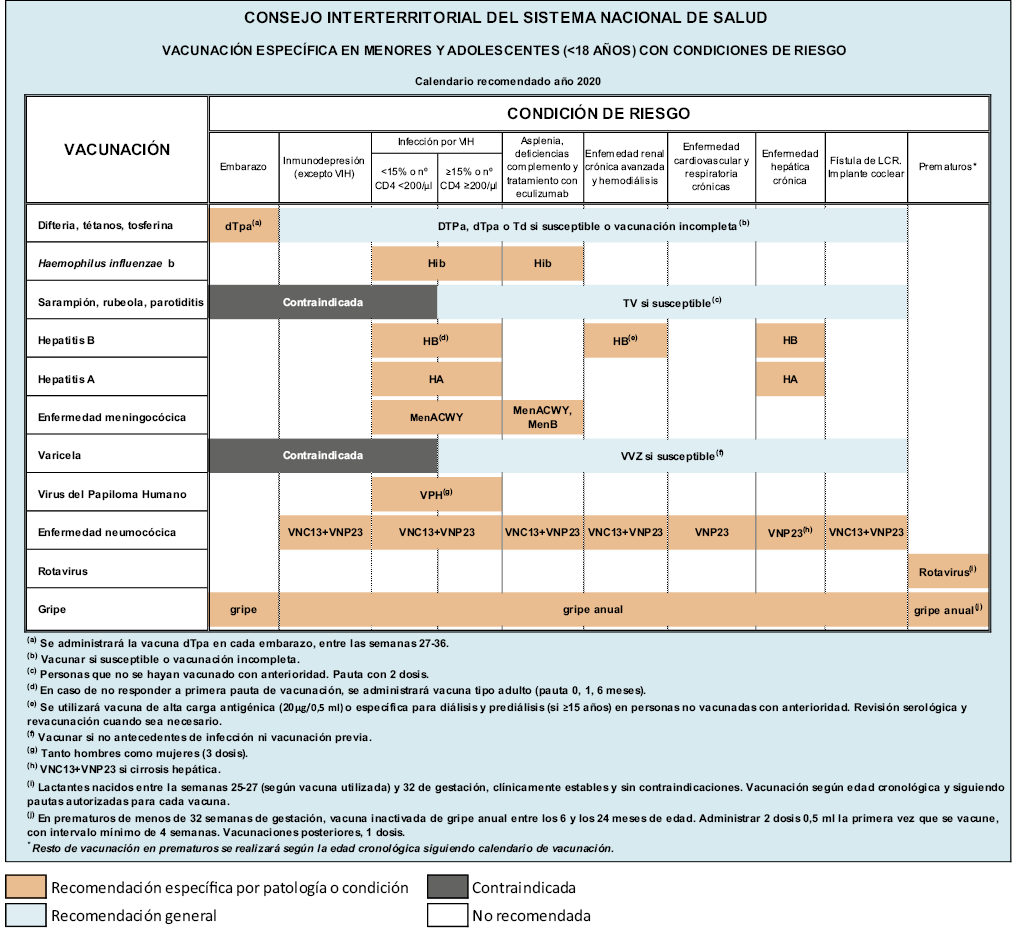
Los pacientes con deficiencia de complemento se asocian con riesgo aumentado de infecciones por bacterias capsuladas, especialmente meningococo. Se recomienda vacunación frente a meningococo B y C, así como la administración de, al menos, una dosis de la vacuna meningocócica conjugada tetravalente (A, C, Y, W135). Actualmente, se encuentra entre los grupos de financiación de vacunación frente al meningococo B, según las recomendaciones del Ministerio de Sanidad(10). Se recomienda protección antineumocócica con esquema secuencial, así como frente a Haemophilus influenzae tipo b y gripe. No existe contraindicación para ningún tipo de vacuna.
Asplenia/hipoesplenia
Estos pacientes pueden presentar esta situación de forma congénita o adquirida. Presentan un riesgo aumentado de padecer infecciones graves, especialmente por bacterias capsuladas, sobre todo, en los primeros 5 años de vida(16). De ahí, la importancia de la vacunación frente a neumococo (secuencial), Haemophilus influenzae tipo b y meningococo B y C. Actualmente, al igual que el déficit de complemento, se encuentra entre los grupos de financiación de vacunación frente al meningococo B, según las recomendaciones del Ministerio de Sanidad(10). Si es posible, ante una esplenectomía programada, debe asegurase la inmunización correcta, al menos, 2 semanas antes de la intervención(2). Debe asegurarse la vacunación frente a la gripe anual y frente a la varicela, ya que ambas son predisponentes de infecciones bacterianas.
En estos pacientes, no existe ninguna contraindicación vacunal especial, como: rotavirus, varicela, triple vírica, hepatitis A o papilomavirus(2). Tampoco para otras vacunas necesarias en caso de viajes a zonas endémicas (cólera, fiebre tifoidea, fiebre amarilla…).
Debe recordarse que, además de la optimización vacunal comentada, deben seguir profilaxis diaria con penicilina o amoxicilina orales.
Infección por el VIH
La mayoría de los niños con VIH en nuestro medio están bien controlados y en buenas condiciones inmunitarias, por lo que pueden recibir todas las vacunas oficiales y las no sistemáticas.
En niños infectados por el VIH, el riesgo de desarrollar enfermedades infecciosas prevenibles está ligeramente aumentado, a pesar del buen control actual que presentan estos pacientes con el tratamiento antirretroviral, por lo que se recomienda un calendario vacunal ampliado. Se recomienda la vacunación antineumocócica secuencial y antigripal anual. En cuanto a la administración de vacunas vivas, como triple vírica y varicela, se pueden administrar si los CD4 están por encima del 15% de forma estable durante, al menos, 6 meses seguidos(2).
El mejor marcador del estatus inmunológico es el valor de CD4/edad, pero no se conoce el dintel mínimo para una correcta respuesta a las vacunas. La alteración funcional de los CD4 es la responsable de la respuesta subóptima a la primovacunación y la pérdida de células memoria a pesar de la dosis de refuerzo(16). El aumento de supervivencia de los niños con VIH conlleva una pérdida de protección vacunal; los niños nacidos antes del TAR, que fueron vacunados con niveles bajos de CD4, no consiguen respuesta protectora ni memoria inmunológica, y el TAR no va a restaurar la respuesta previa a las vacunas. Se considera que ante una situación sin respuesta a las vacunas a pesar de tener historia de vacunación, se consigue mejor respuesta con revacunación completa que con una dosis de refuerzo.
Se recomienda la monitorización periódica del estado de seroprotección, siempre que sea posible. Como orientación, se recomienda el chequeo del estado inmunitario posvacunal en torno a los 4-6 años, cuando se han concluido las dosis de refuerzo, y de nuevo, a los 9-11 años y a los 14-16(20). Lo ideal es hacerlo con todos los antígenos vacunales, pero si no es posible, se recomienda hacerlo, al menos, con estos testigos: tétanos, sarampión, rubéola, varicela y hepatitis B(20).
Se recomienda la vacunación frente a la hepatitis A en todos los niños con infección por el VIH, pero sobre todo, si presentan coinfección con virus de la hepatitis B o C, si viajan a países endémicos o si tienen riesgo significativo de exposición al virus(16).
La vacunación con BCG está contraindicada en nuestro medio en los pacientes con infección por el VIH, independientemente de su grado de inmunosupresión(16).
Se recomienda la vacunación frente al VPH en niñas y niños adolescentes con infección por el VIH. Aunque las fichas técnicas actuales de las dos vacunas disponibles admiten la posología de 2 dosis (0, 6 meses) entre los 9 y los 13 años en el caso de Gardasil® y entre los 9 y 14 años en el caso de Cervarix®, la OMS recomienda seguir con 3 dosis en todas las edades en estos pacientes, hasta tener más datos con dos dosis en inmunodeprimidos(8). En varones, se puede emplear solo la vacuna tetravalente (Gardasil®).
Es recomendable la correcta inmunización de los contactos domiciliarios de los niños VIH, especialmente frente a influenza, varicela y triple vírica.
Niños con tratamiento inmunosupresor
Las vacunas de microorganismos vivos están contraindicadas en todos los pacientes sometidos a un tratamiento que cause inmunosupresión significativa.
Pacientes oncohematológicos en tratamiento quimioterápico
En general, cualquiera de las vacunas que se indican durante los primeros años de vida no debería administrarse en pacientes sometidos a quimioterapia intensiva por cáncer. La propuesta vacunal depende de si ha sido posible o no completar el esquema de inmunización antes de iniciar la quimioterapia.
Las vacunas inactivadas se administran entre los 3 y los 6 meses después de finalizar la quimioterapia, mientras que con las vacunas de microorganismos vivos (triple vírica y varicela) se espera hasta pasados los 6 meses(7). En regímenes terapéuticos que incluyen anticuerpos anti-B (rituximab), se recomienda esperar, al menos, 6 meses para administrar cualquier vacuna.
En los niños con cáncer que antes de la quimioterapia han completado la primoinmunización de las vacunas incluidas en el calendario vacunal, se recomienda administrar una dosis de refuerzo de todas las vacunas del calendario, a partir de los 3-6 meses de la finalización del tratamiento (vacunas inactivadas, se puede a partir de los 3 meses y vacunas atenuadas a partir de los 6 meses)(7). Posteriormente, se continúa con el calendario vacunal según la edad del niño.
En los niños que no han completado la primoinmunización antes de la quimioterapia, se recomienda la revacunación completa según la edad del niño (igual que antes, inactivadas a partir de 3 meses y atenuadas a partir de 6 meses)(7). Alternativamente, pueden considerarse como válidas las dosis administradas antes de la enfermedad y completar el calendario vacunal según las pautas de calendarios incompletos.
Se recomienda la vacunación anual frente a la gripe si el niño es mayor de 6 meses de edad.
Tratamiento inmunosupresor
El grado de inmunosupresión inducido por los diferentes agentes inmunosupresores va a depender de la dosis administrada, la duración, la enfermedad de base y los efectos adicionales de otros fármacos asociados.
Todas las vacunas inactivadas pueden administrarse con seguridad. Está especialmente indicada la vacunación antineumocócica y la antigripal anual. Las dosis y pautas serán similares a las de los niños inmunocompetentes. Sin embargo, la mayoría de las vacunas van a inducir una menor respuesta inmunológica.
Las vacunas de microorganismos vivos están contraindicadas en todos los pacientes sometidos a un tratamiento que cause inmunodepresión significativa y tampoco deberían administrarse en el mes previo al comienzo de dicha terapia(7).
Una vez finalizado el tratamiento inmunosupresor (TIS), las vacunas inactivadas pueden ser administradas a partir de los 3 meses y las vacunas de microorganismos vivos a partir de los 3-6 meses(7). Es útil administrar una dosis de refuerzo de todas las vacunas recibidas con anterioridad y recomendables de acuerdo a la edad.
Corticoides
Es relativamente frecuente el uso de corticoides en Pediatría, por lo que siempre surgen preguntas acerca de la vacunación. Los niños con síndrome adrenogenital o que reciben dosis fisiológicas sustitutivas, así como los que reciben corticoides inhalados, tópicos, locales (intraarticulares) o sistémicos a días alternos con preparados de vida media corta, pueden recibir las vacunas oficiales sin cambios. En cambio, los corticoides sistémicos (vía oral, rectal o parenteral) a dosis inmunosupresoras, sí afectan al empleo de vacunas, ya que pueden disminuir la seguridad de las vacunas vivas o reducir la respuesta inmune de las inactivadas. Aunque no existe contraindicación para la administración de vacunas inactivadas durante el tratamiento, la respuesta suele ser inadecuada. De ahí, la necesidad de revacunación posterior, lo ideal 3 meses después de finalizar el tratamiento(7).
Se consideran dosis inmunosupresoras las siguientes dosis de prednisona (o dosis equivalente para resto de fármacos corticoideos)(7,14):
• >2 mg/kg/día durante >14 días (algunos comités de expertos lo reducen a 7 días).
• >1 mg/kg/día durante >28 días.
• En mayores de 10 kg: >20 mg/día durante >14 días.
Tratamiento con fármacos biológicos y modificadores de la enfermedad
Se incluyen en este grupo de fármacos los siguientes:
• Fármacos modificadores de la enfermedad (FAME): metotrexate, ciclosporina, azatioprina, neflunomida, sulfasalazina, ciclofosfamida, etc.
• Fármacos biológicos: anti-IL-1 (anakinra, canakinumab), anti-IL-6 (tocilizumab), anti IL-12 y anti IL-23 (ustekinumab), anti-TNF alfa (etanercept, infliximab, adalimumab, certolizumab pegol, golimumab, etc.) e inhibidores de los linfocitos B (rituximab, bilimumab).
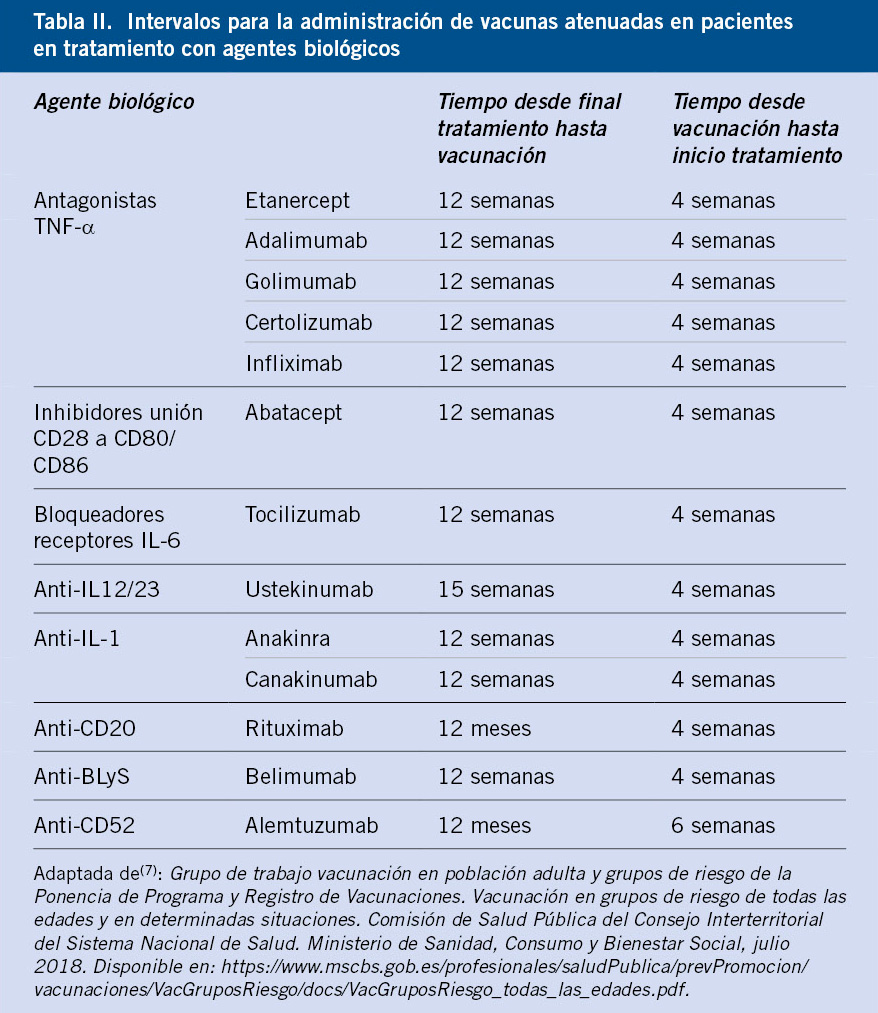
La inmunosupresión secundaria a anticuerpos monoclonales (especialmente anti-TNF) aún es poco conocida, pero podría ser importante en determinadas situaciones. Ni los FAME convencionales, como metotrexate o azatioprina, ni los anti-TNF parecen tener un impacto relevante en la respuesta a las vacunas, mientras que, datos preliminares muestran que abatacept y rituximab podrían inducir una menor respuesta inmunológica.
Estos tratamientos tienen su mayor impacto en la inmunidad celular, aunque también puede verse afectada la producción de anticuerpos. Algunos estudios han demostrado una respuesta inmune alterada frente a vacunas inactivadas en pacientes que reciben inmunosupresores durante largos periodos de tiempo, pero los títulos que se consiguen suelen ser suficientes para proteger a la mayoría de los individuos; de ahí, su recomendación. Las vacunas mejor evaluadas en estos pacientes son: las antineumocócicas, las antigripales y las antihepatitis B.
Las vacunas inactivadas frente a la gripe son seguras y efectivas en personas con enfermedad inflamatoria intestinal o enfermedades reumáticas, aunque su inmunogenicidad puede disminuir cuando el paciente está siendo tratado con fármacos anti-TNFα o con rituximab. Sin embargo, el tratamiento con azatioprina o 6-mercaptopurina no merma de forma significativa la inmunogenicidad de las vacunas inactivadas frente a la gripe. El comportamiento de otras vacunas es similar, y una proporción elevada de sujetos en tratamiento con estos fármacos alcanza títulos protectores. El tocilizumab y los anticuerpos contra el receptor de la IL-6, utilizados para el tratamiento de la artritis reumatoide, tampoco disminuyen de forma marcada la inmunogenicidad de las vacunas inactivadas frente a la gripe(7).
La seguridad y eficacia de las vacunas vivas atenuadas administradas al mismo tiempo que los inmunomoduladores recombinantes o anticuerpos monoclonales frente a linfocitos B (rituximab) no se conoce, recomendándose, hasta que existan más datos, su no utilización en pacientes que reciben estos tratamientos. El uso de vacunas atenuadas en pacientes con dosis bajas de metotrexate (<15 mg/m2/sem.) parece ser segura, existiendo mayor experiencia con triple vírica(7).
Siempre que sea posible, deben administrarse todas las vacunas del calendario de vacunación a cualquier sujeto antes de iniciar un tratamiento inmunosupresor, incluyendo neumococo y varicela entre otras.
Los tratamientos con inmunosupresores o con inmunomoduladores biológicos están asociados con un riesgo de reactivación de hepatitis B, en portadores crónicos, y con cuadros graves de varicela, en personas seronegativas que se infecten durante el tratamiento.
Antes del inicio de estos tratamientos (idealmente, lo antes posible tras el diagnóstico de la enfermedad autoinmune o inflamatoria en la que pueden ser usados), se debe:
• Descartar el estado de portador crónico de hepatitis B, tratar adecuadamente a los portadores crónicos y completar la vacunación frente a hepatitis B a los que no sean inmunes.
• Detectar a los seronegativos a varicela y aplicarles una pauta completa de vacunación (dos dosis separadas, al menos, 4 semanas), siendo la segunda dosis administrada, al menos, 4 semanas antes de iniciar el tratamiento inmunosupresor.
Se recomienda la vacunación frente a la hepatitis A en aquellos pacientes con fármacos hepatotóxicos, sobre todo metotrexate o tocilizumab, ya que tienen riesgo de hepatitis A fulminante(7).
Se recomienda la vacunación frente a VPH en niños y niñas con tratamiento inmunosupresor desde los 9 años de edad con 3 dosis(8).
Se recomienda consultar con el médico especialista del paciente, si se encuentra con un brote o su enfermedad está mal controlada. En algunos casos, podría ser más apropiado retrasar la administración de las vacunas hasta que se consiga un mejor control de la enfermedad.
Pacientes con enfermedades inflamatorias crónicas y enfermedades reumáticas con terapia inmunosupresora
En estos pacientes se deberían seguir las recomendaciones generales aplicables a los pacientes inmunodeprimidos. Pueden recibir las vacunas de microorganismos inactivados, incluyendo la vacunación anual frente a la gripe, y se deberían evitar las vacunas de microorganismos vivos. No obstante, algunas guías recomiendan la administración de la vacuna de la varicela si el niño es susceptible y solo tiene inmunosupresión leve. Se recomienda llevar a cabo la vacunación frente al neumococo con esquemas mixtos secuenciales (Tabla I). Ninguna vacunación que esté indicada debe retrasarse o suspenderse por el temor a desencadenar un brote de la enfermedad, ya que varios estudios han comprobado que este hecho no se produce.
No hay contraindicación para el uso de vacunas inactivadas durante estos tratamientos, pero es probable que no se desarrolle una respuesta inmune adecuada. Para una mejor respuesta inmune, las vacunas inactivadas deberían aplicarse, al menos, 2 semanas antes del inicio del tratamiento, o a partir de los 3 meses después de finalizar el tratamiento con alguno de estos fármacos(7). Las vacunas vivas atenuadas están contraindicadas hasta que hayan transcurrido, al menos, 3 meses de finalización de un tratamiento (6 meses tras un tratamiento con: adalimumab, certolizumab pegol, infliximab, rituximab o ustekinumab)(7).
Pacientes con enfermedad inflamatoria intestinal
Deben recibir las vacunas inactivadas según calendario, haciendo especial énfasis en la vacunación antineumocócica en pauta secuencial y la antigripal anual.
En general, se recomienda determinar los títulos de las vacunas víricas atenuadas y vacunar si son insuficientes, al menos, 4-6 semanas antes de iniciar el tratamiento (incluso 12 semanas para el caso de la varicela). Se evitará su administración durante el tratamiento con corticoides a las dosis previamente expuestas, azatioprina, metotrexate o terapias biológicas (infliximab/adalimumab) o hasta 3 meses después de la suspensión(7). En los niños susceptibles a la varicela, puede administrarse la vacuna frente a esta enfermedad, incluso si están recibiendo tratamiento frente a la misma, siempre y cuando no tenga ninguno de los criterios de inmunodepresión intensa referidos anteriormente. Se recomienda especialmente la vacunación frente a la hepatitis A, dada la especial predisposición de estos pacientes a padecer problemas hepáticos derivados de su enfermedad o de la medicación.
Se debe medir la respuesta frente a la hepatitis B al mes de la última dosis, por la posibilidad de una peor respuesta, y si no existen títulos adecuados, revacunar con el doble de la dosis o con la vacuna Fendrix® o con la vacuna combinada VHB y VHA (Twinrix®).
Vacunación en trasplantes de progenitores hemopoyéticos (TPH) y en trasplantes de órganos sólidos (TOS)
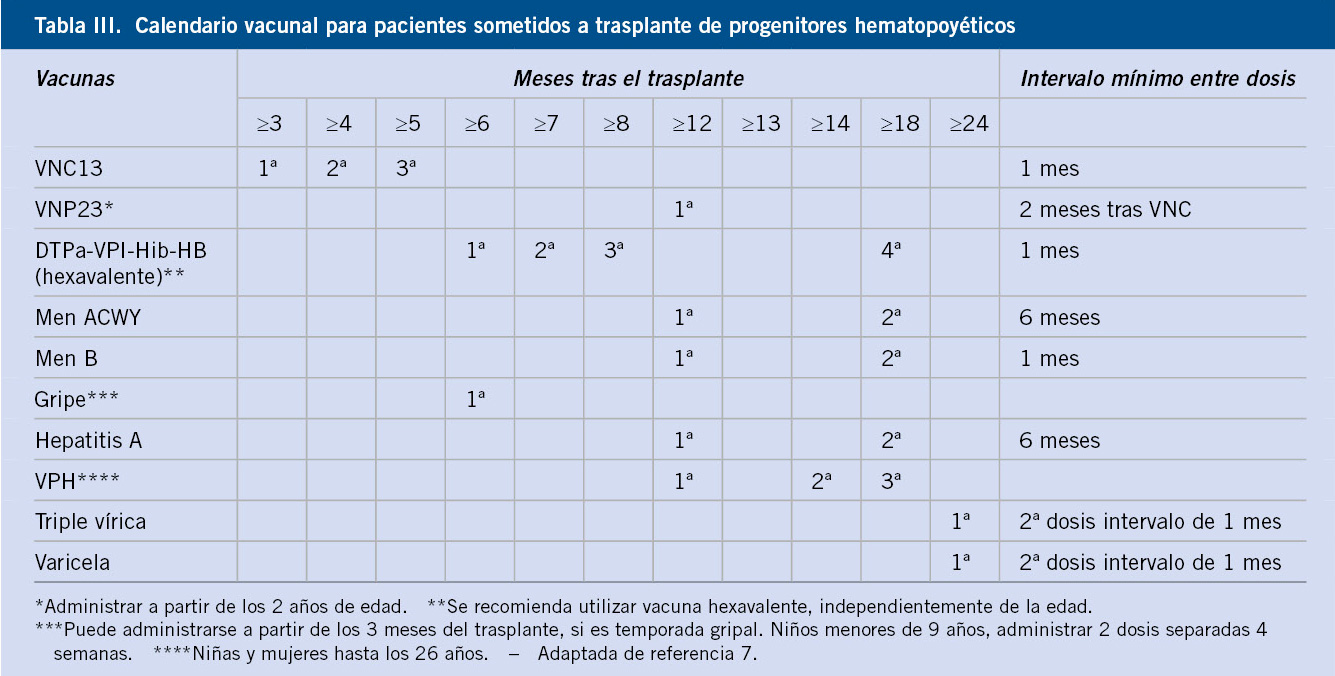
Las vacunas de microorganismos vivos están contraindicadas durante el estado de inmunodepresión (toda la vida en los TOS) y un mes antes del trasplante (TPH o TOS). También están contraindicadas en el donante del TPH durante el mes previo al trasplante. Los pacientes con TPH deben recibir todas las vacunas de calendario, aunque estén previamente, vacunados. Se comienza en los 6-12 meses siguientes al trasplante, excepto la triple vírica, que se administra a los 24 meses del trasplante.
Los TPH y los TOS han dado lugar a una población progresivamente creciente de personas inmunodeprimidas, con una elevada susceptibilidad a las infecciones que, por otra parte, se asocian a una elevada morbimortalidad. La inmunización de estos niños tiene algunas peculiaridades y plantea uno de los problemas más importantes, que es la disminución de la inmunogenicidad de la mayoría de las vacunas. Otro problema es la contraindicación de las vacunas de microorganismos atenuados en los momentos de inmunodepresión por el riesgo de enfermedad grave por el propio agente vacunal. Por todo ello, adquiere una importancia primordial la inmunización correcta de todos los familiares y del personal sanitario que cuidan a estos niños, poniendo al día sus calendarios de vacunación y administrando otras vacunas no sistemáticas como la vacuna frente a la varicela y las vacunas antigripales.
Trasplante de progenitores hemopoyéticos (TPH)
En los trasplantes alogénicos, la inmunosupresión está causada por el régimen condicionante (quimioterapia y radioterapia), la terapia inmunosupresora que se administra después del trasplante y la reacción injerto contra huésped (EICH). En los trasplantes autólogos, la inmunodepresión depende exclusivamente del régimen de acondicionamiento y del tratamiento inmunosupresor postrasplante(2). La duración de la inmunodepresión puede extenderse meses e incluso años, y siempre es más corta en los trasplantes autólogos que en los alogénicos. Además de la incapacidad para responder de forma óptima a las vacunas, los pacientes que reciben cualquier tipo de TPH sufren una pérdida de anticuerpos vacunales después del trasplante.
Poner al día los calendarios de vacunación de los pacientes y de los donantes antes de llevar a cabo el trasplante, debe ser el primer objetivo de la inmunización a la luz de los hechos anteriores. Las vacunas de microorganismos vivos no se deberían administrar, ni al candidato a TPH ni al donante en el mes previo al trasplante, por el riesgo de diseminación(2,22).
Después de realizado el trasplante, se asume, a efectos prácticos, que el niño es susceptible a todas las enfermedades inmunoprevenibles y se lleva a cabo una vacunación completa con todas las vacunaciones sistemáticas. La respuesta a las vacunas es significativa a partir de los 3-6 meses del trasplante(22). El último consenso europeo, estadounidense y canadiense, propone iniciar la revacunación a los 6 meses del trasplante (Tabla VI)(23). Sin embargo, dado el elevado riesgo de infecciones por Haemophilus influenzae tipo b (Hib) y, sobre todo, por neumococo en los meses siguientes al trasplante, las vacunas conjugadas frente a estos agentes pueden administrarse tan pronto como a los 3 meses, ya que producen respuestas de anticuerpos comparables a cuando se administran más tarde(23).

La vacuna triple vírica (sarampión/rubéola/parotiditis) no debe administrarse hasta que hayan transcurrido, al menos, 24 meses desde el trasplante, siempre y cuando no exista EICH y el niño no esté recibiendo tratamiento inmunosupresor(22).
La vacuna frente a la varicela puede administrarse en pacientes sometidos a TPH, a partir de los 24 meses, con 2 dosis y siempre que se cumplan las siguientes condiciones: no estar recibiendo tratamiento inmunosupresor; no recibir tratamiento con inmunoglobulinas y, si las ha recibido, que hayan pasado de 8 a 11 meses; no recibir fármacos antiherpes; no sufrir reacción injerto contra huésped; su número de linfocitos T que sea igual o mayor de 200/mm3 y que, lógicamente, sea no inmune a la varicela(22).
Por último, dada la variabilidad de la respuesta vacunal en los TPH, se recomienda, siempre que sea posible, realizar serologías después de la vacunación(2,22,23).
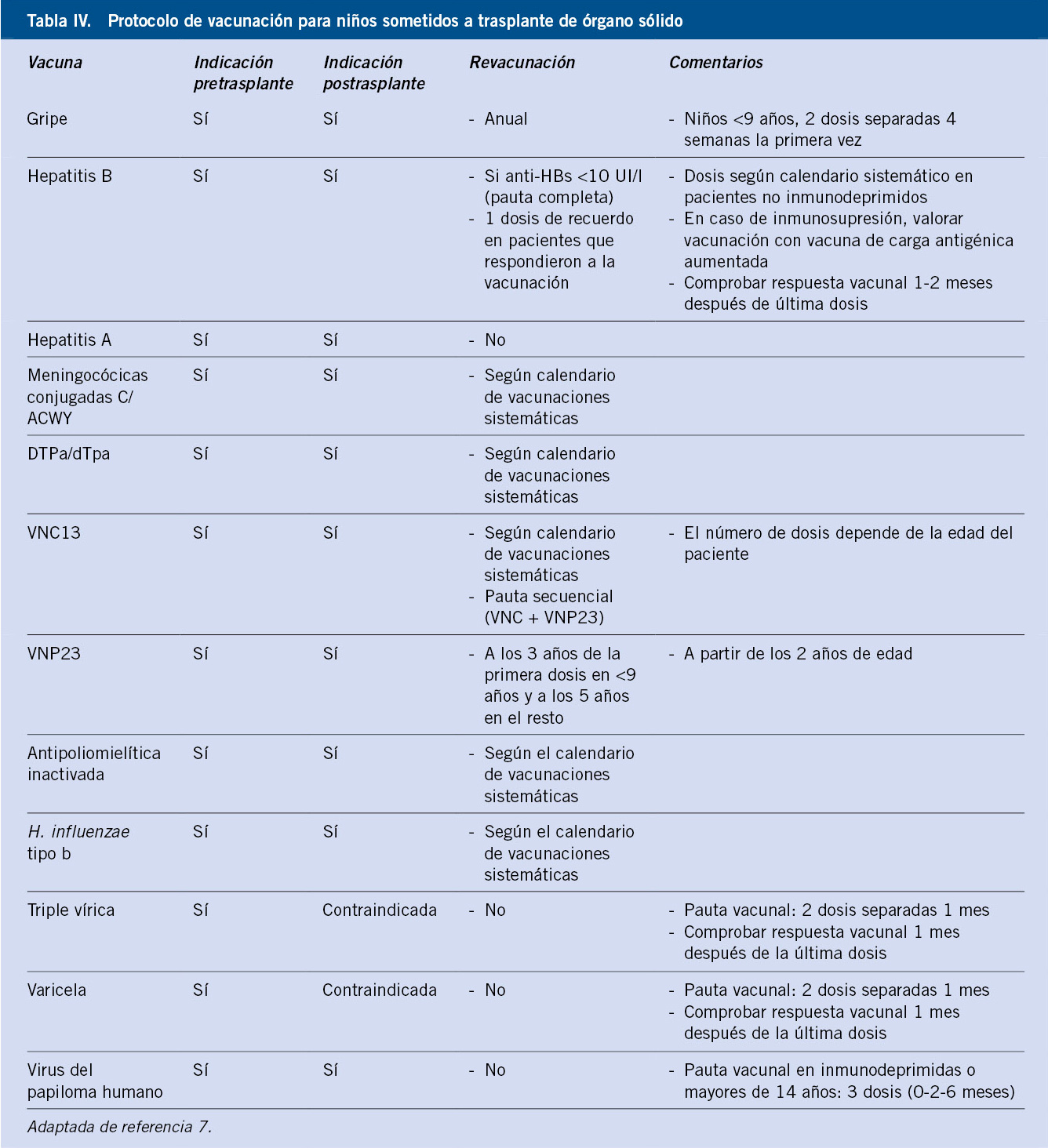
Trasplante de órganos sólidos (TOS)
En las personas candidatas a un TOS, no es infrecuente que la respuesta a las vacunas esté disminuida, dependiendo del tipo y grado de enfermedad, pero en cualquier caso, es superior que la que se obtendrá después del trasplante con la situación de inmunodepresión producida por los fármacos destinados a evitar el rechazo del injerto. Es, por tanto, de importancia capital llevar a cabo las inmunizaciones antes de realizar el trasplante y lo más pronto posible antes de que la enfermedad de base progrese(22). Si es necesario, se emplearán esquemas acelerados de vacunación. Una vez que el trasplante haya sido realizado, las respuestas a las vacunas van a ser subóptimas, aunque algunos niños alcanzarán títulos protectores. Además, en el período postrasplante, muchos sujetos previamente inmunes pierden los anticuerpos y se vuelven susceptibles(22).
Aunque en algún momento se planteó la posibilidad de que las vacunas pudieran facilitar el rechazo del injerto, hay actualmente evidencia suficiente para asegurar que esto no sucede y que las vacunas que no son de microorganismos vivos son seguras en las personas trasplantadas.
Las vacunas inactivadas son seguras, aunque cabe esperar una menor respuesta inmune. En general, los calendarios de vacunación pueden continuarse a partir de los 2-6 meses después del trasplante, cuando el estado inmunitario es estable(22). Debe realizarse la vacunación anual frente a la gripe y vacunación antineumocócica secuencial. Las vacunas con microorganismos vivos están contraindicadas en el periodo postrasplante y deberían evitarse en el mes previo al trasplante. La triple vírica puede administrarse tan pronto como a los 6 meses de edad, en los lactantes candidatos a trasplante.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Moreno-Pérez D, Álvarez García FJ, Arístegui Fernández FJ, Cilleruelo Ortega MJ, Corretger Rauet JM, García Sánchez N, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2016. An Pediatr (Barc.). 2016. Ahead of print.
2.*** Rubin LG, Levin MJ, Ljungman P, Davies EG, Avery R, Tomblyn M, et al. 2013 IDSA Clinical Practice Guideline for vaccination of the immunocompromised host. Clin Infect Dis. 2014; 58: e44-100.
3.** Comité Asesor de Vacunas de la Asociación Española de Pediatría. Recomendaciones de vacunación frente a la gripe 2015-2016. Disponible en: http://vacunasaep.org/documentos/recomendaciones-de-vacunacion-frente-la-gripe-2015-16 (último acceso: 15 de noviembre de 2015).
4.** Comité Asesor de Vacunas de la Asociación Española de Pediatría. Manual en línea. Vacunación de convivientes de pacientes con patologías de riesgo. Disponible en: http://vacunasaep.org/documentos/manual/cap-18#tv (último acceso: 15 de noviembre de 2015).
5.** Centers for Disease Control and Prevention. General recommendations on immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 2011; 60(No. RR-2): 1-64.
6.* Consejo Interterritorial del Sistema Nacional de Salud. Calendario común de vacunación infantil. Calendario recomendado 2015. Disponible en: http://www.msssi.gob.es/ciudadanos/proteccionSalud/vacunaciones/docs/CalendarioVacunacion2015.pdf (último acceso: 15 de noviembre de 2015).
7.*** Comité Asesor de Vacunas de la Asociación Española de Pediatría. Manual en línea. Vacunación en niños inmunodeprimidos o con tratamiento inmunosupresor. Disponible en: http://vacunasaep.org/documentos/manual/cap-14#3.3.10 (último acceso: 15 de noviembre de 2015).
8.* World Health Organization. Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014; 89: 465-91.
9.* Committee on Infectious Diseases, American Academy of Pediatrics (AAP). Updated recommendations on the use of meningococcal vaccines. Pediatrics. 2014; 134: 400-3.
10.* Grupo de Trabajo MenB. Ponencia de Programas y Registro de Vacunaciones. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad, 2013. Vacuna frente a enfermedad meningocócica invasora por serogrupo B y su posible utilización en Salud Pública. Junio de 2013. Disponible en: https://www.msssi.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/docs/MenB.pdf (ultimo acceso: 15 noviembre 2015).
11.* Pérez-Padilla R, Fernández R, García-Sancho C, Franco-Marina F, Aburto O, López-Gatell H, et al. Pandemic (H1N1) 2009 virus and Down syndrome patients. Emerg Infect Dis. 2010; 16: 1312-4.
12.** Comité Asesor de Vacunas de la Asociación Española de Pediatría. Manual en línea. Vacunación en enfermedades crónicas. Disponible en: http://vacunasaep.org/documentos/manual/cap-17#3 (último acceso: 15 de noviembre 2015).
13.* Corretger Rauet JM. Vacunaciones y calendario de vacunaciones en el síndrome de Down. Vacunas. 2012; 13: 112-7.
14.** Australian Immunisation Handbook. 10th Edition, 2013 (NHMRC). Groups with special vaccination requirements. Disponible en: http://www.immunise.health.gov.au/internet/immunise/publishing.nsf/Content/Handbook10-home~handbook10part3~handbook10-3-3.
15.* American Academy of Pediatrics, Committee on Infectious Diseases. Immunization in Special Clinical Circumstances. Immunocompromised children 2012 Report, Red Book. 29th ed. Elk Grove Village, IL, USA; American Academy of Paediatrics. p. 74-90.
16.** Mellado Peña MJ, Moreno-Pérez D, Ruiz Contreras J, Hernández-Sampelayo Matos T, Navarro Gómez ML, grupo de colaboradores del Documento de Consenso SEIP-CAV de la AEP. Documento de consenso de la Sociedad Española de Infectología Pediátrica y el Comité Asesor de Vacunas de la Asociación Española de Pediatría para la vacunación en inmunodeprimidos. An Pediatr (Barc). 2011; 75:413. e1-22.
17.* Patel NC, Hertel PM, Estes MK, De la Morena M, Petru AM, Noroski LM, et al. Vaccine-adquired rotavirus in infants with severe combined inmunodeficiency. N Engl J Med. 2010; 362: 314-9.
18.* Morillo-Gutiérrez B, Worth A, Valappil M, Gaspar HB, Gennery AR. Chronic infection with rotavirus vaccine strains in UK children with severe combined immunodeficiency. Pediatr Infect Dis J. 2015; 34: 1040-1.
19.* Hofstetter AM, Jakob K, Klein NP, Dekker CL, Edwards KM, Halsey NA, et al. Live vaccine use and safety in DiGeorge syndrome. 2014; 133: e946-54.
20.** Menson EN, Mellado MJ, Banford A, Castelli G, Duiculescu D, Marczynska M, et al. Guidance on vaccination of HIV-infected children in Europe. HIV Medicine. 2012; 13: 333-6.
21.* Kobayashi I, Mori M, Yamaguchi K, Ito S, Iwata N, Masunaga K, et al. Pediatric Rheumatology Association of Japan recommendation for vaccination in pediatric rheumatic diseases. Mod Rheumatol. 2015; 25: 335-43.
22.*** Comité Asesor de Vacunas de la Asociación Española de Pediatría. Manual en línea. Vacunación de niños con trasplante de progenitores hemopoyéticos y trasplante de órganos sólidos. Disponible en: http://vacunasaep.org/documentos/manual/cap-16 (último acceso: 15 de noviembre 2015).
23.** Tomblyn M, Chiller T, Einsele H, Gress R, Sepkowitz K, Storek J, et al. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Biol Blood Marrow Transplant. 2009; 15: 1143-238.
Bibliografía recomendada
- Moreno-Pérez D, Álvarez García FJ, Arístegui Fernández FJ, Cilleruelo Ortega MJ, Corretger Rauet JM, García Sánchez N, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2016. An Pediatr (Barc.). 2016. Ahead of print.
Documento esencial para el pediatra, en el que se exponen las recomendaciones más actuales del Comité Asesor de Vacunas de la AEP. Las bases del calendario del niño sano, también lo son de los niños con enfermedades crónicas.
- Rubin LG, Levin MJ, Ljungman P, Davies EG, Avery R, Tomblyn M, et al. 2013 IDSA Clinical Practice Guideline for vaccination of the immunocompromised host. Clin Infect Dis. 2014; 58: e44-100.
Documento guía sobre la vacunación de las personas inmunodeprimidas, de la Infectious Diseases Society of America, referente a nivel mundial.
- Comité Asesor de Vacunas de la Asociación Española de Pediatría. Recomendaciones de vacunación frente a la gripe 2015-2016. Disponible en: http://vacunasaep.org/documentos/recomendaciones-de-vacunacion-frente-la-gripe-2015-16 (último acceso: 15 de noviembre de 2015).
En este documento, se recogen los grupos de riesgo esenciales en los que está indicada la vacunación antigripal, así como los preparados actualmente comercializados en España para la campaña 2015-2016.
- Centers for Disease Control and Prevention. General recommendations on immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR. 2011; 60(No. RR-2): 1-64.
Interesante y práctico documento de los Centers for Disease Control and Prevention (EE.UU.), en el que se abordan de forma actualizada la mayoría de las situaciones especiales, como las comentadas en este artículo, así como tablas de intervalos mínimos y número de dosis necesarias de las vacunas disponibles.
- Australian Immunisation Handbook. 10th Edition, 2013 (NHMRC). Groups with special vaccination requirements. Disponible en: http://www.immunise.health.gov.au/internet/immunise/publishing.nsf/Content/Handbook10-home~handbook10part3~handbook10-3-3.
Capítulo procedente de Manual online con textos muy valorados en el mundo de la vacunología.
- American Academy of Pediatrics, Committee on Infectious Diseases. Immunization in Special Clinical Circumstances. Immunocompromised children 2012 Report, Red Book. 29th ed. Elk Grove Village, IL, USA; American Academy of Paediatrics. p. 74-90.
Recomendaciones prestigiosas y de largo recorrido, desde la Academia Americana de Pediatría.
- Mellado Peña MJ, Moreno-Pérez D, Ruiz Contreras J, Hernández-Sampelayo Matos T, Navarro Gómez ML, grupo de colaboradores del Documento de Consenso SEIP-CAV de la AEP. Documento de consenso de la Sociedad Española de Infectología Pediátrica y el Comité Asesor de Vacunas de la Asociación Española de Pediatría para la vacunación en inmunodeprimidos. An Pediatr (Barc). 2011; 75:413. e1-22.
Documento fuente con las recomendaciones sobre vacunación en pacientes crónicos e inmunodeprimidos, desde el consenso entre el Comité Asesor de Vacunas de la AEP y la Sociedad Española de Infectología Pediátrica.
| Caso clínico |
|
Niño de 7 años, de origen danés, residente en España desde los 2 años de edad, con diagnóstico de esferocitosis hereditaria y que es valorado para la realización de una esplenectomía total de forma programada. Presenta, además, como antecedentes, varios ingresos previos por episodios hemolíticos asociados a procesos virales, los cuales requirieron transfusiones. Tiene a su vez, repercusión en la curva de crecimiento, pero ausencia de alteraciones óseas. Se encuentra correctamente vacunado según el calendario oficial vigente en la comunidad autónoma, además de una pauta de 3+1 de VNC7 en el primer año de vida, así como dos dosis de varicela a los 15 meses y 3 años. Se recomendó vacunación antigripal anual al paciente y los convivientes con cumplimiento variable. Ambos padres son hematológicamente sanos, de manera que el caso ha sido interpretado como una mutación de novo.
En la exploración, destaca un leve tinte ictérico a nivel conjuntival y un abdomen de aspecto distendido, con una esplenomegalia palpable y de consistencia dura. Dentro de las pruebas complementarias, presenta una anemia normocítica e hipercrómica (Hb: 8,2 g/dl, MCHC: 38 g/dL), reticulocitos del 11,4%, test de fragilidad osmótica patológico y una ecografía que revela una esplenomegalia de hasta 11 cm (diámetro craneocaudal).
|
|
|












































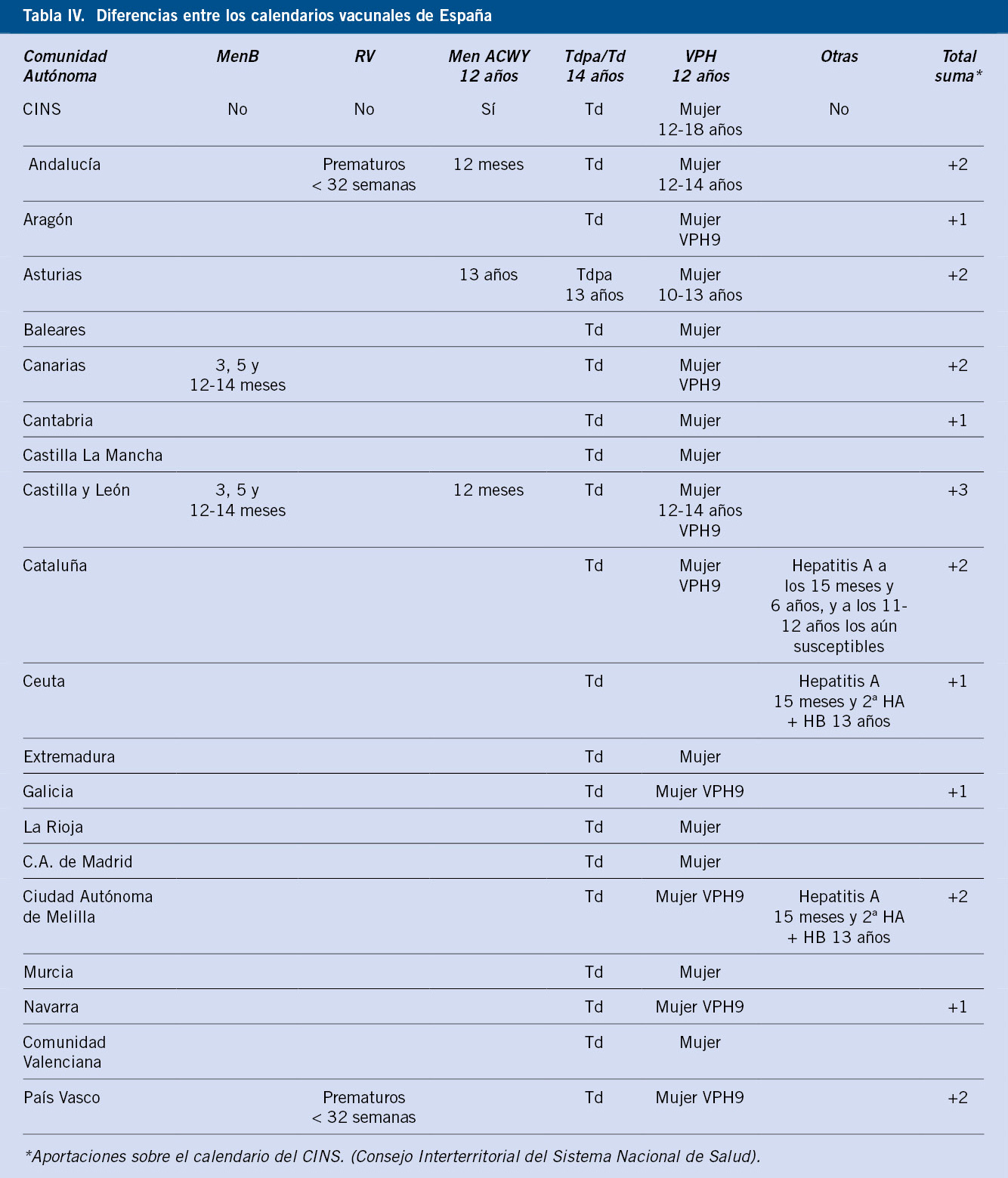







 El objetivo de la Asociación Española de Pediatría es lograr un calendario común de vacunación para todo el país. Aunque todavía hay pequeñas diferencias entre las CC.AA.; en los últimos 2 años, el calendario oficial (basado en el Consejo Interterritorial del SNS) es más completo.
El objetivo de la Asociación Española de Pediatría es lograr un calendario común de vacunación para todo el país. Aunque todavía hay pequeñas diferencias entre las CC.AA.; en los últimos 2 años, el calendario oficial (basado en el Consejo Interterritorial del SNS) es más completo. Las vacunas no financiadas deben ser prescritas en función de su eficacia y seguridad.
Las vacunas no financiadas deben ser prescritas en función de su eficacia y seguridad. Debe resaltarse la importancia de la vacunación frente al meningococo B en niños y adolescentes, así como frente al virus del papiloma humano en los varones.
Debe resaltarse la importancia de la vacunación frente al meningococo B en niños y adolescentes, así como frente al virus del papiloma humano en los varones. Se debe aceptar la negativa de unos padres a la vacunación de su hijo, salvo en el caso de que la vida de este se ponga en peligro, o haya riesgo de salud pública, en cuyo caso será preciso la actuación de un juez. Aunque los padres rechacen la vacunación, el profesional siempre debe perseverar.
Se debe aceptar la negativa de unos padres a la vacunación de su hijo, salvo en el caso de que la vida de este se ponga en peligro, o haya riesgo de salud pública, en cuyo caso será preciso la actuación de un juez. Aunque los padres rechacen la vacunación, el profesional siempre debe perseverar. El menor empleo de recursos sanitarios por los adolescentes dificulta su cobertura vacunal, por lo que cada una de sus visitas (tanto en controles periódicos de salud como de forma oportunista) debe entenderse como una oportunidad para la vacunación.
El menor empleo de recursos sanitarios por los adolescentes dificulta su cobertura vacunal, por lo que cada una de sus visitas (tanto en controles periódicos de salud como de forma oportunista) debe entenderse como una oportunidad para la vacunación. El pediatra debe ceñirse a las contraindicaciones reales de la vacunación, ya que demorar la misma puede terminar suponiendo una oportunidad perdida.
El pediatra debe ceñirse a las contraindicaciones reales de la vacunación, ya que demorar la misma puede terminar suponiendo una oportunidad perdida. El tratamiento antibiótico -salvo para la antitifoidea oral-, la alergia al huevo o las infecciones leves no suponen contraindicaciones para la vacunación.
El tratamiento antibiótico -salvo para la antitifoidea oral-, la alergia al huevo o las infecciones leves no suponen contraindicaciones para la vacunación. Tras la vacunación, es recomendable la permanencia durante 30 minutos en la sala de espera para la vigilancia de posibles reacciones adversas inmediatas.
Tras la vacunación, es recomendable la permanencia durante 30 minutos en la sala de espera para la vigilancia de posibles reacciones adversas inmediatas. El empleo de antitérmicos ha demostrado una disminución en la respuesta inmunitaria de las vacunas –salvo en la del meningococo B–, por lo que no deben emplearse de forma sistemática tras la vacunación para la prevención de posibles efectos adversos.
El empleo de antitérmicos ha demostrado una disminución en la respuesta inmunitaria de las vacunas –salvo en la del meningococo B–, por lo que no deben emplearse de forma sistemática tras la vacunación para la prevención de posibles efectos adversos. La baja tasa de vacunación antigripal anual entre el personal sanitario de nuestro país constituye un urgente punto de mejora.
La baja tasa de vacunación antigripal anual entre el personal sanitario de nuestro país constituye un urgente punto de mejora.






