Pile électrique - Définition
Une pile électrique ou simplement une pile est un dispositif électrochimique, ce système transforme l'énergie d'une réaction chimique en énergie électrique. Dans une pile les réactifs sont introduits à la fabrication, quand ils sont épuisés on doit remplacer la pile par une neuve.
Par extension et, parfois par abus de langage, le terme pile désigne d'autres générateurs électrochimiques : accumulateur électrique, pile à combustible.
Principe
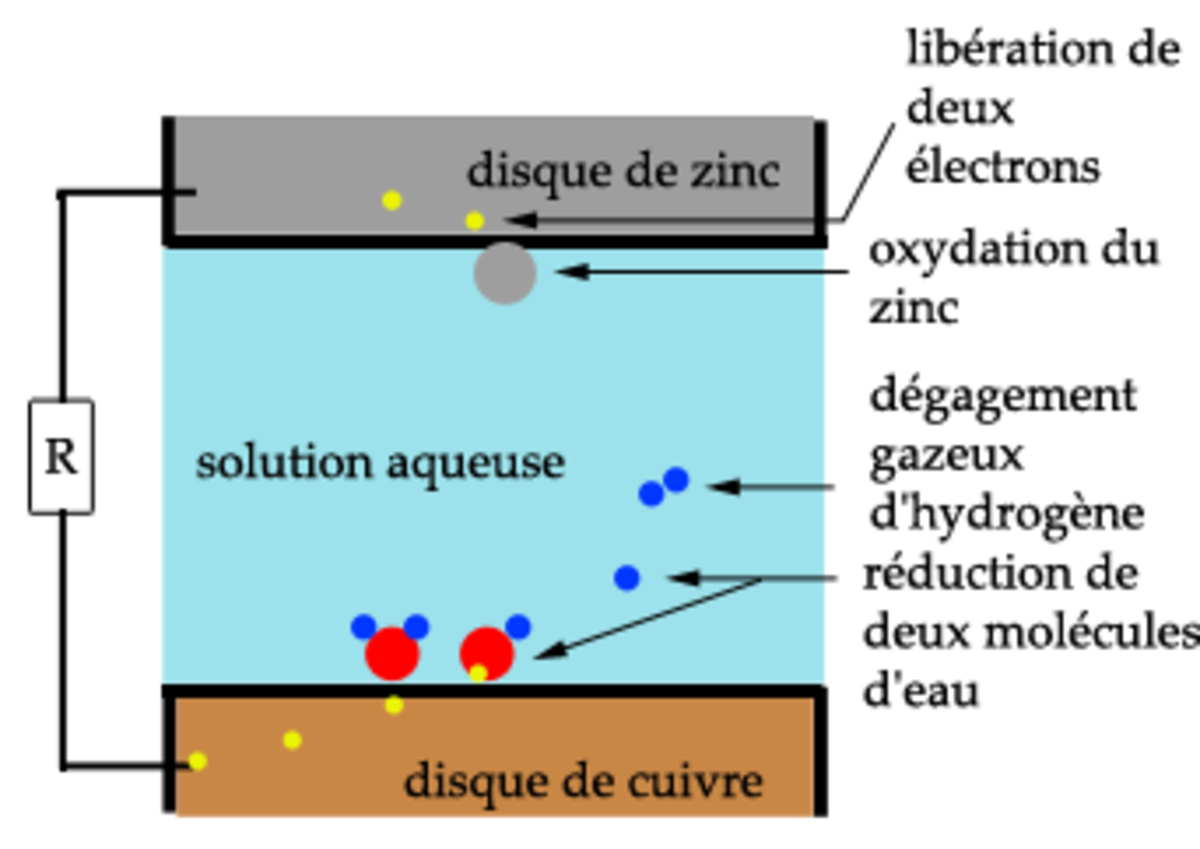
Le boîtier d'une pile abrite une réaction chimique entre deux substances dont l’une peut céder facilement des électrons (matériau réducteur), et l’autre qui les absorbe (matériau oxydant). Une telle réaction est appelée une oxydo-réduction.
Chaque élément du couple oxydant/réducteur est relié à une électrode. Ces électrodes, lorsqu'elles sont reliées à un consommateur électrique, provoquent la circulation d'un courant électrique ; la réaction chimique provoque une circulation de charges (électrons, ions). Une pile fournit donc du courant continu.
- la borne (-) d'une pile correspond à l'anode où se produit la réaction d'oxydation qui va fournir les électrons.
- la borne (+) d'une pile correspond à la cathode où se produit la réaction de réduction qui va consommer les électrons.
Ce système est utilisé pour les piles électriques et les batteries d'accumulateurs, avec divers couples électrochimiques. Une pile électrique peut contenir plusieurs de ces couples montés en série, ce qui permet d'augmenter la tension disponible aux bornes de la pile.
Il est possible de réaliser une pile artisanale, par exemple en piquant dans un citron un trombone déplié (en acier) et un fil électrique dénudé (en cuivre)reliés à une petite lampe ou une diode électroluminescente bien choisie. On trouve dans le commerce des gadgets qui utilisent ce principe: par exemple des petites horloges à quartz qui sont alimentées par une pomme de terre.
Histoire
Il existe des objets archéologiques ressemblant à des piles. C'est par exemple le cas de la pile électrique de Bagdad qui est datée entre -250 et +250. L'hypothèse faisant de ces objets des piles électriques, bien que plausible, reste cependant non prouvée et est donc controversée. Il n'existe par ailleurs aucun lien historique entre ces objets et le développement des piles contemporaines.
En 1786, Luigi Galvani, observe que les muscles d'une cuisse de grenouille se contractent quand elle est mise en contact avec des métaux, de la même manière que lorsqu'on la branche sur une machine électrostatique. Il découvre que la réaction est plus forte quand on utilise un instrument composé de deux métaux différents.
À partir des travaux de Galvani, Alessandro Volta crée en 1800 la première pile à colonne : ces premiers systèmes étaient constitués d'un 'empilement' de disques de deux métaux différents séparés par des disques de feutre, imbibés d'acide, d'où le nom de l'invention. La pression de la colonne sur les disques du bas provoque un assèchement des cylindres de feutre qui finissent par ne plus remplir leur office. Volta invente donc rapidement la pile à couronne, constitués d'empilements plus petits montés en série. Dès 1802 William Cruikshank crée la pile à auge en disposant verticalement les lames de zinc et de cuivre dans un bac à parois isolantes rempli d'eau acidulée. Elle est beaucoup plus simple à produire que la pile de Volta.
Piles polarisables
Entre 1813 et 1815 William Hyde Wollaston développe la pile Wollaston dans laquelle l'électrode de cuivre entoure l'électrode de zinc. Cela permet de doubler la surface de l'électrode et de prolonger le fonctionnement de la pile. Ces premières piles souffrent en effet d'un défaut de fonctionnement : la polarisation.
La réaction d'oxydo-réduction provoque une accumulation de sous-produits qui perturbe le fonctionnement de la pile. Dans ces piles zinc-cuivre c'est la réduction de l'acide de l'électrolyte qui produit un dégagement de bulles hydrogène sur le cuivre qui empêchent le passage du courant. Au bout d'un certain temps, il est donc nécessaire de nettoyer la pile de ces dépôts pour qu'elle continue de fonctionner.
En 1813 Napoléon fournit à l'École polytechnique une pile voltaïque de 600 couples de cuivre et de zinc, occupant 54 mètres carrés de surface. Humphry Davy fait construire une pile Cruikshank constituée de 200 auges et de 2 000 couples à l'institut Royal de Londres. Avec ces piles monumentales il était possible d'obtenir des intensités de 10 ampères, soit des puissances de l'ordre de la dizaine de kW.
Piles impolarisables
Dans ces piles les produits de la réaction d'oxydo-réduction utilisée n'altèrent pas les propriétés électrochimiques de l'ensemble.
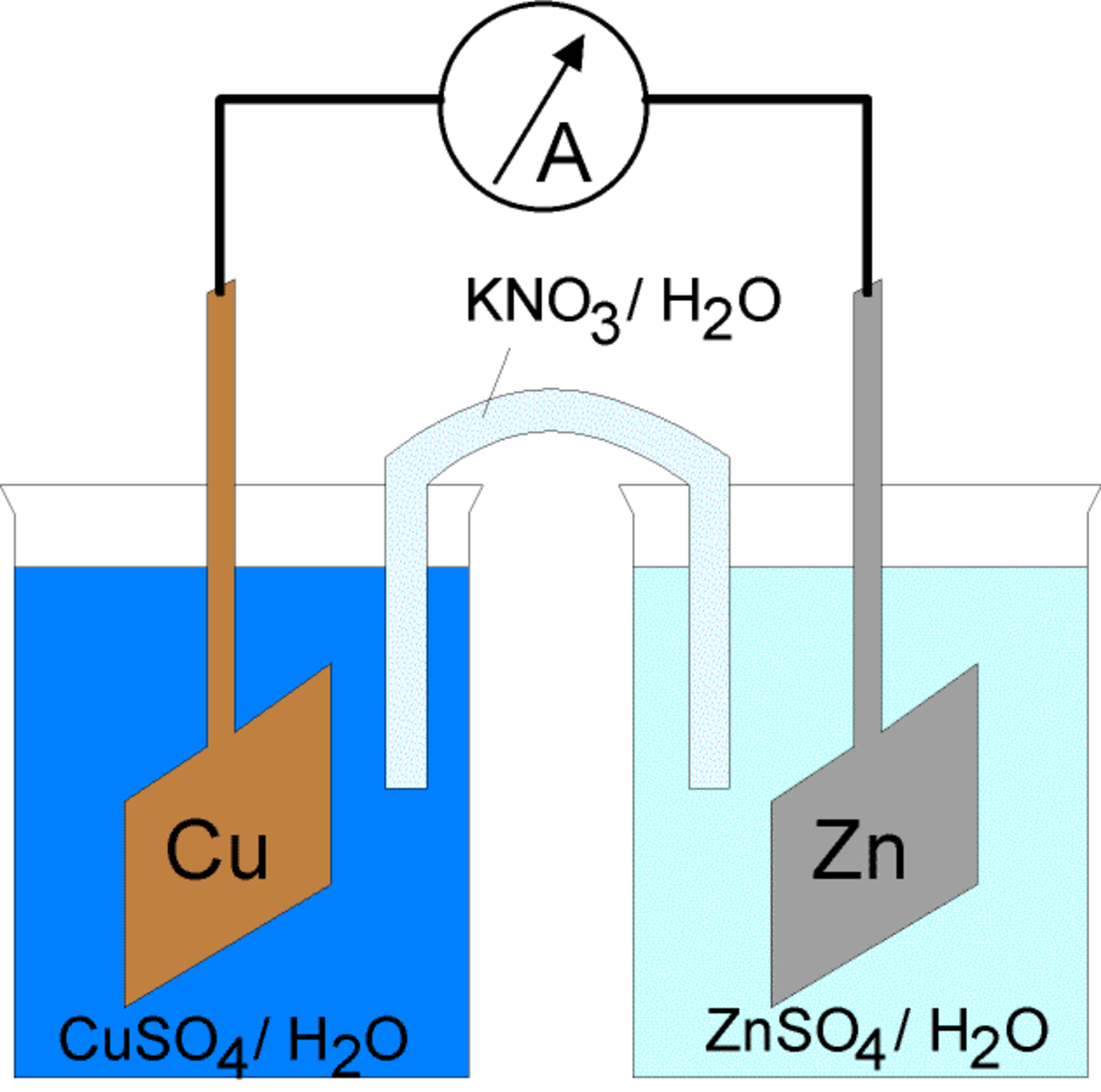
En 1829 Antoine Becquerel crée la première pile à deux liquides séparés en enfermant la plaque de zinc en solution acide dans un gros intestin du bœuf, qui la sépare de l'électrode de cuivre placées dans un bain de sulfate de cuivre. La génération d'hydrogène est remplacée par une accumulation de cuivre sur les parois de la cathode.
Le principe est amélioré en 1836 par John Frederic Daniell qui remplace l'intestin de bœuf par un vase en terre poreuse. La pile Daniell est la première à offrir une source durable d'énergie. Sur le principe de la pile Daniell, on créera par la suite plusieurs amélioration technologiques comme les piles Callaud qui seront utilisées par les compagnies de téléphone dans les années 1860.
Johann Christian Poggendorf invente en 1842 la pile à bichromate: elle dégage de l'oxygène qui se recombine avec l’hydrogène responsable de la polarisation. Créée en 1850, la pile Grenet est une pile à un seul liquide, avec des électrodes en charbon et en zinc amalgamé (plongé dans le mercure) dans un électrolyte d'acide sulfurique et de bichromate de potasse. Quand la pile n'était pas utilisée, il était cependant nécessaire de retirer l'électrode en zinc de la solution pour la préserver. Diverses améliorations (pile Trouvé, pile Chardin, pile Voisin et Dronier… ) vont suivre pour isoler cette électrode.
Ces piles bouteilles seront utilisées jusqu'au début du XXe siècle : la puissance et la tension élevée des piles au bichromate a été longtemps appréciée au laboratoire. Elles ont été peu utilisées comme pile domestique à cause de la toxicité du bichromate et des problèmes d'entretien de l'électrode.
Piles à dépolarisation
Ces piles utilisent un réducteur pour éliminer les produits de réaction qui se forment à la cathode.
La première pile à dépolarisation est inventée en 1838 par William Robert Grove. Il remplace le cuivre par du platine et utilise de l'acide nitrique (nommé acide azotique à cette époque). Il obtient une pile puissante mais chère car le platine est un métal rare. En 1843 Robert Wilhelm Bunsen remplace le platine par du charbon ce qui réduit notablement les coûts. Mais la dépolarisation nitrique entraîne un dégagement de vapeurs toxiques qui rend l'emploi de ces piles malcommode.
En 1867 Georges Leclanché crée la première pile à dépolarisant solide : le dioxyde de manganèse. La pile Leclanché est moins puissante que la pile bouteille mais ne nécessite aucun entretien ( elle "ne s'use que si l'on s'en sert" comme dira la publicité de la pile Wonder). En 1888 Carl Gassner invente la pile sèche en gélifiant la solution de chlorure d'ammonium avec de l'agar-agar. Avec quelques améliorations, cette pile sèche est toujours utilisée aujourd'hui.
Samuel Ruben et Philipp Rogers Mallory créent la pile au mercure pendant la Seconde Guerre mondiale. La première pile alcaline grand public sera conçue par Lewis Urry en 1959 pour Union Carbide.
En 1970 les premières piles au lithium, qui permettent de remplacer le zinc par un métal plus réducteur, sont mises au point. Elles sont commercialisées en 1977.
Des piles ont été utilisées comme références pour définir une norme de tension avant d'être détrônée par une mesure basée sur l'effet Josephson : la pile Daniell, puis la cellule de Clark inventée en 1872 par Josiah Latimer Clark a été employée jusqu'en 1905, puis elle a été remplacée par la cellule de Weston jusqu'en 1972.
Types de piles
La plupart des cellules voltaïques sont limitées à 1,5 V, en raison des potentiels électrochimiques de leurs composants. Les cellules à base de lithium peuvent fournir des tensions plus élevées (jusqu'à 3 Volts).
Formats
La capacité d'une pile est souvent exprimée en ampères-heures (1 Ah = 3600 coulombs). Si une pile peut fournir un ampère (1 A) de courant pendant une heure, elle a une capacité de 1 Ah. Si elle peut fournir 1 A pendant 100 heures ou 2 A pendant 50 h, etc. , sa capacité est de 100 Ah. Elle est directement dépendante de la quantité d'électrolyte et d'électrode dans la pile.
La capacité d'une pile dépend aussi d'autres facteurs comme l'intensité du courant, la durée d'utilisation, la température ... Les fabricants de batteries emploient donc une méthode standard pour évaluer leurs piles. La loi de Peukert modélise la capacité d'une pile en fonction du courant débité.
Le format des piles électriques est normalisé par la Commission électrotechnique internationale (CEI) et par l'American National Standards Institute (ANSI). Bien que la norme CEI soit devenue un standard, un certain nombre d'appellations propres aux fabricants de piles subsiste. La correspondance entre les différents formats est accessible ici : Nommage commercial des piles et accumulateurs électriques.
| Code Pile | Code Accu | Forme et dimensions | Tension | |
|---|---|---|---|---|
| Code CEI | Code ANSI | Code CEI | ||
| (L)R01 | N | RC01 | Cylindre, Longueur 30,2 mm, Diamètre 12 mm | 1,5 V |
| (L)R03 | AAA | RC03 | Cylindre, Longueur 44,5 mm, Diamètre 10,5 mm | 1,5 V |
| (L)R06 | AA | RC06 | Cylindre, Longueur 50 mm, Diamètre 14,2 mm | 1,5 V |
| (L)R14 | C | RC14 S | Cylindre, Longueur 46 mm, Diamètre 26 mm | 1,5 V |
| (L)R20 | D | RC20 S | Cylindre, Longueur 58 mm, Diamètre 33 mm | 1,5 V |
| 3(L)R12 | 1203 | Prisme dont la base est un rectangle aux coins arrondis, 67 mm × 62 mm × 22 mm | 4,5 V | |
| 6(L)F22 | PP3 | RC22 | Parallélépipède rectangle, 69,9 mm × 34,5 mm × 34,5 mm | 9 V |
Note : dans la classification CEI, R représente les piles zinc-carbone, LR les piles alcalines, RC les accumulateurs. Les autres technologies sont généralement écrites en toutes lettres sur l'emballage.
Technologies
Depuis décembre 1998 les piles au mercure sont interdites en Europe (directive 98/101/CE) et aux États-Unis pour des problèmes environnementaux. Il existe donc trois grandes technologies de piles grand public :
- Pile "alcaline" 1,5 V.
- Pile "saline carbone-zinc" 1,5 V. Pour des appareils à faibles besoins.
- Pile "lithium 1,5 V" (appelée aussi L91) Elle risque d’exploser si on tente de la recharger, capable de maintenir très longtemps la tension électrique.[1]
- On trouve aussi des piles à l'oxyde d'argent (certaines piles boutons pour montre) ou des piles air-zinc (utilisées notamment dans les prothèses auditives).
Utilisation des piles
En moyenne les piles électriques sont jetées alors qu'elles possèdent encore un tiers d'énergie utilisable.[2] En effet les appareils électroniques (appareil photo digital, lecteur MP3...) ont besoin d'une tension minimale pour fonctionner, or la tension des piles baisse au cours de leur décharge. De telles piles (alcalines ou charbon-zinc) peuvent alors encore être utilisées pour alimenter des appareils moins exigeants (réveil, jouet, lampe de poche, télécommande...).
La performance d'un ensemble de piles est celle de son élément le plus faible : il faut donc changer toutes les piles en même temps et utiliser des modèles similaires.
En général toutes les piles se déchargent au cours du temps, même si elles ne sont pas utilisées. Il existe des technologies de piles activables qui permettent de retarder le démarrage de la réaction. Elles sont par exemple utilisées dans les éléments de sécurité (air-bag, balise de détresse de bateau...) ou dans certaines applications militaires.
Recyclage
Les piles sont des déchets dangereux. Elles contiennent des métaux (nickel - cadmium - mercure - plomb - fer - zinc - lithium) dont certains sont toxiques et nocifs pour l'environnement. Le plomb et le mercure, notamment, sont des poisons pour les humains et les animaux. Les piles ne doivent pas être jetées dans une poubelle ordinaire, mais rapportées dans un point de collecte.
En France, les vendeurs qui commercialisent des piles et des batteries sont tenus de les reprendre gratuitement une fois usagées. Les piles doivent ensuite être valorisées ou éliminées. En Suisse, une taxe comprise dans le prix de vente finance le recyclage des piles. En Belgique, environ 70 % des piles étaient collectées en 2000. En France en 2006, près de 9 000 tonnes on été collecté et recyclé selon l'Ademe [3]
Le recyclage permet de récupérer des métaux réutilisables (fer, manganèse, zinc et mercure principalement). Mais les piles ne sont pas recyclables à 100 %, et les scories résiduelles doivent être déposées dans des décharges.
Marché
En 2004, 875 millions de piles ont été vendues en France (alcalines 75%, salines 22%, rechargeables 2%) [4], 100 millions en Belgique en l'an 2000 [3].
Parmi les fabricants de piles, on peut citer : Duracell, Energizer, Sony, Rayovac, Varta, Phillips, Panasonic, Saft, Kodak...
Notes
- ↑ http://www.ife.ee.ethz.ch/~zinniker/batak/ideal/francais/index.html
- ↑ La fausse mort des piles, brochure de la plate-forme d’information des cantons romands.
- ↑ a b http://www.observ.be/FR/Piles/piles.shtml
- ↑ Qui sont les champions... des piles Le journal du Management 26/04/2006