Réaction chimique - Définition
La liste des auteurs de cet article est disponible ici.
Réaction chimique et énergie
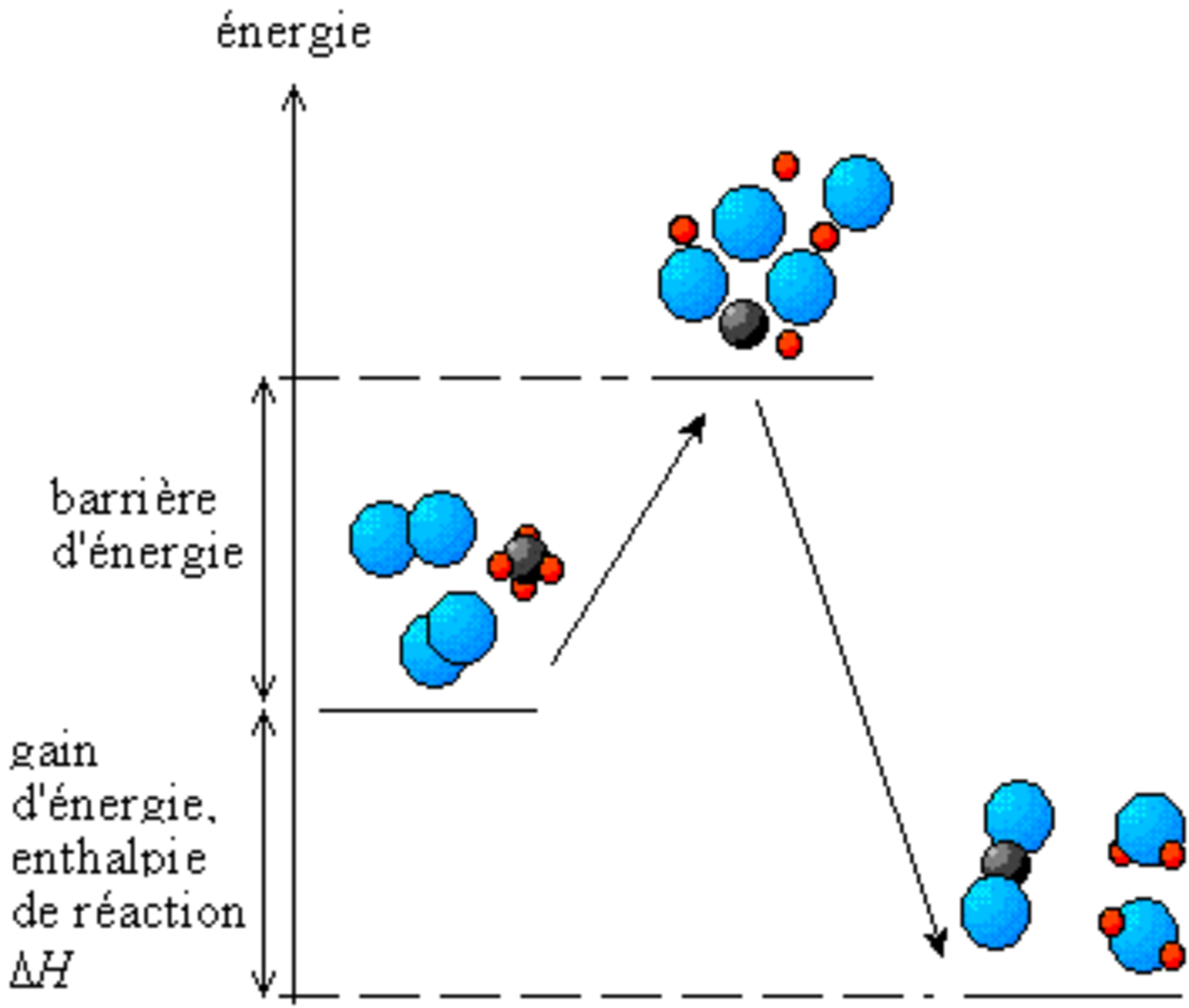
Les transformations ayant lieu lors de la réaction chimique entraînent en général, une diminution de l'énergie totale. En effet, dans une molécule ou un cristal, l'«accrochage» des atomes entre eux nécessite de l'énergie, appelée énergie de liaison. Lorsque l'on rompt une liaison, on « casse » la molécule ou le cristal en « éparpillant » ses atomes. Il faut alors fournir de l'énergie. Lorsque les atomes se recombinent, ils libèrent de l'énergie en formant de nouvelles liaisons. À la fin de la réaction, l'énergie stockée dans les liaisons des produits de réaction est plus faible que celle qui était stockée dans les liaisons des réactants.
Au cours de la réaction, il y a un stade où les anciennes liaisons sont rompues et les nouvelles ne sont pas encore créées. C'est un état où l'énergie du système est élevée, un état transitoire qui constitue une véritable barrière à la réaction. L'amorçage de la réaction consiste tout simplement à faire franchir cette barrière énergétique, appelée énergie d'activation.
Si l'on considère une réaction s'effectuant à la température T et à pression constante; ce qui est le lot des réactions effectuées à l'air libre sous la pression atmosphérique, on mesure l'énergie du système réactionnel par la fonction enthalpie : H. La différence d'enthalpie associée à l'équation de réaction, appelée enthalpie de réaction : ΔrH, permet de déterminer la variation de l'énergie du système après réaction. Elle s'exprime le plus souvent par un transfert thermique avec le milieu extérieur.
L'étude de l'aspect énergétique des réactions chimiques est la thermochimie.
L'état d'un système chimique est caractérisé par: - les grandeurs physiques température et pression, - les espèces chimiques qui le constituent, ainsi que leur état physique ( solide (s), liquide (l), gaz (g), dissous (aq))et leur quantité de matière.
Types de réaction
La grande diversité des réactions chimiques et les manières d'en interpréter les résultats qui souvent se chevauchent fait qu'il y a diverses manières de les classifier.
Voici des exemples de termes très utilisés pour décrire les types communs de réactions:
- Isomérisation, dans laquelle un composé chimique subit une remise en ordre structurale sans aucun changement de sa composition atomique nette .
- Combinaison directe ou synthèse, dans laquelle deux ou plus éléments chimiques ou des composés s'unissent pour former un produit plus complexe : N2 + 3 H2 → 2 NH3
- Décomposition chimique dans laquelle un composé est scindé en plus petits composés ou éléments : 2 H2O → 2 H2 + O2
- Simple déplacement ou substitution où un élément est déplacé d'un composé par un élément plus réactif : 2 Na(s) + 2 HCl(aq) → 2 NaCl(aq) + H2 (g)
- Métathèse ou double substitution, dans laquelle deux composés échangent des ions ou des liaisons pour former différents composés : NaCl(aq) + AgNO3(aq) → NaNO3(aq) + AgCl(s)
- Réactions acide-base largement caractérisées comme réactions entre un acide et une base. Elles peuvent avoir différentes définitions selon le concept d'acide-base utilisé. Les plus communes sont :
- Définition d'Arrhenius : Les acides se dissocient dans l'eau libérant des ions H3O+ ; les bases se dissocient dans l'eau libérant des ions OH-.
- Définition de Brønsted-Lowry : Les acides sont des donneurs de proton (H+) ; les bases sont des receveurs de proton.(inclus dans la définition d'Arrhenius)
- Définition de Lewis : Les acides sont des receveurs de paires d'électrons ; les bases sont des donneurs de paires d'électrons. (inclus dans la définition de Brønsted-Lowry)
- Réactions d'oxydo-réduction, au cours desquelles on observe le transfert d'un ou plusieurs électrons. On peut aussi les caractériser par des changements du nombre d'oxydation des atomes impliquées.
- Un exemple typique de réaction redox est
- 2 S2O32-(aq) + I2(aq) → S4O62-(aq) + 2 I-(aq)
- dans laquelle I2 est réduit en I- et S2O32- (anion thiosulfate) est oxydé en S4O62- (anion tétrathionate).
- La combustion est un genre de réactions redox dans laquelle n'importe quelle substance combustible combine avec un élément oxydant, habituellement l'oxygène, pour produire de la chaleur et pour former les produits oxydés. Le terme combustion est habituellement employé seulement pour l'oxydation à grande échelle des molécules entières. Une oxydation contrôlée d'un seul groupe fonctionnel n'est pas une combustion.
-
- C10H8+ 12 O2 → 10 CO2 + 4 H2O
- CH2S + 6 F2 → CF4 + 2HF + SF6
- C10H8+ 12 O2 → 10 CO2 + 4 H2O
- Réactions organiques comprennent un grand éventail de réactions impliquant les composés qui ont le carbone comme élément principal en leur structure moléculaire. Les réactions auxquelles un composé organique peut participer sont en grande partie définies par ses groupes fonctionnels.
Les réactions peuvent également être classifiées en fonction de leur mécanisme, quelques exemples typiques :